Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению Clostridium difficile-ассоциированной болезни | Ивашкин
1. Рациональная фармакотерапия заболеваний органов пищеварения / Под ред. В.Т. Ивашкина. М.: Литтерра, 2011; 522-6
2. Корнеева О.Н., Ивашкин В.Т. Антибиотикоассоциированный колит: патоморфология, клиника, лечение. Рос журн гастроэнтерол гепатол колопроктол 2007; 17(3):65-70
3. Goudarzi M., Seyedjavadi S.S., Goudarzi H., Mehdizadeh Aghdam E., Nazeri S. Clostridium difficile infection: Epidemiology, pathogenesis, risk factors, and therapeutic options. Scientifica 2014; 2014:916826.
4. Culligan E.P., Sleator R.D. Advances in the microbiome: Applications to Clostridium difficile infection.
5. Ивашкин В.Т., Шифрин О.С., Тертычный А.С., Полуэктова Е.А., Лапина Т.Л., Ляшенко О.С., Ивашкин К.В. Clostridium difficile-ассоциированная болезнь Рос журн гастроэнтерол гепатол колопроктол 2015; 25(6):5-17.
6. Шептулин А.А. Рефрактерные и рецидивирующие формы колита, ассоциированного с Clostridium difficile. Рос журн гастроэнтерол гепатол колопроктол 2011; 21(2):50-3
7. Lessa F.C., Gould C.V., McDonald L.C. Current status of Clostridium difficile infection epidemiology. Clin Infect Dis 2012; 55:65-70.
8. DePestel D., Aronoff D.M. Epidemiology of Clostridium difficile infection. J Pharm Pract 2013; 26(5):464-75.
9. Redelings M.D., Sorvillo F., Mascola L. Increase in Clostridium difficile-related mortality rates, United States 1999-2004. Emerg Infect Dis 2007; 13:1417-9.
Redelings M.D., Sorvillo F., Mascola L. Increase in Clostridium difficile-related mortality rates, United States 1999-2004. Emerg Infect Dis 2007; 13:1417-9.
11. Davies K.A., Longshaw C.M., Davis G.L., Bouza E., et al. Underdiagnosis of Clostridium difficile across Europe: the European, multicentre, prospective, biannual, pointprevalence study of Clostridium difficile infection in hospitalised patients with diarrhoea (EUCLID). Lancet Infect Dis 2014; 14(12):1208-19.
 Infect Drug Resist 2014; 7:63-72.
Infect Drug Resist 2014; 7:63-72.13. Захарова Н.В., Филь Т.С. Микробиологические и клинические особенности инфекции Clostridium difficile. Инфекционные болезни 2015; 13(3):81-6.
14. Furuya-Kanamori L., Marquess J., Yakob L., et al. Asymptomatic Clostridium difficile colonization: epidemiology and clinical implications BMC Infect Dis 2015; 15:516.
15. Surawicz С.M., Brandt L.J., Binion D.G., Ananthakrishnan A.N., Curry S.R., Gilligan P.H., McFarland L.V., Mellow M., Zuckerbraun B.S. Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections Am J Gastroenterol 2013; 108(4):478-98.
16. Paredes-Sabja D., Shen A., Sorg J.A. Clostridium difficile spore biology: sporulation, germination, and spore structural proteins.
17. Britton R.A., Young V.B. Role of the intestinal microbiota in resistance to colonization by Clostridium difficile. Gastroenterology 2014; 146:1547-53.
18. Sarker M.R., Paredes-Sabja D. Molecular basis of early stages of Clostridium difficile infection: germination and colonization. Future Microbiol 2002; 7:933-43.
19. Sun X., Savidge T., Feng H. The enterotoxicity of Clostridium difficile toxins. Toxins (Basel) 2010; 2(7):1848-80.
20. Warny M., Pepin J., Fang A., Killgore G., Thompson A., Brazier J., Frost E., McDonald L.C. Toxin production by an emerging strain of Clostridium difficile associated with outbreaks of severe disease in North America and Europe. Lancet 2005; 366(9491):1079-84.
Lancet 2005; 366(9491):1079-84.
21. McDonald L.C., Killgore G.E., Thompson A., Owens R.C.Jr., Kazakova S.V., Sambol S.P., Johnson S., Gerding D.N. An epidemic, toxin gene-variant strain of Clostridium difficile. N Engl J Med 2005; 353(23):243341.
22. Geric B., Rupnik M., Gerding D.N., Grabnar M., Johnson S. Distribution of Clostridium difficile variant toxinotypes and strains with binary toxin genes among clinical isolates in an American hospital. J Med Microbiol 2004; 53(Pt 9):887-94.
23. Sartelli M., Malangoni M.A., Abu-Zidan F.M., Griffiths E.A., di Bella S., et al. WSES guidelines for management of Clostridium difficile infection in surgical patients World J Emerg Surg 2015; 10:38.
 McDonald L.C., et al. Centers for disease control and prevention. Vital signs: preventing Clostridium difficile infections. Morb Mortal Wkly Rep 2012; 61(9):157-62 http://www.cdc.gov/mmwr
McDonald L.C., et al. Centers for disease control and prevention. Vital signs: preventing Clostridium difficile infections. Morb Mortal Wkly Rep 2012; 61(9):157-62 http://www.cdc.gov/mmwr25. Hensgens M.P., Goorhuis A., Dekkers O.M., Kuijper E.J. Time interval of increased risk for Clostridium difficile infection after exposure to antibiotics. J Antimicrob Chemother 2012; 67:742-8.
26. Spigaglia P. Recent advances in the understanding of antibiotic resistance in Clostridium difficile infection Ther Adv Infect Dis 2016; 3(1):23-42.
27. Keller J.M., Surawicz C.M. Clostridium difficile infection in eldery. Clin Geriatr Med 2014; 30:79-93.
28. Vecchio A.L., Zacur G.M. Clostridium difficile infection: an update on epidemiology, risk factors, and therapeutic options. Curr Opin Gastroenterol 2012; 28:1-9.
Curr Opin Gastroenterol 2012; 28:1-9.
30. Haines C.F., Moore R.D., Bartlett J.G., Sears C.L., Cosgrove S.E., Carroll K., et al. Clostridium difficile in a HIV-infected cohort: incidence, risk factors, and clinical outcomes. AIDS2013; 27(17):2799-807.
31. Rodemann J.F., Dubberke E.R., Reske K.A., et al. Incidence of Clostridium difficile infection in inflammatory bowel disease. Clin Gastroenterol Hepatol 2007; 5:339-44.
32. Ивашкин В.Т., Шелыгин Ю.А., Абдулганиева Д.И., Абдулхак Р.А., Алексеева О.П., Ачкасов С.И., Барановский А.Ю., Белоусова Е.А., Головенко О.В., Григорьев Е.Г., Костенко Н.В., Лапина Т.Л., Маев И.В., Москалев А.И., Низов А.И., Николаева Н.Н., Осипенко М.Ф., Павленко В.В., Парфенов А.И., Полуэктова Е.А., Румянцев В.Г., Тимербулатов В.М., Тертычный А.С., Ткачев А.В., Трухманов А.С., Халиф И.Л., Хубезов Д.А., Чашкова Е.Ю., Шифрин О.С., Щукина О.Б. Рекомендации Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России по диагностике и лечению взрослых больных язвенным колитом. Рос журн гастроэнтерол гепатол колопроктол 2015; 25(1):48-65.
Ивашкин В.Т., Шелыгин Ю.А., Абдулганиева Д.И., Абдулхак Р.А., Алексеева О.П., Ачкасов С.И., Барановский А.Ю., Белоусова Е.А., Головенко О.В., Григорьев Е.Г., Костенко Н.В., Лапина Т.Л., Маев И.В., Москалев А.И., Низов А.И., Николаева Н.Н., Осипенко М.Ф., Павленко В.В., Парфенов А.И., Полуэктова Е.А., Румянцев В.Г., Тимербулатов В.М., Тертычный А.С., Ткачев А.В., Трухманов А.С., Халиф И.Л., Хубезов Д.А., Чашкова Е.Ю., Шифрин О.С., Щукина О.Б. Рекомендации Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России по диагностике и лечению взрослых больных язвенным колитом. Рос журн гастроэнтерол гепатол колопроктол 2015; 25(1):48-65.
33. Ивашкин В.Т., Шелыгин Ю.А., Абдулганиева Д.И., Абдулхаков Р.А., Алексеева О.П., Ачкасов С.И., Барановский А.Ю., Белоусова Е.А., Головенко О.В., Григорьев Е.Г., Костенко Н.В., Низов А.А., Николаева Н.Н., Осипенко М.Ф., Павленко В.В., Парфенов А.И., Полуэктова Е..gif) А., Румянцев В.Г., Тимербулатов В.М., Ткачев А.В., Халиф И.Л., Хубезов Д.А., Чашкова Е.Ю., Шифрин О.С., Щукина О.Б. Рекомендации Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России по диагностике и лечению взрослых пациентов с болезнью Крона. http://www.gastro.ru/
А., Румянцев В.Г., Тимербулатов В.М., Ткачев А.В., Халиф И.Л., Хубезов Д.А., Чашкова Е.Ю., Шифрин О.С., Щукина О.Б. Рекомендации Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России по диагностике и лечению взрослых пациентов с болезнью Крона. http://www.gastro.ru/
34. Thibault R., Graf S., Clerc A., Delieuvin N., Heidegger C.P., Pichard C. Diarrhoea in the ICU: respective contribution of feeding and antibiotics. Crit Care 2013; 17(4):153.
35. Bavishi C., DuPont H.L. Systematic review: the use of proton pump inhibitors and increased susceptibility to enteric infection. Aliment Pharmacol Ther 2011; 34:1269-81.
36. Deshpande A., Pant C., Pasupuleti V., et al. Association between proton pump inhibitor therapy and Clostridium difficile infection in a meta-analysis. Clin Gastroenterol Hepatol 2012; 10:225-33.
Clin Gastroenterol Hepatol 2012; 10:225-33.
37. Stevens V., Dumyati G., Brown J., Wijngaarden E. Differential risk of Clostridium difficile infection with proton pump inhibitor use by level of antibiotic exposure. Pharmacoepidemiol Drug Saf 2011; 20:1035-42.
38. Tleyjeh I.M., Bin Abdulhak A.A., Riaz M., et al. Association between proton pump inhibitor therapy and Clostridium difficile infection: a contemporary systematic review and meta-analysis. PLoS ONE2012; 7(12):e50836.
39. Albright J.B., Bonatti H., Mendez J., Kramer D., Stauffer J., Hinder R., et al. Early and late onset Clostridium difficile-associated colitis following liver transplantation. Transpl Int 2007; 20(10):856-66.
40. Chopra T., Alangaden G.J., Chandrasekar P. Clostridium difficile infection in cancer patients and hematopoietic stem cell transplant recipients. Expert Rev Anti Infect Ther 2010; 8(10):1113-9.
Chopra T., Alangaden G.J., Chandrasekar P. Clostridium difficile infection in cancer patients and hematopoietic stem cell transplant recipients. Expert Rev Anti Infect Ther 2010; 8(10):1113-9.
41. Rodríguez Garzotto A., Mérida García A., Muñoz Unceta N., Galera Lopez M.M., Orellana-Miguel M.A., Díaz-García C.V., et al. Risk factors associated with Clostridium difficile infection in adult oncology patients. Support Care Cancer 2015; 23(6):1569-77.
42. Debast S.B., Bauer M.P., Kuijper E.J. on behalf of the Committee. European society of clinical microbiology and infectious diseases: Update of the treatment guidance document for Clostridium difficile infection. Clin Microbiol Infect 2014; 20 (Suppl. 2):1-26.
43. Abou Chakra C.N., Pepin J., Valiquette L. Prediction tools for unfavourable outcomes in Clostridium difficile infection: a systematic review. PLoS ONE2012; 7:e30258.
Prediction tools for unfavourable outcomes in Clostridium difficile infection: a systematic review. PLoS ONE2012; 7:e30258.
44. Kociolek L.K., Gerding D.N. Clinical utility of laboratory detection of Clostridium difficile strain BI/ NAP1/027. J Clin Microbiol 2016; 54(1):19-24.
45. Vardakas K.Z., Konstantelias A.A., Loizidis G., Rafailidis P.I., Falagas M.E. Risk factors for development of Clostridium difficile infection due to BI/NAP1/027 strain: a meta-analysis. Int J Infect Dis 2012; 16(11):768-73.
46. Eyre D.W., Walker A.S., Wyllie D., Dingle K.E., Griffiths D., Finney J., et al. Predictors of first recurrence of Clostridium difficile infection: Implications for initial management. Clin Infect Dis 2012; 55(Suppl. 2):77-87.
47. Hu M.Y., Katchar K., Kyne L., Maroo S., Tummala S., Dreisbach V., et al. Prospective derivation and validation of a clinical prediction rule for recurrent Clostiridium difficle infection. Gastroenterology 2009; 136:1206-14.
Hu M.Y., Katchar K., Kyne L., Maroo S., Tummala S., Dreisbach V., et al. Prospective derivation and validation of a clinical prediction rule for recurrent Clostiridium difficle infection. Gastroenterology 2009; 136:1206-14.
48. Kelly J.P. Can we identify patients at high risk of recurrent Clostridium difficile infection? Clin Microbiol Infect 2012; 18(Suppl. 6):21-7.
49. Fekety R., McFarland L.V., Surawicz C.M., Greenberg R.N., Elmer G.W., Mulligan M.E. Recurrent Clostridium difficile diarrhea: Characteristics of and the risk factors for patients enrolled in a prospective, randomized, double-blinded trial. Clin Infect Dis 1997; 24(3):324-33.
50. Samie A.A., Traub M., Bachmann K., Kopischke K., Theilmann L. Risk factors for recurrence of Clostridium difficile-associated diarrhea. Hepatogastroenterology. 2013; 60(126):1351-4.
Hepatogastroenterology. 2013; 60(126):1351-4.
51. Planche T., Aghaizu A., Holliman R., et al. Diagnosis of Clostridium difficile infection by toxin detection kits: A systematic review. Lancet Infect Dis 2008; 8:777-84.
52. Crobach M.J.T., Planche T., Eckert C., Barbut F., et al.
53. European society of clinical microbiology and infectious diseases: Update of the diagnostic guidance document for Clostridium difficile infection. Clin Microbiol Infect 2016; 22:63-81.
54. Luo R.F., Banaei N. Is repeat PCR needed for diagnosis of Clostridium difficile infection? J Clin Microbiol 2010; 48:3738-41.
55. Cerilli L.A., Greenson J.K. The differential diagnosis of colitis in endoscopic biopsy specimens: a review article. Arch Pathol Lab Med 2012; 136:854-64.
Cerilli L.A., Greenson J.K. The differential diagnosis of colitis in endoscopic biopsy specimens: a review article. Arch Pathol Lab Med 2012; 136:854-64.
56. Cohen S.H., Gerding D.N., Johnson S., Kelly C.P., Loo V.G., McDonald L.C., et al. Clinical practice guidelines for Clostridium difficile infection in adults: 2010 update by the society for healthcare epidemiology of America (SHEA) and the infectious diseases society of America (IDSA). Infect Control Hosp Epidemiol 2010; 31(5):431-55.
57. Dinh A., Bouchand F., le Monnier A. Current treatment and epidemiology of Clostridium difficile infections. Rev Med Interne 2015; 36(9):596-602.
58. Hempel S., Newberry S.J., Maher A.R., et al. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis. JAMA 2012; 307:1959-69.
JAMA 2012; 307:1959-69.
59. Johnston B.C., Ma S.S.Y., Goldenberg J.Z., et al. Probiotics for the prevention of Clostridium difficile associated diarrhea. Ann Intern Med 2012; 157:878-88.
60. Шрайнер Е.В., Курилович С.А., Осипенко М.Ф., Власов В.В. Трансплантация кишечной микробиоты: терапевтический потенциал при болезнях органов пищеварения Рос журн гастроэнтерол гепатол колопроктол 2014;24(5):63-8.
61. Chapman B.C., Moore H.B., Overbey D.M., Morton A.P. Fecal microbiota transplant in patients with Clostridium difficile infection: A systematic review. J Trauma Acute Care Surg 2016; 81(4):756-64.
62. Lofmark S., Edlund C., Nord C.E. Metronidazole is still the drug of choice for treatment of anaerobic infections. Clin Infect Dis 2010; 50 (suppl 1):16-23.
Clin Infect Dis 2010; 50 (suppl 1):16-23.
63. Aradhyula S., Manian F.A., Hafidh S.A.S., Bhutto S.S., Alpert M.A. Significant absorption of oral vancomycin in a patient with Clostridium difficile colitis and normal renal function. South Med J 2006; 99:518-20.
64. Martirosian G., Rouyan G., Zalewski T., MeiselMikołajczyk F. Dioctahedral smectite neutralization activity of Clostridium difficile and Bacteroides fragilis toxins in vitro. Acta Microbiol Pol 1998; 47(2):177-83.
65. McFarland L.V., Elmer G.W., Surawicz C.M. Breaking the cycle: treatment strategies for 163 cases of recurrent Clostridium difficile disease. Am J Gastroenterol 2002; 97:1769-75.
Современные стратегии диагностики и лечения Clostridium difficile-инфекции (обзор литературы) | Николаева
1. Алексеечкина О.А., Дубров Э.Я., Владимирова Е.С., Пинчук Т.П., Титова Г.П. Возможности ультразвукового исследования в диагностике псевдомембранозного колита у хирургических больных // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. — 2012. — № 2. — С. 29-35
Алексеечкина О.А., Дубров Э.Я., Владимирова Е.С., Пинчук Т.П., Титова Г.П. Возможности ультразвукового исследования в диагностике псевдомембранозного колита у хирургических больных // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. — 2012. — № 2. — С. 29-35
2. Алёшкин В.А., Селькова Е.П., Миронов А.Ю., Гренкова Т.А., Шелыгин Ю.А., Сухина М.А., Ачкасов С.И., Сафин А.Л. Лабораторная диагностика Clostridium difficile-ассоциированных диарей. Федеральные клинические рекомендации. — М., 2017. — 24 с
3. Волчкова Е.В., Белоусова Е.А., Макарчук П.А., Русанова Э.В., Великанов Е.В. Частота выявления инфекции Clostridium difficile в больничных условиях // Альманах клинической медицины. — 2014. № 33. — С. 71-76
4. Дмитриева Н.В., Ключникова И. А., Шильникова И.И. Clostridium difficile-ассоциированная диарея (обзор литературы) // Сибирский онкологический журнал. — 2014. — № 1 (61). — С. 46-53
А., Шильникова И.И. Clostridium difficile-ассоциированная диарея (обзор литературы) // Сибирский онкологический журнал. — 2014. — № 1 (61). — С. 46-53
5. Захарова Н.В., Филь Т.С. Микробиологические и клинические особенности инфекции Clostridium difficile // Инфекционные болезни. — 2015. — Т. 13, № 3. — С. 81-86
6. Захарова Н.В., Филь Т.С. С. difficile и микробиота: как предупредить, диагностировать и лечить инфекцию // Дневник казанской медицинской школы. — 2014. — Т. 3, № 6. — С. 53-58
7. Ивашкин В.Т., Ющук Н.Д., Маев И.В., Лапина Т.Л., Полуэктова Я.А., Шифрин О.С., Тертычный А.С., Трухманов А.С., Шептулин А.А., Баранская Е.К., Ляшенко О.С., Ивашкин К.В. Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению Clostridium difficile-ассоциированной болезни // Российский журнал гастроэнтерологии гепатологии и колопроктологии. — 2016. — № 26 (5). — С. 56-65
— 2016. — № 26 (5). — С. 56-65
8. Карпов И.А., Горбич Ю.Л., Соловей Н.В., Стома И.О. Инфекции, вызванные Clostridium difficile: подходы к диагностике и лечению: учебно-методическое пособие. — Минск: БГМУ, 2014. — 35 с
9. Корнеева О.Н., Ивашкин В.Т. Антибиотикоассоциированный колит: патоморфология, клиника, лечение // Российский журнал гастроэнтерологии гепатологии и колопроктологии. — 2007. — Т. 17, № 3. — С. 65-70
10. Лобзин Ю.В., Захаренко С.М., Иванов Г.А. Современные представления об инфекции Clostridium difficile // Клиническая микробиология и антимикробная терапия. — 2002. — Т. 4, № 3. — С. 200-232
11. Пинчук Т.П., Савельева Н.С., Титова Г.П., Черненькая Т.В., Аванесова В. А., Ярцев П.А. Эндоскопическая диагностика псевдомембранозного колита у реанимационных больных // Экспериментальная и клиническая гастроэнтерология. — 2012. — № 10. — С. 13-16
А., Ярцев П.А. Эндоскопическая диагностика псевдомембранозного колита у реанимационных больных // Экспериментальная и клиническая гастроэнтерология. — 2012. — № 10. — С. 13-16
12. Рациональная фармакотерапия заболеваний органов пищеварения. Руководство для практикующих врачей; 2-е изд., испр. и доп. / Под общ. ред. В.Т. Ивашкина. — М.: Литтерра, 2011. — 848 с
13. Aldrete S.M., Magee M.J., Friedman-Monaco R., Kraft C.S., Chan A., Hutcherson D., Langston A.A., Greenwell B.I., Burd E.M. (2015) Characteristics and antibiotic use associated with short-term risk of Clostridium difficile infection among hospitalized patients. Am J Clin Pathol, 143 (6), 895-900.
14. Bartlett J.C. (2006). Narrative review: the new epidemic of Clostridium difficile-associated enteric disease. Ann Intern Med, 145 (10), 758-764.
Ann Intern Med, 145 (10), 758-764.
15. Bauer M.P., Notermans D.W., van Benthem B.H., Brazier J.S., Wilcox M.H., Rupnik M., Monnet D.L., van Dissel J.T., Kuijper E.J., ECDIS Study Group. (2011). Clostridium difficile infection in Europe: a hospital-based survey. Lancet, 377, 63-73. doi: 10.1016/S0140-6736(10)61266-4.
16. Benedek O., Podbielski A., Warnke P. (2016). Laboratory experience with the liaison analyzer in the diagnosis of Clostridium difficile-associated diarrhea. Eur J Microbiol Immunol, 6 (3), 215-218.
17. Benes J., Husa P., Nyc O. Diagnosis and therapy of Clostridium difficile infection: Czech national guidelines. Klin Mikrobiol Infekc Lek, 20 (2), 56-66.
18. Bobo L. D., Dubberke E.R., Kollef M. (2016). Clostridium difficile in the ICU: the struggle continues. Chest, 140 (6), 1643-1653.
D., Dubberke E.R., Kollef M. (2016). Clostridium difficile in the ICU: the struggle continues. Chest, 140 (6), 1643-1653.
19. Brien J.A., Caro J.J. (2007). The emerging infectious challenge of Clostridium difficile-associated disease in Massachusetts hospitals: clinical and economic consequences. Infect Control Hosp Epidemiol, 28 (11), 1219-1227.
20. Burnham C.A. (2013). Carroll diagnosis of Clostridium difficile infection: an ongoing conundrum for clinicians and for clinical laboratories. KCClin Microbiol Rev, 26 (3), 604-630.
21. Chang J.Y., Antonopoulos D.A., Kalra A., Tonelli A., Khalife W.T., Schmidt T.M., Young V.B. (2008). Decreased diversity of the fecal microbiome in recurrent Clostridium difficile-associated diarrhea. J Infect Dis, 197 (3), 435-438. doi: 10.1086/525047.
doi: 10.1086/525047.
22. Chitnis A.S., Holzbauer S.M., Belflower R.M., Winston L.G., Bamberg W.M., Lyons C., Farley M.M., Dumyati G.K., Wilson L.E., Beldavs Z.G., Dunn J.R., Gould L.H., MacCannell D.R., Gerding D.N., McDonald L.C., Lessa F.C. (2011). Epidemiology of community associated Clostridium difficile infection 2009 through. JAMA Intern Med, 173, 1359-1367.
23. Cohen S.H., Gerding D.N., Johnson S., Kelly C.P., Loo V.G., McDonald L.C., Pepin J., Wilcox M.H. (2010) Clinical practice guidelines for Clostridium difficile infection in adults: 2010 update by the Society for Healthcare Epidemiology of America (SHEA) and the Infectious Diseases Society of America (IDSA). Infect Control Hosp Epidemiol, 31 (5), 431-455. doi: 10.1086/651706.
24. Debast S. B., Bauer M.P. (2014). European Society of Clinical Microbiology and Infectious Diseases: update of the treatment guidance document for Clostridium difficile infection (CDI). Clin Microbiol Infect, 20 (2), 45-48.
B., Bauer M.P. (2014). European Society of Clinical Microbiology and Infectious Diseases: update of the treatment guidance document for Clostridium difficile infection (CDI). Clin Microbiol Infect, 20 (2), 45-48.
25. Gerding D.N., Johnson S., Rupnik M., Aktories K. (2014). Clostridium difficile binary toxin CDT: Mechanism, epidemiology, and potential clinical importance. Gut Microbes, 5, 1-13.
26. Gerding D.N., Muto C.A., Owens R.C. (2008). Treatment of Clostridium difficile infection. Clin Infect Dis, 46 (1), 32-42.
27. Gupta A., Khanna S. (2014). Community-acquired Clostridium difficile infection: an increasing public health threat. Infect Drug Resist, 7, 63-72.
28. Johal S. S., Hammond J., Solomon K., James P.D., Mahida Y.R. (2004). Clostridium difficile associated diarrhoea in hospitalised patients: onset in the community and hospital and role of flexible sigmoidoscopy. Gut, 53 (5), 673-677.
S., Hammond J., Solomon K., James P.D., Mahida Y.R. (2004). Clostridium difficile associated diarrhoea in hospitalised patients: onset in the community and hospital and role of flexible sigmoidoscopy. Gut, 53 (5), 673-677.
29. Kazanowski M., Smolarek S., Kinnarney F., Grzebieniak Z. (2014). Clostridium difficile: Epidemiology, diagnostic and therapeutic possibilities — A systematic review. Tech Coloproctol, 18 (3), 223-232.
30. Kelly C.P., La Mont J.T. (2008). Clostridium difficile -more difficult than ever. N Engl J Med, 359 (18), 1932-1940.
31. Khanna S., Pardi D.S. (2014). Clostridium difficile infection: management strategies for a difficult disease. Ther Adv Gastroenterol, 7 (2), 72-86.
32. Knight D.R., Elliott B., Chang B.J., Perkins T.T., Riley T.V. (2015). Diversity and evolution in the genome of clostridium difficile. Clin Microbiol Rev, 28 (3), 721-741. doi: 10.1128/CMR.00127-14.
Knight D.R., Elliott B., Chang B.J., Perkins T.T., Riley T.V. (2015). Diversity and evolution in the genome of clostridium difficile. Clin Microbiol Rev, 28 (3), 721-741. doi: 10.1128/CMR.00127-14.
33. Korman T.M. (2015). Diagnosis and management of Clostridium difficile infection. Semin Respir Crit Care Med, 36 (1), 31-43.
34. Kostic A.D., Xavier R.J., Gevers D. (2015). The microbiome in iflammatory bowel diseases: current status and the future ahead. Gastroenterology, 146 (6), 1489-1499.
35. Kurti Z., Lovasz B.D., Mandel M.D., Csima Z., Golovics P.A., Csako B.D., Mohas A., Gönczi L., Gecse K.B., Kiss L.S., Szathmari M., Lakatos P.L. (2015). Burden of Clostridium difficile infection between 2010 and 2013: Trends and outcomes from an academic center in Eastern Europe. World J Gastroenterol, 21 (21), 6728-6735.
World J Gastroenterol, 21 (21), 6728-6735.
36. Lowy I., Molrine D., Leav B. (2010). Treatment with monoclonal antibodies against Clostridium difficile toxins. N Engl J Med, 362, 197-205.
37. Lupse M., Flonta M., Cioara A. (2013). Predictors of first recurrence in Clostridium diffcile-associated disease. A study of 306 patients hospitalized in a Romanian tertiary referral center. J Gastrointestin Liver Dis, 22 (4), 397-403.
38. McFarland L.V. (2006). Meta-analysis of probiotics for the prevention of antibiotic associated diarrhea and the treatment of Clostridium difficile disease. Am J Gastroenterol, 101, 812-822.
39. Miller M.A. (2007). Clinical management of Clostridium difficile-associated disease. Clin Infect Dis, 45, Suppl 2, 122-128.
Clin Infect Dis, 45, Suppl 2, 122-128.
40. Nelson R.L., Kelsey P., Leeman H., Meardon N., Patel H., Paul K., Rees R., Taylor B., Wood E., Malakun R. (2011) Antibiotic treatment for Clostridium difficile associated diarrhea in adult. Cochrane Database Syst Rev, 9. Available at: https://www.ncbi.nlm.nih.gov/pubmed/21901692. doi: 10.1002/14651858
41. Norman J.M., Handley S.A., Baldridge M.T., Droit L., Liu C.Y., Keller B.C., Kambal A., Monaco C.L., Zhao G., Fleshner P., Stappenbeck T.S., McGovern D.P., Keshavarzian A., Mutlu E.A., Sauk J., Gevers D., Xavier R.J., Wang D., Parkes M., Virgin H.W. (2016). Disease-specific alterations in the enteric virome in inflammatory bowel disease. NIH Public Access, 160 (3), 447-460. doi: 10.1016/j.cell.2015.01.002.
42. Qin J., Li Y., Cai Z., Li S., Zhu J., Zhang F., Liang S., Zhang W., Guan Y., Shen D., Peng Y., Zhang D., Jie Z., Wu W., Qin Y., Xue W., Li J., Han L., Lu D., Wu P., Dai Y., Sun X., Li Z., Tang A., Zhong S., Li X., Chen W., Xu R., Wang M., Feng Q., Gong M., Yu J., Zhang Y., Zhang M., Hansen T., Sanchez G., Raes J., Falony G., Okuda S., Almeida M., LeChatelier E., Renault P., Pons N., Batto J.M., Zhang Z., Chen H., Yang R., Zheng W., Li S., Yang H., Wang J., Ehrlich S.D., Nielsen R., Pedersen O., Kristiansen K., Wang J. (2012). A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature, 490 (7418), 55-60.
Qin J., Li Y., Cai Z., Li S., Zhu J., Zhang F., Liang S., Zhang W., Guan Y., Shen D., Peng Y., Zhang D., Jie Z., Wu W., Qin Y., Xue W., Li J., Han L., Lu D., Wu P., Dai Y., Sun X., Li Z., Tang A., Zhong S., Li X., Chen W., Xu R., Wang M., Feng Q., Gong M., Yu J., Zhang Y., Zhang M., Hansen T., Sanchez G., Raes J., Falony G., Okuda S., Almeida M., LeChatelier E., Renault P., Pons N., Batto J.M., Zhang Z., Chen H., Yang R., Zheng W., Li S., Yang H., Wang J., Ehrlich S.D., Nielsen R., Pedersen O., Kristiansen K., Wang J. (2012). A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature, 490 (7418), 55-60.
43. Russello G., Russo A., Sisto F., Scaltrito M.M., Farina C. (2012). Laboratory diagnosis of Clostridium difficile associated diarrhoea and molecular characterization of clinical isolates. New Microbiol, 35, 307-316.
44./6_m3.jpg) Semenyuk E.G., Laning M.L., Foley J., Johnston P.F., Knight K.L., Gerding D.N., Driks A. (2014). Spore formation and toxin production in Clostridium difficile biofilms. PLoS One, 9 (1), 1-14. doi: 10.1371/journal.pone.0087757
Semenyuk E.G., Laning M.L., Foley J., Johnston P.F., Knight K.L., Gerding D.N., Driks A. (2014). Spore formation and toxin production in Clostridium difficile biofilms. PLoS One, 9 (1), 1-14. doi: 10.1371/journal.pone.0087757
45. Seo G.S. (2013). Clostridium difficile infection: what’s new? In test Res, (11), 1-13.
46. Shah D.N., Aitken S.L., Barragan L.F., Bozorgui S., Goddu S., Navarro M.E., Xie Y., DuPont H.L., Garey K.W. (2016). Economic burden of primary compared with recurrent Clostridium difficile infection in hospitalized patients: a prospective cohort study. J Hosp Infect Elsevier, 93 (3), 286-289. doi: 10.1016/j.jhin.2016.04.004.
47. Slimings C., Riley T.V. (2014). Antibiotics and hospital-acquired Clostridium difficile infection: update of systematic review and meta-analysis. J Antimicrob Chemother, 69, 881-891
J Antimicrob Chemother, 69, 881-891
48. Surawicz C.M., Brandt L.J., Binion D.G., Ananthakrishnan A.N., Curry S.R., Gilligan P.H., McFarland L.V., Mellow M., Zuckerbraun B.S. (2013). Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections. Am J Gastroenterol, 108 (4), 478-498. doi: 10.1038/ajg.2013.4.
49. Turgeon D.K., Novicki T.J., Quick J., Carlson L., Miller P., Ulness B., Cent A., Ashley R., Larson A., Coyle M., Limaye A.P., Cookson B.T., Fritsche T.R. (2003) Six rapid tests for direct detection of Clostridium difficile and its toxins in fecal samples compared with the fibroblast cytotoxicity assay. J Clin Microbiol, 41 (2), 667-670.
50. Videlock E., Cremonini F. (2012) Meta-analysis: probiotics in antibiotic-associated diarrhea. Aliment Pharmacol Ther, 35 (12), 1355-1369.
Aliment Pharmacol Ther, 35 (12), 1355-1369.
51. Yoldaş Ö., Altindiş M., Cufali D., Aşik G., Keşli RAu. (2016). A diagnostic algorithm for the detection of Clostridium difficile-associated diarrhea. Balkan Med J, 33 (1), 80-86. doi: 10.5152/balkanmedj.2015.15159.
52. Zhang S., Palazuelos-Munoz S., Balsells E.M., Nair H., Chit A., Kyaw M.H. (2016). Cost of hospital management of Clostridium difficile infection in the United States — a meta-analysis and modelling study. BMC Infect Dis, 16, 1-18.
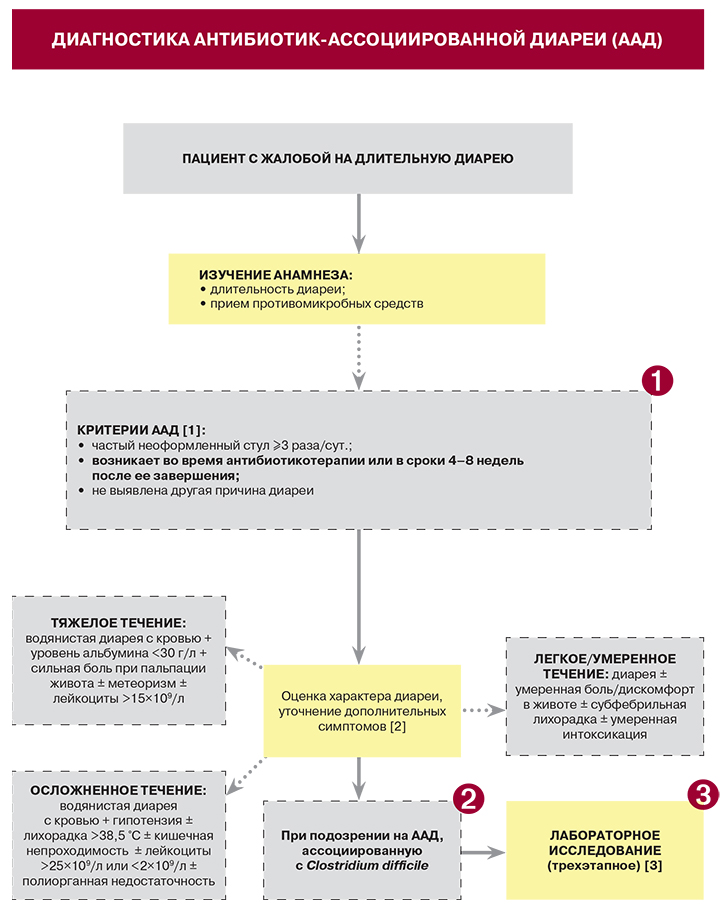
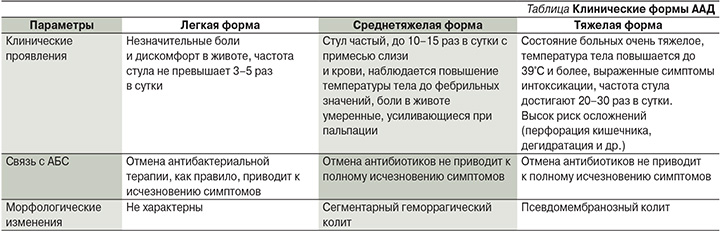
Терапия » АНТИБИОТИК-АССОЦИИРОВАННАЯ ДИАРЕЯ
Терапия » АНТИБИОТИК-АССОЦИИРОВАННАЯ ДИАРЕЯАНТИБИОТИК-АССОЦИИРОВАННАЯ ДИАРЕЯ
Литература
 BMJ 2002; 324: 1361–66.
BMJ 2002; 324: 1361–66. et al. Antibiotic-associated bloody diarrhea in infants: clinical, endoscopic and histopathologic profiles. J Pediatr Gastroenterol Nutr. 2011 Jan; 52(1): 60–64. doi: 10.1097/MPG.0b013e3181da215b.
et al. Antibiotic-associated bloody diarrhea in infants: clinical, endoscopic and histopathologic profiles. J Pediatr Gastroenterol Nutr. 2011 Jan; 52(1): 60–64. doi: 10.1097/MPG.0b013e3181da215b. Официальный сайт Государственного научного центра колопроктологии http://www.gnck.ru/rec/recommendation_ clostridium_difficile.pdf
Официальный сайт Государственного научного центра колопроктологии http://www.gnck.ru/rec/recommendation_ clostridium_difficile.pdf
{«loading»:»\u0417\u0430\u0433\u0440\u0443\u0437\u043a\u0430…»,»close»:»\u0417\u0430\u043a\u0440\u044b\u0442\u044c»,»yes»:»\u0414\u0430″,»no»:»\u041d\u0435\u0442″,»proceed»:»\u041f\u0440\u043e\u0434\u043e\u043b\u0436\u0438\u0442\u044c»,»conf_del»:»\u0412\u044b \u0434\u0435\u0439\u0441\u0442\u0432\u0438\u0442\u0435\u043b\u044c\u043d\u043e \u0445\u043e\u0442\u0438\u0442\u0435 \u0443\u0434\u0430\u043b\u0438\u0442\u044c»,»cancel»:»\u041e\u0442\u043c\u0435\u043d\u0438\u0442\u044c»}
Антибиотик-ассоциированная диарея: выбор пробиотика с позиций медицины, основанной на доказательствах :: ТРУДНЫЙ ПАЦИЕНТ
Н.И.Урсова
МОНИКИ им. М.Ф. Владимирского, Москва
В связи с распространением антибиотикотерапии в научной литературе последних лет высказывается новая концепция способности антибиотика оказывать сопутствующий ущерб (collateral damage). По современным представлениям collateral damage – термин, используемый для описания экологически нежелательных эффектов антимикробной терапии. В статье рассматриваются особенности воздействия различных групп антибиотиков на функцию кишечника и причины развития антибиотик-ассоциированной диареи. В настоящее время мультиштаммовые пробиотики, например, РиоФлора Баланс Нео, представляются наиболее удачными по соотношению эффективности, переносимости и невысокой цены пробиотики. Мультиштаммовые пробиотики могут быть с успехом использованы для профилактики и лечения последствий воздействия антибиотиков на кишечную микрофлору.
По современным представлениям collateral damage – термин, используемый для описания экологически нежелательных эффектов антимикробной терапии. В статье рассматриваются особенности воздействия различных групп антибиотиков на функцию кишечника и причины развития антибиотик-ассоциированной диареи. В настоящее время мультиштаммовые пробиотики, например, РиоФлора Баланс Нео, представляются наиболее удачными по соотношению эффективности, переносимости и невысокой цены пробиотики. Мультиштаммовые пробиотики могут быть с успехом использованы для профилактики и лечения последствий воздействия антибиотиков на кишечную микрофлору.
Ключевые слова: антибиотики, пробиотики, антибиотик-ассоциированная диарея.
Antibiotic-associated diarrhea: choosing probiotics according to evidence-based medicine
N.I.Ursova
M.F.Vladimirsky MRSRCI, Moscow
Due to widespread of antibiotics prescriptions data on the new conception called collateral damage in the science sources is being collecting. Collateral damage includes all ecologically negative effects of antibiotics intake. The article describes the features of antibiotics’ impact on the intestine function and the etiology of antibiotic-associated diarrhea. Multi-strain probiotics, e.g. RioFlora Balance Neo, are supposed to be effective, safety and low cost. Multi-strain probiotics might be prescribed for prevention and treatment of antibiotics damage impact on intestine microflora.
Collateral damage includes all ecologically negative effects of antibiotics intake. The article describes the features of antibiotics’ impact on the intestine function and the etiology of antibiotic-associated diarrhea. Multi-strain probiotics, e.g. RioFlora Balance Neo, are supposed to be effective, safety and low cost. Multi-strain probiotics might be prescribed for prevention and treatment of antibiotics damage impact on intestine microflora.
Keywords: antibiotics, probiotics, antibiotic-associated diarrhea.
Сведения об авторе:
Урсова Наталья Игоревна – д.м.н., профессор кафедры педиатрии МОНИКИ им. М.Ф.Владимирского, главный детский гастроэнтеролог Московской области
Объединенные данные показали, что антибиотикотерапия является одной из самых значимых достижений медицинской практики, которая в корне изменила клинические симптомы и исходы бактериальных инфекций. Приоритет антибиотиков в лечении не подвергается сомнению, причем до такой степени, что предшествующее поколение препаратов никогда не проходило контролируемые клинические испытания [1]. Согласно мониторинговым исследованиям, в лечебных учреждениях во многих странах мира существует острая необходимость оптимизации антибиотикотерапии. Например, установлено, что 50% госпитализированных пациентов получают антибиотики необоснованно. Напротив, 30–40% больным, нуждающимся в их назначении, общие рекомендации по антимикробной терапии вообще не выполнялись [2–4]. Непрерывно возрастающий поток сведений о межнациональных различиях терапевтического использования антибиотиков в странах Европы свидетельствует о том, что в Нидерландах, Великобритании и Скандинавии назначают существенно меньше антибиотиков (10 дневных доз на 1000 жителей в день), чем во Франции, Италии, Испании, Португалии и Греции (32,2 дневных доз на 1000 жителей в день) [5, 6]. Имеется достаточно исследований, подтверждающих, что на амбулаторном и стационарном этапах оказания медицинской помощи увеличивается количество и качество применяемых антибиотиков. Проводя параллель между чрезмерным использованием антимикробных средств и активно внедряемых новых пролонгированных форм антибиотиков широкого спектра действия, была доказана возможность формирования антибиотикорезистентности, лекарственной аллергии, токсических осложнений, суперинфекции и патологических симбиозов кишечника [7, 8].
Согласно мониторинговым исследованиям, в лечебных учреждениях во многих странах мира существует острая необходимость оптимизации антибиотикотерапии. Например, установлено, что 50% госпитализированных пациентов получают антибиотики необоснованно. Напротив, 30–40% больным, нуждающимся в их назначении, общие рекомендации по антимикробной терапии вообще не выполнялись [2–4]. Непрерывно возрастающий поток сведений о межнациональных различиях терапевтического использования антибиотиков в странах Европы свидетельствует о том, что в Нидерландах, Великобритании и Скандинавии назначают существенно меньше антибиотиков (10 дневных доз на 1000 жителей в день), чем во Франции, Италии, Испании, Португалии и Греции (32,2 дневных доз на 1000 жителей в день) [5, 6]. Имеется достаточно исследований, подтверждающих, что на амбулаторном и стационарном этапах оказания медицинской помощи увеличивается количество и качество применяемых антибиотиков. Проводя параллель между чрезмерным использованием антимикробных средств и активно внедряемых новых пролонгированных форм антибиотиков широкого спектра действия, была доказана возможность формирования антибиотикорезистентности, лекарственной аллергии, токсических осложнений, суперинфекции и патологических симбиозов кишечника [7, 8]. В связи с этим, в научной литературе последних лет появилась новая концепция способности антибиотика оказывать сопутствующий ущерб (collateral damaqe). По современным представлениям collateral damaqe – термин, используемый для описания экологически нежелательных эффектов антимикробной терапии. Например, селекции лекарственно-устойчивых микроорганизмов, колонизации условно-патогенной микробной флоры и развитие инфекции, вызванной множественноустойчивыми бактериями. Знание этого фактора риска очень важно для врача первичного звена, постоянно работающего с пациентом, потому что его роль в профилактике нарушений микрофлоры переоценить невозможно. В соответствии с принятыми международными рекомендациями, всем больным, получающим антибиотики, должны назначаться антибиотикорезистентные пробиотики, так как любой из пациентов (независимо от возраста, пола, наличия или отсутствия других факторов риска) подвергается collateral damaqe.
В связи с этим, в научной литературе последних лет появилась новая концепция способности антибиотика оказывать сопутствующий ущерб (collateral damaqe). По современным представлениям collateral damaqe – термин, используемый для описания экологически нежелательных эффектов антимикробной терапии. Например, селекции лекарственно-устойчивых микроорганизмов, колонизации условно-патогенной микробной флоры и развитие инфекции, вызванной множественноустойчивыми бактериями. Знание этого фактора риска очень важно для врача первичного звена, постоянно работающего с пациентом, потому что его роль в профилактике нарушений микрофлоры переоценить невозможно. В соответствии с принятыми международными рекомендациями, всем больным, получающим антибиотики, должны назначаться антибиотикорезистентные пробиотики, так как любой из пациентов (независимо от возраста, пола, наличия или отсутствия других факторов риска) подвергается collateral damaqe.
Основным потенциально опасным эффектом является диарея, связанная с приемом антибиотиков (ААД). В медицинских литературных источниках отмечается большой разброс данных относительно частоты АДД в детской популяции. В проведенных ранее исследованиях этот показатель колебался в пределах 11–40%, но сохранялся стабильно высоким на протяжении последних десятилетий [9, 10]. Согласно доминирующей гипотезе, в основе патогенетических механизмов развития диареи могут лежать как собственные повреждающие эффекты антибиотиков (аллергические, токсические и фармакологические), так и возникшие метаболические и микробиологические изменения кишечника (расстройства моторики, энтерогепатическая дисфункция желчных кислот, избыточный рост потенциально патогенной флоры в тонкой и толстой кишке и др.) [11]. При этом следует подчеркнуть, что в данной модели генеза ААД признается потенциальное значение фонового состояния пищеварительной системы: с физиологическими условиями или функциональными нарушениями. Это же в значительной мере определяет благоприятный или неблагоприятный прогноз ААД. Более того, общепринятая практика совместного использования пробиотика и антибиотика, которая обеспечивает профилактический эффект, снижает риск и редуцирует тяжесть диспепсии, во многом объясняется особенностями функционирования желудочно-кишечного тракта [12–15].
В медицинских литературных источниках отмечается большой разброс данных относительно частоты АДД в детской популяции. В проведенных ранее исследованиях этот показатель колебался в пределах 11–40%, но сохранялся стабильно высоким на протяжении последних десятилетий [9, 10]. Согласно доминирующей гипотезе, в основе патогенетических механизмов развития диареи могут лежать как собственные повреждающие эффекты антибиотиков (аллергические, токсические и фармакологические), так и возникшие метаболические и микробиологические изменения кишечника (расстройства моторики, энтерогепатическая дисфункция желчных кислот, избыточный рост потенциально патогенной флоры в тонкой и толстой кишке и др.) [11]. При этом следует подчеркнуть, что в данной модели генеза ААД признается потенциальное значение фонового состояния пищеварительной системы: с физиологическими условиями или функциональными нарушениями. Это же в значительной мере определяет благоприятный или неблагоприятный прогноз ААД. Более того, общепринятая практика совместного использования пробиотика и антибиотика, которая обеспечивает профилактический эффект, снижает риск и редуцирует тяжесть диспепсии, во многом объясняется особенностями функционирования желудочно-кишечного тракта [12–15]. Как правило, в реальной клинической практике эти аспекты учитываются недостаточно.
Как правило, в реальной клинической практике эти аспекты учитываются недостаточно.
Представлено множество работ, свидетельствующих о том, что большинство антибиотиков может вызывать ААД, при этом нет однозначного ответа: обладают ли они одинаковой повреждающей селективностью. Скорее всего, данные свойства представлены у каждого антибиотика по-разному. Считается, что эритромицин действует на мотилиновые рецепторы, ускоряя транзит; клавулановая кислота и ее метаболиты стимулируют моторную функцию тонкой кишки; пенициллины, проявляя васкулярные эффекты, способны вызывать сегментарный колит; тетрациклины – оказывать непосредственное токсическое действие на слизистую оболочку желудочно-кишечного тракта; цефоперазон и цефтриаксон, выделяясь в просвет кишечника с желчью, запускают каскад реакций, способствующих возникновению мальабсорбции пищевых веществ [16, 17].
В последние годы активно обсуждается способность антибиотиков вызывать структурно-функциональные изменения биоценозов с формированием ассоциативных патологических симбиозов в различных биотопах организма [18]. Заслуживает внимание то, что антибиотики вызывают значительные изменения физико-химических свойств слизи. В этом случае уменьшается внешний и внутренний слой слизи, повышается проницаемость кишечной стенки и абсорбция содержимого просвета кишечника. Под воздействием антибиотиков могут происходить трансформации в сторону увеличения в популяции нормальной транзиторной флоры отдельных видов, характеризующихся наличием факторов патогенности: увеличением адгезивности, высокой биохимической активностью и энтеротоксинпродукцией, множественной лекарственной устойчивостью [19–21]. Последние эпидемиологические исследования, проведенные в Дании, четко свидетельствуют в пользу того, что применение в раннем детстве антибиотиков является неблагоприятным прогностическим фактором развития некоторых воспалительных заболеваний кишечника. 500 тыс новорожденных были включены в проспективное длительное исследование, в течение которого учитывалось число проведенных курсов антибиотиков и объем антимикробной терапии.
Заслуживает внимание то, что антибиотики вызывают значительные изменения физико-химических свойств слизи. В этом случае уменьшается внешний и внутренний слой слизи, повышается проницаемость кишечной стенки и абсорбция содержимого просвета кишечника. Под воздействием антибиотиков могут происходить трансформации в сторону увеличения в популяции нормальной транзиторной флоры отдельных видов, характеризующихся наличием факторов патогенности: увеличением адгезивности, высокой биохимической активностью и энтеротоксинпродукцией, множественной лекарственной устойчивостью [19–21]. Последние эпидемиологические исследования, проведенные в Дании, четко свидетельствуют в пользу того, что применение в раннем детстве антибиотиков является неблагоприятным прогностическим фактором развития некоторых воспалительных заболеваний кишечника. 500 тыс новорожденных были включены в проспективное длительное исследование, в течение которого учитывалось число проведенных курсов антибиотиков и объем антимикробной терапии. Анализ результатов показал, что у младенцев, получавших антибиотики в первые годы жизни, в дальнейшем существенно возрастает заболеваемость болезнью Крона. Кроме того, этот риск пропорционально увеличивается количеству курсов антибиотикотерапии [22]. Полученные данные имеют принципиальное значение с точки зрения долгосрочного прогноза, поскольку состав микробиоты толстой кишки – ключевой фактор развития воспалительных заболеваний кишечника [23, 24], частота которых за минувшие 50 лет повысилась многократно и продолжает непрерывно увеличиваться. Вследствие очевидной связи этих болезней с усилением роли условно-патогенной микробной флоры, эти микроорганизмы являются целью терапевтического вмешательства (энтеросорбция, пробиотикотерапия).
Анализ результатов показал, что у младенцев, получавших антибиотики в первые годы жизни, в дальнейшем существенно возрастает заболеваемость болезнью Крона. Кроме того, этот риск пропорционально увеличивается количеству курсов антибиотикотерапии [22]. Полученные данные имеют принципиальное значение с точки зрения долгосрочного прогноза, поскольку состав микробиоты толстой кишки – ключевой фактор развития воспалительных заболеваний кишечника [23, 24], частота которых за минувшие 50 лет повысилась многократно и продолжает непрерывно увеличиваться. Вследствие очевидной связи этих болезней с усилением роли условно-патогенной микробной флоры, эти микроорганизмы являются целью терапевтического вмешательства (энтеросорбция, пробиотикотерапия).
Установлено, что характерной особенностью воздействия цефалоспоринов на фекальную микробиоту является снижение концентрации кишечных палочек, лактобацилл и бифидобактерий, с заметным увеличением клебсиелл, энтеробактеров, протеев, псевдомонад, энтерококков, стафилококков. Ампициллин вызывает уменьшение популяций кишечных палочек, энтерококков, лактобацилл, бифидобактерий, клостридий, с другой стороны – увеличивает титр клебсиелл, энтеробактеров, цитробактеров, протеев, морганелл и грибов. Карбенициллин оказывает на микроэкологию толстой кишки аналогичное действие, однако оно менее выражено по отношению к лактобациллам, бактероидам и фузобактериям. Аминогликозидные антибиотики заметно снижают число аэробных грамотрицательных бактерий, включая кишечные палочки, клебсиеллы, и практически не оказывают эффекта на протей, псевдомонады, энтерококки, лактобациллы. Линкозамиды (линкомицин, клиндамицин) глубоко изменяют микрофлору толстой кишки: происходит резкое угнетение или даже элиминация грамотрицательных анаэробных бактерий, аэробных кокков, лактобацилл, стафилококков, стрептококков, бифидобактерий, эубактерий, при этом возрастает количество протеев, псевдомонад, цитробактеров, кандид, кишечных палочек
Ампициллин вызывает уменьшение популяций кишечных палочек, энтерококков, лактобацилл, бифидобактерий, клостридий, с другой стороны – увеличивает титр клебсиелл, энтеробактеров, цитробактеров, протеев, морганелл и грибов. Карбенициллин оказывает на микроэкологию толстой кишки аналогичное действие, однако оно менее выражено по отношению к лактобациллам, бактероидам и фузобактериям. Аминогликозидные антибиотики заметно снижают число аэробных грамотрицательных бактерий, включая кишечные палочки, клебсиеллы, и практически не оказывают эффекта на протей, псевдомонады, энтерококки, лактобациллы. Линкозамиды (линкомицин, клиндамицин) глубоко изменяют микрофлору толстой кишки: происходит резкое угнетение или даже элиминация грамотрицательных анаэробных бактерий, аэробных кокков, лактобацилл, стафилококков, стрептококков, бифидобактерий, эубактерий, при этом возрастает количество протеев, псевдомонад, цитробактеров, кандид, кишечных палочек
и клостридий. Макролидные антибиотики
при оральном введении снижают концентрацию аэробных и анаэробных бактерий, хотя и в незначительной степени, и одновременно увеличивают популяции клебсиелл, энтеробактеров, протеев и псевдомонад [9]. Результаты подобных детальных исследований положительно коррелируют с эпидемиологическими данными по развитию ААД. Наибольший риск нежелательных последствий использования антибиотиков доказан в отношении пенициллинов (5–10%), комбинации амоксициллина и клавулановой кислоты (10–25%), цефалоспоринов третьего поколения и клиндамицина (15–20%) [18, 25–27].
Результаты подобных детальных исследований положительно коррелируют с эпидемиологическими данными по развитию ААД. Наибольший риск нежелательных последствий использования антибиотиков доказан в отношении пенициллинов (5–10%), комбинации амоксициллина и клавулановой кислоты (10–25%), цефалоспоринов третьего поколения и клиндамицина (15–20%) [18, 25–27].
В опубликованном обзоре L.V.McFarland [28] было показано, что биологические особенности половой принадлежности пациента, доза и способ приема антибиотика не являются ключевыми прогностическими факторами возникновения АДД. В таблице систематизированы определяющие параметры факторов риска ААД, которые дают возможность клиницистам лучше понимать и объяснять индивидуальную вариабельность пациента.
Наиболее четкие доказательства причинно-следственной связи ААД получены в отношении следующих патогенных микроорганизмов: Salmonella, Clostridium perfringens типа А, Staphylococcus aureus, Klebsiella oxytoca, и, возможно Candida albicans [29, 30]. Есть новые данные о том, что Klebsiella oxytoca вызывает геморрагический колит, который проявляется типичной клинической картиной: остро манифестирующий интенсивный абдоминальный синдром, водянистая кровавая диарея с частотой более 15 раз в сутки, лихорадка и маркеры острой фазы воспаления в анализах крови [31, 32]. При колоноскопии обнаруживается выраженная гиперемией слизистой оболочки с множественными эрозиями, морфология неспецифична и представлена геморрагическим распадом собственной пластинки. Убедительным подтверждением этого этиологического фактора стали результаты инокуляции цитотоксина Klebsiella oxytoca, выделенного от пациентов с геморрагическим колитом, в изолированные кишечные петли кроликов, которая вызвала тяжелые кровотечения слизистой оболочки с увеличением количества жидкости [33]. По данным исследователей, геморрагическая ААД развивается у 20% пациентов, получающих ампициллин, 45% – амоксициллин, 20% – комбинацию последнего с клавулановой кислотой [31, 32].
Есть новые данные о том, что Klebsiella oxytoca вызывает геморрагический колит, который проявляется типичной клинической картиной: остро манифестирующий интенсивный абдоминальный синдром, водянистая кровавая диарея с частотой более 15 раз в сутки, лихорадка и маркеры острой фазы воспаления в анализах крови [31, 32]. При колоноскопии обнаруживается выраженная гиперемией слизистой оболочки с множественными эрозиями, морфология неспецифична и представлена геморрагическим распадом собственной пластинки. Убедительным подтверждением этого этиологического фактора стали результаты инокуляции цитотоксина Klebsiella oxytoca, выделенного от пациентов с геморрагическим колитом, в изолированные кишечные петли кроликов, которая вызвала тяжелые кровотечения слизистой оболочки с увеличением количества жидкости [33]. По данным исследователей, геморрагическая ААД развивается у 20% пациентов, получающих ампициллин, 45% – амоксициллин, 20% – комбинацию последнего с клавулановой кислотой [31, 32].
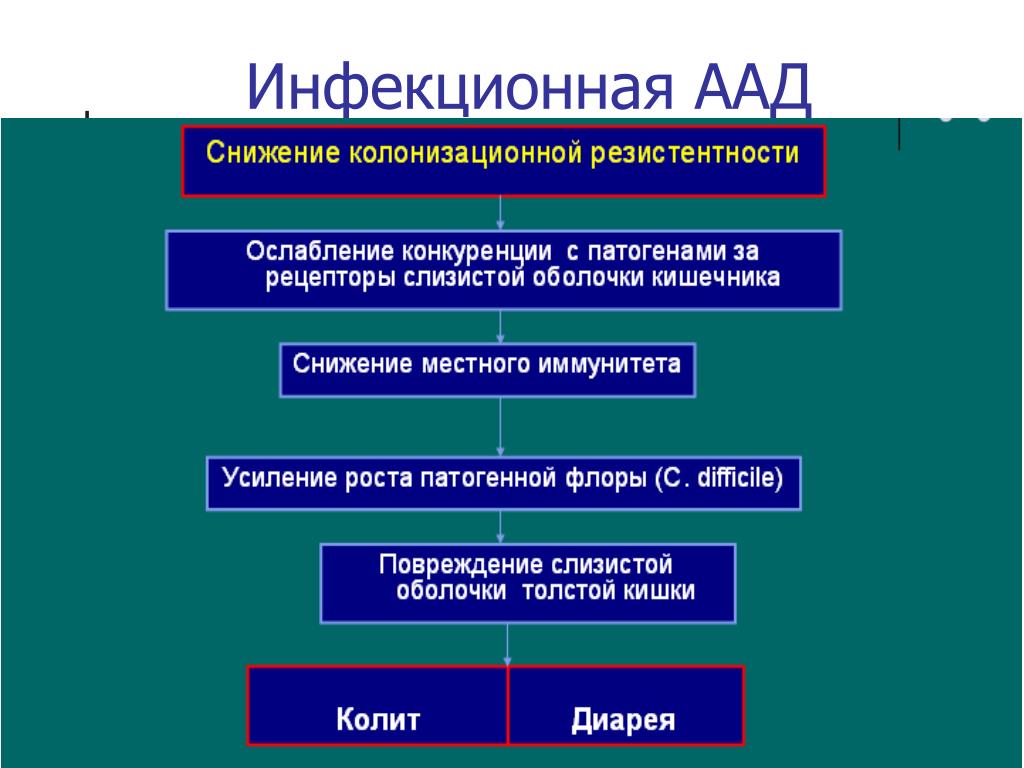
Одним из ведущих, наиболее изученных и часто встречающихся этиологических факторов ААД является Clostridium difficile – анаэробная спорообразующая палочка, передающаяся фекально-оральным путем. Hall и O`Toole в 1935 г. верифицировали C.difficile как облигатный грамположительный спорообразующий анаэроб. Ими же в эксперименте на лабораторных животных была установлена способность C.difficile к выработке нейротоксина, однако до 1970 года этот микроорганизм считался комменсалом кишечной микробиоты. В середине 70-х годов, когда был достигнут существенный прогресс в диагностике инфекционных заболеваний, установили, что C.difficile широко распространен в природе, обнаруживается в почве, морской и речной воде, фекалиях многих животных и in vitro способен вырабатывать летальный токсин. Наиболее высокая колонизация C.difficile регистрируется у младенцев. Хотя этот возрастной период характеризуется транзиторной функциональной недостаточностью желудочно-кишечного тракта, ферментативной, иммунологической незрелостью и нестабильностью микробиоценозов, развитие клинически манифестных форм псевдомембранозного колита встречается крайне редко, что объясняется отсутствием у новорожденных высокоаффинных рецепторов к токсинам возбудителя [34, 35].
Hall и O`Toole в 1935 г. верифицировали C.difficile как облигатный грамположительный спорообразующий анаэроб. Ими же в эксперименте на лабораторных животных была установлена способность C.difficile к выработке нейротоксина, однако до 1970 года этот микроорганизм считался комменсалом кишечной микробиоты. В середине 70-х годов, когда был достигнут существенный прогресс в диагностике инфекционных заболеваний, установили, что C.difficile широко распространен в природе, обнаруживается в почве, морской и речной воде, фекалиях многих животных и in vitro способен вырабатывать летальный токсин. Наиболее высокая колонизация C.difficile регистрируется у младенцев. Хотя этот возрастной период характеризуется транзиторной функциональной недостаточностью желудочно-кишечного тракта, ферментативной, иммунологической незрелостью и нестабильностью микробиоценозов, развитие клинически манифестных форм псевдомембранозного колита встречается крайне редко, что объясняется отсутствием у новорожденных высокоаффинных рецепторов к токсинам возбудителя [34, 35].
Важность выделения проблемы развития инфекции, ассоциированной с C.difficile связана с тем, что применение почти любого антибактериального препарата может вызвать псевдомембранозный колит. Предрасполагающим фактором чаще всего служит госпитализация больного или его пребывание в реабилитационных учреждениях. Последние моделирующие исследования показывают, что C.difficile является основной причиной вспышек внутрибольничных инфекций в странах с высоким уровнем дохода [36–40]. Некоторые данные позволяют предположить, что состояние иммунной системы в процессе становления и старения определяет повышенный риск заражения и тяжесть течения клостридиоза. Практический опыт подтвердил, что распространенность инфицирования C.difficile существенно выше у детей в возрасте с 6 мес до 2-х лет и пожилых пациентов. Именно эта возрастная популяция имеет особенности иммунитета, а также чаще контактирует с медицинскими учреждениями.
Наше понимание процессов манифестации нозокомиальной инфекции, ассоциированной с C. difficile далеко от идеала. Спектр патологии, вызываемой патогенными штаммами C.difficile, варьирует в чрезвычайно широких пределах – от здорового носительства до фульминантных форм заболевания. На сегодняшний день доподлинно известно, что C.difficile вырабатывает два белковых эндотоксина А и В, вызывающие воспаление кишечника и нарушение его функции. Получены сведения о том, что эти токсины кодируются двумя генами: tox A и tox B, которые расположены на бактериальной хромосоме рядом друг с другом. Оказалось, что почти все патогенные штаммы выделяют оба токсина и только несколько штаммов – токсин В.
difficile далеко от идеала. Спектр патологии, вызываемой патогенными штаммами C.difficile, варьирует в чрезвычайно широких пределах – от здорового носительства до фульминантных форм заболевания. На сегодняшний день доподлинно известно, что C.difficile вырабатывает два белковых эндотоксина А и В, вызывающие воспаление кишечника и нарушение его функции. Получены сведения о том, что эти токсины кодируются двумя генами: tox A и tox B, которые расположены на бактериальной хромосоме рядом друг с другом. Оказалось, что почти все патогенные штаммы выделяют оба токсина и только несколько штаммов – токсин В.
Особый интерес представляет тот факт, что механизм действия токсинов на кишечник является видоспецифичным. У человека токсин В проявляет себя в десятки раз более мощным антигеном, чем токсин А. Противоположные эффекты получены в экспериментальных моделях на мышах. Это объясняют существующими различиями в строении рецепторов энтероцитов человека и грызуна. Есть основания полагать, что непосредственное цитотоксическое воздействие на энтероциты у пациентов и лабораторных животных в конечном итоге вызывает одинаковые патофизиологические последовательности и исходы. Во-первых, обусловленная токсинами, дисрегуляция адгезивных протеинов приводит к разрушению белкового цитоскелета микроворсинок, усилению парацеллюлярной проницаемости и перфузии хлора из клеток. Во-вторых, вазоактивные субстанции и провоспалительные продукты проявляют себя триггерами в развитии активной фазы воспаления в lamina propria. У больных выявляются морфофункциональные и гистохимические изменения слизистой оболочки толстой кишки, обусловленные инфильтрацией нейтрофильными гранулоцитами и формированием псевдомембран [38, 41].
Во-первых, обусловленная токсинами, дисрегуляция адгезивных протеинов приводит к разрушению белкового цитоскелета микроворсинок, усилению парацеллюлярной проницаемости и перфузии хлора из клеток. Во-вторых, вазоактивные субстанции и провоспалительные продукты проявляют себя триггерами в развитии активной фазы воспаления в lamina propria. У больных выявляются морфофункциональные и гистохимические изменения слизистой оболочки толстой кишки, обусловленные инфильтрацией нейтрофильными гранулоцитами и формированием псевдомембран [38, 41].
Клостридиоз приводит к образованию специфических IgG- и IgA-антител, обладающих свойствами антитоксина. У взрослых с высокими титрами сывороточных IgG-антител к токсину А колонизация C.difficile не провоцирует колит, а у лиц с низкими титрами IgG- и IgM-антител к токсину А имеется потенциальный риск рецидивирующей инфекции [42, 43].
Диагноз АДД ставится при наличии в анамнезе указаний на лечение любым препаратом из группы антибактериальных средств. Временной интервал между антибиотикотерапией и появлением гастроинтестинальной дисфункции может быть коротким (клинические признаки возникают на фоне приема антибиотика), в течение двух недель после окончания лечения и длительным (по прошествии
Временной интервал между антибиотикотерапией и появлением гастроинтестинальной дисфункции может быть коротким (клинические признаки возникают на фоне приема антибиотика), в течение двух недель после окончания лечения и длительным (по прошествии
2-х и более месяцев).
Доказательств надежности клинических маркеров для идентификации псевдомембранозного колита недостаточно. Исследования демонстрируют существенную вариабельность симптомов: гипертермический синдром регистрируется у 26% больных, болезненные и ложные позывы к дефекации – у 70%, признаки дегидратации с потерей массы тела – в 30% случаев. Обязательной составной частью клинической картины и доминирующим симптомом у 95% больных является водянистая диарея. Частота стула при диарее различна – в среднем 4–10 раз в сутки при относительно большом объеме фекалий. Цвет каловых масс чаще молочный или зеленоватый с незначительной вариацией оттенков.
У 5% больных диарея может отсутствовать или ослабевать в связи с развитием опасных состояний: гастропареза, паралитической кишечной непроходимости и токсического мегаколона. Эту клиническую ситуацию связывают с течением фульминантного псевдомембранозного колита с очень неблагоприятным прогнозом. Она требует безотлагательной консультации хирурга, так как состояние пациента будет ухудшаться стремительно с формированием полиорганной недостаточности.
Эту клиническую ситуацию связывают с течением фульминантного псевдомембранозного колита с очень неблагоприятным прогнозом. Она требует безотлагательной консультации хирурга, так как состояние пациента будет ухудшаться стремительно с формированием полиорганной недостаточности.
В реальной клинической практике очень редко, но встречаются системные нетипичные клинические признаки псевдомембранозного колита: асцит, плевральный выпот, абсцесс селезенки, поражение тонкой кишки, артриты, остеомиелит. Поэтому всегда при интерпретации результатов физикального обследования больного необходимо обращать внимание на факт предшествующего приема антибиотика, крайне важен тщательно собранный анамнез [44–46].
Диагностика инфекции C.difficile представляет некоторую трудность ввиду невозможности многих лабораторий провести адекватные исследования на обнаружение токсинов. Подтверждают инфекцию путем выявления основных повреждающих факторов (токсинов C.difficile) с помощью монокультуры клеток млекопитающих и доказательства нейтрализующего эффекта специфических антитоксических сывороток.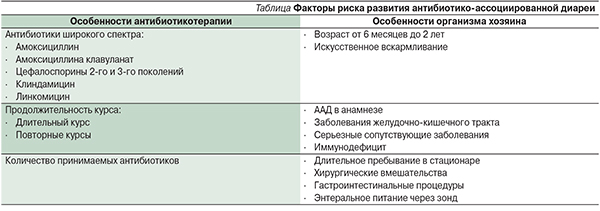 Это самый чувствительный, но трудоемкий и дорогой метод исследования. В настоящее время предлагаются альтернативные методы на основе твердофазного иммуноферментного анализа (ELISA), однако 10–20% тестов дают ложно отрицательные результаты.
Это самый чувствительный, но трудоемкий и дорогой метод исследования. В настоящее время предлагаются альтернативные методы на основе твердофазного иммуноферментного анализа (ELISA), однако 10–20% тестов дают ложно отрицательные результаты.
Эндоскопия прямой и сигмовидной ободочной кишки с помощью гибкого эндоскопа имеет самостоятельную диагностическую ценность для подтверждения активного воспалительного процесса в кишечнике. Данная методика считается относительно инвазивной, но позволяет учитывать такие патогномоничные эндоскопические признаки, как наличие желтовато-белых бляшек с диаметром 2–20 мм, прилипших к эритематозной слизистой оболочке. При гистологическом исследовании обнаруживается поверхностный некроз слизистой оболочки с выпотом лейкоцитов и фибрина вместе с клеточными остатками ткани и слизью. Крипты расширены из-за большого количества слизи, lamina propria инфильтрирована полиморфно-ядерными клетками. Эти морфологические показатели являются эталонным доказательством инфекции, вызываемой C.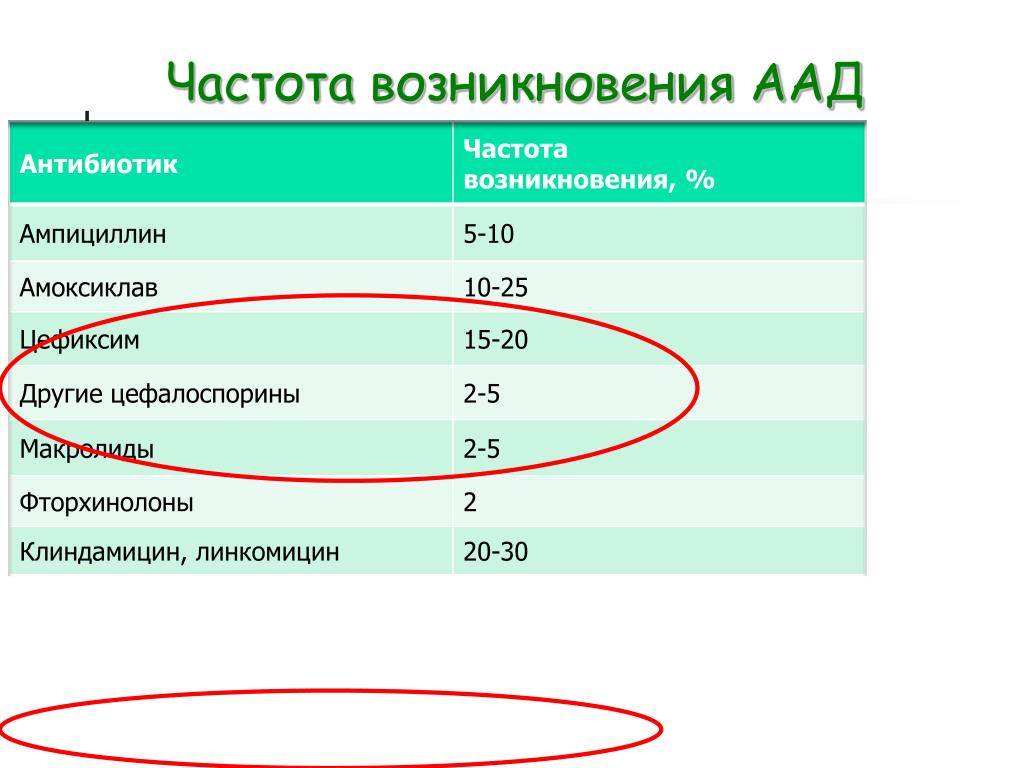 difficile [47–49]. Однако следует подчеркнуть, что вышеперечисленные объективные маркеры не определяются при тяжелых формах псевдомембранозного колита, что затрудняет дифференциальную диагностику между ишемическим, инфекционным или воспалительным колитом. Эндоскопическая картина представлена макроскопическими язвами, которые возникают в результате полного разрушения слизистой оболочки фибрино-лейкоцитарным выпотом. Основополагающим в верификации диагноза будут результаты гистологического исследования [46].
difficile [47–49]. Однако следует подчеркнуть, что вышеперечисленные объективные маркеры не определяются при тяжелых формах псевдомембранозного колита, что затрудняет дифференциальную диагностику между ишемическим, инфекционным или воспалительным колитом. Эндоскопическая картина представлена макроскопическими язвами, которые возникают в результате полного разрушения слизистой оболочки фибрино-лейкоцитарным выпотом. Основополагающим в верификации диагноза будут результаты гистологического исследования [46].
Определенную диагностическую значимость может иметь бариевая контрастная клизма, при которой определяются «пальцевые вдавления», отражающие наличие утолщения стенок ободочной кишки за счет подслизистого отека. Компьютерная томография органов брюшной полости выявляет такие утолщения в 60% случаев [44].
Терапевтическая тактика АДД включает этиопатогенетические аспекты и симптоматический подход. Лечение должно быть, прежде всего, ориентировано на основные фоновые заболевания пациента и факторы риска АДД. Мы не будем подробно останавливаться на базовой терапии псевдомембранозного колита, на эту тему есть много публикаций, отметим только, что эффективность метронидазола и ванкомицина или их комбинация в контролируемых исследованиях никогда не изучалась. Что касается модулирующих бактериальных воздействий, направленных на улучшение функционирования кишечной микробиоты, приоритет на сегодняшний день отдается пробиотикам.
Мы не будем подробно останавливаться на базовой терапии псевдомембранозного колита, на эту тему есть много публикаций, отметим только, что эффективность метронидазола и ванкомицина или их комбинация в контролируемых исследованиях никогда не изучалась. Что касается модулирующих бактериальных воздействий, направленных на улучшение функционирования кишечной микробиоты, приоритет на сегодняшний день отдается пробиотикам.
Информация о клиническом эффекте пробиотиков в профилактике антибиотик-ассоциированной диареи широко освещена в литературе [50–53]. По результатам этих метаанализов, отмечается выраженная польза от назначения пробиотиков, причем более существенная от комбинации пробиотических штаммов бактерий [54].
В настоящее время мультиштаммовые (мультивидовые) пробиотики представляются одними из наиболее удачных – по соотношению эффективности, хорошей переносимости и невысокой номинальной цены – препаратов из группы пробиотиков. В качестве практической иллюстрации к сказанному можно привести большой позитивный опыт Европы по активному использованию VSL#3 при воспалительных заболеваниях кишечника, а также инновационного ряда пробиотических комплексов, именуемых Ecologic®, имеющих полноценное научное досье, обосновывающее дифференцированное управление микробными клетками индигенной микрофлоры. На сегодняшний день пробиотиков Ecologic – 6, это одновременно мультивидовые и мультиштаммовые препараты, которые способны выполнить конкретные функции кишечной микрофлоры в разных клинических ситуациях. Из важных характеристик этих пробиотиков следует отметить целенаправленную селекцию штаммов и наличие специального матрикса, который имитирует биопленку кишечника, благодаря чему обеспечивается сохранение числа жизнеспособных микроорганизмов при прохождении желудочно-кишечного тракта, а, следовательно, пробиотического потенциала. Немаловажным преимуществом этих пробиотиков является физиологическое состояние микроорганизмов без деструкции клеточной стенки бактерий, наблюдающейся в процессе лиофилизации, и потери большей части экзогенных метаболитов в ходе приготовления этих препаратов. В Российской Федерации представлены пробиотические комплексы РиоФлора Баланс Нео и РиоФлора Иммуно Нео, разработанные для взрослых и детей старше 3 лет.
На сегодняшний день пробиотиков Ecologic – 6, это одновременно мультивидовые и мультиштаммовые препараты, которые способны выполнить конкретные функции кишечной микрофлоры в разных клинических ситуациях. Из важных характеристик этих пробиотиков следует отметить целенаправленную селекцию штаммов и наличие специального матрикса, который имитирует биопленку кишечника, благодаря чему обеспечивается сохранение числа жизнеспособных микроорганизмов при прохождении желудочно-кишечного тракта, а, следовательно, пробиотического потенциала. Немаловажным преимуществом этих пробиотиков является физиологическое состояние микроорганизмов без деструкции клеточной стенки бактерий, наблюдающейся в процессе лиофилизации, и потери большей части экзогенных метаболитов в ходе приготовления этих препаратов. В Российской Федерации представлены пробиотические комплексы РиоФлора Баланс Нео и РиоФлора Иммуно Нео, разработанные для взрослых и детей старше 3 лет.
РиоФлора Баланс Нео – пробиотик, имеющий фиксированную комбинацию из 8 жизнеспособных бактерий следующих производственных штаммов: Bifidobacterium bifidum W23, B. lactis W51, L.acidophilus W37, L.acidophilus W55, L.paracasei W20, L.plantarum W62, L.rhamnosus W71, L.salivarius W24. Каждая кишечнорастворимая капсула содержит не менее 5×108 КОЕ/капс живых лиофилизированных микроорганизмов, которые характеризуются строгим регламентированием терапевтических эффектов. Основным аргументом в пользу этого являются факты, свидетельствующие о том, что пробиотик снижает риск развития гастроинтестинальных расстройств, вызванных антибиотикотерапией, инициирует восстановление кишечного микробиоценоза и других физиологических процессов после трофического повреждения слизистой оболочки толстой кишки, улучшает полостное пищеварение и тем самым влияет на параметры физического развития [55]. Доказательные исследования показывают не только профилактическое преимущество препарата, а также его возможности пролонгироваться на ранний и поздний периоды постдиарейной реабилитации. В работе C.J.M.Koning и соавт. проводилось изучение кишечного микробиоценоза 40 больных, получавших амоксициллин по поводу инфекции респираторного тракта с пробиотиком Ecologic или плацебо.
lactis W51, L.acidophilus W37, L.acidophilus W55, L.paracasei W20, L.plantarum W62, L.rhamnosus W71, L.salivarius W24. Каждая кишечнорастворимая капсула содержит не менее 5×108 КОЕ/капс живых лиофилизированных микроорганизмов, которые характеризуются строгим регламентированием терапевтических эффектов. Основным аргументом в пользу этого являются факты, свидетельствующие о том, что пробиотик снижает риск развития гастроинтестинальных расстройств, вызванных антибиотикотерапией, инициирует восстановление кишечного микробиоценоза и других физиологических процессов после трофического повреждения слизистой оболочки толстой кишки, улучшает полостное пищеварение и тем самым влияет на параметры физического развития [55]. Доказательные исследования показывают не только профилактическое преимущество препарата, а также его возможности пролонгироваться на ранний и поздний периоды постдиарейной реабилитации. В работе C.J.M.Koning и соавт. проводилось изучение кишечного микробиоценоза 40 больных, получавших амоксициллин по поводу инфекции респираторного тракта с пробиотиком Ecologic или плацебо. Результаты исследования позволили доказать, что многовидовые пробиотики могут применяться для профилактики антибиотик-ассоциированной диареи, поскольку они позитивно влияют на состав и метаболическую активность фекальной микрофлоры [56].
Результаты исследования позволили доказать, что многовидовые пробиотики могут применяться для профилактики антибиотик-ассоциированной диареи, поскольку они позитивно влияют на состав и метаболическую активность фекальной микрофлоры [56].
Литература
1. Marlies E.J., Hulsher L., Richard P. et al., Antibiotic prescribing in hospitals: a social and behavioural scientific approach. The Lancet Infectious Diseases 2010; 1 (4): 237–247.
2. McGlynn E.A., Asch S.M., Adams J. et al. The guality of health care delivered to adults in the United States. N Engl J Med. 2003; 348: 2635–45.
3. Grol R. Successes and failures in the implementation of evidence based guidelines for clinical practice. Med Care. 2001; 39 (2): 46–54.
4. Behar P., Wagner M.B., Freitas I. et al. Assessing the antimicrobial prescription reguest process in teaching hospital in Brazil: regulation and training. Braz J Infect Dis. 2000; 4: 76–85.
5. Goossens H., Ferech M., Vander Stichele R. , Elseviers M. ESAC Project Group. Outpatient antibiotic use in Europe and association with resistance: a cross-national database study. Lancet. 2005; 365: 579–87.
, Elseviers M. ESAC Project Group. Outpatient antibiotic use in Europe and association with resistance: a cross-national database study. Lancet. 2005; 365: 579–87.
6. Vander Stichele R.H.., Elseviers M.M., Ferech M. et al. Hospital consumption of antibiotics in 15 European countries: results of the ESAC Retrospective Data Collection (1997–2002). Antimicrob Chemother. 2006; 58: 159–67.
7. Tacconelli E. Antimicrobial use: risk driver of multidrug resistant microorganisms in healthcare settings. Curr Opin Infect Dis. 2009; 22: 352–58.
8. Lopez–Lozano J.M., Monnet D.L., Yague A. et al. Modelling and forecasting antimicrobial resistance and its dynamic relationship to antimicrobial use: a time series analysis. Int J Antimicrob Agents. 2000; 14: 21–31.
9. Turck D., Bernet J.P., Marx J. et al. Incidence and risk factors of oral antibiotic-associated diarrhea in an outpatient pediatric population. J Pediatr Gastroenterol Nutr. 2003; 37: 22–6.
10. Elstner C.L., Lindsay A.N., Book L. S., Matsen J.M. Lack of relationship of Clostridium difficile to antibiotic-associated diarrhea in children. Pediatr Inf Dis. 1983; 2: 364–6.
S., Matsen J.M. Lack of relationship of Clostridium difficile to antibiotic-associated diarrhea in children. Pediatr Inf Dis. 1983; 2: 364–6.
11. Surawicz C.M. Probiotics, antibiotic-associated diarrhea and Clostridium difficile diarrhea in humans. Best Pract Res Clin Gastroenterol. 2003; 17: 775–83.
12. Diplock A.T., Aggett P.J., Ashwell M. et al. Scientific concepts of functional foods in Europe: consensus document. Br J Nutr. 1999; 81 (1): 1–27.
13. D’Souza A.L., Rajkumar C., Cooke J. et al. Probiotics in prevention of antibiotic-associated diarrhea: meta-analysis BMJ. 2002; 324 (7350): 1361.
14. Cremonini F., Di Caro S., Nista E.C. et al. Meta-analysis: the effect of probiotic administration on antibiotic-associated diarrhoea. Aliment Pharmacol Ther. 2002; 16 (8): 1461–67.
15. Szajewska H., Mrukowicz J. Meta-analysis: non-pathogenic yeast Saccharomyces boulardii in the prevention of antibiotic associated diarrhea. Aliment Pharmacol Ther. 2005; 22: 365–72.
16. Hawrelak J.A., Whitten D.L., Myers S.P. Is Lactobacillus rhamnosus GG effective in preventing the onset of antibiotic associated diarrhoea: a systematic review. Digestion. 2005; 72: 51–6.
Hawrelak J.A., Whitten D.L., Myers S.P. Is Lactobacillus rhamnosus GG effective in preventing the onset of antibiotic associated diarrhoea: a systematic review. Digestion. 2005; 72: 51–6.
17. Hogenauer C., Hammer H., Krejs G. Mechanisms and management of antibiotic associated diarrhea. Clin Inf Dis. 1998; 27: 702–10.
18. Chassany O., Michaux A., Bergmann J.F. Drug-induced diarrhea. Drug Saf. 2000; 22: 53–72.
19. Vollard E.J., Clasener H. et al. Influence of amoxycillin erythromycin and roxitromycin on colonization resistance and appearance of secondary colonization in healthy volunteers. J Antimicrob Chemotherapy. 1987; 13: 131–38.
20. Beyer G., Heimer–Bau M. et al. Impact of Moxifloxacin versus Claritromycin on normal oropharyngeal microflora. Eur J Clin Microbiol Inf Dis. 2000; 7: 548–50.
21. Mundy L.M., Sahm D.F., Gilmore M. Relationships between Enterococcal virulence and antimicrobial resistance. Clin. Microbiol. Rev. 2000; 4: 513–22.
22. Hviid A., Svanstrom H. , Frisch M. Использование антибиотиков и воспалительные заболевания кишечника у детей. Gut. 2011; 60: 49–54.
, Frisch M. Использование антибиотиков и воспалительные заболевания кишечника у детей. Gut. 2011; 60: 49–54.
23. Dethlefsen L., Eckburg P.B., Bik E.M., Relman D.A. Assembly of the human intestinal microbiota. Trends Ecol Evol. 2006; 21: 517–23.
24. Penders J., Stobberingh E.E., van den Brandt P.A., Thijs C. The role of the intestinal microbiota in the development of atopic disorders. Allergy 2007; 62: 1223–36.
25. Barlett J.G. Antibiotic associated diarrhea. Clin Infect Dis. 1992; 15: 573–81.
26. Bouhnik Y., Rambaut J.C., Buts J.P. et al. Microflora and diarrhea: antibiotic associated diarrhea. Gut Microflora. 2006; 181–197.
27. Barbut F., Meynard J.L., Guiguet M. et al. Clostridium difficile-associated diarrhea in HIV infected patients: epidemiology and risk factors. J Acguir Immune Defic Syndr. 1997; 16: 176–81.
28. McFarland L.V., Surawicz C.M., Stamm W.E. Risk factors for Clostridium difficile carriage and Clostridium difficile-associated diarrhea in cohort of hospitalized patients. J Infect Dis. 1990; 162: 678–84.
J Infect Dis. 1990; 162: 678–84.
29. Gilbert D.N. Aspects of the safety profile of oral antimicrobial agents. Infect Dis Clin Pract. 1995; 4 (2): 103–12.
30. McFarland L.V. Facteurs de risque de la diarrhea associee aux antibiotiques. Une revue de la litterature. Ann Med Interne, 1998; 149: 261–6.
31. Wilcox M.H., Mooney L., Bendall R. et al. A case-control study of community-acquired Clostridium difficile infection. J Antimicrob Chemother. 2008; 62: 388–96.
32. Nerandzic M.M., Pultz M.J., Donskey C.J. Examination of potential mechanisms to explain the association between proton pump inhibitors and Clostridium difficile infection. Antimicrob Agents Chemother. 2009; 53: 4133–37.
33. Sakurai Y., Tsuchiya H., Ikegami F. et al. Acute right-sided hemorrhagic colitis associated with oral administration of ampicillin. Dig Dis Sci. 1979; 24: 910–5.
34. Benoit R., Danquechin Dorval E., Loulergue J. et al. Diarrhee post-antibiotique: role de Klebsiella oxytoca. Gastroenterol Clin Biol. 1992; 16: 840–4.
1992; 16: 840–4.
35. Minami J., Katayama S., Matsushita O. et al. Enteroxic activity of Klebsiella oxytoca cytotoxin in rabbit intestinal loops. Infect Immun. 1994; 62: 172–7.
36. Larson H.E., Barclay F.E., Honour P. et al. Epidemiology of Clostridium difficile in infants. J Infect Dis. 1982; 146: 727–33.
37. Rambaud J.C., LaMont J.T., Buts J.P. The clinical significance of Clostridium difficile infections in infants and children. Gasroenterol Clin Biol. 1996; 29–36.
38. Taori S.K., Hall V., Poxton I. The influence of antibiotics on the changing epidemiology of Clostridium difficile. J Med Microbiol. 2009; published online Nov 26,DOI:10.1099/jmm.0.14829–0.
39. Woodford N., Livermore D.M. Infection caused by Gram-positive bacteria: a review of the global challenge. J Infect. 2009; 59 (1): 4–16.
40. Monaghan T., Boswell T., Mahida Y.R. Recent advances in Clostridium difficile-associated disease. Gut. 2008; 57: 850–60.
41. Rupnik M., Wilcox M.H., Gerding D.N. Clostridium difficile infection: new developments in epidemiology and pathogenesis. Nat Rev Microbiol. 2009; 7: 526–36.
Nat Rev Microbiol. 2009; 7: 526–36.
42. Lamont J.T. Recent advances in the structures and function of Clostridium difficile toxins. Springer-Verlag, 1996; 73–82.
43. Kelly C.P., LaMont J.T. Clostridium difficile: more difficult than even. N Engl J Med. 2008; 359: 1932–40.
44. Marteau P., Rambaud JC. Colites pseudomembraneuses et autres manifestations de l’infection a Clostridium difficile. Paris, Flammarion 2000; 687–93.
45. Bulusu M., Narayan S., Shetler K., Triadafilopoulos G. Leukocytosis as a harbinger and surrogate marker of Clostridium difficile infection in hospitalized patients with diarrhea. Am J Gastroenterol. 2000; 95: 3137–41.
46. Price A.B. Pseudomembranous colitis. London. 2005; 15–172.
47. Kelly C.P., Pothoulakis C., LaMont J.T. Clostridium difficile colitis. N Engl J Med. 1994; 330: 257–62.
48. Gerding D.N. Disease associated with Clostridium difficile infection. Ann Intern Med. 1989; 110: 255–7.
49. Fekety R., Shah A.B. Diagnosis and treatment of Clostridium difficile colitis. JAMA. 1993; 269: 71–5.
JAMA. 1993; 269: 71–5.
50. Johnston B.C., Supina A.L., Vohra S. Probiotics for pediatric antibiotic-associated diarrhea: a meta-analysis of randomized placebo-controlled trials CMAJ. 2006; 175 (4): 377–83.
51. Johnston B.C., Supina A.L., Ospina M. et al. Probiotics for the prevention of pediatric antibiotic-associated diarrhea Cochrane Database Syst Rev. 2007; 2: CD004827.
52. D’Souza A.L., Rajkumar C., Cooke J. et al. Probiotics in prevention of antibiotic-associated diarrhea: meta-analysis BMJ. 2002; 324 (7350): 1361.
53. Szajewska H., Ruszczynski M., Radzikowski A. Probiotics in the prevention antibiotic-associated diarrhea in children: a meta-analysis of randomized controlled trials J Pediatr. 2006; 149 (3): 367–72.
54. Zoppi G., Cinquetti M., Benini A., Bonamini E., Minelli E. Modulation of the intestinal ecosystem by probiotics and lactulose in children during treatment with ceftriaxone. Curr Therap Res. 2001; 62: 418–35.
55. Timmerman H.M., Koning C.J.M., Mulder L. , Rombouts F.M., Beynen A.C. Monostrain, multistrain and multispecies probiotics. A comparison of functionality and efficacy. Int J Food Microbiol. 2004; 96: 219–33.
, Rombouts F.M., Beynen A.C. Monostrain, multistrain and multispecies probiotics. A comparison of functionality and efficacy. Int J Food Microbiol. 2004; 96: 219–33.
56. Koning C.J.M., Jonkers Daisy M.A.E., Stobberingh E.E. et al. The effect of a multispecies probiotic on the intestinal microbiota and bowel movements in healthy volunteers taking the antibiotic amoxycillin. Am J Gastroenterol. 2007; 102: 1–12.
Раздельное определение токсина А и токсина В Clostridium difficile в кале, антигенный тест (Toxin A and B Clostridium difficile. One step rapid immunосhromotographic assay)
Интерпретация результатов
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом.
Информацию из этого раздела нельзя использовать для самодиагностики и самолечения.
Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза,
результатов других обследований и т. д.
д.
Единицы измерения в ИНВИТРО:
Нет. Тест качественный.
Референсные значения:
Токсин А: не обнаружено
Токсин В: не обнаружено
Интерпретация:
При отсутствии токсина А и/или В выдается результат «не обнаружено». В случае обнаружения токсина А и/или В выдается результат «обнаружено».
Положительный результат: свидетельствует об инфицированности или носительстве. Положительные результаты теста не исключают наличия других патогенов
Отрицательный результат: не исключают наличия инфекции C. difficile и может быть вызван протеолизом токсинов в пробе при неправильном хранении. В этом случае обоснованного подозрения на инфекцию следует провести дополнительное исследование новой пробы. Отрицательные результаты также могут быть обусловлены прерывистым выделение токсинов или тем, что концентрация их слишком низкая и находится за пределами детекции (чувствительность теста 87,7%, специфичность — 91,7%).
Как и в случае других диагностических тестов, полученные результаты должны подтверждаться с помощью других клинических и лабораторных данных
Литература
- Шелыгин Ю. А. и соавт. Клинические рекомендации Национальной ассоциации специалистов по контролю инфекций, связанных с оказанием медицинской помощи и общероссийской общественной некоммерческой организации «ассоциации колопроктологов России» по диагностике, лечению и профилактике Clostridium difficile-ассоциированной диареи (CDI). 2017. http://www.gnck.ru/rec/recommendation_clostridium_difficile.pdf, https://melitta-uv.ru/media/publications/
- Козлов Р.С. и соавт. Обзор обновленных практических рекомендаций Американского общества по инфекционным болезням (IDSA) и Американского общества эпидемиологии здравоохранения (SHEA) по инфекциям, вызванным Clostridiumdifficile, у детей и взрослых. КМАХ .2018, Том 20. №2, стр. 76-124. http://www.antibiotic.ru/cmac/pdf/cmac.
 2018.t20.n2.p076.pdf
2018.t20.n2.p076.pdf - Сухина М.А., Сафин А.Л. Современное состояние лабораторной диагностики Clostridium difficileассоциированных диарей; методы детекции токсигенных штаммов Clostridium difficile (Обзор литературы). Клиническая лабораторная диагностика. 2017; 62(10): 635-640. DOI: http://dx.doi.org/10.18821/0869-2084-2017-62-10-635-640 https://cyberleninka.ru/article/n/sovremennoe-sostoyanie-laboratornoy-diagnostiki-clostridium-difficile-assotsiirovannyh-diarey-metody-detektsii-toksigennyh-shtammov
- А.В. Шиповской, С.Б. Фадеев. Опыт применения иммуноферментного анализа для диагностики антибиотикоассоциированных диарей. Бюллетень Оренбургского научного центра УрО РАН (электронный журнал), 2013, №1, стр. 1-8. https://cyberleninka.ru/article/n/opyt-primeneniya-immunofermentnogo-analiza-dlya-diagnostiki-antibiotikoassotsiirovannyh-diarey
- Н.В. Дмитриева, И.А. Ключникова, И.И. Шильникова. Clostridium difficile-ассоциированная диарея (обзор литературы).
 Сибирский онкологический журнал, 2014. № 1 (61), стр. 46-53. https://cyberleninka.ru/article/v/clostridium-difficileassotsiirovannaya-diareya
Сибирский онкологический журнал, 2014. № 1 (61), стр. 46-53. https://cyberleninka.ru/article/v/clostridium-difficileassotsiirovannaya-diareya - А.В. Щербакова, С.К. Аджигайтканова, Н.Г. Потешкина. Clostridium difficile-ассоциированный колит: обзор рекомендаций. Лечебное дело, №3, 2014, стр. 20-24. https://cyberleninka.ru/article/v/clostridium-difficile-assotsiirovannyy-kolit-obzor-rekomendatsiy
- Игорь Карпов и соавт. Clostridium difficile-ассоциированная инфекция. Медвестник, 2016. .http://www.medvestnik.by/ru/sovremennii_podxod/view/clostridium-difficile-assotsiirovannaja-infektsija-15999-2016/
- Заплатников А.Л., Захарова И.Н., Коровина Н.А. Clostridium difficile-инфекция у детей. «РМЖ» №5 от 06.03.2004 стр.373. https://www.rmj.ru/articles/pediatriya/Clostridium_difficile-infekciya_u_detey/
- LabTests Online. AACC. Clostridium difficile and C. diff Toxin Testing. https://labtestsonline.
 org/
org/
В клинические рекомендации по лечению COVID в ПМР внесут изменения — Министерство здравоохранения ПМР
Состоялось очередное заседание Оперативного медицинского штаба по лечению коронавирусной инфекции под руководством Кристины Албул. Специалисты обсудили предполагаемые изменения в клинические рекомендации. Среди них — критерии назначения антибактериальной терапии. Как сообщалось ранее, одними из осложнений, с которыми сталкиваются пациенты являются антибиотик-ассоциированная диарея и колиты. Речь идет о нарушении кишечного микробиома, которое вызывает воспаление и повреждение слизистой оболочки толстой кишки. Чаще всего это происходит после применения антибиотиков широкого спектра. В связи с этим Слободзейский коронавирусный госпиталь на внутрибольничном уровне отказался от использования антибиотиков при легкой и средней стадиях заболевания. Главврач озвучила статистику за две недели:
«Акцент был сделан на то, что пациенты поступали с вирусной пневмонией, а антибактериальная терапия на вирус не действует. Мы опирались на наработки коллег из других стран для лечения пациентов с COVID. В выборку попали пациенты от 47 лет до 86 лет, у некоторых имелись хронические заболевания. При поступлении имели поражения легких, но на фоне лечения без антибиотиков показатели стабилизировались. выписывались эти люди без поражения кишечника». — подчеркнула Алена Лапина.
Мы опирались на наработки коллег из других стран для лечения пациентов с COVID. В выборку попали пациенты от 47 лет до 86 лет, у некоторых имелись хронические заболевания. При поступлении имели поражения легких, но на фоне лечения без антибиотиков показатели стабилизировались. выписывались эти люди без поражения кишечника». — подчеркнула Алена Лапина.
Клиницисты обсудили некоторые аспекты действующих клинических рекомендаций и пришли к тому, что этот документ нужно актуализировать. Прежде всего, описать показания к антибиотикам, усилить работу амбулаторного звена в части обоснованного назначения антибактериальной терапии, а также ввести в практику COVID-стационаров обязательное исследование прокальцитонина (ПКТ) в крови. Этот биомаркер помогает оценить риск возникновения бактериальной инфекции и дальнейшего прогрессирования заболевания.
«Сейчас есть возможность изменить подход к антибиотикам. Заболеваемость, а значит и нагрузка на врачей, снизилась, можно усилить наблюдение за пацентами и быстро реагировать на изменения их состояния», — считает глава ведомства Кристина Албул.
В заключение встречи принято решение изучить протоколы лечения других стран для того, чтобы внести изменения в клинические рекомендации в Приднестровье. Работа будет вестись по блокам — врачи терапевтического звена, поликлинической службы, специалисты по психиатрии, детству и гинекологии изучат применяемые методы по своему профилю и представят предложения. Их обсуждение состоится на следующей неделе.
Инновационный экспресс-анализ на антибиотико-ассоциированную диарею
Если на фоне приёма антибактериальных препаратов у Вас появились такие симптомы, как диарея (возможно с примесью слизи и крови), схваткообразные боли в животе, интоксикация и пр., возможно Вы не избежали инфекции, обусловленной токсигенными штаммами клостридии диффициле. Это заболевание относится к группе антибиотико-ассоциированных поражений кишечника. Чтобы не допустить развития тяжелого поражения кишечника, рекомендуется сделать инновационный экспресс-анализ на обнаружение токсинов А и В Clostridium difficile.
Антибиотико-ассоциированные (АС) поражения кишечника – это группа заболеваний, связанных с негативным влиянием антибиотиков (АБ) на слизистую кишечника и кишечную микрофлору.
В этой группе поражений кишечника в зависимости от тяжести клинико- морфологических поражений и механизмов повреждения слизистой оболочки кишечника выделяют следующие заболевания: антибиотико-ассоциированную диарею (ААД), псевдомембранозный колит(ПМК) и др.
ААД встречаются в среднем у 5% лиц, получавших АБ. Особенно часто заболевания связаны с применением пенициллинов широкого спектра действия (ампициллина, амоксициллина), клиндамицина, цефалоспоринов. Другие АБ (макролиды, тетрациклины, фторхинолоны) приводят к расстройствам кишечника значительно реже. Возможно носительство C.difficile как у детей, так и у взрослых. Носительство особенно часто наблюдается (до 13-30%) среди госпитализированных пациентов, а также среди медицинских работников. Очень широкая контаминация C. difficile наблюдается среди новорожденных детей (до 50 – 90%). Но заболевание вызывают только токсигенные штаммы C.difficile , т.е. вырабатывающие токсины А (энтеротоксин) и В (цитотоксин).
difficile наблюдается среди новорожденных детей (до 50 – 90%). Но заболевание вызывают только токсигенные штаммы C.difficile , т.е. вырабатывающие токсины А (энтеротоксин) и В (цитотоксин).
Согласно общепринятому определению ААД – это 3 и более эпизодов неоформленного стула в течение 2-ух или более последовательных дней, развившихся на фоне или после приёма АБ. Однако, поражения кишечника часто не ограничиваются только диареей. Могут развиться нарушения целостности слизистой толстой кишки, воспаления, изъязвления, которые определяются как АС- колиты, в том числе и некротические энтероколиты.
Антибиотики в данной ситуации играют роль пускового механизма, подавляя нормофлору толстой кишки и создавая условия для роста и размножения токсигенных штаммов Clostridium difficile.
Метод исследования
Иммунохроматографический метод на выявление токсинов А и В Clostridium difficile — современный иммунологический экспресс-метод, обладающий высокой чувствительностью и специфичностью.
Направление на исследование, инструкцию по забору кала и контейнер можно получить в отделе забора биосубстратов на 1-ом этаже с 8.00 до 13.00 часов или в бактериологической лаборатории на 8-ом этаже с 13.00 до 15.00 часов.
Результат анализа выдается пациенту в день исследования.
Название метода в прейскуранте «КДЦ»:
A 09.19.011. Исследование кала на наличие токсинов клостридии диффициле (Clostridium difficile)
Диарея, связанная с антибиотиками — Диагностика и лечение
Диагностика
Для диагностики диареи, связанной с приемом антибиотиков, ваш врач может спросить вас об истории вашего здоровья, в том числе о том, проходили ли вы недавнее лечение антибиотиками. Если ваш врач подозревает, что у вас инфекция C. difficile, образец вашего стула может быть проверен на наличие бактерий.
Лечение
Лечение диареи, связанной с приемом антибиотиков, зависит от тяжести ваших признаков и симптомов.
Лечение легкой диареи, связанной с антибиотиками
Если у вас легкая диарея, ваши симптомы, вероятно, исчезнут в течение нескольких дней после окончания лечения антибиотиками. В некоторых случаях ваш врач может посоветовать вам прекратить терапию антибиотиками до тех пор, пока диарея не пройдет.
Лечение для борьбы с вредными бактериями при инфекции C. difficile
Если у вас разовьется инфекция C. difficile, ваш врач, скорее всего, прекратит прием любого антибиотика, который вы в настоящее время принимаете, и может назначить антибиотики, специально предназначенные для уничтожения бактерий, вызывающих вашу диарею, связанную с антибиотиками. .Вас также попросят прекратить прием препаратов, снижающих кислотность желудка. У людей с этим типом инфекции симптомы диареи могут вернуться и потребовать повторного лечения.
Образ жизни и домашние средства
Чтобы справиться с диареей:
Пейте достаточно жидкости.
 Чтобы предотвратить небольшую потерю жидкости при диарее, пейте больше воды. При более тяжелой потере пейте жидкости, содержащие воду, сахар и соль.Попробуйте бульон или фруктовый сок с низким содержанием сахара. Избегайте напитков с высоким содержанием сахара, алкоголя или кофеина, таких как кофе, чай и кола, которые могут ухудшить ваши симптомы.
Чтобы предотвратить небольшую потерю жидкости при диарее, пейте больше воды. При более тяжелой потере пейте жидкости, содержащие воду, сахар и соль.Попробуйте бульон или фруктовый сок с низким содержанием сахара. Избегайте напитков с высоким содержанием сахара, алкоголя или кофеина, таких как кофе, чай и кола, которые могут ухудшить ваши симптомы.Для младенцев и детей с диареей спросите своего врача об использовании раствора для пероральной регидратации, такого как Pedialyte, для восполнения жидкости и электролитов.
- Избегайте определенных продуктов. Во время диареи рекомендуется избегать жирной и острой пищи. Обычно вы можете вернуться к нормальной диете вскоре после исчезновения симптомов.
- Спросите о лекарствах от диареи. В некоторых случаях легкой диареи, связанной с приемом антибиотиков, ваш врач может порекомендовать противодиарейные препараты, такие как лоперамид (Имодиум A-D). Но посоветуйтесь со своим врачом, прежде чем принимать противодиарейные лекарства, потому что они могут повлиять на способность вашего организма выводить токсины и привести к серьезным осложнениям.

Люди могут обратиться к пробиотикам, содержащимся в таких продуктах, как йогурт, в надежде, что они смогут восстановить баланс полезных бактерий в пищеварительном тракте.Но нет единого мнения о том, могут ли безрецептурные пробиотики помочь уменьшить симптомы диареи, связанной с антибиотиками. Однако прием пробиотиков не вреден, если только у вас не ослаблена иммунная система.
Подготовка к приему
Запишитесь на прием к врачу, который прописал антибиотик. Вот некоторая информация, которая поможет вам подготовиться к встрече.
Что вы можете сделать
Составьте список:
- Ваши симптомы, включая любые, которые могут показаться не связанными с причиной, по которой вы записались на прием.
- Ключевая личная информация, , включая любые серьезные стрессы или недавние изменения в жизни, в том числе если вы недавно находились в больнице или доме престарелых.

- Лекарства, витамины или добавки , которые вы принимаете, включая дозы. Если вы недавно принимали антибиотик, укажите его название, дозировку и дату прекращения приема.
- Вопросы, которые следует задать своему врачу.
В случае диареи, связанной с приемом антибиотиков, некоторые основные вопросы, которые следует задать своему врачу, включают:
- Какие тесты мне нужны?
- Мое состояние вероятно временное или хроническое?
- Как лучше всего действовать?
- Какие альтернативы основному подходу вы предлагаете?
- Есть ли ограничения, которым я должен следовать?
- Есть ли продукты и напитки, которых мне следует избегать?
Не стесняйтесь задавать другие вопросы.
Чего ожидать от врача
Ваш врач, скорее всего, задаст вам ряд вопросов. Если вы будете готовы ответить на них, у вас будет больше времени для обсуждения других вопросов, которые вы хотите затронуть. Ваш врач может спросить:
Ваш врач может спросить:
- Когда у вас появились симптомы?
- Можете ли вы описать свой стул? Как часто они бывают?
- Были ли у вас в анамнезе проблемы с кишечником, такие как язвенный колит, болезнь Крона или другие воспалительные заболевания кишечника?
- Были ли вы в последнее время рядом с кем-нибудь, кто болел диареей?
Что вы можете сделать тем временем
Продолжайте принимать антибиотики в соответствии с указаниями врача.
Чтобы справиться с диареей до приема на прием, вы можете:
- Пейте больше воды и других жидкостей, чтобы восполнить потерю жидкости из-за диареи
- Ешьте мягкую пищу и избегайте острой или жирной пищи, которая может усугубить диарею
15 мая 2019
Показать ссылки- Диарейные болезни: острые и хронические. Американский колледж гастроэнтерологии. http://patients.gi.org/topics/diarrhea-acute-and-chronic/.
 По состоянию на 27 марта 2016 г.
По состоянию на 27 марта 2016 г. - Varughese CA, et al. Диарея, связанная с антибиотиками: напоминание о причинах и возможной профилактике пробиотиками — статья для повышения квалификации. Журнал аптечной практики. 2013; 26: 476.
- Диарея. Национальный институт диабета, болезней органов пищеварения и почек. http://digestive.niddk.nih.gov/ddiseases/pubs/diarrhea/#treated. По состоянию на 27 марта 2016 г.
- Lamont JT. Инфекция Clostridium difficile у взрослых: клинические проявления и диагностика.http://www.uptodate.com/home. По состоянию на 27 марта 2016 г.
- AskMayoExpert. C. difficile. Рочестер, Миннесота: Фонд Мейо медицинского образования и исследований; 2018.
- Флейшер GR. Оценка диареи у детей. http://www.uptodate.com/home. По состоянию на 27 марта 2016 г.
- Surawicz CM, et al. Рекомендации по диагностике, лечению и профилактике инфекций Clostridium difficile. Американский журнал гастроэнтерологии. 2013; 108: 478.

- Управление диареей.Международный фонд функциональных желудочно-кишечных заболеваний. http://www.iffgd.org/site/gi-disorders/functional-gi-disorders/diarrhea/management. По состоянию на 27 марта 2016 г.
- McDonald LC и др. Руководство по клинической практике при инфекции Clostridium difficile у взрослых и детей: обновление 2017 года Американского общества инфекционных болезней (IDSA) и Общества эпидемиологии здравоохранения Америки (SHEA). Клинические инфекционные болезни. 2018; 66: e1.
- Walls RM, et al., ред. Диарея. В: Неотложная медицина Розена: концепции и клиническая практика. 9 изд. Филадельфия, Пенсильвания: Эльзевир; 2018. https://www.clinicalkey.com. По состоянию на 14 марта 2019 г.
Диарея, связанная с антибиотиками
Практическое руководство по пробиотикам в случае диареи, связанной с антибиотиками, в Нидерландах | BMC Gastroenterology
org/ScholarlyArticle»> 1.Кини К.М., Юрист-Даутш С, Арриета М-С, Финли ББ. Влияние антибиотиков на микробиоту человека и последующее заболевание. Анну. Rev. Microbiol. 2014; 68: 217–35.
Артикул PubMed CAS Google ученый
Francino MP. Антибиотики и микробиом кишечника человека: дисбиоз и накопление резистентности. Передний. Microbiol. 2016; 6: 1–11.
Артикул Google ученый
Саркер П., Мили А., Мамун А., Джалал С., Бергман П., Ракиб Р. и др. Ципрофлоксацин воздействует на клетки-хозяева, подавляя экспрессию эндогенных антимикробных пептидов кателицидинов и бета-дефенсина-3 в эпителии толстой кишки. Антибиотики. 2014; 3: 353–74.
Артикул PubMed PubMed Central CAS Google ученый
Кросвелл А., Амир Э., Теггац П., Барман М., Зальцман Н.Х. Длительное воздействие антибиотиков на микробную экологию кишечника и восприимчивость к кишечной инфекции Salmonella .Заразить. Иммун. 2009; 77: 2741–53.
Артикул PubMed PubMed Central CAS Google ученый
Jernberg C, Löfmark S, Edlund C, Jansson JK. Долгосрочное экологическое влияние приема антибиотиков на микробиоту кишечника человека. ISME J. 2007; 1: 56–66.
Артикул PubMed CAS Google ученый
Терк Д., Бернет Дж. П., Маркс Дж., Кемпф Х., Гиард П., Вальбаум О. и др.Заболеваемость и факторы риска диареи, связанной с пероральными антибиотиками, в амбулаторных педиатрических группах. J. Pediatr. Гастроэнтерол. Nutr. 2003; 37: 22–6.
J. Pediatr. Гастроэнтерол. Nutr. 2003; 37: 22–6.
Артикул PubMed CAS Google ученый
Wiström J, Norrby SR, Myhre EB, Eriksson S, Granström G, Lagergren L, et al. Частота диареи, связанной с антибиотиками, у 2462 госпитализированных пациентов, получавших антибиотики: проспективное исследование. J. Antimicrob. Chemother.2001; 47: 43–50.
Артикул PubMed Google ученый
Крамер М.С., Хатчинсон Т.А., Наймарк Л., Контарди Р., Флегель К.М., Ледук Д.Г. Связанные с приемом антибиотиков желудочно-кишечные симптомы у педиатрических больных общего профиля. Педиатрия. 1985; 76: 365–70.
PubMed CAS Google ученый
Kuyvenhoven MM, van Balen FAM, Verheij TJM. Амбулаторные рецепты антибиотиков с 1992 по 2001 год в Нидерландах.J. Antimicrob. Chemother. 2003. 52: 675–8.
Артикул PubMed CAS Google ученый
GIP / ZorgInstituut Nederland [Интернет]. 2016 г. Доступно по адресу: https://www.gipdatabank.nl/databank. По состоянию на февраль 2017 г.
Совместная консультация экспертов ФАО / ВОЗ. Полезные и питательные свойства пробиотиков в пищевых продуктах, включая сухое молоко с живыми молочнокислыми бактериями. 2001.
Hill C, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B и др.Документ о консенсусе экспертов: Консенсусное заявление международной научной ассоциации пробиотиков и пребиотиков о сфере применения и надлежащем использовании термина пробиотик. Nat. Преподобный Гастроэнтерол. Гепатол. 2014; 11: 506–14.
Nat. Преподобный Гастроэнтерол. Гепатол. 2014; 11: 506–14.
Артикул PubMed Google ученый
Ричи М.Л. Романюк Т.Н. Мета-анализ эффективности пробиотиков при желудочно-кишечных заболеваниях. PLoS One. 2012; 7: e34938
Lee YK, Puong KY, Ouwehand AC, Salminen S.Вытеснение бактериальных патогенов из слизи и поверхности клеток Caco-2 лактобациллами. J. Med. Microbiol. 2003. 52: 925–30.
Артикул PubMed Google ученый
Фон Оссовски И., Реунанен Дж., Сатокари Р., Вестерлунд С., Канкайнен М., Хухтинен Х. и др. Адгезионные свойства слизистой оболочки пробиотических субъединиц пилина Lactobacillus rhamnosus GG SpaCBA и SpaFED..gif) Appl. Environ. Microbiol. 2010. 76: 2049–57.
Appl. Environ. Microbiol. 2010. 76: 2049–57.
Артикул PubMed PubMed Central CAS Google ученый
Collado MC, González A, González R, Hernández M, Ferrús MA, Sanz Y. Антимикробные пептиды входят в число антагонистических метаболитов, продуцируемых Bifidobacterium против Helicobacter pylori . Int. J. Antimicrob. Агенты. 2005; 25: 385–91.
Артикул PubMed CAS Google ученый
Чу В., Лу Ф., Чжу В., Канг С. Выделение и характеристика новых потенциальных пробиотических бактерий на основе системы определения кворума.J. Appl. Microbiol. 2011; 110: 202–8.
Артикул PubMed CAS Google ученый
Cotter PD, Hill C, Ross PR, Paul D, Cotter CH, Bacteriocins RPR. выработка врожденного иммунитета к еде. Nat. Rev. Microbiol. 2005; 3: 777–88.
Артикул PubMed CAS Google ученый
Servin AL. Антагонистическая активность лактобацилл и бифидобактерий против микробных патогенов.FEMS Microbiol. Ред. 2004; 28: 405–40.
Артикул PubMed CAS Google ученый
Ашраф Р., Шах Н.П. Стимуляция иммунной системы пробиотическими микроорганизмами. Крит. Rev. Food Sci. Nutr. 2014; 54: 938–56.
Артикул PubMed CAS Google ученый
Hempel S, Newberry S, Ruelaz A, Wang Z, Miles JN V, Suttorp MJ, et al. Безопасность пробиотиков, используемых для снижения риска и предотвращения или лечения заболеваний.Evid Rep Technol Assess. 2011; 200: 1-645.
Снидман ДР. Безопасность пробиотиков. Clin. Заразить. Dis. 2008; 46: S104–11.
Артикул PubMed Google ученый
Stadlbauer V. Иммуносупрессия и пробиотики: насколько они эффективны и безопасны? Benef. Микробы. 2015; 6: 823–8.
Артикул PubMed CAS Google ученый
Дидари Т., Солки С., Мозаффари С., Никфар С., Абдоллахи М. Систематический обзор безопасности пробиотиков. Мнение эксперта. Drug Saf. 2014; 13: 227–39.
Систематический обзор безопасности пробиотиков. Мнение эксперта. Drug Saf. 2014; 13: 227–39.
Артикул PubMed Google ученый
Шарма П., Томар С.К., Госвами П., Сангван В., Сингх Р. Устойчивость к антибиотикам среди коммерчески доступных пробиотиков. Food Res. Int. 2014; 57: 176–95.
Артикул CAS Google ученый
Wong A, Ngu DY, Dan LA, Ooi A, Lim RL.Выявление устойчивости к антибиотикам в пробиотиках БАД. Нутр Дж. 2015; 14: 95.
Авадхани А., Майли Х. Пробиотики для профилактики антибиотико-ассоциированной диареи и Clostridium difficile -ассоциированного заболевания у госпитализированных взрослых — метаанализ. Варенье. Акад. Медсестра Практ. 2011; 23: 269–74.
Варенье. Акад. Медсестра Практ. 2011; 23: 269–74.
Артикул PubMed Google ученый
Butler CC, Duncan D, Hood K. Предотвращает ли регулярный прием пробиотиков с антибиотиками диарею, связанную с антибиотиками? BMJ.2012; 344: e682.
Артикул PubMed Google ученый
Кремонини Ф., Ди Каро С., Ниста Э.С., Бартолоцци Ф., Капелли Дж., Гасбаррини Дж. И др. Мета-анализ: влияние введения пробиотиков на диарею, ассоциированную с антибиотиками. Алимент. Pharmacol. Ther. 2002; 16: 1461–7.
Артикул PubMed CAS Google ученый
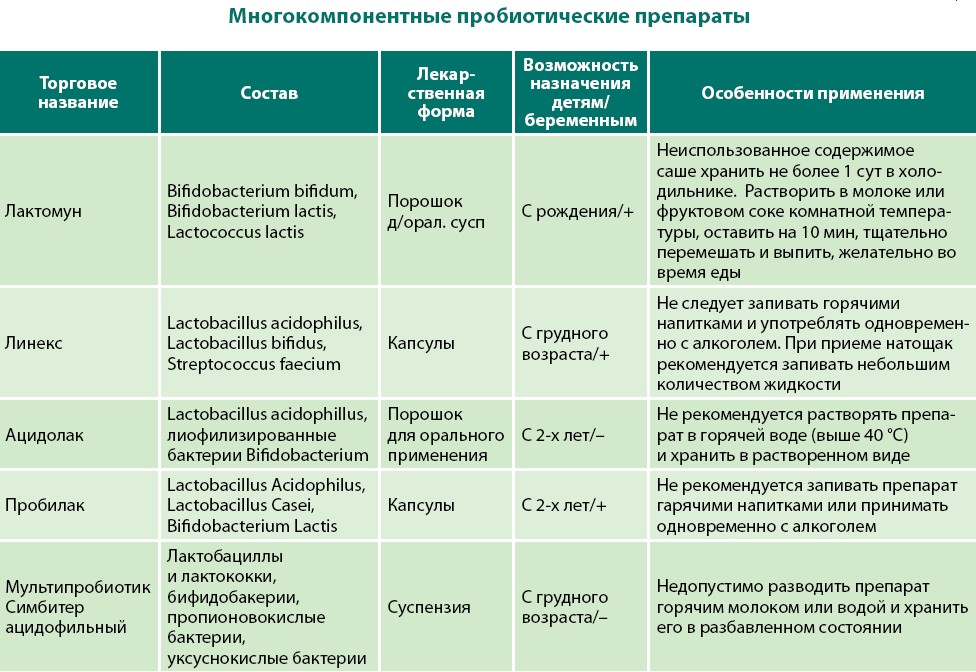
Дендукури Н., Коста В., МакГрегор М., Брофи Дж. М..Пробиотическая терапия для профилактики и лечения диареи, ассоциированной с Clostridium difficile : систематический обзор. Может. Med. Доц. J. 2005; 173: 167–70.
Артикул Google ученый
D’Souza AL, Rajkumar C, Cooke J, Bulpitt CJ. Пробиотики в профилактике диареи, связанной с антибиотиками: метаанализ. BMJ. 2002. 324: 1–6.
Google ученый
Гольденберг Дж., Литвин Л., Стейрих Дж., Паркин П., Махант С., Джонстон Б. Пробиотики для профилактики детской диареи, связанной с антибиотиками. Кокрановская база данных Syst. Ред. 2015; (12): CD004827.
Голденберг Дж., Ма С., Сакстон Дж., Мартцен М., Вандвик П., Торлунд К. и др. Пробиотики для профилактики Clostridium difficile — ассоциированной диареи у взрослых и детей. Кокрановская база данных Syst. Ред.2013; (12): CD006095.
Хаврелак Дж. А., Уиттен Д. Л., Майерс СПИ. Lactobacillus rhamnosus GG эффективно предотвращает возникновение диареи, связанной с антибиотиками: систематический обзор. Пищеварение. 2005; 72: 51–6.
Артикул PubMed Google ученый
Hempel S, Newberry SJ, Maher AR, Wang Z, Miles JNV, Shanman R, et al. Пробиотики для профилактики и лечения диареи, связанной с антибиотиками. Clin. Угол. 2012; 307: 1959–69.
CAS Google ученый
Johnston BC, Supina AL, Vohra S. Пробиотики для лечения детской диареи, связанной с антибиотиками: метаанализ рандомизированных плацебо-контролируемых исследований. Может. Med. Доц. J. 2006; 175: 377–83.
Артикул Google ученый
Джонстон Б., Гольденберг Дж., Вандвик П., Сан X, Гайатт Г. Пробиотики для профилактики детской диареи, связанной с антибиотиками (Кокрановский обзор). Cochrane Libr. 2011; (11): CD004827.
Джонстон до н.э., Ма СС, Гольденберг Дж. З., Торлунд К., Вандвик П.О., Лёб М. и др. Пробиотики для профилактики диареи, вызванной Clostridium difficile . Ann Intern Med. 2012; 157: 878–88.

Kale-Pradhan PB, Jassal HK, Wilhelm SM. Роль Lactobacillus в профилактике диареи, связанной с антибиотиками: метаанализ. Фармакотерапия. 2010. 30: 119–26.
Артикул PubMed Google ученый
McFarland LV. Пробиотики для первичной и вторичной профилактики инфекций C. difficile : метаанализ и систематический обзор. Антибиотики. 2015; 4: 160–78.
Артикул PubMed PubMed Central CAS Google ученый
McFarland LV. Мета-анализ пробиотиков для профилактики диареи, ассоциированной с антибиотиками, и лечения болезни, вызванной Clostridium difficile , . Являюсь. J. Gastroenterol.2006; 101: 812–22.
Артикул PubMed Google ученый
McFarland LV. Систематический обзор и метаанализ Saccharomyces boulardii у взрослых пациентов. Мир J. Gastroenterol. 2010. 16: 2202–22.
Артикул PubMed PubMed Central Google ученый
Pattani R, Palda VA, Hwang SW, Shah PS. Пробиотики для профилактики диареи, связанной с антибиотиками, и инфекции, вызванной Clostridium difficile , среди госпитализированных пациентов: систематический обзор и метаанализ.Open Med. 2013; 7: e56.
PubMed PubMed Central Google ученый
Пиллай А., Нельсон Р.Л. Пробиотики для лечения колита, ассоциированного с Clostridium difficile , у взрослых. Кокрановская база данных Syst. Ред. 2008 г .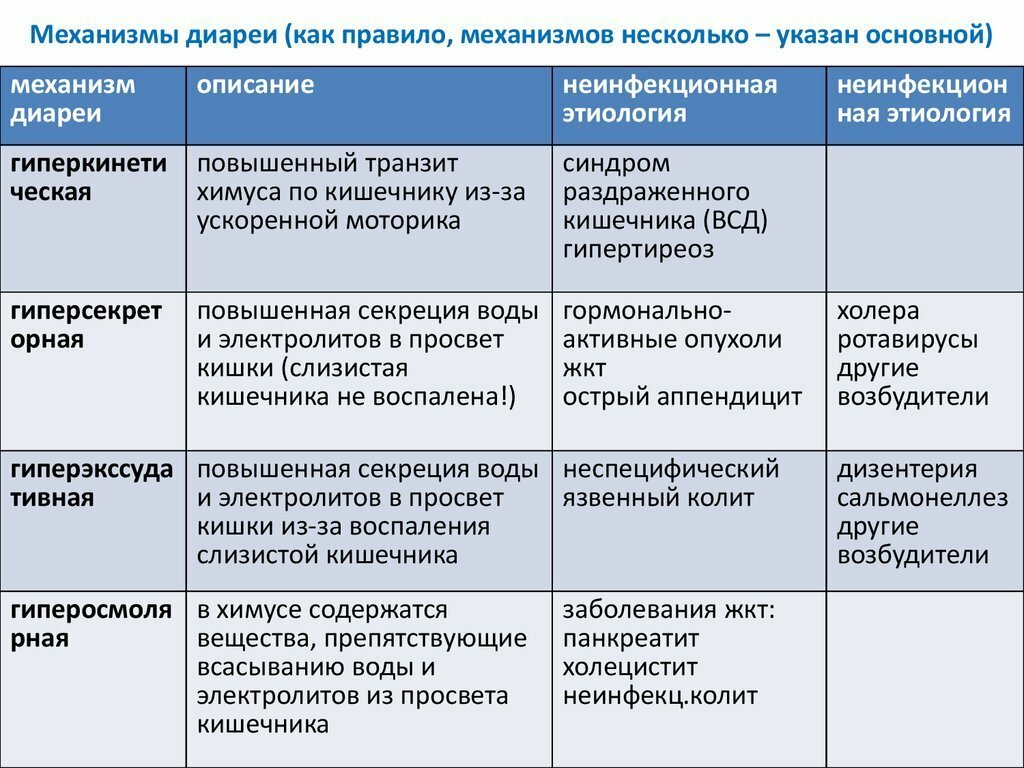 ; (1): CD004611.
; (1): CD004611.
Szajewska H, Мета-анализ MJ. Непатогенные дрожжи Saccharomyces boulardii в профилактике диареи, связанной с антибиотиками. Алимент. Pharmacol.Ther. 2005; 22: 365–72.
Артикул PubMed CAS Google ученый
Szajewska H, Kołodziej M. Систематический обзор с метаанализом: Lactobacillus rhamnosus GG в профилактике антибиотико-ассоциированной диареи у детей и взрослых. Алимент. Pharmacol. Ther. 2015; 42: 1149–57.
Артикул PubMed CAS Google ученый
Szajewska H, Kołodziej M. Систематический обзор с метаанализом: Saccharomyces boulardii в профилактике диареи, связанной с антибиотиками.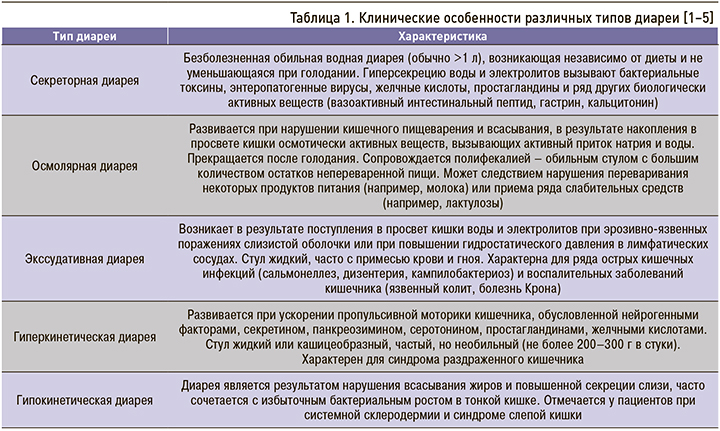 Алимент. Pharmacol. Ther. 2015; 42: 793–801.
Алимент. Pharmacol. Ther. 2015; 42: 793–801.
Артикул PubMed CAS Google ученый
Szajewska H, Ruszczyński M, Radzikowski A. Пробиотики в профилактике антибиотико-ассоциированной диареи у детей: метаанализ рандомизированных контролируемых исследований.J. Pediatr. 2006; 149: 367–72.
Артикул PubMed Google ученый
Тунг Дж. М., Долович Л. Р., Ли Ч. Профилактика инфекции Clostridium difficile Saccharomyces boulardii : систематический обзор. Может. J. Gastroenterol. 2009; 23: 817–21.
Артикул PubMed PubMed Central Google ученый
Urbańska M, Gieruszczak-Białek D, Szajewska H.Систематический обзор с метаанализом: Lactobacillus reuteri, DSM 17938, для диарейных заболеваний у детей. Алимент. Pharmacol. Ther. 2016; 43: 1025–34.
Артикул PubMed Google ученый
Videlock EJ, Cremonini F. Мета-анализ: пробиотики при диарее, связанной с антибиотиками. Алимент. Pharmacol. Ther. 2012; 35: 1355–69.
Артикул PubMed CAS Google ученый
Цзоу Дж., Дун Дж., Мета-анализ YX. Lactobacillus , содержащий четверную терапию, по сравнению со стандартной тройной терапией первой линии для эрадикации Helicobacter pylori . Helicobacter. 2009. 14: 449–59.
Артикул Google ученый
Szajewska H, Canani RB, Guarino A, Hojsak I, Indrio F, Kolacek S, et al. Пробиотики для профилактики диареи, связанной с антибиотиками, у детей. J. Pediatr. Гастроэнтерол.Nutr. 2016; 62: 495–506.
Артикул PubMed CAS Google ученый
Суурмонд Р., ван Ри Х., Хак Т. Введение, сравнение и проверка Meta-Essentials: бесплатный и простой инструмент для мета-анализа. Res. Synth. Методы. 2017; 8: 537–53.
Артикул PubMed PubMed Central Google ученый
Арвола Т., Лайхо К., Торккели С., Микка Х.Дети с респираторными инфекциями: рандомизированное исследование. 1999; 104
Beausoleil M, Fortier N, Guénette S, L’Ecuyer A, Savoie M, Franco M, et al. Эффект ферментированного молока, сочетающего Lactobacillus acidophilus CL1285 и Lactobacillus casei в профилактике антибиотико-ассоциированной диареи: рандомизированное двойное слепое плацебо-контролируемое исследование. Может. J. Gastroenterol. 2007; 21: 732–6.
Артикул PubMed PubMed Central CAS Google ученый
Cimperman L, Bayless G, Best K, Diligente A, Mordarski B, Oster M и др. Рандомизированное двойное слепое плацебо-контролируемое пилотное исследование Lactobacillus reuteri ATCC 55730 для профилактики антибиотико-ассоциированной диареи у госпитализированных взрослых. J. Clin. Гастроэнтерол. 2011; 45: 785–9.
Артикул PubMed Google ученый
Correa NB, Peret Filho LA, Penna FJ, Lima FM, Nicoli JR. Рандомизированное контролируемое испытание формулой Bifidobacterium lactis и Streptococcus thermophilus для профилактики диареи, связанной с антибиотиками, у младенцев.J. Clin. Гастроэнтерол. 2005; 39: 385–9.
Артикул PubMed Google ученый
Фокс М.Дж., Ахуджа К.Д.К., Робертсон И.К., Болл М.Дж., Эри Р.Д. Может ли йогурт с пробиотиками предотвратить диарею у детей, принимающих антибиотики? Двойное слепое рандомизированное плацебо-контролируемое исследование. BMJ Open. 2015; 5: e006474.
Артикул PubMed PubMed Central Google ученый
Гао XW, Mubasher M, Fang CY, Reifer C, Miller LE. Дозозависимая эффективность запатентованной пробиотической формулы Lactobacillus acidophilus CL1285 и Lactobacillus casei LBC80R при антибиотико-ассоциированной диарее и Clostridium difficile -ассоциированной профилактики диареи у взрослых пациентов. Являюсь. J. Gastroenterol. Издательская группа «Природа». 2010; 105: 1636–41.
Дозозависимая эффективность запатентованной пробиотической формулы Lactobacillus acidophilus CL1285 и Lactobacillus casei LBC80R при антибиотико-ассоциированной диарее и Clostridium difficile -ассоциированной профилактики диареи у взрослых пациентов. Являюсь. J. Gastroenterol. Издательская группа «Природа». 2010; 105: 1636–41.
Артикул PubMed Google ученый
Георгиева М., Панчева Р., Рашева Н., Ушева Н., Иванова Л., Колева К.Использование пробиотика Lactobacillus reuteri DSM 17938 для профилактики антибиотико-ассоциированных инфекций у госпитализированных болгарских детей: рандомизированное контролируемое исследование. J. IMAB — Annu. Продолжение. 2015; 21: 895–900.
Артикул Google ученый
Hickson M, D’Souza AL, Muthu N, Rogers TR, Want S, Rajkumar C, et al. Использование препарата пробиотика Lactobacillus для предотвращения диареи, связанной с антибиотиками: рандомизированное двойное слепое плацебо-контролируемое исследование.BMJ. 2007; 335: 80.
Артикул PubMed PubMed Central Google ученый
Конинг С.Дж., Джонкерс Д., Смидт Х., Ромбоутс Ф., Пеннингс Х.Дж., Воутерс Э. и др. Влияние многовидового пробиотика на состав фекальной микробиоты и привычки кишечника у пациентов с хронической обструктивной болезнью легких, получающих антибиотики. Br J Nutr. 2009; 103: 1452-60.
Koning CJM, Jonkers DMAE, Stobberingh EE, Mulder L, Rombouts FM, Stockbrügger RW.Влияние многовидового пробиотика на микробиоту кишечника и дефекацию у здоровых добровольцев, принимающих антибиотик амоксициллин. Являюсь. J. Gastroenterol. 2008. 103: 178–89.
Являюсь. J. Gastroenterol. 2008. 103: 178–89.
Артикул PubMed CAS Google ученый
Kotowska M, Albrecht P, Szajewska H. Saccharomyces boulardii в профилактике антибиотико-ассоциированной диареи у детей: рандомизированное двойное слепое плацебо-контролируемое исследование.Алимент. Pharmacol. Ther. 2005; 21: 583–90.
Артикул PubMed CAS Google ученый
Льюис С.Дж., Поттс Л., Барри Р.Э. Отсутствие терапевтического эффекта Saccharomyces boulardii в профилактике диареи, связанной с антибиотиками, у пожилых пациентов. J. Infect. 1998; 36: 171–4.
Артикул PubMed CAS Google ученый
Lönnermark E, Friman V, Lappas G, Sandberg T, Berggren A, Adlerberth I.Прием Lactobacillus plantarum уменьшает некоторые желудочно-кишечные симптомы во время лечения антибиотиками. J. Clin. Гастроэнтерол. 2010; 44: 106–12.
Артикул PubMed Google ученый
McFarland L, Surawicz C. Профилактика диареи, связанной с лактамом, с помощью Saccharomyces boulardii по сравнению с плацебо. Am J Gastroenterol. 1995; 90: 439–48.
PubMed CAS Google ученый
Myllyluoma E, Veijola L, Ahlroos T, Tynkkynen S, Kankuri E, Vapaatalo H, et al. Добавление пробиотиков улучшает переносимость эрадикационной терапии Helicobacter pylori — плацебо-контролируемое двойное слепое рандомизированное пилотное исследование. Алимент. Pharmacol. Ther. 2005; 21: 1263–72.
Алимент. Pharmacol. Ther. 2005; 21: 1263–72.
Артикул PubMed CAS Google ученый
Pozzoni P, Riva A, Bellatorre A, Amigoni M, Redaelli E, Ronchetti A, et al. Saccharomyces boulardii для профилактики диареи, связанной с антибиотиками, у взрослых госпитализированных пациентов: одноцентровое рандомизированное двойное слепое плацебо-контролируемое исследование.Являюсь. J. Gastroenterol. 2012; 107: 922–31.
Артикул PubMed Google ученый
Ruszczyński M, Radzikowski A, Szajewska H. Клиническое испытание: эффективность Lactobacillus rhamnosus (штаммы E / N, Oxy и Pen) в профилактике антибиотико-ассоциированной диареи у детей. Алимент. Pharmacol. Ther. 2008. 28: 154–61.
2008. 28: 154–61.
Артикул PubMed Google ученый
Сафдар Н., Баригала Р., Саид А., Мак-Кинли Л. Возможность и переносимость пробиотиков для профилактики антибиотико-ассоциированной диареи у госпитализированных ветеранов вооруженных сил США. J. Clin. Pharm. Ther. 2008; 33: 663–8.
Артикул PubMed CAS Google ученый
Sampalis J, Psaradellis E, Rampakakis E. Эффективность BIO K + CL1285 в снижении антибиотико-ассоциированной диареи — двойное слепое рандомизированное многоцентровое исследование с контролем плацебо.Arch. Med. Sci. 2010; 6: 56–64.
Google ученый
Сон Х. Дж., Ким Дж. Й, Юнг С. А., Ким С. И., Пак Х. С., Чон Й и др. Влияние пробиотика Lactobacillus (Lacidofil® cap) на профилактику антибиотико-ассоциированной диареи: проспективное рандомизированное двойное слепое многоцентровое исследование. J. Korean Med. Sci. 2010; 25: 1784–91.
Артикул PubMed PubMed Central Google ученый
Surawicz CM, Elmer GW, Speelman P, McFarland L.V, Chinn J, Belle VAN. Профилактика антибиотико-ассоциированной диареи, вызванной Sacchromyces boulardii: проспективное исследование. 1989; 96: 981-88.
Szajewska H, Albrecht P, Topczewska-cabanek A. Рандомизированное, двойное слепое, плацебо-контролируемое испытание: влияние добавки Lactobacillus GG на частоту эрадикации Helicobacter pylori и побочные эффекты во время лечения у детей._575.gif) J Pediatr Gastroenterol Nutr.2009: 431–436.
J Pediatr Gastroenterol Nutr.2009: 431–436.
Szymański H, Armańska M, Kowalska-Duplaga K, Szajewska H. Bifidobacterium longum PL03, Lactobacillus rhamnosus KL53A и Lactobacillus rhamnosus, KL53A, и Lactobacillus, ассоциированный с растением Aimobacillus, антибактериальным препаратом 9016, антибактериальные бактерии, связанные с антибактериальными бактериями A-9016, у детей-антибиотиков, предотвращающих развитие диких бактерий, вызываемых бактериями A-901 рандомизированное контролируемое пилотное исследование. Пищеварение. 2008; 78: 13–7.
Артикул PubMed Google ученый
Танканов Р.М., Росс М.Б., Эртель И.Дж., Дикинсон Д.Г., Маккормик Л.С., Гарфинкель Дж.Ф.Двойное слепое плацебо-контролируемое исследование эффективности Lactinex в профилактике диареи, вызванной амоксициллином. Dicp. 1990; 24: 382–4.
Dicp. 1990; 24: 382–4.
Артикул PubMed CAS Google ученый
Vanderhoof JA, Whitney DB, Antonson DL, Hanner TL, Lupo JV, Young RJ. Lactobacillus GG в профилактике антибиотико-ассоциированной диареи у детей. J. Pediatr. 1999; 135: 564–8.
Артикул PubMed CAS Google ученый
Wenus C, Goll R, Loken EB, Biong AS, Halvorsen DS, Florholmen J. Профилактика диареи, связанной с антибиотиками, с помощью ферментированного пробиотического молочного напитка. Евро. J. Clin. Nutr. 2008; 62: 299–301.
Артикул PubMed CAS Google ученый
Allen SJ, Wareham K, Wang D., Bradley C., Hutchings H, Harris W., et al. Лактобациллы и бифидобактерии в профилактике антибиотико-ассоциированной диареи и Clostridium difficile диареи у пожилых стационарных пациентов (PLACIDE): рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование.Ланцет. 2013; 382: 1249–57.
Артикул PubMed Google ученый
Чаттерджи С., Кар П., Дас Т., Рэй С., Гангули С., Раджендиран С. и др. Рандомизированное плацебо-контролируемое двойное слепое многоцентровое исследование эффективности и безопасности Lactobacillus acidophilus LA-5 и Bifidobacterium BB-12 для профилактики диареи, связанной с антибиотиками. J. Assoc. Врачи Индии. 2013; 61: 708–12.
PubMed Google ученый
Эванс М., Салевски Р.П., Кристман М.С., Жирар С.А., Томпкинс Т.А. Эффективность Lactobacillus helveticus и Lactobacillus rhamnosus для лечения антибиотико-ассоциированной диареи у здоровых взрослых: рандомизированное двойное слепое плацебо-контролируемое исследование. Br. J. Nutr. 2016; 116: 94–103.
Артикул PubMed CAS Google ученый
Ouwehand AC, DongLian C, Weijian X, Stewart M, Ni J, Stewart T. и др.Пробиотики уменьшают симптомы употребления антибиотиков в условиях больницы: рандомизированное исследование реакции на дозу. Вакцина. 2014; 32: 458–63.
Артикул PubMed Google ученый
Patel J, Curry WJ, Graybill MA, Bernard S, Mcdermott AS, Karpa K. Рандомизированное исследование пробиотиков в первичной медико-санитарной помощи. J. Pharm. Лечить. Серв. Res. 2014; 5: 187–90.
Рандомизированное исследование пробиотиков в первичной медико-санитарной помощи. J. Pharm. Лечить. Серв. Res. 2014; 5: 187–90.
Артикул Google ученый
Селинджер С.П., Белл А., Кэрнс А., Локетт М., Себастьян С., Хаслам Н. Пробиотик VSL # 3 предотвращает антибиотико-ассоциированную диарею в двойном слепом рандомизированном плацебо-контролируемом клиническом исследовании. J. Hosp. Заразить. 2013; 84: 159–65.
Артикул PubMed CAS Google ученый
Дуйяр Ф.П., Кант Р., Ритари Дж., Паулин Л., Палва А., Де Вос WM. Сравнительный анализ генома штаммов Lactobacillus casei , выделенных из продуктов Actimel и Yakult, выявил заметное сходство и указывает на общее происхождение. Microb. Biotechnol. 2013; 6: 576–87.
Microb. Biotechnol. 2013; 6: 576–87.
Артикул PubMed PubMed Central CAS Google ученый
Horvath A, Dziechciarz P, Szajewska H. Мета-анализ: Lactobacillus rhamnosus GG для функциональных желудочно-кишечных расстройств, связанных с абдоминальной болью, в детском возрасте. Алимент. Pharmacol. Ther. 2011; 33: 1302–10.
Артикул PubMed CAS Google ученый
Sybesma W, Molenaar D, Van IJcken W, Venema K, Korta R. Нестабильность генома Lactobacillus rhamnosus GG. Appl. Environ. Microbiol. 2013; 79: 2233–2239.
Шен Н.Т., Мо А., Тманова Л. Л., Пино А., Анси К., Кроуфорд К.В. и др. Своевременное использование пробиотиков у госпитализированных взрослых предотвращает инфекцию Clostridium difficile : систематический обзор с мета-регрессионным анализом. Гастроэнтерология. Elsevier, Inc., 2017; 152: 1889–1900. e9.
Л., Пино А., Анси К., Кроуфорд К.В. и др. Своевременное использование пробиотиков у госпитализированных взрослых предотвращает инфекцию Clostridium difficile : систематический обзор с мета-регрессионным анализом. Гастроэнтерология. Elsevier, Inc., 2017; 152: 1889–1900. e9.
Артикул PubMed Google ученый
Hayes SR, Vargas AJ. Пробиотики для профилактики детской диареи, связанной с антибиотиками. Explor. J. Sci. Лечить. 2016; 12: 463–6.
Google ученый
Ouwehand AC. Обзор дозозависимых пробиотиков в исследованиях на людях. Benef. Микробы. 2016: 1–10.
Эдвардс-Ингрэм Л. , Гитшем П., Бертон Н., Уорхерст Дж., Кларк И., Хойл Д. и др. Генотипическая и физиологическая характеристика Saccharomyces boulardii , пробиотического штамма Saccharomyces cerevisiae .Appl. Environ. Microbiol. 2007. 73: 2458–67.
, Гитшем П., Бертон Н., Уорхерст Дж., Кларк И., Хойл Д. и др. Генотипическая и физиологическая характеристика Saccharomyces boulardii , пробиотического штамма Saccharomyces cerevisiae .Appl. Environ. Microbiol. 2007. 73: 2458–67.
Артикул PubMed PubMed Central CAS Google ученый
Антибиотики Диарея: причины, лечение и профилактика
Антибиотики — это лекарства, которые используются для лечения бактериальных инфекций. Однако иногда лечение антибиотиками может привести к неприятному побочному эффекту — диарее.
Диарея, связанная с приемом антибиотиков, встречается довольно часто. Подсчитано, что от 5 до 25 процентов взрослых могут испытывать диарею при приеме антибиотиков.
Но что именно вызывает это? И можно ли это предотвратить? Продолжайте читать, поскольку мы углубимся в изучение диареи, связанной с антибиотиками, ее причин и того, что вы можете сделать, если это случится с вами.
Да, антибиотики могут вызвать диарею — и вот почему.
Антибиотики нацелены на бактерии, используя структуры и процессы, которые имеют бактериальные клетки, которые отличаются от наших собственных клеток. Итак, хотя антибиотики не вредят нашим клеткам, они могут убивать как хорошие, так и плохие бактерии, живущие в вашем кишечнике.
Не все бактерии плохие. В вашем кишечнике обитает много видов полезных бактерий. Эти полезные бактерии помогают процессу пищеварения, а также помогают поддерживать ваше здоровье. Антибиотики могут нарушить баланс этих бактерий. Одним из побочных эффектов уничтожения хороших бактерий, помимо вредных, является возможность более жидкого стула.
Еще одна задача, которую делают хорошие бактерии, — сдерживать рост условно-патогенных бактерий.Эти бактерии, такие как Clostridium difficile (сокращенно C. diff ), могут вызывать инфекции, если им позволить развиваться, что может произойти, если полезные бактерии уничтожены антибиотиками..gif)
Токсины, вырабатываемые C. diff , могут вызывать воспаление в кишечнике, ведущее к диарее. По оценкам исследований, до 17,5% здоровых людей колонизированы C. diff . Это число может увеличиваться в медицинских учреждениях, например в больницах.
Диарея, связанная с антибиотиками, определяется как жидкий, водянистый стул три или более раз в день при приеме антибиотиков.
Это может начаться примерно через неделю после начала приема антибиотиков. Кроме того, через несколько недель после окончания лечения может развиться диарея.
Если у вас инфекция C. diff , у вас могут возникнуть дополнительные симптомы, например:
Хотя все антибиотики могут вызывать диарею, некоторые типы более тесно связаны с этим заболеванием.До сих пор не совсем ясно, почему эти антибиотики чаще вызывают диарею по сравнению с другими.
Антибиотики, которые с большей вероятностью могут вызвать диарею, включают:
Если вы страдаете диареей от антибиотиков, изменение диеты может помочь облегчить симптомы..gif) Вот некоторые общие рекомендации:
Вот некоторые общие рекомендации:
- Употребление продуктов с низким содержанием клетчатки. Хотя здоровым людям рекомендуется употреблять продукты с высоким содержанием клетчатки, их употребление при диарее может ухудшить ваше состояние.
- Замена калия. Это питательное вещество может быть потеряно из-за диареи, но употребление продуктов, содержащих калий, может помочь восполнить его.
- Восполнение потерянных жидкостей и солей. Диарея может привести к более быстрой потере жидкости и электролитов, поэтому важно их восполнить.
Основываясь на этих предложениях, при диарее старайтесь употреблять следующие продукты и напитки:
- жидкости , включая воду, бульоны или чай без кофеина
- фрукты , такие как бананы, яблочное пюре или небольшое количество консервированные фрукты без сиропа
- зерна , такие как белый рис, белый хлеб и лапша
- очищенный картофель (хороший источник калия), сваренный или запеченный
- белок источники, такие как птица, постное мясо и рыба
- йогурт , содержащий живые культуры
Некоторые виды пищи могут ухудшить ваши симптомы или помешать лечению антибиотиками. К ним относятся:
К ним относятся:
- алкогольные напитки
- напитки с кофеином , такие как кофе, газированные напитки и чай
- молочные продукты (кроме йогурта), могут вызывать проблемы с пищеварением при приеме антибиотиков и могут влиять на абсорбцию антибиотиков
- жирные продукты , такие как жирное мясо, выпечка, картофельные чипсы, картофель фри и другие жареные продукты
- продукты или напитки с высоким содержанием добавленного сахара такие как газированные напитки, фруктовые соки, пирожные и печенье
- продукты с высоким содержанием клетчатки такие как цельнозерновые, бобовые и большинство фруктов и овощей
- острая пища , которая может еще больше раздражать пищеварительный тракт
Кроме того, старайтесь не есть грейпфрут и не принимать добавки с кальцием.Они могут повлиять на то, насколько хорошо антибиотики усваиваются вашим организмом, и могут уменьшить действие лекарств..jpg)
Помимо корректировки диеты, вы можете предпринять и другие шаги, чтобы облегчить симптомы.
Замените потерянную жидкость
Диарея может привести к потере жидкости, что подвергает вас риску обезвоживания. Пейте много воды, чтобы избежать обезвоживания. Бульоны или фруктовые соки с низким содержанием сахара также могут помочь предотвратить потерю жидкости.
Если у вашего ребенка диарея, вы можете подумать о растворе для пероральной регидратации, таком как Pedialyte.
Используйте противодиарейные препараты с осторожностью.
В некоторых случаях противодиарейные препараты, такие как лоперамид (имодиум), могут быть эффективными для облегчения ваших симптомов. Однако посоветуйтесь со своим врачом перед применением этих лекарств.
В некоторых случаях прием противодиарейных препаратов может замедлить время, необходимое вашему организму, чтобы избавиться от токсинов в пищеварительном тракте. Это может продлить ваше состояние и подвергнуть вас риску осложнений.
Обратитесь к врачу или обратитесь за неотложной помощью, если вы принимаете антибиотики и у вас наблюдаются следующие симптомы:
- более пяти эпизодов диареи в день
- кровь или гной в стуле
- лихорадка
- брюшная полость боль или судороги
Если у вас более легкая диарея, ваш врач может посоветовать вам прекратить прием антибиотика до тех пор, пока диарея не пройдет.Ваш врач также может прописать другой антибиотик, который имеет меньший риск возникновения диареи.
При подозрении на инфекцию C. diff ваш врач прекратит прием антибиотика, который вы принимаете. Вместо этого ваш врач может назначить антибиотик, который нацелен на бактерии C. diff , например ванкомицин, фидаксомицин или метронидазол.
Есть несколько шагов, которые вы можете предпринять, чтобы снизить риск развития диареи, связанной с приемом антибиотиков. Некоторые предложения включают:
- Попробуйте пробиотики.
 Пробиотики могут помочь вернуть полезные бактерии в пищеварительную систему. Некоторые недавние обзоры научной литературы показали, что использование пробиотиков во время приема антибиотиков может быть эффективным для предотвращения диареи.
Пробиотики могут помочь вернуть полезные бактерии в пищеварительную систему. Некоторые недавние обзоры научной литературы показали, что использование пробиотиков во время приема антибиотиков может быть эффективным для предотвращения диареи. - Соблюдайте правила гигиены. Частое мытье рук, особенно после посещения туалета, может помочь предотвратить распространение бактерий C. diff .
- Следуйте инструкциям по лечению. Некоторые антибиотики можно рекомендовать принимать во время еды.Обязательно сделайте это, чтобы предотвратить раздражение пищеварительной системы.
- Принимайте антибиотики только при необходимости. Хотя антибиотики могут лечить бактериальные инфекции, они неэффективны против вирусных инфекций, таких как простуда и грипп. Чрезмерное употребление антибиотиков может негативно повлиять на здоровье пищеварительной системы и вызвать другие проблемы.
- Поговорите со своим врачом.
 Если у вас раньше был понос при приеме антибиотиков, сообщите об этом врачу. Они могут прописать антибиотик, который с меньшей вероятностью вызовет эту проблему.
Если у вас раньше был понос при приеме антибиотиков, сообщите об этом врачу. Они могут прописать антибиотик, который с меньшей вероятностью вызовет эту проблему.
Диарея, связанная с антибиотиками, встречается довольно часто. Это происходит, когда антибиотики нарушают естественный баланс бактерий в кишечнике. Это может привести к раздражению пищеварительной системы и повысить риск заболевания из-за некоторых видов вредных бактерий, таких как C. diff .
Все типы антибиотиков могут вызывать диарею. Однако некоторые типы антибиотиков, такие как пенициллины и цефалоспорины, могут вызывать его чаще.
Если у вас диарея, связанная с антибиотиками, сосредоточьтесь на потреблении продуктов с низким содержанием клетчатки и восполнении потерянной жидкости и питательных веществ.Обратитесь к врачу, если во время приема антибиотиков у вас очень частая или тяжелая диарея, спазмы в животе или лихорадка.
(PDF) Механизмы и лечение диареи, связанной с антибиотиками
708 Ho
¨
genauer et al. CID 1998; 27 (октябрь)
CID 1998; 27 (октябрь)
9. Голдхилл Дж. М., Роуз К., Перси У. Влияние антибиотиков на ион эпителия
В недавнем исследовании клинические симптомы повторялись в 7% случаев переноса pa-
в дистальный отдел толстой кишки кролика in vitro. J Pharm Pharmacol 1996;
пациентов с использованием тейкопланина, 16% с использованием метронидазола, 16% с использованием
48: 651–6.
ванкомицин и 28% с использованием фузидовой кислоты [85]. Возможен рецидив
10. Риглер М., Седиви Р., Поулакис С. и др. Клостридий дифференцированный токсин В —
, его следует лечить вторым курсом того же антибиотика или
более сильным, чем токсин А, повреждающим эпителий толстой кишки человека в условиях
vitro. J Clin Invest 1995; 95: 2004–11.
один из других антибиотиков. Было показано, что S. boulardii представляет собой
11. McFarland LV, Mulligan ME, Kwok RY, Stamm WE.Нозокомиальное приобретение
— эффективная и безопасная дополнительная терапия при рецидивах [87]. Антибиотик
Антибиотик
от Clostridium difficile. N Engl J Med 1989; 320: 204–
За лечениемможет следовать использование Lactobacillus (1-2 г в день)
10.
в течение 4 недель [4, 88]. Если у пациента нет диареи или если
12. Larson HE, Barclay FE, Honor P, Hill ID. Эпидемиология Clostridium
диарея проходит после прекращения приема антибиотиков, индуцирующих антибиотики
, у младенцев.J Infect Dis 1982; 146: 727–33.
13. Libby JM, Donta ST, Wilkins TD. Clostridium difficile toxin A у младенцев.
ics, лечение C. difficile специальными антибиотиками не соответствует
J Infect Dis 1983; 148: 606.
Рекомендуется[4, 5, 6].
14. Cheng SH, Lu JJ, Young TG, Perng CL, Chi WM. Clostridium difficile —
Должны быть предоставлены одноместные палаты с отдельными ванными комнатами
Сопутствующие заболевания: сравнение симптоматической инфекции и инфекции —
, если возможно, для пациентов с C.различная диарея, по крайней мере
случаев на основе факторов риска, выработки токсинов и генотипирования
до прекращения диареи [3]. Использование перчаток и рук —
результатов. Clin Infect Dis 1997; 25: 157–8.
15. Нолан Н. П., Келли С. П., Хамфрис Дж. Ф. и др. Эпидемия псевдомембра-
— промывание между контактами с больными обязательно [3].
ноус колит: важность передачи от человека к человеку. Gut 1987; 28: 1467–
Избыточный кандидозный рост можно лечить с помощью нистатина (250,000
73.
отдо 1 000 000 ЕД перорально от трех до четырех раз в день), и ответ
16. Бендер Б.С., Беннетт Р., Лафон Б.Е. и др. Можно ли ожидать, что Clostridium отличается эндемичностью
от противогрибковой терапии в течение 3–7 дней [37,
] в учреждениях по оказанию хронической помощи? Ланцет 1986; 2: 11–3.
40, 42].
17. Borriello SP, Larson HE, Welch AR, Barclay F. Энтеротоксигенный Clostrid-
ium perfringens: возможная причина диареи, связанной с антибиотиками.
Пациенты с легкой диареей, не вызванной C.дифференциал май
Lancet 1984; 1: 305–7.
не требует специального обращения. Особенно у детей и
18. Larson HE, Borriello SP. Инфекционная диарея, вызванная Clostridium per-
у пожилых людей, потеря жидкости и электролитов должна быть восполнена.
fringens. J Infect Dis 1988; 157: 390–1.
Следует избегать употребления плохо усваиваемых углеводов. In
19. Borriello SP, Barclay FE, Welch AR, et al. Эпидемиология диареи
небольшое исследование, йогурт, содержащий Bi ofdobacterium longum, показал
, вызванный энтеротоксигенным Clostridium perfringens.J Med Microbiol
1985; 20: 363–72.
снижает риск диареи, вызванной эритромицином [89]. Ан-
20. Borriello SP. Клостридиальное заболевание кишечника. Clin Infect Dis 1995; 20 (Suppl
, другое исследование предполагает, что препарат Lactobacillus снижает
2): S242– 50.
диарея, вызванная ампициллином [90].
21. Макдональд М., Уорд П., Харви К. Диарея, связанная с антибиотиками, и
устойчивый к метициллину Staphylococcus aureus.Med J Aust 1982; 1:
462–4.
Выражение признательности
22. Инамацу Т., Оошима Х., Фукаяма М., Масуда Й., Хатакеяма Т. Клинический
спектр энтероколита, ассоциированного с антибиотиками, вызванного резистентностью к метициллину
Авторы благодарят Д. Брукнера, доктора философии, и Б. Беарсон, к.
tant Staphylococcus aureus. Ниппон Риншо 1992; 50: 1087 –92.
(оба из Калифорнийского университета в Лос-Анджелесе), а также К. Тамуссино, доктор медицины (из Граца), за
23. Хори К., Юра Дж., Синагава Н., Сакураи С., Машита К., Мидзуно А.Postopera-
их критический обзор этой рукописи.
Активный энтероколит и текущее состояние энтероколита MRSA — результат
анкетного опроса в Японии. Kansenshogaku Zasshi 1989; 63:
701–7.
24. Скопетти Ф., Орефик Джи, Бионди Ф., Бенини Ф. Устойчивый к стафилококку
Ссылки
на метициллин и гентамицин как причину вспышки эпидемического энтерита
1. Hammer HF, Fine KD, Санта-Ана, Калифорния, Портер Дж. Л., Шиллер Л. Р., Фордтран
в больнице.Болл Ist Sieroter Milan 1983; 62: 406–11.
JS. Мальабсорбция углеводов: ее измерение и ее вклад
25. Тейлор М., Аджайи Ф., Алмонд М. Энтероколит, вызванный метициллин-резистентным
к диарее. J Clin Invest 1990; 86: 1936 –44.
tant Staphylococcus aureus. Lancet 1993; 342: 804.
2. Кац Д.А., Линч М.Э., Литтенберг Б. Правила клинического прогнозирования для оптимизации
26. Тофер РБ, Пингоуд Э.Г., Баррелл М.И. Острый колит, связанный с пенициллином
, тестирование цитотоксина на Clostridium difficile у госпитализированных пациентов с
и производными пенициллина.Ланцет 1978; 2: 707–9.
диарея. Am J Med 1996; 100: 487– 95.
27. Mrowka C, Muench R, Rezzonico M, Greminger P. Acute segmental
3. Fekety R. Рекомендации по диагностике и лечению Clostridium
геморрагического пенициллин-ассоциированного колита. Dtsch Med Wochenschr 1990;
Диарея и колит, ассоциированные с дифференцировкой. Am J Gastroenterol 1997; 92:
115: 1750–3.
739– 50.
28. Флюкигер Т., Фрёли П., Балтиссер И.Сегментарный гем, связанный с антибиотиками —
4. Bartlett JG. Управление инфекцией Clostridium difficile и другими антибиотиками
оррагический колит: описание случая. Z Gastroenterol 1992; 30: 262– 3.
ушные диареи. Eur J Gastroenterol Hepatol 1996; 8: 1054–
29. Бенц С., Колер Б., Риман Дж. Ф. Острый сегментарный геморрагический пенициллин —
61.
ассоциированный колит у 32-летнего пациента. Лебер Маген Дарм 1994;
5. Келли С.П., Поулакис С., ЛаМонт Дж. Т..Clostridium difficile колит. N Engl
24: 171–3.
J Med 1994; 330: 257–62.
30. Минами Дж., Катаяма С., Мацусита О, Сакамото Х., Окабе А. Энтеротоксический
6. Бартлетт Дж. Диарея, связанная с антибиотиками. Clin Infect Dis 1992; 15: 573 —
активность цитотоксина Klebsiella oxytoca в петлях кишечника кролика. Инфекция
81.
Иммун 1994; 62: 172–7.
7. Поулакис С. Патогенез диареи, ассоциированной с Clostridium difficile.
31. Cleau D, Humblot S, Jobard JM, Berger M. Острый правосторонний геморрагический синдром
Eur J Gastroenterol Hepatol 1996; 8: 1041–7.
колит с проявлением Klebsiella oxytoca после лечения
8. Ямамото-Осаки Т., Камия С., Савамура С., Кай М., Одзава А. Рост
амоксициллина. Пресс Мед 1994; 23: 1879–80.
ингибирование Clostridium difficile кишечной флорой детских фекалий в
32. Grando V, Bellaiche G, Le Pennec MP, et al.Язвенный геморрагический
проктит, вызванный Klebsiella oxytoca, после лечения амокс-непрерывной культурой. J Med Microbiol 1994; 40: 179–87.
/ 9c57 $$ oc49 09-16-98 11:21:28 cida UC: CID
гостем 13 июля 2011 г. cid.oxfordjournals.org Загружено с
Диарея, связанная с антибиотиками — обзор
Наркотики — частая причина послеоперационной диареи (Таблица 9-2). Общие фармакологические причины диареи в послеоперационном периоде включают антациды, содержащие магний, антибиотики, дигиталис, хинидин, теофиллин и слабительные средства.Часто диарея может быть результатом пищевых добавок, таких как сорбит. Пероральные калорийные добавки также могут вызвать диарею. Можно ожидать, что диарея исчезнет, когда прекратят прием вызывающего нарушения препарата, или когда калорийная добавка будет разбавлена или введена более медленными темпами.
Диарея, связанная с антибиотиками
Диарея, связанная с антибиотиками, является основной причиной диареи у послеоперационных пациентов. Легкая диарея, которая часто возникает у послеоперационных пациентов, получающих антибиотики, считается вызванной изменением бактериальной флоры толстой кишки и обычно быстро проходит после прекращения приема антибиотиков.Из всех пациентов с диареей, связанной с приемом антибиотиков, от 15% до 25% имеют положительный анализ стула на токсина C. difficile , что может привести к псевдомембранозному колиту. Диарея при псевдомембранозном колите обычно начинается в течение нескольких дней после начала антибактериальной терапии, но может возникать до 6 недель после завершения курса пероральных или внутривенных антибиотиков. Диарея часто бывает обильно водянистой и иногда может быть очень кровянистой. Пациенты с диабетом, сепсисом или раком или те, кто получил предоперационную подготовку кишечника или терапию, подавляющую кислоту желудочного сока, особенно ингибиторы протонной помпы, подвергаются повышенному риску псевдомембранозного колита.Любой антибиотик, кроме ванкомицина, может вызвать псевдомембранозный колит; цефалоспорины, ампициллин, клиндамицин и аминогликозиды были наиболее часто замешаны в прошлом. В более поздних вспышках диареи, связанной с C. difficile , наиболее важным фактором риска было введение фторхинолонов. Диарея обычно указывает на скрытую кровь и сопровождается лихорадкой, лейкоцитозом и схваткообразной болью в животе. Реже возникают гематохезия, болезненность живота и уменьшение объема; может возникнуть токсичный мегаколон.У пожилых пациентов инфекция C. difficile была связана с субклинической энтеропатией с потерей белка при отсутствии явной диареи. Более поздние вспышки были связаны с вирулентной формой C. difficile , продуцирующей высокие уровни токсина и с высокими показателями заболеваемости и смертности (Loo et al, 2005).
Диагноз псевдомембранозного колита часто ставится в соответствующих условиях путем обнаружения в кале токсина C. difficile .Два токсина (A и B) участвуют в патогенезе C. difficile . Анализ на токсин C. difficile дает положительный результат в 90–95% случаев псевдомембранозного колита при исследовании до трех образцов стула. Стандартный анализ тканевой культуры обнаруживает токсины А и В и немного более чувствителен, чем иммуноанализ, но последние намного быстрее и предпочтительнее. Диагноз также можно подтвердить с помощью ректороманоскопии, обнаружив характерные желто-белые бляшечные мембраны на болотистой, эритематозной основе.В некоторых случаях сохраняется прямая и даже сигмовидная кишка, и при колоноскопии выявляется только правосторонний псевдомембранозный колит. Иногда пациенты с антибиотико-ассоциированной диареей и отрицательным результатом анализа на C. difficile имеют псевдомембранозный колит, вызванный другими токсигенными бактериями, такими как Clostridium perfringens .
Лечение псевдомембранозного колита. Лечение состоит из отмены антибиотика, вызывающего нарушение, и начала приема перорального метронидазола по 250 мг каждые 8 часов в течение 10–14 дней [ Bartlett, 2002 ].В качестве альтернативы можно использовать пероральный ванкомицин в дозе 125 мг каждые 6 часов, но он дороже, чем метронидазол, и был связан с появлением в некоторых больницах резистентного энтерококка Enterococcus faecium . И наоборот, начали появляться сообщения о резистентности к метронидазолу, причем в некоторых вспышках этот показатель превышал 20%. Следует избегать агентов, снижающих моторику, таких как дифеноксилат и атропин (ломотил) или лоперамид. Частота рецидивов после терапии составляет около 20%; рецидивы обычно поддаются повторному курсу терапии.У случайных пациентов с множественными рецидивами необходимо лечить длительными и постепенно снижающимися курсами перорального ванкомицина или новыми методами лечения, такими как капсулы, содержащие дрожжи Saccharomyces boulardii . В настоящее время изучается анатоксиновая вакцина C. difficile для пациентов с рецидивирующей диареей, связанной с C. difficile . Тяжелые случаи псевдомембранозного колита с кишечной непроходимостью, исключающие пероральный прием лекарств, можно лечить метронидазолом в дозе 500 мг внутривенно каждые 8 часов.Иногда развивается токсический мегаколон, требующий хирургического лечения; Повышенный риск токсического мегаколона связан с применением кортикостероидов, слабительных или противовоспалительных средств, полным парентеральным питанием, иммуносупрессией и длительной госпитализацией.
Пробиотики для профилактики антибиотико-ассоциированной диареи у взрослых и детей
Вмешательство
Пробиотики у взрослых и детей, принимающих антибиотики.
Есть некоторые свидетельства того, что преимущества пробиотиков зависят от штамма. Lactobacillus rhamnosus GG и Saccharomyces boulardii , по-видимому, являются наиболее эффективным выбором для предотвращения диареи, связанной с антибиотиками, в то время как Lactobacillus casei может быть лучшим средством специфической профилактики тяжелой диареи, связанной с C. difficile- .
Индикация
Диарея, связанная с антибиотиками, встречается у 2–15% людей, принимающих антибиотики. Считается, что около 20–30% случаев вызваны инфекцией Clostridium difficile.
Для снижения риска диареи, связанной с приемом антибиотиков, у лиц из группы повышенного риска.
Хотя любой антибиотик может вызывать диарею, более высокие показатели диареи связаны с амоксициллин-клавуланатом, цефалоспоринами и клиндамицином.
Более длительный прием антибиотиков (> 3 дней) с большей вероятностью может вызвать диарею, связанную с приемом антибиотиков.
Дети в возрасте <2 лет и люди со слабым здоровьем или с сопутствующими заболеваниями могут иметь более высокий риск диареи, связанной с антибиотиками, чем население в целом.
Примечание. Этот обзор данных не охватывал использование пробиотиков для лечения установленного ААД. Однако, учитывая их эффективность в профилактике, использование пробиотиков при ААД было бы разумным.
Меры предосторожности
Кратковременное употребление пробиотиков кажется безопасным, по крайней мере, для людей с ослабленным иммунитетом.
Наличие
Множество различных составов пробиотиков (капсулы, порошки, пакетики) можно приобрести в супермаркетах, аптеках и магазинах здорового питания.Продукты, содержащие пробиотики, классифицируемые как пищевые продукты (например, йогурт), не подпадают под те же требования по определению количества активного ингредиента, что и те, которые продаются в качестве дополнительных лекарственных средств.
Описание
Пробиотики — это живые организмы, которые, как считается, улучшают микробный баланс организма-хозяина. Считается, что они снижают риск изменений кишечной флоры, связанных с использованием антибиотиков и колонизацией патогенными бактериями.
Было показано, что пробиотики уменьшают диарею, связанную с антибиотиками, у взрослых и детей, у госпитализированных и амбулаторных пациентов, с различными видами пробиотиков, с более низкими или более высокими дозами пробиотиков и в исследованиях с высоким или низким риском систематической ошибки.
Использование пробиотиков — это недорогое полезное вмешательство с низким риском для людей с повышенным риском диареи, связанной с антибиотиками. Апостериорный анализ подгрупп показал, что пробиотики эффективны в исследованиях с исходным риском диареи, ассоциированной с C. difficile ,> 5% (NNT = 12; доказательства умеренной достоверности), но не в исследованиях с более низким исходным риском. К сожалению, пока нет перспективного инструмента прогнозирования рисков, применимого в условиях общей практики.
Опубликованные на данный момент данные не показывают разницы в эффективности или переносимости комбинаций по сравнению с одним пробиотиком.
Советы и задачи
- Пробиотики можно принимать во время и / или после приема антибиотиков. Продолжительность дозы варьировалась в разных исследованиях. Тем не менее, использование пробиотиков в течение минимального периода лечения антибиотиками было бы разумным.
- Хотя режим дозирования не определен, испытания использовали дозу от 10 до 50 миллиардов колониеобразующих единиц (КОЕ) в день.
Оценка
Доказательства уровня 1 NHMRC.
Диарея, связанная с антибиотиками
Изображения: Ссылки по теме на внешние сайты (из Bing)
Онтология: Диарея, связанная с антибиотиками (C0578159)
| Концепции | Заболевание или синдром ( T047 ) |
| SnomedCT | 301469002 |
| Голландский | antibiotica-geassocieerde diarree, antibioticumgeassocieerde diarree |
| Французский | Diarrhée associée aux antibiotiques, Diarrhée liée aux antibiotiques |
| Немецкий | durch Antiobiotika verursachte Diarrhoe |
| Итальянский | Диарея да антибиотики |
| Португальский | Diarreia associada a antibióticos |
| Испанский | Ассоциированная диарея и антибиотикос, диарея асоциада и антибиотикос, диарея асоциада кон антибиотикос (трасторно), асоциада диарея кон антибиотикос |
| Японский | 抗 生 物質 関 連 下痢, コ ウ セ イ ブ ッ シ ツ カ ン レ ン ゲ リ |
| Английский | Диарея, связанная с антибиотиками, диарея, связанная с антибиотиками, диарея, связанная с антибиотиками, диарея, связанная с антибиотиками, диарея, связанная с антибиотиками, диарея, связанная с антибиотиками, диарея, связанная с антибиотиками, диарея, связанная с антибиотиками, диарея, связанная с антибиотиками, диарея, связанная с антибиотиками, диарея, связанная с антибиотиками, диарея, связанная с антибиотиками (беспорядок) |
| Чешский | Průjem spojený s léčbou antibiotiky |
| Венгерский | Antibiotikum-asszociált hasmenés |

 2018.t20.n2.p076.pdf
2018.t20.n2.p076.pdf  Сибирский онкологический журнал, 2014. № 1 (61), стр. 46-53. https://cyberleninka.ru/article/v/clostridium-difficileassotsiirovannaya-diareya
Сибирский онкологический журнал, 2014. № 1 (61), стр. 46-53. https://cyberleninka.ru/article/v/clostridium-difficileassotsiirovannaya-diareya  org/
org/ Чтобы предотвратить небольшую потерю жидкости при диарее, пейте больше воды. При более тяжелой потере пейте жидкости, содержащие воду, сахар и соль.Попробуйте бульон или фруктовый сок с низким содержанием сахара. Избегайте напитков с высоким содержанием сахара, алкоголя или кофеина, таких как кофе, чай и кола, которые могут ухудшить ваши симптомы.
Чтобы предотвратить небольшую потерю жидкости при диарее, пейте больше воды. При более тяжелой потере пейте жидкости, содержащие воду, сахар и соль.Попробуйте бульон или фруктовый сок с низким содержанием сахара. Избегайте напитков с высоким содержанием сахара, алкоголя или кофеина, таких как кофе, чай и кола, которые могут ухудшить ваши симптомы.

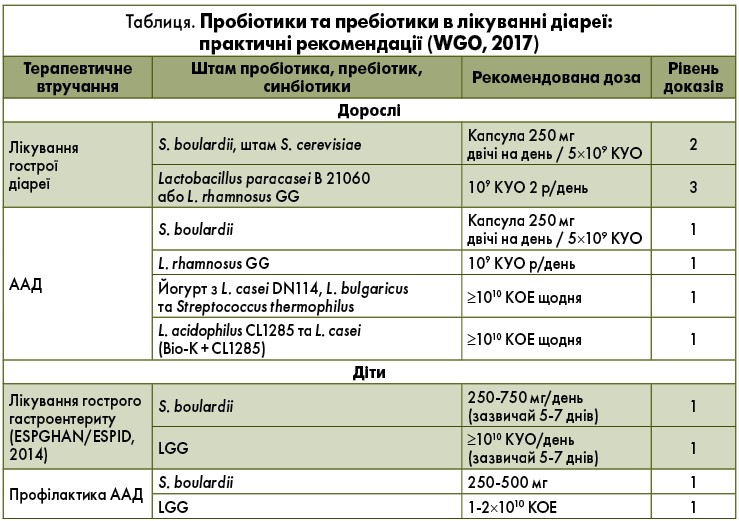 По состоянию на 27 марта 2016 г.
По состоянию на 27 марта 2016 г.
 Пробиотики могут помочь вернуть полезные бактерии в пищеварительную систему. Некоторые недавние обзоры научной литературы показали, что использование пробиотиков во время приема антибиотиков может быть эффективным для предотвращения диареи.
Пробиотики могут помочь вернуть полезные бактерии в пищеварительную систему. Некоторые недавние обзоры научной литературы показали, что использование пробиотиков во время приема антибиотиков может быть эффективным для предотвращения диареи. Если у вас раньше был понос при приеме антибиотиков, сообщите об этом врачу. Они могут прописать антибиотик, который с меньшей вероятностью вызовет эту проблему.
Если у вас раньше был понос при приеме антибиотиков, сообщите об этом врачу. Они могут прописать антибиотик, который с меньшей вероятностью вызовет эту проблему.