Низкий уровень лимфоцитов в крови указывает на повышенный риск смерти
https://ria.ru/20200113/1563357352.html
Низкий уровень лимфоцитов в крови указывает на повышенный риск смерти
Низкий уровень лимфоцитов в крови указывает на повышенный риск смерти
Датские ученые выяснили, что низкий уровень лимфоцитов в крови указывает на повышенный риск преждевременной смерти. Результаты исследования опубликованы в… РИА Новости, 13.01.2020
2020-01-13T11:42
2020-01-13T11:42
2020-01-13T11:42
наука
долголетие
здоровье
открытия — риа наука
дания
копенгаген
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn24.img.ria.ru/images/156085/52/1560855269_0:0:2000:1125_1920x0_80_0_0_c3f670c83b0aaed1053af4154fc0956a.jpg
МОСКВА, 13 янв — РИА Новости. Датские ученые выяснили, что низкий уровень лимфоцитов в крови указывает на повышенный риск преждевременной смерти.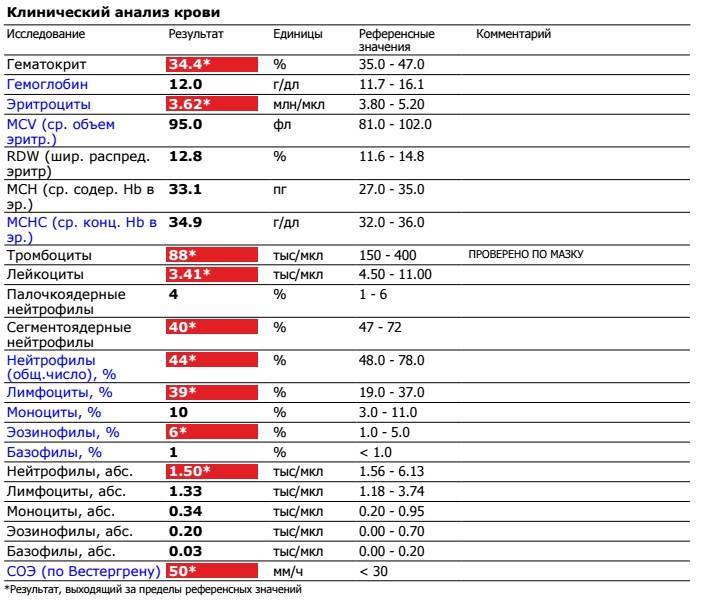 Результаты исследования опубликованы в журнале Canadian medical association journal. Лимфоциты – клетки крови из группы лейкоцитов, отвечающие за сопротивляемость организма. Это клетки иммунной системы, являющиеся первой преградой на пути распространения различных болезней, в том числе рака.Повышенный уровень лимфоцитов в крови отмечается, когда человек чем-то заражен и организм борется с вирусом или инфекцией, поэтому именно увеличение количества этих клеток традиционно является предметом для беспокойства.Недавнее исследование датских ученых показало, что внимательно стоит относиться не только к высокому, но и к низкому уровню лимфоцитов. Лимфопения — уменьшение концентрации лимфоцитов в крови может быть ранним предупреждением о повышенной уязвимости организма к различным инфекциям и значительном увеличении риска смертности.Низкий уровень лимфоцитов легко выявляется во время обычных анализов крови, но пациенты обычно не направляются на дальнейшее обследование, потому что значение лимфопении как предиктора будущих заболеваний не было известно.
Результаты исследования опубликованы в журнале Canadian medical association journal. Лимфоциты – клетки крови из группы лейкоцитов, отвечающие за сопротивляемость организма. Это клетки иммунной системы, являющиеся первой преградой на пути распространения различных болезней, в том числе рака.Повышенный уровень лимфоцитов в крови отмечается, когда человек чем-то заражен и организм борется с вирусом или инфекцией, поэтому именно увеличение количества этих клеток традиционно является предметом для беспокойства.Недавнее исследование датских ученых показало, что внимательно стоит относиться не только к высокому, но и к низкому уровню лимфоцитов. Лимфопения — уменьшение концентрации лимфоцитов в крови может быть ранним предупреждением о повышенной уязвимости организма к различным инфекциям и значительном увеличении риска смертности.Низкий уровень лимфоцитов легко выявляется во время обычных анализов крови, но пациенты обычно не направляются на дальнейшее обследование, потому что значение лимфопении как предиктора будущих заболеваний не было известно.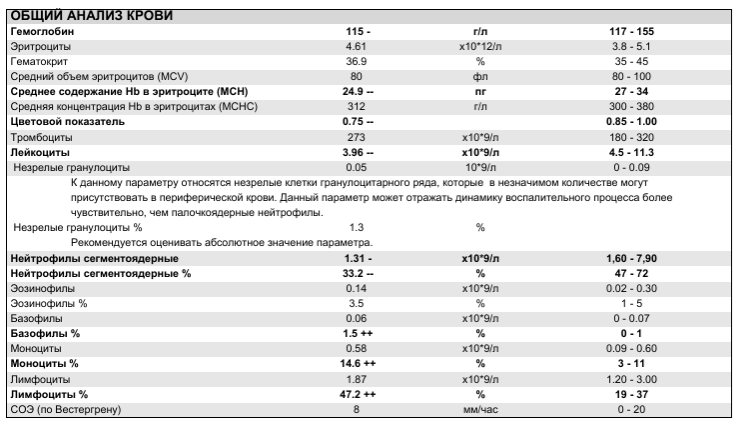 В исследование, которое проводилось в Копенгагене в период с 2003 по 2015 год, были включены 108 135 человек в возрасте от 20 до 100 лет (средний возраст — 68 лет). За исследуемый период умерли 10 372 человека.При обработке результатов учитывались поправки на возраст, пол, потребление табака и алкоголя, массу тела, а также такие параметры, как C-реактивный белок плазмы, количество нейтрофилов в крови, недавние инфекции, диабет, систолическое артериальное давление, холестерин в плазме, триглицериды в плазме, образование, доход и физическая активность.Результаты показали, риск смертности от всех причин у пациентов с низким уровнем лимфоцитов был на 60 процентов выше, чем у людей с нормальным уровнем. В 1,5-2,8 раза у них был повышен риск смерти от рака, сердечно-сосудистых, респираторных заболеваний, и различных инфекций.»Участники с лимфопенией имели высокий риск умереть от любой причины, независимо от других факторов риска смертности, включая возраст», — приводятся в пресс-релизе Канадской медицинской ассоциации слова руководителя исследования Стига Божесена (Stig Bojesen) из Копенгагенского университета.
В исследование, которое проводилось в Копенгагене в период с 2003 по 2015 год, были включены 108 135 человек в возрасте от 20 до 100 лет (средний возраст — 68 лет). За исследуемый период умерли 10 372 человека.При обработке результатов учитывались поправки на возраст, пол, потребление табака и алкоголя, массу тела, а также такие параметры, как C-реактивный белок плазмы, количество нейтрофилов в крови, недавние инфекции, диабет, систолическое артериальное давление, холестерин в плазме, триглицериды в плазме, образование, доход и физическая активность.Результаты показали, риск смертности от всех причин у пациентов с низким уровнем лимфоцитов был на 60 процентов выше, чем у людей с нормальным уровнем. В 1,5-2,8 раза у них был повышен риск смерти от рака, сердечно-сосудистых, респираторных заболеваний, и различных инфекций.»Участники с лимфопенией имели высокий риск умереть от любой причины, независимо от других факторов риска смертности, включая возраст», — приводятся в пресс-релизе Канадской медицинской ассоциации слова руководителя исследования Стига Божесена (Stig Bojesen) из Копенгагенского университета.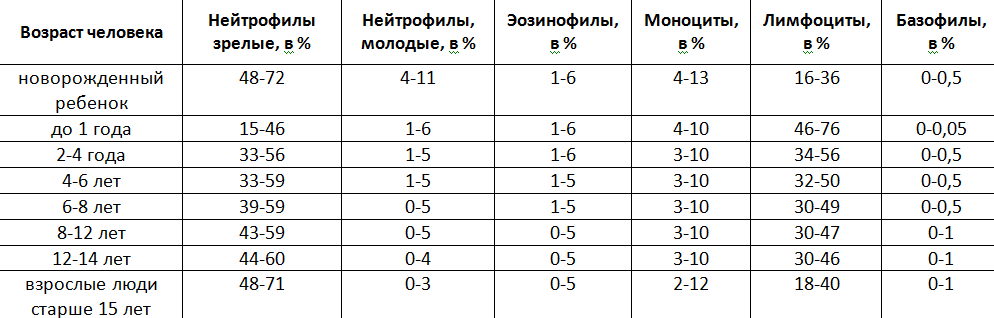 Связь между лимфопенией и повышенной смертностью объясняется тем, что при этом заболевании снижается сопротивляемость организма при потенциально опасных для жизни заболеваниях. Особенно это критично для людей пожилого возраста, у которых количество лимфоцитов и так понижено.
Связь между лимфопенией и повышенной смертностью объясняется тем, что при этом заболевании снижается сопротивляемость организма при потенциально опасных для жизни заболеваниях. Особенно это критично для людей пожилого возраста, у которых количество лимфоцитов и так понижено.
https://ria.ru/20190420/1552884422.html
https://ria.ru/20180523/1521124988.html
дания
копенгаген
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
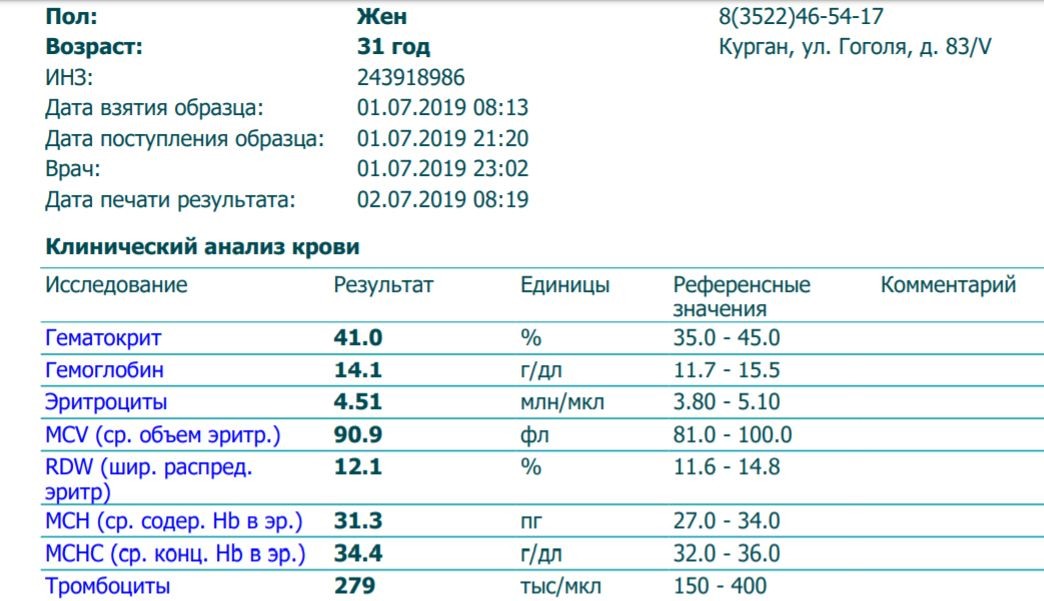
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
долголетие, здоровье, открытия — риа наука, дания, копенгаген
МОСКВА, 13 янв — РИА Новости. Датские ученые выяснили, что низкий уровень лимфоцитов в крови указывает на повышенный риск преждевременной смерти. Результаты исследования опубликованы в журнале Canadian medical association journal.Лимфоциты – клетки крови из группы лейкоцитов, отвечающие за сопротивляемость организма. Это клетки иммунной системы, являющиеся первой преградой на пути распространения различных болезней, в том числе рака.
Повышенный уровень лимфоцитов в крови отмечается, когда человек чем-то заражен и организм борется с вирусом или инфекцией, поэтому именно увеличение количества этих клеток традиционно является предметом для беспокойства.
Недавнее исследование датских ученых показало, что внимательно стоит относиться не только к высокому, но и к низкому уровню лимфоцитов. Лимфопения — уменьшение концентрации лимфоцитов в крови может быть ранним предупреждением о повышенной уязвимости организма к различным инфекциям и значительном увеличении риска смертности.
Низкий уровень лимфоцитов легко выявляется во время обычных анализов крови, но пациенты обычно не направляются на дальнейшее обследование, потому что значение лимфопении как предиктора будущих заболеваний не было известно.
20 апреля 2019, 18:59НаукаУченые рассказали, как снизить риск смерти после инфаркта в пять разВ исследование, которое проводилось в Копенгагене в период с 2003 по 2015 год, были включены 108 135 человек в возрасте от 20 до 100 лет (средний возраст — 68 лет). За исследуемый период умерли 10 372 человека.
За исследуемый период умерли 10 372 человека.
При обработке результатов учитывались поправки на возраст, пол, потребление табака и алкоголя, массу тела, а также такие параметры, как C-реактивный белок плазмы, количество нейтрофилов в крови, недавние инфекции, диабет, систолическое артериальное давление, холестерин в плазме, триглицериды в плазме, образование, доход и физическая активность.
Результаты показали, риск смертности от всех причин у пациентов с низким уровнем лимфоцитов был на 60 процентов выше, чем у людей с нормальным уровнем. В 1,5-2,8 раза у них был повышен риск смерти от рака, сердечно-сосудистых, респираторных заболеваний, и различных инфекций.
«Участники с лимфопенией имели высокий риск умереть от любой причины, независимо от других факторов риска смертности, включая возраст», — приводятся в пресс-релизе Канадской медицинской ассоциации слова руководителя исследования Стига Божесена (Stig Bojesen) из Копенгагенского университета.
Связь между лимфопенией и повышенной смертностью объясняется тем, что при этом заболевании снижается сопротивляемость организма при потенциально опасных для жизни заболеваниях.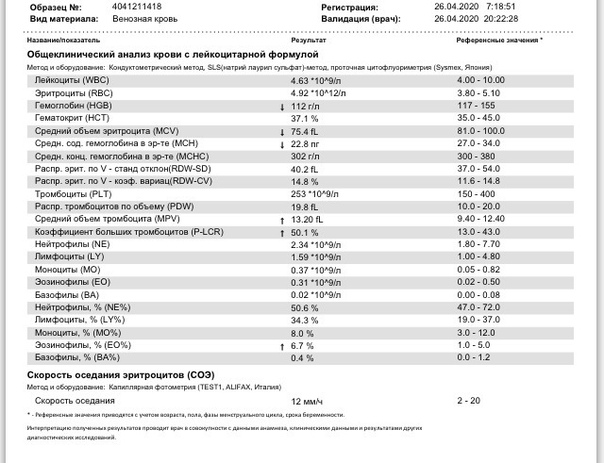 Особенно это критично для людей пожилого возраста, у которых количество лимфоцитов и так понижено.
Особенно это критично для людей пожилого возраста, у которых количество лимфоцитов и так понижено.
Анализ крови при орви
Когда у ребенка поднимается температура, появляется кашель и насморк, родители хотят быть уверены в том, что это обычное ОРВИ, а не бактериальная инфекция. Иногда им кажется, что точки над «и» расставит общий анализ крови — стоит его сдать, как сразу станет ясно, чем болен ребенок и нужно ли давать ему антибиотики. Однако это не совсем так. В некоторых случаях анализ крови действительно поможет врачу поставить диагноз, но чаще всего в нем нет никакой необходимости. Кроме того, полученный результат, где половина показателей выходит за границы нормы, только понапрасну пугает родителей. О том, почему не стоит спешить с анализом крови при первых симптомах болезни, рассказывает врач-педиатр Александра Жуковская.
Какие показатели могут меняться при инфекции?
В первую очередь меняется общее количество лейкоцитов — именно эти клетки занимаются защитой организма от вирусов и бактерий.
О чем говорят отклонения
При бактериальной инфекции обычно наблюдается:
- повышение количества лейкоцитов (лейкоцитоз) — более 15 × 10⁹/л;
- увеличение абсолютного* количества нейтрофилов — более 10 × 10⁹/л;
- сдвиг лейкоцитарной формулы влево — то есть появление незрелых (палочкоядерных) форм нейтрофилов — более 1,5 × 10⁹/л.

* Чтобы оценить абсолютное количество нейтрофилов, нужно знать общее число лейкоцитов и процент нейтрофилов. Например: лейкоцитов 9 × 10⁹/л, а нейтрофилы составляют 72%, что обычно уже выделено красным. Считаем: 9 × 72/100%, получаем 6,5 — то есть нормальное абсолютное количество нейтрофилов.
При вирусной инфекции обычно наблюдается:
- Снижение общего количества лейкоцитов (лейкопения) — особенно при гриппе, кори и др.
- Повышение абсолютного количества лимфоцитов (лимфоцитоз).
- Появление «атипичных» клеток — при инфекционном мононуклеозе.
Другой неспецифический признак воспаления — увеличение скорости оседания эритроцитов (СОЭ). Высокая СОЭ характерно как для вирусных, так и для бактериальных инфекций.
Что же тогда вызывает сложности?
Дело в том, что в первые дни болезни характерных изменений в общем анализе крови может еще не быть или наоборот — лейкоциты могут значительно «подскочить» и на банальную вирусную инфекцию, внося сомнения в диагноз.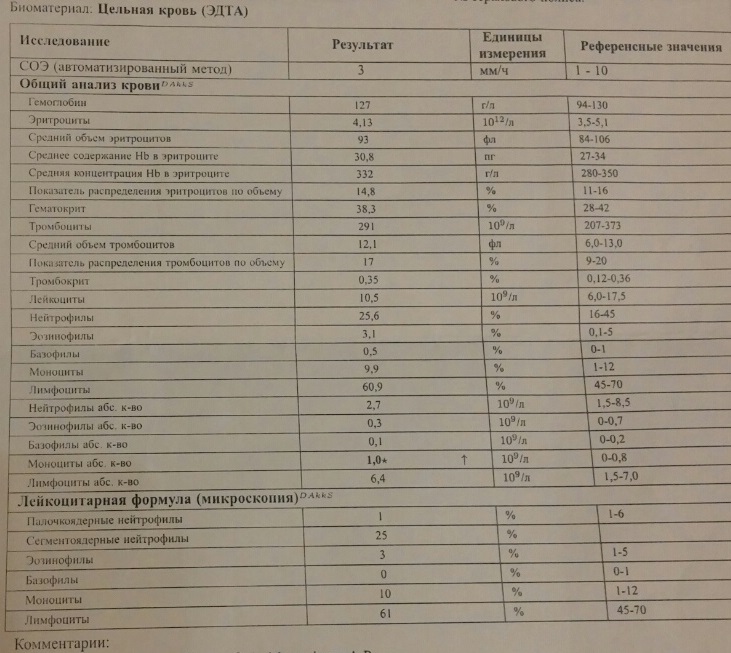
И наоборот, некоторые бактериальные заболевания протекают без отклонений в анализах крови — например, отит или атипичная пневмония, или даже с изменениями, характерными для вирусной инфекции — например, при коклюше наблюдается лимфоцитоз.
Подобных исключений довольно много, именно поэтому в начале болезни общий анализ крови не может быть универсальным методом диагностики — врач получит намного больше информации во время тщательного осмотра ребенка.
А как еще можно уточнить диагноз?
Если врач подозревает стрептококковую ангину или грипп — проводится стрептатест или экспресс-тест на грипп. Доступны методы обнаружения многих вирусов в слюне, выделениях из носа и др. Для исключения пневмонии показана рентгенография грудной клетки. При подозрении на инфекцию мочевых путей применяют мочевые тест-полоски и проводят анализы мочи.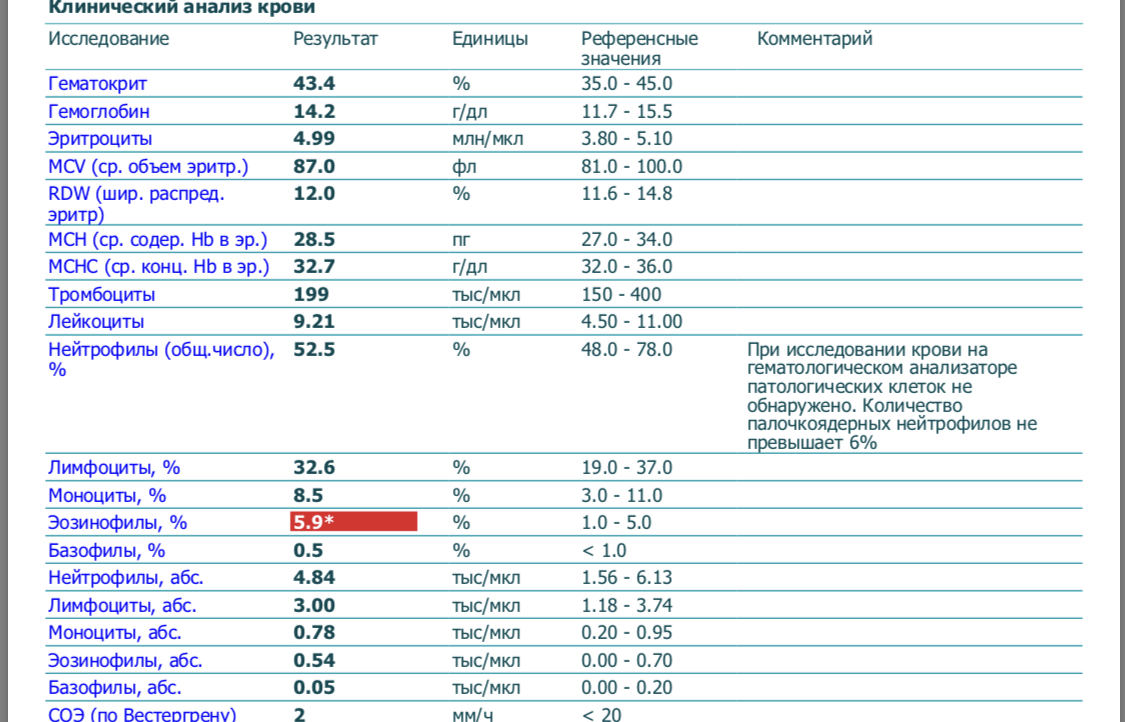
Не проще ли сразу дать антибиотик?
Нет.
- Антибиотики неэффективны против вирусов и не могут служить профилактикой бактериальных осложнений — зато с этим справляется вакцинация против пневмококка и других бактериальных инфекций.
- Антибактериальная терапия нарушает жизнедеятельность нормальной микрофлоры, участвующей в защите от чужих и опасных микроорганизмов.
- Прием антибиотиков без показаний приводит к антибиотикорезистентности — устойчивости бактерий. Это значит, что в следующий раз, когда антибиотик действительно понадобится, он уже не будет страшен для бактерий, и заболевание будет сложнее вылечить.

- При некоторых вирусных инфекциях (например при инфекционном мононуклеозе) назначение широко используемых антибиотиков пенициллинового ряда приводит к появлению сыпи. Это часто трактуют как аллергическую реакцию, хотя противопоказаний для дальнейшего использования этой группы антибиотиков у ребенка нет.
- У всех лекарств, включая антибактериальные препараты, есть побочные эффекты. Польза от любого вмешательства должна быть больше, чем потенциальный вред — не стоит нарушать это правило, давая антибиотики “на всякий случай”.
Показатели крови при коронавирусе, анализы при коронавирусе, как лечить коронавирус на начальной стадии, восстановление после коронавируса | НГС
Недавно, например, у меня был пациент в возрасте 35–40 лет, два года назад перенесший пневмонию. Когда он заболел коронавирусом, то у него возникло матовое стекло, которое было видно по снимкам легких. Я посмотрела снимки его легких, сделанные два года назад: оказалось, что практически в тех же местах повторился воспалительный процесс.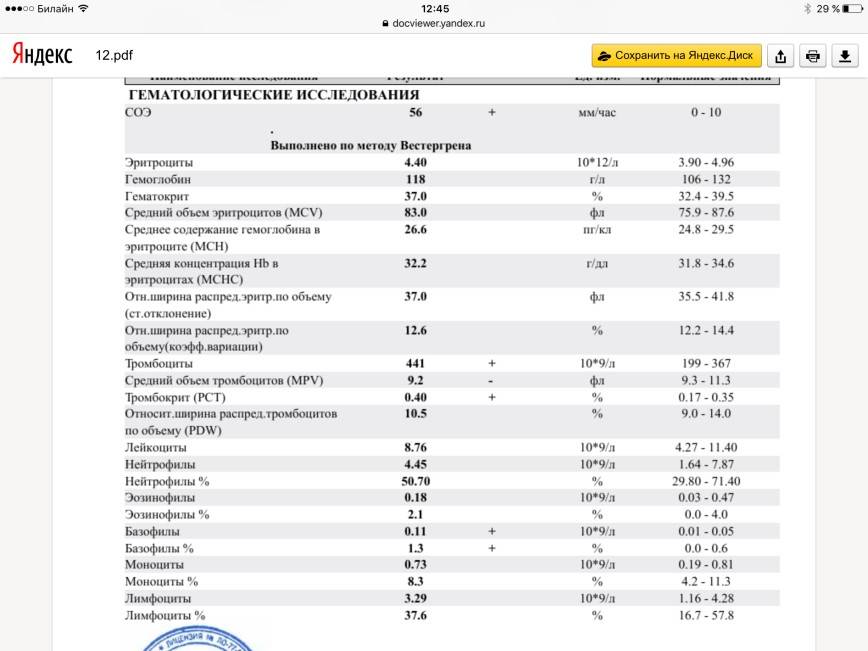 Мы начали разбираться и поняли, что, видимо, тогда не было восстановительного периода. Хотя вообще-то после пневмонии тоже нужно длительное восстановление на клеточном уровне — не зря же придуманы дыхательные упражнения, чтобы усиливать кровоток, снимать лимфостаз. К сожалению, не все пациенты относятся к этому сознательно.
Мы начали разбираться и поняли, что, видимо, тогда не было восстановительного периода. Хотя вообще-то после пневмонии тоже нужно длительное восстановление на клеточном уровне — не зря же придуманы дыхательные упражнения, чтобы усиливать кровоток, снимать лимфостаз. К сожалению, не все пациенты относятся к этому сознательно.
— Про дыхательные упражнения сначала говорили, что их нужно делать всем, потом стали акцентировать внимание на консультации специалиста и необходимости рассчитывать нагрузку. Что вы думаете по этому поводу?
— Я дыхательную гимнастику люблю нежной любовью, потому что она действительно имеет под собой не одно десятилетие, она не появилась сейчас в эпидемию коронавируса или несколько лет назад в эпидемию гриппа. Люди пользовались ею годами, она имела терапевтический эффект. Всегда нужно отталкиваться от тяжести течения коронавирусной инфекции: если пациент приходит ко мне после стационара с кожей приятного зеленоватого оттенка, я не скажу ему: «Включай видео на 26 минут, вставай и делай». Я понимаю, что это нереально.
Я понимаю, что это нереально.
Я предпочитаю видео с дыхательной гимнастикой, предупреждаю пациентов, что ее можно делать как стоя, так и сидя. Возможны головокружения. Не нужно делать до последнего: если закружилась голова даже через две минуты от начала занятий, то всё равно лучше прерваться и продолжить на следующий день.
Чем больше у пациента процент поражения легких, тем медленнее стоит увеличивать интенсивность, потому что в этом случае лучшее — враг хорошего. Надувать шарики и дуть через соломинку в банку с водой тоже эффективно, но лучше, когда больше упражнений.
— Читатель спрашивает о восстановлении после 60–65 лет: какое оно и есть ли какие-то ограничения? Все ли комплексы можно делать в этом возрасте?
— Конечно, есть ограничения у старшей возрастной группы — у пациентов 65+. Обычно они уже имеют особенности организма, ряд хронических заболеваний, принимают лекарственные препараты на постоянной основе. Выбирая физиотерапевтические, восстановительные процедуры, нужно отталкиваться от этого.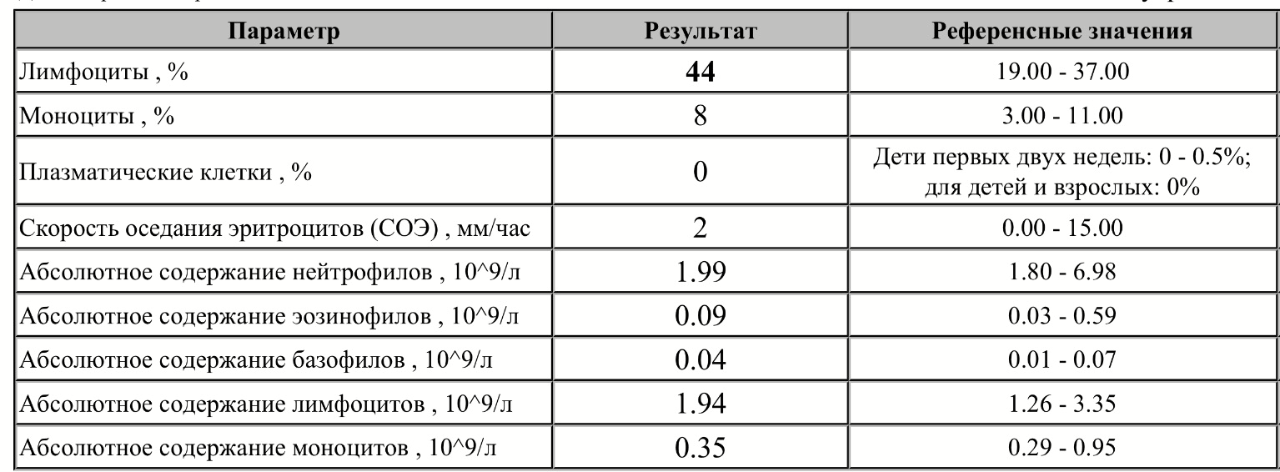 Мы об этом говорили. Должен быть обязательно подбор.
Мы об этом говорили. Должен быть обязательно подбор.
Например, в любимой всеми соляной пещере несколько понижается артериальное давление. Если в нее придет пациент с подобранной гипотензивной терапией с давлением 120 на 70 и давление у него снизится, то для гипертоника понижение давления не очень комфортно. Поэтому нужно основываться на противопоказаниях физиотерапии. Иногда некоторым пациентам мы не можем предложить такой вид лечения, и это нормально.
Еще три интересных текста
На НГС есть специальная рубрика «Разговоры с врачами» — в прямом эфире мы разговариваем со специалистами на важные и интересные темы, а потом публикуем стенограмму беседы.
Гадание по анализам. Часть II / Новости общества Красноярска и Красноярского края / Newslab.Ru
Продолжим разговор об интерпретации результатов развернутого анализа крови.
Помимо показателей, характеризующих состояние эритроцитов, анализ крови дает представление о том, сколько в ней содержится и других форменных элементов — то есть лейкоцитов и  Последние характеризуют способность крови к нормальному свертыванию. Значимое отклонение от нормы этого показателя в любую сторону — очень настораживающее явление, которое требует обязательной консультации у гематолога. Кстати, появление на коже маленьких подкожных кровоизлияний или даже синяков, никак не связанных с ушибами, — однозначный повод сдать общий анализ крови, а также анализ свертывающей системы крови. Эта же рекомендация дается и тем, у кого долго не останавливается кровь из ссадин и мест уколов, а также людям с частыми носовыми кровотечениями.
Последние характеризуют способность крови к нормальному свертыванию. Значимое отклонение от нормы этого показателя в любую сторону — очень настораживающее явление, которое требует обязательной консультации у гематолога. Кстати, появление на коже маленьких подкожных кровоизлияний или даже синяков, никак не связанных с ушибами, — однозначный повод сдать общий анализ крови, а также анализ свертывающей системы крови. Эта же рекомендация дается и тем, у кого долго не останавливается кровь из ссадин и мест уколов, а также людям с частыми носовыми кровотечениями.
Лейкоциты — показатель, которому уделяется больше всего места на бланке развернутого анализа крови. Эти форменные элементы (их иногда называют белыми кровяными тельцами) выполняют очень много функций, поэтому гематологи подсчитывают не только их общее количество, но и процентное соотношение каждой их разновидности. Поговорим об этом подробнее.
Увеличение общего количества лейкоцитов называют лейкоцитозом. Чаще всего это явление связано с каким-либо воспалительным процессом в организме. Основная функция лейкоцитов — борьба с инфекцией, поэтому в ответ на любое «вторжение» чужеродного агента, количество белых клеток в периферической крови резко возрастает. Необычайно высокое (к примеру, до 50 * 10
Основная функция лейкоцитов — борьба с инфекцией, поэтому в ответ на любое «вторжение» чужеродного агента, количество белых клеток в периферической крови резко возрастает. Необычайно высокое (к примеру, до 50 * 10
Лейкоциты имеют 6 основных разновидностей, встречающихся у здоровых людей. Самое малочисленные из них — это базофилы и эозинофилы. Эти два вида клеток отвечают за аллергические реакции и иммунный ответ на присутствие в организме паразитов. Если базофилы или эозинофилы повышены — это повод для консультации у врача-аллерголога. Следующая группа лейкоцитов, представленная в лейкоцитарной формуле (процентном соотношении разных видов белых кровяных телец) — это  Нейтрофилы по степени зрелости делят на юные, палочкоядерные и сегментоядерные. Под термином «сдвиг лейкоцитарной формулы влево» подразумевают увеличение количество «молодых» (т.е. юных и палочкоядерных) форм, что говорит об активном иммунном процессе в организме. По аналогии с ситуацией во время войны, когда армия несет большие потери, и требуется постоянный приток новобранцев. В некоторых случаях встречается и «сдвиг лейкоцитарной формулы вправо», а также ситуация, когда возрастает исключительно содержание палочкоядерных форм нейтрофилов. Важно обращать внимание на эти явления и просить врача объяснить их.
Нейтрофилы по степени зрелости делят на юные, палочкоядерные и сегментоядерные. Под термином «сдвиг лейкоцитарной формулы влево» подразумевают увеличение количество «молодых» (т.е. юных и палочкоядерных) форм, что говорит об активном иммунном процессе в организме. По аналогии с ситуацией во время войны, когда армия несет большие потери, и требуется постоянный приток новобранцев. В некоторых случаях встречается и «сдвиг лейкоцитарной формулы вправо», а также ситуация, когда возрастает исключительно содержание палочкоядерных форм нейтрофилов. Важно обращать внимание на эти явления и просить врача объяснить их.
Еще одна разновидность лейкоцитов, отмеченная в анализе крови — моноциты. Это крупные клетки, способные к фагоцитозу — то есть поглощению чужеродных частиц. Их содержание в крови, как правило, постоянно, а увеличение процентного соотношения говорит об инфекционном процессе.
Лимфоциты — еще одна разновидность лейкоцитов, также отвечающая за иммунитет.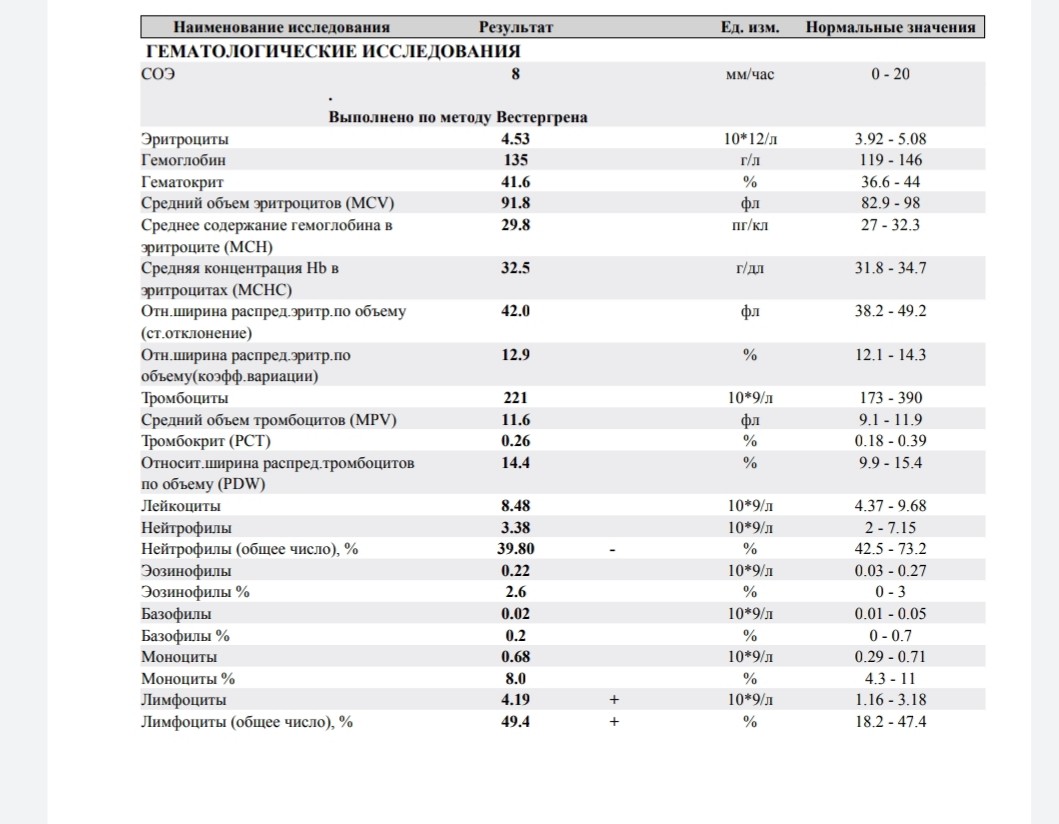 Их количество может варьироваться, и важно различать абсолютное и относительное изменение содержания лейкоцитов в анализе крови. Если речь идет о процентном соотношении, то такие колебания могут быть связаны с другими показателями (например, относительный лейкоцитоз при уменьшении количества нейтрофилов). Если же количество лимфоцитов достоверно повышается или понижается — нужно искать причину этого явления. К примеру, резкое увеличение количества этих клеток, влекущее за собой общее увеличение лейкоцитов — признак хронического лимфолейкоза, онкологического заболевания крови.
Их количество может варьироваться, и важно различать абсолютное и относительное изменение содержания лейкоцитов в анализе крови. Если речь идет о процентном соотношении, то такие колебания могут быть связаны с другими показателями (например, относительный лейкоцитоз при уменьшении количества нейтрофилов). Если же количество лимфоцитов достоверно повышается или понижается — нужно искать причину этого явления. К примеру, резкое увеличение количества этих клеток, влекущее за собой общее увеличение лейкоцитов — признак хронического лимфолейкоза, онкологического заболевания крови.
Небольшие колебания уровня лимфоцитов могут быть связаны с реакцией организма на бактериальные или вирусные заболевания. Уточнить причины таких изменений может помочь иммунограмма.
Помимо вышеуказанных видов лейкоцитов в анализе крови могут появляться и другие — промиелоциты, метамиелоциты, бластные клетки… Само их наличие в периферическом кровяном русле — безусловная патология, что требует скорейшей консультации у гематолога.
Важно помнить, что на содержание лейкоцитов большое влияние оказывает прием различных препаратов. Часто развернутый анализ крови назначают как раз для того, чтобы оценить побочный эффект от лечения. Поэтому не забудьте рассказать врачу о том, какие лекарства вы принимаете, возможно, это окажется существенным для интерпретации вашего анализа.
Ну, и последний показатель, на который стоит обратить внимание. Это — скорость оседания эритроцитов (СОЭ), которую на старых бланках иногда обозначают как «РОЭ» (реакция оседания эритроцитов). Изменение этой скорости может говорить о многом — и о количестве и свойствах самих эритроцитов, и о среде (то есть плазме крови и других форменных элементах), в которых они оседают. Чаще всего повышение СОЭ — признак инфекции в организме, однако также это явление может быть связано и с онкологическим заболеванием, значительным уменьшением количества эритроцитов (анемией), беременностью у женщин, недостатком белка в организме и многими другими явлениями.
Заключение о результате анализа, разумеется, выносится и на основании жалоб и общего самочувствия больного. Так некоторые физиологические процессы могут объяснить даже значительные отклонения от нормальных показателей крови. Главное, что развернутый анализ крови способен дать представление о состоянии здоровья человека в целом без сложных диагностических обследований. Поэтому — не избегайте возможности подставить палец под иголку лаборанта! В награду за дискомфорт вы получите немало полезных сведений о себе.
Ольга Дарсавелидзе
Нейтрофіли та онкогенез
Резюме. В огляді наведено дані про роль нейтрофілів периферичної крові і нейтрофілів, які інфільтрують пухлини, у протипухлинних та пухлиностимулюючих процесах, які відбуваються при розвитку багатьох видів раку. Наведено характеристику двох основних фенотипів Н1 і Н2 клітин, обговорюються їх функції і механізми переходу від Н1 клітин з протипухлинною активністю в Н2 клітини, які стимулюють проліферацію пухлинних клітин, ангіогенез і метастазування. Наведено дані про функціонально важливі цитокіни та хемокіни, що виділяються пухлинними клітинами, мікрооточенням, лімфоцитами і самими нейтрофілами, які стимулюють вироблення кістковим мозком нейтрофілів і спричиняють накопичення цих клітин у пухлинному вогнищі, розвиток нейтрофілії в крові. Описано основні функціональні молекули нейтрофілів, такі як нейтрофільна еластаза, катепсин, матриксна металопротеїназа-9, аргіназа 1 та ін., з якими зв’язуються протуморогенні властивості Н2 нейтрофілів. Багато процесів, викликані як Н1, так і Н2 нейтрофілами, ще недостатньо вивчені. Коротко зазначається про існування сьогодні багатьох підходів до генерації та активації нейтрофілів з протипухлинними властивостями і гальмування нейтрофілів, які стимулюють ріст пухлин.
Резюме. В обзоре приведены данные о роли нейтрофилов периферической крови и нейтрофилов, инфильтрирующих опухоли, в противоопухолевых и опухольстимулирующих процессах, которые происходят при развитии многих видов раков. Приведена характеристика двух основных фенотипов Н1 и Н2 клеток, обсуждаются их функции и механизмы перехода от Н1 клеток с противоопухолевой активностью в Н2 клетки, стимулирующие пролиферацию опухолевых клеток, ангиогенез и метастазирования. Представлены данные о функционально важных цитокинах и хемокинах, выделяемых опухолевыми клетками, микроокружением, лимфоцитами и самими нейтрофилами, которые стимулируют выработку костным мозгом нейтрофилов и обусловливают накопление этих клеток в опухолевом очаге, развитие нейтрофилии в крови. Приведены основные функциональные молекулы нейтрофилов, такие как нейтрофильная эластаза, катепсин, матриксная металлопротеиназа-9, аргиназа 1 и др., с которыми связывают протуморогенные свойства Н2 нейтрофилов. Многие процессы, вызываемые в опухолевом очаге как Н1, так и Н2 нейтрофилами, еще не до конца изучены. Кратко отмечается о существовании сегодня многих подходов к генерации и активации нейтрофилов с противоопухолевыми свойствами и подавлению опухольстимулирующих нейтрофилов.
Получено 09.02.2018
Принято в печать 16.03.2018
Введение
Общеизвестно, что нейтрофилы являются наиболее распространенными лейкоцитами крови и считаются первой линией защиты при воспалении и инфекциях [1]. Проникшие в организм микроорганизмы вызывают воспалительную реакцию, которая привлекает нейтрофилы из кровообращения в ткани. Там нейтрофилы разрушают микроорганизм с помощью ряда механизмов, главным образом за счет фагоцитоза, высвобождения противомикробных веществ и образования внеклеточных ловушек нейтрофилов [1, 2]. Активированные нейтрофилы также выделяют различные протеиназы в окружающую ткань, вызывая повреждения возбудителей и зачастую собственных тканей [3]. Кроме того, нейтрофилы способны продуцировать множество цитокинов и хемокинов, которые могут влиять на воспалительную реакцию, а также иммунный ответ организма [4, 5].
Помимо этой классической роли нейтрофилов в антимикробной защите, также выявлено накопление нейтрофилов во многих типах опухолей. Первоначально считалось, что эти связанные с опухолью нейтрофилы (опухольинфильтрирующие нейтрофилы — ОН) являются простыми свидетелями, потому что трудно представить, что нейтрофилы, будучи короткоживущими клетками, могут влиять на такое хроническое и прогрессирующее заболевание, как рак. Однако в последнее время стало известно, что ОН играют важную роль при злокачественных новообразованиях. Этот частично объясняется признанием того, что развитие воспаления, с одной стороны, в организме связано с нейтрофилами, а с другой, является важной характеристикой многих опухолей [6, 7]. Показано, что нейтрофилы могут быть активными эффекторными клетками с противоопухолевыми функциями [8]. Различные противомикробные и цитотоксические соединения, содержащиеся в их гранулах, могут разрушать злокачественные клетки, а цитокины и хемокины, секретируемые нейтрофилами, могут также активировать другие клетки с противоопухолевой активностью [5, 7, 9].
Однако большее число клинических наблюдений и лабораторных исследований показали, что наличие нейтрофилов в опухолях часто коррелирует с плохим прогнозом. Это хорошо доказано при целом ряде опухолей, в частности при бронхоальвеолярной карциноме [10], почечно-клеточной карциноме [12] и плоскоклеточной карциноме головы и шеи [13], а также меланоме [11]. Во всех этих случаях нейтрофилы проявляют другой фенотип, который может быть неблагоприятным для исхода заболевания. Механизмы формирования и реализации этого фенотипа нейтрофилов только начинают выяснять, но предполагается, что некоторые из них связаны с генотоксичностью, ангиогенезом и иммуносупрессией [8]. Следовательно, ОН могут быть полезны или вредны для хозяина [14]. Эти два типа нейтрофилов, четко описанные у мышей, были названы Н1 и Н2 [15] подобно противоопухолевым и опухольстимулирующим макрофагам (М1 и М2) [16]. Положение о том, что нейтрофилы могут являться действительно важными клетками в развитии рака у человека, детально обсуждается в ряде обзоров [16–18].
Стимуляция образования нейтрофилов. У многих пациентов с распространенным раком выявлены повышенные уровни нейтрофилов в крови. Как опухоли индуцируют нейтрофилию, окончательно неизвестно, но синтез опухолевыми клетками гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), возможно, является одним из механизмов стимуляции продукции нейтрофилов костным мозгом [19]. Кроме того, и другие цитокины, такие как интерлейкин (IL)-1 и IL-6, продуцируемые также опухолями, по-видимому, способствуют увеличению числа нейтрофилов в крови [7, 20]. Эта нейтрофилия связана с плохим прогнозом при нескольких типах рака, таких как рак легкого, меланома и почечная карцинома [11, 21, 22]. В соответствии с этим наличие большого количества нейтрофилов в определенных типах опухолей также является показателем неблагоприятного прогноза. Поскольку нейтрофилия в крови часто ассоциируется с воспалительными реакциями на инфекцию и повреждение тканей, то в опухолевом очаге она представляет собой одно из доказательств концепции о роли воспаления в онкогенезе и индуцированного им прогрессирования роста опухоли [7].
Предполагается, что отношение числа нейтрофилов в крови к другим типам лейкоцитов служит фактором прогноза для больных раком. Так, например, отношение нейтрофилов к лимфоцитам (НЛО) было введено как прогностический фактор для больных колоректальным раком [25]. Из-за своей простоты определения НЛО показало, что является легкодоступным и недорогим биомаркером для многих типов опухолей, включая немелкоклеточный рак легкого [26], гепатоцеллюлярную карциному [24], карциному носоглотки [27], колоректальный рак [26], меланому [11] и рак грудной железы [28, 29]. Высокий уровень НЛО коррелирует с неблагоприятной общей выживаемостью при многих солидных опухолях [30–32].
В то же время, несмотря на данные многих исследований, часть которых упомянута выше, нейтрофилия (большее количество нейтрофилов в крови как следствие повышенного выхода клеток из костного мозга) не всегда является плохим показателем прогрессирования рака. При некоторых типах опухолей, например раке желудка, повышенный уровень нейтрофилов в крови сопряжен с положительным прогнозом [33]. Это означает, что нейтрофилы могут в некоторых случаях контролировать развитие рака. Способность нейтрофилов непосредственно убивать опухолевые клетки как in vitro, так и in vivo зарегистрирована давно [34–36]. Также сообщалось, что нейтрофилы от животных с экспериментальными опухолями обладают повышенной цитотоксической активностью [7]. Нейтрофилы, выделенные из крови здоровых людей, оказывают прямое цитотоксическое действие на некоторые линии опухолевых клеток [40]. Таким образом, точная роль нейтрофилов в развитии опухолевого роста различных типов рака является спорным вопросом [7, 14, 37] и не до конца изученной, что требует дальнейших исследований.
Типы нейтрофилов. В дополнение к увеличенному количеству нейтрофилов в крови отмечено повышение уровня в крови незрелых миелоидных клеток на ранних стадиях дифференцировки, что выявлено в нескольких типах опухолей [38], включая пациентов с терминальной стадией рака легкого, грудной железы и желудочно-кишечного тракта [39]. Эти незрелые клетки костномозгового происхождения, представляющие гетерогенную популяцию, фенотипически разделяли на гранулоцитарные (G-MDSC) и моноцитарные (Mo-MDSC) подгруппы [40–42]. Их выявляют в большом количестве в селезенке экспериментальных животных с опухолями, где они представляют иммунодепрессивный фенотип, что приводит к прогрессированию опухолей [43, 44]. G-MDSC характеризуются незрелой морфологией нейтрофилов и фенотипом CD33/CD11b/HLA-DR/CD15 у людей [45]. Они выявлены в периферической крови пациентов с глиобластомой [46], множественной миеломой, лимфомой Ходжкина [47], раком головы и шеи [48].
Эти G-MDSC могут осуществлять иммуносупрессию различными механизмами. Основной механизм включает в себя производство активных форм кислорода (АФК) при дыхательной вспышке этих клеток. У больных онкологического профиля пероксид водорода (H2O2), продуцируемый активированными гранулоцитами, снижал экспрессию CD3 цепи Т-клеточного рецептора и уменьшал выработку цитокинов Т-клетками пациентов [49]. Эти окисленные Т-клетки человека имели дефектный хемотаксис. Более того, АФК, продуцируемые MDSC, могут приводить к блокаде также CD8 T-клеток и с помощью другого механизма, в частности пероксинитрита [50].
Как отмечалось выше, в зависимости от фенотипа нейтрофилы можно классифицировать как Н1 или Н2 [15], и подобно инфильтрирующим опухоль макрофагам (M1) клетки Н1 проявляют провоспалительную и противоопухолевую функции. Напротив, клетки M2 и Н2 обладают протуморогенной активностью [16]. Установлено, что ОН отличаются от циркулирующих нейтрофилов, а также от G-MDSC в костном мозге и селезенке мышей. Мышиные CD11b/Ly6G нейтрофилы, выделенные из опухоли и активированные трансформирующим фактором роста бета (TGF-β), были гиперсегментированы и более цитотоксичны к опухолевым клеткам, экспрессировали более высокие уровни провоспалительных цитокинов [15]. Напротив, истощение этих нейтрофилов из крови угнетало рост опухоли и сопровождалось активацией внутриопухолевых CD8 Т-клеток [15]. В подтверждение идеи о разных фенотипах нейтрофилов проведены исследования на двух моделях рака у мышей (карцинома легкого Льюиса и мезотелиома AB12), у которых нейтрофилы были выявлены прежде всего на периферии опухолевого узла на ранних стадиях развития опухоли. Эти ОН были более цитотоксичны по отношению к опухолевым клеткам и продуцировали более высокие уровни фактора некроза опухоли альфа (TNF-α), NO и H2O2. Напротив, ОН на поздних стадиях развития этих опухолей уже не проявляли таких свойств и демонстрировали протуморогенный фенотип [51]. Эти результаты исследований свидетельствуют, что нейтрофилы, попадая в опухоль, со временем становятся клетками, способными стимулировать рост опухолей [51]. Следовательно, ОН, полученные от мышей с растущими опухолями, могут иметь как противоопухолевый (Н1), так и протуморогенный (Н2) фенотип, который способен поддерживать рост опухоли и подавлять противоопухолевые иммунные реакции [14, 37], зависящие от микроокружения опухоли [17].
Несмотря на эту классификацию ОН у мышей, природа и функция ОН, находящихся в опухолях человека, остаются еще малоизученными, но уже получены результаты, подтверждающие такое деление ОН. Так, в исследованиях биопсийного материала опухоли легкого человека ОН составляли 5–25% всех клеток в опухоли [65]. Эти ОН представляли активированный фенотип (CD62L/CD54) с экспрессией отчетливого репертуара рецепторов хемокинов, которые включали CCR5, CCR7, CXCR3 и CXCR4 [65]. Кроме того, ОН продуцировали большее количество провоспалительных факторов MCP-1, IL-8, MIP-1α и IL-6, чем нейтрофилы в крови. ОН также стимулировали пролиферацию Т-клеток и выделение интерферона-гамма (IFN-γ). Эти результаты показывают, что на ранних стадиях рака легкого ОН не являются иммунодепрессантами, а скорее всего стимулируют ответы Т-клеток [52]. В исследовании [53] изучена роль хронического воспаления, в частности IL-23 и IL-17, при раке толстой кишки человека. Авторы выявили, что врожденные γδT (γδT17) клетки являются основным клеточным источником IL-17 при колоректальном раке. Эти активированные клетки индуцировали клетки γδT17 секретировать IL-8, TNF-α и GM-CSF, что приводит к накоплению нейтрофилов в опухоли. Эти ОН характеризовались CD45/Lin/HLADR/CD11b/CD33/CD66b и имели типичную полиморфноядерную морфологию. Они были описаны как G-MDSC [66]. Эти ОН (G-MDSC) продуцировали намного больше аргиназы-1 (ARG1) и АФК, чем аутологичные нейтрофилы в крови, и ингибировали пролиферацию активированных аутологичных Т-клеток и продукцию IFN-γ [53]. Результаты приведенных исследований указывают, что и в опухолях человека могут быть нейтрофилы с двойной функцией. В ранних стадиях развития опухоли ОН, по-видимому, способны стимулировать противоопухолевые иммунные реакции, особенно Т-клеток [52], на поздних этапах роста опухоли ОН уже становятся иммунодепрессивными клетками [54]. Сегодня остается еще много неясных вопросов. Например, являются ли ОН в ранних стадиях роста опухолей незрелыми нейтрофилами с противоопухолевыми свойствами, или ОН — это зрелые нейтрофилы, которые меняют фенотип со временем при прогрессировании опухоли, как предполагают ряд исследователей [17, 51]. Уже идентифицировано несколько субпопуляций нейтрофилов в крови как мышей с опухолями, так и людей, больных раком, и описывается несколько вариантов взаимосвязей этих клеток в связи с прогрессированием рака [54]. Показано, что циркулирующие в крови нейтрофилы от животных с опухолями распределяли на субпопуляции (фракции) при разделении их в различных градиентах плотности фиколла. Одна субпопуляция состояла из «нормальных» нейтрофилов с высокой плотностью, которую выделяли на градиенте с высокой плотностью фиколла. Другая субпопуляция имела нейтрофилы с меньшей плотностью, которые находились вместе со слоем мононуклеарных лимфоидных клеток низкой плотности [55]. У здоровых мышей, не имеющих опухоли, большинство нейтрофилов были высокой плотности, а у животных с опухолями прогрессивно возрастало количество нейтрофилов с низкой плотностью, и они становились доминирующим типом нейтрофилов в циркуляции [54]. Эти нейтрофилы обладали меньшей цитотоксичностью и имели меньшую экспрессию различных хемокинов (CXCL1, CXCL2, CXCL10, CCL2 и CCL3) и хемокиновых рецепторов (CXCR2 и CCR5), что свидетельствовало о снижении их провоспалительных возможностей. Предполагается, что нейтрофилы с низкой плотность являются незрелыми нейтрофилами. Важно отметить, что TGF-β способен индуцировать трансформацию нейтрофилов с высокой плотностью от мышей с опухолями в нейтрофилы с низкой плотностью, и в то же время этот фактор не влиял на нейтрофилы крови животных без опухолей [54]. Это указывает на то, что для такого изменения ОН у животных с раком необходимы и другие стимулы, помимо TGF-β. На основании этих результатов авторы предложили гипотезу, согласно которой три субпопуляции нейтрофилов могут присутствовать в крови при раке: нормальные нейтрофилы высокой плотности, незрелые нейтрофилы низкой плотности (G-MDSC) и крупные зрелые нейтрофилы низкой плотности. Эти типы клеток обладают разной функциональностью и пластичностью. Так, нейтрофилы с высокой плотностью являются противоопухолевыми, а низкой — клетками, способными стимулировать рост опухоли [67], они могут изменяться под влиянием различных хемокинов и цитокинов в микроокружении опухоли [17].
Очевидно, высокий уровень нейтрофилов в опухоли происходит под действием нейтрофил-притягивающих хемокинов, которые могут продуцироваться не только иммунными клетками, но и опухолевыми клетками, в частности интерлейкином-8 (IL-8/CXCL8). Другим хемокином, который также участвует в рекрутировании нейтрофилов в опухоли, является хемокин GCP-2/CXCL6. В мышиной модели меланомы специфические моноклональные антитела против CXCL6 уменьшали количество ОН, а также размер опухоли [56]. Кроме того, из карциноматозных опухолей человека выделен и идентифицирован фактор ингибирования миграции (MIF), уровень которого был высокий в опухолях с бóльшим содержанием ОН и низкой выживаемостью этих пациентов [57]. Используя те же рецепторы CXCR1 и CXCR2, нейтрофилы могут также реагировать и на другие хемокины, такие как CXCL1, CXCL2, CXCL5, CXCL6 и CXCL7 [58]. Не исключено, что нейтрофилы активируют сами себя по механизму положительной обратной связи, высвобождая нейтрофильные хемокины, которые привлекают больше нейтрофилов в опухоль, подобно миграции нейтрофилов в очаги инфекции [59]. При исследовании 919 пациентов с гепатоцеллюлярной карциномой выявлено, что CXCL5 сверхэкспрессируется у пациентов с рецидивирующими опухолями, уровни CXCL5 коррелировали с большим накоплением в опухоли нейтрофилов и с меньшей общей выживаемостью [60]. В частности, известно, что активированные Т-клетки продуцируют GM-CSF, CXCL1, CXCL2, TNF-α и IFN-γ [59]. Эти факторы могут прямо или косвенно привлекать больше нейтрофилов к опухоли. Хотя конкретные механизмы влияния активированных Т-клеток на миграцию нейтрофилов в опухоль изучены недостаточно.
Нейтрофильные молекулы. Большой объем клинических данных показывает, что нейтрофилы участвуют в развитии рака и прогрессировании опухолей. В большинстве случаев увеличенное количество ОН ассоциируется с прогрессирующей болезнью и плохим прогнозом для больных онкологического профиля. Установлено, что такая отрицательная ассоциация характерна для ряда солидных опухолей, таких как меланома, гепатоцеллюлярная карцинома, немелкоклеточная карцинома легкого, глиома, аденокарцинома и рак толстой кишки [37, 61]. Предполагается, что в стимуляцию онкогенеза включаются те же молекулы, которые нейтрофилы используют для уничтожения микроорганизмов и модуляции воспаления [7]. Важными молекулами, которые могут влиять на темп роста и инвазивность опухолей, являются гранулярные белки, деградирующие в матриксе протеиназы, реактивные виды кислорода, хемокины и цитокины [7]. В последнее время появились сообщения, описывающие, как ОН используют эти молекулы для воздействия на пролиферацию опухолевых клеток, ангиогенез, метастазы и иммунный надзор. Среди этих молекул следует выделить такие, как нейтрофильная эластаза (NE), катепсин, матриксная металлопротеиназа (MMP)-9 и др.
NE представляет собой основной белок азурофильных гранул, который выделяется при клеточной дегрануляции нейтрофилов. NE — сериновая протеаза с широким спектром субстратов. Помимо своей роли в воспалении и уничтожении бактерий, NE проявляет различные протуморогенные эффекты как in vivo, так и in vitro [62]. Выявлено, что NE непосредственно стимулирует пролиферацию опухолевых клеток A459, когда мышиные нейтрофилы культивировали вместе с клеточной линией карциномы легкого [62, 63]. Кроме того, также установлено, что NE стимулирует миграцию опухолевых клеток. Нейтрофилы человека при культивировании с клетками аденокарциномы поджелудочной железы стимулировали миграцию клеток опухоли из монослоя. NE также повышала миграционную способность раковых клеток пищевода [64].
Катепсин G представляет собой пептидазу из азурофильных гранул, которая участвует в деградации фагоцитированных микроорганизмов и ремоделировании белков внеклеточного матрикса [98]. Кроме того, катепсин G может стимулировать ангиогенез и миграцию опухолевых клеток [65–67]. На модели метастазирования рака грудной железы в костную ткань также показано, что катепсин G усиливает передачу сигналов TGF-β и повышает уровень сосудистого эндотелиального фактора роста (VEGF) для стимуляции ангиогенеза [66].
MMP-9 — желатиназа B — высвобождается из вторичных (специфических) гранул и, как установлено, приводит к пролиферации опухолей кожи человека вирусом папилломы человека 16-го типа (HPV-16). Кроме того, иммуногистохимическое исследование MMP-9 в плоскоклеточных опухолях карциномы показало, что MMP-9 присутствовала только в опухолевых инфильтрирующих лейкоцитах, а не в самих опухолевых клетках. Показано, что MMP-9 ингибирует апоптоз опухолевых клеток при раке легкого [68]. Таким образом, ММП-9 ответственна за усиление роста опухоли как за счет увеличения пролиферации клеток, так и уменьшения их апоптоза. Другим важным эффектом MMP-9, который поддерживает рост опухоли, является ангиогенез. Протеолитическое высвобождение VEGF из тканевого матрикса при действии MMPs считается необходимым условием ангиогенеза in vivo [68, 69]. Ангиогенный эффект MMP-9 зарегистрирован в нескольких моделях рака — меланоме, аденокарциноме поджелудочной железы [70–72].
Прямое доказательство того, что нейтрофилы являются основным, ассоциированным с опухолью лейкоцитарным типом, экспрессирующим MMP-9, предоставлено в исследовании с использованием человеческих ксенотрансплантатов и сингенных опухолей в эксперименте на мышах [73]. Когда опухоли или изолированные из них макрофаги или нейтрофилы были дважды окрашены для выявления MMP-9 и соответствующих антигенов макрофагов или нейтрофилов, только ОН содержали большое количество MMP-9 [74, 75]. Кроме того, подсчитано, что 1•10 нейтрофилов в крови или ОН могут высвобождать приблизительно 100–200 нг проМMP-9 в течение 1–2 ч инкубации. Напротив, для макрофагов 1•10 потребуется несколько недель для получения такого же количества проММР-9 [73, 74]. Следовательно, MMP-9, полученная из нейтрофилов, ответственна за усиление ангиогенеза за счет высвобождения VEGF из внеклеточного матрикса, что отмечается при многих типах опухолей. С внеклеточным матриксом связывают и другие процессы онкогенеза, например метастазирование опухолей [75, 76].
Нейтрофилы являются эффективными производителями АФК для уничтожения микроорганизмов. АФК также может косвенно способствовать росту опухоли. Во-первых, нейтрофилы генерируют пероксид водорода (H2O2), который затем превращается в гипохлорид (HOCl) с помощью миелопероксидазы. HOCl затем может активировать несколько MMPs, включая MMP-2, -7, -8 и -9. Кроме того, HOCl может блокировать ингибитор МMP-1 и таким образом потенцировать протеолитическую активность MMPs [77, 78].
Выделенная из гранул нейтрофилов ARG1 способна разрушать внеклеточный аргинин, незаменимую аминокислоту для активации Т-клеток. Таким образом, дегрануляция нейтрофилов может оказывать иммуносупрессивный эффект в опухолях, ингибируя опухольинфильтрирующие Т-клетки таким же образом, как описано для G-MDSC [79]. Показано, что истощение ОН у опухольсодержащих животных увеличило число активированных CD8 T-клеток, способствовало уменьшению размера опухолей и удлиняло время жизни животных [15].
Нейтрофилы могут также продуцировать цитокины или факторы роста, которые увеличивают туморогенный потенциал раковых клеток [5]. Это пока что установлено для двух цитокинов — онкостатина-M [79–81] и для фактора роста гепатоцитов [10, 82, 83]. Раковые клетки грудной железы могут стимулировать нейтрофилы к выделению онкостатина-М, IL-6-подобного цитокина. Онкостатин-М, в свою очередь, стимулировал клетки рака грудной железы секретировать VEGF [84]. Аналогично, клетки гепатоцеллюлярной карциномы стимулировали нейтрофилы высвобождать фактор роста гепатоцитов (HGF). В свою очередь, этот фактор стимулировал инвазивный рост опухолевых клеток [85].
Нейтрофилы также могут влиять на миграционный потенциал раковых клеток. При нескольких типах рака показано, что нейтрофилы способствуют метастазированию плоскоклеточного рака кожи [86], меланомы [87], аденокарциномы [88] и рака грудной железы [89]. Способ, которым нейтрофилы повышают миграционную активность опухолевых клеток, может включать несколько различных механизмов. Циркулирующие опухолевые клетки непосредственно прилипают к сосудистому эндотелию, приводя к экстравазации для создания новых метастазов. В месте образования метастатического очага клетками рака легкого отмечалась их тесная связь с нейтрофилами [90]. В этом процессе нейтрофилы усиливают задержку опухолевых клеток, и, как следствие, возникает больше метастазов [91]. Показано прямое взаимодействие между клетками нейтрофилов и клетками карциномы грудной железы путем взаимодействия молекул адгезии ICAM-1 в опухолевых клетках и β2-интегринов на нейтрофилах. Нейтрофилы связывали опухолевые клетки с участием интегринов и индуцировали кластеризацию ICAM-1 в опухолевой клетке [91]. Это активировало в опухолевой клетке сигнальный путь с участием фокальной адгезии киназы (FAK) и p38-MAPK, что привело к усиленной миграции [89]. Вследствие этого повышенная миграция, как показано in vivo, приводила к увеличению количества метастазов в печени [92]. Раковые клетки непосредственно прикреплялись поверх адгезированных нейтрофилов, которые выступали в качестве мостика при взаимодействии между опухолевыми клетками и паренхимой печени, что ускоряло развитие метастазов [93].
Несмотря на большое количество доказательств отрицательной роли нейтрофилов во время прогрессирования опухоли, имеются также четкие свидетельства положительной роли нейтрофилов в канцерогенезе. Как упоминалось ранее, нейтрофилы могут проявлять противоопухолевую активность в различных формах. Фактически, противоопухолевая способность нейтрофилов установлена давно, более трех десятилетий назад. Нейтрофилы могут непосредственно уничтожать опухолевые клетки как in vitro [36], так и in vivo [37]. Нейтрофилы потенцируют этот противоопухолевый эффект, когда они активированы. Важность ОН типа Н1 в противоопухолевых реакциях также подчеркивается экспериментальными исследованиями о том, что истощение уровня нейтрофилов в крови приводит к увеличению роста опухоли [15, 93, 94]. Очевидно, что нейтрофилы обладают потенциалом непосредственного уничтожения опухолевых клеток. Механизмы, посредством которых нейтрофилы выполняют эту функцию, многочисленны и еще не полностью изучены, но они включают в себя многие уже известные механизмы антиинфекционной защиты [7].
ЗАКЛЮЧЕНИЕ
Таким образом, согласно представленным выше кратким сведениям подчеркивается двойной противоопухолевый и протуморальный потенциал нейтрофилов и предполагается, что нейтрофилы могут быть использованы для усиления различных противоопухолевых реакций в организме.
Хотя во многих случаях наличие нейтрофилов в опухолях оказывает негативное влияние на течение раковой болезни, эти клетки, несомненно, обладают способностью разрушать опухолевые клетки. Сегодня рассматривается около десяти новых терапевтических стратегий и подходов для усиления противоопухолевого потенциала нейтрофилов или блокирования доступа ОН к растущим опухолям, такие как активация нейтрофилов интерфероном, синтез и накопление высоких уровней провоспалительных цитокинов в опухоли, которые могут убивать опухолевые клетки, блокирование инфильтрации нейтрофилами опухоли и многие другие. Как указывалось выше, в некоторых опухолях образуются хемокины, главным образом IL-8, которые привлекают нейтрофилы в опухолевый очаг. Показано, что применение антагонистов IL-8 (таких как полностью гуманизированное нейтрализующее моноклональное антитело ABX-IL8) к IL-8 уменьшает рост опухоли, метастазы и ангиогенез меланомы и рака легкого [95]. Наличие двух фенотипов Н1 и Н2 нейтрофилов, предполагает также, что, влияя на микроокружение опухоли, можно манипулировать ОН и генерировать большее количество противоопухолевых нейтрофилов. Также получены многообещающие результаты с использованием моноклональных терапевтических антител, индуцирующих нейтрофилы для выполнения антителозависимой цитотоксичности и высвобождения цитокинов, которые модулируют иммунный противоопухолевый ответ [96, 97].
На развитие опухоли оказывают влияние многие типы клеток организма, в том числе ОН. Точная роль ОН до конца не установлена, и ее предстоит еще выяснить. В настоящее время широко изучаются разные способы привлечения их в опухоль и превращения Н1 нейтрофилов в противоопухолевые эффекторные клетки. Научиться переворачивать «монеты» нейтрофилов на «выигрышную сторону», как считают E. Uribe-Querol и C. Rosales [98], а именно, заставить действовать их как противоопухолевые эффекторные клетки, является вызовом и задачей для будущих исследований, что, возможно, позволит усовершенствовать существующие методы лечения рака.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Borregaard N. (2010) Neutrophils, from marrow to microbes. Immunity, 33(5): 657–670. doi: 10.1016/j.immuni.2010.11.011.
2. Kolaczkowska E., Kubes P. (2013) Neutrophil recruitment and function in health and inflammation. Nat. Rev. Immunol., 13(3): 159–175. doi: 10.1038/nri3399.
3. Pham C.T.N. (2006) Neutrophil serine proteases: specific regulators of inflammation. Nat. Rev. Immunol., 6(7): 541–550. doi: 10.1038/nri1841.
4. Scapini P., Lapinet-Vera J.A., Gasperini S. et al. (2000) The neutrophil as a cellular source of chemokines. Immunol. Rev., 177: 195–203. doi: 10.1034/j.1600-065x.2000.17706.
5. Tecchio C., Scapini P., Pizzolo G., Cassatella M.A. (2013) On the cytokines produced by human neutrophils in tumors. Sem. Cancer Biol., 23(3): 159–170. doi: 10.1016/j.semcancer.2013.02.004.
6. Mantovani A., Allavena P., Sica A., Balkwill F. (2008) Cancer-related inflammation. Nature, 454 (7203): 436–444. doi: 10.1038/nature07205.
7. Бережная Н.М., Чехун В.Ф. (2005) Иммунология злокачественного роста. Наукова думка, Киев, 791 с.
8. Gregory A.D., Houghton A.M. (2011) Tumor-associated neutrophils: new targets for cancer therapy. Cancer Res., 71(7): 2411–2416. doi: 10.1158/0008-5472.can-10-2583.
9. Mantovani A., Cassatella M.A., Costantini C., Jaillon S. (2011) Neutrophils in the activation and regulation of innate and adaptive immunity. Nat. Rev. Immunol., 11(8): 519–531. doi: 10.1038/nri3024.
10. Wislez M., Rabbe N., Marchal J. et al. (2003) Hepatocyte growth factor production by neutrophils infiltrating bronchioloalveolar subtype pulmonary adenocarcinoma: role in tumor progression and death. Cancer Res., 63(6): 1405–1412.
11. Schmidt H., Bastholt L., Geertsen P. et al. (2005) Elevated neutrophil and monocyte counts in peripheral blood are associated with poor survival in patients with metastatic melanoma: a prognostic model. Brit. J. Cancer, 93(3): 273–278. doi: 10.1038/sj.bjc.6602702.
12. Jensen H.K., Donskov F., Marcussen N. et al. (2009) Presence of intratumoral neutrophils is an independent prognostic factor in localized renal cell carcinoma. J. Clin. Oncol., 27(28): 4709–4717. doi: 10.1200/jco.2008.18.9498.
13. Trellakis S., Bruderek K., Dumitru C.A. et al. (2011) Polymorphonuclear granulocytes in human head and neck cancer: enhanced inflammatory activity, modulation by cancer cells and expansion in advanced disease. Int. J. Cancer, 129(9): 2183–2193. doi: 10.1002/ijc.25892.
14. Fridlender Z.G., Albelda S.M. (2012) Tumor-associated neutrophils: friend or foe? Carcinogenesis, 33(5): 949–955. doi: 10.1093/carcin/bgs123.
15. Fridlender Z.G., Sun J., Kim S. et al. (2009) Polarization of tumor-associated neutrophil phenotype by TGF-β: ‘N1’ versus ‘N2’ TAN. Cancer Cell, 16(3): 183–194. doi: 10.1016/j.ccr.2009.06.017. [PMC free article].
16. Galdiero M.R., Garlanda C., Jaillon S. et al. (2013) Tumor associated macrophages and neutrophils in tumor progression. J. Cell. Physiol., 228(7): 1404–1412. doi: 10.1002/jcp.24260.
17. Sionov R.V., Fridlender Z.G., Granot Z. (2014) The multifaceted roles neutrophils play in the tumor microenvironment. Cancer Microenviron., 1–34. doi: 10.1007/s12307-014-0147-5.
18. Swierczak A., Mouchemore K.A., Hamilton J.A., Anderson R.L. (2015) Neutrophils: important contributors to tumor progression and metastasis. Cancer and Metastasis Rev., 34(4): 735–751. doi: 10.1007/s10555-015-9594-9.
19. McGary C.T., Miele M.E., Welch D.R. (1995) Highly metastatic 13762NF rat mammary adenocarcinoma cell clones stimulate bone marrow by secretion of granulocyte-macrophage colony-stimulating factor/interleukin-3 activity. Am. J. Pathol., 147(6): 1668–1681.
20. Lechner M.G., Liebertz D.J., Epstein A.L. (2010) Characterization of cytokine-induced myeloid-derived suppressor cells from normal human peripheral blood mononuclear cells. J. Immunol., 185(4): 2273–2284. doi: 10.4049/jimmunol.1000901.
21. Atzpodien J., Reitz M. (2008) Peripheral blood neutrophils as independent immunologic predictor of response and long-term survival upon immunotherapy in metastatic renal-cell carcinoma. Cancer Biother. Radiopharm., 23(1): 129–134. doi: 10.1089/cbr.2007.0429.
22. Bellocq A., Antoine M., Flahault A. et al. (1998) Neutrophil alveolitis in bronchioloalveolar carcinoma: induction by tumor-derived interleukin-8 and relation to clinical outcome. Am. J. Pathol., 152(1): 83–92.
23. Reid M.D., Basturk O., Thirabanjasak D. et al. (2011) Tumor-infiltrating neutrophils in pancreatic neoplasia. Modern Pathol., 24(12): 1612–1619. doi: 10.1038/modpathol.2011.113.
24. Halazun K.J., Hardy M.A., Rana A.A. et al. (2009) Negative impact of neutrophil-lymphocyte ratio on outcome after liver transplantation for hepatocellular carcinoma. Ann. Surg., 250(1): 141–151. doi: 10.1097/SLA.0b013e3181a77e59.
25. Walsh S.R., Cook E.J., Goulder F. et al. (2005) Neutrophil-lymphocyte ratio as a prognostic factor in colorectal cancer. J. Surg. Oncol., 91(3): 181–184. doi: 10.1002/jso.20329.
26. Peng B., Wang Y.-H., Liu Y.-M., Ma L.-X. (2015) Prognostic significance of the neutrophil to lymphocyte ratio in patients with non-small cell lung cancer: a systemic review and meta-analysis. Int. J. Clin. Exp. Med., 8(3): 3098–3106.
27. Malietzis G., Giacometti M., Kennedy R.H. et al. (2014) The emerging role of neutrophil to lymphocyte ratio in determining colorectal cancer treatment outcomes: a systematic review and meta-analysis. Ann. Surg. Oncol., 21(12): 3938–3946. doi: 10.1245/s10434-014-3815-2.
28. Krenn-Pilko S., Langsenlehner U., Thurner E.-M. et al. (2014) The elevated preoperative derived neutrophil-to-lymphocyte ratio predicts poor clinical outcome in breast cancer patients. Brit. J. Cancer, 110(10): 2524–2530. doi: 10.1038/bjc.2014.163.
29. Pistelli M., De Lisa M., Ballatore Z. et al. (2015) Pre-treatment neutrophil to lymphocyte ratio may be a useful tool in predicting survival in early triple negative breast cancer patients. BMC Cancer, 15, article 195. doi: 10.1186/s12885-015-1204-2.
30. Guthrie G.J.K., Charles K.A., Roxburgh C.S.D. et al. (2013) The systemic inflammation-based neutrophil-lymphocyte ratio: experience in patients with cancer. Crit. Rev. Oncol. Hematol., 88(1): 218–230. doi: 10.1016/j.critrevonc.2013.03.010.
31. Templeton A.J., McNamara M.G., Šeruga B. et al. (2014) Prognostic role of neutrophil-to-lymphocyte ratio in solid tumors: a systematic review and meta-analysis. J. Nat. Cancer Institute, 106(6). doi: 10.1093/jnci/dju124.dju124.
32. Paramanathan A., Saxena A., Morris D.L. (2014) A systematic review and meta-analysis on the impact of pre-operative neutrophil lymphocyte ratio on long term outcomes after curative intent resection of solid tumours. Surg. Oncol., 23(1): 31–39. doi: 10.1016/j.suronc.2013.12.001.
33. Caruso R.A., Bellocco R., Pagano M. et al. (2002) Prognostic value of intratumoral neutrophils in advanced gastric carcinoma in a high-risk area in Northern Italy. Modern Pathol., 15(8): 831–837. doi: 10.1097/01.mp.0000020391.98998.6b.
34. Pickaver A.H., Ratcliffe N.A., Williams A.E., Smith H. (1972) Cytotoxic effects of peritoneal neutrophils on a syngeneic rat tumour. Nature: New biology, 235(58): 186–187.
35. Gerrard T.L., Cohen D.J., Kaplan A.M. (1981) Human neutrophil-mediated cytotoxicity to tumor cells. J. Natl Cancer Inst., 66(3): 483–488 (19820701) 50:160;62::aid-cncr282050011362;3.0.co;2-0.
36. Katano M., Torisu M. (1982) Neutrophil-mediated tumor cell destruction in cancer ascites. Cancer, 50(1): 62–68. doi: 10.1002/1097-0142.
37. Brandau S., Dumitru C.A., Lang S. (2013) Protumor and antitumor functions of neutrophil granulocytes. Seminars in Immunopathology, 35(2): 163–176. doi: 10.1007/s00281-012-0344-6.
38. Almand B., Clark J.I., Nikitina E. et al. (2001) Increased production of immature myeloid cells in cancer patients: a mechanism of immunosuppression in cancer. J. Immunol., 166(1): 678–689. doi: 10.4049/jimmunol.166.1.678.
39. Choi J., Suh B., Ahn Y. et al. (2012) CD15+/CD16 human granulocytes from terminal cancer patients: granulocytic myeloid-derived suppressor cells that have suppressive function. Tumor Biology, 33(1): 121–129. doi: 10.1007/s13277-011-0254-6.
40. Peranzoni E., Zilio S., Marigo I. et al. (2010) Myeloid-derived suppressor cell heterogeneity and subset definition. Curr. Opin. Immunol., 22(2): 238–244. doi: 10.1016/j.coi.2010.01.021.
41. Raber P.L., Thevenot P., Sierra R. et al. (2014) Subpopulations of myeloid-derived suppressor cells impair T cell responses through independent nitric oxide-related pathways. Int. J. Cancer, 134(12): 2853–2864. doi: 10.1002/ijc.28622.
42. Youn J.-I., Nagaraj S., Collazo M., Gabrilovich D.I. (2008) Subsets of myeloid-derived suppressor cells in tumor-bearing mice. J. Immunol., 181(8): 5791–5802. doi: 10.4049/jimmunol.181.8.5791.
43. Gabrilovich D.I., Nagaraj S. (2009) Myeloid-derived suppressor cells as regulators of the immune system. Nat. Rev. Immunol., 9(3): 162–174. doi: 10.1038/nri2506.
44. Nagaraj S., Schrum A.G., Cho H.-I. et al. (2010) Mechanism of T cell tolerance induced by myeloid-derived suppressor cells. J. Immunol., 184(6): 3106–3116. doi: 10.4049/jimmunol.0902661.
45. Favaloro J., Liyadipitiya T., Brown R. et al. (2014) Myeloid derived suppressor cells are numerically, functionally and phenotypically different in patients with multiple myeloma. Leukemia & Lymphoma, 55(12): 2893–2900. doi: 10.3109/10428194.2014.904511.
46. Raychaudhuri B., Rayman P., Huang P. et al. (2015) Myeloid derived suppressor cell infiltration of murine and human gliomas is associated with reduction of tumor infiltrating lymphocytes. J. Neuro-Oncology, 122: 293–301. doi: 10.1007/s11060-015-1720-6.
47. Gallamini A., Di Raimondo F., La Nasa G. et al. (2013) Standard therapies versus novel therapies in Hodgkin lymphoma. Immunol. Letters, 155(1–2): 56–59. doi: 10.1016/j.imlet.2013.09.011.
48. Trellakis S., Bruderek K., Hütte J. et al. (2013) Granulocytic myeloid-derived suppressor cells are cryosensitive and their frequency does not correlate with serum concentrations of colony-stimulating factors in head and neck cancer. Innate Immunity, 19(3): 328–336. doi: 10.1177/1753425912463618.
49. Schmielau J., Finn O.J. (2001) Activated granulocytes and granulocyte-derived hydrogen peroxide are the underlying mechanism of suppression of T-cell function in advanced cancer patients. Cancer Res., 61(12): 4756–4760.
50. Nagaraj S., Gupta K., Pisarev V. et al. (2007) Altered recognition of antigen is a mechanism of CD8+ T cell tolerance in cancer. Nat. Med., 13(7): 828–835. doi: 10.1038/nm1609.
51. Mishalian I., Bayuh R., Levy L. et al. (2013) Tumor-associated neutrophils (TAN) develop pro-tumorigenic properties during tumor progression. Cancer Immunol., Immunother., 62(11): 1745–1756. doi: 10.1007/s00262-013-1476-9.
52. Eruslanov E.B., Bhojnagarwala P.S., Quatromoni J.G. et al. (2014) Tumor-associated neutrophils stimulate T cell responses in early-stage human lung cancer. J. Clin. Invest., 124(12): 5466–5480. doi: 10.1172/JCI77053.
53. Wu P., Wu D., Ni C. et al. (2014) γδT17 cells promote the accumulation and expansion of myeloid-derived suppressor cells in human colorectal cancer. Immunity, 40(5): 785–800. doi: 10.1016/j.immuni.2014.03.013.
54. Sagiv J.Y., Michaeli J., Assi S. et al. (2015) Phenotypic diversity and plasticity in circulating neutrophil subpopulations in cancer. Cell Reports, 10(4): 562–573. doi: 10.1016/j.celrep.2014.12.039.
55. García-García E., Uribe-Querol E., Rosales C. (2013) A simple and efficient method to detect nuclear factor activation in human neutrophils by flow cytometry. J. Vis. Exp. (74). doi: 10.3791/50410.e50410 [PMC free article] [PubMed] [Cross Ref10.1016/j.celrep.2014.12.039].
56. Verbeke H., Struyf S., Berghmans N. et al. (2011) Isotypic neutralizing antibodies against mouse GCP-2/CXCL6 inhibit melanoma growth and metastasis. Cancer Letters, 302(1): 54–62. doi: 10.1016/j.canlet.2010.12.013.
57. Dumitru C.A., Gholaman H., Trellakis S. et al. (2011) Tumor-derived macrophage migration inhibitory factor modulates the biology of head and neck cancer cells via neutrophil activation. Int. J. Cancer, 129(4): 859–869. doi: 10.1002/ijc.25991. [PubMed] [Cross Ref.].
58. Lazennec G., Richmond A. (2010) Chemokines and chemokine receptors: new insights into cancer-related inflammation. Trends Mol. Med., 16(3): 133–144. doi: 10.1016/j.molmed.2010.01.003. [PMC free article] [PubMed] [Cross Ref.].
59. Kobayashi Y. (2008) The role of chemokines in neutrophil biology. Front. Bioscie., 13(7): 2400–2407. doi: 10.2741/2853. [PubMed] [Cross Ref.].
60. Okabe H., Beppu T., Ueda M. et al. (2012) Identification of CXCL5/ENA-78 as a factor involved in the interaction between cholangiocarcinoma cells and cancer-associated fibroblasts. Int. J. Cancer, 131(10): 2234–2241. doi: 10.1002/ijc.27496.
61. Dumitru C.A., Moses K., Trellakis S. et al. (2012) Neutrophils and granulocytic myeloid-derived suppressor cells: immunophenotyping, cell biology and clinical relevance in human oncology. Cancer Immunol., Immunother., 61(8): 1155–1167. doi: 10.1007/s00262-012-1294-5.
62. Houghton A.M., Rzymkiewicz D.M., Ji H. et al. (2010) Neutrophil elastase-mediated degradation of IRS-1 accelerates lung tumor growth. Nat. Med., 16(2): 219–223. doi: 10.1038/nm.2084.
63. Wada Y., Yoshida K., Tsutani Y. et al. (2007) Neutrophil elastase induces cell proliferation and migration by the release of TGF-α, PDGF and VEGF in esophageal cell lines. Oncol. Reports, 17(1): 161–167.
64. Segal A.W. (2005) How neutrophils kill microbes. Ann. Rev. Immunol., 23: 197–223. doi: 10.1146/annurev.immunol.23.021704.115653.
65. Morimoto-Kamata R., Mizoguchi S.-I., Ichisugi T., Yui S. (2012) Cathepsin G induces cell aggregation of human breast cancer MCF-7 cells via a 2-step mechanism: Catalytic site-independent binding to the cell surface and enzymatic activity-dependent induction of the cell aggregation. Mediators Inflamm., 2012: 13. doi: 10.1155/2012/456462.456462.
66. Wilson T.J., Nannuru K.C., Futakuchi M., Singh R.K. (2010) Cathepsin G-mediated enhanced TGF-β signaling promotes angiogenesis via upregulation of VEGF and MCP-1. Cancer Letters, 288(2): 162–169. doi: 10.1016/j.canlet.2009.06.035.
67. Yui S., Osawa Y., Ichisugi T., Morimoto-Kamata R. (2014) Neutrophil cathepsin G, but not elastase, induces aggregation of MCF-7 mammary carcinoma cells by a protease activity-dependent cell-oriented mechanism. Mediators Inflamm., 2014: 12. doi: 10.1155/2014/971409.971409.
68. Acuff H.B., Carter K.J., Fingleton B. et al. (2006) Matrix metalloproteinase-9 from bone marrow-derived cells contributes to survival but not growth of tumor cells in the lung microenvironment. Cancer Res., 66(1): 259–266. doi: 10.1158/0008-5472.can-05-2502.
69. Ebrahem Q., Chaurasia S.S., Vasanji A. et al. (2010) Cross-talk between vascular endothelial growth factor and matrix metalloproteinases in the induction of neovascularization in vivo. Am. J. Pathol., 176(1): 496–503. doi: 10.2353/ajpath.2010.080642.
70. Hawinkels L.J.A.C., Zuidwijk K., Verspaget H.W. et al. (2008) VEGF release by MMP-9 mediated heparan sulphate cleavage induces colorectal cancer angiogenesis. Eur. J. Cancer, 44(13): 1904–1913. doi: 10.1016/j.ejca.2008.06.031.
71. Coillie E.V., Aelst I.V., Wuyts A. et al. (2001) Tumor angiogenesis induced by granulocyte chemotactic protein-2 as a countercurrent principle. Am. J. Pathol., 159(4): 1405–1414. doi: 10.1016/s0002-9440(10)62527-8.
72. Bergers G., Brekken R., McMahon G. et al. (2000) Matrix metalloproteinase-9 triggers the angiogenic switch during carcinogenesis. Nat. Cell Biol., 2(10): 737–744. doi: 10.1038/35036374.
73. Deryugina E.I., Zajac E., Juncker-Jensen A. et al. (2014) Tissue-infiltrating neutrophils constitute the major in vivo source of angiogenesis-inducing MMP-9 in the tumor microenvironment. Neoplasia, 16(10): 771–788. doi: 10.1016/j.neo.2014.08.013.
74. Deryugina E.I., Quigley J.P. (2015) Tumor angiogenesis: MMP-mediated induction of intravasation- and metastasis-sustaining neovasculature. Matrix Biology, 44.
75. Бережная Н.М., Чехун В.Ф. (2016) Физиологическая система соединительной ткани и онкогенез. Экстрацеллюлярный матрикс и метастазирование. Онкология, 18(3): 164–176.
76. Чехун В.Ф., Бережная Н.М. (2017) Физиологическая система соединительной ткани и онкогенез. Формирование резистентности к химиопрепаратам. Онкология, 19(3): 156–170.
77. De Larco J.E., Wuertz B.R.K., Furcht L.T. (2004) The potential role of neutrophils in promoting the metastatic phenotype of tumors releasing interleukin-8. Clin. Cancer Res., 10(15): 4895–4900. doi: 10.1158/1078-0432.ccr-03-0760.
78. Shabani F., McNeil J., Tippett L. (1998) The oxidative inactivation of tissue inhibitor of metalloproteinase-1 (TIMP-1) by hypochlorous acid (HOCl) is suppressed by anti-rheumatic drugs. Free Radical Res., 28(2): 115–123. doi: 10.3109/10715769809065797.
79. Cross A., Edwards S.W., Bucknall R.C., Moots R.J. (2004) Secretion of oncostatin M by neutrophils in rheumatoid arthritis. Arthritis Rheum., 50(5): 1430–1436. doi: 10.1002/art.20166.
80. Goren I., Kämpfer H., Müller E. et al. (2006) Oncostatin M expression is functionally connected to neutrophils in the early inflammatory phase of skin repair: implications for normal and diabetes-impaired wounds. J. Invest. Dermatol., 126(3): 628–637. doi: 10.1038/sj.jid.5700136.
81. Grenier A., Combaux D., Chastre J. et al. (2001) Oncostatin M production by blood and alveolar neutrophils during acute lung injury. Lab. Invest., 81(2): 133–141. doi: 10.1038/labinvest.3780220.
82. Grenier A., Chollet-Martin S., Crestani B. et al. (2002) Presence of a mobilizable intracellular pool of hepatocyte growth factor in human polymorphonuclear neutrophils. Blood, 99(8): 2997–3004. doi: 10.1182/blood.v99.8.2997.
83. Matsushima A., Ogura H., Koh T. et al. (2004) Hepatocyte growth factor in polymorphonuclear leukocytes is increased in patients with systemic inflammatory response syndrome. J. Trauma, 56(2): 259–264. doi: 10.1097/01.ta.0000111752.60500.da.
84. Queen M.M., Ryan R.E., Holzer R.G. et al. (2005) Breast cancer cells stimulate neutrophils to produce oncostatin M: potential implications for tumor progression. Cancer Res., 65(19): 8896–8904. doi: 10.1158/0008-5472.can-05-1734.
85. Imai Y., Kubota Y., Yamamoto S. et al. (2005) Neutrophils enhance invasion activity of human cholangiocellular carcinoma and hepatocellular carcinoma cells: an in vitro study. J. Gastroenterol. Hepatol., 20(2): 287–293. doi: 10.1111/j.1440-1746.2004.03575.x.
86. Loukinova E., Dong G., Enamorado-Ayalya I. et al. (2000) Growth regulated oncogene-alpha expression by murine squamous cell carcinoma promotes tumor growth, metastasis, leukocyte infiltration and angiogenesis by a host CXC receptor-2 dependent mechanism. Oncogene, 19(31): 3477–3486. doi: 10.1038/sj.onc.1203687.
87. Schaider H., Oka M., Bogenrieder T. et al. (2003) Differential response of primary and metastatic melanomas to neutrophils attracted by IL-8. Int. J. Cancer, 103(3): 335–343. doi: 10.1002/ijc.10775.
88. Welch D.R., Schissel D.J., Howrey R.P., Aeed P.A. (1989) Tumor-elicited polymorphonuclear cells, in contrast to ‘normal’ circulating polymorphonuclear cells, stimulate invasive and metastatic potentials of rat mammary adenocarcinoma cells. Proceedings of the National Academy of Sciences of the United States of America, 86(15): 5859–5863. doi: 10.1073/pnas.86.15.5859.
89. Strell C., Lang K., Niggemann B. et al. (2010) Neutrophil granulocytes promote the migratory activity of MDA-MB-468 human breast carcinoma cells via ICAM-1. Exp. Cell Res., 316(1): 138–148. doi: 10.1016/j.yexcr.2009.09.003.
90. Crissman J.D., Hatfield J., Schaldenbrand M. et al. (1985) Arrest and extravasation of B16 amelanotic melanoma in murine lungs. A light and electron microscopic study. Lab. Invest., 53(4): 470–478.
91. Huh S.J., Liang S., Sharma A. et al. (2010) Transiently entrapped circulating tumor cells interact with neutrophils to facilitate lung metastasis development. Cancer Res., 70(14): 6071–6082. doi: 10.1158/0008-5472.can-09-4442.
92. Spicer J.D., McDonald B., Cools-Lartigue J.J. et al. (2012) Neutrophils promote liver metastasis via Mac-1-mediated interactions with circulating tumor cells. Cancer Res., 72(16): 3919–3927. doi: 10.1158/0008-5472.CAN-11-2393.
93. Kousis P.C., Henderson B.W., Maier P.G., Gollnick S.O. (2007) Photodynamic therapy enhancement of antitumor immunity is regulated by neutrophils. Cancer Res., 67(21): 10501–10510. doi: 10.1158/0008-5472.can-07-1778.
94. Suttmann H., Riemensberger J., Bentien G. et al. (2006) Neutrophil granulocytes are required for effective Bacillus Calmette-Guérin immunotherapy of bladder cancer and orchestrate local immune responses. Cancer Res., 66(16): 8250–8257. doi: 10.1158/0008-5472.can-06-1416.
95. Huang S., Mills L., Mian B. et al. (2002) Fully humanized neutralizing antibodies to interleukin-8 (ABX-IL8) inhibit angiogenesis, tumor growth, and metastasis of human melanoma. Am. J. Pathol., 161(1): 125–134. doi: 10.1016/s0002-9440(10)64164-8.
96. Otten M.A., Leusen J.H.W., Rudolph E. et al. (2007) FcR γ-chain dependent signaling in immature neutrophils is mediated by FcαRI, but not by FcγRI. J. Immunol., 179(5): 2918–2924. doi: 10.4049/jimmunol.179.5.2918.
97. Bakema J.E., Ganzevles S.H., Fluitsma D.M. et al. (2011) Targeting FcαRI on polymorphonuclear cells induces tumor cell killing through autophagy. J. Immunol., 187(2): 726–732. doi: 10.4049/jimmunol.1002581.
98. Uribe-Querol E., Rosales C. (2015) Neutrophils in Cancer: Two Sides of the Same Coin. J. Immunol. Res., 2015: 983698. Pub. online 2015 Dec. 24. doi: 10.1155/2015/983698.
Адрес:
Лисяный Николай Иванович
04050, Киев, ул. П. Майбороды, 32
ГУ «Институт нейрохирургии
им. акад. А.П. Ромоданова НАМН Украины»
Тел.: (044) 483-01-93
E-mail: [email protected]
Correspondence:
Lisyaniy Mykola
32 P. Mayborody str., Kyiv 04050
SI «Institute of Neurosurgery named after acad. A.P. Romodanov
NAMS of Ukraine»
Tel.: 044 483-01-93
E-mail: [email protected]
Какие патологии влияют на повышение лимфоцитов, и одновременное понижение лейкоцитов?
Лимфоциты являются разновидностью лейкоцитов — белых кровяных клеток. Они осуществляют иммунную функцию. Лимфоциты — одни из главных клеток иммунной системы, как моноциты и нейтрофилы, которые отвечают за выработку антител — молекул, направленных на уничтожение чужеродных частиц и их вывод из организма. Если они понижены или повышены, то такие данные говорят о том, что в организме произошёл сбой. Первое явление называется лимфопенией, второе — лимфоцитозом.В норме уровень этих клеток в крови может меняться в течение суток, под влиянием всевозможных внутренних/внешних факторов (стрессы, перепад температур, предменструальный синдром и др.). Однако, дальнейшая диагностика совершенно точно необходима в случае если лимфоциты повышены. Лимфоцитозом называют повышение лимфоцитов относительно нормы. В зависимости от возраста выделены следующие нормативные показатели:
Причины лимфоцитоза
Почему только при анализе можно узнать об изменении количества кровяных телец? Лимфоцитоз не имеет специфических симптомов — определить его может только общий анализ крови. Расшифровка результата осуществляется специалистами биохимических лабораторий, и на её основании, а также опираяся на данные истории болезни или характер жалоб пациента, врач может выдвинуть гипотезу о причинах повышения и назначить дальнейшее обследование. Повышение уровня лимфоцитов может вызываться целым рядом факторов, которые специфичны для взрослых и детей.
У детей
Повышенное количество лимфоцитов у детей может быть вызвано:
- Вирусным заболеванием: лишай, коклюш, малярия, ветряная оспа (ветрянка), корь, вирусный гепатит и другие;
- Инфекцией: грипп, ОРВИ, ангина и прочие;
- Гнойно-воспалительными процессами;
- Бронхиальной астмой;
- Лейкемией
Повышены лимфоциты могут быть и при протекании других заболеваний, при различных индивидуальных особенностях организма. Точные причины можно определить только после проведения полного обследования. Также следует помнить, что иногда лимфоциты остаются повышены даже и через некоторое время после выздоровления в анализе крове можно наблюдать.
Если лимфоциты повышены у взрослых
Повышение лимфоцитов, выявленное в анализе взрослого человека, может быть обусловлено:
- Различными заболеваниями инфекционно-вирусной природы: всевозможные простуды, грипп, ОРВИ, гепатит, мононуклеоз и прочие;
- Системным заболеванием крови: лимфосаркома, лейкемия, лимфолейкоз и другие;
- Бронхиальной астмой;
- Сывороточной болезнью;
- Различными заболеваниями эндокринной системы: тиреотоксикоз, болезнь Аддисона, акромегалия и прочие;
- Гиперчувствительностью к некоторым лекарственным препаратам;
- Неврастенией;
- Васкулитом;
- Периодом восстановления после перенесённого заболевания;
- Отравлением опасными химическими веществами: мышьяк, свинец и другие.
Количество лимфоцитов, отклоняющееся от нормы, может быть свидетельством наличия других заболеваний — в каждом случае это индивидуально. Расшифровка анализа крови не является достаточным основанием для постановки того или иного диагноза — такое заключение можно дать только по результатам полного обследования квалифицированными врачами.Также следует помнить, что если понижены моноциты, сегментоядерные нейтрофилы и другие виды лейкоцитов, то и это может говорить о том что лимфоциты повышены. В каждом конкретном случае при подозрении на какое-то заболевание должна проводиться детальная расшифровка всех показателей.
Лимфоциты понижены, а сегментоядерные нейтрофилы повышены у взрослого
Содержание
Если лимфоциты понижены, нейтрофилы повышены, можно говорить о присутствии в организме патологии. Лимфоциты необходимы человеку для того, чтобы справляться с различными инфекциями.
Если выявлен недостаток этого показателя, то нужно искать причину, повлиявшую на сбой.
Нейтрофилы относят к группе лейкоцитов.
Каждый нейтрофильный гранулоцит имеет ядро, которое играет значительную роль на протяжении всего жизненного цикла клеток.
Функции лимфоцитов, диагностика
Самой важной функцией этих кровяных телец принято считать защитную функцию. То есть, благодаря лимфоцитам, формируется иммунная система. Следовательно, низкий процент данных кровяных телец окажет отрицательное влияние на организм.
Лимфоциты делят на три группы:
- Т-лимфоциты – уничтожают поврежденные клетки в организме.
- В-лимфоциты – борются с патогенными микроорганизмами и различными бактериями. Помогают базофилам и нейтрофилам находить ненужные организму клетки.
- NК-лимфоциты – убивают пораженные клетки.
Можно сделать вывод, что лимфоциты — необходимые помощники для нашего организма, особенно в период заражения инфекционными болезнями.
Чтобы диагностировать отклонения, необходимо провести анализ крови пациента.
Для этого стоит придерживаться таких норм:
- кровь берется утром, на голодный желудок;
- при приеме лекарственных препаратов обязательно сообщить доктору;
- исключить курение и алкоголь за несколько дней;
- избегать физической нагрузки перед сдачей крови.
Норма лимфоцитов колеблется в зависимости от пола и возраста.
Существуют относительное (в процентах) и абсолютное (в единицах) значения:
- с нуля до 12 месяцев – 4-10,5 единиц, 55-75%;
- с одного до четырех лет – 2-84 единиц, 45-65%;
- с четырех до шести лет – 1,5-7 единиц; 35-55%;
- с шести до десяти лет – 1,5-6,5 единиц, 30-50%;
- с десяти до двадцати лет – 1-4,8 единиц; 30-45%;
- с двадцати и далее лет – 1-4,5 единиц, 20-34%.
При беременности лимфоциты всегда ниже своей нормы, поэтому поводов для беспокойства нет. Нужен только контроль специалиста.
Проанализировав приведенные значения, можно сделать вывод, что с возрастом количество лимфоцитов постепенно снижается. Это считается нормой.
Причины и симптомы снижения уровня лимфоцитов
Состояние, когда в крови недостаточно лимфоцитов, называют лимфопения. Условно ее делят на приобретенную и врожденную.
Приобретенная лимфопения возникает при таких заболеваниях:
- синдром приобретенного иммунодефицита;
- грипп;
- воспалительные заболевания печени;
- туберкулез;
- пневмония;
- гнойно-некротические процессы в костной системе;
- сепсис;
- хронические заболевания соединительной ткани;
- системная красная волчанка;
- болезнь Рустицкого-Калера;
- заболевания суставов;
- болезнь Ходжкина;
- нарушения функций почек;
- лейкоз.
Врожденная лимфопения возникает при таких заболеваниях:
- Пороки в развитии плода.
- Атаксия-телеангиэктазия.
- Первичный иммунодефицит.
- Опухоль тимуса.
Также на уровень лимфоцитов могут оказать влияние следующие факторы:
- недостаток витаминов в организме;
- продолжительные менструации;
- избыток физических нагрузок;
- нервное истощение;
- труд на предприятиях с вредным производством.
Как правило, лимфопения носит бессимптомный характер, но иногда можно заметить такие изменения:
- бледность или желтизна кожи;
- потеря волос;
- сыпь на коже;
- спленомегалия;
- изнеможение;
- появление гнойных участков на коже;
- повышение температуры тела.
Если перечисленные симптомы стали встречаться у человека, то ему стоит обратиться за консультацией к специалисту.
Часто на фоне лимфопении могут возникнуть некоторые осложнения:
- Рак лимфатической системы.
- Нарушение функционирования печени и почек.
- Снижение иммунитета.
- Рак с последующими метастазами.
Чтобы избежать таких серьезных осложнений, стоит вовремя посещать профилактические осмотры и сдавать анализы. Только контроль способен предотвратить печальные последствия.
Причины и симптомы повышения нейтрофилов
Нейтрофилы занимают от 47 до 72% общей массы лейкоцитов. Кажется, что это много, но на самом деле это является нормой. Нейтрофилы, как и лимфоциты, защищают человеческий организм от чужеродных агентов.
Когда нейтрофил встречает на своем пути микроорганизм, то сразу же начинает поедать его. Дальнейшая участь этой клетки – смерть.
Возникают ситуации, когда нейтрофилов становится намного больше нормы:
- При рождении. Если роды прошли хорошо, то в первые часы своей жизни показатели нейтрофилов малыша будут превышать определенную норму. Такая ситуация считается стандартной.
- У взрослых это значит присутствие в организме воспаления. Сюда можно отнести даже самые безобидные случаи, такие как попадание занозы или образование кариеса. Но и про серьезные проблемы не стоит забывать, например – аппендицит.
Высокий уровень нейтрофилов может также свидетельствовать о наличии гнойных абсцессов (фурункулез, воспаление головного мозга и других органов).
О таких страшных заболеваниях некоторые даже и не подозревают, так как симптомов повышения нейтрофилов почти незаметно. Вовремя сданный анализ крови может предотвратить печальные последствия.
Сепсис тоже относят к одной из причин повышения нейтрофилов. Кровяные клетки образуются в бешеном ритме, но все равно не справляются с поставленной задачей, которая заключается в устранении чужеродных агентов. Сепсис может развиться вследствие перенесенного воспаления легких.
Каждое инфекционное заболевание должно быть под контролем у специалиста. Профессиональный подход к лечению способен уберечь пациента от возникновения осложнений, которые достаточно сложно побороть.
Лечение
Когда понижены лимфоциты, а повышены нейтрофилы в крови, следует искать причину возникновения такого состояния. Только повлияв на неё, можно избежать серьезных заболеваний.
Если специалист видит нарушение в составе кровяных клеток, то пациента направляют на дополнительное обследование. Сюда входят рентген, ультразвуковая диагностика, а также томография.
Обычно процесс лечения заключается в приеме следующих препаратов:
- антивирусные;
- антибиотики;
- антигистаминные;
- средства от температуры;
- гормональные;
- витамины.
Если болезнь зашла слишком далеко, врач может назначить:
- Операцию.
- Пересадку клеток.
- Лучевую или химиотерапию.
Для быстрой нормализации состава кровяных клеток назначаются внутривенные инъекции иммуноглобулинов.
В рацион вводят продукты красного цвета, а также сухофрукты с орехами. Перед сном пациентам рекомендуют 50 г красного вина.
К эффективным народным средствам стоит отнести отвар из ячменя с цикорием. Для помощи иммунитету следует принимать настойки элеутерококка или родиолы розовой.
Для поддержания тонуса не стоит забывать про активный отдых, то есть гимнастические упражнения и свежий воздух. Нужно избегать перенапряжения нервной системы, а именно стрессов и переживаний.
Оценить статью:
Рекомендуем прочитать:
boleznikrovi.com
Лимфоцитоз у беременных
Количество белых кровяных телец (лимфоциты, моноциты и др.) — очень важный показатель при беременности. Почему гинекологи так пристально следят за ним? Причины этого в том, что в норме организм поддерживает уровень лейкоцитов безопасный для плода, т. е. лимфоциты осуществляют свои функции и не несут угрозы уничтожения чужеродным антигенам отца, которые обязательно должны быть у эмбриона. Если же лимфоциты повышены, то такое положение может стать причиной выкидыша.Поэтому беременным нужно пристально следить за уровнем лимфоцитов и других лейкоцитов. Поможет в этом регулярный анализ крови. Особенно это необходимо в 2-й и 3-й триместр беременности. Обратиться к врачу понадобится и в том случае, если лейкоциты понижены.
Лечение
Лимфоцитоз не является самостоятельным заболеванием. Если лимфоциты выше нормы, то это означает, что в организме протекают какие-то патологические процессы. Чтобы устранить их, необходимо:
- Выявить причины. Для этого назначается комплексное обследование. Проконсультироваться со специалистом. Расшифровка данных любых анализов и исследований должна осуществляться только опытным врачом.
- Пройти лечение. Конкретные назначения даются в зависимости от найденного заболевания. Если нейтрофилы, моноциты и другие виды бесцветных клеток крови часто отклоняются от нормативных показателей, то это говорит о том, что нужно незамедлительно обратиться к специалисту. Также следует помнить, что понижение уровня лимфоцитов после болезни не всегда свидетельствует о полном её прохождении.
Повышение других видов лейкоцитов
Общий уровень лейкоцитов крови также является очень важным показателем. Моноциты и сегментоядерные нейтрофилы могут оказывать прямое влияние на уровень лимфоцитов. Например, если данные клетки крови относительно понижены, то лимфоциты повышены. Если повышены сами сегментоядерные нейтрофилы и моноциты, то это означает, что в организме присутствует вирус или инфекция. При любом изменении уровня лейкоцитов в крови потребуется повторный анализ, детальная расшифровка и комплексное обследование.
Что такое лимфоциты и лейкоциты и их значение в крови
Лимфоциты представляют собой белые клеточки крови и относятся к подгруппе лейкоцитов. В целом, они отвечают за работу иммунной системы, ее память и ответ в случае проникновения вредоносных элементов.
Именно лейкоциты первыми бросаются на борьбу с инородными частицами при их обнаружении, но если остальные подгруппы этой категории клеток занимаются уничтожением вредоносных элементов, то целью лимфоцитов можно назвать уничтожение самих себя после проведенной борьбы. Лимфоциты уничтожают собственные клетки, подвергшиеся мутации или иным повреждениям, а также переродившиеся в клетки опухолей.
Лимфоциты существуют в крови лишь несколько суток, после чего происходит их разделение на особые подгруппы в различных железах организма, у каждой из которых есть свои функции.
Например, лимфатические узлы преобразовывают около 15% клеток в категорию В-лимфоциты, которые являются одними из важнейших клеток иммунитета. Именно они, столкнувшись с вредоносными элементами, запоминают их и обеспечивают в дальнейшем иммунитет против этих недугов.
В тимусе происходит предобразование примерно 80% клеток в категорию Т-лимфоцитов, разделяющуюся на подвиды: Т-супрессоры, Т-хеллеры и Т-киллеры, у каждого из которых свои функции, направленные на уничтожение вредоносных элементов и поддержание иммунной системы.
NK-лимфоциты составляют всего около 5%, но именно они отвечают за уничтожение собственных поврежденных клеток. Скопления погибших клеток образуют гной.
В целом, все лейкоциты выполняют роль обеспечения естественной защиты организма и поддержания нормальной работы иммунной системы.
Острый лимфобластный лейкоз | Фонд «Подари жизнь»
Суть болезни
Лейкоз, или лейкемия – заболевание костного мозга, в обиходе иногда называемое «раком крови». При лейкозе нарушено нормальное кроветворение: производится избыточное количество аномальных незрелых клеток крови, обычно предшественников лейкоцитов. Эти бластные клетки, размножаясь и накапливаясь в костном мозге, мешают выработке и функционированию нормальных клеток крови, что и обусловливает основные симптомы заболевания. Кроме того, эти опухолевые клетки могут накапливаться в лимфоузлах, печени, селезенке, центральной нервной системе и других органах, также вызывая появление специфических симптомов.
Как известно, различные клетки крови развиваются по-разному и имеют разных предшественников – то есть относятся к различным линиям кроветворения (см. схему в статье «Кроветворение»). Линия кроветворения, приводящая к появлению лимфоцитов, называется лимфоидной; остальные же лейкоциты относятся к миелоидной линии. Соответственно, различают лейкозы из клеток-предшественников лимфоцитов (такие лейкозы называют лимфобластными, лимфоцитарными или просто лимфолейкозами) и из предшественников других лейкоцитов (миелобластные, миелоидные, миелолейкозы).
Острый лимфобластный лейкоз (ОЛЛ) – самый распространенный вид лейкоза у детей, но это заболевание нередко встречается и во взрослом возрасте. Термин «острый» означает быстрое развитие болезни, в противоположность хроническому лейкозу. Термин «лимфобластный» означает, что незрелые клетки, составляющие основу болезни, являются лимфобластами, то есть предшественниками лимфоцитов.
Частота встречаемости и факторы риска
На долю ОЛЛ приходится 75-80% всех опухолевых заболеваний кроветворной системы у детей (3-4 случая на 100 тысяч детей в год). Именно ОЛЛ – самое распространенное онкологическое заболевание у детей. Чаще всего ОЛЛ возникает в возрасте до 14 лет; пик детской заболеваемости приходится на возраст 2-5 лет. У мальчиков эта болезнь встречается немного чаще, чем у девочек.
Вероятность возникновения ОЛЛ несколько повышена у людей, ранее получавших лечение от какой-либо другой болезни (обычно злокачественной опухоли) с использованием облучения или определенных видов цитостатической химиотерапии. Также риск ОЛЛ повышен у детей с некоторыми генетическими нарушениями – например, с синдромом Дауна, нейрофиброматозом типа I или первичными иммунодефицитными состояниями.
Риск заболеть для ребенка выше среднего, если у его брата- или сестры-близнеца уже был диагностирован лейкоз.
Впрочем, в большинстве случаев ОЛЛ не удается обнаружить никакого из перечисленных факторов риска, и причины, вызвавшие болезнь, остаются неизвестными.
Признаки и симптомы
ОЛЛ характеризуется множеством различных признаков и у разных больных может проявляться совершенно по-разному. Большинство наблюдаемых симптомов, однако, обусловлено тяжелыми нарушениями кроветворения: избыток аномальных бластных клеток при ОЛЛ сочетается с недостаточным количеством нормальных функциональных клеток крови.
Обычно наблюдаются слабость, бледность, снижение аппетита, потеря веса, учащенное сердцебиение (тахикардия) – проявления анемии и опухолевой интоксикации. Недостаток тромбоцитов проявляется мелкими кровоизлияниями на коже и слизистых оболочках, кровотечениями из десен, носовыми и кишечными кровотечениями, кровоподтеками, синяками. Из-за накопления бластных клеток часто увеличиваются лимфоузлы – в частности, шейные, подмышечные, паховые. Нередко увеличиваются также печень и селезенка — как говорят, возникает гепатоспленомегалия.
Часто наблюдаются боли в костях и суставах, иногда возникают патологические (то есть вызванные заболеванием) переломы костей. Из-за недостаточного количества нормальных зрелых лейкоцитов возможны частые инфекции. Повышение температуры может наблюдаться как в связи с возникшей на фоне лейкоза инфекцией, так и из-за опухолевой интоксикации. Иногда одним из проявлений острого лейкоза является продолжительная ангина, плохо поддающаяся терапии антибиотиками.
В некоторых случаях ОЛЛ вызывает изменения и в других органах: глазах, почках, яичках у мальчиков и яичниках у девочек, причем у мальчиков поражение половых органов наблюдается чаще. Нередко возникает поражение центральной нервной системы — нейролейкемия.
Так как все наблюдаемые симптомы могут быть связаны и с другими заболеваниями и не специфичны для ОЛЛ, перед началом лечения необходима лабораторная диагностика, которая в срочном порядке производится в больничных условиях.
Диагностика
При ОЛЛ возникают изменения в обычном клиническом анализе крови: понижены уровни эритроцитов и тромбоцитов, появляются бластные клетки. Очень высокий лейкоцитоз возможен, но, вопреки распространенному мнению, наблюдается не во всех случаях. В целом же надежно поставить диагноз можно только при исследовании образца костного мозга; для этой цели необходима костномозговая пункция.
При морфологическом исследовании диагноз «острый лимфобластный лейкоз» ставится при обнаружении более 25% бластных клеток в костном мозге (в противном случае речь может идти о лимфобластной лимфома). Но обязательно производятся более тонкие исследования: цитохимическое (окрашивание клеток, позволяющее более точно установить их природу), цитогенетическое (изучение строения хромосом в лейкемических клетках), иммунофенотипирование (изучение белковых молекул на поверхности клеток). Дело в том, что при диагностике очень важно не только надежно отличить ОЛЛ от острого миелоидного лейкоза, но и определить конкретный вариант ОЛЛ, поскольку он сильно влияет на терапию и прогноз заболевания.
Так, ОЛЛ может быть B-клеточным (около 80% случаев) и T-клеточным, в зависимости от того, относятся ли лейкемические клетки к B- или T-лимфоцитарной линии. В зависимости от «степени зрелости» бластных клеток среди как В-, так и Т-клеточных лейкозов выделяют несколько вариантов; их установление в ходе иммунофенотипирования важно для определения стратегии лечения. Все большую важность для определения терапии приобретают и генетические особенности опухолевых клеток.
В ходе диагностики ОЛЛ также необходимо исследовать состояние центральной нервной системы. Анализ спинномозговой жидкости (ликвора) позволяет определить, нет ли у больного поражения центральной нервной системы – нейролейкемии. Образец ликвора для анализа получают посредством пункции спинномозгового канала.
Возможны и дополнительные диагностические процедуры для исследования пораженных лимфоузлов и внутренних органов – компьютерная томография (КТ), ультразвуковое исследование (УЗИ) и так далее.
Диагностические исследования позволяют для каждого конкретного больного определить ту или иную группу риска, от которой зависят прогноз заболевания и планируемое лечение. Так, говорят о стандартном риске, высоком риске и т.д. Отнесение к той или иной группе зависит от многих факторов. Перечислим некоторые из них.
- Возраст больного: менее благоприятным считается возраст до 1 года или старше 10 лет.
- Количество лейкоцитов: риск увеличивается при очень высоком лейкоцитозе в момент диагноза.
- Т-клеточный ОЛЛ у детей традиционно считается связанным с несколько более высоким риском по сравнению с В-клеточным.
- Хромосомные аномалии в лейкемических клетках, связанные с числом хромосом и транслокациями. При некоторых из них усложняется лечение болезни. Так, филадельфийская хромосома – транслокация t(9;22) – требует подключения дополнительных таргетных лекарств к терапии. Транслокация t(4;11) часто требует трансплантации костного мозга. В то же время, например, транслокация t(12;21) чаще всего связана с относительно хорошим прогнозом.
- Распространение ОЛЛ в другие органы, помимо костного мозга (например, возникновение нейролейкемии), определяет более высокий риск.
- При раннем или повторном рецидиве лейкоза риск значительно повышается.
Лечение
Как упомянуто в предыдущем разделе, современное лечение ОЛЛ основано на разделении пациентов на группы риска – в зависимости от того, насколько вероятно у них достижение и сохранение ремиссии при одинаковой терапии. Соответственно, пациенты, относящиеся к группам более высокого риска (то есть те, у кого изначальный прогноз хуже), получают более интенсивную терапию, а в группах более низкого риска можно использовать менее интенсивную терапию и тем самым избегать излишней токсичности и тяжелых осложнений.
Терапия ОЛЛ, как правило, состоит из трех этапов:
Индукция ремиссии (то есть терапия, направленная на достижение ремиссии) проводится в течение нескольких первых недель лечения. Под ремиссией здесь подразумеваеся содержание менее 5% бластных клеток в костном мозге и отсутствие их в обычной (периферической) крови в сочетании с признаками восстановления нормального кроветворения.
В ходе индукции проводится интенсивная многокомпонентная химиотерапия лекарствами-цитостатиками, которые вызывают разрушение лейкемических клеток. На этом этапе могут применяться, в зависимости от протокола, такие лекарства, как гормоны-глюкокортикостероиды, аспарагиназа и пэгаспаргаза, винкристин, антрациклины (даунорубицин и др.), иногда и другие препараты. Индукция позволяет достигнуть ремиссии более чем у 95% детей и у 75-90% взрослых с ОЛЛ. При плохом ответе на терапию индукции пациент переводится в группу более высокого риска.Консолидация (закрепление) ремиссии направлена на уничтожение остаточных аномальных бластных клеток во избежание рецидива заболевания. Общая продолжительность этого этапа составляет несколько месяцев и сильно зависит от конкретного протокола лечения. В ходе курсов терапии на этапе консолидации могут использоваться, опять-таки в зависимости от конкретного протокола, метотрексат, 6-меркаптопурин, винкристин, преднизолон, а также циклофосфамид, цитарабин, даунорубицин, аспарагиназа и т.д.
На этапах индукции и консолидации введение химиотерапевтических препаратов производится в основном внутривенно, в условиях больничного стационара или стационара одного дня.Поддерживающая терапия проводится для поддержания ремиссии, то есть для дополнительного снижения риска рецидива после этапов индукции и консолидации. Продолжительность поддерживающей терапии – полтора-два года. На этом этапе основными препаратами являются 6-меркаптопурин и метотрексат.
Поддерживающая терапия представляет собой этап наименее интенсивного лечения. Лекарства принимаются в виде таблеток, их прием не требует пребывания в больнице.
Для лечения и профилактики нейролейкемии на перечисленных этапах химиопрепараты должны вводиться интратекально, то есть в спинномозговой канал посредством люмбальных пункций. Иногда лекарства вводят в желудочки (особые полости) головного мозга через специальный резервуар Оммайя, который устанавливается под кожей головы. Для интратекального введения при ОЛЛ используется метотрексат, цитарабин и гормоны-глюкокортикостероиды. У некоторых пациентов используется и облучение головы – краниальное облучение.
Существует также понятие реиндукции: это периодически повторяемые уже после достижения ремиссии циклы интенсивной полихимиотерапии. Реиндукция позволяет дополнительно снизить число лейкемических клеток и тем самым повысить «надежность» ремиссии.
К сожалению, несмотря на все перечисленные меры, иногда возникает рецидив ОЛЛ – костномозговой, экстрамедуллярный (то есть вне костного мозга – например, с поражением центральной нервной системы или яичек) или комбинированный. В этом случае проводится противорецидивная терапия. Выбор метода лечения рецидива зависит от сроков его возникновения (ранний или поздний) и от того, является ли рецидив костномозговым или экстрамедуллярным. К сожалению, при раннем рецидиве шансы на успех лекарственной терапии значительно снижаются.
В ходе лечения ОЛЛ может применяться трансплантация костного мозга от родственного или неродственного донора. Если по плану лечения предусмотрена трансплантация, то ее проводят после достижения ремиссии. Как правило, трансплантация показана только при высоком риске (например, после раннего рецидива или при плохом ответе на терапию индукции), поскольку вероятность хорошего ответа на стандартную терапию при ОЛЛ в среднем высока, особенно у детей.
Химиотерапия ОЛЛ высокоэффективна, но зачастую тяжело переносится и может быть связана с серьезными побочными эффектами. Так, в процессе лечения подавляется кроветворение и бывают необходимы переливания компонентов донорской крови – тромбоцитов во избежание кровотечений при очень низком уровне собственных тромбоцитов больного, эритроцитов для борьбы с анемией. Переливания донорских лейкоцитов (гранулоцитов) применяются только в редких случаях при тяжелых инфекционных осложнениях.
В числе «обычных» побочных эффектов химиотерапии можно также назвать тошноту, рвоту, облысение. Серьезнае проблема связана с возможностью аллергических реакций на химиопрепараты, вплоть до анафилактического шока – жизнеугрожающего состояния, которое характеризуется отеком, затруднением дыхания, сильным зудом и т.д. Так, сравнительно часто встречается аллергия на аспарагиназу, и может быть необходимо использование аналогов этого препарата (онкаспар, эрвиназа).
Поскольку и лейкоз сам по себе, и используемая при его лечении химиотерапия резко снижают сопротивляемость организма различным инфекциям, то больным во время лечения необходимы эффективные антибактериальные и противогрибковые лекарства для профилактики и терапии инфекционных осложнений. Опасны как обычные, так и оппортунистические инфекции. В частности, серьезную проблему представляют такие грибковые инфекции, как кандидоз и аспергиллез.
Интенсивное лечение ОЛЛ накладывает серьезные ограничения на образ жизни больного. Необходимо соблюдать определенную диету и строгие гигиенические требования. Во избежание инфекций ограничиваются контакты с внешним миром. При очень низком уровне тромбоцитов нельзя не только допускать травмы, но даже, например, чистить зубы зубной щеткой, чтобы не спровоцировать кровотечение из десен. После достижения ремиссии строгость этих ограничений постепенно снижается. Врачи и медсестры сообщают каждому больному, что ему можно и что нельзя на текущем этапе лечения.
В последние годы появилось несколько новых возможностей лечения сложных случаев ОЛЛ. Особо следует отметить иммунопрепарат блинатумомаб и CAR T-клеточную терапию, применяемые при В-клеточном ОЛЛ.
Прогноз
Без лечения ОЛЛ приводит к гибели больного в течение нескольких месяцев или даже недель. Однако использование современных протоколов лечения дает при ОЛЛ очень хороший результат: можно вылечить 85-90% больных детей. У взрослых, особенно пожилых, результаты хуже, но, тем не менее, примерно у 40% взрослых больных удается достичь стойкой ремиссии – то есть отсутствия рецидивов болезни в течение многих лет.
Лимфоцитоз: симптомы, причины, лечение
Обзор
Что такое лимфоцитоз?
Лимфоцитоз — это повышенное по сравнению с нормальным количество лимфоцитов, подтипа белых кровяных телец, в организме. Лимфоциты являются частью вашей иммунной системы и борются с инфекциями.
Кто наиболее подвержен риску лимфоцитоза?
Лимфоцитоз может быть у любого.
Насколько распространен лимфоцитоз?
Лимфоцитоз очень распространен. Это особенно часто встречается у людей, у которых:
Симптомы и причины
Что вызывает лимфоцитоз?
Лимфоцитоз возникает в результате увеличения количества лимфоцитов в крови.Лимфоциты — это белые кровяные тельца. Они играют важную роль в вашей иммунной системе, помогая вашему организму бороться с инфекцией. Многие сопутствующие заболевания могут вызывать лимфоцитоз.
Высокий уровень лимфоцитов в крови указывает на то, что ваш организм имеет дело с инфекцией или другим воспалительным заболеванием. Чаще всего временно повышенное количество лимфоцитов является нормальным результатом работы иммунной системы вашего организма. Иногда уровень лимфоцитов повышается из-за серьезного заболевания, например лейкемии.
Ваш врач может назначить специальные диагностические тесты, которые помогут точно определить причину вашего лимфоцитоза. Эти тесты могут включать в себя другие лабораторные тесты для исключения инфекций или тесты, исследующие другие ткани тела, такие как биопсия костного мозга и изучение вашей крови под микроскопом.
Каковы симптомы лимфоцитоза?
Лимфоцитоз сам по себе не вызывает симптомов. Однако у вас могут возникнуть симптомы, лежащие в основе первопричины лимфоцитоза. В зависимости от причины симптомы могут варьироваться от бессимптомных до тяжелых.
Диагностика и тесты
Как диагностируется лимфоцитоз?
Ваш врач диагностирует лимфоцитоз с помощью анализа крови, называемого полным анализом крови (CBC) с дифференциалом. Этот тест показывает увеличение белых кровяных телец с более высоким, чем обычно, количеством лимфоцитов.Ваш врач может использовать другие диагностические анализы крови, такие как тест, называемый проточной цитометрией, чтобы определить, являются ли лимфоциты клональными (что наблюдается при заболевании, называемом хроническим лимфолейкозом). Обследование может также включать биопсию костного мозга, чтобы помочь определить первопричину лимфоцитоза. Врачи полагаются на вашу историю болезни, текущие симптомы, список лекарств и физический осмотр, чтобы определить основную причину лимфоцитоза.
Ведение и лечение
Как лечится лимфоцитоз?
Врачи лечат лимфоцитоз, пытаясь устранить его первопричину.У большинства людей лимфоцитоз проходит по мере улучшения основного состояния.
Какие осложнения связаны с лимфоцитозом?
Лимфоцитоз говорит вашему врачу, что у вас есть или были инфекция или болезнь. Во многих случаях лимфоцитоз просто означает, что ваше тело борется с вирусной инфекцией.
В некоторых случаях лимфоцитоз является одним из первых признаков некоторых видов рака крови, включая хронический лимфолейкоз (ХЛЛ), который является наиболее распространенным типом лейкемии у взрослых.Обычно необходимы дополнительные тесты, чтобы исключить другие заболевания и поставить точный диагноз причины лимфоцитоза.
Профилактика
Можно ли предотвратить лимфоцитоз?
Невозможно предотвратить лимфоцитоз. Вы можете снизить риск вирусной инфекции:
- Часто и тщательно мыть руки водой с мылом
- Избегать контакта с больными
- Не делиться личными вещами с больными людьми
- Дезинфекция поверхностей и часто используемых предметов
Перспективы / Прогноз
Каков исход лечения лимфоцитоза?
Лимфоцитоз обычно проходит после лечения состояния или заболевания, из-за которого в организме вырабатывались дополнительные лейкоциты.
Жить с
Когда мне следует позвонить своему врачу?
Если у вас хроническая инфекция или вы испытываете хронические (продолжающиеся) симптомы или симптомы, которые со временем ухудшаются, обратитесь к врачу. Ваш врач может определить, есть ли у вас лимфоцитоз, во время полного медицинского обследования.
Лимфоцитоз: симптомы, причины, лечение
Обзор
Что такое лимфоцитоз?
Лимфоцитоз — это повышенное по сравнению с нормальным количество лимфоцитов, подтипа белых кровяных телец, в организме. Лимфоциты являются частью вашей иммунной системы и борются с инфекциями.
Кто наиболее подвержен риску лимфоцитоза?
Лимфоцитоз может быть у любого.
Насколько распространен лимфоцитоз?
Лимфоцитоз очень распространен. Это особенно часто встречается у людей, у которых:
Симптомы и причины
Что вызывает лимфоцитоз?
Лимфоцитоз возникает в результате увеличения количества лимфоцитов в крови.Лимфоциты — это белые кровяные тельца. Они играют важную роль в вашей иммунной системе, помогая вашему организму бороться с инфекцией. Многие сопутствующие заболевания могут вызывать лимфоцитоз.
Высокий уровень лимфоцитов в крови указывает на то, что ваш организм имеет дело с инфекцией или другим воспалительным заболеванием. Чаще всего временно повышенное количество лимфоцитов является нормальным результатом работы иммунной системы вашего организма. Иногда уровень лимфоцитов повышается из-за серьезного заболевания, например лейкемии.
Ваш врач может назначить специальные диагностические тесты, которые помогут точно определить причину вашего лимфоцитоза. Эти тесты могут включать в себя другие лабораторные тесты для исключения инфекций или тесты, исследующие другие ткани тела, такие как биопсия костного мозга и изучение вашей крови под микроскопом.
Каковы симптомы лимфоцитоза?
Лимфоцитоз сам по себе не вызывает симптомов. Однако у вас могут возникнуть симптомы, лежащие в основе первопричины лимфоцитоза. В зависимости от причины симптомы могут варьироваться от бессимптомных до тяжелых.
Диагностика и тесты
Как диагностируется лимфоцитоз?
Ваш врач диагностирует лимфоцитоз с помощью анализа крови, называемого полным анализом крови (CBC) с дифференциалом. Этот тест показывает увеличение белых кровяных телец с более высоким, чем обычно, количеством лимфоцитов.Ваш врач может использовать другие диагностические анализы крови, такие как тест, называемый проточной цитометрией, чтобы определить, являются ли лимфоциты клональными (что наблюдается при заболевании, называемом хроническим лимфолейкозом). Обследование может также включать биопсию костного мозга, чтобы помочь определить первопричину лимфоцитоза. Врачи полагаются на вашу историю болезни, текущие симптомы, список лекарств и физический осмотр, чтобы определить основную причину лимфоцитоза.
Ведение и лечение
Как лечится лимфоцитоз?
Врачи лечат лимфоцитоз, пытаясь устранить его первопричину.У большинства людей лимфоцитоз проходит по мере улучшения основного состояния.
Какие осложнения связаны с лимфоцитозом?
Лимфоцитоз говорит вашему врачу, что у вас есть или были инфекция или болезнь. Во многих случаях лимфоцитоз просто означает, что ваше тело борется с вирусной инфекцией.
В некоторых случаях лимфоцитоз является одним из первых признаков некоторых видов рака крови, включая хронический лимфолейкоз (ХЛЛ), который является наиболее распространенным типом лейкемии у взрослых.Обычно необходимы дополнительные тесты, чтобы исключить другие заболевания и поставить точный диагноз причины лимфоцитоза.
Профилактика
Можно ли предотвратить лимфоцитоз?
Невозможно предотвратить лимфоцитоз. Вы можете снизить риск вирусной инфекции:
- Часто и тщательно мыть руки водой с мылом
- Избегать контакта с больными
- Не делиться личными вещами с больными людьми
- Дезинфекция поверхностей и часто используемых предметов
Перспективы / Прогноз
Каков исход лечения лимфоцитоза?
Лимфоцитоз обычно проходит после лечения состояния или заболевания, из-за которого в организме вырабатывались дополнительные лейкоциты.
Жить с
Когда мне следует позвонить своему врачу?
Если у вас хроническая инфекция или вы испытываете хронические (продолжающиеся) симптомы или симптомы, которые со временем ухудшаются, обратитесь к врачу. Ваш врач может определить, есть ли у вас лимфоцитоз, во время полного медицинского обследования.
Лимфоцитов: уровни, диапазоны и функции
Лимфоциты — это лейкоциты, которые также являются одним из основных типов иммунных клеток организма. Они вырабатываются костным мозгом и обнаруживаются в крови и лимфатической ткани.
Иммунная система представляет собой сложную сеть клеток, известных как иммунные клетки, которые включают лимфоциты. Эти клетки работают вместе, чтобы защитить организм от посторонних веществ, таких как бактерии, вирусы и раковые клетки, которые могут угрожать его функционированию.
В этой статье мы рассмотрим различные типы лимфоцитов, их нормальные уровни в крови и что произойдет, если уровни станут слишком низкими или слишком высокими.
Существует две категории лимфоцитов, известных как В-лимфоциты и Т-лимфоциты. Их обычно называют В-клетками и Т-клетками.
Оба типа происходят из стволовых клеток костного мозга. Оттуда некоторые клетки попадают в тимус, где становятся Т-лимфоцитами. Другие остаются в костном мозге, где становятся В-клетками.
Задача В-клеток — вырабатывать антитела, которые представляют собой белки, вырабатываемые иммунной системой для борьбы с чужеродными веществами, известными как антигены.
Каждая В-клетка настроена на выработку одного специфического антитела. Каждое антитело соответствует антигену так же, как ключ соответствует замку, и когда это происходит, антиген маркируется для разрушения.
Задача Т-клеток — помочь организму убивать раковые клетки и контролировать иммунный ответ на чужеродные вещества. Они делают это, уничтожая клетки в организме, которые были захвачены вирусами или стали злокачественными.
Третий тип лимфоцитов, известный как естественные киллеры или NK-клетки, происходит из того же места, что и B- и T-клетки. NK-клетки быстро реагируют на несколько чужеродных веществ и специализируются на уничтожении раковых и инфицированных вирусом клеток.
Существуют различные типы В-клеток и Т-клеток, которые играют определенную роль в организме и иммунной системе.
В-клетки
В-клетки памяти
В-клетки памяти циркулируют в организме, чтобы запустить быстрый ответ антител при обнаружении инородного вещества.Они остаются в организме на десятилетия и становятся клетками памяти, которые запоминают ранее обнаруженные антигены и помогают иммунной системе быстрее реагировать на будущие атаки.
Регуляторные B-клетки
Регуляторные B-клетки или Breg составляют около 0,5 процента всех B-клеток у здоровых людей. Хотя их немного, они играют жизненно важную роль.
Bregs обладают защитным противовоспалительным действием в организме и останавливают лимфоциты, вызывающие воспаление. Они также взаимодействуют с некоторыми другими иммунными клетками и способствуют выработке регуляторных Т-клеток или Treg.
Т-клетки
Т-киллеры
Киллерные или цитотоксические Т-клетки сканируют поверхность клеток в организме, чтобы узнать, не заразились ли они микробами или превратились в злокачественные. Если так, они убивают эти клетки.
Т-хелперы
Т-хелперы «помогают» другим клеткам иммунной системы запускать и контролировать иммунный ответ против чужеродных веществ.
Существуют разные типы Т-хелперных клеток, и некоторые из них более эффективны, чем другие, против разных типов микробов.
Например, клетка Th2 более эффективна против микробов, вызывающих инфекцию внутри других клеток, таких как бактерии и вирусы, тогда как клетка Th3 более эффективна против микробов, вызывающих инфекцию вне клеток, таких как определенные бактерии и паразиты.
Регуляторные Т-клетки или Tregs
Tregs контролируют или подавляют другие клетки в иммунной системе. У них есть как полезные, так и вредные эффекты.
Они поддерживают толерантность к микробам, предотвращают аутоиммунные заболевания и ограничивают воспалительные заболевания.Но они также могут подавлять работу иммунной системы против определенных антигенов и опухолей.
Т-клетки памяти
Т-клетки памяти защищают организм от ранее обнаруженных антигенов. Они живут долгое время после того, как инфекция прошла, помогая иммунной системе вспомнить предыдущие инфекции.
Если тот же самый микроб попадает в организм во второй раз, Т-клетки памяти запоминают его и быстро размножаются, помогая организму быстрее бороться с ним.
Т-клетки естественных киллеров
Т-клетки естественных киллеров представляют собой смешанную группу Т-клеток, которые имеют общие характеристики как Т-клеток, так и естественных клеток-киллеров.Они могут влиять на другие иммунные клетки и контролировать иммунные реакции против веществ в организме, которые вызывают иммунный ответ.
Уровни лимфоцитов могут меняться в зависимости от расы, пола, местоположения и образа жизни человека.
Нормальный диапазон лимфоцитов у взрослых составляет от 1000 до 4800 лимфоцитов в 1 микролитре (мкл) крови. У детей нормальный диапазон составляет от 3000 до 9500 лимфоцитов в 1 мкл крови.
Необычно высокое или низкое количество лимфоцитов может быть признаком болезни.
Поделиться на Pinterest Высокий уровень лимфоцитов может указывать на лимфоцитоз, связанный с воспалительным заболеванием кишечника.Количество лимфоцитов выше нормы может быть безвредной и временной ситуацией из-за нормальной реакции организма на инфекцию или воспалительное состояние.
Но высокий уровень лимфоцитов также может быть признаком лимфоцитоза, который является более серьезным заболеванием.
Лимфоцитоз часто ассоциируется с хроническими инфекциями, некоторыми видами рака крови и аутоиммунными заболеваниями, такими как воспалительные заболевания кишечника.
У взрослых лимфоцитоз обычно соответствует количеству лимфоцитов выше 3000 лимфоцитов в 1 мкл крови. У детей количество лимфоцитов составляет около 9000 лимфоцитов в 1 мкл крови, хотя это значение может меняться с возрастом.
Количество лимфоцитов ниже нормы также может быть временным. Они могут возникать после простуды или другой инфекции или быть вызваны интенсивными физическими упражнениями, сильным стрессом или недоеданием.
Низкий уровень также может быть признаком состояния, известного как лимфоцитопения или лимфопения.
Лимфоцитопения может передаваться по наследству или передаваться вместе с некоторыми заболеваниями, в том числе:
- редкими наследственными заболеваниями, такими как атаксия-телеангиэктазия
- заболеваниями нервов, такими как рассеянный склероз
- аутоиммунными заболеваниями
- СПИДом или другими инфекционными болезни
Лимфоцитопения также может быть побочным эффектом лекарств или некоторых других методов лечения.
Количество лимфоцитов, сигнализирующих о лимфоцитопении, варьируется у взрослых и детей.Обычно они составляют менее 1000 лимфоцитов в 1 мкл крови для взрослых и менее 3000 лимфоцитов в 1 мкл крови для детей.
Анализ крови, который определяет количество лимфоцитов в крови человека, называется скринингом В- и Т-клеток. В этом тесте измеряется уровень основных типов лейкоцитов в организме.
Подсчет лимфоцитов — это часть большого анализа цельной крови, называемого полным анализом крови (CBC). Врачи могут запросить общий анализ крови, если подозревают наличие заболевания или инфекции.
В некоторых случаях вместо крови можно использовать образец костного мозга.
Экран B- и T-клеток даст оценку количества T- и B-клеток в крови.
Результаты могут указывать на нормальное или ненормальное количество клеток, последнее указывает на возможное наличие заболевания. В этом случае врач, скорее всего, попросит провести другие анализы для подтверждения диагноза.
количество Т-клеток выше нормального диапазона может указывать на любое из следующих состояний:
количество В-клеток выше нормального диапазона может указывать на:
- хронический лимфоцитарный лейкоз
- множественная миелома
- генетическое заболевание, известное как синдром ДиДжорджи
- тип рака, называемый макроглобулинемией Вальденстрема
Число Т-лимфоцитов ниже нормального диапазона может указывать на:
- заболевание, присутствующее с рождения
- приобретенное заболевание дефицита Т-клеток, такое как ВИЧ, которое может прогрессировать до СПИДа или HTLV-1
- Тип рака
Число В-клеток ниже нормы может указывать на:
Необычно высокое или низкое количество лимфоцитов само по себе может не вызывать никаких признаков, симптомов или серьезных проблем.Они могут быть нормальной реакцией организма на инфекцию, воспалительное состояние или другое необычное состояние и через некоторое время вернутся к нормальному уровню.
Если количество лимфоцитов остается высоким или низким с течением времени, это может быть признаком состояния здоровья и может быть диагностировано как лимфоцитопения или лимфоцитоз. Эти состояния могут варьироваться от легких до тяжелых, и их продолжительность зависит от того, что их вызвало.
Лечение аномального уровня лимфоцитов будет зависеть как от причины, так и от степени тяжести, а легкие формы могут вообще не потребоваться.
Мы выбрали связанные элементы, исходя из качества продуктов, и перечислили плюсы и минусы каждого, чтобы помочь вам определить, что лучше всего подойдет вам. Мы сотрудничаем с некоторыми компаниями, которые продают эти продукты, что означает, что Healthline UK и наши партнеры могут получать часть доходов, если вы совершите покупку, используя ссылку (ссылки) выше.
Лимфоциты: уровни, диапазоны и функции
Лимфоциты — это белые кровяные тельца, которые также являются одним из основных типов иммунных клеток организма.Они вырабатываются костным мозгом и обнаруживаются в крови и лимфатической ткани.
Иммунная система представляет собой сложную сеть клеток, известных как иммунные клетки, которые включают лимфоциты. Эти клетки работают вместе, чтобы защитить организм от посторонних веществ, таких как бактерии, вирусы и раковые клетки, которые могут угрожать его функционированию.
В этой статье мы рассмотрим различные типы лимфоцитов, их нормальные уровни в крови и что произойдет, если уровни станут слишком низкими или слишком высокими.
Существует две категории лимфоцитов, известных как В-лимфоциты и Т-лимфоциты. Их обычно называют В-клетками и Т-клетками.
Оба типа происходят из стволовых клеток костного мозга. Оттуда некоторые клетки попадают в тимус, где становятся Т-лимфоцитами. Другие остаются в костном мозге, где становятся В-клетками.
Задача В-клеток — вырабатывать антитела, которые представляют собой белки, вырабатываемые иммунной системой для борьбы с чужеродными веществами, известными как антигены.
Каждая В-клетка настроена на выработку одного специфического антитела. Каждое антитело соответствует антигену так же, как ключ соответствует замку, и когда это происходит, антиген маркируется для разрушения.
Задача Т-клеток — помочь организму убивать раковые клетки и контролировать иммунный ответ на чужеродные вещества. Они делают это, уничтожая клетки в организме, которые были захвачены вирусами или стали злокачественными.
Третий тип лимфоцитов, известный как естественные киллеры или NK-клетки, происходит из того же места, что и B- и T-клетки.NK-клетки быстро реагируют на несколько чужеродных веществ и специализируются на уничтожении раковых и инфицированных вирусом клеток.
Существуют различные типы В-клеток и Т-клеток, которые играют определенную роль в организме и иммунной системе.
В-клетки
В-клетки памяти
В-клетки памяти циркулируют в организме, чтобы запустить быстрый ответ антител при обнаружении инородного вещества. Они остаются в организме на десятилетия и становятся клетками памяти, которые запоминают ранее обнаруженные антигены и помогают иммунной системе быстрее реагировать на будущие атаки.
Регуляторные B-клетки
Регуляторные B-клетки или Breg составляют около 0,5 процента всех B-клеток у здоровых людей. Хотя их немного, они играют жизненно важную роль.
Bregs обладают защитным противовоспалительным действием в организме и останавливают лимфоциты, вызывающие воспаление. Они также взаимодействуют с некоторыми другими иммунными клетками и способствуют выработке регуляторных Т-клеток или Treg.
Т-клетки
Т-киллеры
Киллерные или цитотоксические Т-клетки сканируют поверхность клеток в организме, чтобы узнать, не заразились ли они микробами или превратились в злокачественные.Если так, они убивают эти клетки.
Т-хелперы
Т-хелперы «помогают» другим клеткам иммунной системы запускать и контролировать иммунный ответ против чужеродных веществ.
Существуют разные типы Т-хелперных клеток, и некоторые из них более эффективны, чем другие, против разных типов микробов.
Например, клетка Th2 более эффективна против микробов, вызывающих инфекцию внутри других клеток, таких как бактерии и вирусы, тогда как клетка Th3 более эффективна против микробов, вызывающих инфекцию вне клеток, таких как определенные бактерии и паразиты.
Регуляторные Т-клетки или Tregs
Tregs контролируют или подавляют другие клетки в иммунной системе. У них есть как полезные, так и вредные эффекты.
Они поддерживают толерантность к микробам, предотвращают аутоиммунные заболевания и ограничивают воспалительные заболевания. Но они также могут подавлять работу иммунной системы против определенных антигенов и опухолей.
Т-клетки памяти
Т-клетки памяти защищают организм от ранее обнаруженных антигенов.Они живут долгое время после того, как инфекция прошла, помогая иммунной системе вспомнить предыдущие инфекции.
Если тот же самый микроб попадает в организм во второй раз, Т-клетки памяти запоминают его и быстро размножаются, помогая организму быстрее бороться с ним.
Т-клетки естественных киллеров
Т-клетки естественных киллеров представляют собой смешанную группу Т-клеток, которые имеют общие характеристики как Т-клеток, так и естественных клеток-киллеров. Они могут влиять на другие иммунные клетки и контролировать иммунные реакции против веществ в организме, которые вызывают иммунный ответ.
Уровни лимфоцитов могут меняться в зависимости от расы, пола, местоположения и образа жизни человека.
Нормальный диапазон лимфоцитов у взрослых составляет от 1000 до 4800 лимфоцитов в 1 микролитре (мкл) крови. У детей нормальный диапазон составляет от 3000 до 9500 лимфоцитов в 1 мкл крови.
Необычно высокое или низкое количество лимфоцитов может быть признаком болезни.
Поделиться на Pinterest Высокий уровень лимфоцитов может указывать на лимфоцитоз, связанный с воспалительным заболеванием кишечника.Количество лимфоцитов выше нормы может быть безвредной и временной ситуацией из-за нормальной реакции организма на инфекцию или воспалительное состояние.
Но высокий уровень лимфоцитов также может быть признаком лимфоцитоза, который является более серьезным заболеванием.
Лимфоцитоз часто ассоциируется с хроническими инфекциями, некоторыми видами рака крови и аутоиммунными заболеваниями, такими как воспалительные заболевания кишечника.
У взрослых лимфоцитоз обычно соответствует количеству лимфоцитов выше 3000 лимфоцитов в 1 мкл крови.У детей количество лимфоцитов составляет около 9000 лимфоцитов в 1 мкл крови, хотя это значение может меняться с возрастом.
Количество лимфоцитов ниже нормы также может быть временным. Они могут возникать после простуды или другой инфекции или быть вызваны интенсивными физическими упражнениями, сильным стрессом или недоеданием.
Низкий уровень также может быть признаком состояния, известного как лимфоцитопения или лимфопения.
Лимфоцитопения может передаваться по наследству или передаваться вместе с некоторыми заболеваниями, в том числе:
- редкими наследственными заболеваниями, такими как атаксия-телеангиэктазия
- заболеваниями нервов, такими как рассеянный склероз
- аутоиммунными заболеваниями
- СПИДом или другими инфекционными болезни
Лимфоцитопения также может быть побочным эффектом лекарств или некоторых других методов лечения.
Количество лимфоцитов, сигнализирующих о лимфоцитопении, варьируется у взрослых и детей. Обычно они составляют менее 1000 лимфоцитов в 1 мкл крови для взрослых и менее 3000 лимфоцитов в 1 мкл крови для детей.
Анализ крови, который определяет количество лимфоцитов в крови человека, называется скринингом В- и Т-клеток. В этом тесте измеряется уровень основных типов лейкоцитов в организме.
Подсчет лимфоцитов — это часть большого анализа цельной крови, называемого полным анализом крови (CBC).Врачи могут запросить общий анализ крови, если подозревают наличие заболевания или инфекции.
В некоторых случаях вместо крови можно использовать образец костного мозга.
Экран B- и T-клеток даст оценку количества T- и B-клеток в крови.
Результаты могут указывать на нормальное или ненормальное количество клеток, последнее указывает на возможное наличие заболевания. В этом случае врач, скорее всего, попросит провести другие анализы для подтверждения диагноза.
количество Т-клеток выше нормального диапазона может указывать на любое из следующих состояний:
количество В-клеток выше нормального диапазона может указывать на:
- хронический лимфоцитарный лейкоз
- множественная миелома
- генетическое заболевание, известное как синдром ДиДжорджи
- тип рака, называемый макроглобулинемией Вальденстрема
Число Т-лимфоцитов ниже нормального диапазона может указывать на:
- заболевание, присутствующее с рождения
- приобретенное заболевание дефицита Т-клеток, такое как ВИЧ, которое может прогрессировать до СПИДа или HTLV-1
- Тип рака
Число В-клеток ниже нормы может указывать на:
Необычно высокое или низкое количество лимфоцитов само по себе может не вызывать никаких признаков, симптомов или серьезных проблем.Они могут быть нормальной реакцией организма на инфекцию, воспалительное состояние или другое необычное состояние и через некоторое время вернутся к нормальному уровню.
Если количество лимфоцитов остается высоким или низким с течением времени, это может быть признаком состояния здоровья и может быть диагностировано как лимфоцитопения или лимфоцитоз. Эти состояния могут варьироваться от легких до тяжелых, и их продолжительность зависит от того, что их вызвало.
Лечение аномального уровня лимфоцитов будет зависеть как от причины, так и от степени тяжести, а легкие формы могут вообще не потребоваться.
Мы выбрали связанные элементы, исходя из качества продуктов, и перечислили плюсы и минусы каждого, чтобы помочь вам определить, что лучше всего подойдет вам. Мы сотрудничаем с некоторыми компаниями, которые продают эти продукты, что означает, что Healthline UK и наши партнеры могут получать часть доходов, если вы совершите покупку, используя ссылку (ссылки) выше.
Лимфоциты: уровни, диапазоны и функции
Лимфоциты — это белые кровяные тельца, которые также являются одним из основных типов иммунных клеток организма.Они вырабатываются костным мозгом и обнаруживаются в крови и лимфатической ткани.
Иммунная система представляет собой сложную сеть клеток, известных как иммунные клетки, которые включают лимфоциты. Эти клетки работают вместе, чтобы защитить организм от посторонних веществ, таких как бактерии, вирусы и раковые клетки, которые могут угрожать его функционированию.
В этой статье мы рассмотрим различные типы лимфоцитов, их нормальные уровни в крови и что произойдет, если уровни станут слишком низкими или слишком высокими.
Существует две категории лимфоцитов, известных как В-лимфоциты и Т-лимфоциты. Их обычно называют В-клетками и Т-клетками.
Оба типа происходят из стволовых клеток костного мозга. Оттуда некоторые клетки попадают в тимус, где становятся Т-лимфоцитами. Другие остаются в костном мозге, где становятся В-клетками.
Задача В-клеток — вырабатывать антитела, которые представляют собой белки, вырабатываемые иммунной системой для борьбы с чужеродными веществами, известными как антигены.
Каждая В-клетка настроена на выработку одного специфического антитела. Каждое антитело соответствует антигену так же, как ключ соответствует замку, и когда это происходит, антиген маркируется для разрушения.
Задача Т-клеток — помочь организму убивать раковые клетки и контролировать иммунный ответ на чужеродные вещества. Они делают это, уничтожая клетки в организме, которые были захвачены вирусами или стали злокачественными.
Третий тип лимфоцитов, известный как естественные киллеры или NK-клетки, происходит из того же места, что и B- и T-клетки.NK-клетки быстро реагируют на несколько чужеродных веществ и специализируются на уничтожении раковых и инфицированных вирусом клеток.
Существуют различные типы В-клеток и Т-клеток, которые играют определенную роль в организме и иммунной системе.
В-клетки
В-клетки памяти
В-клетки памяти циркулируют в организме, чтобы запустить быстрый ответ антител при обнаружении инородного вещества. Они остаются в организме на десятилетия и становятся клетками памяти, которые запоминают ранее обнаруженные антигены и помогают иммунной системе быстрее реагировать на будущие атаки.
Регуляторные B-клетки
Регуляторные B-клетки или Breg составляют около 0,5 процента всех B-клеток у здоровых людей. Хотя их немного, они играют жизненно важную роль.
Bregs обладают защитным противовоспалительным действием в организме и останавливают лимфоциты, вызывающие воспаление. Они также взаимодействуют с некоторыми другими иммунными клетками и способствуют выработке регуляторных Т-клеток или Treg.
Т-клетки
Т-киллеры
Киллерные или цитотоксические Т-клетки сканируют поверхность клеток в организме, чтобы узнать, не заразились ли они микробами или превратились в злокачественные.Если так, они убивают эти клетки.
Т-хелперы
Т-хелперы «помогают» другим клеткам иммунной системы запускать и контролировать иммунный ответ против чужеродных веществ.
Существуют разные типы Т-хелперных клеток, и некоторые из них более эффективны, чем другие, против разных типов микробов.
Например, клетка Th2 более эффективна против микробов, вызывающих инфекцию внутри других клеток, таких как бактерии и вирусы, тогда как клетка Th3 более эффективна против микробов, вызывающих инфекцию вне клеток, таких как определенные бактерии и паразиты.
Регуляторные Т-клетки или Tregs
Tregs контролируют или подавляют другие клетки в иммунной системе. У них есть как полезные, так и вредные эффекты.
Они поддерживают толерантность к микробам, предотвращают аутоиммунные заболевания и ограничивают воспалительные заболевания. Но они также могут подавлять работу иммунной системы против определенных антигенов и опухолей.
Т-клетки памяти
Т-клетки памяти защищают организм от ранее обнаруженных антигенов.Они живут долгое время после того, как инфекция прошла, помогая иммунной системе вспомнить предыдущие инфекции.
Если тот же самый микроб попадает в организм во второй раз, Т-клетки памяти запоминают его и быстро размножаются, помогая организму быстрее бороться с ним.
Т-клетки естественных киллеров
Т-клетки естественных киллеров представляют собой смешанную группу Т-клеток, которые имеют общие характеристики как Т-клеток, так и естественных клеток-киллеров. Они могут влиять на другие иммунные клетки и контролировать иммунные реакции против веществ в организме, которые вызывают иммунный ответ.
Уровни лимфоцитов могут меняться в зависимости от расы, пола, местоположения и образа жизни человека.
Нормальный диапазон лимфоцитов у взрослых составляет от 1000 до 4800 лимфоцитов в 1 микролитре (мкл) крови. У детей нормальный диапазон составляет от 3000 до 9500 лимфоцитов в 1 мкл крови.
Необычно высокое или низкое количество лимфоцитов может быть признаком болезни.
Поделиться на Pinterest Высокий уровень лимфоцитов может указывать на лимфоцитоз, связанный с воспалительным заболеванием кишечника.Количество лимфоцитов выше нормы может быть безвредной и временной ситуацией из-за нормальной реакции организма на инфекцию или воспалительное состояние.
Но высокий уровень лимфоцитов также может быть признаком лимфоцитоза, который является более серьезным заболеванием.
Лимфоцитоз часто ассоциируется с хроническими инфекциями, некоторыми видами рака крови и аутоиммунными заболеваниями, такими как воспалительные заболевания кишечника.
У взрослых лимфоцитоз обычно соответствует количеству лимфоцитов выше 3000 лимфоцитов в 1 мкл крови.У детей количество лимфоцитов составляет около 9000 лимфоцитов в 1 мкл крови, хотя это значение может меняться с возрастом.
Количество лимфоцитов ниже нормы также может быть временным. Они могут возникать после простуды или другой инфекции или быть вызваны интенсивными физическими упражнениями, сильным стрессом или недоеданием.
Низкий уровень также может быть признаком состояния, известного как лимфоцитопения или лимфопения.
Лимфоцитопения может передаваться по наследству или передаваться вместе с некоторыми заболеваниями, в том числе:
- редкими наследственными заболеваниями, такими как атаксия-телеангиэктазия
- заболеваниями нервов, такими как рассеянный склероз
- аутоиммунными заболеваниями
- СПИДом или другими инфекционными болезни
Лимфоцитопения также может быть побочным эффектом лекарств или некоторых других методов лечения.
Количество лимфоцитов, сигнализирующих о лимфоцитопении, варьируется у взрослых и детей. Обычно они составляют менее 1000 лимфоцитов в 1 мкл крови для взрослых и менее 3000 лимфоцитов в 1 мкл крови для детей.
Анализ крови, который определяет количество лимфоцитов в крови человека, называется скринингом В- и Т-клеток. В этом тесте измеряется уровень основных типов лейкоцитов в организме.
Подсчет лимфоцитов — это часть большого анализа цельной крови, называемого полным анализом крови (CBC).Врачи могут запросить общий анализ крови, если подозревают наличие заболевания или инфекции.
В некоторых случаях вместо крови можно использовать образец костного мозга.
Экран B- и T-клеток даст оценку количества T- и B-клеток в крови.
Результаты могут указывать на нормальное или ненормальное количество клеток, последнее указывает на возможное наличие заболевания. В этом случае врач, скорее всего, попросит провести другие анализы для подтверждения диагноза.
количество Т-клеток выше нормального диапазона может указывать на любое из следующих состояний:
количество В-клеток выше нормального диапазона может указывать на:
- хронический лимфоцитарный лейкоз
- множественная миелома
- генетическое заболевание, известное как синдром ДиДжорджи
- тип рака, называемый макроглобулинемией Вальденстрема
Число Т-лимфоцитов ниже нормального диапазона может указывать на:
- заболевание, присутствующее с рождения
- приобретенное заболевание дефицита Т-клеток, такое как ВИЧ, которое может прогрессировать до СПИДа или HTLV-1
- Тип рака
Число В-клеток ниже нормы может указывать на:
Необычно высокое или низкое количество лимфоцитов само по себе может не вызывать никаких признаков, симптомов или серьезных проблем.Они могут быть нормальной реакцией организма на инфекцию, воспалительное состояние или другое необычное состояние и через некоторое время вернутся к нормальному уровню.
Если количество лимфоцитов остается высоким или низким с течением времени, это может быть признаком состояния здоровья и может быть диагностировано как лимфоцитопения или лимфоцитоз. Эти состояния могут варьироваться от легких до тяжелых, и их продолжительность зависит от того, что их вызвало.
Лечение аномального уровня лимфоцитов будет зависеть как от причины, так и от степени тяжести, а легкие формы могут вообще не потребоваться.
Мы выбрали связанные элементы, исходя из качества продуктов, и перечислили плюсы и минусы каждого, чтобы помочь вам определить, что лучше всего подойдет вам. Мы сотрудничаем с некоторыми компаниями, которые продают эти продукты, что означает, что Healthline UK и наши партнеры могут получать часть доходов, если вы совершите покупку, используя ссылку (ссылки) выше.
Лимфоциты: уровни, диапазоны и функции
Лимфоциты — это белые кровяные тельца, которые также являются одним из основных типов иммунных клеток организма.Они вырабатываются костным мозгом и обнаруживаются в крови и лимфатической ткани.
Иммунная система представляет собой сложную сеть клеток, известных как иммунные клетки, которые включают лимфоциты. Эти клетки работают вместе, чтобы защитить организм от посторонних веществ, таких как бактерии, вирусы и раковые клетки, которые могут угрожать его функционированию.
В этой статье мы рассмотрим различные типы лимфоцитов, их нормальные уровни в крови и что произойдет, если уровни станут слишком низкими или слишком высокими.
Существует две категории лимфоцитов, известных как В-лимфоциты и Т-лимфоциты. Их обычно называют В-клетками и Т-клетками.
Оба типа происходят из стволовых клеток костного мозга. Оттуда некоторые клетки попадают в тимус, где становятся Т-лимфоцитами. Другие остаются в костном мозге, где становятся В-клетками.
Задача В-клеток — вырабатывать антитела, которые представляют собой белки, вырабатываемые иммунной системой для борьбы с чужеродными веществами, известными как антигены.
Каждая В-клетка настроена на выработку одного специфического антитела. Каждое антитело соответствует антигену так же, как ключ соответствует замку, и когда это происходит, антиген маркируется для разрушения.
Задача Т-клеток — помочь организму убивать раковые клетки и контролировать иммунный ответ на чужеродные вещества. Они делают это, уничтожая клетки в организме, которые были захвачены вирусами или стали злокачественными.
Третий тип лимфоцитов, известный как естественные киллеры или NK-клетки, происходит из того же места, что и B- и T-клетки.NK-клетки быстро реагируют на несколько чужеродных веществ и специализируются на уничтожении раковых и инфицированных вирусом клеток.
Существуют различные типы В-клеток и Т-клеток, которые играют определенную роль в организме и иммунной системе.
В-клетки
В-клетки памяти
В-клетки памяти циркулируют в организме, чтобы запустить быстрый ответ антител при обнаружении инородного вещества. Они остаются в организме на десятилетия и становятся клетками памяти, которые запоминают ранее обнаруженные антигены и помогают иммунной системе быстрее реагировать на будущие атаки.
Регуляторные B-клетки
Регуляторные B-клетки или Breg составляют около 0,5 процента всех B-клеток у здоровых людей. Хотя их немного, они играют жизненно важную роль.
Bregs обладают защитным противовоспалительным действием в организме и останавливают лимфоциты, вызывающие воспаление. Они также взаимодействуют с некоторыми другими иммунными клетками и способствуют выработке регуляторных Т-клеток или Treg.
Т-клетки
Т-киллеры
Киллерные или цитотоксические Т-клетки сканируют поверхность клеток в организме, чтобы узнать, не заразились ли они микробами или превратились в злокачественные.Если так, они убивают эти клетки.
Т-хелперы
Т-хелперы «помогают» другим клеткам иммунной системы запускать и контролировать иммунный ответ против чужеродных веществ.
Существуют разные типы Т-хелперных клеток, и некоторые из них более эффективны, чем другие, против разных типов микробов.
Например, клетка Th2 более эффективна против микробов, вызывающих инфекцию внутри других клеток, таких как бактерии и вирусы, тогда как клетка Th3 более эффективна против микробов, вызывающих инфекцию вне клеток, таких как определенные бактерии и паразиты.
Регуляторные Т-клетки или Tregs
Tregs контролируют или подавляют другие клетки в иммунной системе. У них есть как полезные, так и вредные эффекты.
Они поддерживают толерантность к микробам, предотвращают аутоиммунные заболевания и ограничивают воспалительные заболевания. Но они также могут подавлять работу иммунной системы против определенных антигенов и опухолей.
Т-клетки памяти
Т-клетки памяти защищают организм от ранее обнаруженных антигенов.Они живут долгое время после того, как инфекция прошла, помогая иммунной системе вспомнить предыдущие инфекции.
Если тот же самый микроб попадает в организм во второй раз, Т-клетки памяти запоминают его и быстро размножаются, помогая организму быстрее бороться с ним.
Т-клетки естественных киллеров
Т-клетки естественных киллеров представляют собой смешанную группу Т-клеток, которые имеют общие характеристики как Т-клеток, так и естественных клеток-киллеров. Они могут влиять на другие иммунные клетки и контролировать иммунные реакции против веществ в организме, которые вызывают иммунный ответ.
Уровни лимфоцитов могут меняться в зависимости от расы, пола, местоположения и образа жизни человека.
Нормальный диапазон лимфоцитов у взрослых составляет от 1000 до 4800 лимфоцитов в 1 микролитре (мкл) крови. У детей нормальный диапазон составляет от 3000 до 9500 лимфоцитов в 1 мкл крови.
Необычно высокое или низкое количество лимфоцитов может быть признаком болезни.
Поделиться на Pinterest Высокий уровень лимфоцитов может указывать на лимфоцитоз, связанный с воспалительным заболеванием кишечника.Количество лимфоцитов выше нормы может быть безвредной и временной ситуацией из-за нормальной реакции организма на инфекцию или воспалительное состояние.
Но высокий уровень лимфоцитов также может быть признаком лимфоцитоза, который является более серьезным заболеванием.
Лимфоцитоз часто ассоциируется с хроническими инфекциями, некоторыми видами рака крови и аутоиммунными заболеваниями, такими как воспалительные заболевания кишечника.
У взрослых лимфоцитоз обычно соответствует количеству лимфоцитов выше 3000 лимфоцитов в 1 мкл крови.У детей количество лимфоцитов составляет около 9000 лимфоцитов в 1 мкл крови, хотя это значение может меняться с возрастом.
Количество лимфоцитов ниже нормы также может быть временным. Они могут возникать после простуды или другой инфекции или быть вызваны интенсивными физическими упражнениями, сильным стрессом или недоеданием.
Низкий уровень также может быть признаком состояния, известного как лимфоцитопения или лимфопения.
Лимфоцитопения может передаваться по наследству или передаваться вместе с некоторыми заболеваниями, в том числе:
- редкими наследственными заболеваниями, такими как атаксия-телеангиэктазия
- заболеваниями нервов, такими как рассеянный склероз
- аутоиммунными заболеваниями
- СПИДом или другими инфекционными болезни
Лимфоцитопения также может быть побочным эффектом лекарств или некоторых других методов лечения.
Количество лимфоцитов, сигнализирующих о лимфоцитопении, варьируется у взрослых и детей. Обычно они составляют менее 1000 лимфоцитов в 1 мкл крови для взрослых и менее 3000 лимфоцитов в 1 мкл крови для детей.
Анализ крови, который определяет количество лимфоцитов в крови человека, называется скринингом В- и Т-клеток. В этом тесте измеряется уровень основных типов лейкоцитов в организме.
Подсчет лимфоцитов — это часть большого анализа цельной крови, называемого полным анализом крови (CBC).Врачи могут запросить общий анализ крови, если подозревают наличие заболевания или инфекции.
В некоторых случаях вместо крови можно использовать образец костного мозга.
Экран B- и T-клеток даст оценку количества T- и B-клеток в крови.
Результаты могут указывать на нормальное или ненормальное количество клеток, последнее указывает на возможное наличие заболевания. В этом случае врач, скорее всего, попросит провести другие анализы для подтверждения диагноза.
количество Т-клеток выше нормального диапазона может указывать на любое из следующих состояний:
количество В-клеток выше нормального диапазона может указывать на:
- хронический лимфоцитарный лейкоз
- множественная миелома
- генетическое заболевание, известное как синдром ДиДжорджи
- тип рака, называемый макроглобулинемией Вальденстрема
Число Т-лимфоцитов ниже нормального диапазона может указывать на:
- заболевание, присутствующее с рождения
- приобретенное заболевание дефицита Т-клеток, такое как ВИЧ, которое может прогрессировать до СПИДа или HTLV-1
- Тип рака
Число В-клеток ниже нормы может указывать на:
Необычно высокое или низкое количество лимфоцитов само по себе может не вызывать никаких признаков, симптомов или серьезных проблем.Они могут быть нормальной реакцией организма на инфекцию, воспалительное состояние или другое необычное состояние и через некоторое время вернутся к нормальному уровню.
Если количество лимфоцитов остается высоким или низким с течением времени, это может быть признаком состояния здоровья и может быть диагностировано как лимфоцитопения или лимфоцитоз. Эти состояния могут варьироваться от легких до тяжелых, и их продолжительность зависит от того, что их вызвало.
Лечение аномального уровня лимфоцитов будет зависеть как от причины, так и от степени тяжести, а легкие формы могут вообще не потребоваться.
Мы выбрали связанные элементы, исходя из качества продуктов, и перечислили плюсы и минусы каждого, чтобы помочь вам определить, что лучше всего подойдет вам. Мы сотрудничаем с некоторыми компаниями, которые продают эти продукты, что означает, что Healthline UK и наши партнеры могут получать часть доходов, если вы совершите покупку, используя ссылку (ссылки) выше.
Иммунная система: информация о лимфоцитах, дендритных клетках, макрофагах и лейкоцитах — что такое химиотерапия?
Chemocare.ком
Уход во время химиотерапии и после нее
Иммунная система
Иммунная система — это сложная сеть клеток (например, лимфоцитов) и органов. которые работают вместе, чтобы защитить организм от инородных веществ (антигенов), таких в виде бактерий, вирусов или опухолевых клеток.Когда организм обнаруживает такое вещество несколько видов клеток вступают в действие, вызывая так называемый иммунный ответ. Ниже приводится описание некоторых клеток, которые являются частью иммунной системы.
Лимфоциты
Лимфоциты — один из основных типов иммунных клеток. Лимфоциты делится в основном на В- и Т-клетки.
- B-лимфоциты продуцируют антитела — белки (гамма-глобулины), которые распознают чужеродные вещества (антиген) и прикрепляются к ним.В-лимфоциты (или В-клетки) запрограммированы на выработку одного специфического антитела. Когда В-клетка встречает свой запускающий антиген, она дает начало множеству крупных клеток. известные как плазматические клетки. Каждая плазменная ячейка — это, по сути, фабрика по производству антитело. Антитело соответствует антигену так же, как ключ соответствует замку. Всякий раз, когда антитело и антиген сцепляются, антитело маркирует антиген для разрушение.В-лимфоциты не могут проникнуть в клетку, поэтому работа атаковать эти клетки-мишени остается Т-лимфоцитам.
- Т-лимфоциты — это клетки, которые запрограммированы на распознавание, реагирование и запомните антигены. Т-лимфоциты (или Т-клетки) способствуют иммунной защите двумя основными способами. Некоторые направляют и регулируют иммунные ответы. При стимуляции с помощью антигенного материала, представленного макрофагами, Т-клетки вырабатывают лимфокины. которые сигнализируют другим клеткам.Другие Т-лимфоциты способны уничтожать целевые ячейки при прямом контакте.
Макрофаги
Макрофаги являются первой линией защиты организма и выполняют множество функций. Макрофаг является первой клеткой, которая распознает и поглощает чужеродные вещества (антигены). Макрофаги расщепляют эти вещества и представляют более мелкие белки Т-лимфоцитам. (Т-клетки запрограммированы на распознавание, реакцию и запоминание антигенов).Макрофаги также производят вещества, называемые цитокинами, которые помогают регулировать активность лимфоцитов.
Дендритные клетки
Дендритные клетки известны как наиболее эффективный тип антигенпрезентирующих клеток с способность взаимодействовать с Т-клетками и инициировать иммунный ответ. Дендритный клетки вызывают все больший научный и клинический интерес из-за их ключевых роль в иммунном ответе и потенциальное использование с противоопухолевыми вакцинами.
Белые кровяные тельца
Есть разные типы лейкоцитов, которые являются частью иммунного ответа. Нейтрофилы или гранулоциты — самые распространенные иммунные клетки в организме. При инфекции их количество быстро увеличивается. Это основные компоненты гноя и обнаруживаются вокруг наиболее распространенных воспалений. Их работа — есть и уничтожить посторонний материал. Базофилы и эозинофилы — это белые кровяные тельца. которые содержат внутри клетки большие гранулы.Они взаимодействуют с некоторыми иностранными материалы. Их повышенная активность может привести к аллергической реакции.
Иммунный ответ — это скоординированные усилия. Все иммунные клетки работают вместе, поэтому им нужно общаться друг с другом. Они делают это, секретируя увеличенное уровни особой белковой молекулы, называемой цитокинами, которая действует на другие клетки. Есть много разных цитокинов. Примерами являются интерлейкины, интерфероны, факторы некроза опухолей и колониестимулирующие факторы.Немного стратегии иммунотерапевтического лечения включают введение большего количества этих белки путем инъекции или инфузии. Это делается в надежде стимулировать клетки иммунной системы, чтобы действовать более эффективно или заставлять опухолевые клетки более узнаваемый для иммунной системы.
Осторожно: Есть люди, которые продвигают непроверенные методы лечения. как ускорители иммунной системы.Будьте осторожны при оценке этих заявлений. Ниже приведены типы иммунотерапии, которые обычно и законно используются. в традиционной и научной медицинской практике.
Дополнительная информация о химиотерапии:
Условия химиотерапии Химиотерапия Протоколы — как работает химиотерапия Как проводится химиотерапия Как врачи решают, какие химиотерапевтические препараты назначать Как долго дается химиотерапия Как узнать, работает ли химиотерапия Раковые клетки и химиотерапия Типы химиотерапии Целевые Терапия Иммунный Система О Иммунотерапия Гормон Терапия Химиопоротективный Агенты Сопротивление химиотерапии Краткосрочные и долгосрочные побочные эффекты химиотерапии Надир Клинические испытания рака
Chemocare.