Стенозы сонных артерий и современные методы их лечения
Стенотическое поражение сонной артерии – это состояние, при котором происходит сужение (стеноз) или полное закрытие (окклюзия) сонной артерии. У человека имеются две сонные артерии, располагающиеся на шее (справа и слева). Эти кровеносные сосуды приносят кровь к головному мозгу и лицу.
Наиболее частой причиной сужения или окклюзии сонной артерии является отложение на внутренних стенках сосуда атеросклеротических бляшек. Бляшка состоит из рубцовой ткани, клеток крови, холестерина и других жирных веществ. Увеличение бляшки сужает артерию и замедляет кровоток.
На бляшках могут образовываться сгустки крови (тромбы) еще больше препятствующие кровотоку. Части тромба или атеросклеротической бляшки могут отделяться и с током крови попадать в артерии головного мозга.
В результате чего, происходит, так называемая, эмболия сосудов головного мозга, приводящая к развитию ишемического инсульта.
Окклюзия сонной артерии может привести к развитию инсульта или внезапной быстрой смерти.
Риск для жизни возрастает при наличии поражения сонных артерий с обеих сторон. Наиболее частой причиной сужения или окклюзии сонной артерии является отложение на внутренних стенках сосуда атеросклеротических бляшек.
Бляшка состоит из рубцовой ткани, клеток крови, холестерина и других жирных веществ. Увеличение бляшки сужает артерию и замедляет кровоток. На бляшках могут образовываться сгустки крови (тромбы) еще больше препятствующие кровотоку.
Части тромба или атеросклеротической бляшки могут отделяться и с током крови попадать в артерии головного мозга. В результате чего, происходит, так называемая, эмболия сосудов головного мозга, приводящая к развитию ишемического инсульта.
Окклюзия сонной артерии может привести к развитию инсульта или внезапной быстрой смерти.
Риск для жизни возрастает при наличии поражения сонных артерий с обеих сторон.
Наиболее частой причиной сужения или окклюзии сонной артерии является отложение на внутренних стенках сосуда атеросклеротических бляшек.
Бляшка состоит из рубцовой ткани, клеток крови, холестерина и других жирных веществ. Увеличение бляшки сужает артерию и замедляет кровоток.
На бляшках могут образовываться сгустки крови (тромбы) еще больше препятствующие кровотоку.
Части тромба или атеросклеротической бляшки могут отделяться и с током крови попадать в артерии головного мозга. В результате чего, происходит, так называемая, эмболия сосудов головного мозга, приводящая к развитию ишемического инсульта.
Окклюзия сонной артерии может привести к развитию инсульта или внезапной быстрой смерти. Риск для жизни возрастает при наличии поражения сонных артерий с обеих сторон.
Симптомы стенозов сонных артерий
Большинство людей с поражениями сонных артерии не имеют никаких симптомов. При наличии симптомов риск возникновения ишемического инсульта повышается в несколько раз.
Наиболее частыми симптомами являются транзиторные (т.е. приходящие) ишемические атаки, которые иногда называются малым инсультом.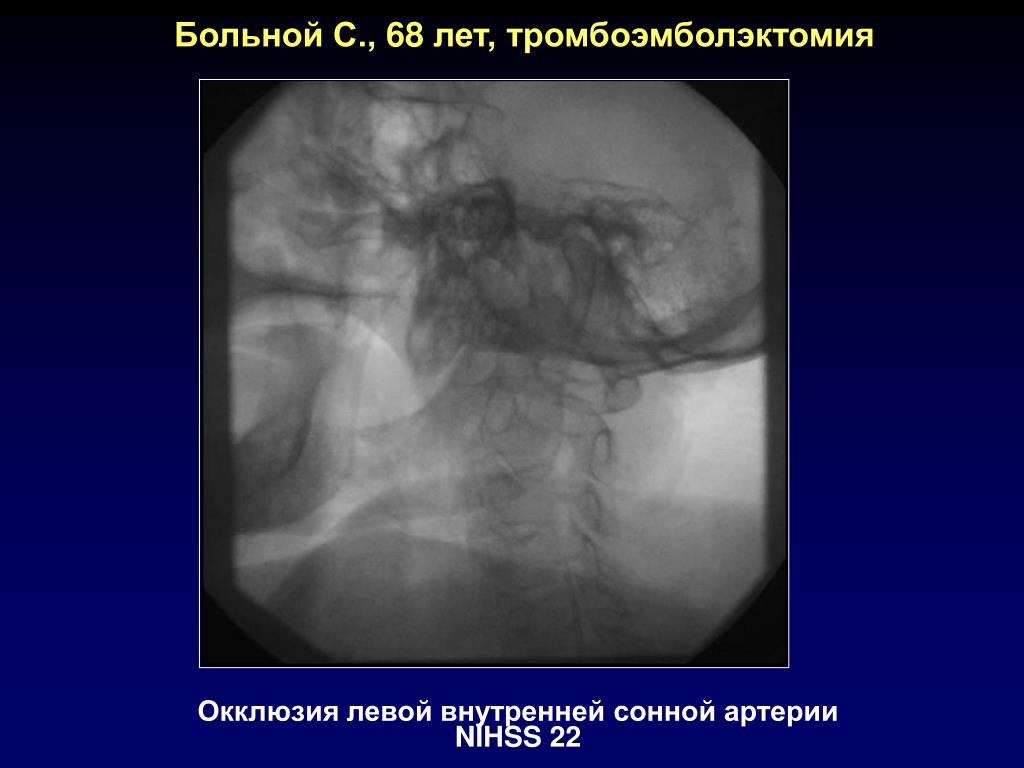
Во время ишемической атаки снижается кровоснабжение определенных участков головного мозга. Это может вызвать временные головокружения, нарушения зрения, онемение и покалывание кожи конечностей, слабость в руке или ноге, которые обычно длятся не более 30 минут.
Риск возникновения инсульта очень высок у людей, перенесших транзиторные ишемические атаки.
Инсульт возникает при резком снижении кровоснабжения по сосуду питающему головной мозг или при его окклюзии. В зависимости от страдающего участка мозга инсульт проявляется параличом руки и/или ноги, нарушениями зрения и речи, изменениями поведения.
Чем больше поражается участок мозга, тем больше риск для жизни.
Факторы риска возникновения инцульта:
- Атеросклероз
- Сахарный диабет
- Повышенное кровяное артериальное давление
- Курение
- Употребление жирной пищи
- Лишний вес
- Повышенное тромбообразование
Диагностика стенозов сонных артерий
Для того чтобы определить есть ли у Вас стенотические поражения сонных артерий или нет, Ваш врач осмотрит Вас.
Даже при отсутствии у Вас симптомов болезни, врач может выслушать шум над сонными артериями, вызванный током крови через стенозированный участок.
В случае необходимости Вам будет назначена ультразвуковая допплерография магистральных артерий головы (УЗДГ МАГ), электроэнцефалография головного мозга (ЭЭГ) или компьютерная томография (КТ).
Для более детальной оценки состояния сонных артерий врач может порекомендовать Вам сделать ангиографию (рентгенологическое исследование кровеносных сосудов).
Это исследование проводится путем катетеризации, как правило, бедренной артерии под местной анестезией в специальной операционной, оснащенной ангиографической установкой.
После исследования врач определит наличие поражения и выберет для Вас оптимальный способ лечения.
Ангиография сонных артерий
Во время этого исследования очень тонкий катетер вводится в артерию на Вашей ноге и продвигается к шее.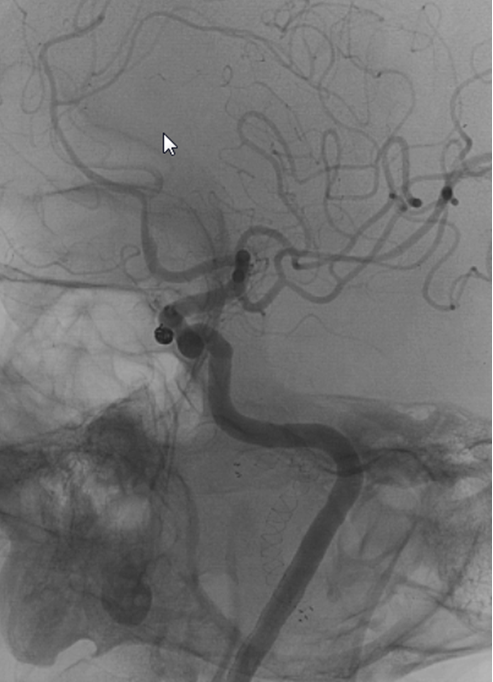 После этого через катетер вводится контрастное вещество, делающее видимыми сонные артерии и другие артерии шеи под рентгеновскими лучами.
После этого через катетер вводится контрастное вещество, делающее видимыми сонные артерии и другие артерии шеи под рентгеновскими лучами.
Накануне исследования Вам следует побрить кожу в паховой области. Вам также следует с вечера воздержаться от приема пищи и жидкости (кроме лекарств). В операционной Вас укроют стерильными простынями, до которых нельзя дотрагиваться, чтобы не нарушить стерильность.
Во время исследования врач будет контролировать Вашу электрокардиограмму (ЭКГ) и кровяное давление (АД). Место введения катетера будет обработано антисептиком и обезболено.
После этого врач произведет пункцию Вашей артерии, через которую проведет катетер к Вашей шее. Вы не почувствуете этого, но сможете видеть катетер на мониторе.
Вы должны выполнять все указания врача. Иногда нужно будет задерживать дыхание и не шевелиться. Периодически, от введения контрастного вещества, Вы можете ощущать тепло или прилив жара в голове. Врач произведет съемку артерии. Если у Вас имеются стенозы или окклюзии сонных артерий – они будут обнаружены.
В зависимости от полученных результатов Вам может быть рекомендована лечебная процедура или назначено повторное обследование на более поздний срок.
Лечение стенозов сонных артерий
На сегодняшний день во всем мире самым передовым и малотравматичным способом лечения стенозов сонных артерий является их стентирование. Стентированием называется установка в суженную часть артерии стента, который представляет собой металлическую трубочку, состоящую из ячеек.
Раскрываясь, стент изнутри раздвигает суженные стенки артерии и постоянно поддерживает их в расправленном состоянии. Благодаря этому восстанавливается внутренний просвет артерии и тем самым улучшается кровоснабжение головного мозга.
Первые этапы стентирования сонной артерии осуществляются также, как и ангиографическое исследование: подготовка, местное обезболивание, пункция артерии, проведение катетера и введение контрастного вещества. Продолжительность всей операции занимает не больше часа.
Периодически Вы будете ощущать приливы жара в голове.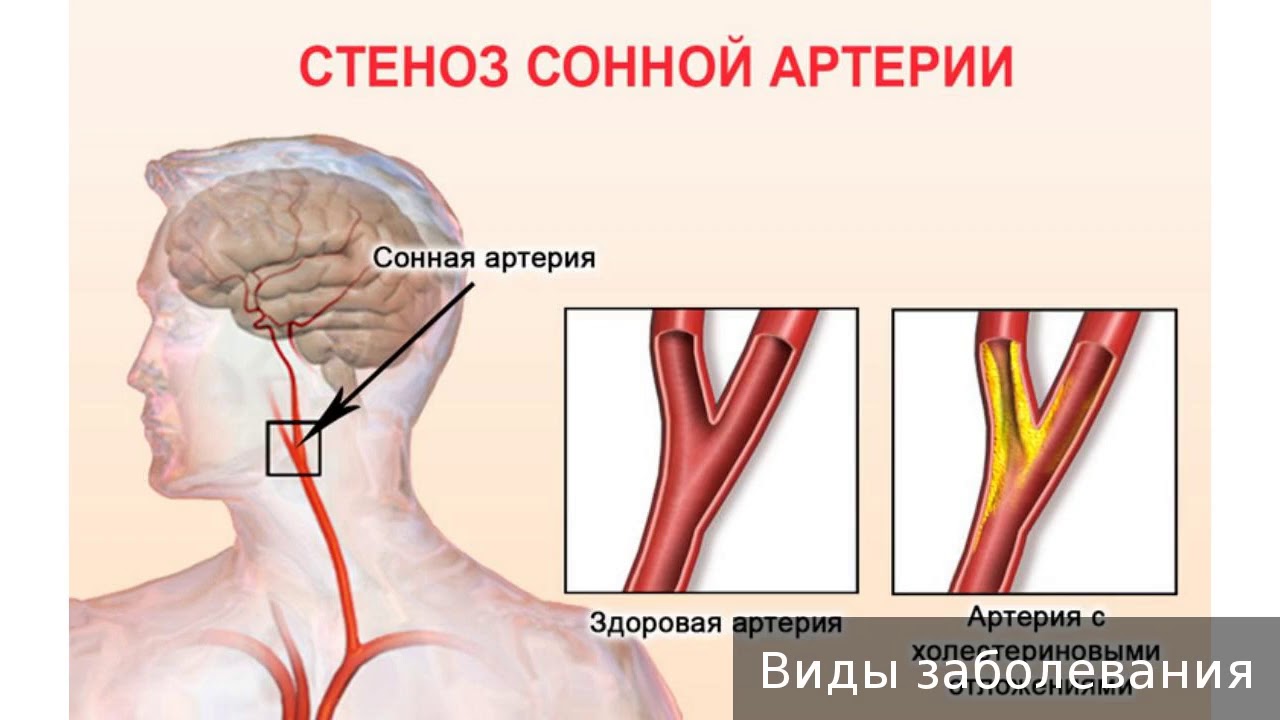 Врач также может просить Вас пошевелить рукой, ногой или произвести другие действия.
Врач также может просить Вас пошевелить рукой, ногой или произвести другие действия.
Стентирование сонных артерий может выполняться с защитой или без защиты от микроэмболии сосудов головного мозга во время операции.
Этот вопрос до недавнего времени оставался открытым, однако ряд исследований, проведенных во всем мире доказали эффективность и необходимость использования внутрисосудистых защитных устройств во время стентирования сонных артерий.
При использовании защиты снижается риск возникновения инсульта во время операции. На сегодняшний момент ряд ведущих мировых специалистов отдают предпочтение так называемым фильтрам.
Фильтр представляет собой металлический каркас, на котором расположена мембрана (отдаленно напоминающая зонтик).
Фильтр задерживает микроэмболы не препятствуя при этом току крови по сосуду: кровь протекает через микропоры в мембране, не пропускающие эмболы.
Проводник с фильтром
После пункции артерии, установив проводниковый катетер в пораженную атеросклерозом сонную артерию, врач проводит проводник с фильтром выше места сужения артерии.
Затем по проводнику в область стеноза устанавливается стент. На мониторе врач может увидеть и оценить полученный результат. В некоторых случаях может потребоваться раздуть установленный стент специальным баллонным катетером.
В этот момент Вы можете ощущать некоторый дискомфорт в области шеи и изменение частоты сердечных сокращений. Это нормально и не должно Вас беспокоить.
В конце вмешательства удаляется фильтр, баллон (если его использовали) и проводниковый катетер.
Стент остается в артерии постоянно, поддерживая ее в раскрытом состоянии.
Врач прижмет место пункции бедренной артерии на несколько минут до полной остановки кровотечения. Вас могут перевести на несколько часов в отделение реанимации для наблюдения за Вашими жизненными показателями.
В течение суток после стентирования Вам следует соблюдать строгий постельный режим. После возвращения в палату Вы сможете есть и пить в обычном режиме.
Продолжительность пребывания в больнице зависит, главным образом, от быстроты заживления места пункции артерии..jpg) Большинство пациентов выписываются на следующий день после операции.
Большинство пациентов выписываются на следующий день после операции.
После возвращения домой Вы должны строго соблюдать все предписания врача и регулярно принимать назначенные Вам лекарства. От этого зависит дальнейший успех выполненной Вам операции.
Следует регулярно проходить осмотры невропатолога. При появлении новых жалоб следует сразу обратиться к врачу.
Строго придерживаясь рекомендаций врача после операции, Вы сможете быть уверены в лучшем качестве жизни на многие годы.
Окклюзия внутренней сонной артерии как причина рецидивирующей «преходящей слепоты» и артериальной гипертензии?
Окклюзия внутренней сонной артерии как причина рецидивирующей «преходящей слепоты» и артериальной гипертензии? Пример успешного эндоваскулярного лечения.
Шукуров Ф.Б., Чигидинова Д.С., Руденко Б.А., Шаноян А.С.
ФГБУ «Государственный научно-исследовательский центр профилактической медицины» Минздрава РФ.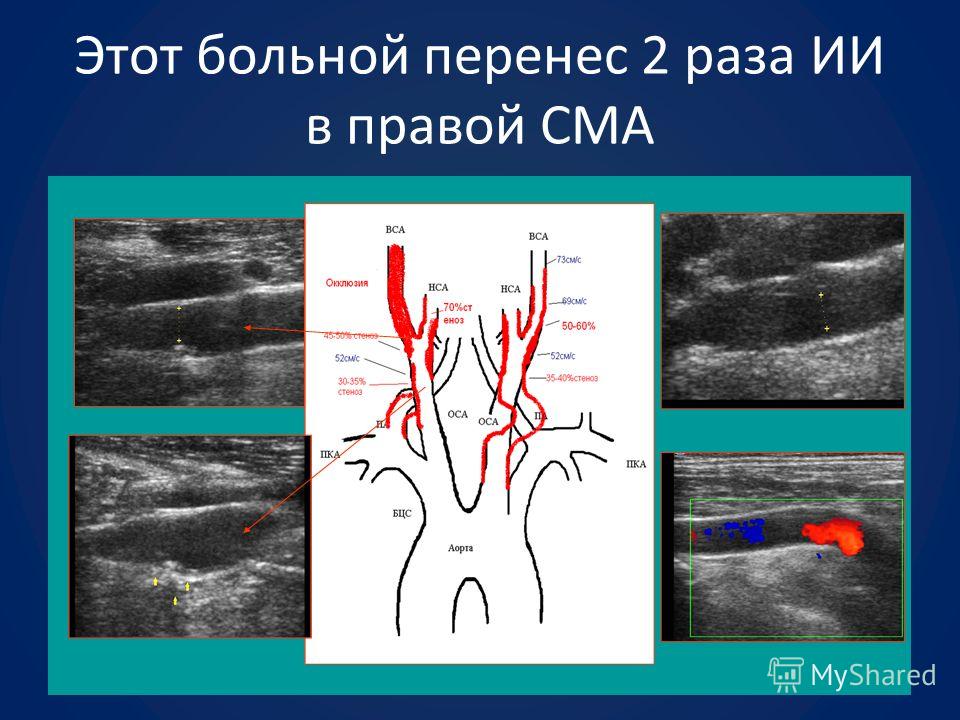 101990, Россия, Москва, Петроверигский пер., 10, стр. 3.
101990, Россия, Москва, Петроверигский пер., 10, стр. 3.
В неврологическое отделение поступил пациент 60 лет с жалобами на слабость и чувство онемения в левых конечностях, шаткость при ходьбе, нарушение речи (в течение 12 месяцев) и рецидивирующую кратковременную потерю зрения (последний эпизод за 2 недели до госпитализации). Повышенное АД до 160/100мм.рт.ст.
Из анамнеза известно, что страдает гипертонической болезнью на протяжении 10 лет (на фоне многокомпонентной терапии среднее АД по данным самоконтроля артериального давления (СКАД) составляло 145/80мм.рт.ст.). За год до госпитализации перенес ОНМК в теменно-затылочной области справа с клиникой левостороннего гемипареза, на фоне консервативной терапии — уменьшение симптоматики.
Выполнено МРТ головного мозга в режиме DWI: постинсультные изменения в теменно-затылочной области справа размерами 40x34x25 мм, мелкие сосудистые очаги, асимметрия полушарий мозга.
Выполнено контрольное дуплексное сканирование брахиоцефальных артерий, по результатам которого выявлен 80% стеноз устья правой внутренней сонной артерии (пВСА). Пиковая скорость кровотока в пВСА – 250 см/сек. Учитывая рецидивирующую клинику ТИА, гемодинамически-значимое поражение правой ВСА – больному рекомендована реваскуляризация в бассейне правой ВСА. Однако при селективной ангиографии брахиоцефальных артерий выявлена короткая окклюзия правой ВСА от устья.
Пиковая скорость кровотока в пВСА – 250 см/сек. Учитывая рецидивирующую клинику ТИА, гемодинамически-значимое поражение правой ВСА – больному рекомендована реваскуляризация в бассейне правой ВСА. Однако при селективной ангиографии брахиоцефальных артерий выявлена короткая окклюзия правой ВСА от устья.
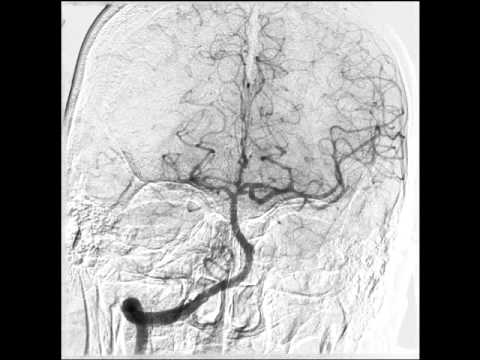
Интракраниальные отделы кровоснабжаются из бассейна левой сонной артерии по Вилизиеву кругу.
Учитывая «симптомность» поражения сонной артерии, а также благоприятные анатомо-морфологические характеристики поражения и высокую вероятность успеха эноваскулярного лечения — принято решение о проведении ангиопластики со стентированием правой внутренней сонной артерии с использованием проксимальной системы защиты головного мозга.
Операция проводилась правым феморальным доступом. Дистальный баллон системы позиционирован на расстоянии 1 см дистальнее бифуркации, в проксимальный отдел пНСА. Проксимальный баллон системы позиционирован в дистальном отделе пОСА. Последовательно произведено
раздувание дистального (в наружной сонной артерии) и проксимального (в общей сонной артерии) баллонов системы с перекрытием кровотока по целевому сосуду.
Проведение проводника за зону окклюзии с последующей реканализацией окклюзии баллонным катетером d=3 L=20 мм инфляцией 14 атм.
В область остаточного стеноза позиционирован и имплантирован самораскрывающийся каротидный стент с «закрытой ячейкой» d= 8-6 L=40 мм, с последующей постдилатацией стентированного сегмента баллонным катетером d=6 L=20 мм инфляцией 8 атм.
Выполнена аспирация 60 мл крови через систему церебральной протекции с получением атеросклеротического дебриса до получения «чистой» крови. Поочередно произведено снижение давления в дистальном и проксимальном баллонах системы, антеградный кровоток по правой ВСА восстановлен. Интракраниальные отделы хорошо кровоснабжаются из бассейна правой сонной артерии.
Общее время перекрытия правой ОСА составило 12 минут.
Во время операции пациент находился в сознании, был доступен продуктивному вербальному контакту, активно жалоб не предъявлял, очаговой неврологической симптоматики не отмечалось, гемодинамические показатели оставались стабильными.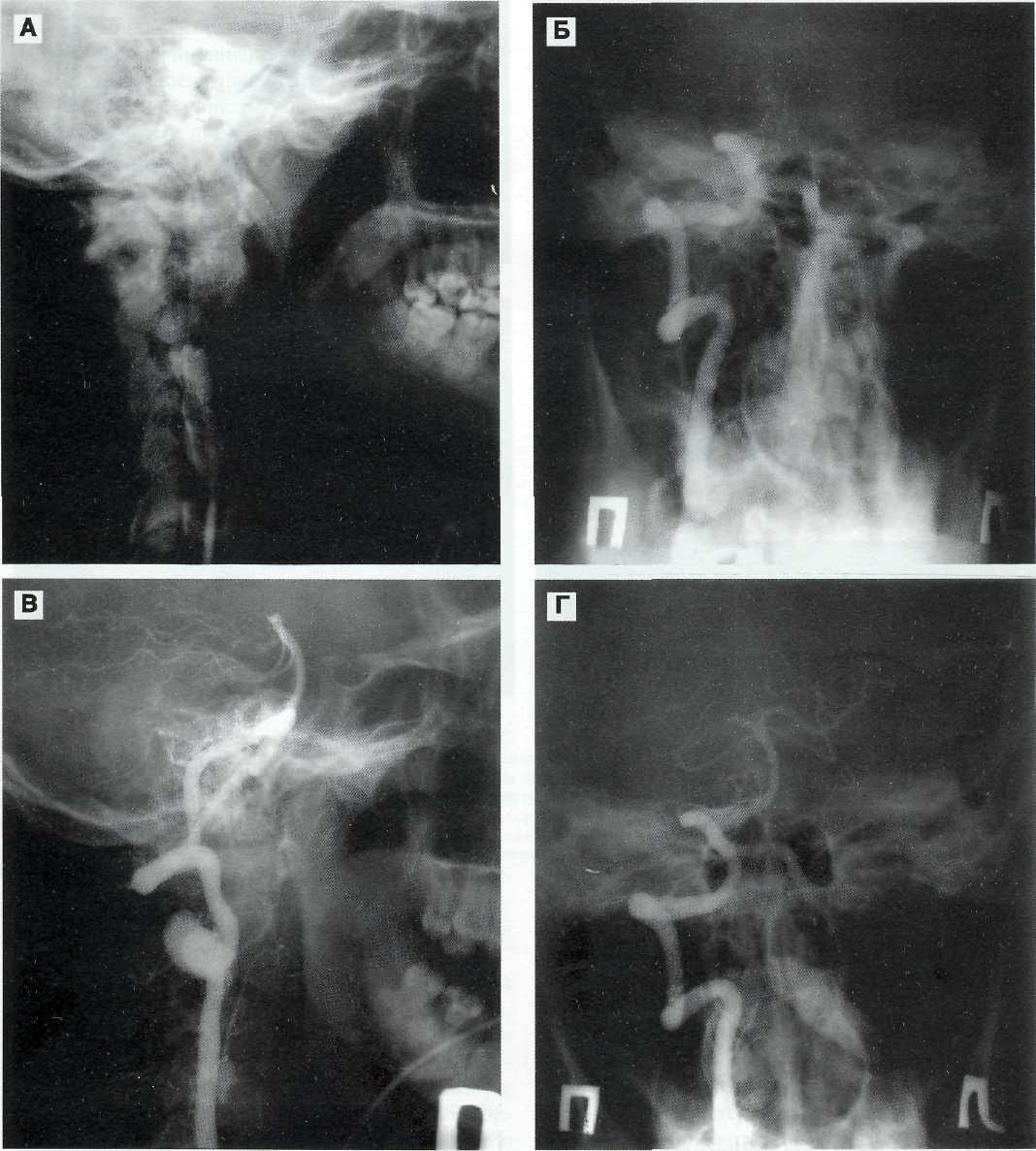
МРТ головного мозга в режиме DWI в 1-е сутки после операции: очагов повышенного МР-сигнала в веществе головного мозга не выявлено в режиме DWI b =1000.
Больной был выписан на 2-е сутки послеоперационного периода.
В ближайшем и отдаленном послеоперационном периоде (3, 12 месяцев) –регресс неврологической симптоматики, данных за рецидив «преходящей слепоты» нет. По данным СКАД (на фоне прежней гипотензивной терапии среднее АД составляло 125/70мм.рт.ст. (145/80мм.рт.ст. до вмешательства).
Заключение: данный пример является иллюстрацией того, что правильный подбор пациентов и адекватная оценка факторов риска интраоперационных осложнений позволяет добиться максимально эффективных результатов эндоваскулярного лечения. Асимптомное окклюзирующее поражение внутренней сонной артерии является противопоказанием к реваскуляризации в данном бассейне, тогда как при симптомном течении патологического процесса для оптимальных результатов эндоваскулярного лечения необходим детальный подбор пациентов, оценка анатомо-морфологических характеристик окклюзирующего атеросклеротического поражения и наличие необходимого операционного инструментария, опыт хирурга, подготовленность операционной, взаимодействие с неврологами.
Комментарии могут оставлять только авторизованные пользователи
Хирургическое лечение атеросклеротической окклюзии внутренней сонной артерии
Известно, что для обеспечения высокой активности метаболических процессов в головном мозге необходима постоянная поддержка его адекватного кровоснабжения [1, 2]. При нарушении кровоснабжения возникают патологические процессы, обусловленные ишемизацией мозговой ткани, что чаще всего связано с нарушениями структуры и функции мозговых сосудов.
В 1951 г. Ch. Fisher [3] была отмечена связь окклюзии внутренней сонной артерии (ВСА) с ишемическим инсультом. При этом автор подчеркнул, что окклюзия ВСА обычно развивается на фоне атеросклеротического поражения ее шейного сегмента, а предвещают приближающийся ишемический инсульт транзиторные ишемические атаки (ТИА).
Хотя до сих пор обсуждается патогенез развития ишемического инсульта у больных с окклюзией ВСА [4], она диагностируется приблизительно у 15% пациентов c ТИА или инфарктами в каротидном бассейне [5-8]. При окклюзии крупных артерий церебральное перфузионное давление (ЦПД) снижается, и для его поддержания на требуемом уровне компенсаторно расширяются артерии среднего калибра (приводя к повышению сосудисто-мозгового объема) с одновременным усилением кровотока по существующим коллатералям. При этом показатели объемного мозгового кровотока не меняются. Данный механизм ауторегуляции мозгового кровотока соответствует I стадии гемодинамической декомпенсации. По мере дальнейшего снижения ЦПД, в том числе по причине недостаточно развитой коллатеральной сети, исчерпываются возможности компенсаторной вазодилатации, приводя к «срыву» ауторегуляции и понижению объемного мозгового кровотока. При этом метаболические процессы, обеспечивающие нормальное функционирование головного мозга, поддерживаются за счет повышенного потребления кислорода тканью мозга (II стадия) [9, 10]. Иногда II стадию декомпенсации церебральной гемодинамики называют «нищей» перфузией [11].
При окклюзии крупных артерий церебральное перфузионное давление (ЦПД) снижается, и для его поддержания на требуемом уровне компенсаторно расширяются артерии среднего калибра (приводя к повышению сосудисто-мозгового объема) с одновременным усилением кровотока по существующим коллатералям. При этом показатели объемного мозгового кровотока не меняются. Данный механизм ауторегуляции мозгового кровотока соответствует I стадии гемодинамической декомпенсации. По мере дальнейшего снижения ЦПД, в том числе по причине недостаточно развитой коллатеральной сети, исчерпываются возможности компенсаторной вазодилатации, приводя к «срыву» ауторегуляции и понижению объемного мозгового кровотока. При этом метаболические процессы, обеспечивающие нормальное функционирование головного мозга, поддерживаются за счет повышенного потребления кислорода тканью мозга (II стадия) [9, 10]. Иногда II стадию декомпенсации церебральной гемодинамики называют «нищей» перфузией [11].
На сегодняшний день для исследования церебральной гемодинамики и оценки цереброваскулярного резерва применяются инструментальные методы, позволяющие оценить объем мозгового кровотока, в том числе с использованием внутривенной пробы с ацетазоламидом [12]. «Нищая» перфузия проявляется снижением объема мозгового кровотока на стороне окклюзии ВСА после введения ацетазоламида, тогда как в норме при этом он увеличивается [12-14]. Исследование объема мозгового кровотока возможно с помощью позитронно-эмиссионной томографии (ПЭТ), однофотонной эмиссионной компьютерной томографии (КТ), КТ с ингаляцией ксенона, магнитно-резонансной томографии, транскраниальной допплерографии, а также перфузионной КТ (п-КТ) [15]. Преимуществами п-КТ являются ее общедоступность, простота и непродолжительность исследования, а также возможность получения количественных результатов [12, 16, 17]. Помимо объема мозгового кровотока, п-КТ оценивает сосудисто-мозговой объем и среднее время прохождения контрастного вещества по артериям в исследуемой области головного мозга [18].
«Нищая» перфузия проявляется снижением объема мозгового кровотока на стороне окклюзии ВСА после введения ацетазоламида, тогда как в норме при этом он увеличивается [12-14]. Исследование объема мозгового кровотока возможно с помощью позитронно-эмиссионной томографии (ПЭТ), однофотонной эмиссионной компьютерной томографии (КТ), КТ с ингаляцией ксенона, магнитно-резонансной томографии, транскраниальной допплерографии, а также перфузионной КТ (п-КТ) [15]. Преимуществами п-КТ являются ее общедоступность, простота и непродолжительность исследования, а также возможность получения количественных результатов [12, 16, 17]. Помимо объема мозгового кровотока, п-КТ оценивает сосудисто-мозговой объем и среднее время прохождения контрастного вещества по артериям в исследуемой области головного мозга [18].
Для улучшения коллатерального кровоснабжения головного мозга у больных с сосудисто-мозговой недостаточностью M. Yasargil и R. Donaghy в 1967 г. была разработана и внедрена в клиническую практику операция создания анастомоза между поверхностной височной артерией и ветвью средней мозговой артерии (цит. по [19]), получившая название «экстра-интракраниальный микроартериальный анастомоз» (ЭИКМА). Со временем операция ЭИКМА приобрела популярность в нейрохирургическом сообществе, например в 70-е годы в США ежегодно выполнялось несколько тысяч таких вмешательств [20, 21]. Однако проведенное в 1985 г. мультицентровое исследование (EC-IC Bypass Study) [22, 23], продолжавшееся 5 лет и включавшее 1377 больных, не выявило преимуществ операции ЭИКМА по сравнению с медикаментозной профилактикой ТИА и ишемического инсульта аспирином. Следует отметить, что исследование EC-IC Bypass оказалось недостаточно репрезентативным по больным, имеющим повышенный риск прогрессирования ишемии головного мозга, поскольку на момент его проведения отсутствовали диагностические методы, позволяющие выявить пациентов с декомпенсированной церебральной гемодинамикой [24-31].
по [19]), получившая название «экстра-интракраниальный микроартериальный анастомоз» (ЭИКМА). Со временем операция ЭИКМА приобрела популярность в нейрохирургическом сообществе, например в 70-е годы в США ежегодно выполнялось несколько тысяч таких вмешательств [20, 21]. Однако проведенное в 1985 г. мультицентровое исследование (EC-IC Bypass Study) [22, 23], продолжавшееся 5 лет и включавшее 1377 больных, не выявило преимуществ операции ЭИКМА по сравнению с медикаментозной профилактикой ТИА и ишемического инсульта аспирином. Следует отметить, что исследование EC-IC Bypass оказалось недостаточно репрезентативным по больным, имеющим повышенный риск прогрессирования ишемии головного мозга, поскольку на момент его проведения отсутствовали диагностические методы, позволяющие выявить пациентов с декомпенсированной церебральной гемодинамикой [24-31].
В последующие 20 лет были разработаны нейровизуализационные методики, позволяющие облегчить отбор больных с окклюзирующими поражениями артерий головного мозга и с ожидаемой пользой от реваскуляризирующих вмешательств.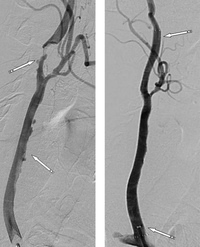 Было проведено несколько исследований оценки риска развития ишемического инсульта в зависимости от выраженности расстройств церебральной гемодинамики. Например, в исследовании Каротидной Окклюзии St. Louis оценивалась возможность ПЭТ в выявлении «нищей» перфузии головного мозга. При повышении экстракции кислорода мозговой тканью было отмечено повышение риска ипсилатерального ишемического инсульта в течение 2 лет до 26,5% по сравнению с 5,3% у пациентов с нормальными показателями [10]. В исследовании из Японии [32] оценивался риск повторного ишемического инсульта методом ПЭТ при проведении нагрузочной пробы с ацетазоламидом. Ежегодный риск ишемического инсульта при наблюдении в сроки до 45,6 мес составил 10,6% для больных с повышенным потреблением кислорода мозговой тканью, тогда как при нормальном потреблении он отсутствовал [32].
Было проведено несколько исследований оценки риска развития ишемического инсульта в зависимости от выраженности расстройств церебральной гемодинамики. Например, в исследовании Каротидной Окклюзии St. Louis оценивалась возможность ПЭТ в выявлении «нищей» перфузии головного мозга. При повышении экстракции кислорода мозговой тканью было отмечено повышение риска ипсилатерального ишемического инсульта в течение 2 лет до 26,5% по сравнению с 5,3% у пациентов с нормальными показателями [10]. В исследовании из Японии [32] оценивался риск повторного ишемического инсульта методом ПЭТ при проведении нагрузочной пробы с ацетазоламидом. Ежегодный риск ишемического инсульта при наблюдении в сроки до 45,6 мес составил 10,6% для больных с повышенным потреблением кислорода мозговой тканью, тогда как при нормальном потреблении он отсутствовал [32].
В 2011 г. было завершено масштабное исследование хирургического лечения каротидной окклюзии — COSS (Carotid Occlusion Surgery Study) [33], на котором мы остановимся более подробно.
COSS проводилось на территории США и Канады в 49 стационарах и 18 центрах, оснащенных позитронноэмиссионными томографами. Критериями включения пациентов в исследование было наличие ТИА либо ишемического инсульта (в одноименном полушарии с окклюзированной сонной артерией) в период до 120 дней с момента ишемического эпизода. Больные с асимметрией показателей экстракции кислорода ипсилатеральное/контралатеральное полушарие >1,13 рандомизировались в две группы: лечившиеся консервативным методом («консервативная») и хирургическим (ЭИКМА). Инсульт или летальный исход в течение 30 дней после операции либо ипсилатеральный ишемический инсульт в течение 2 лет стали определяющими критериями (конечная точка) для каждого клинического случая. После предварительного анализа результатов лечения 195 больных COSS было досрочно завершено по причине неубедительности полученных данных. Тем не менее представленные группой COSS наблюдения заслуживают внимания.
По данным COSS, определяющие критерии в течение 2 лет существенно не различались в выделенных группах, составив 21% в хирургической и 22,7% в «консервативной» группе соответственно.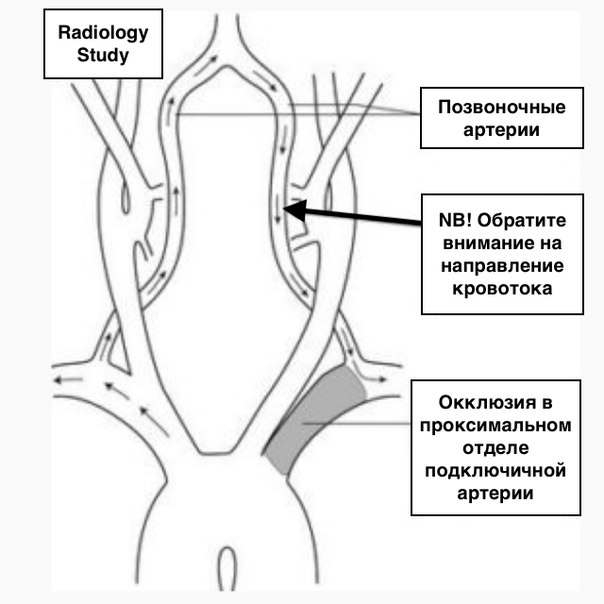
В хирургической группе было зарегистрировано улучшение показателя экстракции кислорода по сравнению с исходным уровнем при проведении ПЭТ в сроки с 30-го по 60-й день после операции.
В «консервативной» группе были получены существенно более низкие показатели развития инсульта, чем предполагалось — 22,7% против 40%. По мнению ряда исследователей [33], показатели лечения в «консервативной» группе улучшились благодаря терапии статинами. Не вызывает сомнения, что совершенствование медикаментозной терапии ведет к снижению заболеваемости инсультом. Так, в завершившемся недавно исследовании SAMMPRIS [34] агрессивная медикаментозная терапия, направленная на достижение уровня липопротеинов низкой плотности менее 70 мг/дл (1,81 ммоль/л), постоянный контроль за цифрами артериального давления и показателями гликемии при сахарном диабете, отказ от курения и малоподвижного образа жизни, снижение избыточной массы тела привели к существенному снижению заболеваемости инсультом у больных со стенозами интракраниальных артерий. Сходные результаты были получены и в широкомасштабном исследовании SPARCL [35], продемонстрировавшем очевидную пользу от назначения аторвастатина в дозе 80 мг/сут, позволившем уменьшить абсолютный риск развития инсульта на 5,5% при поражении артерий крупного диаметра.
Сходные результаты были получены и в широкомасштабном исследовании SPARCL [35], продемонстрировавшем очевидную пользу от назначения аторвастатина в дозе 80 мг/сут, позволившем уменьшить абсолютный риск развития инсульта на 5,5% при поражении артерий крупного диаметра.
Для выяснения причин неэффективности критериев COSS, разработанных с целью выявления лиц с повышенным риском прогрессирования ишемии головного мозга, были оценены другие факторы, способствовавшие снижению заболеваемости инсультом в «консервативной» группе больных [36]. Во-первых, настолько ли специфична ПЭТ, чтобы ее использование было оправдано для отбора пациентов? Были проанализированы методики, использовавшиеся для оценки цереброваскулярного резерва с помощью ПЭТ. В исследовании Каротидной Окклюзии St. Louis, взятом «за основу» исследователями COSS, оценка экстракции кислорода мозговой тканью определялась как межполушарная разница показателей, т.е. полученные результаты имели относительный характер, тогда как в исследовании H. Yamauchi и соавт. [37] суждения о недостаточности кровоснабжения головного мозга принимались на основании абсолютных показателей экстракции кислорода. По мнению авторов, такой способ расчетов достовернее, поскольку: 1) даже при односторонней окклюзии ВСА страдает и контралатеральное полушарие вследствие развития синдрома обкрадывания, поскольку кровоснабжение полушария на ее стороне, как правило, осуществляется через переднюю соединительную артерию из бассейна контралатеральной ВСА; 2) при двусторонних либо множественных окклюзиях магистральных артерий головы судить о состоянии кровоснабжения полушарий головного мозга можно лишь на основании абсолютных показателей. Тем не менее анализ данных, полученных в исследовании Каротидной Окклюзии St. Louis, продемонстрировал, что методика расчета относительных показателей проще и имеет сходную чувствительность с расчетом абсолютных показателей в прогнозировании повышенного риска ишемии мозга [38]. Более того, в подгруппе больных с контралатеральными каротидными стенозами, включенных в исследование COSS, метод относительной (межполушарная) оценки экстракции кислорода вряд ли отражал истинное состояние кровоснабжения головного мозга, как и степень его компенсации.
Yamauchi и соавт. [37] суждения о недостаточности кровоснабжения головного мозга принимались на основании абсолютных показателей экстракции кислорода. По мнению авторов, такой способ расчетов достовернее, поскольку: 1) даже при односторонней окклюзии ВСА страдает и контралатеральное полушарие вследствие развития синдрома обкрадывания, поскольку кровоснабжение полушария на ее стороне, как правило, осуществляется через переднюю соединительную артерию из бассейна контралатеральной ВСА; 2) при двусторонних либо множественных окклюзиях магистральных артерий головы судить о состоянии кровоснабжения полушарий головного мозга можно лишь на основании абсолютных показателей. Тем не менее анализ данных, полученных в исследовании Каротидной Окклюзии St. Louis, продемонстрировал, что методика расчета относительных показателей проще и имеет сходную чувствительность с расчетом абсолютных показателей в прогнозировании повышенного риска ишемии мозга [38]. Более того, в подгруппе больных с контралатеральными каротидными стенозами, включенных в исследование COSS, метод относительной (межполушарная) оценки экстракции кислорода вряд ли отражал истинное состояние кровоснабжения головного мозга, как и степень его компенсации. Обобщая сказанное, можно утверждать, что специально разработанные для выявления лиц с повышенным риском прогрессирования ишемии головного мозга критерии оценки результатов ПЭТ, использовавшиеся в исследовании COSS, оказались недостаточно эффективными. Во-вторых, исследователи COSS ориентировались на ретроспективный анализ подгрупп пациентов, вошедших в исследование Каротидной Окклюзии St. Louis, используя наиболее характерные клинические проявления, требовавшиеся для определения критериев, на основании которых в последующем вычленялись пациенты с повышенным риском прогрессирования ишемии мозга [39, 40]. Применение такого метода необоснованно, поскольку для прогнозирования того, что «возможно случится», использовался ретроспективный анализ данных, полученных не от всех больных, а лишь от определенных групп пациентов [41]. Неправомерность использования полученных на основании ретроспективного анализа результатов объясняется тем, что методика определения оптимальных точек пересечения при наслоении рисков предрасполагает к переоценке истинных различий и частоты развития конечного события в сравниваемых группах [42, 43].
Обобщая сказанное, можно утверждать, что специально разработанные для выявления лиц с повышенным риском прогрессирования ишемии головного мозга критерии оценки результатов ПЭТ, использовавшиеся в исследовании COSS, оказались недостаточно эффективными. Во-вторых, исследователи COSS ориентировались на ретроспективный анализ подгрупп пациентов, вошедших в исследование Каротидной Окклюзии St. Louis, используя наиболее характерные клинические проявления, требовавшиеся для определения критериев, на основании которых в последующем вычленялись пациенты с повышенным риском прогрессирования ишемии мозга [39, 40]. Применение такого метода необоснованно, поскольку для прогнозирования того, что «возможно случится», использовался ретроспективный анализ данных, полученных не от всех больных, а лишь от определенных групп пациентов [41]. Неправомерность использования полученных на основании ретроспективного анализа результатов объясняется тем, что методика определения оптимальных точек пересечения при наслоении рисков предрасполагает к переоценке истинных различий и частоты развития конечного события в сравниваемых группах [42, 43].
Можно утверждать, что попытки «вычленения» пациентов с повышенным риском прогрессирования ишемии мозга и включения их в COSS оказались безуспешными из-за предвзятого отношения к результатам, полученным в предшествующих исследованиях, и неубедительных диагностических критериев, разработанных для подтверждения факта декомпенсации церебральной гемодинамики.
В недавно завершенных исследованиях CREST и SAMMPRIS было продемонстрировано [44, 45], что хирургический опыт — важная составляющая исследований, оценивающих новые методы лечения и технологии, при этом требуется его подтверждение сертификационным экзаменом. На первый взгляд кажется, что организаторы COSS приняли все меры для того, чтобы операции ЭИКМА проводилась хирургами, имеющими достаточный опыт их выполнения. Однако более «пристальное» изучение критериев, необходимых для участия хирурга в исследовании COSS продемонстрировало, что достаточно было прохождения двухдневных обучающих курсов, а хирургам, самостоятельно выполнившим менее 10 таких операций, разрешалось оперировать под контролем более опытного коллеги. Можно предположить, что эти послабления были вызваны желанием организаторов COSS увеличить количество стационаров, участвующих в исследовании, однако зародили сомнения об уровне подготовки нейрохирургов, выполнявших операции. Несмотря на заявления исследователей COSS, что частота периоперационного инсульта не была связана с утвержденным сертификационным процессом, количество хирургических вмешательств, выполненных 93 пациентам 30 хирургами, оказалось ничтожно малым, чтобы выявить значимые различия. На основании анализа крупных национальных баз данных США [46-49] доказано, что эффективность нейрососудистых вмешательств, включая шунтирующие, напрямую зависит от количества выполняемых операций в конкретном учреждении. Анализ 558 операций ЭИКМА (данные Общенационального стационарного реестра США по выписанным больным) продемонстрировал связь между количеством операций и лучшими результатами лечения, при этом отношение шансов составило 0,45 при 10-кратном увеличении объема пролеченных больных [46].
Можно предположить, что эти послабления были вызваны желанием организаторов COSS увеличить количество стационаров, участвующих в исследовании, однако зародили сомнения об уровне подготовки нейрохирургов, выполнявших операции. Несмотря на заявления исследователей COSS, что частота периоперационного инсульта не была связана с утвержденным сертификационным процессом, количество хирургических вмешательств, выполненных 93 пациентам 30 хирургами, оказалось ничтожно малым, чтобы выявить значимые различия. На основании анализа крупных национальных баз данных США [46-49] доказано, что эффективность нейрососудистых вмешательств, включая шунтирующие, напрямую зависит от количества выполняемых операций в конкретном учреждении. Анализ 558 операций ЭИКМА (данные Общенационального стационарного реестра США по выписанным больным) продемонстрировал связь между количеством операций и лучшими результатами лечения, при этом отношение шансов составило 0,45 при 10-кратном увеличении объема пролеченных больных [46]. Высокий процент проходимости шунтов (98% в 30-дневный период и 96% в течение 723 дней после операции) в исследовании COSS можно считать показателем успешности выполненной операции и достаточного опыта хирурга. Хотя 15% частоты послеоперационных осложнений, с которыми столкнулись исследователи COSS, не «выходит» за рамки прогнозируемых и рассчитанных на основании результатов исследований EC-IC Bypass, завершенном в 1985 г., она все-таки не является идеалом, к которому нужно стремиться. Появившиеся новые технологии анестезиологического обеспечения, интенсивной терапии и реабилитационных мероприятий не должны провоцировать «рост» послеоперационных осложнений. Нейрохирурги из центров с большим хирургическим опытом также придерживаются мнения [50-53], что 15% — это «не самое лучшее, чего мы смогли достичь», оперируя больных с окклюзирующими поражениями магистральных артерий головы, кровоснабжение головного мозга у которых находится на грани гемодинамической декомпенсации, формально имеющих повышенные хирургические риски.
Высокий процент проходимости шунтов (98% в 30-дневный период и 96% в течение 723 дней после операции) в исследовании COSS можно считать показателем успешности выполненной операции и достаточного опыта хирурга. Хотя 15% частоты послеоперационных осложнений, с которыми столкнулись исследователи COSS, не «выходит» за рамки прогнозируемых и рассчитанных на основании результатов исследований EC-IC Bypass, завершенном в 1985 г., она все-таки не является идеалом, к которому нужно стремиться. Появившиеся новые технологии анестезиологического обеспечения, интенсивной терапии и реабилитационных мероприятий не должны провоцировать «рост» послеоперационных осложнений. Нейрохирурги из центров с большим хирургическим опытом также придерживаются мнения [50-53], что 15% — это «не самое лучшее, чего мы смогли достичь», оперируя больных с окклюзирующими поражениями магистральных артерий головы, кровоснабжение головного мозга у которых находится на грани гемодинамической декомпенсации, формально имеющих повышенные хирургические риски. Проще говоря, для того чтобы польза от хирургического лечения стала очевидной, требуется проведение сходного по количеству больных клинического исследования, при этом показатели по периоперационному инсульту должны быть снижены в 2 раза по сравнению с исследованием COSS [36].
Проще говоря, для того чтобы польза от хирургического лечения стала очевидной, требуется проведение сходного по количеству больных клинического исследования, при этом показатели по периоперационному инсульту должны быть снижены в 2 раза по сравнению с исследованием COSS [36].
Исследование COSS продемонстрировало в хирургической группе больных тенденцию к снижению частоты ишемических эпизодов в отдаленные сроки после операции. Сходные результаты были получены японскими исследователями, предварительно сообщившими о снижении частоты инсульта после операции ЭИКМА. В исследовании JET [54, 55] риск периоперационного инсульта приблизился к нулю, что указывает на превосходство хирургического метода лечения над консервативным. К сожалению, окончательные результаты этого исследования пока не опубликованы. Исследование COSS однозначно продемонстрировало улучшение кровоснабжения головного мозга в послеоперационном периоде (подтверждено проведением ПЭТ в динамике). Полученные результаты согласуются с концепцией эффективности реваскуляризации головного мозга путем наложения экстра-интракраниального микроанастомоза, способного предупредить прогрессирование ишемии головного мозга при условии максимального уменьшения рисков периоперационного инсульта. Кумулятивные кривые Каплан-Мейера, смоделированные на 2-летний период и позволяющие сравнивать хирургический и консервативный методы по риску ишемического инсульта, не имеют достоверных отличий, однако не исключено, что их «продление» все-таки продемонстрирует преимущество оперативного метода. Это означает, что если все пациенты будут прослежены в сроки до 5 лет, исследование COSS сможет доказать эффективность хирургического метода (для этого риск развития инсульта должен оставаться неизменным в обеих группах более 2 лет).
Кумулятивные кривые Каплан-Мейера, смоделированные на 2-летний период и позволяющие сравнивать хирургический и консервативный методы по риску ишемического инсульта, не имеют достоверных отличий, однако не исключено, что их «продление» все-таки продемонстрирует преимущество оперативного метода. Это означает, что если все пациенты будут прослежены в сроки до 5 лет, исследование COSS сможет доказать эффективность хирургического метода (для этого риск развития инсульта должен оставаться неизменным в обеих группах более 2 лет).
О спонтанном улучшении кровоснабжения головного мозга без хирургического вмешательства (в основном за счет развития коллатералей) было сообщено в небольших обсервационных исследованиях, хотя опубликованные результаты носили противоречивый характер. В одном из них [56] сообщалось об улучшении состояния пациентов в отдаленные сроки наблюдения, тогда как в другом [57] улучшение состояния было зарегистрировано в течение первых месяцев с начала наблюдения и не имело продолжительного эффекта в виде снижения риска инсульта в отдаленные сроки. К сожалению, пациентам «консервативной» группы COSS ПЭТ в динамике не выполнялась, поэтому на сегодняшний день нельзя получить достоверных отдаленных результатов, как и прогнозировать вероятность пересечения кумулятивных кривых Каплан-Мейера при анализе результатов лечения.
К сожалению, пациентам «консервативной» группы COSS ПЭТ в динамике не выполнялась, поэтому на сегодняшний день нельзя получить достоверных отдаленных результатов, как и прогнозировать вероятность пересечения кумулятивных кривых Каплан-Мейера при анализе результатов лечения.
Важно понимать, что исследование COSS было остановлено по причине неубедительности полученных результатов, не позволивших подтвердить гипотезу (риск развития инсульта 24% в хирургической и 40% в «консервативной» группе). Тем не менее, чтобы разница в рисках составила 10% в пользу хирургического метода лечения, требуется значительное увеличение (до 986) количества пациентов, включенных в исследование, что потребует привлечения дополнительных ресурсов и значительно удорожит его. Однако проведение такого исследования будет иметь значение для клинической практики и позволит получить ответ, который не дало исследование COSS [36].
Больные с рецидивирующей симптоматикой и грубым атеросклеротическим поражением магистральных артерий головы (у которых ишемия головного мозга провоцируется постуральными реакциями либо колебаниями артериального давления) как раз представляют тех пациентов, которым возможно улучшить кровоснабжение головного мозга путем реваскуляризирующих вмешательств. Такие пациенты не были «выделены» в исследовании COSS в отдельную подгруппу. Критерием включения в исследование был 120-дневный срок после ишемического «события», и одним из требований было стабильное состояние пациента, чтобы направить его для проведения ПЭТ (иногда даже требовался авиаперелет до ПЭТ-центра), чтобы принять окончательное решение о необходимости операции. Установлено, что обусловленная атеросклеротическим поражением магистральных артерий головы ишемия головного мозга наиболее часто рецидивирует в ранние сроки с момента появления первичных симптомов. Как правило, риск повторных ишемических атак у таких больных максимален в первые 2 нед с последующим снижением в дальнейшем [58-60]. Согласно опубликованным результатам исследования COSS, среднее время от клинической манифестации до включения пациента в исследование составило 72 дня, что не исключает стабилизации кровоснабжения головного мозга у части больных. Отсутствие повторных ишемических атак в течение 6 дней с момента «включения» в исследование (до выполнения операции) наводит на мысль, что риски прогрессирования ишемии головного мозга у этих больных не были повышенными.
Такие пациенты не были «выделены» в исследовании COSS в отдельную подгруппу. Критерием включения в исследование был 120-дневный срок после ишемического «события», и одним из требований было стабильное состояние пациента, чтобы направить его для проведения ПЭТ (иногда даже требовался авиаперелет до ПЭТ-центра), чтобы принять окончательное решение о необходимости операции. Установлено, что обусловленная атеросклеротическим поражением магистральных артерий головы ишемия головного мозга наиболее часто рецидивирует в ранние сроки с момента появления первичных симптомов. Как правило, риск повторных ишемических атак у таких больных максимален в первые 2 нед с последующим снижением в дальнейшем [58-60]. Согласно опубликованным результатам исследования COSS, среднее время от клинической манифестации до включения пациента в исследование составило 72 дня, что не исключает стабилизации кровоснабжения головного мозга у части больных. Отсутствие повторных ишемических атак в течение 6 дней с момента «включения» в исследование (до выполнения операции) наводит на мысль, что риски прогрессирования ишемии головного мозга у этих больных не были повышенными.
По протоколу COSS для включения в исследование требовалось наличие у пациента единичного ишемического эпизода. По одной из теорий, ишемия головного мозга при окклюзии ВСА — следствие артериальной эмболии, которая вряд ли будет рецидивировать на фоне начатой антитромботической терапии. С другой стороны, критерии отбора пациентов в исследование COSS выглядят обоснованными, поскольку окончательное решение о рандомизации принималось лишь после определения степени расстройств церебральной гемодинамики с помощью ПЭТ. Можно предположить, что у части больных по мере формирования коллатералей наступала компенсация нарушенной гемодинамики, тогда как остальные пациенты оставались в группе повышенного риска и имели рецидивирующую ишемию головного мозга, наличие которой можно объяснить неэффективной медикаментозной терапией. Данные о прогрессировании ишемии головного мозга у включенных в исследование пациентов на сегодняшний день не опубликованы. Вероятно, в COSS было включено недостаточно больных с рецидивирующей ишемией головного мозга, обусловленной прогрессирующей сосудисто-мозговой недостаточностью, которые как раз и являются кандидатами на реваскуляризирующие вмешательства [36].
Хотя COSS прекращено, продолжается вспомогательное исследование, оценивающее когнитивные расстройства у больных с окклюзией ВСА «Рандомизированная оценка каротидной окклюзии и когнитивной функции» (RECON) [61]. Учитывая малое количество пациентов, перенесших реваскуляризацию головного мозга, исследование вряд ли сможет достоверно оценить влияние операции на когнитивные функции, но, вероятно, предоставит подтверждающие гипотезу доказательства, что прирост мозгового кровотока, помимо предупреждения повторного инсульта, также способствует ощутимому клиническому улучшению. Имеются сообщения [62-65] об уменьшении выраженности когнитивных расстройств как после операции ЭИКМА, так и после каротидной эндартерэктомии при стенозах сонных артерий. D. Jussen и соавт. [66], изучающие эффективность операций шунтирования артерий головного мозга у больных с неврологическими «выпадениями» после завершенного инсульта, сообщили об улучшении не только электрофизиологических показателей, но и клинического состояния после операций. Опубликованы результаты исследований [67, 68], предоставивших данные об увеличении мозгового кровотока в ишемизированных участках головного мозга после реваскуляризирующих вмешательств.
Опубликованы результаты исследований [67, 68], предоставивших данные об увеличении мозгового кровотока в ишемизированных участках головного мозга после реваскуляризирующих вмешательств.
Приведенные в настоящем обзоре данные свидетельствуют, что на данный момент еще нет достаточных доказательств, способных подтвердить эффективность хирургического метода лечения. Это произошло, в основном, по причине переоценки ожидаемой заболеваемости инсультом в выбранной популяции больных. С момента завершения исследования EC-IC Bypass (1985) количество выполненных реваскуляризирующих вмешательств при окклюзии сонной артерии ограничилось ничтожно малой популяцией больных, прогрессирование ишемии головного мозга у которых не удавалось приостановить, используя даже максимально доступную антитромботическую терапию [52, 69]. Хотя COSS не предоставило доказательств в поддержку расширения показаний к хирургическому лечению, вероятно, у определенной категории пациентов можно добиться улучшения состояния в виде снижения риска инсульта при условии проведения операций в специализированных центрах и низких периоперационных осложнениях. Если посмотреть шире на проблему реваскуляризации головного мозга при окклюзии ВСА, то помимо предупреждения прогрессирования ишемии, шунтирование артерий головного мозга способно не только уменьшить выраженность когнитивных расстройств, но и улучшить функциональное состояние пациента уменьшением его зависимости либо полным избавлением от посторонней помощи, что должно стать предметом будущих научных исследований.
Если посмотреть шире на проблему реваскуляризации головного мозга при окклюзии ВСА, то помимо предупреждения прогрессирования ишемии, шунтирование артерий головного мозга способно не только уменьшить выраженность когнитивных расстройств, но и улучшить функциональное состояние пациента уменьшением его зависимости либо полным избавлением от посторонней помощи, что должно стать предметом будущих научных исследований.
Спонтанная реканализация хронической окклюзии внутренней сонной артерии
%PDF-1.3
%
54 0 obj
>]/PageLayout/SinglePage/Pages 47 0 R/Type/Catalog>>
endobj
110 0 obj
>/Font>>>/Fields[]>>
endobj
50 0 obj
>stream
2015-04-28T11:04:13+04:002015-05-22T14:21:24+04:002015-05-22T14:21:24+04:00Adobe InDesign CS6 (Windows)uuid:0f3fc731-73d3-4b56-a619-ceadda32547exmp.did:74117FE320071168AFFDFCC3E0D2D4BDxmp.id:AC26368D74EDE41195DAE4301C9EA666proof:pdf1xmp.iid:AB26368D74EDE41195DAE4301C9EA666xmp.did:EB82B8B57FE9E411824CDAF4FFFE586Dxmp. did:74117FE320071168AFFDFCC3E0D2D4BDdefault
did:74117FE320071168AFFDFCC3E0D2D4BDdefault
 0 0.0 595.276 822.047]/Type/Page>>
endobj
1 0 obj
>/Font>/ProcSet[/PDF/Text/ImageC]/XObject>>>/Rotate 0/TrimBox[0.0 0.0 595.276 822.047]/Type/Page>>
endobj
3 0 obj
>/Font>/ProcSet[/PDF/Text]/XObject>>>/Rotate 0/TrimBox[0.0 0.0 595.276 822.047]/Type/Page>>
endobj
5 0 obj
>/Font>/ProcSet[/PDF/Text]/XObject>>>/Rotate 0/TrimBox[0.0 0.0 595.276 822.047]/Type/Page>>
endobj
7 0 obj
>/Font>/ProcSet[/PDF/Text]/XObject>>>/Rotate 0/TrimBox[0.0 0.0 595.276 822.047]/Type/Page>>
endobj
8 0 obj
>stream
HW[o[R@,ģ9@-P@D#Ik»}?O;%} gosُyΚW72_mOoݷe8&)-
0 0.0 595.276 822.047]/Type/Page>>
endobj
1 0 obj
>/Font>/ProcSet[/PDF/Text/ImageC]/XObject>>>/Rotate 0/TrimBox[0.0 0.0 595.276 822.047]/Type/Page>>
endobj
3 0 obj
>/Font>/ProcSet[/PDF/Text]/XObject>>>/Rotate 0/TrimBox[0.0 0.0 595.276 822.047]/Type/Page>>
endobj
5 0 obj
>/Font>/ProcSet[/PDF/Text]/XObject>>>/Rotate 0/TrimBox[0.0 0.0 595.276 822.047]/Type/Page>>
endobj
7 0 obj
>/Font>/ProcSet[/PDF/Text]/XObject>>>/Rotate 0/TrimBox[0.0 0.0 595.276 822.047]/Type/Page>>
endobj
8 0 obj
>stream
HW[o[R@,ģ9@-P@D#Ik»}?O;%} gosُyΚW72_mOoݷe8&)-Стеноз сонных артерий
К стенотическим поражениям сонной артерии относятся сужение
(стеноз) и полное закрытие (окклюзия) сонной артерии — наиболее важного сосуда
в кровоснабжении головного мозга. Распространенной причиной этого состояния
является отложение атеросклеротических бляшек на внутренних стенках сосуда. Бляшка
сужает артерию и уменьшает кровоток. Данная патология приводит к ишемическому
инсульту: на атеросклеротических бляшках образуются сгустки крови (тромбы), еще
больше препятствующие кровотоку, части которых отделяются от стенки сосуда и с
током крови попадают в артерии головного мозга, в результате чего происходит
эмболия сосудов головного мозга и нарушение мозгового кровообращения.
Бляшка
сужает артерию и уменьшает кровоток. Данная патология приводит к ишемическому
инсульту: на атеросклеротических бляшках образуются сгустки крови (тромбы), еще
больше препятствующие кровотоку, части которых отделяются от стенки сосуда и с
током крови попадают в артерии головного мозга, в результате чего происходит
эмболия сосудов головного мозга и нарушение мозгового кровообращения.
Симптомы стенозов сонных артерий
В большинстве случаев заболевание протекает бессимптомно.
При выраженной симптоматике риск ишемического инсульта повышается в несколько
раз. Основное проявление патологии — транзиторная ишемическая атака, во время которой
снижается кровоснабжение определенных участков головного мозга. Это может
вызвать временное головокружение, нарушение зрения, онемение и покалывание кожи
конечностей, слабость в руке или ноге. Транзиторная ишемическая атака длится от
30 минут до суток.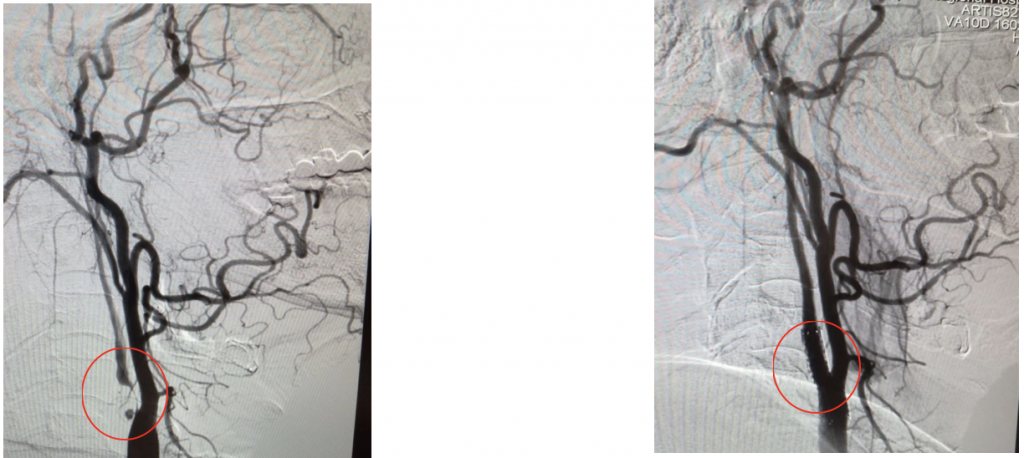
Диагностика заболевания
Даже при отсутствии симптомов заболевания на общем осмотре врач может заподозрить патологию по шуму над сонными артериями, вызванному током крови через стенозированный участок. В случае необходимости специалист назначает ультразвуковую допплерографию магистральных артерий головы — брахиоцефальных артерий. Данное исследование позволяет определить локализацию сужения, его степень и значимость. Для более детальной оценки состояния сонных артерий врач может порекомендовать МСКТ-ангиографию с контрастированием.
Лечение патологии
Существуют два конкурирующих метода хирургического лечения
стеноза сонных артерий — стентирование и каротидная эндартерэктомия. Передовым
и малотравматичным методом лечения стенозов сонных артерий является
стентирование. Данная процедура заключается в установке в просвет суженного
сосуда металлической конструкции в виде цилиндра, играющего роль каркаса. Стент
изнутри раздвигает суженные стенки артерии и постоянно поддерживает их в
расправленном состоянии. Это позволяет восстановить внутренний просвет артерии
и тем самым улучшить кровоснабжение головного мозга.
Стент
изнутри раздвигает суженные стенки артерии и постоянно поддерживает их в
расправленном состоянии. Это позволяет восстановить внутренний просвет артерии
и тем самым улучшить кровоснабжение головного мозга.
Каротидная эндартерэктомия — это «открытое» оперативное вмешательство, направленное на восстановление нарушенного кровотока в сонной артерии. Этот метод лечения является наиболее распространенным при выраженном стенозе сонных артерий. Вмешательство выполняется под общим наркозом и заключается в удалении атеросклеротической бляшки через небольшой разрез сонной артерии.
Лечение окклюзии внутренней сонной артерии с использованием проксимальной системы церебральной протекции и ее влияние на динамику артериального давления. Клинический случай Текст научной статьи по специальности «Клиническая медицина»
ИННОВАЦИОННАЯ КАРДИОЛОГИЯ
Лечение окклюзии внутренней сонной артерии с использованием проксимальной системы церебральной протекции и ее влияние на динамику артериального давления. Клинический случай
Клинический случай
Фирдавс Баходурович Шукуров1*, Дарья Сергеевна Чигидинова1, Елена Сергеевна Булгакова1, Борис Александрович Руденко1, Татьяна Васильевна Творогова2, Артем Сергеевич Шаноян1, Оксана Михайловна Драпкина1
1 Национальный медицинский исследовательский центр профилактической медицины Россия, 101990, Москва, Петроверигский пер., 10, стр. 3
2 Клиника «Семья». Россия, 141730, Московская область, Лобня, ул.Текстильная, 16
Согласно отчету Министерства здравоохранения Российской Федерации в 2016 г от острого нарушения мозгового кровообращения (ОНМК) умерло около 200 тыс человек. ОНМК считается главной причиной инвалидизации населения, нанося огромный экономический ущерб стране. Одной из самых частых причин возникновения ишемического инсульта служит атеросклероз ветвей дуги аорты. Наиболее часто встречаемая локализация атеросклеротических бляшек — экстракраниальный отдел сонных артерий — бифуркация общей сонной артерии (ОСА), устья ОСА и внутренней сонной артерии (ВСА). Реканализация окклюзии ВСА до недавнего времени была неразрешимой задачей для интервенционной хирургии из-за большого риска дистальной эмболизации. Внедрение в практику систем проксимальной церебральной протекции, обеспечивающих полное прекращение кровотока по бассейну целевой сонной артерии на момент оперативного вмешательства, позволило минимизировать интраоперационные осложнения, и может стать переломным моментом в лечении данных пациентов. Стоит отметить, что данную процедуру необходимо проводить только у больных с клиническими проявлениями стено-окклюзирующего поражения каротидного русла. Дополнительным преимуществом эндоваскулярной методики у некоторых пациентов является гипотензивный эффект стентирования каротидного бассейна вследствие воздействия на барорецепторы каротидного сплетения путем баллонной ангиопластики, что приводит к рефлекторному снижению артериального давления.
Наиболее часто встречаемая локализация атеросклеротических бляшек — экстракраниальный отдел сонных артерий — бифуркация общей сонной артерии (ОСА), устья ОСА и внутренней сонной артерии (ВСА). Реканализация окклюзии ВСА до недавнего времени была неразрешимой задачей для интервенционной хирургии из-за большого риска дистальной эмболизации. Внедрение в практику систем проксимальной церебральной протекции, обеспечивающих полное прекращение кровотока по бассейну целевой сонной артерии на момент оперативного вмешательства, позволило минимизировать интраоперационные осложнения, и может стать переломным моментом в лечении данных пациентов. Стоит отметить, что данную процедуру необходимо проводить только у больных с клиническими проявлениями стено-окклюзирующего поражения каротидного русла. Дополнительным преимуществом эндоваскулярной методики у некоторых пациентов является гипотензивный эффект стентирования каротидного бассейна вследствие воздействия на барорецепторы каротидного сплетения путем баллонной ангиопластики, что приводит к рефлекторному снижению артериального давления. Этот эффект диктует необходимость детального изучения патофизиологических механизмов, тщательного отбора пациентов и коррекции предоперационной подготовки к каротидному стентированию. Данное клиническое наблюдение служит иллюстрацией того, что адекватная оценка факторов риска интраоперационных осложнений позволяет добиться максимально эффективных результатов эндоваскулярного лечения.
Этот эффект диктует необходимость детального изучения патофизиологических механизмов, тщательного отбора пациентов и коррекции предоперационной подготовки к каротидному стентированию. Данное клиническое наблюдение служит иллюстрацией того, что адекватная оценка факторов риска интраоперационных осложнений позволяет добиться максимально эффективных результатов эндоваскулярного лечения.
Ключевые слова: окклюзия внутренней сонной артерии, каротидное стентирование, проксимальная система церебральной протекции, артериальная гипертензия.
Для цитирования: Шукуров Ф.Б., Чигидинова Д.С., Булгакова Е.С., Руденко Б.А., Творогова Т.В., Шаноян А.С., Драпкина О.М. Лечение окклюзии внутренней сонной артерии с использованием проксимальной системы церебральной протекции, и ее влияние на динамику артериального давления. Клинический случай. Рациональная Фармакотерапия в Кардиологии 2018;14(2):266-271. DOI: 1 0.20996/1 81 96446-2018-14-2-266-271
DOI: 1 0.20996/1 81 96446-2018-14-2-266-271
Treatment of Internal Carotid Artery Occlusion Using Proximal Cerebral Protection Device and its Effect on the Blood Pressure Dynamics. Clinical Case
Firdavs B. Shukurov1*, Daria S. Chigidinova1, Elena S. Bulgakova1, Boris A. Rudenko1, Tatiana V. Tvorogova2, Artem S. Shanoyan1, Oxana M. Drapkina1
1 National Medical Research Center for Preventive Medicine. Petroverigsky per. 1 0, Moscow, 1 01 990 Russia
2 Private Clinic «Family». Teхtilnaya ul. 16, Moscow Region, Lobnya,141 730 Russia
In 201 6, according to the Ministry of Health of the Russian Federation, about 200 thousand people died from stroke. Strokes are considered as the main cause of disability of the population, causing huge economic damage to the country. One of the most common causes of ischemic stroke is atherosclerosis of the branches of the aortic arch. The most common localization of atherosclerotic plaques is the extracranial section of the carotid arteries — bifurcation and ostium of the common carotid artery and the internal carotid artery. Recanalization of occlusion of the internal carotid artery until recently was an insoluble task for interventional surgery due to the high risk of distal embolization. The invention and use of the proximal cerebral protection device, which ensure the complete cessation of blood flow, has changed the situation. Effect of carotid revascularization on arterial hypertension, due to the effect on the baroreceptors of the carotid plexus by balloon angioplasty, which leads to a reflex decrease in arterial pressure, is an additional advantage of the endovascular technique in some cases. This effect requires further study. One also needs to pay careful attention to the diagnosis and imaging of carotid artery lesions before procedure.
One of the most common causes of ischemic stroke is atherosclerosis of the branches of the aortic arch. The most common localization of atherosclerotic plaques is the extracranial section of the carotid arteries — bifurcation and ostium of the common carotid artery and the internal carotid artery. Recanalization of occlusion of the internal carotid artery until recently was an insoluble task for interventional surgery due to the high risk of distal embolization. The invention and use of the proximal cerebral protection device, which ensure the complete cessation of blood flow, has changed the situation. Effect of carotid revascularization on arterial hypertension, due to the effect on the baroreceptors of the carotid plexus by balloon angioplasty, which leads to a reflex decrease in arterial pressure, is an additional advantage of the endovascular technique in some cases. This effect requires further study. One also needs to pay careful attention to the diagnosis and imaging of carotid artery lesions before procedure.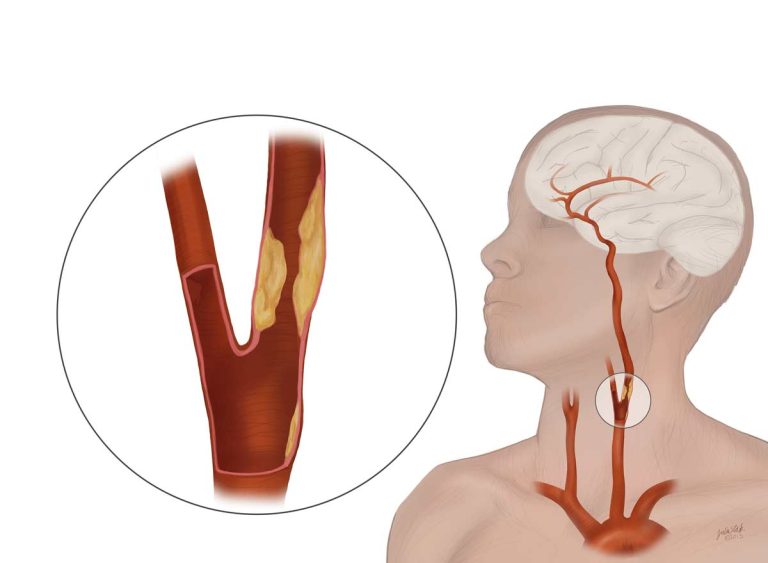 This clinical case is the illustration that an adequate assessment of the risk factors for intraoperative complications allows to achieve maximum results of endovascular treatment.
This clinical case is the illustration that an adequate assessment of the risk factors for intraoperative complications allows to achieve maximum results of endovascular treatment.
Keywords: occlusion of the internal carotid artery, carotid artery stenting, proximal cerebral protection system, hypertension.
For citation: Shukurov F.B., Chigidinova D.S., Bulgakova E.S., Rudenko B.A., Tvorogova T.V., Shanoyan A.S., Drapkina O.M. Treatment of Internal Carotid Artery Occlusion Using Proximal Cerebral Protection Device and its Effect on the Blood Pressure Dynamics. Clinical Case. Rational Pharmacotherapy in Cardiology 201 8;14(2):266-271. (In Russ). DOI: 10.20996/1819-6446-2018-14-2-266-271
—Corresponding Author (Автор, ответственный за переписку):
Received / Поступила: 25.°9.201 7 fshukurov@gnicpm. ru
ru
Accepted / Принята в печать: 1 7.1 0.201 7
Введение
Заболевания сердечно-сосудистой системы являются главной причиной смертности и инвалидиза-ции населения во всем мире. Рост распространенности сосудистых заболеваний обуславливает увеличение частоты развития острых нарушений мозгового и коронарного кровообращения [1, 2].
Согласно отчету Министерства здравоохранения Российской Федерации в 2016 г. заболевания сердечно-сосудистой системы явились основной причиной смертности, и составили 55% от общего количества умерших. На долю острого нарушения мозгового кровообращения (ОНМК) пришлось 17% от общего количества смертей (около 200 тыс человек в год). ОНМК считается главной причиной инвалиди-зации населения, нанося огромный экономический ущерб стране.
Одной из самых частых причин возникновения ишемического инсульта служит атеросклероз ветвей дуги аорты [3-5]. Наиболее часто встречаемая локализация атеросклеротических бляшек — экстракраниальный отдел сонных артерий — бифуркация общей сонной артерии (ОСА), устья ОСА и внутренней сонной артерии (ВСА). Интракраниальные поражения церебральных артерий обнаруживаются в 4 раза реже [6]. Также доказана корреляция степени сужения просвета ВСА с риском развития транзиторной ишемиче-ской атаки (ТИА) или инсульта. Интересным является и то, что риск развития инсульта повышается при про-грессировании стенозирующего поражения как у пациентов с клинически симптомными стенозами ВСА, так и у пациентов с асимптомными стенозами ВСА [7-9]. Симптомными считаются те атеросклеротические поражения, которые приводили к ОНМК, ТИА, либо к преходящей слепоте (amaurosis fugax) в течение последних 6 мес.
Наиболее часто встречаемая локализация атеросклеротических бляшек — экстракраниальный отдел сонных артерий — бифуркация общей сонной артерии (ОСА), устья ОСА и внутренней сонной артерии (ВСА). Интракраниальные поражения церебральных артерий обнаруживаются в 4 раза реже [6]. Также доказана корреляция степени сужения просвета ВСА с риском развития транзиторной ишемиче-ской атаки (ТИА) или инсульта. Интересным является и то, что риск развития инсульта повышается при про-грессировании стенозирующего поражения как у пациентов с клинически симптомными стенозами ВСА, так и у пациентов с асимптомными стенозами ВСА [7-9]. Симптомными считаются те атеросклеротические поражения, которые приводили к ОНМК, ТИА, либо к преходящей слепоте (amaurosis fugax) в течение последних 6 мес.
Проблема лечения стенозирующего атеросклероза сонных артерий как способа профилактики ишемиче-ских инсультов является одной из самых актуальных в современной медицине.
Долгое время каротидная эндартерэктомия (КЭЭ) считалась «золотым стандартом» в лечении стенозирующего поражения каротидных артерий, однако с развитием технологий и широким внедрением в клиническую практику эндоваскулярных методов лечения на смену КЭЭ приходит каротидная ангиопластика со стентированием (КАС).
Обязательное применение систем протекции от церебральной эмболизации во время эндоваскулярной процедуры позволило снизить риск микроэмболии дистального русла церебральных артерий при стенти-ровании и добиться уровня острых осложнений, сопоставимого с операцией эндартерэктомии. Благодаря таким исследованиям, как CAVATAS [10],
SAPPHIRE [11] и CREST эндоваскулярная хирургия завоевала еще большее влияние и полностью разрушила стереотип о «золотом стандарте» каротидной эндартерэктомии в лечении пациентов со стенозирую-щим поражением брахиоцефальных артерий [1 2].
Нерешенной проблемой современной эндоваскулярной хирургии каротидного бассейна является лечение пациентов с наличием симптомного окклюзирующего поражения ВСА. Долгое время данная когорта пациентов была лишена возможности хирургической реваскуляризации из-за высокого риска интраоперационных осложнений, связанных с эмбо-лизацией артерий головного мозга частицами атерос-клеторического дебриса в момент проведения реканализации. Внедрение в практику проксимальных систем церебральной протекции, обеспечивающих полное прекращение кровотока по бассейну целевой сонной артерии на момент оперативного вмешательства, позволило добиться минимальных интраопера-ционных осложнений и расширить перечень показаний к эндоваскулярной реваскуляризации каротидных артерий [13].
Дополнительное преимущество имплантации стента, которое игнорируется и не изучается должным образом, — стойкое снижение артериального давления (АД) у определенной группы пациентов (исходя из нашего опыта — порядка 1 5%) после процедуры, вследствие воздействия на барорецепторы каротидного сплетения [14-16].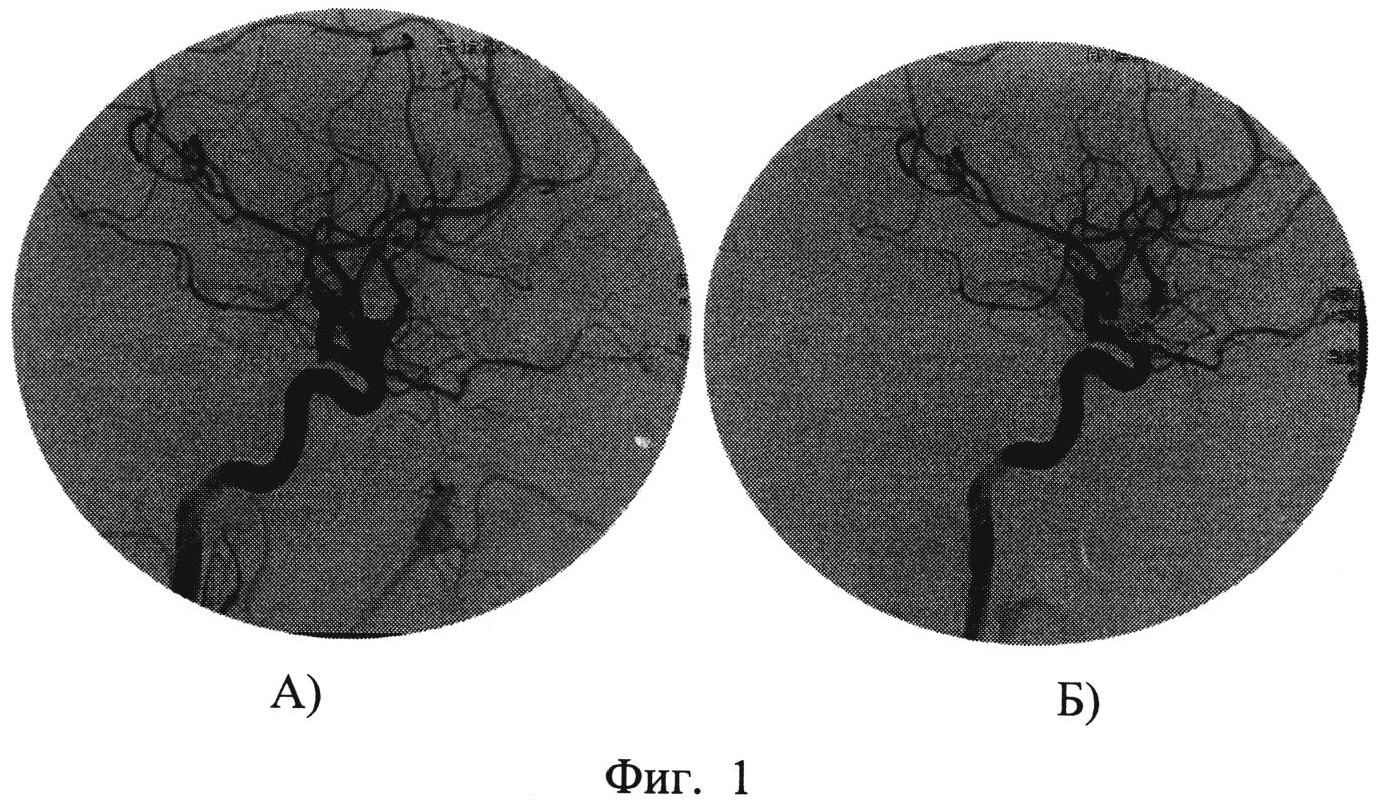 При выполнении дилатации и стентирования ВСА происходит ремоделирование стенки сосуда с расширением внешнего диаметра, что приводит к активации барорецеторов и рефлекторному снижению артериального давления [14]. Согласно отдаленным результатам исследования CREST смертность от любых видов инсульта в течение 4-х летнего периода наблюдения после каротидного стентирования составляет 13,3%, после каротидной эндартерэктомии — 1 5% (p<0,05) [1 7]. Эти данные требуют дополнительного анализа, поскольку снижение АД после эндоваскулярной процедуры может вносить вклад в снижение риска развития инсульта.
При выполнении дилатации и стентирования ВСА происходит ремоделирование стенки сосуда с расширением внешнего диаметра, что приводит к активации барорецеторов и рефлекторному снижению артериального давления [14]. Согласно отдаленным результатам исследования CREST смертность от любых видов инсульта в течение 4-х летнего периода наблюдения после каротидного стентирования составляет 13,3%, после каротидной эндартерэктомии — 1 5% (p<0,05) [1 7]. Эти данные требуют дополнительного анализа, поскольку снижение АД после эндоваскулярной процедуры может вносить вклад в снижение риска развития инсульта.
Ниже приводим клинический пример выполненного в рентгенхирургическом отделении НМИЦ ПМ эндоваскулярного лечения окклюзии ВСА с использованием проксимальной системы церебральной протекции, и ее влияние на динамику артериального давления.
Клинический случай
Пациент Ж.-1446022CDEB32DEB775.png) , 60 лет, поступил в неврологическое отделение с жалобами на слабость в левых руке и ноге, ощущение онемения левой ноги, шаткость походки, нарушение речи. Из анамнеза известно, что пациент более 5 лет страдает артериальной гипертонией (АГ;
, 60 лет, поступил в неврологическое отделение с жалобами на слабость в левых руке и ноге, ощущение онемения левой ноги, шаткость походки, нарушение речи. Из анамнеза известно, что пациент более 5 лет страдает артериальной гипертонией (АГ;
на фоне многокомпонентной терапии среднее АД при самостоятельном измерении утром и вечером на протяжении 7 дней до процедуры составило 145/80 мм рт.ст.). За год до госпитализации пациент перенес инфаркт головного мозга в теменно-затылочной области справа с клиникой левостороннего гемипареза, на фоне консервативной терапии — уменьшение симптоматики. Также периодически отмечает кратковременную потерю зрения, последний эпизод за 2 нед до госпитализации.
По результатам ультразвукового дуплексного сканирования (УЗДС) брахиоцефальных артерий за 2 мес до настоящей госпитализации определялся стеноз устья правой ВСА до 80%.
При магнитной резонансной томографии (МРТ) головного мозга в режиме DWI выявлялись постинсультные изменения в теменно-затылочной области справа размерами 40x34x25 мм, мелкие сосудистые очаги, асимметрия полушарий мозга.
При селективной ангиографии брахиоцефальных артерий выявлено: окклюзия правой ВСА от устья, протяженностью около 20 мм, постокклюзионные отделы без значимого атеросклеротического поражения (рис. 1). Интракраниальные отделы кровоснабжаются из бассейна левой сонной артерии по Вилизиеву кругу.
Учитывая регулярные ТИА, а также подходящие для эндоваскулярной реваскуляризации анатомо-морфологические характеристики поражения ВСА (непротяженная окклюзия давностью менее 2 мес, учитывая несоответствие данных УЗДС и ангиографии, а также интактное состояние постокклюзионных сег-
ментов правой ВСА), было принято решение о проведении ангиопластики со стентированием правой ВСА с использованием системы проксимальной защиты головного мозга.
Операция проводилась правым феморальным доступом. Дистальный баллон системы позиционирован на расстоянии 1 см дистальнее бифуркации в проксимальный отдел наружной сонной артерии (НСА). Distal balloon
Distal balloon
Дистальный баллом *
Contrast stasis Стаз
контрастного
вещества
JI
Figure 1. Occlusion of the right internal carotid artery Рисунок 1. Окклюзия правой внутренней сонной артерии от устья
Proximal balloon Проксимальный баллон
Figure 2. Balloon dilatation of the common carotid artery Рисунок 2. Баллонная дилатация общей сонной артерии
The distal (in the external carotid artery) and the proximal (in the common carotid artery) balloons of the system are successively dilated. Stasis of contrast agent in the common carotid artery is visualized
Последовательно дилатированы дистальный (в наружной сонной артерии) и проксимальный (в общей сонной артерии) баллоны системы.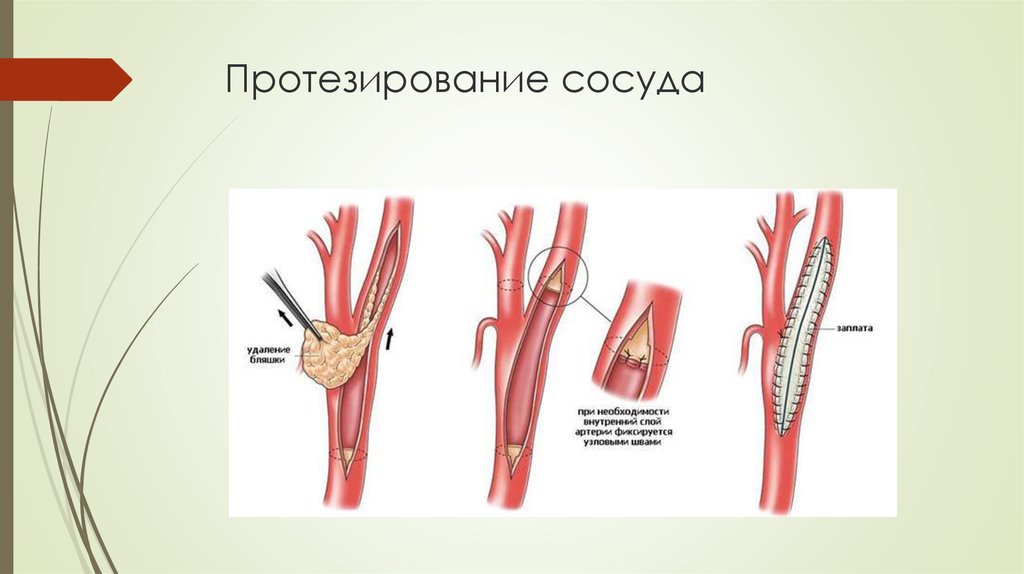 На контрольной съемке визуализирован стаз контрастного вещества в бассейне общей сонной артерии
На контрольной съемке визуализирован стаз контрастного вещества в бассейне общей сонной артерии
Balloon dilatation Балоннал дилатация
Figure 3. Recanalization of occlusion with a balloon
catheter
Рисунок 3. Реканализация окклюзии баллонным катетером
нием атеросклеротического дебриса до получения «чистой» крови. За время процедуры сохранялся стаз крови в ограниченном баллонами пространстве. Поочередно произведено снижение давления в дисталь-
ном и проксимальном баллонах системы, антеград-ный кровоток по правой ВСА восстановлен.
Общее время «выключения» правой ОСА составило! 2 мин. На контрольной съемке стент позиционирован правильно, полностью расправлен, остаточного стеноза нет, признаков краевой диссекции нет (рис. 4).
4).
Во время проведения операции пациент находился в сознании, был доступен продуктивному вербальному контакту, активно жалоб не предъявлял, очаговой неврологической симптоматики не отмечалось, гемодинамические показатели оставались стабильными. Отмечалось интраоперационное рефлекторное снижение АД в момент имплантации стента и баллонной дилатации в зоне каротидного сплетения со 140/80 мм рт.ст. до 100/70 мм рт.ст. с сохранением данных цифр АД на протяжении 24 ч после операции.
МРТ головного мозга в режиме DWI в 1-е сут после операции: очагов повышенного МР-сигнала в веществе головного мозга не выявлено в режиме DWI b=1000.
Больной был выписан на 2-е сут послеоперационного периода со стабилизацией уровня АД 130/70 мм рт.ст. на фоне прежней антигипертензивной терапии.
В ближайшем и отдаленном послеоперационном периоде (3, 12 мес) ухудшения состояния не отмечено. По данным самоконтроля АД (на фоне преж-
По данным самоконтроля АД (на фоне преж-
Stent in the internal carotid artery Стент во —
внутренной сонной артерии
Figure 4. Results of stenting of the internal carotid artery
Рисунок 4. Результаты стентирования внутренней сонной артерии
A. Correct stent position, residual stenosis and marginal dissection are absent, antegrade blood flow through the internal carotid artery is restored. B. The intracranial parts are well sucked from the right carotid artery
А. На контрольной съемке стент позиционирован правильно, остаточного стеноза нет, признаков краевой диссекции нет, антеградный кровоток по внутренней сонной артерии восстановлен. B. Интракраниальные отделы хорошо кровоснабжаются из бассейна правой сонной артерии
ней антигипертензивной терапии среднее АД составляло 130/70 мм рт. ст.).
ст.).
Обсуждение
Хирургическое лечение окклюзирующих/субто-тальных поражений каротидных артерий является наиболее дискуссионным вопросом в лечении атеросклероза брахиоцефальных артерий на современном этапе развития медицины из-за сложности исполнения данных вмешательств и отсутствием достаточной доказательной базы. Решение вопроса о стратегии лечения возложено на лечащего врача и решается отдельно в каждом индивидуальном случае. В представленном случае мы проводили лечение пациента высокого риска развития ОНМК с симптомным поражением правой ВСА («amaurosis fugax» за 2 нед до госпитализации). Учитывая благоприятные для эндо-васкулярного лечения анатомо-морфологические характеристики поражения (короткая протяженность окклюзии и свободное от тромбов и стенозирующих поражений дистальное русло) было принято решение о проведении вмешательства. Использование проксимальной системы церебральной протекции от микро-эмболизации в данном случае было критическим условием, т.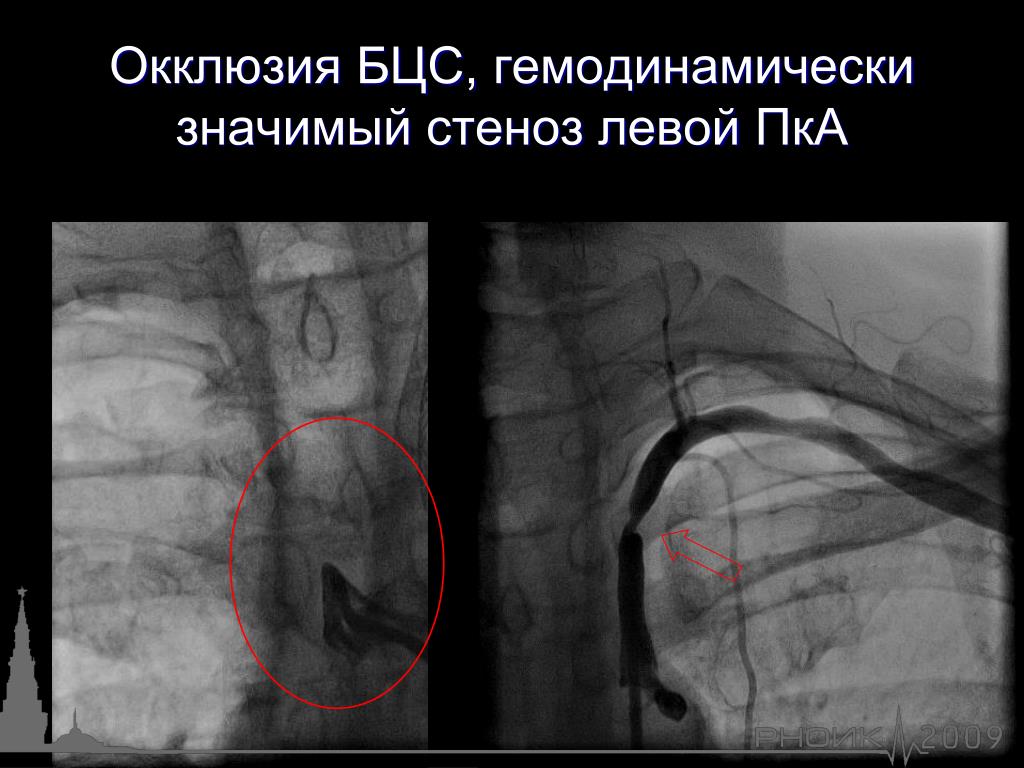 к. только данное устройство позволяет полностью отключить целевой сегмент артерии из кровотока и обеспечить максимальную безопасность манипуляций. Значимое снижение цифр артериального давления после восстановления кровотока по окклю-
к. только данное устройство позволяет полностью отключить целевой сегмент артерии из кровотока и обеспечить максимальную безопасность манипуляций. Значимое снижение цифр артериального давления после восстановления кровотока по окклю-
зированной сонной артерии в раннем и отдаленном периоде наблюдения мы связываем с отключением компенсаторного механизма артериальной гипертен-зии у пациентов с хронической ишемией головного мозга в совокупности с рефлекторным гипотензивным эффектом при воздействии на барорецепторы каро-тидного сплетения.
Заключение
Данное клиническое наблюдение служит иллюстрацией того, что адекватная оценка факторов риска интраоперационных осложнений позволяет добиться максимально эффективных результатов эндоваску-лярного лечения. Асимптомное окклюзирующее поражение ВСА является противопоказанием к реваскуляризации в данном бассейне, тогда как при симптомном течении патологического процесса для оптимальных результатов эндоваскулярного лечения необходима детальная оценка анатомо-морфологи-ческих характеристик окклюзирующего атеросклеро-тического поражения, наличие необходимого операционного инструментария, опыт хирурга, взаимодействие с неврологами.
Конфликт интересов. Все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Disclosures. All authors have not disclosed potential conflicts of interest regarding the content of this paper.
References / Литература
1. Demographic Yearbook of Russia 2011. Statistical compilation. Moscow: Rosstat; 2011. (In Russ.) [Демографический ежегодник России 2011. Статистический сборник. М.: Росстат; 2011].
2. Bokeria LA, ed. Health of Russia: atlas. 5th edition. Moscow: NNPTSSSH n.a. A.N. Bakulev; 2010. (In Russ.) [Бокерия Л.А., ред. Здоровье России: атлас. 5-е издание. М.: ННПЦССХ им. А.Н. Бакулева; 2010].
3. Suslina ZA, Piradov MA, eds.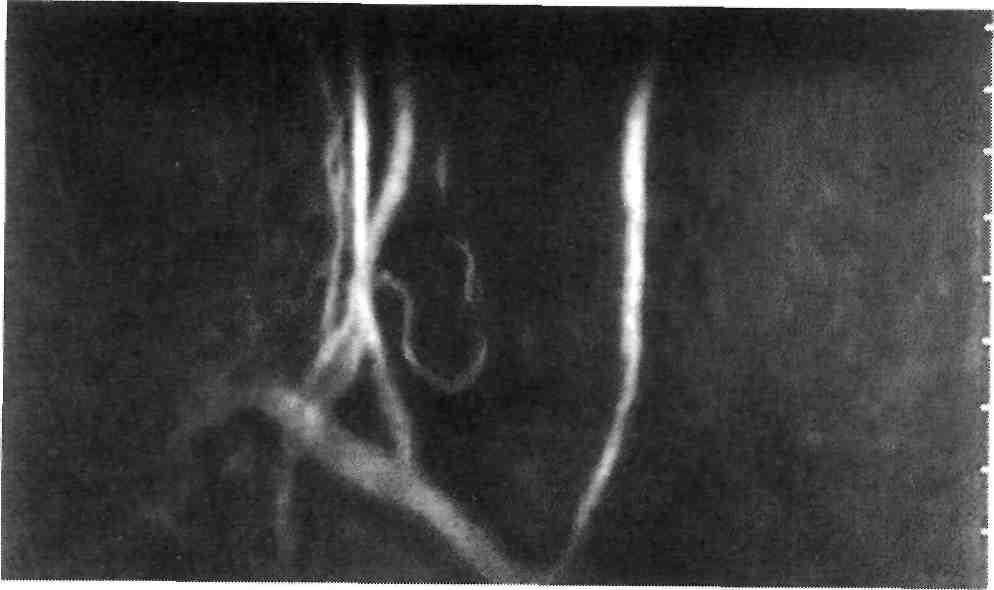 Stroke: diagnosis, treatment, prevention. Moscow: MEDpress-inform; 2008. (In Russ.) [Суслина З.А., Пирадов М.А., ред. Инсульт: диагностика, лечение, профилактика. М.: МЕДпресс-информ; 2008].
Stroke: diagnosis, treatment, prevention. Moscow: MEDpress-inform; 2008. (In Russ.) [Суслина З.А., Пирадов М.А., ред. Инсульт: диагностика, лечение, профилактика. М.: МЕДпресс-информ; 2008].
4. Tanashyan MM, Lagoda OV, Domashenko MA. Prophylaxis of ischemic strokes in patients with atherosclerotic pathology of the main arteries of the head. Atmosfera. Nervnye bolezni. 2008;(1):2-6. (In Russ.) [Танашян М.М., Лагода О.В., Домашенко М.А. Профилактика ишемических инсультов у пациентов с атеросклеротической патологией магистральных артерий головы. Атмосфера. Нервные болезни. 2 008;( 1) :2-6].
5. Warlow С., van Gijn J., Dennis M. et al. Stroke: practical management. 3rd ed. Oxford: Blackwell Publishing; 2008.
6. Nikiforov AS, Konovalov AN, Gusev EI. Clinical neurology. Volume 3, part 2. Moscow: Meditsina; 2004. (In Russ.) [Никифоров А.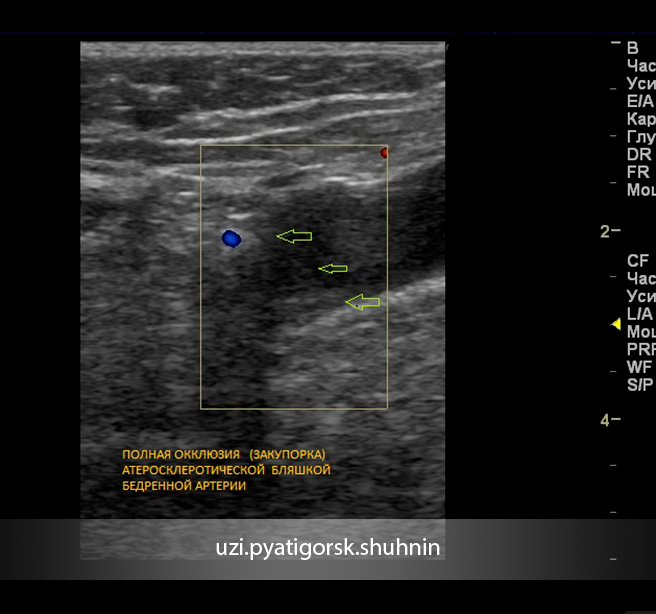 С., Коновалов А.Н., Гусев Е.И. Клиническая неврология. Том 3, часть 2. М.: Медицина; 2004].
С., Коновалов А.Н., Гусев Е.И. Клиническая неврология. Том 3, часть 2. М.: Медицина; 2004].
7. Caplan L., Henerici M. Impared clearance of emboli (washut) is an important link between hypoperfusion, embolism and ischemic stroke. Arch Neurol. 1998;55:1475-82. doi: 10.1001 /archneur. 55.1 1.1475.
8. Norris J.W. Risks of cerebral infarction, myocardial infarction and vascular death in patients with asymptomatic carotid disease, transient ischemic attacks and stroke. Cerebrovasc Dis. 1992 ;2 (suppl. 1):2-5.
9. Rothwell P.M. Carotid artery disease and the risk of ischaemic stroke and coronary vascular events.Cerebrovasc Dis. 2000;10 (suppl. 5):21 -33.
10. CAVATAS Investigators. Endovascular versus surgical treatment in patients with carotid stenosis in the Carotid and Vertebral Artery Transluminal Angioplasty Study (CAVATAS): a randomised trial. Lancet. 2001;357(9270):1729-37. doi: 10.1016/S0140-6736(00)04893-5.
Lancet. 2001;357(9270):1729-37. doi: 10.1016/S0140-6736(00)04893-5.
11. Diethrich EB, Ndiaye M, Reid DB. Stenting in the Carotid Atrery: Initial Experience in 110 Patients. J Endovasc Surg. 1996;3(1):42-62. doi: 10.1 583/1 074-621 8(1 996)003<0042:SITCAI>2.0. CO;2.
12. Setacci C, de Donato G, Chisci E, et al. Is carotid artery stenting in octogenarians really dangerous? J Endovasc Ther. 2006;13(3):302-9. doi: 1 0.1 583/06-1 836.1.
13. Sakamoto S, Kiura Y Kajihara Y et al. Carotid artery stenting using the proximal or dual protection method for near occlusion of the cervical internal carotid artery. Neurosurg Rev. 2013;36(4):551 -7. doi: 10.1 007/s10143-013-0481 -y.
14. Chung J, Kim BM, Paik HK, et al. Effects of carotid artery stenosis treatment on blood pressure. J Neurosurg. 2012;1 17(4):750-60. doi: 10.3171/2012.7.JNS112198.
2012;1 17(4):750-60. doi: 10.3171/2012.7.JNS112198.
15. Chung J1, Kim YB, Hong CK, el al. Blood pressure-lowering effect of carotid artery stenting in patients with symptomatic carotid artery stenosis. Acta Neurochir (Wien). 2014;1 56(1 ):69-75. doi: 10.1 007/s00701 -013-1928-1.
16. McKevitt FM, Sivaguru A, Venables GS et al. Effect of Treatment of Carotid Artery Stenosis on Blood Pressure: A Comparison of Hemodynamic Disturbances After Carotid Endarterectomy and Endovascular Treatment. Stroke. 2003;34(1 1):2576-81. doi: 10.1161/01 .STR.0000097490.8801 5.3A.
17. Paraskevas KI, Mikhailidis DP, Veith FJ. Comparison of the five 2011 guidelines for the treatment of carotid stenosis. J Vasc Surg. 2012;55(5):1 504-8. doi: 10.1016/j.jvs.201 2.01.084.
About the Authors:
Firdavs B. Shukurov — MD, Doctor, Department of Roentgen-Endovascular Diagnostics and Treatment (Interventional Cardiology), National Medical Research Center for Preventive Medicine
Shukurov — MD, Doctor, Department of Roentgen-Endovascular Diagnostics and Treatment (Interventional Cardiology), National Medical Research Center for Preventive Medicine
Daria S.Chigidinova — MD, Resident of the 2nd Year of Study, Department of Roentgen-Endovascular Diagnostics and Treatment (Interventional Cardiology), National Medical Research Center for Preventive Medicine
Elena S. Bulgakova — MD, Junior Researcher, Department
of Fundamental and Applied Aspects of Obesity, National Medical
Research Center for Preventive Medicine
Boris A. Rudenko — MD, Leading Researcher, Department
of Roentgen-Endovascular Diagnostics and Treatment
(Interventional Cardiology), National Medical Research Center
for Preventive Medicine
Tatiana V.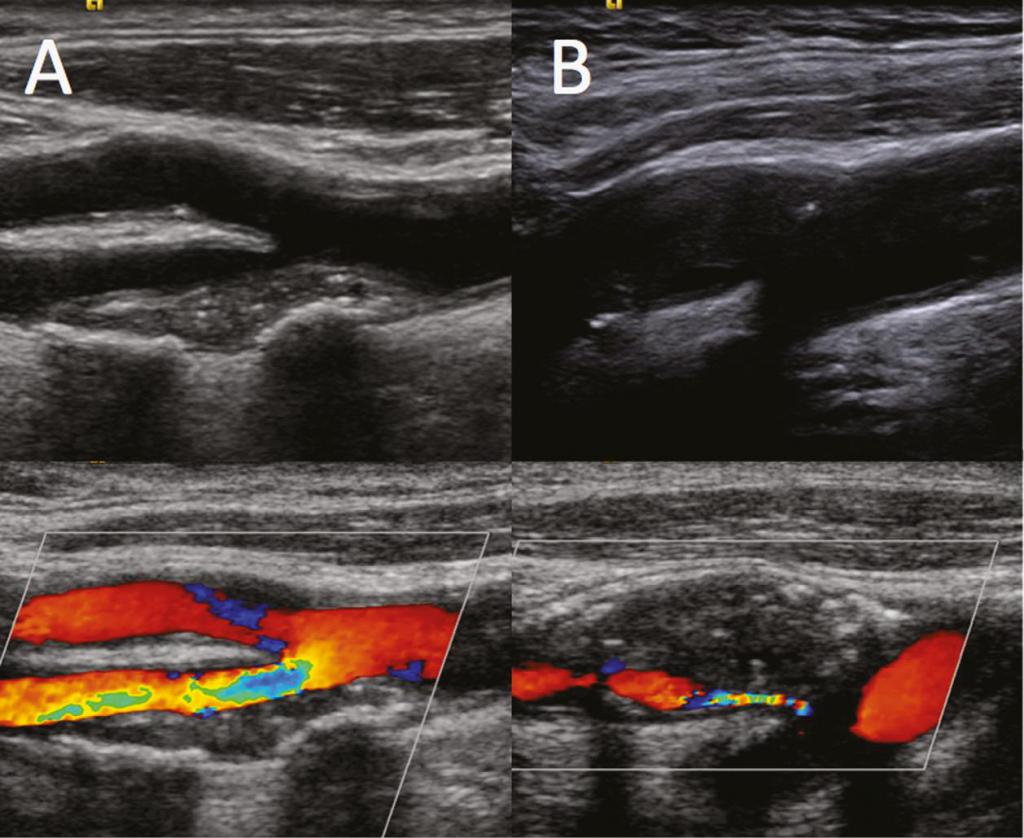 Tvorogova — MD, PhD, Chief Physician, Private Clinic «Family»
Tvorogova — MD, PhD, Chief Physician, Private Clinic «Family»
Artem S. Shanoyan — MD, Head of Department of Roentgen-Endovascular Diagnostics and Treatment (Interventional Cardiology), National Medical Research Center for Preventive Medicine
Oxana M. Drapkina — MD, PhD, Professor, Corresponding Member of the Russian Academy of Sciences, Director, National Medical Research Centre for Preventive Medicine
Сведения об авторах:
Шукуров Фирдавс Баходурович — врач, отделение рентгенэндоваскулярных методов диагностики и лечения, НМИЦ ПМ
Чигидинова Дарья Сергеевна — ординатор 2 года обучения, отделение рентгенхирургических методов диагностики и лечения, НМИЦ ПМ
Булгакова Елена Сергеевна — м. н.с, отдел фундаментальных и прикладных аспектов ожирения, НМИЦ ПМ Руденко Борис Александрович — д.м.н., в.н.с., лаборатория рентгенэндоваскулярных методов диагностики и лечения, НМИЦ ПМ
н.с, отдел фундаментальных и прикладных аспектов ожирения, НМИЦ ПМ Руденко Борис Александрович — д.м.н., в.н.с., лаборатория рентгенэндоваскулярных методов диагностики и лечения, НМИЦ ПМ
Творогова Татьяна Васильевна — к.м.н., главный врач клиники «Семья»
Шаноян Артем Сергеевич — к.м.н., зав. отделением рентгенхирургических методов диагностики и лечения, НМИЦ ПМ
Драпкина Оксана Михайловна — д.м.н., профессор, член-корреспондент РАН, директор НМИЦ ПМ
Стентирование хронических окклюзий внутренней сонной артерии Текст научной статьи по специальности «Клиническая медицина»
Стентирование хронических окклюзий внутренней сонной артерии
А.В. Хрипун, М.В. Малеванный1, Я.В. Куликовских, А.В. Крамаренко, М.Т. Акбашева,
Е.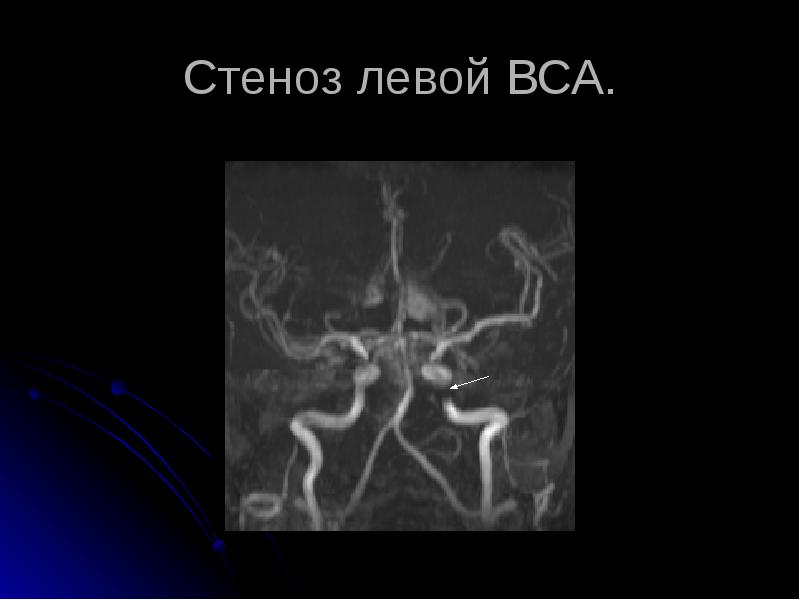 П. Фоменко, З.Ю. Зайпулаева Областной сосудистый центр РОКБ, Ростов-на-Дону, Россия
П. Фоменко, З.Ю. Зайпулаева Областной сосудистый центр РОКБ, Ростов-на-Дону, Россия
Риск инсульта при наличии хронической окклюзии ВСА достигает 30% в год, несмотря на медикаментозную терапию. Открытая хирургическая коррекция данной патологии либо характеризуется низким процентом успеха, либо малоэффективна. Эндоваскулярные вмешательства продемонстрировали свою эффективность и безопасность в восстановлении физиологического церебрального кровотока у данной категории пациентов. Проанализировано 7 случаев стентирования хронических окклюзий ВСА у пациентов с ОНМК в анамнезе за 6,8±3,1 месяцев до госпитализации. Успешная реканализация и стентирование хронической окклюзии ВСА с восстановлением кровотока ЛО-3 достигнута в 100%. За период наблюдения новых ТИА или ишемических инсультов не отмечалось. По данным методов функциональной нейровизуализации определяется улучшение перфузии головного мозга.
Ключевые слова: хроническая окклюзия внутренней сонной артерии, стентирование.
Цели: оценить возможность, эффективность и безопасность стентирования хронических окклюзий ВСА.
Обоснование: риск инсульта у пациентов с окклюзированной ВСА составляет 5-7% в год. При сниженном цереброваскулярном резерве риск инсульта достигает 30%, несмотря на медикаментозную терапию. Открытая хирургическая коррекция данной патологии либо характеризуется низким процентом успеха, либо малоэффективна. Эндоваскулярные вмешательства продемонстрировали свою эффективность и безопасность в восстановлении физиологического церебрального кровотока у данной категории пациентов.
Методы: проанализировано 7 случаев стентирования хронических окклюзий ВСА. У всех пациентов в анамнезе имелось ОНМК по ишемическому типу в ипсилатеральном полушарии за 6,8±3,1 месяцев до госпитализации. У всех пациентов наличие хронической окклюзии сопровождалось нестабильной неврологической симптоматикой.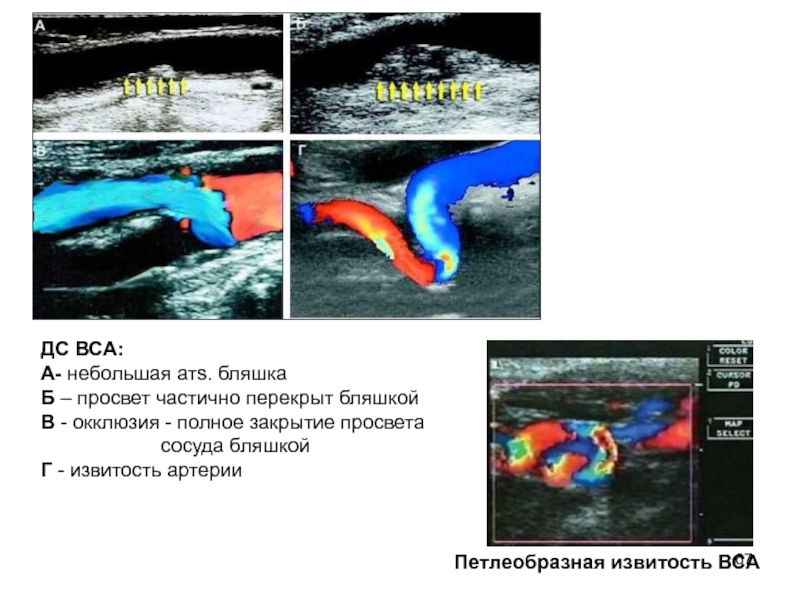 Всем пациентам выполнена реканализация и стентирование хронической окклюзии ВСА. Результаты эндоваскулярного вмешательства оценивались по наличию клиники, шкале NIHSS, шкале Ренкина. Проходимость стентов и наличие/отсутствие рестеноза определялось по данным УЗТС, ТКДС. Перед выпиской у всех пациентов оценивалась перфузия головного мозга при помощи ОФЭКТ или перфузионной КТ.
Всем пациентам выполнена реканализация и стентирование хронической окклюзии ВСА. Результаты эндоваскулярного вмешательства оценивались по наличию клиники, шкале NIHSS, шкале Ренкина. Проходимость стентов и наличие/отсутствие рестеноза определялось по данным УЗТС, ТКДС. Перед выпиской у всех пациентов оценивалась перфузия головного мозга при помощи ОФЭКТ или перфузионной КТ.
* Адрес для переписки:
Малеванный Михаил Владимирович
Россия, 344082, Ростов-на-Дону, ул. М.Горького 11/43 кв. 57
e-mail: [email protected]
тел.раб. 8-863-218-94-18
тел.сот. 8-928-296-27-50
Статья получена 14 сентября 2011 г.
Принята в печать 21 ноября 2011 г. -3 достигнута в 100%. За период наблюдения новых ТИА или ишемических инсультов не было. В раннем послеоперационном периоде отмечается тенденция к уменьшению степени выраженности неврологического дефицита по NIHSS, наблюдается тенденция к восстановлению функциональной независимости пациентов. По данным методов функциональной нейровизуализации определяется улучшение перфузии головного мозга. При ультразвуковом исследовании через 30 дней все стенты проходимы, без признаков рестеноза.
-3 достигнута в 100%. За период наблюдения новых ТИА или ишемических инсультов не было. В раннем послеоперационном периоде отмечается тенденция к уменьшению степени выраженности неврологического дефицита по NIHSS, наблюдается тенденция к восстановлению функциональной независимости пациентов. По данным методов функциональной нейровизуализации определяется улучшение перфузии головного мозга. При ультразвуковом исследовании через 30 дней все стенты проходимы, без признаков рестеноза.
Выводы: стентирование хронических окклюзий ВСА возможно и безопасно у определенной группы пациентов. Необходимо проведение больших рандомизированных исследований для определения клинической эффективности и показаний к реканализации хронических окклюзий ВСА.
Сокращения
ВСА — внутренняя сонная артерия СМА — средняя мозговая артерия ТИА — транзиторная ишемическая атака ОФЭКТ — однофотонная эмиссионная компьютерная томография
ТКДС — транскраниальное дуплексное сканирование
УЗТС — ультразвуковое триплексное сканирование
КТ — компьютерная томография ОНМК — острое нарушение мозгового кровообращения
NIHSS — шкала инсульта Национального института здоровья
mRS — модифицированная шкала Ренкина
Стентирование сонных артерий в настоящее время признано эффективной и безопасной
альтернативой каротидной эндартерэктомии (1, 2).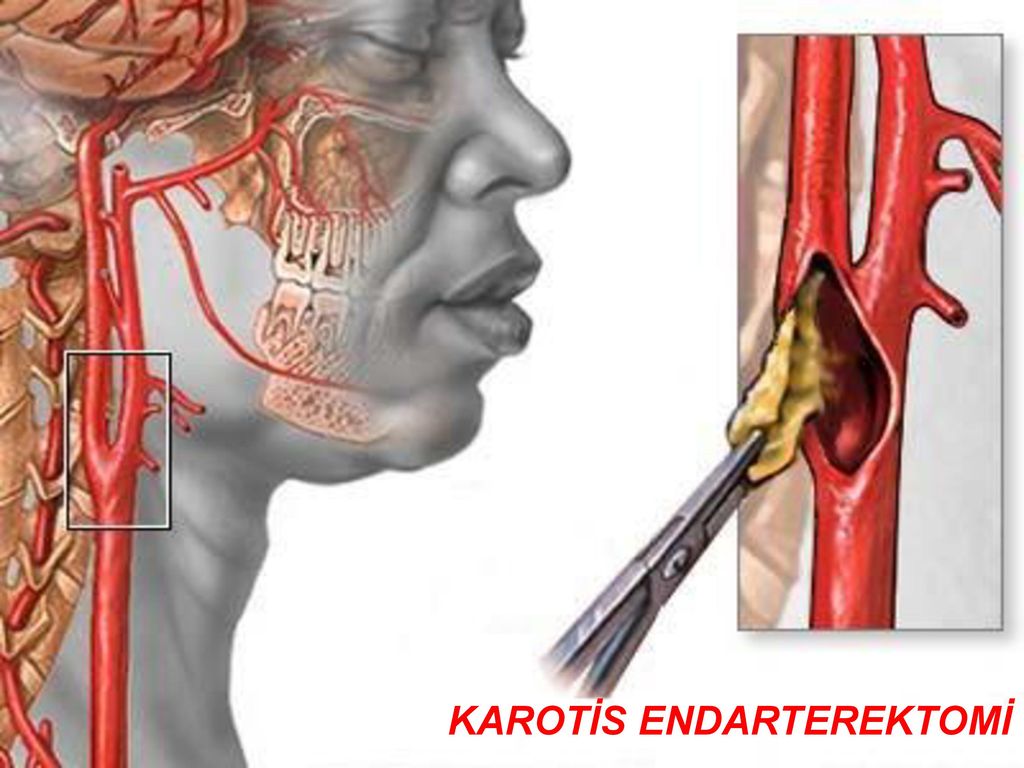 Однако оно редко выполняется при окклюзиях сонных артерий, за исключением случаев острого нарушения мозгового кровообращения по ишемическому типу (3). Несмотря на все достижения в технике каротидной реваскуляризации, малый прогресс был сделан в лечении хронических окклюзий сонных артерий. Мы представляем наш первый опыт стентирования хронических окклюзий сонных артерий.
Однако оно редко выполняется при окклюзиях сонных артерий, за исключением случаев острого нарушения мозгового кровообращения по ишемическому типу (3). Несмотря на все достижения в технике каротидной реваскуляризации, малый прогресс был сделан в лечении хронических окклюзий сонных артерий. Мы представляем наш первый опыт стентирования хронических окклюзий сонных артерий.
Материал и методы
В 2010 году в Областном сосудистом центре ГУЗ РОКБ г Ростова-на-Дону реканализация и стентирование хронической окклюзии ВСА было выполнено 7 пациентам. Средний возраст составил 64,6±4,7 лет. Пятеро (71,4%) пациентов были мужского пола. У всех пациентов в анамнезе имелось ОНМК по ишемическому типу в ипси-латеральном полушарии 6,8±3,1 месяцев назад. При госпитализации неврологический дефицит по шкале NIHSS составлял 3,3±0,7; степень функциональной независимости, оцениваемой по модифицированной шкале Ренкина — 1,0±0,8. Наличие хронической окклюзии ВСА сопровождалось нестабильной неврологической симптоматикой в виде ухудшения неврологического статуса — 2 (28,6%) пациента, частых рецидивирующих ТИА — 3 (42,9%), ортостатических ТИА — 1 (14,3%), головных болей и amaurosis fugax со стороны окклюзии — 1 (14,3%). Сопутствующая патология была представлена следующими заболеваниями: сахарный диабет — 1 (14,3%) пациент, артериальная гипертензия — 7 (100%) пациентов, поражение коронарного русла — 3 (42,9%) пациента. Всем пациентам в предоперационном периоде для оценки перфузии головного мозга выполнялась ОФЭКТ — 4 (57,1%) или перфузионная КТ — 3 (42,9%) больных, по результатам которых было выявлено наличие очагов ишемии в полушарии со стороны окклюзии.
Наличие хронической окклюзии ВСА сопровождалось нестабильной неврологической симптоматикой в виде ухудшения неврологического статуса — 2 (28,6%) пациента, частых рецидивирующих ТИА — 3 (42,9%), ортостатических ТИА — 1 (14,3%), головных болей и amaurosis fugax со стороны окклюзии — 1 (14,3%). Сопутствующая патология была представлена следующими заболеваниями: сахарный диабет — 1 (14,3%) пациент, артериальная гипертензия — 7 (100%) пациентов, поражение коронарного русла — 3 (42,9%) пациента. Всем пациентам в предоперационном периоде для оценки перфузии головного мозга выполнялась ОФЭКТ — 4 (57,1%) или перфузионная КТ — 3 (42,9%) больных, по результатам которых было выявлено наличие очагов ишемии в полушарии со стороны окклюзии.
По данным селективной ангиографии брахиоцефальных артерий у всех пациентов определялась окклюзия шейного сегмента ВСА протяженностью от 4 до 63 мм с ретроградным контрастированием шейного сегмента ВСА дис-тальнее окклюзии через глазную артерию и переднюю соединительную артерию и/или ан-теградным контрастированием через vasa vasorum. У пяти (71,4%) пациентов выявлены гемодинамически незначимые стенозы контрлатеральной ВСА. У двух (28,6%) больных с противоположной стороны имелся стеноз ВСА более 70%. У данных пациентов первым этапом было выполнено стентирование контрлатеральной ВСА, вторым этапом — реканализация и стентирование хронической окклюзии.
У пяти (71,4%) пациентов выявлены гемодинамически незначимые стенозы контрлатеральной ВСА. У двух (28,6%) больных с противоположной стороны имелся стеноз ВСА более 70%. У данных пациентов первым этапом было выполнено стентирование контрлатеральной ВСА, вторым этапом — реканализация и стентирование хронической окклюзии.
Все вмешательства проводились в плановом порядке под местной анестезией. Во всех случаях использовался трансфеморальный доступ.
У 6 (85,7%) больных при реканализации и стентировании хронической окклюзии ВСА применялась только проксимальная защита МoMa Ultra (Invatec). У 1 (14,3%) пациента операция проведена с комбинированным применением систем проксимальной и дистальной защиты головного мозга. Всем пациентам имплантировался каротидный стент Cristallo Ideale (Invatec). Двум (28,6%) больным ввиду пролонгированного поражения дополнительно имплантирован коронарный стент Multi-Link (Abbott Vascular). В результате эндоваскулярного вмешательства у всех пациентов получен кровоток TICI-3.
В результате эндоваскулярного вмешательства у всех пациентов получен кровоток TICI-3.
Всем пациентам за 1 день до операции давалась нагрузочная доза Клопидогреля 600 мг и Аспирина 300 мг. После стентирования был рекомендован прием Аспирина 100 мг в сутки пожизненно и Клопидогреля 75 мг в сутки в течение минимум 3 месяцев. Всем пациентам во время операции вводился гепарин в дозировках 5 000 — 10 000 единиц внутривенно для поддержания активированного времени свертывания в пределах 200-250 секунд.
Результаты эндоваскулярного вмешательства оценивались по наличию клиники, неврологический статус оценивался с помощью шкалы NIHSS при выписке и через 30 дней; степень функциональной независимости пациентов оценивалась по модифицированной шкале Ренкина (mRS) через 30 дней. Проходимость стентов и наличие/отсутствие рестеноза определялись по данным УЗТС, ТКДС при выписке и через 30 дней. Перед выпиской у всех пациентов оценивалась перфузия головного мозга при помощи ОФЭКТ или перфузионной КТ
Результаты
Успешная реканализация и стентирование хронической окклюзии ВСА с восстановлением кровотока TICI-3 достигнута в 100% (7 пациентов).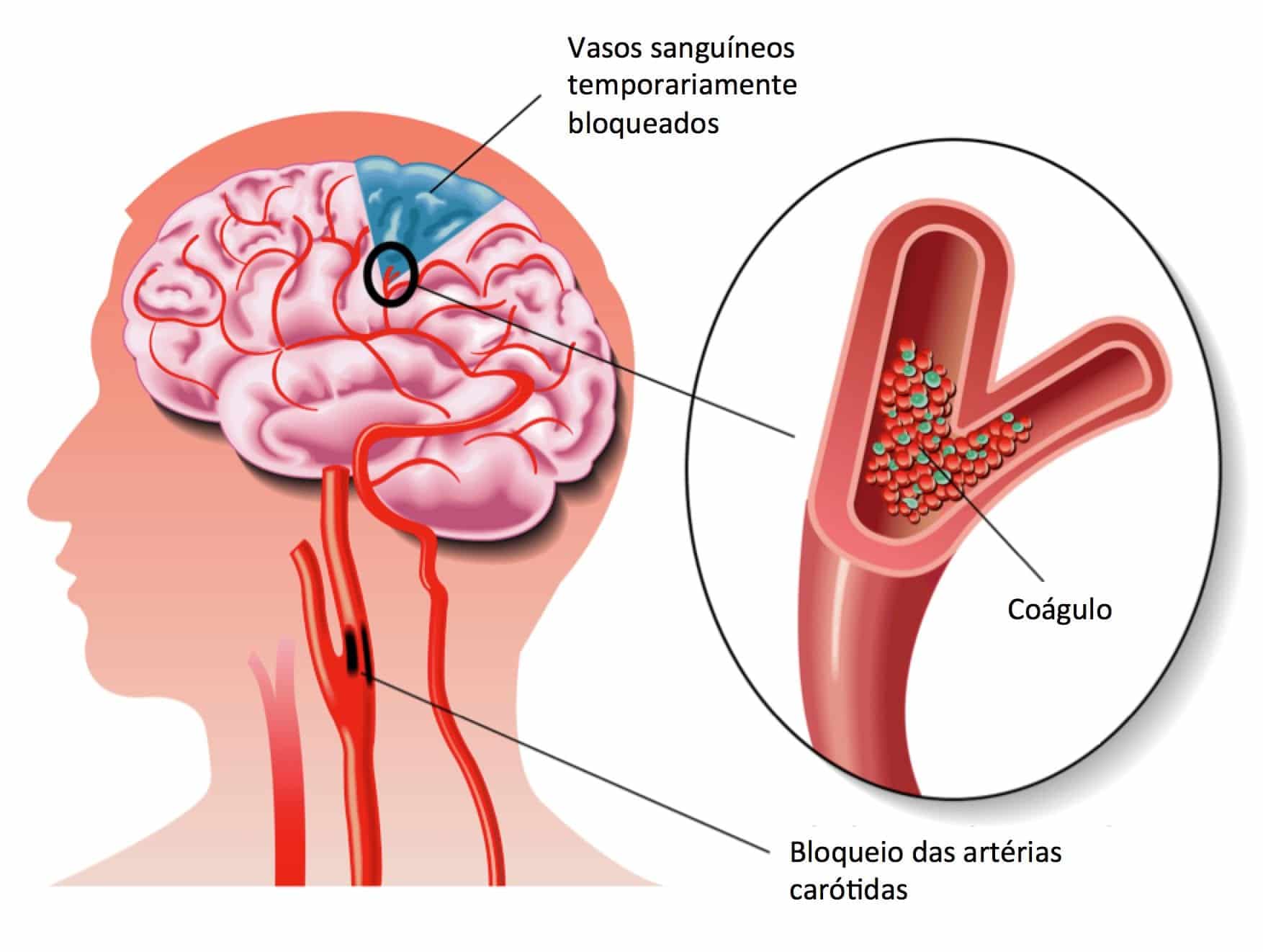 Продолжительность операции в среднем составила 58,0±16,8 минут. Случаев перфорации сонной артерии или экстравазации контраста в ходе вмешательства не зафиксировано. В первые часы после операции у 1 (14,3%) пациента отмечалась брадикардия и гипотензия, разрешившиеся в течение 12 ч. Всем пациентам через 24-48 ч после операции выполнялось КТ головного мозга, не выявившая геморрагических очагов.
Продолжительность операции в среднем составила 58,0±16,8 минут. Случаев перфорации сонной артерии или экстравазации контраста в ходе вмешательства не зафиксировано. В первые часы после операции у 1 (14,3%) пациента отмечалась брадикардия и гипотензия, разрешившиеся в течение 12 ч. Всем пациентам через 24-48 ч после операции выполнялось КТ головного мозга, не выявившая геморрагических очагов.
За период наблюдения, который составил 59,7±13,5 дней, новых ТИА или ишемических инсультов не отмечалось. По данным ультразвуковых методов исследования через 30 дней все стенты проходимы, без признаков рестеноза.
При оценке неврологического статуса по шкале инсультов Национального института здоровья статистически значимых различий в показателях NIHSS при госпитализации (3,3±0,7), при выписке (2,4±0,9) и спустя 30 дней после операции (0,9±0,7) нет, что можно объяснить малым количеством пациентов.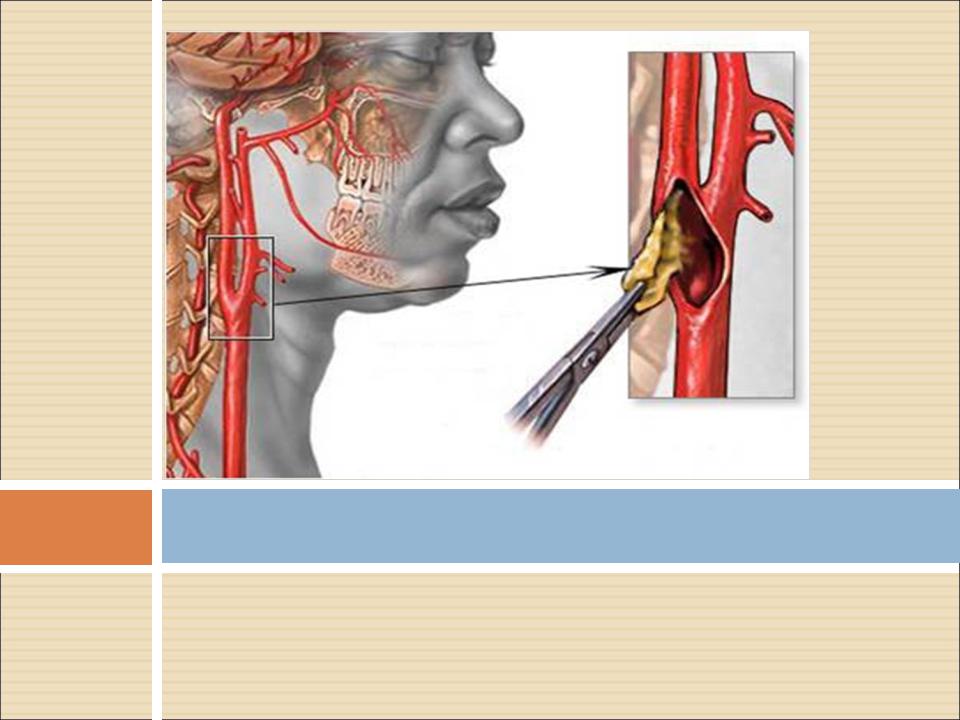 Однако имеется тенден-
Однако имеется тенден-
Рис.1. Окклюзия шейного сегмента правой внутренней сонной артерии
Рис.2. Ретроградное контрастирование русла правой внутренней сонной артерии (стрелки) через глазную артерию
ция к улучшению неврологического статуса, что в совокупности с отсутствием рецидивов ТИА или новых инсультов говорит об успешности эндо-васкулярного вмешательства. Достоверной разницы не выявлено также в показателях функциональной независимости по модифицированной шкале Ренкина при госпитализации и спустя 30 дней после операции на фоне тенденции к улучшению.
По данным методов функциональной нейровизуализации перед выпиской у всех пациентов отмечается улучшение перфузии как ипсилателате-рального, так и контрлатерального полушарий с увеличением цереброваскулярного резерва.
Клиническое наблюдение
Пациент З. , 69 лет, поступил в Областной сосудистый центр ГУЗ РОКБ г. Ростова-на-Дону с жалобами на частые рецидивирующие транзитор-ные ишемические атаки в бассейне правой СМА. В анамнезе у пациента имелось ОНМК в бассейне правой СМА за 7 месяцев до госпитализации. Неврологический статус по шкале NIHSS при поступлении — 2 балла. Степень функциональной независимости по модифицированной шкале Ренкина составляла 1 балл. При УЗТС брахиоцефальных артерий у пациента выявлена окклюзия правой ВСА в шейном сегменте, стеноз 30% в проксимальной трети шейного сегмента левой ВСА. При ТКДС — выраженное снижение линейных скоростных показателей кровотока по правой СМА, кровоток коллатерального типа. При КТ — очаг
, 69 лет, поступил в Областной сосудистый центр ГУЗ РОКБ г. Ростова-на-Дону с жалобами на частые рецидивирующие транзитор-ные ишемические атаки в бассейне правой СМА. В анамнезе у пациента имелось ОНМК в бассейне правой СМА за 7 месяцев до госпитализации. Неврологический статус по шкале NIHSS при поступлении — 2 балла. Степень функциональной независимости по модифицированной шкале Ренкина составляла 1 балл. При УЗТС брахиоцефальных артерий у пациента выявлена окклюзия правой ВСА в шейном сегменте, стеноз 30% в проксимальной трети шейного сегмента левой ВСА. При ТКДС — выраженное снижение линейных скоростных показателей кровотока по правой СМА, кровоток коллатерального типа. При КТ — очаг
перенесенного нарушения мозгового кровообращения в правом полушарии.
При проведении селективной ангиографии брахиоцефальных артерий выявлена окклюзия правой ВСА в шейном сегменте протяженностью 4 мм (рис. 1) с антеградным контрастированием русла ВСА дистальнее окклюзии по уаэа уаэогит и ретроградным — через глазную артерию (рис. 2). Левая ВСА без гемодинамически значимых стенозов с контрастированием правой передней и средней мозговых артерий через переднюю соединительную артерию.
1) с антеградным контрастированием русла ВСА дистальнее окклюзии по уаэа уаэогит и ретроградным — через глазную артерию (рис. 2). Левая ВСА без гемодинамически значимых стенозов с контрастированием правой передней и средней мозговых артерий через переднюю соединительную артерию.
Ввиду частых рецидивирующих ТИА в правой гемисфере и наличия окклюзии правой ВСА, для оценки церебральной перфузии и цереброваскулярного резерва пациенту была выполнена однофотонная эмиссионная компьютерная томография, по результатом которой в правом полушарии головного мозга был выявлен большой очаг ишемии (рис. 3) со сниженным цереброваскулярным резервом.
Учитывая симптомную хроническую окклюзию правой ВСА, наличие дистального русла и нарушение перфузии правого полушария головного мозга, было принято решение об оперативном лечении — реканализации и стентирования правой ВСА.
Эндоваскулярное вмешательство выполнено под местной анестезией правым трансфеморальным доступом.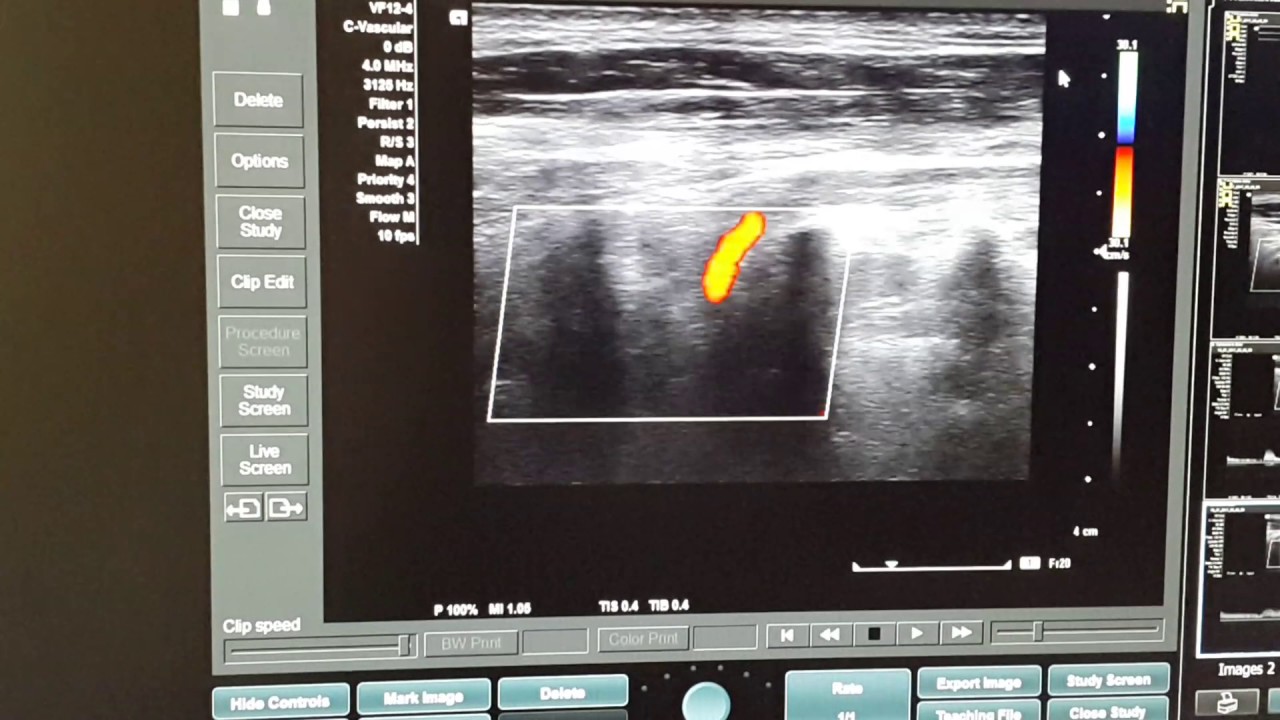 С использованием проксимальной защиты МоМа иКга (1пуа1ес) к зоне окклюзии ВСА проведена система, состоящая из
С использованием проксимальной защиты МоМа иКга (1пуа1ес) к зоне окклюзии ВСА проведена система, состоящая из
45 Inferior
Рис. 3. Однофотонная эмиссионная компьютерная томография головного мозга пациента З. до эндоваскулярного вмешательства (стрелкой указан очаг ишемии в правом полушарии)
коронарного проводника PT2 (Boston Scientific) и коронарного баллонного катетера 1,5-1G мм. Выполнена проводниковая реканализация, пре-дилатация зоны окклюзии. Получен ретроградный кровоток. Выполнена аспирация 4G мл крови: в фильтре осадок не получен. При ангиографии определяется пролонгированный стеноз в шейном сегменте правой ВСА. В зону пролонгированного стеноза имплантирован каротидный стент Cristallo Ideale б-8 х 4G мм (Invatec) (рис. 4) и коронарный стент Multi-Link (Abbott Vascular) (рис. 5). При контрольной ангиографии определяется ан-теградное контрастирование правой ВСА, передней и средней мозговых артерий, кровоток TICI-3 (рис. б и 7). При ОФЭКТ головного мозга, выполненной пациенту перед выпиской, определяется улучшение перфузии правого полушария (рис. 8).
б и 7). При ОФЭКТ головного мозга, выполненной пациенту перед выпиской, определяется улучшение перфузии правого полушария (рис. 8).
Обсуждение
Частота симптомной хронической окклюзии ВСА по данным Flaherty et al. составляет б случаев на 1GG GGG, что является лишь приблизительной оценкой в связи с тем, что многие пациенты с ТИА не обращаются за медицинской помощью, а некоторым больным с инсультом или ТИА не проводится визуализация сонных артерий (4). Эти же авторы предполагают, что около 15% инсультов происходит вследствие окклюзии сонных артерий (4). Встречаемость бессимптомной окклюзии ВСА не известна.
Риск повторного инсульта при наличии ок-клюзированной ВСА достигает 5-7% в год, при этом частота инсульта в бассейне окклюзиро-ванной ВСА составляет 2-б% (5-7). Более того, при сниженном цереброваскулярном резерве у пациентов с хронической окклюзией ВСА риск
повторного инсульта значительно выше и достигает 30% в год (5,7-9). Риск инсульта сохраняется, несмотря на стандартную медикаментозную терапию, включающую дезагре-ганты и антикоагулянты (7).
Риск инсульта сохраняется, несмотря на стандартную медикаментозную терапию, включающую дезагре-ганты и антикоагулянты (7).
Клиническая картина окклюзии ВСА варьирует от совершенно бессимптомной до тяжелого инвалидизирующе-го инсульта и смерти (10). У пациентов с хронической окклюзией ВСА неврологическая симптоматика может появляться в ситуациях, при которых снижается перфузия головного мозга: резкий подъем из положения лежа или сидя (ортостатические ТИА), постпрандиальная гипотензия, кровопотеря или потеря жидкости при физической нагрузке и сердечной недостаточности (10,11). Редким проявлением нарушения церебральной гемодинамики у пациентов с хронической окклюзией ВСА являются повторные непроизвольные движения одной или обеих конечностей одной половины тела, что часто неверно расценивают как проявление эпилепсии (10-12). При этом электроэнцефалограмма не демонстрирует какой-либо эпи-лептиформной активности (10,13,14). У некоторых пациентов развиваются нетипичные головные боли как результат формирования коллатерального кровообращения (10). При окклюзии ВСА коллатеральный кровоток по ветвям наружной сонной артерии может стать причиной пульсации в области угла нижней челюсти, брови и щеки (15). Эпизод транзиторной потери зрения на один глаз (amaurosis fugax) с высокой вероятностью говорит о поражении ВСА проксимальнее глазной артерии (10). Несмотря на то, что amaurosis fugax — это симптом острой ишемии сетчатки, наиболее часто вызванный эмболией из ВСА, у 4-18% пациентов с окклюзией или критическим стенозом ВСА может развиться синдром хронической окулярной ишемии (16). В этом случае пациенты жалуются на прогрессирующую потерю зрения (16). Окклюзия ВСА также может проявляться синко-пальными эпизодами (17). Существует гипотеза, что хроническая церебральная ишемия, вызванная окклюзией ВСА, может приводить к деменции (18).
При окклюзии ВСА коллатеральный кровоток по ветвям наружной сонной артерии может стать причиной пульсации в области угла нижней челюсти, брови и щеки (15). Эпизод транзиторной потери зрения на один глаз (amaurosis fugax) с высокой вероятностью говорит о поражении ВСА проксимальнее глазной артерии (10). Несмотря на то, что amaurosis fugax — это симптом острой ишемии сетчатки, наиболее часто вызванный эмболией из ВСА, у 4-18% пациентов с окклюзией или критическим стенозом ВСА может развиться синдром хронической окулярной ишемии (16). В этом случае пациенты жалуются на прогрессирующую потерю зрения (16). Окклюзия ВСА также может проявляться синко-пальными эпизодами (17). Существует гипотеза, что хроническая церебральная ишемия, вызванная окклюзией ВСА, может приводить к деменции (18).
Церебральная ишемия и ишемия сетчатки при хронической окклюзии ВСА может быть обусловлена эмболией, недостаточностью перфузии или комбинацией обеих причин (10).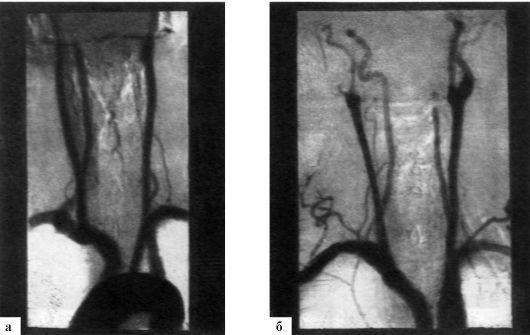 Источником эмболии может являться проксимальная культя ок-
Источником эмболии может являться проксимальная культя ок-
Рис. 4. Правая внутренняя сонная артерия после имплантации каротидного стента: определяется стеноз в шейном сегменте дистальнее стента
клюзированной ВСА, а также атеросклеротические бляшки в общей или наружной сонных артериях (10). При этом эмболия происходит через кол-латерали наружной сонной артерии (10). В пользу данного механизма говорит факт полного купирования симптомов после выключения из кровотока проксимальной культи ВСА и антитромботи-ческого лечения (10,19). Кроме того, существует возможность эмболии из дистального отрезка ок-клюзированной ВСА (5). Однако ввиду отсутствия антеградного кровотока риск эмболии в этом случае не может быть высоким (20). Главную роль в патогенезе ишемии у пациентов с окклюзией ВСА играет недостаточность церебрального кровотока (10,11,20-22). При хронической окклюзии ВСА перфузия головного мозга поддерживается за счет коллатерального кровообращения, недостаточность которого может способствовать гемо-динамическим нарушениям (10). Исследования с применением методов функциональной нейровизуализации, таких как позитронно-эмиссионная томография и ОФЭКТ, продемонстрировали, что нарушение перфузии головного мозга при хронической окклюзии ВСА является независимым фактором будущих ТИА и/или инсультов (10,23). Окклюзия ВСА часто ассоциирована с инфарктами пограничных зон как результат недостаточности церебральной перфузии (10,24). Кроме того, у одного и того же пациента могут иметь место оба механизма (10,25). При этом, как показали исследования на животных, в случае эмболии размер
Исследования с применением методов функциональной нейровизуализации, таких как позитронно-эмиссионная томография и ОФЭКТ, продемонстрировали, что нарушение перфузии головного мозга при хронической окклюзии ВСА является независимым фактором будущих ТИА и/или инсультов (10,23). Окклюзия ВСА часто ассоциирована с инфарктами пограничных зон как результат недостаточности церебральной перфузии (10,24). Кроме того, у одного и того же пациента могут иметь место оба механизма (10,25). При этом, как показали исследования на животных, в случае эмболии размер
Рис. 5. Правая внутренняя сонная артерия после эндоваскулярного вмешательства
инсульта значительно увеличивается при наличии сопутствующей недостаточности церебрального кровотока (26).
Каротидная эндартерэктомия предупреждает инсульт у пациентов со стенозом ВСА, но при окклюзии ВСА частота успешной открытой операции составляет всего 34% вследствие технических трудностей (27). Экстра-интракраниальное шунтирование в теории может улучшить церебральный кровоток у пациентов с окклюзией ВСА, но оказалось неэффективным в снижении частоты инсульта по сравнению с медикаментозной терапией (28). Низкая эффективность открытых вмешательств переключила внимание на путь усиления коллатерального кровотока посредством стентирования наружной или общей сонных артерий, контралатеральной ВСА, позвоночных артерий в зависимости от источника колла-тералей, однако на настоящий момент не существует рандомизированных исследований, поддерживающих данную практику (10, 11).
Экстра-интракраниальное шунтирование в теории может улучшить церебральный кровоток у пациентов с окклюзией ВСА, но оказалось неэффективным в снижении частоты инсульта по сравнению с медикаментозной терапией (28). Низкая эффективность открытых вмешательств переключила внимание на путь усиления коллатерального кровотока посредством стентирования наружной или общей сонных артерий, контралатеральной ВСА, позвоночных артерий в зависимости от источника колла-тералей, однако на настоящий момент не существует рандомизированных исследований, поддерживающих данную практику (10, 11).
В мировой литературе имеются статьи, демонстрирующие эффективность и безопасность стентирования при острых окклюзиях ВСА (29). В последние годы появились публикации о проведении успешных эндоваскулярных вмешательств на хронически окклюзированных сонных артериях (20-22).
Небольшая серия наших клинических наблюдений показывает, что эндоваскулярная реканализация с последующим стентированием хро-
Рис. 6. Селективная ангиография правой общей сонной артерии до эндоваскулярного вмешательства. Отсутствует антеградное контрастирование интракраниального отдела правой ВСА, правой передней и средней мозговых артерий
6. Селективная ангиография правой общей сонной артерии до эндоваскулярного вмешательства. Отсутствует антеградное контрастирование интракраниального отдела правой ВСА, правой передней и средней мозговых артерий
нических окклюзий ВСА возможна и эффективна у определенной группы пациентов. Основными критериями нашего отбора пациентов на эндо-васкулярное вмешательство были: 1) нестабильность неврологического статуса или прогрессирующий неврологический дефицит в бассейне окклюзированной ВСА на фоне полноценной консервативной терапии, 2) доказанная ишемия ип-силатерального полушария по данным ОФЭКТ или перфузионной КТ, и 3) наличие контрастирования шейного сегмента ВСА дистальнее окклюзии, что по данным литературы является хорошим прогностическим признаком успешной реканализации (22). Вызывает сомнение возможность эн-доваскулярной реваскуляризации окклюзирован-ной ВСА при отсутствии контрастирования шейного сегмента, но если контрастирование есть, то реваскуляризация может быть успешно проведена у тщательно отобранных больных.
В нашей практике при селективной ангиографии брахиоцефальных артерий в 24% случаев имелось контрастирование русла шейного сегмента ВСА дистальнее окклюзии, что позволяет думать о возможности проведения успешной эндоваскулярной коррекции данной патологии с восстановлением адекватного антеградного кровотока. При этом наличие проходимого дистального русла у пациентов с диагностированной окклюзией ВСА было выявлено только при селективной ангиографии брахиоцефальных артерий.
Рис. 7. Селективная ангиография правой общей сонной артерии после эндоваскулярного вмешательства
Ультразвуковые исследования и КТ-ангиография оказались малоинформативными в оценке русла ВСА дистальнее окклюзии, предположительно вследствие технических сложностей в визуализации низкоскоростного кровотока по артерии и неориентированности специалистов лучевой диагностики на возможность хирургической коррекции данной патологии.
Эндоваскулярные вмешательства при хронической окклюзии ВСА имеют риск дистальной эмболии, диссекции или перфорации сонной артерии (21,22). У всех 7 пациентов для профилактики эмболии нами применялась система проксимальной защиты MoMa Ultra (Invatec). В одном случае, когда после реканализации, предилатации и получения ретроградного кровотока из аспириро-ванной крови на фильтре был выделен макроскопический осадок, мы приняли решение дополнительно использовать систему дистальной защиты Accunet (Abbott Vascular).
Частота рестеноза после стентирования хронически окклюзированных сонных артерий неизвестна (22). Данные стентирования хронических окклюзий подключичных артерий указывают на то, что частота рестенозов в подобных высокопоточных сосудах низка (30).
При реваскуляризации критических стенозов сонных артерий всегда существует риск гипер-перфузионного синдрома (22). Риск его развития при стентировании хронических окклюзий ВСА
Риск его развития при стентировании хронических окклюзий ВСА
Рис. 8. Однофотонная эмиссионная компьютерная томография головного мозга пациента З. после эндоваскулярного вмешательства. Определяется улучшение перфузии правого полушария
неизвестен, однако доказано, что у пациентов со сниженным цереброваскулярным резервом риск гиперперфузионного синдрома выше (21,22,31). Для профилактики гиперперфузионного синдрома в периоперационном периоде мы старались поддерживать систолическое давление в пределах 100-140 мм.рт.ст.
Риск гиперперфузионного синдрома также выше при наличии критического стеноза с противоположной стороны (32). В наших наблюдениях у двух пациентов имелось гемодинамически значимое поражение контралатеральной ВСА. Первым этапом этим больным было выполнено стентирование гемодинамически значимого стеноза контралатеральной ВСА в ожидании купирования ТИА вследствие усиления перфузии головного мозга. Улучшения неврологического статуса носили временный характер. Проведенная ОФЭКТ головного мозга подтвердила ишемию полушария со стороны окклюзии, вследствие чего пациентам был предложен второй этап лечения.
Улучшения неврологического статуса носили временный характер. Проведенная ОФЭКТ головного мозга подтвердила ишемию полушария со стороны окклюзии, вследствие чего пациентам был предложен второй этап лечения.
Заключение
Небольшое количество пациентов, использование таких традиционных конечных точек
контроля, как новые ТИА или инсульт, недостаточно для полноценной демонстрации эффективности данных эндоваскулярных вмешательств. Небольшая серия наших клинических наблюдений показывает, что проведение таких операций возможно и безопасно. Важен тщательный отбор пациентов, которые наиболее выиграют от подобного рода лечения. В будущем необходимо проведение больших проспективных рандомизированных исследований с включением методов оценки функциональных нейрокогнитивных изменений для определения клинической эффективности и показаний к реканализации хронических окклюзий ВСА.
Список литературы
1. Yadav J.S., Wholey
M.H., Kuntz R.E. Protected carotid-artery stenting versus endarterectomy in high-risk patients. N. Engl. J. Med., 2GG4,351,1493-5G1
2. Qureshi A.I., Kirmani
J.F., Divani F.A., Hobson
R.W. II. Carotid angioplasty
with or without stent placement versus carotid endarterectomy for treatment of carotid stenosis: a meta-analysis. Neurosurgery, 2GG5,56,1171-81
3. Terada T, Yamaga H., Tsumoto T., et al. Use of an embolic protection system during endovascular recanalization of a totally occluded cervical internal carotid artery at the chronic stage. Case report. J. Neurosurg., 2GG5,1G2,558-64
Case report. J. Neurosurg., 2GG5,1G2,558-64
4. Flaherty M.L., Flemming K.D., McClelland R. Population-based study of symptomatic internal carotid artery occlusion. Incidence and long-term follow-up. Stroke, 2GG4,35,e349.
5. Klijn C.J.M., Kappelle L.J., Tulleken C.A., van Gijn J. Symptomatic carotid artery occlusion: a reappraisal of hemodynamic factors. Stroke, 1997,28,2G84-93
6. Hankey G.J. Prognosis of symptomatic carotid artery occlusion. Cerebrovasc. Dis., 1991,1,245-5б
7. Grubb R.L. Jr, Derdeyn C.P, Fritsch S.M. The importance of hemodynamic factors in the prognosis of symptomatic carotid occlusion. JAMA, 1998,28G,1G55-6G
8. Yonas H., Smith H.A., Durham S.R., et al. Increased stroke risk predicted by compromised
cerebral blood flow reactivity.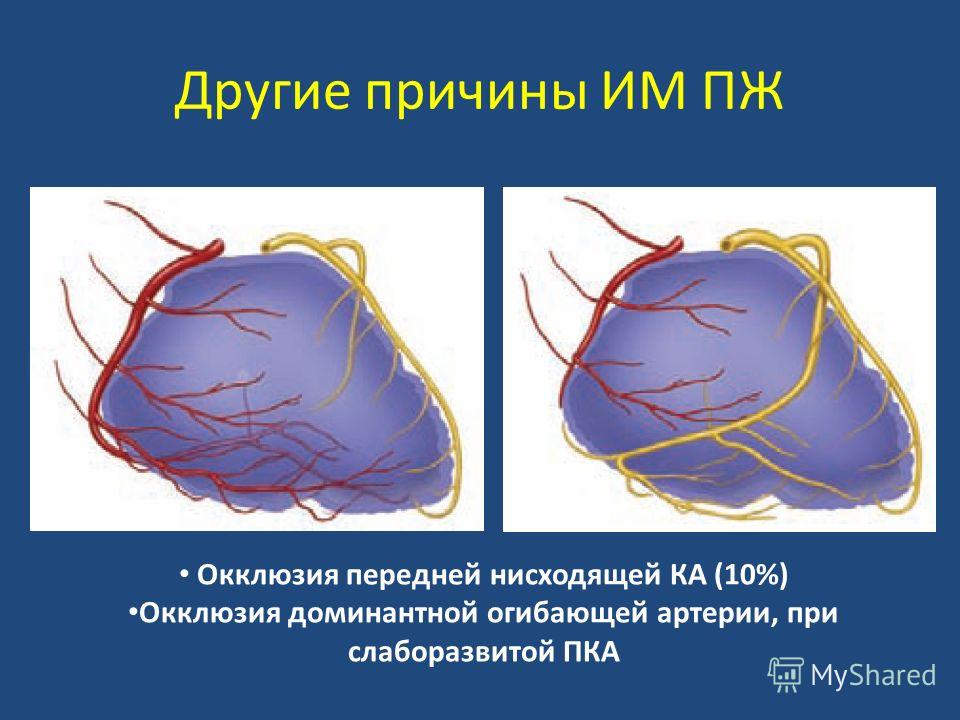 J. Neurosurg., 1993,79,483-9
J. Neurosurg., 1993,79,483-9
9. Derdeyn C.P., Grubb R.L. Jr, Powers WJ. Cerebral hemodynamic impairment: methods of measurement and association with stroke risk. Neurology, 1999,53,251-9
10. Thanvi B., Robinson T. Complete occlusion of extracranial internal carotid artery: clinical features, pathophysiology, diagnosis and management. Postgrad. Med. J., 2007,83,95-9
11. Derdeyn C.P., Grubb R.L. Jr, Powers WJ. Indications for cerebral revascularization for patients with atherosclerotic carotid occlusion. Skull Base, 2005,15(1),7-14
12. Yanagihara T., Piepgras D.G., Klass D.W. Repetitive involuntary movement associated with episodic cerebral ischemia. Ann. Neurol., 1985,18,244-50
13. Yanagihara T., Klass D.W. Rhythmic involuntary movement as a manifestation of transient ischemic attacks. Trans. Am. Neurol. Assoc., 1981,106,46-8
Trans. Am. Neurol. Assoc., 1981,106,46-8
14. Tatemichi T.K., Young W.L., Prohovnik I., et al. Perfusion insufficiency in limb shaking transient ischemic attacks. Stroke, 1990,21,341-7
15. Fisher C.M. Facial pulses in internal carotid artery occlusion. Neurology, 1970,20,476-8
16. Klijn C.J., Kappelle L.J., van Schooneveld M.J., et al. Venous stasis retinopathy in symptomatic carotid artery occlusion: prevalence, cause, and outcome. Stroke, 2002,33,695-701
17. Kashiwazaki D., Kuroda S., Terasaka S., et al. Carotid occlusive disease presenting with loss of consciousness. No Shinkei Geka, 2005,33,29-34
18. Tatemichi T.K., Desmond D.W., Prohovnik I., et al. Dementia associated with bilateral carotid occlusions: neuropsychological and haemodynamic course after extracranial to intracranial bypass surgery. J. Neurol. Neurosurg. Psychiatry, 1995,58,633-6
J. Neurol. Neurosurg. Psychiatry, 1995,58,633-6
19. Barnett H.J.M., Peerless S.J., Kaufmann J.C.E. ‘Stump’ of internal carotid artery: a source for further cerebral embolic ischemia. Stroke, 1978,9,448-56
20. Kao H.L., Lin M.S., Wang C.S. Feasibility of endovascular recanalization for symptomatic cervical internal carotid artery occlusion. J. Am. Coll. Cardiol., 2007,49,765-71
21. Bhatt A., Majid A., Kassab M., Gupta R. Chronic total symptomatic carotid artery occlusion treated successfully with stenting and angioplasty. J. Neuroimaging., 2009,19(1),68-71
22. Thomas A.J., Gupta R., Tayal A.H., et al. Stenting and angioplasty of the symptomatic chronically occluded carotid artery. Am. J. Neuroradiol., 2007,28,168-71
23. Yamauchi H. , Fukuyama H., Nagahama Y, et al. Evidence for misery perfusion and risk for recurrent stroke in major cerebral arterial occlusive diseases from PET. J. Neurol. Neurosurg. Psychiatry, 1996,61,18-25
, Fukuyama H., Nagahama Y, et al. Evidence for misery perfusion and risk for recurrent stroke in major cerebral arterial occlusive diseases from PET. J. Neurol. Neurosurg. Psychiatry, 1996,61,18-25
24. Hupperts R.M.M., Lodder J., Heuts-van Raak E.P.M., et al. Border zone brain infarcts on CT taking into account the variability in vascular supply areas. Cerebrovasc. Dis., 1996,6,294-300
25. Pessin M.S., Hinton R.C., Davis K.R., et al. Mechanisms of acute carotid stroke. Ann. Neurol., 1979,6,245
26. Omae T, Mayzel-Oreg O., Li F., et al. In apparent hemodynamic insufficiency exacerbates ischemic damage in a rat microembolic stroke model. Stroke, 2000,31,2494-9
27. Paty P.S.K., Adeniyi J.A., Mehta M., et al. Surgical treatment of internal carotid artery occlusion. J. Vasc. Surg.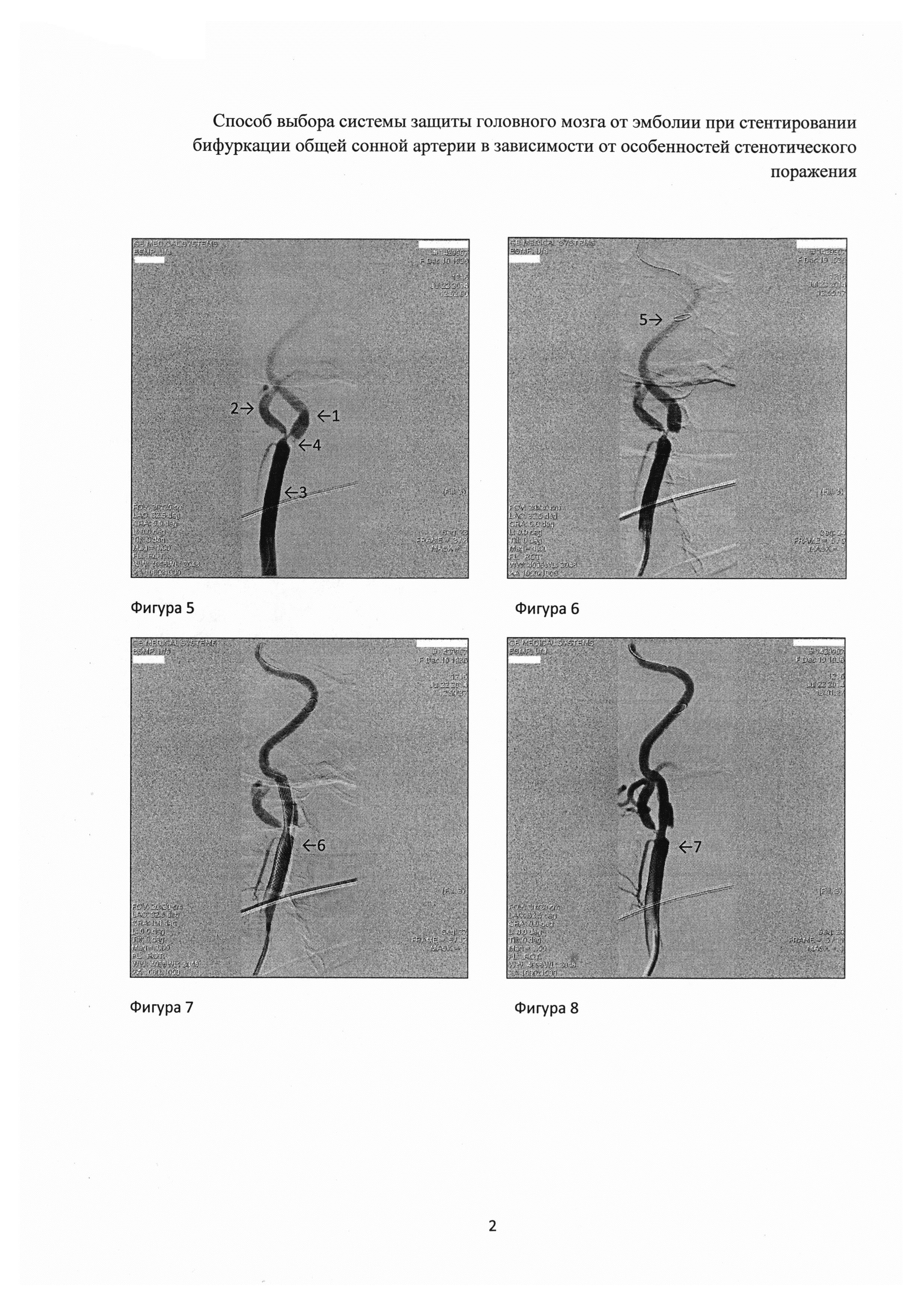 , 2003,37,785-8
, 2003,37,785-8
28. The EC/IC Bypass Study Group. Failure of extracranial-intracranial arterial bypass to reduce the risk of ischemic stroke. Results of an international randomized trial. N. Engl. J. Med., 1985,313,1191-1200
29. Jovin TG, Gupta R, Uchino K, et al. Emergent stenting of extracranial internal carotid artery occlusion in acute stroke has a high revascularization rate. Stroke, 2005,36,2426-30
30. Duber C., Klose K.J., Kopp H., et al. Percutaneous transluminal angioplasty for occlusion of the subclavian artery: short- and long-term results. Cardiovasc. Intervent. Radiol., 1992,15,205-10
31. Kaku Y, Yoshimura S., Kokuzawa J. Factors predictive of cerebral hyperperfusion after carotid angioplasty and stent placement. Am. J. Neuroradiol., 2004,25,1403-8
32. Estol C.J. Carotid revascularization syndrome. International Journal of Stroke, 2006, 1, 2, 81-90.
Estol C.J. Carotid revascularization syndrome. International Journal of Stroke, 2006, 1, 2, 81-90.
Окклюзионная болезнь сонных артерий | Центр мозга и позвоночника Weill Cornell
Окклюзионная болезнь сонной артерии, также называемая стенозом сонной артерии, представляет собой состояние, при котором одна или обе сонные артерии сужаются или блокируются. Это серьезное заболевание, которое при отсутствии лечения увеличивает риск инсульта.
Сонные артерии расположены по обе стороны от шеи — вы можете довольно сильно почувствовать свой пульс, прижав пальцы к шее ниже челюсти сбоку от голосового аппарата.Сразу над точкой пульса сонная артерия разветвляется на два меньших сосуда, называемых внутренней и внешней сонными артериями. Здоровые, свободные сонные артерии — это важные пути, по которым свежая кислородная кровь доставляется от сердца к мозгу. Когда эти артерии сужаются или закупориваются бляшками, в мозг поступает недостаточно кислорода. Зубной налет также может распадаться на мелкие кусочки (эмболы), которые могут попасть в более мелкие сосуды головного мозга и привести к инсульту. Область, где разветвляется основная сонная артерия, является частым местом закупорки.
Зубной налет также может распадаться на мелкие кусочки (эмболы), которые могут попасть в более мелкие сосуды головного мозга и привести к инсульту. Область, где разветвляется основная сонная артерия, является частым местом закупорки.
Если артерия полностью блокируется (что называется окклюзией сонной артерии) или если часть закупорки отламывается и перемещается в меньший сосуд, где он полностью блокирует кровоток, часть мозга может быть полностью лишена кислорода, что приводит к разрушение мозговой ткани. Это то, что происходит во время события, которое мы называем инсультом или «мозговой атакой». Ежегодно в США случается около полумиллиона инсультов, и это третья по значимости причина смерти. Инсульт уносит 140 000 жизней американцев в год — и половина из этих смертельных инсультов связана с окклюзией сонной артерии.
Частичная закупорка, при которой одна из обеих сонных артерий сужается, называется стенозом сонной артерии. Сонные артерии достаточно велики, чтобы обеспечить хорошее кратковременное кровоснабжение, даже когда они начинают сужаться, а другие артерии иногда расширяются, чтобы компенсировать сниженный кровоток, но стеноз сонной артерии все еще может вызвать инсульт или транзиторную ишемическую атаку (ТИА).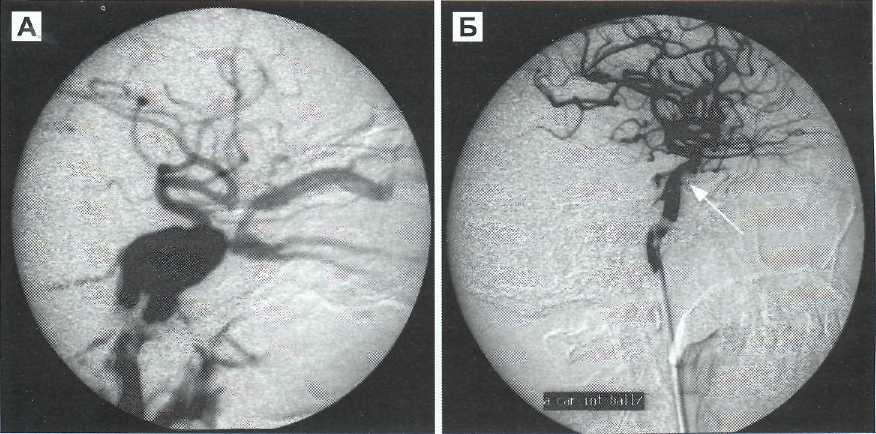 Большая опасность стеноза сонной артерии заключается в том, что часть атеросклеротической бляшки отламывается и полностью блокирует артерию в головном мозге, что также может привести к инсульту или ТИА.ТИА, иногда называемая «мини-инсультом», может вызвать временный неврологический дефицит и является индикатором повышенного риска инсульта в будущем. Мини-удар часто достаточно мал, чтобы его не заметить или не заметить, но это предупреждающий знак, который нельзя игнорировать. (См. Симптомы окклюзионной болезни сонных артерий.)
Большая опасность стеноза сонной артерии заключается в том, что часть атеросклеротической бляшки отламывается и полностью блокирует артерию в головном мозге, что также может привести к инсульту или ТИА.ТИА, иногда называемая «мини-инсультом», может вызвать временный неврологический дефицит и является индикатором повышенного риска инсульта в будущем. Мини-удар часто достаточно мал, чтобы его не заметить или не заметить, но это предупреждающий знак, который нельзя игнорировать. (См. Симптомы окклюзионной болезни сонных артерий.)
Что вызывает окклюзионную болезнь сонных артерий?
Обычно причиной сужения сонных артерий является накопление атеросклеротической бляшки, состоящей из жирового материала и тромбоцитов, вдоль стенок кровеносного сосуда.Это скопление может повредить стенки артерий, которые затем сужаются и затвердевают. Кусочек жирового отложения также может отломиться и попасть в более мелкую артерию головного мозга, вызывая закупорку (отколовшаяся закупорка называется эмболом). Факторы, способствующие накоплению бляшек, включают высокий уровень холестерина, высокое кровяное давление, диабет, курение и ожирение. Окклюзионное заболевание сонных артерий также имеет семейный компонент, поэтому наличие в семейном анамнезе инсульта увеличивает ваш собственный риск.
Факторы, способствующие накоплению бляшек, включают высокий уровень холестерина, высокое кровяное давление, диабет, курение и ожирение. Окклюзионное заболевание сонных артерий также имеет семейный компонент, поэтому наличие в семейном анамнезе инсульта увеличивает ваш собственный риск.
Узнайте больше о программе лечения инсульта в Центре мозга и позвоночника Weill Cornell или воспользуйтесь нашей онлайн-формой, чтобы записаться на прием.
Записаться на прием | Направьте пациента
Проверено Ю. Пьером Гобином, доктором медицины
Последняя проверка / обновление: сентябрь 2020 г.
Иллюстрация Тома Грейвса, CMI
Заболевание сонной артерии: симптомы, причины, диагностика, лечение
Заболевание сонной артерии также называют стенозом сонной артерии. Этот термин относится к сужению сонных артерий. Это сужение обычно вызвано накоплением жирных веществ и отложений холестерина, называемых зубным налетом.Окклюзия сонной артерии означает полную закупорку артерии.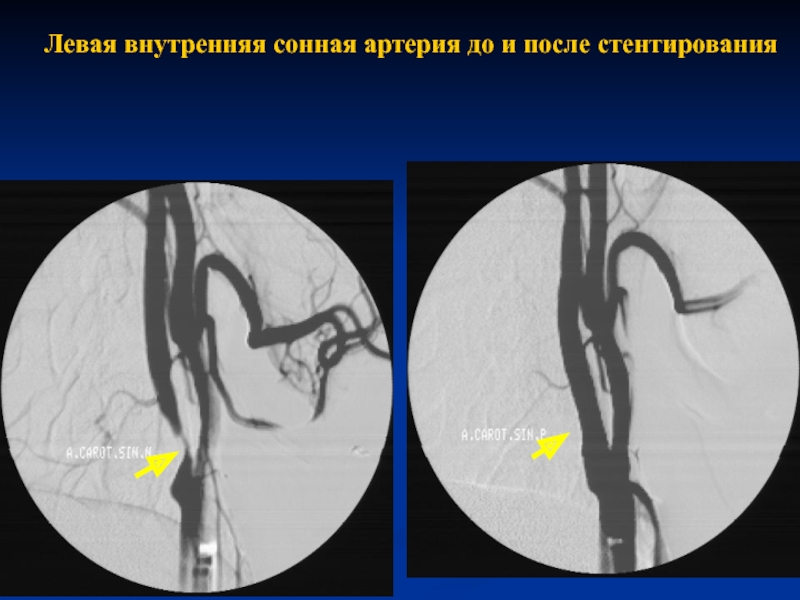 При закупорке сонных артерий повышается риск инсульта, 5-й по значимости причины смерти в США.
При закупорке сонных артерий повышается риск инсульта, 5-й по значимости причины смерти в США.
Что такое сонные артерии?
Сонные артерии — это два крупных кровеносных сосуда, которые поставляют насыщенную кислородом кровь к большой передней части мозга. Здесь находятся мышление, речь, личность, сенсорные и моторные функции. Вы можете почувствовать свой пульс в сонных артериях на каждой стороне шеи, прямо под углом линии челюсти.
Как протекает заболевание сонной артерии?
Подобно артериям, которые снабжают кровью сердце — коронарным артериям, в сонных артериях также может развиться атеросклероз или «затвердение артерий» внутри сосудов.
Со временем накопление жировых веществ и холестерина сужает сонные артерии. Это снижает приток крови к мозгу и увеличивает риск инсульта.
Продолжение
Инсульт, который иногда называют «мозговым приступом», похож на сердечный приступ.Это происходит, когда кровоток прекращается от части мозга. Если отсутствие кровотока длится более трех-шести часов, повреждение обычно необратимо. Инсульт может произойти, если:
- Артерия становится чрезвычайно суженной
- Имеется разрыв в артерии, ведущей к мозгу с атеросклерозом
- Кусок бляшки отламывается и перемещается в более мелкие артерии головного мозга
- Сгусток крови образует и закупоривает кровеносный сосуд
Инсульт может возникать в результате других состояний, помимо болезни сонной артерии.Например, внезапное кровотечение в мозг, называемое внутримозговым кровоизлиянием, может вызвать инсульт. Другие возможные причины включают:
Каковы факторы риска заболевания сонной артерии?
Факторы риска заболевания сонной артерии аналогичны факторам риска других типов сердечных заболеваний. Они включают:
Мужчины моложе 75 лет имеют больший риск, чем женщины той же возрастной группы. Женщины подвергаются большему риску, чем мужчины старше 75 лет. Люди с ишемической болезнью сердца имеют повышенный риск развития болезни сонной артерии.Как правило, сонные артерии заболевают на несколько лет позже коронарных артерий.
Каковы симптомы заболевания сонной артерии?
Возможно, у вас нет никаких симптомов заболевания сонной артерии. Бляшки накапливаются в сонных артериях с течением времени без каких-либо предупреждающих знаков, пока не произойдет преходящая ишемическая атака , (ТИА) или инсульт.
Признаки инсульта могут включать:
- Внезапная потеря зрения, помутнение зрения или нарушение зрения одним или обоими глазами
- Слабость, покалывание или онемение на одной стороне лица, на одной стороне тела , или в одной руке или ноге
- Внезапное затруднение при ходьбе, потеря равновесия, нарушение координации
- Внезапное головокружение и / или спутанность сознания
- Затруднение речи (называемое афазией)
- Спутанность сознания
- Внезапная сильная головная боль
- Проблемы с памятью
- Затруднение при глотании (дисфагия)
Что такое транзиторная ишемическая атака (ТИА)?
ТИА возникает, когда кровоток снижается или сгусток ненадолго блокирует артерию, по которой кровь поступает в мозг.При ТИА у вас могут быть те же симптомы, что и при инсульте. Но симптомы длятся всего несколько минут или несколько часов, а затем проходят.
Продолжение
ТИА — это неотложная медицинская помощь, поскольку невозможно предсказать, перейдет ли она в серьезный инсульт. Если вы или ваш знакомый испытываете какой-либо из вышеперечисленных симптомов, обратитесь за неотложной помощью. Немедленное лечение может спасти вам жизнь и увеличить ваши шансы на полное выздоровление.
Результаты показывают, что у человека, перенесшего ТИА, в 10 раз больше шансов получить серьезный инсульт, чем у человека, не перенесшего ТИА.
Как диагностируется заболевание сонной артерии?
Часто симптомы болезни сонной артерии отсутствуют, пока у вас не будет ТИА или инсульта. Вот почему так важно регулярно посещать врача для медицинских осмотров. Ваш врач может прослушать артерии на вашей шее с помощью стетоскопа. Если ненормальный звук, называемый шумом , слышен над артерией, он может отражать турбулентный кровоток. Это может указывать на заболевание сонной артерии.
Выявление шумов на шее — простой, безопасный и недорогой способ выявления стеноза (сужения) сонной артерии, хотя он может не обнаружить все закупорки.Некоторые эксперты считают, что синяки могут быть более точными предикторами атеросклеротического заболевания, чем риска инсульта. Обязательно сообщите своему врачу, если у вас были какие-либо симптомы, например, перечисленные выше.
Продолжение
Ваш врач может также использовать тест для диагностики болезни сонной артерии. Возможные тесты включают следующее:
- УЗИ сонных артерий (стандартное или допплеровское). В этом неинвазивном, безболезненном скрининговом тесте используются высокочастотные звуковые волны для просмотра сонных артерий.Он ищет бляшки и сгустки крови и определяет, сужены или заблокированы артерии. Ультразвуковая допплерография показывает движение крови по кровеносным сосудам. При ультразвуковой визуализации рентгеновские лучи не используются.
- Магнитно-резонансная ангиография (МРА). В этом методе визуализации используется мощный магнит для сбора точной информации о мозге и артериях. Затем компьютер использует эту информацию для создания изображений с высоким разрешением. МРА часто позволяет обнаружить даже небольшие инсульты в головном мозге.
- Компьютерная томографическая ангиография (КТА). Более детализированный, чем рентгеновский снимок, компьютерная томография использует рентгеновские лучи и компьютерные технологии для получения изображений поперечного сечения сонных артерий. Также можно собирать изображения мозга. С помощью этого визуализирующего теста сканирование может выявить участки повреждения мозга. Компьютерная томография использует низкий уровень излучения.
- Церебральная ангиография (каротидная ангиограмма). Эта процедура считается золотым стандартом для визуализации сонных артерий.Это инвазивная процедура, которая позволяет врачу в режиме реального времени увидеть кровоток по сонным артериям. Церебральная ангиография позволяет врачу увидеть сужение или закупорку на экране рентгеновского снимка в реальном времени, поскольку в сонные артерии вводится контрастный краситель. Эта процедура дает наилучшую информацию. Это несет небольшой риск серьезных осложнений.
Как лечить заболевание сонной артерии?
Для эффективного лечения болезни сонной артерии врачи рекомендуют следующее:
- Соблюдение рекомендованных привычек образа жизни.
- Прием лекарств по назначению.
- Рассматривая процедуру для улучшения кровотока, если ваш врач считает, что она может помочь снизить риск будущего инсульта.
Каковы рекомендуемые изменения образа жизни при заболевании сонной артерии?
Чтобы не допустить прогрессирования заболевания сонной артерии, рекомендуется изменить образ жизни:
- Бросить курить.
- Контроль высокого кровяного давления.
- Контроль диабета.
- Регулярно посещайте врача.
- Попросите вашего врача проверить уровень холестерина и, при необходимости, пройти курс лечения.
- Придерживайтесь здоровой для сердца диеты.
- Поддерживайте здоровый вес.
- Делайте физические упражнения не менее 30 минут большую часть дней в неделю.
- Ограничьте употребление алкоголя до 1 порции в день для женщин и 2 для мужчин.
Какие лекарства могут снизить риск инсульта?
Ваш врач может порекомендовать антиагрегантные препараты, такие как аспирин и клопидогрель (плавикс), для снижения риска инсульта, вызванного сгустками крови.Ваш врач может также назначить лекарства для снижения уровня холестерина и артериального давления. В некоторых случаях может быть назначен разжижитель крови варфарин (кумадин).
Какие медицинские процедуры помогают при заболевании сонной артерии?
Если имеется сильное сужение или закупорка сонной артерии, можно выполнить процедуру, чтобы открыть артерию. Это увеличит приток крови к мозгу и предотвратит инсульт в будущем. Ваш врач может предложить одну из следующих процедур:
- Каротидная эндартерэктомия (CEA). Это обычно выполняемая процедура для пациентов с атеросклерозом сонных артерий и ТИА или легким инсультом. Пока вы находитесь под общей анестезией, на шее делается разрез в месте закупорки. Хирург изолирует артерию и хирургическим путем удаляет зубной налет и пораженные участки артерии. Затем артерии сшивают, чтобы улучшить приток крови к мозгу. Риски и преимущества CEA зависят от вашего возраста, степени блокады, а также от того, был ли у вас инсульт или ТИА.
- Стентирование сонной артерии (CAS). Стентирование сонной артерии (CAS) — это новый метод лечения. Она менее инвазивна, чем каротидная эндартерэктомия, и выполняется в лаборатории катетеризации. При CAS делается небольшой прокол в паху. Специально разработанный катетер вводится в область сужения сонной артерии. Оказавшись на месте, небольшой наконечник воздушного шара надувается на несколько секунд, чтобы открыть артерию. Затем в артерию помещается стент, который расширяется, чтобы удерживать артерию открытой.Стент — это небольшая трубка, которая действует как каркас для поддержки внутри вашей артерии. Стент обычно делается из металла и является постоянным. Он также может быть изготовлен из материала, который со временем впитывается организмом. В некоторых стентах есть лекарство, которое помогает предотвратить повторную закупорку артерии. КАС — это более новая процедура, и до сих пор существуют некоторые разногласия относительно того, насколько хорошо она предотвращает инсульт, вызванный заболеванием сонной артерии. Исследования показывают, что стандартный CEA может быть безопаснее, чем CAS, что может повысить риск инсульта или смерти после процедуры.
Заболевание сонной артерии (стеноз сонной артерии): лечение
Обзор каротидных заболеванийЧто такое сонные артерии?
Артерии несут богатую кислородом кровь от сердца к голове и телу. Есть две сонные артерии (по одной с каждой стороны шеи), которые снабжают мозг кровью. Сонные артерии можно прощупать с каждой стороны нижней части шеи, непосредственно под углом челюсти.
Сонные артерии снабжают кровью большую переднюю часть мозга, где находятся мышление, речь, личность, сенсорные и моторные функции.
Позвоночные артерии проходят через позвоночник и снабжают кровью заднюю часть мозга (ствол мозга и мозжечок).
Что такое заболевание сонной артерии?
Заболевание сонной артерии, также называемое стенозом сонной артерии, представляет собой сужение сонных артерий, обычно вызываемое атеросклерозом.Атеросклероз — это накопление холестерина, жира и других веществ, перемещающихся с кровотоком, таких как воспалительные клетки, продукты жизнедеятельности клеток, белки и кальций. Эти вещества со временем прилипают к стенкам кровеносных сосудов с возрастом и объединяются, образуя материал, называемый бляшкой.
Накопление бляшек может привести к сужению или закупорке сонной артерии, что, если оно значительно, может подвергнуть человека повышенному риску инсульта.
Каковы симптомы?
Симптомы болезни сонной артерии могут отсутствовать.Однако есть предупреждающие признаки инсульта. Транзиторная ишемическая атака (также называемая ТИА или «мини-инсульт») — один из наиболее важных предупреждающих признаков инсульта. ТИА возникает, когда сгусток крови на короткое время блокирует артерию, поставляющую кровь в мозг. Следующие симптомы ТИА, которые являются временными и могут длиться от нескольких минут до нескольких часов, могут возникать по отдельности или в сочетании:
- Внезапная потеря зрения или помутнение зрения на один или оба глаза
- Слабость и / или онемение одной стороны лица, или одной руки или ноги, или одной стороны тела
- Невнятная речь, трудности при разговоре или понимании того, что говорят другие
- Нарушение координации
- Головокружение или спутанность сознания
- Затруднения при глотании
ТИА — это неотложная медицинская помощь , поскольку невозможно предсказать, перейдет ли она в серьезный инсульт.Если вы или ваш знакомый испытываете эти симптомы, обратитесь за неотложной помощью (звоните 9-1-1 в большинстве районов). Немедленное лечение может спасти вам жизнь или увеличить ваши шансы на полное выздоровление.
TIA являются надежными предикторами будущих инсультов; человек, перенесший ТИА, в 10 раз чаще страдает серьезным инсультом, чем тот, кто не испытал ТИА.
Что такое инсульт?
Инсульт, или «атака мозга», происходит, когда кровеносный сосуд в головном мозге блокируется или лопается.Мозг не может хранить кислород, поэтому он полагается на сеть кровеносных сосудов, чтобы обеспечить его кровью, богатой кислородом. Инсульт приводит к недостатку кровоснабжения, в результате чего окружающие нервные клетки лишаются доступа к питательным веществам и кислороду. Когда ткань лишается доступа к кислороду более чем на 3-4 минуты, она начинает умирать.
Инсульт может произойти, если:
- Артерия сильно сужается из-за бляшки
- Часть бляшки отламывается и попадает в более мелкие артерии головного мозга
- Сгусток крови, блокирующий суженную артерию
Инсульт также может возникнуть в результате других состояний, таких как внезапное кровотечение в головном мозге (внутримозговое кровоизлияние), внезапное кровотечение в пространстве спинномозговой жидкости (субарахноидальное кровоизлияние), фибрилляция предсердий, кардиомиопатия или закупорка крошечных артерий внутри мозг.
Далее: Диагностика и тестыПроверено медицинским специалистом Cleveland Clinic.
Получите полезную, полезную и актуальную информацию о здоровье и благополучии
е НовостиКлиника Кливленда — некоммерческий академический медицинский центр.Реклама на нашем сайте помогает поддерживать нашу миссию. Мы не поддерживаем продукты или услуги, не принадлежащие Cleveland Clinic. Политика
Когда проводить операцию при заболевании сонной артерии
1. Факты об инсульте. Даллас: Американская кардиологическая ассоциация, 1989 ….
2. Гарсия JH, Хан-Лун Х. Каротидный атеросклероз.Определение, патогенез и клиническое значение. Клиника нейровизуализации № Am . 1996; 6: 801–10.
3. Эль-Баргути Н, Николаидес А, Бахал V, Герулакос Г, Андроулакис А. Выявление бляшки сонной артерии высокого риска. евро J Vasc Endovasc Surg . 1996; 11: 470–8.
4. Карр С., Фарб А, Пирс WH, Вирмани Р, Yao JS. Разрыв атеросклеротической бляшки при симптоматическом стенозе сонной артерии. J Vasc Surg . 1996. 23: 755–65.
5. Хацуками Т.С., Фергюсон М.С., Пляж кВт, Гордон Д, Детмер П., Бернс Д, и другие. Морфология каротидных бляшек и клинические проявления. Ход . 1997. 28: 95–100.
6. MacMahon S, Роджерс А. Первичная и вторичная профилактика инсульта. Клин Эксперт Гипертенз . 1996; 18: 537–46.
7. Биллер Дж., Люблю BB. Диабет и инсульт. Med Clin North Am . 1993; 77: 95–110.
8. Горелик ПБ, Шнек М, Берглунд Л.Ф., Файнберг В, Голдстоун Дж. Статус липидов как фактора риска инсульта. Нейроэпидемиология . 1997; 16: 107–15.
9. Abbott RD, Инь Y, Рид ДМ, Яно К. Риск инсульта у курильщиков сигарет. N Engl J Med . 1986; 315: 717–20.
10. Palomaki H, Касте М.Регулярное употребление алкоголя от слабого до умеренного и риск ишемического инсульта. Есть ли положительный эффект ?. Ход . 1993; 24: 1828–32.
11. Walker SP, Римм ЭБ, Аскерио А, Кавачи I, Штампфер MJ, Willet WC. Размер тела и распределение жира как предикторы инсульта у мужчин в США. Am J Epidemiol . 1996; 144: 1143–50.
12. Coull BM, Проектор NB, Кларк ВМ, Винн М.Микроальбуминурия и риск повторного инсульта [Резюме]. В: 23-я международная совместная конференция по инсульту и церебральному кровообращению, Орландо, Флорида; 5–7 февраля 1988 г. Инсульт . 1998; 24: 285.
13. Обуховский Н.А., Модик МТ, Магдинек М, Mazaryk TJ. Оценка эффективности неинвазивного скрининга пациентов с бессимптомными ушибами шеи. Ход . 1997; 28: 1330–9.
14. Heiserman JE, Забрамский Ю.М., Осушитель БП, Келлер П.Дж.Клиническое значение разрыва потока в магнитно-резонансной ангиографии сонной артерии. Дж. Нейросург . 1996; 85: 384–7.
15. Moneta GL, Эдвардс Дж. М., Папаниколау G, Хацуками Т, Тейлор Л. М. младший, Strandness DE Jr, и другие. Скрининг бессимптомного стеноза внутренней сонной артерии: дуплексные критерии для различения стеноза от 60% до 99%. J Vasc Surg . 1995; 21: 989–94.
16. Льюис РФ, Абрахамович М, Кот Р, Battista RN.Прогностическая сила дуплексного ультразвукового исследования при бессимптомной болезни сонной артерии. Энн Интерн Мед. 1997. 129: 13–20.
17. Перри-младший, Салаи JP, Норрис Дж. У. Консенсус против эндартерэктомии и рутинного скрининга бессимптомного стеноза сонной артерии. Арка Нейрол . 1997. 54: 25–8.
18. Баллард JL, Дейпарин МК, Берган Дж. Дж., Бунт Т.Дж., Киллин JD, Смит LL. Экономически эффективное обследование и лечение заболеваний сонных артерий. Arch Surg . 1997. 132: 268–71.
19. Североамериканское испытание симптоматической каротидной эндартерэктомии (NASCET) Соавторы. Благоприятный эффект каротидной эндартерэктомии у симптомных пациентов со стенозом сонной артерии высокой степени. N Engl J Med . 1991; 325: 445–53.
20. Европейская группа исследователей хирургии сонных артерий. MRC European Carotid Surgery Trial: промежуточные результаты для симптоматических пациентов с тяжелым (70–99%) или легким (0–29%) стенозом сонных артерий. Ланцет . 1991; 337: 1235–43.
21. Майберг М.Р., Wilson SE, Яцу Ф, Weiss DG, Мессина L, Херши Л.А., и другие. Каротидная эндартерэктомия и профилактика церебральной ишемии при симптоматическом стенозе сонной артерии. ЯМА . 1991; 266: 3289–94.
22. Ротвелл П.М., Гибсон Р.Дж., Слэттери J, Селлар Р.Дж., Warlow CP. Эквивалентность измерений стеноза сонной артерии.Сравнение трех методов на 1001 ангиограмме. Ход . 1994; 25: 2435–9.
23. Европейская группа исследователей сонных артерий. Эндартерэктомия при умеренном симптоматическом стенозе сонной артерии: промежуточные результаты исследования MRC European Carotid Surgery Trial. Ланцет . 1996; 347: 1591–3.
24. Barnett HJ, Тейлор DW, Элиашив М, Фокс Эй Джей, Фергюсон Г.Г., Хейнс РБ, и другие. Преимущества каротидной эндартерэктомии у пациентов с симптоматическим стенозом средней или тяжелой степени. N Engl J Med . 1998; 339: 1415–25.
25. Sauve JS, Торп К.Э., Сакетт Д.Л., Тейлор В, Барнетт HJ, Хейнс РБ, и другие. Могут ли синяки отличить стеноз сонной артерии высокой степени от умеренного симптоматического? Североамериканское исследование симптоматической эндартерэктомии сонной артерии. Энн Интерн Мед. 1994; 120: 633–7.
26. Виберс Д.О., Whisnant JP, Сандок Б.А., О’Фаллон WM. Проспективное сравнение когорты с бессимптомным каротидным шумом и популяционной когорты без каротидного шума. Ход . 1990; 21: 984–8.
27. Норрис Дж. У., Чжу CA, Борнштейн Н.М., Палаты BR. Сосудистые риски бессимптомного стеноза сонной артерии. Ход . 1991; 22: 1485–90.
28. CASANOVA Study Group. Хирургия сонной артерии в сравнении с медикаментозной терапией при бессимптомном стенозе сонной артерии. Ход . 1991; 22: 1229–35.
29. Группа исследования бессимптомной каротидной эндартерэктомии Мэйо. Результаты рандомизированного контролируемого исследования каротидной эндартерэктомии при бессимптомном стенозе сонной артерии. Mayo Clin Proc . 1992; 67: 513–8.
30. Хобсон Р.В. 2д, Вайсс Д.Г., Филдс В.С., Голдстоун Дж., Мур В.С., Таун Дж. Б. и др. Эффективность каротидной эндартерэктомии при бессимптомном стенозе сонной артерии. N Engl J Med . 1993; 328: 276–9.
31. Исполнительный комитет по исследованию бессимптомного атеросклероза сонных артерий. Эндартерэктомия при бессимптомном стенозе сонной артерии. ЯМА . 1995; 273: 1421–8.
32. Европейская группа исследователей хирургии сонных артерий.Риск инсульта при бессимптомном распространении сонной артерии. Ланцет . 1995; 345: 209–12.
33. Мур WS, Барнетт HJ, Биби Х.Г., Бернштейн Э. Ф., Бренер Б.Дж., Бротт Т, и другие. Рекомендации по каротидной эндартерэктомии. Междисциплинарное заявление о консенсусе Специального комитета Американской кардиологической ассоциации. Тираж . 1995; 91: 566–79.
Заболевание сонной артерии | Кафедра неврологии
Что такое заболевание сонной артерии?
Заболевание сонной артерии, также называемое стенозом сонной артерии, возникает при сужении сонных артерий, основных кровеносных сосудов, по которым насыщенная кислородом кровь в мозг сужается.Сужение сонных артерий чаще всего связано с атеросклерозом (накопление зубного налета, который представляет собой отложение жировых веществ, холестерина, продуктов жизнедеятельности клеток, кальция и фибрина во внутренней выстилке артерии). Атеросклероз или «затвердение артерий» — это сосудистое заболевание (заболевание артерий и вен). Заболевание сонной артерии похоже на заболевание коронарной артерии, при котором закупорка происходит в артериях сердца и может вызвать сердечный приступ.
Чтобы лучше понять, как поражение сонной артерии влияет на мозг, следует краткий обзор анатомии системы кровообращения головного мозга.
Что такое сонные артерии?
Основное кровоснабжение головного мозга осуществляется сонными артериями. Сонные артерии ответвляются от аорты (самой большой артерии в организме) на небольшом расстоянии от сердца и проходят вверх через шею, неся богатую кислородом кровь в мозг.
Сонные артерии 2: правая и левая. Каждая сонная артерия затем разветвляется на внутреннюю сонную артерию и внешнюю сонную артерию. По одной паре (внешняя и внутренняя) расположены с каждой стороны шеи.Так же, как пульс можно почувствовать в запястьях, пульс можно также почувствовать или услышать с обеих сторон шеи над сонными артериями.
Почему так важны сонные артерии?
Поскольку сонные артерии доставляют кровь в мозг, заболевание сонных артерий может иметь серьезные последствия из-за снижения притока кислорода к мозгу. Мозгу для нормальной работы необходим постоянный приток кислорода. Даже кратковременное прерывание кровоснабжения может вызвать проблемы. Клетки мозга начинают умирать всего через несколько минут без крови и кислорода.Если сужение сонных артерий становится достаточно серьезным, чтобы блокировать кровоток, или если кусок атеросклеротической бляшки отламывается и препятствует притоку крови к мозгу, может возникнуть инсульт.
Что вызывает заболевание сонной артерии?
Атеросклероз — наиболее частая причина заболевания сонной артерии. Атеросклероз — это медленное прогрессирующее заболевание сосудов. Однако болезнь может быстро прогрессировать. Обычно для него характерно скопление жировых отложений вдоль внутреннего слоя артерий.Если болезнь прогрессирует, возможно образование зубного налета. Зубной налет состоит из отложений гладкомышечных клеток, жировых веществ, холестерина, кальция и клеточных отходов. Это утолщение сужает артерии и может уменьшить кровоток или полностью заблокировать приток крови к мозгу.
Факторы риска, связанные с атеросклерозом, включают:
Пожилой возраст
Мужской
Семейная история
Раса или национальность
Генетические факторы
Гиперлипидемия (повышенное содержание жиров в крови)
Гипертония (высокое кровяное давление)
Курение
Диабет
Ожирение
Диета с высоким содержанием насыщенных жиров
Недостаток активности
Фактор риска — это все, что может напрямую увеличить или быть связанным с шансом человека на развитие болезни.Это может быть какая-то деятельность, например, курение, диета, семейный анамнез или многое другое. Различные заболевания имеют разные факторы риска.
Хотя эти факторы риска увеличивают риск для человека, они не обязательно вызывают заболевание. У некоторых людей с одним или несколькими факторами риска болезнь никогда не развивается, у других заболевание развивается, и факторы риска неизвестны. Знание ваших факторов риска любого заболевания может помочь вам сориентироваться в правильных действиях, включая изменение поведения и клиническое наблюдение за заболеванием.
Каковы симптомы болезни сонной артерии?
Заболевание сонной артерии может быть бессимптомным (без симптомов) или симптоматическим (с симптомами). Бессимптомное заболевание сонной артерии — это наличие значительного количества атеросклеротических образований, не препятствующих кровотоку, достаточному для возникновения симптомов. Однако не всегда достаточно плотный стеноз вызывает симптомы. Симптоматическое заболевание сонной артерии может привести к транзиторной ишемической атаке (ТИА) и / или инсульту (мозговому приступу).
Преходящая ишемическая атака (ТИА) — это внезапная или временная потеря кровотока в определенной области мозга, обычно продолжающаяся от нескольких минут до 1 часа. Симптомы полностью проходят в течение 24 часов с полным выздоровлением. Инсульт, также называемый цереброваскулярным нарушением (ЦВА), — это когда симптомы не проходят. Симптомы TIA или CVA могут включать, помимо прочего, следующее:
Внезапная слабость или неуклюжесть руки и / или ноги с одной стороны тела
Внезапный паралич (невозможность двигаться) руки и / или ноги с одной стороны тела
Нарушение координации или движения
Спутанность сознания, снижение способности концентрироваться, головокружение, обмороки и / или головная боль
Онемение или потеря чувствительности (ощущения) лица
Онемение или потеря чувствительности руки и / или ноги
Временная потеря зрения или нечеткость зрения
Неспособность говорить четко или невнятно
ТИА может быть связана с серьезным сужением или закупоркой или с отрывом небольших кусочков атеросклеротической бляшки, перемещением по кровотоку и оседанием мелких кровеносных сосудов головного мозга.ТИА редко вызывает стойкое повреждение мозга.
Немедленно обратитесь за медицинской помощью, если вы подозреваете, что у человека есть ТИА, так как это может быть предупреждающим знаком о приближении инсульта. Однако не всем инсультам предшествуют ТИА.
Инсульт (CVA) — еще один индикатор заболевания сонной артерии. Симптомы инсульта такие же, как и при ТИА. Инсульт — это потеря кровотока (ишемия) к мозгу, которая продолжается достаточно долго, чтобы вызвать необратимое повреждение мозга. Клетки мозга начинают умирать через несколько минут без кислорода.Область мертвых клеток в тканях — это инфаркт.
Область мозга, в которой нарушен кровоток, будет определять, какой может быть физический или умственный недостаток. Это может включать нарушение двигательной способности, речи, мышления и памяти, функции кишечника и мочевого пузыря, приема пищи, эмоционального контроля и других жизненно важных функций организма. Восстановление конкретной затронутой способности зависит от размера и местоположения удара. Инсульт может привести к проблемам, таким как слабость в руке или ноге, или вызвать паралич, потерю речи или даже смерть.
Симптомы болезни сонной артерии могут напоминать другие заболевания или проблемы. Всегда консультируйтесь с врачом для постановки диагноза.
Как диагностируется заболевание сонной артерии?
В дополнение к полному анамнезу и физическому обследованию, диагностические процедуры при заболевании сонной артерии могут включать в себя любое или комбинацию следующего:
Аускультация (выслушивание) сонных артерий. Наложение стетоскопа на сонную артерию для прослушивания особого звука, называемого шумом (произносится как «варево»).Шум — это ненормальный звук, производимый кровью, проходящей через суженную артерию. Шум обычно считается признаком атеросклеротической артерии; однако артерия может быть поражена без этого звука.
Дуплексное сканирование сонной артерии. Тип ультразвукового исследования сосудов, выполняемый для оценки кровотока в сонных артериях. Дуплексное сканирование сонной артерии — это неинвазивная (кожа не прокалывается) процедура. Зонд, называемый преобразователем, излучает ультразвуковые звуковые волны на слишком высокой частоте, чтобы их можно было услышать.Когда датчик (например, микрофон) размещается на сонных артериях в определенных местах и под определенными углами, ультразвуковые звуковые волны движутся через кожу и другие ткани тела к кровеносным сосудам, где волны отражаются от клеток крови. Преобразователь улавливает отраженные волны и отправляет их в усилитель, который делает ультразвуковые звуковые волны слышимыми. Отсутствие или слабость этих звуков может указывать на препятствие кровотоку.
Магнитно-резонансная томография (МРТ). Диагностическая процедура, которая использует комбинацию больших магнитов, радиочастоты и компьютера для получения детальных изображений органов и структур внутри тела. Чтобы пройти этот тест, вы ложитесь в большую трубку, пока магниты проходят вокруг вашего тела. Это очень громко. Иногда это делается с помощью внутривенного введения контрастного вещества в вены, а иногда нет.
Магнитно-резонансная ангиография (МРА). Диагностическая процедура, при которой используется комбинация технологии магнитного резонанса (МРТ) и внутривенного (IV) контрастного красителя для визуализации кровеносных сосудов.Контрастный краситель делает кровеносные сосуды непрозрачными на МРТ-изображении, что позволяет врачу визуализировать оцениваемые кровеносные сосуды.
Компьютерная томография (также называемая компьютерной томографией или компьютерной томографией). Диагностическая процедура визуализации, при которой используется комбинация рентгеновских лучей и компьютерных технологий для получения горизонтальных или осевых изображений (часто называемых срезами) тела. КТ показывает подробные изображения любой части тела, включая кости, мышцы, жир и органы.КТ более детализирована, чем обычная рентгенография. Как и МРТ, иногда это делается с внутривенным введением контрастного вещества в вены, а иногда нет.
Ангиография. Инвазивная процедура, используемая для оценки степени закупорки или сужения сонных артерий путем получения рентгеновских снимков при введении контрастного красителя. Контрастный краситель помогает визуализировать форму и кровоток по артериям во время рентгеновских снимков.
Лечение болезни сонной артерии
Специфическое лечение болезни сонной артерии будет назначено вашим врачом на основании:
Ваш возраст, общее состояние здоровья и история болезни
Степень заболевания
Ваши признаки и симптомы
Ваша переносимость определенных лекарств, процедур или методов лечения
Ожидания по течению болезни
Ваше мнение или предпочтение
Заболевание сонной артерии (бессимптомное или симптоматическое), при котором сужение сонной артерии составляет менее 50%, чаще всего лечится медикаментозно.Бессимптомное заболевание с сужением менее 70% также можно лечить медикаментозно, в зависимости от индивидуальной ситуации.
Лечение болезни сонной артерии может включать:
Изменение факторов риска. Факторы риска, которые могут быть изменены, включают курение, повышенный уровень холестерина, повышенный уровень глюкозы в крови, недостаток физических упражнений, неправильное питание и повышенное кровяное давление.
Лекарства. Лекарства, которые можно использовать для лечения болезни сонной артерии, включают:
Антиагрегантные препараты. Лекарства, используемые для уменьшения способности тромбоцитов в крови слипаться и вызывать образование тромбов. Аспирин, клопидогрель и дипиридамол являются примерами антиагрегантов.
Антигиперлипидемические средства. Лекарства, используемые для снижения содержания липидов (жиров) в крови, особенно холестерина. Статины представляют собой группу антигиперлипидемических препаратов и включают, среди прочего, симвастатин, аторвастатин и правастатин. Исследования показали, что некоторые статины могут уменьшать толщину стенки сонной артерии и увеличивать размер просвета (отверстия) артерии.
Антигипертензивные средства. Лекарства, применяемые для снижения артериального давления. Есть несколько разных групп лекарств, которые по-разному действуют на снижение артериального давления.
Людям с сужением сонной артерии более чем на 50–69% может быть рекомендовано более агрессивное лечение, особенно людям с симптомами. Хирургическое лечение снижает риск инсульта после таких симптомов, как ТИА или малый инсульт, особенно у людей с окклюзией (закупоркой) более 70%, которые являются хорошими кандидатами на операцию.
Хирургическое лечение болезни сонной артерии включает:
Каротидная эндартерэктомия (CEA). Каротидная эндартерэктомия — это процедура, используемая для удаления налета и сгустков из сонных артерий, расположенных в области шеи. Эндартерэктомия может помочь предотвратить инсульт у людей с симптомами сужения сонной артерии на 70% и более.
Ангиопластика сонной артерии со стентированием (CAS). Каротидная ангиопластика со стентированием — вариант для пациентов с высоким риском каротидной эндартерэктомии.Это минимально инвазивная процедура, при которой очень маленькая полая трубка или катетер продвигается от кровеносного сосуда в паховой области к сонным артериям. Как только катетер установлен, можно надуть баллон, чтобы открыть артерию, и установить стент. Стент представляет собой цилиндрическую трубку из тонкой металлической сетки, которая удерживает артерию открытой. Поскольку существует риск инсульта из-за того, что кусочки зубного налета отламываются во время процедуры, можно использовать устройство, называемое устройством защиты от эмболии.Устройство защиты от эмболии представляет собой фильтр (например, небольшую корзину), прикрепленный к проволочному проводнику для улавливания любого мусора, который может отломиться во время процедуры.
Окклюзия общей сонной артерии: серия случаев
Субъекты и методы . Мы проанализировали 5000 записей ультразвукового исследования сосудов головного мозга. Окклюзия общей сонной артерии (CCAO) была у 0,4% пациентов. Результатов . Средний возраст составлял годы, а соотношение мужчин и женщин — 2,33. Наиболее частыми факторами риска были артериальная гипертензия, ишемическая болезнь сердца, дислипидемия, сахарный диабет и курение.Правосторонняя и левосторонняя ОСАО встречались в 65% и 30% случаев соответственно, а двусторонняя окклюзия была обнаружена в одном случае (5%). Патентная бифуркация наблюдалась в 10 случаях CCAO, в которых антероградный поток в ICA поддерживался из наружной сонной артерии с обратным потоком. В двух случаях окклюзированная ОСА была гипопластической. Этиология ХКАО в большинстве случаев — атеросклероз (15 случаев). Соотношение мужчин и женщин было выше у пациентов с окклюзией дистальных сосудов, и краткосрочный результат был хуже.Только два пациента из этой серии подверглись реваскуляризации. Спонтанная реканализация наблюдалась в одном случае. Выводы . Наиболее частой причиной CCAO был атеросклероз. При открытых дистальных сосудах исход улучшается, возможна спонтанная реканализация. Методы лечения не стандартизированы. Хирургическая реваскуляризация возможна при открытых дистальных сосудах, но показания к ней спорны.
1. Введение
Окклюзия общей сонной артерии (ОСА) — редкая причина цереброваскулярных событий.Распространенность у пациентов с инсультом составляет примерно 0,24–5% [1–6].
В отличие от большого количества данных в литературе об окклюзии внутренней сонной артерии, имеется мало информации о заболеваемости, клинических проявлениях, результатах ультразвукового исследования, гемодинамике, причинах и лечении окклюзии общей сонной артерии (CCAO).
Окклюзия ОСА обычно связана с окклюзией дистальных сосудов (внутренней сонной артерии (ВСА) и наружной сонной артерии (ВСА)).В некоторых случаях кровоток в ВСА и НСА поддерживается за счет коллатерального кровообращения через экстракраниальные ветви через ретроградную наружную сонную артерию. Распознавание проходимости дистальных сосудов важно, потому что это может позволить провести эффективную хирургическую реваскуляризацию [5].
Ультразвуковая допплерография — важный инструмент в диагностике CCAO.
Целью этого исследования было обсуждение клинических данных, ультразвуковых характеристик, возможных механизмов и возможностей лечения окклюзии общей сонной артерии.
2. Объекты и методы
Мы проанализировали 5000 дуплексных записей УЗИ сосудов головного мозга, выполненных в течение 5-летнего периода с 2008 по 2012 год у пациентов, которые были обследованы в Ультразвуковой лаборатории неврологической клиники I Клинической больницы скорой помощи округа Муреш. Обследования проводились с использованием ультразвуковой системы Siemens Acuson Antares (линейный датчик VFX13–5 МГц, транскраниальный датчик PX4–1 МГц, карандашный доплеровский датчик CW5). В сомнительных случаях результаты ультразвукового исследования подтверждались ангиографией или КТ-ангиографией.
Дуплексные критерии окклюзии сонной артерии включали повышенную эхогенность по ходу сосуда, отсутствие пульсации в поперечном сечении и отсутствие сигнала потока [2].
У 160 из 5000 (3,2%) пациентов с цереброваскулярным заболеванием, направленных на сонографию сонных артерий, была окклюзия сонной артерии. Из этих пациентов у 20 (0,4%) была окклюзия ОСА или окклюзия ОСА, связанная с окклюзией ВСА. История болезни, факторы риска и клинические характеристики этих случаев были получены из архивных медицинских записей.
Во всех случаях мы попытались определить возможные причины CCAO на основе истории болезни, клинических данных, результатов ультразвукового исследования и лабораторных исследований. Подозрение на атеросклеротическую этиологию возникало, когда у пациента присутствовали факторы риска развития сосудов, а результаты ультразвукового исследования сосудов указывали на атеросклероз (например, атеросклеротические изменения стенки сосуда в экстракраниальных артериях и ОСА, заполненные гетерогенным или гиперэхогенным атеротромботическим материалом).Артериит Такаясу можно было заподозрить, если пациент соответствовал диагностическим критериям Американского колледжа ревматологии 1990 г. [7]. Пострадиационная артериопатия диагностировалась, если пациенты обращались за лучевой терапией в области шеи в анамнезе из-за злокачественного новообразования. Эмболия сердца подозревалась, если у пациентов была сердечная аритмия или другое сердечное заболевание с высоким риском эмболии без признаков атеросклероза. Первичная или вторичная гиперкоагуляция подозревалась у молодых пациентов с окклюзией ОСА без признаков атеросклероза или эмболической болезни сердца, которые не соответствовали критериям артериита Такаясу, не подвергались облучению в области шеи и имели другие тромботические события.В случае окклюзии кардиоэмболического происхождения или тромбоза in situ просвет сосуда заполняется гипоэхогенным тромботическим материалом.
Считалось, что пациенты имели бессимптомную окклюзию общей сонной артерии, если не было сообщений о симптомах или признаках, связанных с сосудистыми событиями в области окклюзии ОСА. Симптоматическая CCAO была определена как возникновение по крайней мере одной транзиторной ишемической атаки (TIA) или инсульта, связанного с кровообращением сонной артерии на той же стороне, вызвавшей ультразвуковое исследование, которое не показало проходимости соответствующей CCA [8].
Большой инсульт определялся как комбинация нарушения сознания и по крайней мере двух из следующих неврологических признаков: сопряженное отклонение, гомонимная гемианопсия, афазия и гемиплегия. Остальные события считались незначительными инсультами [2].
Тяжесть у пациентов с острым инсультом оценивалась с использованием шкалы инсульта Национального института здравоохранения (NIHSS) [9], а краткосрочные исходы инсульта — по шкале результатов Глазго (GOS) (1 — умер, 2 — вегетативное состояние, 3 — инвалидность в тяжелой форме, 4 — инвалидность средней степени и 5 — хорошее восстановление) [10].
3. Результаты
20 случаев окклюзии ОСА составили 0,4% от всех пациентов с цереброваскулярной патологией, которым проводилось цервико-церебральное дуплексное ультразвуковое исследование.
В таблице 1 приведены демографические характеристики, факторы риска и показания к ультразвуковому обследованию. Средний возраст пациентов с ХКАО составлял лет (мин. 26, макс. 86), а соотношение мужчин и женщин составляло 2,33. Наиболее частыми факторами риска были артериальная гипертензия, ишемическая болезнь сердца, дислипидемия, сахарный диабет и курение.Показанием к ультразвуковому обследованию в большинстве случаев был острый инсульт или постинсультное состояние.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сокращения: ТИА: транзиторная ишемическая атака; HT: гипертензия, DL: дислипидемия; ИБС: ишемическая болезнь сердца; СД: сахарный диабет; PVD: заболевание периферических сосудов; ФП: фибрилляция предсердий. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Диагноз ХКАО установлен на основании ультразвукового (УЗИ) исследования. Результаты УЗИ были подтверждены КТ-ангиографией в 2 случаях и цифровой субтракционной ангиографией (DSA) в 3 случаях.
Правая и левая стороны ОСА были окклюзированы в 65% (13/20) и 30% (6/20) случаев соответственно, а ОСА была окклюзирована с двух сторон в одном случае (5%).
Патентная бифуркация выявлена в 10 случаях ХКАО (50%). В 9 из этих случаев антероградный поток в ВСА поддерживался из наружной сонной артерии с обратным направлением потока (рис. 1). В одном случае и ВСА, и НСА имели антероградный кровоток, и направление потока было обратным только в первой ветви НСА (верхняя щитовидная артерия).Этот высокий ретроградный поток питал как ECA, так и ICA. Интересно, что ECA оказывает неполное влияние на ВСА (замедление и кратковременный отрицательный поток в мезосистолии на спектральной форме волны ВСА) (рис. 2).
Окклюзированная ОСА была гипопластической в двух случаях (рис. 4).
В 9 случаях наблюдался тяжелый стеноз или окклюзия контралатеральной ОСА или ВСА, а в 3 случаях — феномен подключичного обкрадывания или тяжелый стеноз позвоночной артерии.На рисунке 3 показаны ультразвуковые изменения в случае множественной сосудистой патологии шейки матки, включая окклюзию ПКР с открытыми дистальными сосудами, феномен обкрадывания правой подключичной кости и значительный стеноз LICA (рисунок 3).
Окклюзия ОСА была симптоматической (по крайней мере, одна транзиторная ишемическая атака или инсульт, связанные с кровообращением сонной артерии ипсилатеральной окклюзии ОСА) в 9 случаях и бессимптомной (нет сообщений о симптомах или признаках, связанных с сосудистыми событиями в области окклюзии ОСА. ) в 11 случаях.В группе с симптомами 6 случаев были представлены малым инсультом или ТИА, а 3 случая — тяжелым инсультом. В бессимптомной группе у 4 пациентов не было ишемического инсульта артериального происхождения, но у них была неспецифическая симптоматика, такая как головокружение (2 случая), или CCAO был случайным обнаружением во время обычного ультразвукового исследования для других церебральных патологий (случай 13 представили аневризматическое субарахноидальное кровоизлияние и случай 20 представили тромбоз глубоких вен головного мозга) (Таблица 1).В общей сложности 7 пациентов в бессимптомной группе поступили с инсультами, которые затронули полушарие головного мозга, противоположное CCAO (4 малых инсульта, 3 больших инсульта).
В 15 случаях этиология ХКАО была атеросклерозом. Один пациент соответствовал диагностическим критериям Американского колледжа ревматологии 1990 г. [7] для артериита Такаясу, один случай в истории болезни был представлен с облучением шеи по поводу рака гортани, один случай имел вероятную этиологию кардиоэмболии (пароксизмальная фибрилляция предсердий), а 2 случая имели гиперкоагуляция (случай 10 развился CCAO после хирургического вмешательства по удалению свободно плавающего тромба из правой луковицы сонной артерии, и обнаружение CCAO было случайным в случае 20 с тромбозом глубоких вен головного мозга).
Не было существенной разницы между пациентами с прорезанными дистальными сосудами и окклюзированными дистальными сосудами в отношении возраста и факторов риска сосудов. У пациентов с окклюзией дистальных сосудов систолическое артериальное давление было значительно выше, индекс NIHSS был значительно выше, а GOS был значительно ниже (таблица 2). Соотношение мужчин и женщин было выше у пациентов с закупоркой дистальных сосудов. Сосуды
| ||||||||||||||||||||||||||||||||||
| Сокращения: SBP: систолическое артериальное давление; ДАД: диастолическое артериальное давление; NIHSS: шкала инсульта Национального института здравоохранения; GOS: Шкала результатов в Глазго. | ||||||||||||||||||||||||||||||||||
Только два пациента прошли реваскуляризацию. Один пациент умер после вмешательства (развился тяжелый инсульт), а у второго пациента после операции не было симптомов.Спонтанная реканализация окклюзированной ОСА наблюдалась в одном случае.
4. Обсуждение
Клинические проявления окклюзии ОСА варьируются от бессимптомных до тяжелых цереброваскулярных событий. Поскольку бессимптомные случаи диагностируются случайно, фактическая частота окклюзии ОСА неизвестна.
Parthenis et al. сообщили о распространенности CCAO 0,54% и 2,8% ICAO на основании большой ультразвуковой базы данных, содержащей 6415 случаев [11]. Chang сообщил о распространенности CCAO и 2.5% ИКАО [2]. Другие авторы сообщают о распространенности от 1 до 5% у пациентов с инсультом [2, 12–14]. Эти результаты согласуются с данными этого исследования (распространенность окклюзии ВСА 3,2% и окклюзии ОСА 0,4%).
Механизмы тромботических процессов могут различаться в зависимости от этиологии. У пациентов с атеросклеротической окклюзией тромбоз может быть ретроградным, поскольку атеросклероз чаще всего поражает бифуркацию сонной артерии. У пациентов с артериитом Такаясу тромботический процесс может быть антероградным, с более частым поражением дуги аорты, подключичных артерий и брахиоцефального ствола.
Окклюзию ОСА можно классифицировать на основании проходимости дистальных сосудов. При окклюзии I типа наблюдается полная окклюзия как ОСА, так и ВСА. При окклюзии II типа дистальные сосуды проходимы [15]. При окклюзии I типа ишемические явления возникают чаще, что свидетельствует о гемодинамической этиологии. При окклюзии II типа ВСА снабжается коллатеральным током крови через экстракраниальные ветви через ретроградную наружную сонную артерию. В этих случаях ишемические события вызваны эмболиями артерий-артерий [6, 15, 16].
Парфенис и др. [11] предложили следующие подробные классификации: Тип I: изолированные CCAO с открытыми дистальными сосудами; Тип Ia: направление потока от ECA к ICA; Тип Ib: направление потока от ICA к ECA; Типы II и III: изолированная проходимость НСА и ВСА; и Тип IV: одновременная окклюзия обоих дистальных сосудов. Согласно этой классификации, большинство случаев в этом исследовании можно разделить на Тип Ia и Тип IV. В этом исследовании мы не выявили случаев с проходимостью открытых дистальных сосудов с направлением потока от ВСА к НСА или случаев с изолированной проходимостью ВСА или НСА.
В нашей серии преобладание самцов () было очевидным, что соответствует литературным данным [2, 4, 13, 14, 17]. Напротив, в нашей серии исследований чаще поражалась правосторонняя ВСА (65% случаев). Chang et al. и предыдущие исследования показали более высокую распространенность левостороннего поражения [2, 12, 13, 17]. Parthenis et al. сообщили о равном распределении между правой и левой сторонами [11]. Двусторонняя окклюзия ОСА встречается редко и в первую очередь сообщается в случаях артериита Такаясу и в редких случаях у пациентов с атеросклерозом [18, 19].Пациент 86 лет, участвовавший в нашем исследовании с двусторонней окклюзией и распространенным атеросклерозом без очаговых неврологических признаков, был обследован с помощью ультразвука на предмет неспецифического головокружения.
Профиль факторов риска не отличался от ранее опубликованных данных. Chang et al. и Коллис и др. сообщили о высокой распространенности гипертонии и болезней сердца [2, 13]. В нашей группе пациентов распространенность артериальной гипертензии составила 90%, а распространенность ишемической болезни сердца — 75%.
В большинстве опубликованных серий случаев основной причиной ХКАО является атеросклероз [1, 2, 6].Сообщалось о более высокой распространенности артериита Такаясу среди азиатского населения [18]. К более редким причинам относятся пострадиационная артериопатия, эмболия сердца, расслоение дуги аорты и ОСА, аневризма дуги аорты, гиперкоагуляция, фиброзно-мышечная дисплазия и черепно-шейный травматизм [2, 20]. В большинстве наших случаев (75%) этиология ОСА — атеросклероз.
В литературе нет данных, касающихся гипоплазии ОСА как предрасполагающего фактора к окклюзии. Два корпуса из нашей серии представлены диаметром ОСА менее 4 мм.
При ХКАО перфузия ипсилатерального полушария головного мозга обеспечивается за счет коллатерального кровообращения. Экстракраниальные коллатеральные сосуды ретроградно заполняют НСА и поддерживают антероградный кровоток в ВСА. Экстракраниальный коллатеральный поток исходит из ипсилатеральной подключичной артерии через реберно-шейный или тироцервикальный ствол и позвоночную артерию и, в меньшей степени, из контралатеральной НСА через верхнюю щитовидную железу и язычные, лицевые и затылочные ветви [6, 11, 20] .Поток поддерживается внутричерепно через Виллизиев круг через переднюю и заднюю соединительные артерии. Мы не нашли данных, подобных нашему случаю (рис. 2), в литературе, где и ВСА, и НСА имели антероградный поток и подавались через главную ветвь НСА с ретроградным потоком.
В общей сложности 16 пациентов в нашей серии поступили с цереброваскулярным событием, 6 малыми инсультами или ТИА и 3 крупными инсультами, поражающими ипсилатеральное полушарие, и 4 малыми инсультами или ТИА, и 3 большими инсультами, поражающими контралатеральное полушарие головного мозга.В серии случаев, проведенных Chang et al., Инсульт был более распространен, чем ТИА, и большинство инсультов были серьезными. В других сериях случаев сообщалось о более частых ТИА [4, 14, 17, 20]. Parthenis et al. сообщили о частых симптомах, связанных с положением. В некоторых случаях ТИА поражали контралатеральное полушарие по отношению к CCAO.
Подобно нашим результатам, в большинстве серий случаев сообщалось о более легких неврологических симптомах и более благоприятных исходах у пациентов с открытыми дистальными сосудами. Зборникова и Лассвик опубликовали серию из 21 пациента с ХКАО и обнаружили 12 случаев бифуркации патента.В 10 случаях поток поддерживался от ECA к ICA, а направление потока было противоположным (от ICA к ECA) в остальных 2 случаях. Хотя у большинства пациентов с явной бифуркацией наблюдались приступы амавроза и головокружения, ни у одного из пациентов с открытыми дистальными сосудами и хорошо функционирующими внутричерепными коллатералями не было серьезного инсульта. Напротив, у 50% пациентов с закупоренными дистальными сосудами развился обширный инсульт [21].
Артериография остается золотым стандартом для точной диагностики стенококклюзионной болезни сонной артерии.Однако неинвазивная дуплексная сонография, КТ-ангиография и МР-ангиография частично заменили артериографию в повседневной клинической практике. Точность дуплексной сонографии должна быть намного выше при диагностике CCAO по сравнению с окклюзией ICA из-за доступности CCA [2]. Артериография имеет несколько ограничений в случаях полностью окклюзированной ОСА из-за неадекватной концентрации контрастного вещества, переменного коллатерального кровообращения, минимального кровотока в дистальных ветвях и плохих изображений с задержкой [2, 11].В серии случаев, описанных Parthenis et al., Ультразвуковое доплеровское исследование показало по крайней мере 1 открытый дистальный сосуд в 29 из 35 случаев, а артериография не смогла продемонстрировать проходимость дистальных сосудов у 19 пациентов [11]. Цветной допплер с низкой частотой повторения импульсов позволяет легко идентифицировать состояния низкого кровотока в сосудах дистальнее окклюзированной ОСА [2, 5, 6, 11, 22]. Ультрасонографические особенности внутрипросветного тромботического материала позволяют нам сделать выводы относительно этиологии окклюзии и, в некоторых случаях, возраста окклюзии.
Большинство клиницистов пришли к выводу, что дуплексное исследование цветового потока является отличительным признаком выявления патологической ВСА, несмотря на окклюзию ОСА [23].
В литературе описано несколько очень редких случаев спонтанной реканализации окклюзированной ОСА. Контрольное ультразвуковое исследование полезно для оценки реканализации [24]. Shah сообщил о случае CCAO со спонтанной реканализацией и последующей эмболической окклюзией средней мозговой артерии [25].
В литературе мало данных о различных стратегиях лечения ХККА.Успешная реваскуляризация зависит от состояния дистальных ветвей. В результате, определение проходимости ICA и ECA имеет важное значение до вмешательства. Несколько небольших серий, описанных в литературе, показали отличные результаты реваскуляризации в облегчении симптомов церебральной ишемии.
Martin et al. сообщили о серии из 8 случаев CCAO, которые лечились хирургическим путем (шунтирование подкожной вены к бифуркации сонной артерии, внутренней или внешней сонной артерии).В этом исследовании были установлены следующие показания к хирургическому лечению: ипсилатеральная ТИА, недавний недействующий полушарный инсульт и преходящие внеполушарные мозговые симптомы или профилактическая реваскуляризация перед серьезными хирургическими вмешательствами (плановая операция на аорте). Периоперационных инсультов, окклюзий или летальных исходов не было [26]. Естественное течение CCAO с патентом ICA в бессимптомных случаях неизвестно [22]. Хирургические вмешательства представляют собой обходные процедуры (подключичная к ОСА, подключичная к ВСА, подключичная к ОСА, подмышечная к ОСА или трансплантат восходящей бифуркации аорты к ОСА) или эндартерэктомия [2].
Pintér et al. сообщил о пациенте с окклюзией ОСА, которому было проведено гибридное лечение, состоящее из эндартерэктомии и стентирования [27]. Эверсионная бифуркационная эндартерэктомия сонной артерии была выполнена с помощью ретроградной эндартерэктомии общей сонной артерии с флюороскопическим контролем и стентированием остаточного стеноза дисоблитерированной артерии.
Sharma et al. сообщили о 3 случаях тромботической окклюзии ОСА, связанной с острым ишемическим инсультом из-за тандемной окклюзии внутричерепных артерий, которые лечились внутривенным тканевым активатором плазминогена.В 2 из 3 случаев отмечалось раннее неврологическое улучшение [28].
Поскольку не существует отдельных научно обоснованных рекомендаций по атеросклеротической окклюзии ОСА, общие рекомендации по ведению пациентов с атеросклеротической окклюзией сонной артерии (включая атеросклеротические ОСАО) применимы в этих редких случаях. Пациенты с острым ишемическим инсультом из-за атеросклеротической окклюзии сонной артерии (ACAO) должны получать внутривенный тканевый активатор плазминогена, если они соответствуют критериям отбора.Пациенты, которые не подходят для внутривенного введения тканевого активатора плазминогена, должны получать аспирин, поскольку гепарин и гепариноподобные препараты не улучшают исход. Терапия для предотвращения повторного инсульта у пациентов с АКАО должна состоять из изменения образа жизни, вмешательства факторов риска и приема антиагрегантов. Варфарин не показан, а эффективность хирургических или эндоваскулярных процедур в лечении или профилактике инсульта, вызванного ACAO, не доказана. Бессимптомная окклюзия сонной артерии имеет благоприятный прогноз и не требует специального лечения, кроме изменения образа жизни и вмешательства факторов риска [29].
5. Выводы
Наиболее частой причиной ХКАО является атеросклероз. Дуплексная сонография — важный неинвазивный и надежный метод диагностики окклюзии ОСА и определения проходимости дистальных сосудов. Результат улучшается в случае проходимости дистальных сосудов. В редких случаях возможна самопроизвольная реканализация. Из-за низкой заболеваемости CCAO методы лечения не стандартизированы. При открытых дистальных сосудах возможна хирургическая реваскуляризация, но показания к операции остаются спорными.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Пять фактов о стенозе сонной артерии, которые следует знать
Инсульт является третьей по значимости причиной смерти в Америке, а стеноз сонной артерии, также известный как заболевание сонной артерии, является одним из основных факторов риска инсульта, на который приходится около 20 процентов инсультов.
В мае, чтобы отметить Национальный месяц инсульта, мы попросили нейрохирурга и нейроинтеролога из Университета Миннесоты Рамачандру Туммалу рассказать нам пять вещей, которые мы должны знать о стенозе сонной артерии и его связи с риском инсульта.
Стеноз сонной артерии возникает, когда нарост начинает блокировать кровоток.
Стеноз — это медицинский термин, обозначающий сужение кровеносных сосудов в организме из-за накопления воспалительных веществ и отложений холестерина, называемых бляшками. Две сонные артерии на шее несут большую часть кровотока от сердца к мозгу. Стеноз этих артерий известен как стеноз сонной артерии.
Стеноз сонной артерии может привести к инсульту.
Пациенты со стенозом сонной артерии имеют повышенный риск инсульта, который может привести к инвалидности или смерти.Иногда инсульт бывает легким и излечимым. В других случаях инсульты бывают очень большими и разрушительными. Стеноз сонной артерии может вызвать инсульт двумя способами. Часто бляшки, застрявшие в сонных артериях, отделяются и попадают в кровеносные сосуды головного мозга, где блокируют кровоток. Мы называем это эмболией. Другой менее распространенной причиной является то, что закупорка сонной артерии становится настолько серьезной, что фактически замедляет приток крови к мозгу.
Узнайте больше о лечении инсульта в Университете Миннесоты.
Стеноз сонной артерии может быть признаком более серьезной проблемы.
Если есть закупорка сонных артерий, скорее всего, у пациента накопилось скопление в других артериях по всему телу. Определенные факторы риска, такие как высокое кровяное давление, диабет, курение, ожирение, нездоровое питание и малоподвижный образ жизни, могут подвергать пациентов большему риску стеноза сонной артерии. Мы называем эти изменяемые факторы риска, потому что это факторы, которые человек может частично или полностью контролировать.Другие факторы риска включают возраст, семейный анамнез и генетику. Мы называем эти факторы риска неизменными. В целом, риск сердечного приступа и риск инсульта во многом следуют друг за другом. Правильная работа с сердцем может помочь снизить стеноз сонной артерии и, следовательно, риск инсульта.
Чем вы старше, тем выше риск.
Накопление зубного налета происходит у каждого взрослого. Но не все скопления бляшек ограничивают кровоток по кровеносным сосудам или вызывают эмболию. Чем вы старше, тем выше риск накопления.У мужчин больше шансов накапливать зубной налет, чем у женщин.
Существует два типа стеноза сонной артерии: симптоматический и бессимптомный. Первое более важно, потому что существует более высокий риск инсульта. Бессимптомное сужение снижает риск инсульта. Иногда стеноз может быть обнаружен врачом до появления симптомов. Пациенты могут испытывать симптомы, похожие на инсульт, например, временную ишемическую атаку (иногда называемую мини-инсультом). Эти симптомы могут включать внезапное онемение; проблемы с речью или зрением, головокружение, слабость с одной стороны тела, слабость с одной стороны лица или сильная головная боль.
Лечение включает медицинское вмешательство или, возможно, операцию.
Лечение подбирается индивидуально в зависимости от наличия у пациента симптомов, степени тяжести стеноза, возраста и истории болезни. Другая более серьезная проблема со здоровьем, такая как рак легких, также может повлиять на подход к лечению. Например, бессимптомный стеноз сонной артерии может не быть приоритетом, если у пациента есть серьезные проблемы со здоровьем, такие как активный рак или сердечная недостаточность.
Исходя из этих факторов, существует три возможных способа лечения болезни:
- Медицинское лечение, которое может включать в себя положительные изменения образа жизни и другие модификации для снижения риска.Эти модификации могут включать лекарства, такие как аспирин, лекарства, снижающие артериальное давление, и агенты, снижающие уровень холестерина.
- Каротидная эндартерэктомия — профилактическая операция по удалению бляшек с внутренней стороны сонной артерии. Эта операция подвергалась тщательной оценке в течение последних 60 лет и является очень эффективным методом снижения риска инсульта у некоторых пациентов, особенно с симптоматическим тяжелым стенозом.
- Установка каротидного стента, менее инвазивная процедура, которая включает в себя установку небольшого расширяемого стента в сонную артерию для улучшения кровотока.
