Прогестерон
Прогестерон — гормон беременности. Прогестерон секретирует желтое тело (железа, образующаяся в яичнике после овуляции — выхода яйцеклетки из фолликула). Если зачатие не произошло, желтое тело гибнет через 12-14 дней и начинается менструация. Желтое тело вырабатывает гормон прогестерон до 16 недели беременности — до тех пор, пока сформированная плацента не возьмет на себя самостоятельную выработку гормонов. Прогестерон подготавливает ткани матки к имплантации оплодотворенной яйцеклетки и сохранению беременности. Прогестерон влияет на нервную систему, как бы подготавливая организм к вынашиванию беременности и родам. Прогестерон подавляет активность сокращения мускулатуры матки и реакцию отторжения плодного яйца, стимулирует рост матки. Оказывает влияние прогестерон и на развитие тех отделов молочных желез, которые отвечают за выработку молока. Кроме того, прогестерон стимулирует выработку кожного сала.
Прогестерон вырабатывается не только в яичниках, некоторое количество прогестерона вырабатывают надпочечники, поэтому прогестерон одновременно и женский гормон, и мужской, хотя и значительно ниже нормы прогестерона у женщин.
Анализ прогестерона — незаменимый метод исследования овуляции. Его уровень в организме женщины колеблется в зависимости от фазы менструального цикла. В норме прогестерон перед овуляцией повышается в 10 раз. Если повышения его уровня не происходит, значит возможны различные отклонения в организме женщины.
Во время беременности наблюдается постепенное повышение уровня прогестерона между 9 и 32 неделями и часто в 100 раз превышает уровень до начала беременности. Концентрация прогестерона выше в случае многоплодной беременности, по сравнению с одноплодной. Нехватка прогестерона во время беременности может приводить к ее прерыванию. Поэтому анализ прогестерона — необходимый этап в диагностике состояние плода во второй половине беременности.
Если прогестерон повышен, для врача этот результат анализа крови дает основания предполагать беременность, дисфункциональные маточные кровотечения, нарушения менструального цикла (аменорея), отклонения в развитии плаценты, кисту желтого тела, почечную недостаточность, отклонения в образовании гормонов в надпочечниках. Повышенный уровень прогестерона может быть следствием приема некоторых медицинских препаратов.
Повышенный уровень прогестерона может быть следствием приема некоторых медицинских препаратов.
Недостаток прогестерона может быть симптомом следующих отклонений в организме женщины: отсутствие овуляции, недостаточная функция желтого тела или плаценты, угрожающий аборт как следствие гормонального дисбаланса, задержка внутриутробного развития плода, истинное перенашивание беременности, хронические воспалительные заболевания женской половой сферы, маточные кровотечения, нарушения менструального цикла (аменорея). Низкий прогестерон может быть следствием приема некоторых лекарственных препаратов.
Обычно врачи советуют женщинам сдавать кровь на анализ прогестерона на 19-21 день менструального цикла. Между последним приемом пищи и взятием крови u1076 должно пройти не менее 8 часов. Если у Вас регулярный менструальный цикл, то уровень прогестерона определяют за неделю до менструации, при нерегулярном цикле — несколько раз. Мужчинам анализ на прогестерон можно сдавать в любой день.
Прогестерон (Progesterone)
Прогестерон (Progesterone)
Прогестерон – это стероидный гормон, основной функцией которого является подготовка организма женщины к беременности. Он вырабатывается жёлтым телом яичников. Каждый месяц эстроген заставляет внутренний выстилающий слой матки – эндометрий – расти и обновляться, в то время как лютеинизирующий гормон (ЛГ) способствует высвобождению яйцеклетки в одном из яичников. На месте высвободившейся яйцеклетки образуется так называемое жёлтое тело, которое вырабатывает прогестерон. Прогестерон вместе с гормоном, выделяемым надпочечниками, останавливает рост эндометрия и подготавливает матку к возможной имплантации оплодотворенной яйцеклетки. Если оплодотворения не происходит, желтое тело исчезает, уровень прогестерона падает и наступает менструальное кровотечение. Если же оплодотворенная яйцеклетка прикрепляется к стенке матки, желтое тело продолжает производить прогестерон.
Подготовка к исследованию
Исследование проводится утром, натощак. С последнего приема пищи должно пройти не менее 8 часов. Анализ делается на 22-23 день менструального цикла, если другие сроки не указаны лечащим врачом.
Показания к исследованию
При выяснении, нормально ли протекает овуляция (иногда дважды в течение менструального цикла).
При стимулировании овуляции.
При введении прогестерона во время беременности.
Периодически при беременности с повышенным риском ее прерывания для контроля за состоянием плода и плаценты.
Когда у небеременной пациентки маточные кровотечения.

Интерпретация
Референсные значения : еденица измерения нмоль/л.
|
Фаза |
норма |
|
Фоликулярная фаза |
1.0-3.8 |
|
Лютеиновая фаза |
2.3-56.6 |
|
постменопауза |
< 3.2 |
|
Бер.,I триместр |
29. |
|
Бер.,II триместр |
93.8-159 |
|
Бер.,III триместр |
264-509 |
|
Общая норма |
0.86-2.9 |
Причины повышенного уровня прогестерона:
киста яичников, патологическая беременность, а также пузырный занос или хорионкарцинома,
редкие формы опухолей яичников, врождённая гиперплазия надпочечников.
Причины пониженного уровня прогестерона:
токсикоз на поздних сроках беременности, пониженная функциональная активность яичников,
отсутствие менструаций, внематочная беременность, угроза выкидыша.
На результаты могут влиять
На результат может влиять: приём пищевых добавок и фармацевтических препаратов, меняющих концентрацию эстрадиола и прогестерона. Уровень прогестерона будет более высоким, если женщина беременна несколькими плодами (двойняшками, тройняшками), а не одним.
Назначается в комплексе с
Фолликулостимулирующий гормон (ФСГ)
Лютеинизирующий гормон (ЛГ)
Бета-субъединица хорионического гонадотропина человека (бета-ХГЧ)
Тиреотропный гормон (ТТГ)
Тироксин свободный (Т4 свободный)
Повышен прогестерон в лютеиновой фазе: причины и способы нормализации
Прогестерон – это гормон, главными функциями которого являются подготовка женского организма к зачатию и обеспечение нормального протекания беременности. Его концентрация зависит от этапа менструального цикла. Повышенный уровень вещества в лютеиновой фазе, которая длится с момента овуляции до начала месячных, наблюдается при наступившей беременности. Если зачатия не произошло, а показатели превышают норму, это может говорить о патологиях.
Если зачатия не произошло, а показатели превышают норму, это может говорить о патологиях.
Какими должны быть показатели уровня прогестерона в норме?
Концентрация гормона зависит от фазы менструального цикла и возраста женщины. Вещество вырабатывается надпочечниками и яичниками. С наступлением лютеиновой фазы его уровень резко повышается. После выхода яйцеклетки из фолликула образуется желтое тело – временная железа, также синтезирующая прогестерон. Его повышенная концентрация в этот период менструального цикла способствует подготовке эндометрия матки к имплантации эмбриона.
Пик уровня гормона приходится на 20–23 день цикла. Анализ на прогестерон обычно назначают именно в этот период лютеиновой фазы. Если оплодотворения не произошло, желтое тело регрессирует, концентрация прогестерона падает. При наступлении беременности временная железа продолжает синтез вещества до 16 недели, после чего эту функцию берет на себя плацента.
Уровень гормона определяется с помощью исследования крови из вены. В таблице представлены его нормы по возрасту и фазам цикла:
В таблице представлены его нормы по возрасту и фазам цикла:
| Возраст/Фаза цикла/Срок беременности | Минимальный уровень прогестерона, нмоль/л | Максимальный уровень прогестерона, нмоль/л | |
| Девочки | |||
| Возраст | 0–9 лет | 0 | 1,1 |
| 9–13 лет | 0 | 1,8 | |
| 13–18 лет | 0,3 | 30,4 | |
| Женщины | |||
| Фаза цикла | Фолликулярная | 0,3 | 2,2 |
| Овуляторная | 0,5 | 9,4 | |
| Лютеиновая | 7,0 | 56,6 | |
| Менопауза | 0 | 2,3 | |
| Беременные | |||
| Срок беременности | 1 триместр | 8,9 | 468,4 |
| 2 триместр | 71,5 | 303,1 | |
| 3 триместр | 88,7 | 771,5 | |
Причины повышенного прогестерона
Избыток прогестерона в лютеиновой фазе может быть связан с наступившей беременностью, причем при многоплодной его уровень выше, чем при одноплодной. Если оплодотворения не произошло, а концентрация гормона повышена, причиной могут быть патологии:
Если оплодотворения не произошло, а концентрация гормона повышена, причиной могут быть патологии:
- опухоли яичников и матки;
- пузырный занос;
- маточное кровотечение;
- печеночная и почечная недостаточность;
- отсутствие месячных в течение полугода и более;
- кисты репродуктивных органов и желтого тела;
- болезни надпочечников.
Какими симптомами сопровождается?
Прогестерон воздействует на многие системы организма. Высокий уровень гормона негативно влияет на работу репродуктивных органов, вызывая нарушение цикла и боли в области малого таза. Грудь становится болезненной и увеличивается в размерах. Нарушается работа пищеварительной системы: появляются вздутие, запоры и диарея. Состояние кожи и волос ухудшается, может происходить резкий набор массы тела.
Со стороны нервной системы возникают такие симптомы, как слабость и утомляемость. Женщина может чувствовать подавленность, замечать снижение внимания и памяти. Нередко появляются головные боли и головокружение.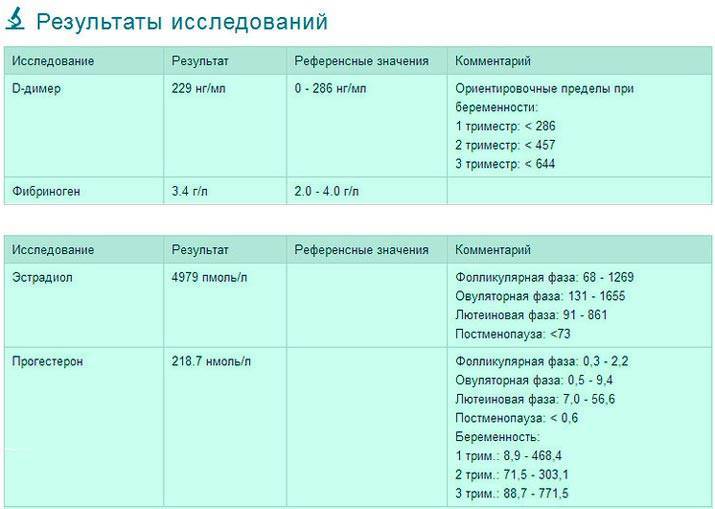
Интенсивность симптомов может варьироваться от слабой до выраженной, иногда симптоматика отсутствует вовсе.
Что делать?
Приступать к лечению необходимо сразу после обнаружения отклонения, поскольку оно может приводить к бесплодию, ожирению, заболеваниям сердца и сосудов, почек, надпочечников. Тактика терапии выбирается в зависимости от причины патологии. Для нормализации гормонального фона применяют оральные контрацептивы и антагонисты прогестерона.
Лечение кист и новообразований, пузырного заноса проводят хирургическим путем. При почечной и печеночной недостаточности требуется соблюдение диеты, прием мочегонных, желчегонных и антибактериальных препаратов, витаминотерапия, при необходимости – гемодиализ. Заболевания надпочечников требуют гормонотерапии, применения глюкокортикоидов и антибиотиков.
youtube.com/embed/-aX6-5fKl8Y?wmode=transparent&autohide=1&controls=1&disablekb=0&showinfo=1&fs=1&iv_load_policy=3&modestbranding=1&rel=0&autoplay=0″ sandbox=»allow-scripts allow-same-origin allow-presentation allow-popups»/>
Врач акушер-гинеколог, репродуктолог, консультант по грудному вскармливанию, окончила ЧГУ им. Ульянова со специализацией гинекология, маммология Подробнее »Поделитесь с друьями!
Репродуктивная функция, гормоны коры надпочечников, тропные гормоны Archives — ДРГ
Два белковых гормона: фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ) совместно регулируют (по механизму отрицательной обратной связи) рост и репродуктивную активность мужских и женских половых желез, в которых идет синтез и секреция стероидных половых гормонов (1, 2). Секреция ФСГ базофильными клетками передней доли гипофиза находится под контролем продуцируемого гипоталамусом гонадотропин-рилизинг-гормона (ГНРФ). Подобно другим гликопротеинам, таким как ЛГ, ТСГ и ХГЧ, ФСГ состоит из двух субъединиц, обозначаемых альфа и бета.
У женщин ФСГ стимулирует рост и созревание фолликулов в яичниках, непосредственно воздействуя на ФСГ-рецепторы гранулярных клеток. В результате в этих клетках запускается стероидогенез, который затем приводит к стимуляции продукции ЛГ. В свою очередь, ЛГ связывается с клетками оболочки и также стимулирует в них стероидогенез. Увеличенная продукция яичниками эстрадиола способствует фактически созреванию фолликул, так как он стимулирует увеличенную активность рецепторов ФСГ и, следовательно, связывание ФСГ фолликулами. Таким образом, ФСГ, ЛГ и эстрадиол тесно взаимодействуют, поддерживая циклическое развитие и созревание яичников у женщин (6, 7 ,9).
Увеличенный уровень ФСГ наблюдается в периоде пост-менопаузы, после кастрации и до наступления половой зрелости, когда яичники еще не развиты. Уровень ФСГ можно нормализовать введением эстрогенов (то есть путем использования их действия по механизму отрицательной обратной связи). При анорексии нервного происхождения и при поликистозном яичнике нормальное взаимодействие между ФСГ и ЛГ, ФСГ и эстрогеном нарушается. На недостаточное функционирование яичников может указывать неожиданно возникающее возрастание уровня ФСГ выше 40 мЕд/мл (8).
Уровень ФСГ можно нормализовать введением эстрогенов (то есть путем использования их действия по механизму отрицательной обратной связи). При анорексии нервного происхождения и при поликистозном яичнике нормальное взаимодействие между ФСГ и ЛГ, ФСГ и эстрогеном нарушается. На недостаточное функционирование яичников может указывать неожиданно возникающее возрастание уровня ФСГ выше 40 мЕд/мл (8).
У мужчин ФСГ регулирует рост семенных канальцев и поддержание сперматогенеза. Однако андрогены, в отличие от эстрогенов, не снижают уровень ФСГ, они действуют по механизму отрицательной обратной связи только на сывороточный уровень ЛГ (10, 11, 12). Не полностью изучены причины увеличения уровня ФСГ при азооспермии и олигоспермии. Радиоиммунные исследования показали, что рак яичка в основном подавляет сывороточную концентрацию ФСГ, но при этом уровень ЛГ увеличен. Было постулировано, что кажущееся увеличение уровня ЛГ может быть вызвано перекрестным взаимодействием с субстанциями, подобными ХГЧ, которые секретируются опухолями яичка (11, 12).
Высокие уровни ФСГ у мужчин обнаруживают при первичной тестикулярной недостаточности и при синдроме Кляйнфельтера. Увеличенные концентрации присутствуют также в случаях голодания, при почечной недостаточности, гипертиреоидизме и циррозе (1, 3).
1. Marshall, J. C.: Clinic in Endocrinol. Metab., 4, 545 (1975).
2. Jeffcoate, S. L.: Clinic. in Endocrinol. Metab. 4, 521 (1975).
3. Cohen, K. L.: Metabolism, 26, 1165 (1977).
4. Shome, B. and Parlow, A. F.: J. Clin. Endocrinol. Metab., 39, 199 (1974).
5. Lundy, L. E., Lee, S. G., Levy, W., et al.: Obstet. Gynecol., 44, 14 (1974).
6. Ross, F. T., Vande Wiele, R. L. and Franty, A. G.: Text of Endocrinol., Chapter 7, Ed.: R. H. Williams, W.B. Saunders, Philadelphia (1981).
7. Speroff, L.: Clinic. Gynecol. Endocrinol. and Infert., Chapter 3, Ed: L. Speroff, R. H. Glass and M. G. Kase, Williams & Wilkins Baltimore (1978).
8. Rebar, R. W., Erickson, G. F. and Yen, S.S.C.: Fertil. Steril., 37, 35 (1982).
9. Catt, K. J. and Pierce, J.G.: Reprod. Endocrinol., Chapter 2, Ed: S.S.C. Yen and R. B. Jaffe, Philadelphia (1978).
Catt, K. J. and Pierce, J.G.: Reprod. Endocrinol., Chapter 2, Ed: S.S.C. Yen and R. B. Jaffe, Philadelphia (1978).
10. Leonard, J. M., Leach, R. B., Couture, M. and Paulsen, C.A.: J. Clinic. Endocrinol., 34, 209 (1972).
11. Reiter, E. O. and Lulin, H. E.: J. Clinic. Endocrinol., 33, 957 (1971).
12. Abraham, G. E., Ed.: Radioassay Systems in Clinic. Endocrinol., Marcel Dekker, Inc., New York (1981).
13. Engvall, E., Methods in Enzymology, Volume 70, VanVunakis, H. and Langone, J.J., (eds.), Academic Press, New York, 419 (1980).
14. Uotila, M., Ruoslahti, E. and Engvall, E., J.Immunol. Methods, 42, 11 (1981).
[quickshop product=»ФСГ, EIA1288″]
Назад к перечню наборов >>>
Повышен ЛГ и ФСГ — значение, последствия. Соотношение ЛГ и ФСГ
Роль гормонов в нашем организме трудно переоценить, так как они регулируют работу практически всех органов. Гормональный фон влияет на поведение, эмоционально состояние, внешний вид, общее здоровье. Особенно сильное воздействие оказывают гормоны на репродуктивную систему человека, отвечая за способность к продолжению рода. Активное участие в регуляции деятельности половой системы принимают гонадотропные гормоны: фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ), поэтому информация об их повышении, понижении или нарушении соотношения поможет устранить серьезные заболевания, а также предупредить их развитие.
Особенно сильное воздействие оказывают гормоны на репродуктивную систему человека, отвечая за способность к продолжению рода. Активное участие в регуляции деятельности половой системы принимают гонадотропные гормоны: фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ), поэтому информация об их повышении, понижении или нарушении соотношения поможет устранить серьезные заболевания, а также предупредить их развитие.
ФСГ и ЛГ: роль в организме
Существует несколько уровней гормональной регуляции функционирования половой системы: гипоталамус, гипофиз и непосредственно яичники и яички. ФСГ и ЛГ – это гипофизарные гормоны, вырабатывающиеся центральной эндокринной железой, секретирование которых зависит от либеринов и статинов гипоталамуса.
Фолликулостимулирующий — отвечает за формирование половых гамет, принимая активное участие в оогенезе и сперматогенезе. ФСГ способствует появлению доминантного фолликула, обеспечивает рост его оболочки и синтез эстрогенов, тестостерона, а также увеличивает восприимчивость клеток половых органов к ЛГ. Лютеинизирующий — влияет на развитие половых органов, а также синтез тестостерона и эстрогенов. Повышенный уровень ЛГ и высокий ФСГ у женщин в овуляторной фазе способствует выходу яйцеклетки из фолликула, ЛГ также отвечает за формирование желтого тела и продукцию прогестерона.
Лютеинизирующий — влияет на развитие половых органов, а также синтез тестостерона и эстрогенов. Повышенный уровень ЛГ и высокий ФСГ у женщин в овуляторной фазе способствует выходу яйцеклетки из фолликула, ЛГ также отвечает за формирование желтого тела и продукцию прогестерона.
Соотношение ЛГ и ФСГ и фазы менструального цикла
Репродуктивная функция половых органов находится в прямой зависимости от гормонов гипофиза. Нормальное соотношение ФСГ и ЛГ является основным условием для развития полноценной яйцеклетки и сперматозоида, появления овуляции и желтого тела у женщин. Без этих процессов невозможно наступление беременности.
В норме после рождения фиксируют высокий уровень ФСГ и ЛГ, которые постепенно снижаются, увеличение концентрации гормонов регистрируется с 8-9 лет до полового созревания, в этот период они способствуют формированию вторичных половых признаков и обеспечивают правильное развитие половых органов. После наступления полового созревания у мальчиков концентрация гормонов стабилизируется и сохраняется примерно на одном уровне, обеспечивая необходимые условия для формирования сперматозоидов. Но показатели гормонов в женском организме подвержены колебаниям в течение всей жизни, а также на протяжении менструального цикла, который делится на определенные фазы.
Но показатели гормонов в женском организме подвержены колебаниям в течение всей жизни, а также на протяжении менструального цикла, который делится на определенные фазы.
В фолликулярной фазе цикла отмечают постепенное повышение ФСГ (его уровень составляет 3,5-12,5 мМЕ/мл), который обеспечивает созревание доминантного фолликула и синтез эстрогенов. Концентрация ЛГ в крови равна 1,8-2,7 мМЕ/мл. Как только в клетках накопился достаточный уровень эстрогенов, они выбрасываются в кровь, что подает сигнал в центральные эндокринные железы и возникает резкое увеличение концентрации ЛГ, превышающее первоначальное значение в 10 раз (до 19,5-115 мМЕ/мл). Стоит отметить, что в это время наблюдается высокий уровень ФСГ (4,5-21 мМЕ/мл). Все это способствует выходу яйцеклетки из созревшего фолликула – возникает овуляция и начинается овуляторная фаза, которая длится несколько дней.
Затем начинается лютеиновая фаза. Постепенно уровень ФСГ снижается до 1,5-7,5 мМЕ/мл, так как он не несет большой роли. Концентрация ЛГ также снижается до 0,6-16 мМЕ/мл, но он преобладает над фолликулостимулирующим гормоном, так как в этой фазе он обеспечивает формирование желтого тела, необходимого для подготовки женщины к наступлению будущей беременности: продуцируется прогестерон, создающий оптимальные условия для развития эмбриона. Если эмбрион успешно имплантировался в эндометрий, то функциональность желтого тела поддерживается дальше, но если он отторгнулся или оплодотворения не было, то желтое тело атрофируется, в крови вновь возрастет уровень ФСГ и цикл повторяется вновь.
Концентрация ЛГ также снижается до 0,6-16 мМЕ/мл, но он преобладает над фолликулостимулирующим гормоном, так как в этой фазе он обеспечивает формирование желтого тела, необходимого для подготовки женщины к наступлению будущей беременности: продуцируется прогестерон, создающий оптимальные условия для развития эмбриона. Если эмбрион успешно имплантировался в эндометрий, то функциональность желтого тела поддерживается дальше, но если он отторгнулся или оплодотворения не было, то желтое тело атрофируется, в крови вновь возрастет уровень ФСГ и цикл повторяется вновь.
Повышение ЛГ и ФСГ в различные периоды развития и в фазы менструального цикла, их понижение или изменение соотношения сигнализирует о нарушении работы половой системы и развитии серьезных патологических состояний.
Нормальное соотношение ЛГ и ФСГ
В течение всего менструального цикла концентрация ЛГ и ФСГ меняется, но их соотношение должно составлять от 1,5 до 2 у женщин в репродуктивный период. До наступления полового созревания соотношение гормонов составляет 1, через год после наступления первой менструации оно увеличивается до 1,5.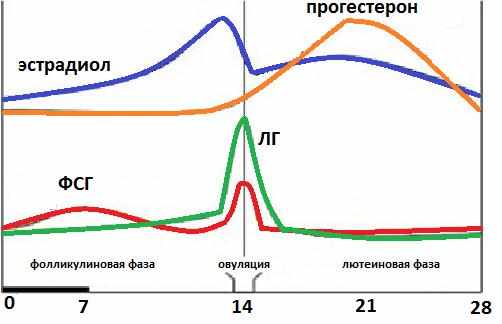 Через 2 года после наступления менархе соотношение стабилизируется, увеличиваясь, но, не превышает 2.
Через 2 года после наступления менархе соотношение стабилизируется, увеличиваясь, но, не превышает 2.
У мужчин ЛГ и ФСГ выполняют не менее важную функцию, но их концентрация после полового созревания более стабильна: ЛГ достигает 0,9-8,8 мМЕ/мл, а ФСГ – 1,1- 11,1 мМЕ/мл. При этом в мужском организме чаще всего незначительно преобладает ФСГ.
Но равновесие должно быть всегда, увеличение одного гормона (например, повышение ФСГ) неизменно приводит к дисбалансу других, что значительно нарушает функционирование половой системы и снижает вероятность наступления беременности. Стоит напомнить, что изменение уровня одного из гормонов всегда сказывается на концентрации других. Поэтому во время диагностики наблюдаются отклонения от нормы практически у всех гормонов; хотя повышение ФСГ или ЛГ при сохранении нормального соотношения не является признаком патологии и свидетельствует о благоприятном состоянии женского организма. По этой причине расшифровывать анализы самостоятельно не рекомендуется, так как адекватно оценить данные может только квалифицированный специалист. Сдать анализы на гормоны и получить их расшифровку можно в «Центр ЭКО» в Калининграде.
Сдать анализы на гормоны и получить их расшифровку можно в «Центр ЭКО» в Калининграде.
Повышение ФСГ
Уровень гормонов зависит от возраста, дня цикла, индивидуальных особенностей и других внешних и внутренних факторов. Все эти признаки учитываются при интерпретации результатов исследований. Отклонения могут быть выявлены в результате лабораторных ошибок, из-за воздействия неблагоприятных факторов или каких-либо заболеваний.
Нарушение равновесия в сторону повышения ФСГ сигнализирует о наступлении патологических состояний. В норме повышение ФСГ наблюдается в период климакса, так как в этот период яичники теряют свою функциональную активность, количество эстрогенов снижается, что приводит к высокому уровню ФСГ.
Но повышение ФСГ в молодом возрасте говорит об эндокринных нарушениях, истощении яичников. Высокий ФСГ чаще всего сопровождается маточными кровотечениями, расстройствами менструального цикла, при этом не исключается полное отсутствие менструации (аменорея). Помимо этого, высокий ФСГ может быть вызван новообразованиями и гинекологическими заболеваниями.
Помимо этого, высокий ФСГ может быть вызван новообразованиями и гинекологическими заболеваниями.
Чем выше уровень фолликулостимулирующего гормона и ниже показатель ЛГ, тем вероятнее всего гиперплазия эндометрия, задержка менструации, ановуляция, маточные кровотечения. При этом стоит отметить, что высокий уровень ФСГ — частая причина бесплодия и невынашивания беременности.
Повышение ФСГ у мужчин свидетельствует о наличии эндокринной патологии, которая неблагоприятно воздействует на процесс сперматогенеза.
Повышение ЛГ
Чаще всего у женщин регистрируются нормальные или пониженные показатели ЛГ. Увеличение уровня ЛГ значительно сокращает вероятность наступления беременности, так как такие показатели говорят о серьезном гормональном дисбалансе, появлении эндометриоза, поликистоза, почечной недостаточности. Высокий уровень ЛГ при низкой концентрации ФСГ приводит к нарушению функции яичников, фолликул не может полноценно созреть, овуляция не наступает, что заканчивается формированием кисты.
Часто повышение ФСГ и ЛГ сигнализирует о наступлении ранней менопаузы, истощении яичников и бесплодии. Поэтому определение уровня этих гормонов является обязательным исследованием при диагностировании бесплодия и проблем с вынашиванием беременности, особенно перед подготовкой к протоколу ЭКО. Хотя пониженные показатели также не являются благоприятными признаками, но такие результаты требуют повторной сдачи анализов, так как гормоны ФСГ и ЛГ поступают в кровь в импульсном режиме, поэтому не всегда исследования могут дать объективную оценку состоянию организма женщины.
В любом случае, получив результаты анализа, следует обратиться к лечащему врачу, чтобы он составил дальнейший план вашего наблюдения, назначил дополнительные методы исследования и при необходимости лечебные мероприятия.
Запишитесь на прием по телефону
+7 (4012) 92-06-76
или
воспользуйтесь формой записи:Роль ФСГ у женщин и мужчин
В организме человека гормоны играют важную роль. Они синтезируются железами внутренней секреции и регулируют все процессы жизнедеятельности индивидуума. Фолликулостимулирующий гормон (ФСГ) продуцируется передней долей гипофиза. Его выработка контролируется гонаторопин – рилизинг-гормоном, который эпизодически выбрасывается в кровь гипофизом. ФСГ в организме женщины отвечает за фолликулогенез, течение беременности, либидо и функцию половых желез.
Какова роль фолликулостимулирующего гормона ФСГ в организме женщины
Уровень ФСГ в крови неодинаков на протяжении жизни. От того, в какой фазе цикла пребывает женщина, зависит концентрация фолликулостимулирующего гормона. Фолликулярная фаза характеризуется развитием в яичниках доминантного фолликула и созреванием яйцеклетки, что и стимулирует фолликулостимулирующий гормон. Он также совместно с лютеинизирующим гормоном (ЛГ) инициирует выработку гормона эстрадиола фолликулами. Тестостерон преобразуется в эстрадиол благодаря действию фолликулостимулирующего гормона.
В середине цикла уровень ФСГ становится максимальным, в это время резко повышается концентрация ЛГ. Фолликул под их воздействием разрывается, и яйцеклетка выходит в брюшную полость. На её месте образуется жёлтое тело, ткань которого в лютеиновую фазу продуцирует в достаточном количестве прогестерон.
Фолликулостимулирующий гормон вырабатывается импульсивно. Уровень ФСГ повышенный в начале овариально-менструального цикла, максимально высокий ФСГ в середине цикла, а после того, как произошла овуляция, концентрация его вновь снижается. Уровень ФСГ превышает фолликулярную фазу лишь накануне менструации. Важно не то, повышен ФСГ или понижен, главное – его соотношение с другими гормонами, например с лютеинизирующим. Его концентрация всегда должна быть ниже ЛГ!
Какую роль играет ФСГ у мужчин
У мужчин ФСГ отвечает за развитие и нормальную работу яичек и семенных канальцев. Он контролирует выработку семенниками сперматозоидов, способствует транспорту тестостерона к придаткам яичка и созреванию мужских половых клеток. Продукция гипофизом фолликулостимулирующего гормона в мужском организме контролируется по принципу обратной связи тестостероном: чем выше уровень последнего, тем становится понижен ФСГ.
Когда надо сдать кровь на ФСГ
Кровь для определения уровня ФСГ у женщин назначают в таких случаях:
- при многократном невынашивании беременности;
- в случае проблем с деторождением;
- при отсутствии овуляции;
- если снижается функция половых желез;
- когда имеются маточные кровотечения;
- при снижении либидо.
Эндометриоз, множественные кисты яичников и хронические воспалительные процессы также служат абсолютным показанием для взятия крови на ФСГ. Уровень ФСГ у мужчин имеет значение для определения причин бесплодия и снижения сперматогенеза. Его следует определять при эректильной дисфункции и снижении либидо, недоразвитии половых органов и изменении типа оволосения.
Какова норма ФСГ
Норма ФСГ у женщины разная в разные периоды её жизни. Так, концентрация ФСГ в фолликулярную фазу в норме от 2,9 до 11,3 МЕ/мл. Во второй фазе обычно понижен ФСГ до 1,2-9; овуляторный пик же находится в пределах от5,8 до 21 МЕ/мл. У женщины в постменопаузе ФСГ повышен (21,7 – 153 МЕ/мл), а у девочек до девятилетнего возраста понижен ФСГ (не более 1,6 МЕ/мл). У мужчин концентрация этого гормона не меняется на протяжении всей жизни. У них норма ФСГ от 0,7 до 11,1 МЕ/мл. Уровень ФСГ при беременности остаётся всё время низким, поскольку в этот период женщине не надо, чтобы развивался фолликул и образовывалась новая яйцеклетка.
Когда определяется низкий уровень ФСГ
Низкий ФСГ может быть в случае:
- гиперпролактинемии;
- поликистозных яичников;
- ожирения;
- патологии гипофизарно-гипоталамической системы;
- аменореи.
Не стоит забывать, что низкий уровень ФСГ определяется на протяжении всей беременности, при приёме анаболиков и голодании. У мужчин при пониженной концентрации фолликулостимулирующего гормона атрофируются яички, возникает эректильная дисфункция, уменьшается количество и ухудшается качество сперматозоидов в эякуляте вплоть до азооспермии. У представителей обоих полов при низком уровне ФСГ снижается либидо, меньше растёт волос на теле и рано появляются морщины.
Когда может иметь место высокий ФСГ
Если у женщины уровень ФСГ высокий, то у неё могут прекратиться месячные или начаться меноррагии (маточные кровотечения), которые никоим образом не связаны с менструацией. Выше нормы концентрация фолликулостимулирующего гормона и у женщин в менопаузе. Если же представительница прекрасного пола находится в репродуктивном возрасте, то при повышении концентрации фолликулостимулирующего гормона в крови у неё надо искать такую патологию:
- истощение либо дисфункцию яичников;
- новообразование гипофиза;
- злоупотребление спиртными напитками;
- повышение уровня тестостерона.
При высоком уровне ФСГ беременность может наступить только в том случае, если происходит овуляция и этот факт подтверждён с помощью ультразвукового исследования.
Как сдавать кровь для определения уровня ФСГ
Для того чтобы правильно выбрать день, когда надо сдать кровь на ФСГ, врач должен знать её цикл. Поскольку уровень фолликулостимулирующего гормона максимальный в середине цикла, то врачи рекомендуют определять уровень ФСГ с третьего по седьмой день цикла. Концентрация ФСГ выше всего в фолликулярную фазу. С пятого по восьмой день стоит произвести сдачу крови для ФСГ женщинам, у которых нет иной патологии, кроме задержки развития фолликула. Мужчины же могут сдавать кровь для определения концентрации фолликулостимулирующего гормона в любое время.
К сдаче анализа крови на содержание ФСГ женщине надо подготовиться заблаговременно. Она не должна употреблять спиртные напитки накануне сдачи анализа, не есть жирную пищу, не нервничать и не курить. Кровь лучше сдать натощак.
Какие ещё гормоны определяют у женщин
Передняя доля гипофиза синтезирует пролактин. ФСГ тоже вырабатывается гипофизом. Пролактин очень важен при беременности: он способствует набуханию молочных желез, усилению лактации и стимулирует продукцию прогестерона, поддерживает беременность. Его концентрация достигает максимума ночью, находится на нижнем уровне до позднего утра и затем вновь начинает повышаться.
В отличие от ФСГ, пролактин определяют в таких случаях:
- самопроизвольное выделение из молочных желез молока у небеременных женщин;
- периодические боли в молочных железах;
- мастопатия;
- хроническое воспаление половых органов;
- рост чрезмерного количества волос по всему телу по типу мужского оволосения;
- неполное и недостаточное развитие женских половых органов;
- проблемы с зачатием и вынашиванием беременности.
Ожирение, остеопороз и климакс, протекающий с резко выраженным болевым синдромом, вынуждают женщину сдать кровь для определения пролактина, ФСГ и иных гормонов. В организме женщины важную роль играет не только ФСГ. Эстрадиол – самый мощный женский гормон. Его уровень зависит от фазы цикла женщины. Наибольшая концентрация эстрадиола, в отличие от ФСГ, наблюдается в момент выхода яйцеклетки, то есть, в середине менструального цикла. Как и ФСГ, эстрадиол определяет половое развитие девочек, наличие менструаций и развитие нарушений менструального цикла.
Спустя несколько дней после овуляции во второй половине цикла женщине определяют уровень прогестерона. Во время беременности этот гормон отвечает за сохранение плода. Его концентрация должна быть не выше 2,23 и не ниже 0,32 нмоль/л. Если повышен прогестерон, как и ФСГ, в фолликулярной фазе, то это может говорить о наличии опухолей либо же кист яичников. Повышение его концентрации происходит и при опухолях надпочечников. Снижение уровня прогестерона возможно тогда, когда забор крови состоялся после овуляции.
Нормальный баланс гормонов обеспечивает гармоническую работу всего организма. И женщины, и мужчины должны контролировать уровень этих веществ в крови для того, чтобы быть здоровыми, рожать детей и ощущать гармонию в интимной жизни. Сдать анализ крови для определения уровня фолликулостимулирующего гормона можно в Центр ЭКО Тамбов. В нашем центре в кратчайший срок вы сможете получить результаты исследования, интерпретированные опытным эндокринологом. Специалисты Центр ЭКО Тамбов всегда готовы вам помочь!
Повышенный прогестерон в лютеиновой фазе
Повышенный прогестерон в лютеиновой фазе, при условии, что женщина не вынашивает ребенка, говорит о наличии хронических заболеваний репродуктивной системы.
Болезни с характерным всплеском уровня прогестерона развиваются на фоне злокачественных опухолей яичника.
Дефицит гормона провоцирует бесплодие, чем ниже показатели прогестерона, тем меньше шансов зачать.
Прогестерон относится к гормонам женской половой сферы, отвечающим за полноценность II фазы цикла менструаций. За возможность зачатия и за все этапы вынашивания. Продуцируется надпочечниками и желтым телом (временной железой). При беременности производится еще и плацентой.
Женский гормональный фон нельзя охарактеризовать как постоянный, поэтому и гормональный уровень может колебаться, завися от общего состояния здоровья.
Нормальные показатели прогестерона
Референсные нормы концентрации гормонов обусловлены фазой менструального цикла. Во время I фазы наблюдается пролонгированный рост уровня гормона, вплоть до самой овуляции. На момент овуляции приходится пик прогестеронового всплеска (около 0,48-9,41 нанограмма на миллиметр). Если оплодотворения не было, то под нормальным значением гинекологи понимают показатель в рамках 0,32-2,23 нанограмма на миллилитр.
Для определения референсных значений прогестерона в лютеиновой фазе — требуется сдать анализ венозной крови.Из-за постоянной смены фаз в цикле уровень гормона тоже меняет значения. Поэтому есть несколько предписаний для сдачи крови, позволяющих провести анализы с высокой точностью.
Их соблюдение необходимо, так как нужно не просто установить уровень прогестерона, но и определить степень патологичности состояния при корреляции с уровнем эстрадиола.
Лютеиновая фаза — это вторая половина цикла, когда прогестерон повышается максимально. Согласно исследованиям, уровень гормона поднимается почти в 10 раз. Отсутствие всплеска или дефицит гормона свидетельствуют о гинекологических проблемах.
Узнать, адекватен ли уровень концентрации прогестерона в крови поможет тест на овуляцию. А специфические анализы сдают на 23 день от начала менструального кровотечения, при условии, что цикл состоит из 28 дней. Если он дольше (32-36 дней), то анализ, соответственно, сдвигается на 28-29 сутки.
Нерегулярность цикла вынуждает врачей несколько раз повторять анализ, а женщина должна измерять базальную температуру с первого дня после окончания менструации и до начала нового кровотечения.
Если уровень прогестерона и эстрадиола понижается или повышается, то развиваются симптоматические комплексы, указывающие на первичное заболевание. К основным симптомам можно отнести болезненность и нагрубание молочных желез, неконтролируемые эмоциональные перепады, вздутие, кровотечения из влагалища (никак не связанные с менструацией).
Любой из описанных признаков должен стать поводом незамедлительного обращения к гинекологу, так как хронические изменения гормонального фона лечить гораздо дольше и тяжелее.
Причины повышенного прогестерона
Основная причина повышения прогестеронового уровня — беременность, но если она не выявлена, а гормональные показатели продолжают расти и находятся на критической отметке, то предполагают:
- дисфункциональные нарушения работы надпочечников;
- патологическое нарушение менструации из-за злокачественной опухли;
- скрытые маточные кровотечения;
- кистоз желтого тела;
- почечную недостаточность.
Определить первоначальную причину можно только путем полноценного обследования.
Во время беременности повышенный уровень прогестерона хоть и физиологичен, но требует постоянного врачебного внимания и контроля.
При врожденных органических поражениях коры надпочечников у женщин развивается бесплодие. Но в некоторых случаях симптоматика не проявляется и ребенка удается выносить без осложнений. Поэтому повышение уровня ОН-прогестерона, обусловленное проблемами функциональности надпочечников, настораживает врачей не меньше.
Стероидный гормон прогестерон обеспечивает нормальное протекание беременности. Какова норма прогестерона у женщин и как правильно сдавать анализ на гормон, читайте на нашем сайте.
Когда и зачем сдавать анализы на ФСГ, ЛГ и пролактин, расскажем тут.
По этой ссылке https://gormonexpert.ru/gormony/progesteron/kogda-sdavat-na-kakoj-den-cikla.html вы узнаете, на какой день цикла необходимо сдавать прогестерон и как правильно сдавать анализ женщинам с нерегулярным циклом.
Симптомы
Поскольку прогестерон участвует во многих процессах жизнеобеспечения организма, то колебания его уровня в любую из сторон безотлагательно проявляются.
В первые дни цикла гормона продуцируется мало, к началу лютеинового периода (примерно 15 сутки), наступает овуляция и показатели прогестерона стремительно растут. При наступлении беременности этот рост продолжается постоянно.
Патологический профицит гормона, не обусловленный зачатием, имеет собственную симптоматику:
- На лице, теле и голове появляются глубокие подкожные прыщи.
- Женщина постоянно чувствует себя вялой и усталой.
- Менструальный цикл нерегулярный.
- Пониженное артериальное давление.
- Диагностируется приобретенное бесплодие.
- Появляются частые мигрени, приступы гипергидроза.
- Развивается депрессия.
В качестве дополнительной симптоматики проявляются вздутия живота, увеличение веса, ломкость, чрезмерная сальность и выпадение волос.
Повышенный уровень ОН-прогестерона становится причиной:
- опухолей надпочечников и/или яичников;
- тяжелой степени акне;
- нарушений цикла менструации;
- поликистоза яичников;
- мертворождения, выкидыша (при беременности).
ОН-прогестерон не является гормоном в привычном понятии этого термина. Это продукт метаболизма стероидных гормонов, выделяемых яичниками и корой надпочечников. Но он является основанием для производства других важных гормонов.
Какие действия предпринимать?
У здоровой женщины уровень прогестерона находится в норме согласно возрасту и фазе менструального цикла. Для лечения гормональных всплесков используют несколько способов. Самым надежным среди них можно считать метод медикаментозной коррекции. Самолечение недопустимо, если женщина не желает прибегать к фармацевтике, врач порекомендует воспользоваться народными средствами.
Понизить уровень прогестерона можно такими препаратами:
- «Кломифен»;
- Вальпроевая кислота;
- «Мифепристон»;
- «Тамоксифен».
Перед началом курса нужно исключить беременность, в противном случае каждое из этих лекарств может спровоцировать выкидыш.
Особой осторожности требуют назначения при сахарном диабете, почечных дисфункциях, диагностированной эпилепсии, сердечной недостаточности, мигренях, депрессивных состояниях. А также при внематочной беременности и во время грудного вскармливания.
На уровне прогестерона сказывается чрезмерное потребление пищи, богатой белками. Рацион корректируется по принципу «от обратного». Требуется на время исключить из меню твердые сорта сыра, кисломолочную продукцию, курицу, бобовые, говядину, тыквенные семечки. Обед и ужин лучше запивать чаем с мятой, способствующей гормональной стабилизации.
В качестве народных методов рассматривается отвар из плодов рябины горькой, гвоздичных цветков, зеленой массы матки боровой. Каждую из этих трав можно приобрести в аптечном киоске.
Курс лечения — 1-2 недели, перед началом терапии нужно посоветоваться с гинекологом и исключить возможность развития аллергических реакций.Терапевтические мероприятия по стабилизации уровня прогестерона лучше не откладывать.
При подозрении на гормональный дисбаланс нужно обратиться к гинекологу, так как критически высокий прогестерон в лютеиновой фазе становится причиной раннего развития остеопороза, воспалительных процессах в почках, заболеваний сердца и сосудов, эпилептических припадков.
Во время беременности уровень прогестерона повышается, но бывают случаи патологического увеличения концентрации гормона. Повышен прогестерон у женщины – в чем причины и что можно предпринять?
Как правильно сдавать анализ на прогестерон и как правильно к нему подготовиться, читайте в этой теме.
Видео на тему
Когда у меня овуляция? Симптомы овуляции и многое другое
Эта статья также доступна на: português, español
Что нужно знать
Ваши яйца живут в мешочках в яичниках, называемых фолликулами
Для фолликулов необходимы правильные условия. вырастить и выпустить свою яйцеклетку: ваша среда, здоровье, и поведения все играют роль
Чтобы узнать, когда у вас овуляция, вы можете отслеживать свой цикл, цервикальную жидкость, базальную температуру тела и / или проходить тесты на овуляцию
Овуляция иногда связана с овуляционным кровотечением или овуляционной болью
Что такое овуляция?
Овуляция — это выход яйцеклетки из яичника в маточную трубу.Обычно это происходит примерно за 13–15 дней до начала каждой менструации (1). Как и ваш период, время овуляции может варьироваться от цикла к циклу, и у вас может быть странный цикл, при котором овуляция не происходит вообще.
Загрузите Clue, чтобы лучше понять время цикла.
4.8
более 2 миллионов оценок
Понимание основ работы овуляции может быть мощным инструментом для вашего здоровья
Обычно люди знакомятся с этой темой только после того, как у них возникнут проблемы с беременностью. Но понимание процесса может дать вам представление не только о рождаемости. Вы лучше поймете любые гормональные изменения в вашем теле примерно в это время и узнаете, какие факторы могут повлиять на время овуляции (например, стресс) и почему.
В настоящее время на западе мы овулируем примерно 400 раз на протяжении нашей жизни (2). На это число влияет использование противозачаточных средств (многие из которых блокируют овуляцию), время, проведенное во время беременности и кормления грудью, а также любые формы поведения или состояния здоровья, которые влияют на репродуктивные гормоны (например,грамм. расстройства пищевого поведения, СПКЯ). Доисторически женщины овулировали менее чем в два раза чаще (3).
В каждую овуляцию уходит много. А если условия не будут подходящими, этого не произойдет.
Развитие и выпуск яйцеклетки в каждом цикле происходит в ответ на сложные взлеты и падения ваших репродуктивных гормонов. На овуляцию (и менструальный цикл в целом) влияют энергетические, пищевые, эмоциональные и социально-экономические факторы.
Могут оказывать влияние краткосрочные факторы, такие как нарушение биоритмов, сезонные изменения, стресс и курение, а также более долгосрочные факторы, такие как СПКЯ и заболевания щитовидной железы (4–8).
Как работает овуляция: основы
Крошечные яйца развиваются в мешочках, называемых фолликулами, в ваших яичниках. Фолликулы развиваются в течение нескольких месяцев, прежде чем они будут готовы выпустить свою яйцеклетку (по оценкам,> 175 дней или> ~ 6 циклов) (9, 10). В любой момент времени в ваших яичниках есть фолликулы на нескольких стадиях развития (10).
Ранние ученые однажды приняли фолликул за саму яйцеклетку.
Фолликулы претерпевают невероятные изменения, ведущие к овуляции, развивая множество частей и слоев, каждый со своими функциями.Однако большинство фолликулов никогда не достигают овуляции, отмирают на разных этапах развития или до развития.
В начале каждого менструального цикла несколько (~ 10) развивающихся фолликулов считаются кандидатами на овуляцию этого цикла (11). Примерно к середине фолликулярной фазы один фолликул становится доминирующим.
Так же, как спортсмена-суперзвезды, выбираемого из стаи, все ресурсы затем идут на подготовку этого единственного фолликула, а остальные потенциалы отмирают.
Когда фолликул готов, он выпускает свою яйцеклетку. Яйцеклетка выходит из яичника и попадает в маточную трубу (две на самом деле не прикреплены — подумайте о конце маточной трубы, собирающем яйцо из брюшной полости). После выхода яйцеклетки есть около 12–24 часов для оплодотворения спермой в маточной трубе. Если яйцо не оплодотворяется за это короткое время, оно начинает разлагаться. Если он оплодотворяется, он попадает в матку в течение следующих 6–12 дней, чтобы, возможно, имплантировать во время беременности (12, 13).
Все эти события вызваны циклическими изменениями в ваших репродуктивных гормонах. Гормоны контролируют выбор и развитие фолликулов, высвобождение каждой яйцеклетки и подготовку матки к возможной имплантации.
Эта первая часть цикла называется фолликулярной фазой (теперь вы знаете, откуда она получила свое название).
Время рассказа: ваш мозг, гормоны и овуляция
Связь мозга и яичников, которая контролирует развитие фолликулов и овуляцию, называется осью гипоталамуса и гипофиза, или осью HPO.
До овуляции
В течение всего цикла мозг производит непрерывные выбросы фолликулостимулирующего гормона или ФСГ. ФСГ делает именно то, что названо, — стимулирует развитие фолликулов (2). По мере роста фолликулы производят эстроген.
По мере выбора и роста доминантного фолликула (дни 6–9 цикла) эстроген начинает расти (10).
Фолликул становится доминирующим при диаметре около 10 мм и обычно вырастает до около двух сантиметров в диаметре (и примерно до 3.3 см) (14–17). Это примерно размером с виноградину или лесной орех с скорлупой.
Готово к высвобождению
Когда количество эстрогена достигает своего верхнего порога, яйцо готово к высвобождению. Затем мозг производит выброс лютеинизирующего гормона (ЛГ), вызывая овуляцию. Выход яйцеклетки из фолликула и яичника происходит примерно через 24 часа (через 10–12 часов после пикового уровня ЛГ) (13, 17). Фолликул использует ферменты, чтобы разрушить свою стенку и сформировать отверстие, позволяющее высвободить крошечное яйцо из его центра (18).
В конце фаллопиевой трубы пальцеобразная структура набухает от крови, чтобы схватить и ввести яйцо внутрь. Тем временем яйцо претерпевает собственные изменения, чтобы подготовиться к возможному оплодотворению.
Преовуляторный фолликул является основным источником эстрогена в организме. Доминирующий фолликул является источником> 90% продукции эстрогена в предовуляторный период (19).
Взгляните на график гормонов. Вы увидите синим цветом, что уровень эстрогена начинается с низкого уровня и начинает повышаться в середине фолликулярной фазы.
После овуляции
Яйцеклетка может быть в пути, но работа фолликула еще далека от завершения. Лютеинизирующий гормон превращает большой фолликул, вырабатывающий эстроген, в на машине для производства прогестерона (10) .
Этот новый продуцент прогестерона (который также производит эстроген) называется «желтое тело» , или «желтое тело» на латыни (потому что оно желтоватого цвета). Новое желтое тело производится каждый цикл, в котором происходит овуляция.Если овуляции не произойдет, у вас вообще не будет такого всплеска прогестерона.
Если яйцеклетка не оплодотворяется спермой , а затем имплантируется в слизистую оболочку матки (после путешествия по фаллопиевой трубе, что занимает несколько дней), желтое тело начинает разлагаться, а уровень гормонов падает, вызывая менструальный цикл ( 20). Если беременность все же наступает, желтое тело обеспечивает достаточное количество прогестерона для развития вашей беременности, пока плацента не возьмет верх (21).
Посмотрите на гормоны сразу после овуляции.Уровень эстрогена немного падает, а затем начинает расти прогестерон (и эстроген). Если нет гормонального сигнала о том, что беременность началась, они снова начинают падать в середине лютеиновой фазы, в конечном итоге вызывая период.
Ваша овуляция — это не часы
Любые факторы, влияющие на гормональную пульсацию в вашем мозгу, могут повлиять на вашу овуляцию. Факторы окружающей среды и внутренние факторы, такие как стресс, изменения в диете и физических упражнениях, могут привести к тому, что овуляция произойдет немного раньше, или позже, или вообще не произойдет.Тогда ваши месячные могут наступить раньше или позже, быть легче или тяжелее.
Ваша фолликулярная фаза считается «пластичной» по сравнению с вашей лютеиновой фазой.
Это означает, что она обычно может меняться по длине от цикла к циклу. Если вы знаете длину вашей типичной лютеиновой фазы (чаще всего 13– 15 дней), вы можете отсчитывать в обратном порядке, чтобы понять, когда у вас произошла овуляция.Изменения продолжительности вашего цикла обычно точно определяются в фолликулярной фазе — времени, за которое фолликул достигает точки овуляции.
При первой менструации обычно не происходит регулярная овуляция. Также часто бывает нерегулярная овуляция сразу после беременности и кормления грудью, а также в годы, приближающиеся к менопаузе.
Почему это важно
Отсутствие овуляции время от времени может не вызывать беспокойства, но если это станет обычным явлением или если вы полностью прекратите овуляцию (и не получите гормоны по-другому), могут возникнуть серьезные проблемы со здоровьем. результат.
Процесс овуляции обеспечивает организм столь необходимыми уровнями эстрогена и прогестерона — гормонов, которые играют важную роль не только в фертильности. Они влияют на плотность костей, здоровье сердца, обмен веществ, качество сна, психическое здоровье и многое другое. Очень важно получать их в достаточном количестве.
Ановуляция в плодородные годы связана с остеопорозом, сердечно-сосудистыми заболеваниями и некоторыми видами рака в более позднем возрасте (22-25). Например, спортсмены с нарушением менструального цикла значительно чаще страдают от стрессовых переломов (26).
Как я узнаю, что у меня овуляция?
Как взрослый, вы, вероятно, большую часть времени овулируете, если ваш цикл обычно находится в пределах диапазона (это 24–38 дней для взрослых, с менее чем 7–9 отклонениями от цикла к циклу и менструальным периодом 2– 7 дней) (27).Циклы, которые постоянно выходят за пределы этих диапазонов (они длинные, короткие или очень нерегулярные), могут быть признаком ановуляции и поводом поговорить с вашим лечащим врачом.
Чтобы узнать, происходит ли у вас овуляция (и когда это происходит в вашем цикле), вы можете попробовать:
Отслеживание продолжительности и регулярности цикла в Clue
Использование тестов мочи на овуляцию, купленных в вашей аптеке
Отслеживание физических признаков фертильности в течение нескольких циклов, включая базальную температуру тела и цервикальную жидкость
Проведение у врача проверки гормонального профиля (путем анализа образца крови, взятого в середине лютеинового периода) phase)
Загрузите Clue и легко отслеживайте уровень цервикальной жидкости и BBT.
4,8
более 2M + рейтинги
Когда я могу сдать тест на овуляцию?Тестировать можно в любое время дня, но лучше делать это каждый день в одно и то же время.
Наборы для тестов на овуляцию рекомендуют выбирать время, когда вы не мочились в течение 4 часов перед тестированием или когда вы потребляли чрезмерное количество жидкости. ЛГ обычно повышается утром, между 4-8 часами утра (29). Если вы сделаете тест до того, как он впервые повысится, вы можете получить отрицательный результат в тот же день, но вы все равно должны получить положительный результат на следующий день.Если вы пытаетесь определить самый ранний подъем ЛГ или если у вас возникают проблемы с получением положительного результата, попробуйте проводить тестирование в разное время в течение дня и посмотрите, что лучше всего подходит для вашего тела.
Статья была первоначально опубликована 23 ноября 2017 г.
Узнайте о
своем теле и здоровье женщин Привет, я Стеф! Я буду отправлять вам познавательные и развлекательные истории о женском здоровье, а также поделюсь советами и рекомендациями, которые помогут максимально эффективно использовать ваше приложение Clue!Уровни прогестерона в сыворотке крови во время фолликулярной фазы менструального цикла происходят из-за взаимодействия между яичниками и корой надпочечников | Репродукция человека
Аннотация
ИСТОРИЯ ВОПРОСА: Преовуляторный подъем прогестерона важен для овуляции, но как его регуляция, так и его происхождение спорны.Было проведено три эксперимента, чтобы определить, возникает ли прогестерон фолликулярной фазы из яичников, коры надпочечников или из обоих. МЕТОДЫ. Первое исследование было проведено на пациентах, которым была назначена вспомогательная репродуктивная система, которые получали агонист ГнРГ длительного действия либо во время приема орального контрацептива, либо во время лютеиновой фазы менструального цикла, не подвергавшегося лечению. Второе исследование также проводилось во время понижающей регуляции агонистом ГнРГ: некоторые пациенты с повышенным уровнем прогестерона получали дексаметазон (ДХМ).Другие пациенты с таким же повышенным базальным уровнем прогестерона и пациенты с низким уровнем прогестерона не получали ДХМ и служили контролем. Наконец, тесты на адренокортикотропный гормон (АКТГ) проводились у нормоциклических добровольцев как во время ранней и поздней фолликулярной фазы, так и во время приема противозачаточных таблеток. РЕЗУЛЬТАТЫ: Во время подавления секреции эндогенного гонадотропина уровень прогестерона повышался после введения АКТГ, но не ГнРГ. ДХМ не предотвращал преовуляторного повышения концентрации прогестерона в сыворотке.Концентрация прогестерона и 17α-гидроксипрогестерона, стимулированная АКТГ, значительно снижалась во время приема этинилэстрадиола. ВЫВОДЫ: Прогестерон возникает в коре надпочечников на протяжении большей части фолликулярной фазы, в результате чего его функция модулируется неизвестным фактором яичников, который подавляется этинилэстрадиолом. Источник прогестерона перемещается в яичники до овуляции.
Введение
Повышение сывороточных концентраций прогестерона и 17α-гидроксипрогестерона считается первым признаком надвигающейся овуляции, предшествующей всплеску ЛГ примерно на 12 часов (Hoff et al., 1983). У многих видов, включая человека, успешную овуляцию можно предотвратить с помощью антагонистов прогестерона или ингибиторов синтеза прогестерона (Collins and Hodgen, 1986; Liu et al. , 1987; Shoupe et al. , 1987; Batista et al. др. , 1992; Hibbert и др. , 1996). Гомозиготные трансгенные мыши, лишенные рецептора прогестерона, неспособны к овуляции, поэтому их ооциты остаются в ловушке неразорвавшихся фолликулов (Lydon et al., 1995). Несмотря на это экспериментальное свидетельство, рецептор прогестерона лишь слабо и временно экспрессируется в гранулезе зрелых графианских фолликулов (Iwai et al. , 1990; Park and Mayo, 1991). Сам по себе прогестерон не может вызвать овуляцию, но, по-видимому, опосредует действие ЛГ на фолликул Граафа до и во время овуляции (Brännström and Janson, 1989).
Несмотря на очевидную роль прогестерона в процессе овуляции, его источник в этот период менструального цикла не определен.Фермент, ответственный за синтез прогестерона, 3β-гидроксистероид дегидрогеназа (3β-HSD), экспрессируется в коре надпочечников, внутренней теке и, по крайней мере, у некоторых видов, также в гранулезе фолликула Граафия (Dupont et al. , 1990). В то время как некоторые авторы утверждают, что надпочечники вносят значительный вклад в преовуляторный прогестерон (Eldar-Geva et al. , 1998), другие считают яичник основным источником (Fanchin et al. , 1997; Urman et al., 1999). Помимо этих неопределенностей, ничего не известно о регуляторных сигналах, которые вызывают повышение уровня прогестерона в конце развития фолликулов.
В этом сообщении обобщены результаты трех проспективных экспериментов, которые были проведены для определения происхождения и регуляции секреции прогестерона в фолликулярной фазе у регулярно менструирующих женщин. Две серии экспериментов были выполнены во время десенсибилизации агонистом ГнРГ длительного действия у пациентов, получавших ЭКО или ИКСИ, поскольку это лечение эффективно снижает вклад стероидогенеза яичников.Третий эксперимент проводился на добровольцах с нормальной менструацией во время их естественного цикла, не получавшего лечения, а затем во время приема противозачаточных таблеток.
Материалы и методы
Первое исследование было разработано для изучения влияния любой остаточной гормональной активности предыдущего менструального цикла на уровни циркулирующего прогестерона во время последующего цикла. С этой целью пациенты получали этинилэстрадиол и дезогестрел во время приема агониста гонадолиберин пролонгированного действия.Второе исследование было разработано для оценки роли коры надпочечников на уровнях прогестерона во время фолликулярной фазы с использованием супрессора эндогенной активности кортикостероидов надпочечников, дексаметазона (ДХМ), у пациентов во время десенсибилизации агонистом ГнРГ длительного действия. Наконец, в третьем исследовании стимулятор стероидогенеза надпочечников, аденокортикотропный гормон (АКТГ), давали женщинам во время естественного менструального цикла, а затем во время приема орального контрацептива, содержащего этинилэстрадиол и дезогестрел.Три экспериментальных протокола визуализированы на Рисунке 1. Первое и второе клинические исследования, представленные ниже, были проведены в Институте репродуктивной медицины Университета Мюнстера, Германия, тогда как третье исследование проводилось в Университетской женской больнице Базеля. Швейцария. Все исследования были представлены в местные этические комитеты, и участники подписали форму информированного согласия.
Первое исследование: источник прогестерона во время подавления с помощью агониста ГнРГ длительного действия
В ходе рандомизированного проспективного исследования 23 пациента лечили гормональными противозачаточными таблетками, содержащими 50 мкг этинилэстрадиола и 0.125 мг дезогестрела, вводимого последовательно (Ovidol, Nourypharma, Oss, Нидерланды) во время менструального цикла, предшествующего лечению гонадотропинами. Во время лечения оральным контрацептивом внутримышечно вводили агонист ГнРГ длительного действия. (трипторелина ацетат, декапептил ретард; Ferring, Wallisellen, Швейцария) для последующего лечения с помощью ЭКО или ИКСИ. Другая группа из 32 женщин получала ацетат трипторелина во время лютеиновой фазы нелеченого менструального цикла. Все включенные пациенты имели нормальные овуляторные менструальные циклы, и ни у одной из них не было синдрома поликистозных яичников (СПКЯ) или каких-либо других эндокринных аномалий, влияющих на яичники или надпочечники.Рандомизация основывалась на месяце рождения женщины; те, у кого был четный месяц, получали гормональные противозачаточные средства, а те, у кого был неравный месяц, не получали никаких лекарств. Восемь пациентов отказались от участия в проспективном исследовании. После менструации была инициирована гиперстимуляция яичников гонадотропинами, и ее контролировали с помощью повторных измерений сывороточных концентраций 17β-эстрадиола и прогестерона вместе с вагинальными ультразвуковыми исследованиями, как описано ранее (De Geyter et al., 1994). Каждая пара была включена в исследование только один раз.
Кроме того, у 11 женщин тест на ГнРГ, состоящий из болюсной инъекции 100 мкг ГнРГ (Ферринга), и у 18 женщин тест на АКТГ, состоящий из болюса в / в. инъекции 250 мкг АКТГ (Synacthen; Ferring) были выполнены для оценки активности гипофизарно-яичниковой и гипофизарно-надпочечниковой оси соответственно во время десенсибилизации трипторелина ацетатом. Ответ ЛГ в тесте на заражение ГнРГ считается оптимальным для оценки десенсибилизации гипофиза во время лечения агонистами ГнРГ (Scheele et al., 1996). Тесты на ГнРГ и АКТГ были выполнены перед началом стимуляции яичников гонадотропинами. Все образцы сыворотки хранили замороженными при –20 ° C до анализа.
Второе исследование: подавление сывороточного уровня прогестерона в фолликулярной фазе с помощью DXM
ДХМ использовался для подавления выработки прогестерона надпочечниками и для наблюдения за вкладом яичников в уровни прогестерона во время фолликулярной фазы. Пациенты с регулярным менструальным циклом и нормальным овариальным резервом (по оценке уровня ФСГ третьего дня цикла <9 МЕ / л), но страдающие трубным бесплодием или мужским иммунологическим бесплодием, были набраны до их первого лечения с помощью ЭКО.У всех участников был нормальный овуляторный менструальный цикл, и ни один из них не страдал от СПКЯ или каких-либо явных эндокринных аномалий яичников или надпочечников. Концентрация прогестерона в сыворотке определялась в трех образцах сыворотки, взятых каждые 10 мин, во время подавления секреции эндогенного гонадотропина, что было достигнуто с помощью ацетата трипторелина на 2–3 недели ранее (декапептил ретард; Ferring). Пациенты, у которых все три базальные концентрации прогестерона в сыворотке равномерно> 2 нмоль / л во время подавления яичников получали ДХМ (1 мг в день, принимаемый перорально) для подавления секреции прогестерона надпочечниками на протяжении всей стимуляции яичников гонадотропинами.Одна контрольная группа пациентов с тремя последующими концентрациями прогестерона в сыворотке> 2 нмоль / л не получала ДХМ во время стимуляции яичников. Пациенты были рандомизированы по месяцу их рождения (пациенты с четным месяцем рождения лечились DXM, а пациенты с неравномерным месяцем рождения — нет). Пациенты с тремя последующими концентрациями прогестерона в сыворотке <2 нмоль / л и получавшие ЭКО впервые в течение того же периода составили дополнительную контрольную группу. Каждая пара была включена в исследование только один раз.Образцы сыворотки отбирали до стимуляции яичников и в день индукции овуляции с помощью ХГЧ (Profasi; Serono, Zug, Switzerland). Эти образцы сыворотки хранили замороженными при –20 ° C до анализа. Клинические данные пациентов, участвовавших в этом исследовании, и результаты лечения ДХМ обобщены в Таблице II.
Третье исследование: происхождение прогестерона в поздней фолликулярной фазе
Стимулирующие тесты надпочечников с помощью АКТГ были выполнены у девяти нормоциклических добровольцев для проверки их функции надпочечников во время естественного менструального цикла или во время приема 50 мкг этинилэстрадиола (Ovidol; Nourypharma).У всех участниц были регулярные менструальные циклы, и они не принимали никаких других лекарств. Их средний возраст составлял 28 лет (диапазон 22–39).
Все тесты на АКТГ проводились рано утром (с 8.00 до 10.00), и девяти участникам разрешили отдыхать, лежа на протяжении всей процедуры. Болюс внутривенный инъекции АКТГ (250 мкг болюса в / в) делали на 3-й день необработанного менструального цикла. Образцы сыворотки крови брали натощак в утренние часы за 30 и 0 минут до, а также через 30 и 60 минут после болюсного введения АКТГ.Второй тест на АКТГ проводился во время преовуляторного подъема прогестерона, который определялся путем ежедневного измерения ранним утром (например, 7.00–9.00) концентрации прогестерона в сыворотке, начиная с 12 дня необработанного менструального цикла. Дополнительный тест на АКТГ был проведен на 3 день следующего менструального цикла, после чего участники начали принимать 50 мкг этинилэстрадиола в течение 7 дней, затем 50 мкг этинилэстрадиола и 0,125 мг дезогестрела в течение дополнительных 15 дней (Ovidol; Nourypharma).Четвертый тест на АКТГ проводился через 7 дней лечения 50 мкг этинилэстрадиола ежедневно перед приемом дезогестрела. Образцы сыворотки хранили замороженными при –20 ° C до анализа.
Измерение концентрации гормонов
Все концентрации гормонов были измерены с помощью имеющихся в продаже наборов для анализа. Надежное измерение уровней прогестерона во время фолликулярной фазы менструального цикла требует систем анализа с высокой точностью на нижнем конце стандартной кривой.Для измерения прогестерона использовали две чувствительные системы анализа: SR1 (ImmunoChem, Фрайбург, Германия) и Elecsys (Roche Diagnostics, Базель, Швейцария), обе с аналитической чувствительностью 0,48 нмоль / л и функциональной чувствительностью 1,43 нмоль / л. , то есть самая низкая концентрация, которая может быть измерена воспроизводимо с коэффициентом вариации между анализами 20%. Во время первоначального тестирования результаты набора иммуноферментного анализа SR1 (ELISA) для измерения низких концентраций прогестерона сравнивались с коммерчески доступным радиоиммуноанализом (RIA; Biermann, Bad Nauheim, Германия), и была обнаружена высокая корреляция. значительный (0.811, P <0,00001). Коэффициенты вариаций между анализами и внутри анализов для измерений прогестерона, эстрадиола и ЛГ были ниже 10,1, 5,7 и 9,0% соответственно, определенные с контрольными растворами с концентрациями, установленными на уровне 5 нмоль / л, 196 пмоль / л и 15 МЕ / л соответственно. Концентрацию андростендиона измеряли с помощью RIA от Diagnostic Systems Laboratories I7nc. (DSL, Вебстер, Техас, США). Концентрацию 17β-гидроксипрогестерона измеряли с помощью RIA от Diagnostic Products Corporation (DPC, Лос-Анджелес, Калифорния, США).Для андростендиона и 17α-гидроксипрогестерона коэффициенты вариации между анализами и внутри анализов были ниже 7,1 и 8,4% соответственно, определенные с растворами с низкой концентрацией при 3,3 и 2,6 нмоль / л соответственно.
Статистический анализ
Данные были проанализированы с помощью теста Манна-Уитни U , Крускала Уоллиса или теста χ 2 , в зависимости от ситуации, с использованием пакета статистического программного обеспечения Statgraphics (Manugistics Inc., Роквилл, Массачусетс, США). Данные были представлены средними значениями вместе с их 95% доверительным интервалом во всех случаях.Уровень статистической значимости был установлен на уровне 5%.
Результаты
Происхождение прогестерона в ранней фолликулярной фазе
Клинические данные пациентов, участвовавших в этой части исследования, и результаты, полученные с помощью ЭКО или ИКСИ, суммированы в таблице I. Наблюдаемые сывороточные концентрации прогестерона во время начальной фазы фолликулярной фазы были ниже после предварительной обработки этинилэстрадиолом и дезогестрела, чем в циклах без предварительной обработки, но различия между обеими группами не достигли статистической значимости.Статистика Колмогорова-Смирнова, которая использовалась для анализа распределения концентраций прогестерона в обеих группах, была значительно ниже в циклах, предварительно обработанных этинилэстрадиолом и дезогестрелом (0,87 против 1,75, P <0,01), что указывает на более низкую дисперсию концентрации прогестерона после предварительной обработки оральными противозачаточными таблетками на последних стадиях развития фолликулов. Однако не было обнаружено различий ни в концентрации прогестерона в сыворотке, ни в их распределении между обеими группами.
Никаких изменений в циркулирующих сывороточных концентрациях прогестерона не было вызвано дозой 100 мкг ГнРГ во время десенсибилизации ацетатом трипторелина (рис. 2А), тогда как 250 мкг АКТГ вызывали немедленное и значительное повышение уровня прогестерона в сыворотке (рис. 2Б).
Влияние ДХМ на концентрацию прогестерона в сыворотке
Клинические данные вовлеченных пациентов и результаты их лечения сведены в Таблицу II. ДХМ вводили перорально во время стимуляции яичников (1 мг в день), чтобы изучить влияние подавления стероидогенеза надпочечников на сывороточные уровни прогестерона.
ДХМ эффективно снижал концентрацию прогестерона в сыворотке во время развития фолликулов у пациентов с изначально повышенными концентрациями прогестерона, но частота наступления беременности среди пациентов, получавших ДХМ, не отличалась от таковых с повышенным базальным уровнем прогестерона в сыворотке крови, оставшимся без лечения, и пациентов с низким базальным уровнем сывороточные уровни прогестерона. Концентрация прогестерона в сыворотке крови в день введения ХГЧ — у пациентов, не получавших ДХМ, несмотря на повышенную исходную концентрацию прогестерона в сыворотке, — повысилась значительно выше, чем у пациентов, получавших ДХМ ( P < 0.001).
Влияние АКТГ на секрецию стероидов коры надпочечников во время естественного менструального цикла и при приеме оральных контрацептивов
Более высокий рост уровня прогестерона у пациентов, у которых отсутствует подавление адренокортикального стероидогенеза под действием DXM, предполагает значительный вклад надпочечников в позднюю фолликулярную фазу. Таким образом, происхождение преовуляторного прогестерона было дополнительно проверено с использованием АКТГ для стимуляции стероидогенеза надпочечников. Для этого исследования были отобраны девять участниц с нормальным, нелеченным менструальным циклом.Результаты двух участников были исключены, поскольку овуляция произошла до второго теста на АКТГ. Результаты семи оставшихся участников были суммированы на рисунке 3. В то время как сывороточные концентрации прогестерона и 17α-гидроксипрогестерона значительно выросли через 30 и 60 минут после в / в. При введении АКТГ изменения, наблюдаемые для концентраций андростендиона до и после введения АКТГ, были статистически недостоверными ( P <0,05 и P <0.001 для прогестерона, P <0,001 для 17α-гидроксипрогестерона). Базальные концентрации прогестерона и 17α-гидроксипрогестерона до введения АКТГ были выше в поздней фолликулярной фазе по сравнению с ранней фолликулярной фазой. Однако различия базальных значений 17α-гидроксипрогестерона и прогестерона были значительными только по сравнению с таковыми после 7 дней лечения этинилэстрадиолом ( P, <0,02 и <0,01 соответственно).Изменения концентраций прогестерона и 17α-гидроксипрогестерона, вызванные АКТГ, во время поздней фолликулярной фазы не отличались от таковых во время ранней фолликулярной фазы. Повышение концентрации прогестерона, вызванное АКТГ, было значительно ниже во время приема этинилэстрадиола, чем во всех других проведенных тестах ( P <0,05).
Обсуждение
Несмотря на неопровержимые доказательства решающей роли прогестерона в овуляции, его происхождение и регуляция его секреции на протяжении фолликулярной фазы менструального цикла остаются плохо изученными.Фермент 3β-HSD, который необходим для превращения прегненолона в прогестерон, сильно экспрессируется во всей фолликулярной фазе в внутренней теке, а также в коре надпочечников, но не в клетках гранулезы (Bao and Garverick, 1998). У некоторых видов 3β-HSD может экспрессироваться в некоторых клетках гранулезы доминантного фолликула во время поздней фолликулярной фазы (Richards, 1994). Было обнаружено, что у морской свинки 3β-HSD экспрессируется в единственном слое гранулезных клеток, окружающих зрелый ооцит (Dupont et al., 1990), тогда как в клетках гранулез преовуляторных фолликулов свиней не удалось обнаружить экспрессию 3β-HSD (Conley et al. , 1994). Источник прогестерона поздней фолликулярной фазы в яичниках вызывает особую загадку в свете недавнего сообщения, демонстрирующего, что биосинтез прогестерона 3β-HSD ингибируется в присутствии высоких концентраций эстрадиола (Gilling-Smith et al. , 1997).
Кора надпочечников также может рассматриваться как важный источник прогестерона в поздней фолликулярной фазе (Eldar-Geva et al., 1998). Рецепторы ЛГ были обнаружены в коре надпочечников человека (Pabon et al. , 1996), что свидетельствует об участии этого органа в процессе овуляции. Напротив, у пациентов с СПКЯ повышенные уровни прогестерона и 17α-гидроксипрогестерона возникают в яичниках, а не в надпочечниках (Lachelin et al. , 1979; Chetkowski et al. , 1984; Azziz et al. , 1990). ). В настоящем сообщении описывается вклад коры надпочечников в циркуляцию прогестерона во время фолликулярной фазы у женщин с регулярными овуляторными менструальными циклами.
Настоящие данные четко показывают, что надпочечники являются основным секреторным источником циркулирующего прогестерона во время ранней фолликулярной фазы. Об этом свидетельствует быстрое повышение уровня прогестерона после введения АКТГ во время подавления секреции эндогенного гонадотропина ацетатом трипторелина. АКТГ стимулирует превращение холестерина в прегненолон в коре надпочечников (Simpson and Waterman, 1988), который быстро превращается в прогестерон, 17α-гидроксипрогестерон и андростендион ферментами 3β-HSD и 17α-гидроксилаза / 17,20-лиаза (цитохром P450c17) соответственно.Хотя длительное введение АКТГ, по-видимому, нарушает стероидогенез яичников (Viveiros and Liptrap, 2000), кратковременное введение, используемое в этом исследовании, могло не повлиять ни на одну из функций яичников.
Во время поздней фолликулярной фазы основной источник циркулирующего прогестерона смещается в сторону яичников, о чем свидетельствует отсутствие подавления ДХМ к концу развития фолликулов. На активность надпочечников не влияет циклическая активность яичников, о чем свидетельствует сходная реакция секреции прогестерона и 17α-гидроксипрогестерона, индуцированная АКТГ как в ранней, так и в поздней фолликулярной фазе естественного менструального цикла.
Однако важный аспект настоящего исследования выявил основной вклад коры надпочечников в уровни циркулирующего прогестерона во время преовуляторной фазы. Высокая концентрация прогестерона у некоторых пациентов значительно увеличивалась во время поздней фолликулярной фазы по сравнению с пациентами со стабильно низким уровнем прогестерона. По-видимому, существует индивидуальная уставка, которая определяет скорость секреции прогестерона как во внутренней теке, так и в коре надпочечников как в ранней фолликулярной фазе, так и в преовуляторной фазе.Яичники опосредуют роль коры надпочечников. Это демонстрируется подавляющим действием этинилэстрадиола как на базальную, так и на стимулируемую АКТГ концентрации прогестерона и 17α-гидроксипрогестерона. Аналогичный результат был представлен ранее Lobo et al. , которые обнаружили значительно сниженный выход андрогенов надпочечников после стимуляции АКТГ у женщин с овариэктомией по сравнению с женщинами с регулярной овуляцией (Lobo et al. , 1982). Хотя в этом исследовании было продемонстрировано прямое стимулирующее действие конъюгированных эстрогенов на стероидогенез надпочечников, наши данные предполагают скорее подавляющее действие этинилэстрадиола на реактивность надпочечников к АКТГ.
Пероральный этинилэстрадиол вызывает повышение уровня транскортина, который связывает не только кортизол, но и прогестерон (Rosner, 1991). Эффекты этинилэстрадиола в этом исследовании можно объяснить снижением доступности прогестерона из-за повышенного связывания с транскортином. Однако обе системы анализа измеряли общий сывороточный прогестерон: связанный и несвязанный. Таким образом, наши экспериментальные результаты предполагают снижение секреции прогестерона надпочечниками при подавлении функции яичников.
Присутствие эндокринных перекрестных помех между яичниками и корой надпочечников в гормональной регуляции менструального цикла предполагалось как экспериментально, так и клинически в прошлом. У всех трансгенных мышей с дефицитом α-субъединицы ингибина развиваются опухоли гонад (Matzuk et al. , 1994; Kananen et al. , 1995). У этих животных опухоли надпочечников будут развиваться после гонадэктомии, а смещение онкогенеза от гонад к коре надпочечников опосредуется ЛГ (Rilianawati et al., 1998). Другие примеры перекрестного взаимодействия между надпочечниками и яичниками обнаруживаются при СПКЯ, поскольку резекция клина яичников приводит к снижению реактивности прогестерона и концентраций 17α-гидроксипрогестерона после введения АКТГ (Wu et al. , 2000), а также у женщин с овариэктомией, у которых надпочечники андрогенез подавлен по сравнению с контрольной группой с регулярной овуляцией (Lobo et al. , 1982).
Настоящие результаты ясно демонстрируют, что надпочечники являются основным источником циркулирующего прогестерона во время раннего фолликулярного развития, тогда как яичники обеспечивают большую часть циркулирующего прогестерона во время поздней фолликулярной фазы.Наши данные также демонстрируют, что на стероидогенез надпочечников влияет действие яичников. Перекрестное взаимодействие между надпочечниками и яичниками может быть аналогично взаимодействию между гранулезой и внутренней текой, в которой синтез прогестерона в текальной области стимулируется гранулезой (Makris and Ryan, 1977; Kotsuji et al. , 1990; Yada et al. ). , 1999). Молекулярная природа эндокринных и паракринных медиаторов между гранулезой, внутренней текой и корой надпочечников еще предстоит определить.
Таблица I.Клинические характеристики пациенток, предварительно получавших 50 мкг этинилэстрадиола вместе с 0,125 мг дезогестрела и агониста ГнРГ, по сравнению с теми, кто получал только агонист ГнРГ во время предшествующего естественного менструального цикла
| . | Естественный цикл . | с предварительной обработкой . |
|---|---|---|
| a Ни одно из различий не было статистически значимым (критерий Манна – Уитни U ). | ||
| b Ни одно из различий не было статистически значимым (χ 2 -тест). | ||
| Кол-во пациентов | 32 | 23 |
| Возраст пациента (лет) | 33,9 ± 1,7 | 32,9 ± 2,1 a |
| лет 3615 лет ± 2,3 | 35,7 ± 2,5 a | |
| Продолжительность бесплодия (лет) | 6.6 ± 1,4 | 5,6 ± 1,1 a |
| Начальная концентрация прогестерона (нмоль / л) | 1,72 ± 0,64 | 1,16 ± 0,30 a |
| Прогестерон при введении ХГЧ 9040 нмоль / л | 4,53 ± 1,22 | 4,58 ± 1,34 a |
| Эстрадиол при введении ХГЧ (нмоль / л) | 6,14 ± 0,41 | 6,19 ± 0,84 a |
| Окоциты | 81/155 (52.3%) | 77/105 (73,3%) b |
| Достигнутая беременность (%) | 7 (21,9%) | 6 (26,1%) b |
| Естественный цикл . | с предварительной обработкой . | |||
|---|---|---|---|---|
| a Ни одно из различий не было статистически значимым (критерий Манна – Уитни U ). | ||||
| b Ни одно из различий не было статистически значимым (χ 2 -тест). | ||||
| Кол-во пациентов | 32 | 23 | ||
| Возраст пациента (лет) | 33,9 ± 1,7 | 32,9 ± 2,1 a | ||
| лет 3615 лет ± 2,3 | 35,7 ± 2,5 a | |||
| Продолжительность бесплодия (лет) | 6,6 ± 1,4 | 5,6 ± 1,1 a | ||
| Начальная концентрация прогестерона (нмоль / л) | 1 | 72 ± 0,64 | 1,16 ± 0,30 a | |
| Прогестерон при введении ХГЧ (нмоль / л) | 4,53 ± 1,22 | 4,58 ± 1,34 a | ||
| Эстрадиол при введении ХГЧ (нмоль / л) | 6,14 ± 0,41 | 6,19 ± 0,84 a | ||
| Оплодотворенные / осемененные ооциты (%) | 81/155 (52,3%) | 77/105 (73,3%) b 3 b | 3 90 достигнуто (%)7 (21.9%) | 6 (26,1%) b |
Клинические характеристики пациентов, предварительно получавших 50 мкг этинилэстрадиола вместе с 0,125 мг дезогестрела и агониста ГнРГ, по сравнению с пациентами, получавшими ГнРГ только агонист в течение предыдущего естественного менструального цикла
| . | Естественный цикл . | с предварительной обработкой . |
|---|---|---|
| a Ни одно из различий не было статистически значимым (критерий Манна – Уитни U ). | ||
| b Ни одно из различий не было статистически значимым (χ 2 -тест). | ||
| Кол-во пациентов | 32 | 23 |
| Возраст пациента (лет) | 33,9 ± 1,7 | 32,9 ± 2,1 a |
| лет 3615 лет ± 2,3 | 35,7 ± 2,5 a | |
| Продолжительность бесплодия (лет) | 6.6 ± 1,4 | 5,6 ± 1,1 a |
| Начальная концентрация прогестерона (нмоль / л) | 1,72 ± 0,64 | 1,16 ± 0,30 a |
| Прогестерон при введении ХГЧ 9040 нмоль / л | 4,53 ± 1,22 | 4,58 ± 1,34 a |
| Эстрадиол при введении ХГЧ (нмоль / л) | 6,14 ± 0,41 | 6,19 ± 0,84 a |
| Окоциты | 81/155 (52.3%) | 77/105 (73,3%) b |
| Достигнутая беременность (%) | 7 (21,9%) | 6 (26,1%) b |
| Естественный цикл . | с предварительной обработкой . | |||
|---|---|---|---|---|
| a Ни одно из различий не было статистически значимым (критерий Манна – Уитни U ). | ||||
| b Ни одно из различий не было статистически значимым (χ 2 -тест). | ||||
| Кол-во пациентов | 32 | 23 | ||
| Возраст пациента (лет) | 33,9 ± 1,7 | 32,9 ± 2,1 a | ||
| лет 3615 лет ± 2,3 | 35,7 ± 2,5 a | |||
| Продолжительность бесплодия (лет) | 6,6 ± 1,4 | 5,6 ± 1,1 a | ||
| Начальная концентрация прогестерона (нмоль / л) | 1 | 72 ± 0,64 | 1,16 ± 0,30 a | |
| Прогестерон при введении ХГЧ (нмоль / л) | 4,53 ± 1,22 | 4,58 ± 1,34 a | ||
| Эстрадиол при введении ХГЧ (нмоль / л) | 6,14 ± 0,41 | 6,19 ± 0,84 a | ||
| Оплодотворенные / осемененные ооциты (%) | 81/155 (52,3%) | 77/105 (73,3%) b 3 b | 3 90 достигнуто (%)7 (21.9%) | 6 (26,1%) б |
Влияние совместного лечения с ДХМ (принимаемым внутрь, 1 мг в день) во время стимуляции яичников гонадотропинами на концентрацию прогестерона в сыворотке во время развития фолликулов
| Концентрация прогестерона . | <2 нмоль / л . | > 2 нмоль / л с ДХМ . | > 2 нмоль / л без ДХМ . | ||||
|---|---|---|---|---|---|---|---|
| a Статистически значимая разница (тест Манна – Уитни U , P <0,001). | |||||||
| b Статистически значимая разница по сравнению с обоими другими значениями (тест Манна – Уитни U , P <0,0001). | |||||||
| Кол-во пациентов | 21 | 12 | 8 | ||||
| Продолжительность бесплодия (лет) | 6.0 ± 0,7 | 6,8 ± 0,9 | 5,6 ± 0,5 | ||||
| Возраст пациента (лет) | 32,0 ± 0,9 | 31,7 ± 1,5 | 32,1 ± 1,7 | ||||
| Возраст мужа (лет) | 35,0 ± 1,1 | 35,0 ± 2,7 | 35,9 ± 2,3 | ||||
| Исходный прогестерон (нмоль / л) | 1,05 ± 0,10 | 3,28 ± 0,19 a | 3,72 ± 0,73 a | Прогестерон при введении ХГЧ (нмоль /) | 4.23 ± 0,29 | 3,47 ± 0,57 | 7,38 ± 1,49 b |
| Эстрадиол при введении ХГЧ (нмоль / л) | 7,34 ± 1,47 | 7,71 ± 1,10 | 9,54 ± 2,20 9038 фолликулярная фаза (дни) | 12,9 ± 0,4 | 12,6 ± 0,4 | 12,7 ± 0,5 | |
| Введенный ФСГ (МЕ) | 4443 ± 348 | 4437 ± 530 | 3919 ± 556 | оплодотворенных / осемененных (%) | 66/102 (64.7) | 44/55 (80,0) | 34/40 (85,0) | |
| Достигнутая беременность (%) | 11 (52,4) | 7 (58,3) | 6 (75,0) | ||||
| Концентрация прогестерона . | <2 нмоль / л . | > 2 нмоль / л с ДХМ . | > 2 нмоль / л без ДХМ . | |||
|---|---|---|---|---|---|---|
| a Статистически значимая разница (тест Манна – Уитни U , P <0.001). | ||||||
| b Статистически значимая разница по сравнению с обоими другими значениями (тест Манна – Уитни U , P <0,0001). | ||||||
| Кол-во пациентов | 21 | 12 | 8 | |||
| Продолжительность бесплодия (лет) | 6,0 ± 0,7 | 6,8 ± 0,9 | 5,6 ± 0,5 | Пациент s возраст (лет)32,0 ± 0.9 | 31,7 ± 1,5 | 32,1 ± 1,7 |
| Возраст мужа (лет) | 35,0 ± 1,1 | 35,0 ± 2,7 | 35,9 ± 2,3 | |||
| Прогестерон исходный (нмоль2 / л) | 1,05 ± 0,10 | 3,28 ± 0,19 a | 3,72 ± 0,76 a | |||
| Прогестерон при введении ХГЧ (нмоль /) | 4,23 ± 0,29 | 3,47 ± 0,57 | b | |||
| Эстрадиол при введении ХГЧ (нмоль / л) | 7.34 ± 1,47 | 7,71 ± 1,10 | 9,54 ± 2,20 | |||
| Продолжительность фолликулярной фазы (дни) | 12,9 ± 0,4 | 12,6 ± 0,4 | 12,7 ± 0,5 | |||
| FSH402 4443 ± 348 | 4437 ± 530 | 3919 ± 556 | ||||
| Оплодотворенные / осемененные ооциты (%) | 66/102 (64,7) | 44/55 (80,0) | 34/40 (85,0) | |||
| Достигнутая беременность (%) | 11 (52.4) | 7 (58,3) | 6 (75,0) | |||
Влияние совместного лечения с ДХМ (принимаемым внутрь, 1 мг в день) во время стимуляции яичников гонадотропинами на концентрацию прогестерона в сыворотке во время развития фолликулов
| Концентрация прогестерона . | <2 нмоль / л . | > 2 нмоль / л с ДХМ . | > 2 нмоль / л без ДХМ . | ||||
|---|---|---|---|---|---|---|---|
| a Статистически значимая разница (тест Манна – Уитни U , P <0,001). | |||||||
| b Статистически значимая разница по сравнению с обоими другими значениями (тест Манна – Уитни U , P <0,0001). | |||||||
| Кол-во пациентов | 21 | 12 | 8 | ||||
| Продолжительность бесплодия (лет) | 6.0 ± 0,7 | 6,8 ± 0,9 | 5,6 ± 0,5 | ||||
| Возраст пациента (лет) | 32,0 ± 0,9 | 31,7 ± 1,5 | 32,1 ± 1,7 | ||||
| Возраст мужа (лет) | 35,0 ± 1,1 | 35,0 ± 2,7 | 35,9 ± 2,3 | ||||
| Исходный прогестерон (нмоль / л) | 1,05 ± 0,10 | 3,28 ± 0,19 a | 3,72 ± 0,73 a | Прогестерон при введении ХГЧ (нмоль /) | 4.23 ± 0,29 | 3,47 ± 0,57 | 7,38 ± 1,49 b |
| Эстрадиол при введении ХГЧ (нмоль / л) | 7,34 ± 1,47 | 7,71 ± 1,10 | 9,54 ± 2,20 9038 фолликулярная фаза (дни) | 12,9 ± 0,4 | 12,6 ± 0,4 | 12,7 ± 0,5 | |
| Введенный ФСГ (МЕ) | 4443 ± 348 | 4437 ± 530 | 3919 ± 556 | оплодотворенных / осемененных (%) | 66/102 (64.7) | 44/55 (80,0) | 34/40 (85,0) | |
| Достигнутая беременность (%) | 11 (52,4) | 7 (58,3) | 6 (75,0) | ||||
| Концентрация прогестерона . | <2 нмоль / л . | > 2 нмоль / л с ДХМ . | > 2 нмоль / л без ДХМ . | |||
|---|---|---|---|---|---|---|
| a Статистически значимая разница (тест Манна – Уитни U , P <0.001). | ||||||
| b Статистически значимая разница по сравнению с обоими другими значениями (тест Манна – Уитни U , P <0,0001). | ||||||
| Кол-во пациентов | 21 | 12 | 8 | |||
| Продолжительность бесплодия (лет) | 6,0 ± 0,7 | 6,8 ± 0,9 | 5,6 ± 0,5 | Пациент s возраст (лет)32,0 ± 0.9 | 31,7 ± 1,5 | 32,1 ± 1,7 |
| Возраст мужа (лет) | 35,0 ± 1,1 | 35,0 ± 2,7 | 35,9 ± 2,3 | |||
| Прогестерон исходный (нмоль2 / л) | 1,05 ± 0,10 | 3,28 ± 0,19 a | 3,72 ± 0,76 a | |||
| Прогестерон при введении ХГЧ (нмоль /) | 4,23 ± 0,29 | 3,47 ± 0,57 | b | |||
| Эстрадиол при введении ХГЧ (нмоль / л) | 7.34 ± 1,47 | 7,71 ± 1,10 | 9,54 ± 2,20 | |||
| Продолжительность фолликулярной фазы (дни) | 12,9 ± 0,4 | 12,6 ± 0,4 | 12,7 ± 0,5 | |||
| FSH402 4443 ± 348 | 4437 ± 530 | 3919 ± 556 | ||||
| Оплодотворенные / осемененные ооциты (%) | 66/102 (64,7) | 44/55 (80,0) | 34/40 (85,0) | |||
| Достигнутая беременность (%) | 11 (52.4) | 7 (58,3) | 6 (75,0) | |||
Рисунок 1.
Диаграммы трех экспериментальных протоколов.
Рисунок 1.
Диаграммы трех экспериментальных протоколов.
Рисунок 2.
Концентрации прогестерона в сыворотке крови в нмоль / л (черные столбцы) и ЛГ в МЕ / л (пустые столбцы) до и после болюса в / в. инъекция 100 мкг GnRH ( A ) или 250 мкг ACTH ( B ) во время подавления секреции эндогенного гонадотропина агонистом GnRH длительного действия.В то время как концентрации прогестерона и ЛГ не изменялись под действием ГнРГ, после введения АКТГ наблюдалось быстрое повышение концентрации прогестерона. * P <0,01 по сравнению с 0 мин.
Рис. 2.
Концентрации прогестерона в сыворотке крови в нмоль / л (черные столбцы) и ЛГ в МЕ / л (пустые столбцы) до и после болюса в / в. инъекция 100 мкг GnRH ( A ) или 250 мкг ACTH ( B ) во время подавления секреции эндогенного гонадотропина агонистом GnRH длительного действия.В то время как концентрации прогестерона и ЛГ не изменялись под действием ГнРГ, после введения АКТГ наблюдалось быстрое повышение концентрации прогестерона. * P <0,01 по сравнению с 0 мин.
Рисунок 3.
( a ) Концентрации прогестерона в сыворотке (верхняя панель), 17α-гидроксипрогестерона (средняя панель) и андростендиона (нижняя панель) за 30 минут до, непосредственно перед, 30 и 60 минут после болюсного внутривенного введения. инъекция 250 мкг АКТГ.Тесты на АКТГ проводились во время ранней фолликулярной фазы (A и C), один раз во время поздней фолликулярной фазы (B) и через 7 дней лечения 50 мкг этинилэстрадиола (D). Над каждым тестом на АКТГ указывается, был ли эндокринный ответ статистически значимым (Kruskal Wallis) от a до e и i, j и k P <0,05 f, g и h P <0,01 ( b ). Тесты на АКТГ во время поздней фолликулярной фазы (столбец B на рисунке 3a) проводились во время преовуляторного повышения прогестерона, показанного здесь.Последний определяли путем ежедневного измерения прогестерона ранним утром, начиная с 12-го дня необработанного менструального цикла.
Рисунок 3.
( a ) Концентрации прогестерона в сыворотке (верхняя панель), 17α-гидроксипрогестерона (средняя панель) и андростендиона (нижняя панель) за 30 минут до, непосредственно перед, через 30 и 60 минут после болюса внутривенно. инъекция 250 мкг АКТГ. Тесты на АКТГ проводились во время ранней фолликулярной фазы (A и C), один раз во время поздней фолликулярной фазы (B) и через 7 дней лечения 50 мкг этинилэстрадиола (D).Над каждым тестом на АКТГ указывается, был ли эндокринный ответ статистически значимым (Kruskal Wallis) от a до e и i, j и k P <0,05 f, g и h P <0,01 ( b ). Тесты на АКТГ во время поздней фолликулярной фазы (столбец B на рисунке 3a) проводились во время преовуляторного повышения прогестерона, показанного здесь. Последний определяли путем ежедневного измерения прогестерона ранним утром, начиная с 12-го дня необработанного менструального цикла.
Это исследование было поддержано грантом медицинского факультета Базельского университета.Мы благодарим г-жу Энн Катрин Фоэдж за техническую помощь. Мы также благодарны профессору Дж. Дж. Стаубу за его ценные советы при настройке протокола эксперимента.
Список литературы
Аззиз Р., Рафи А., Смит Б. Р., Брэдли Э. и Закур, Х.В. (
1990
) О происхождении повышенных уровней 17-гидроксипрогестерона после стимуляции надпочечников при гиперандрогении.J. Clin. Эндокринол. Метаб.
,70
,431
–436.Бао Б. и Гарверик Х.А. (
1998
) Экспрессия стероидогенных ферментов и генов рецепторов гонадотропина в фолликулах крупного рогатого скота во время фолликулярных волн яичников: обзор.J. Anim. Sci.
,76
,1903
–1921.Батиста, М.С., Картледж, Т.П., Зеллмер, А.В., Ниман, Л.К., Мерриам, Г.Р. и Loriaux, D.L. (
1992
) Доказательства критической роли прогестерона в регуляции выброса гонадотропинов в середине цикла и овуляции.J. Clin. Эндокринол. Метаб.
,74
,565
–570.Brännström, M. и Janson, P.O. (
1989
) Прогестерон является посредником в овуляторном процессе яичника крысы, перфузированного in vitro.Biol. Репродукция.
,40
,1170
–1178.Четковски, Р.Дж., Чанг, Р.Дж., ДеФазио, Дж., Мелдрам, Д. and Judd, H.L. (
1984
) Происхождение сывороточных прогестинов при СПКЯ.Акушерство. Гинеколь.
,64
,27
–31.Коллинз Р.Л. и Ходген Г.Д. (
1986
) Блокада спонтанного выброса гонадотропинов в середине цикла у обезьян с помощью RU486: антагонист или агонист прогестерона?J. Clin. Эндокринол. Метаб.
,63
,1270
–1276.Конли, А.Дж., Ховард, Х.Дж., Сленджер, В.Д. и Форд, Д.Дж. (
1994
) Стероидогенез в преовуляторном фолликуле свиньи.Biol. Репродукция.
,51
,655
–661.De Geyter, Ch., De Geyter, M., Simoni M., Castro, E., Bals-Pratsch, M., Nieschlag, E. and Schneider, H.P.G. (
1994
) Пульсирующее подкожное или болюсное внутримышечное введение гонадотропина после подавления гипофиза аналогом ГнРГ длительного действия: контролируемое проспективное исследование.Hum. Репродукция.
,9
,1070
–1076.Dupont, E., Luu-The, V., Labrie, F. и Pelletier, G. (
1990
) Световая микроскопическая иммуноцитохимическая локализация 3β-гидрокси-5-ен-стероиддегидрогеназы / β 5 -β 4 -изомераза в гонадах и надпочечниках морской свинки.Эндокринология
,126
,2906
–2909.Эльдар-Гева, Т., Маргалиот, Э.Дж., Брукс, Б., Алгур, Н., Зильбер-Харан, Э. и Диамант, Ю.З. (
1998
) Происхождение сывороточного прогестерона во время фолликулярной фазы менотропин-стимулированных циклов.Hum. Репродукция.
,13
,9
–14.Fanchin, R., Righini, C., Olivennes, R., Taieb, J., de Ziegler, D. and Frydman, R. (
1997
) Преждевременное повышение уровня прогестерона и андрогенов в плазме не предотвращается подавлением надпочечников в экстракорпоральное оплодотворение.Fertil. Стерил.
,67
,115
–119.Гиллинг-Смит, К., Уиллис, Д.С. и Фрэнкс, С. (
1997
) Эстрадиоловая обратная стимуляция биосинтеза андрогенов тека-клетками человека.Hum. Репродукция.
,12
,1621
–1628.Хибберт, М., Стоуфер, Р.Л., Вольф, Д.П. и Зелински-Вутен, М. (
1996
) Введение в середине цикла ингибитора синтеза прогестерона предотвращает овуляцию у приматов.Proc.Natl Acad. Sci. США
,93
,1897
–1901.Hoff, J.D., Quigley, M.E. and Yen, S.S.C. (
1983
) Гормональная динамика в середине цикла: переоценка.J. Clin. Эндокринол. Метаб.
,57
,792
–796.Iwai, T., Nanbu, Y., Iwai, M., Taii, S., Fujii, S. и Mori, T. (
1990
) Иммуногистохимическая локализация рецепторов эстрогена и рецепторов прогестерона в яичниках человека на всем протяжении менструальный цикл.Арка Вирхова. A. Pathol. Анат. Histopathol.
,417
,369
–375.Кананен, К., Марккула, М., Райнио, Ф., Су, Дж. Г. Сюэ, А.Дж. and Huhtaniemi, I.T. (
1995
) Гонадный онкогенез у трансгенных мышей, несущих промотор альфа-субъединицы мышиного ингибина / гибридный ген Т-антигена обезьяньего вируса: характеристика опухолей яичников и создание линий клеток гранулезы, чувствительных к гонадотрофам.Мол. Эндокринол.
,9
,616
–627.Коцудзи Ф., Камитани Н., Гото К. и Томинага Т. (
1990
) Взаимодействие тека и гранулезы крупного рогатого скота влияет на их рост, морфологию и функцию.Biol. Репродукция.
,43
,726
–732.Lachelin, G.C.L., Barnett, M., Hopper, B.R., Brink, G. and Yen, S.S.C. (
1979
) Функция надпочечников у здоровых женщин и женщин с СПКЯ.J. Clin. Эндокринол. Метаб.
,49
,892
–898.Лю Дж.H., Garzo, G., Morris, S., Stuenkel, C., Ulmann, A. и Yen, S.S.C. (
1987
) Нарушение созревания фолликулов и задержка овуляции после введения антипрогестерона RU486.J. Clin. Эндокринол. Метаб.
,65
,1135
–1140.Lobo, R.A., Goebelsmann, U., Brenner, P.F. и Мишелл, Д. Jr (
1982
) Влияние эстрогена на андрогены надпочечников у женщин после овариэктомии.г. J. Obstet. Гинеколь.
,142
,471
–478.Лайдон, Д.П., ДеМайо, Ф.Дж., Функ, К.Р., Мани, С.К., Хьюз, А.Р., Монтгомери-младший, К.А., Шьямала, Г., Коннели, О.М. и О’Мэлли, Б. (
1995
) У мышей, лишенных рецептора прогестерона, наблюдаются плейотропные репродуктивные аномалии.Genes Dev.
,9
,2266
–2278.Макрис А. и Райан Дж. Дж. (
1977
) Доказательства взаимодействия между клетками гранулезы и текой при раннем синтезе прогестерона.Endocr. Res. Comm.
,4
,233
–246.Мацук, М.М., Файнголд, М.Дж., Мазер, Дж. П., Краммен, Л., Лу, Х. и Брэдли, А. (
1994
) Развитие рака, кахексиального синдрома и опухолей надпочечников у мышей с дефицитом ингибина.Proc. Natl Acad. Sci. США
,91
,8817
–8821.Pabon, J.E., Li, X., Lei, Z.M., Sanfilippo, J.S. и Рао, К.В. (
1996
) Новое присутствие рецепторов лютеинизирующего гормона / хорионического гонадотропина в надпочечниках человека.J. Clin. Эндокринол.Метаб.
,81
,2397
–2400.Парк, О. К. и Мэйо, К. Э. (
1991
) Временная экспрессия матричной РНК рецептора прогестерона в клетках гранулезы яичников после преовуляторного выброса лютеинизирующего гормона.Мол. Эндокринол.
,5
,967
–978.Ричардс, Дж. (
1994
) Гормональный контроль экспрессии генов в яичнике.Endocr. Ред.
,15
,725
–751.Рилианавати, Паукку, Т., Kero, J., Zhang, F.-P., Rahman, N., Kananen, K. and Huhtaniemi, I. (
1998
) Прямое действие лютеинизирующего гормона запускает адренокортикальный туморогенез у кастрированных мышей, трансгенных по мышиному ингибину α. -субъединичный промотор / ген слияния 40 Т-антигена обезьяньего вируса.Мол. Эндокринол.
,12
,801
–809.Rosner, W. (
1991
) Стероид-связывающие белки плазмы.Endocr. Метаб. Clin. North Am.
,20
,697
–720.Scheele, F., Hompes, P.G.A., Lambalk, C..B., Schoute E., Broekmans, F.J. и Schoemaker, F.J. (
1996
) Тест на заражение GnRH: количественный показатель десенсибилизации гипофиза во время введения агониста GnRH.Clin. Эндокринол.
(Oxf.) ,44
,581
–586.Шоуп, Д., Мишелл, Д. Младший, Пейдж, М.А., Мадкур, Х., Шпиц, И.М. и Лобо, Р.А. (
1987
) Эффекты антипрогестерона RU 486 у нормальных женщин.II. Применение в поздней фолликулярной фазе.г. J. Obstet. Гинеколь.
,157
,1421
–1426.Simpson, E.R. и Waterman, M.R. (
1988
) Регулирование синтеза стероидогенных ферментов в клетках коры надпочечников с помощью АКТГ.Ann. Rev. Physiol.
,50
,427
–440.Урман, Б., Алатас, К., Аксой, С., Меркан, Р., Исиклар, А. и Балабан, Б. (
1999
) Повышенный уровень прогестерона в сыворотке крови в день введения ХГЧ не оказывает отрицательного воздействия. частота имплантации после интрацитоплазматической инъекции сперматозоидов и переноса эмбрионов.Fertil. Стерил.
,72
,975
–979.Вивейрос, М. и Liptrap, R.M. (
2000
) Лечение АКТГ нарушает выработку яичникового IGF-I и стероидных гормонов.J. Endocrinol.
,164
,255
–264.Wu, X.-K., Zhou, S.-Y., Sallinen, K., Pöllänen, P. and Erkkola, R. (
2000
) Перекрестные помехи между яичниками и надпочечниками при СПКЯ: данные клиновидной резекции.евро. J. Endocrinol.
,143
,383
–388.Яда, Х., Хосокава, К., Таджима, К., Хасегава, Й. и Коцудзи, Ф. (
1999
) Роль взаимодействия тека и гранулезных клеток яичника в выработке гормонов и росте клеток во время созревания фолликулов крупного рогатого скота процесс.Biol. Репродукция.
,61
,1480
–1486.© Европейское общество репродукции человека и эмбриологии
Уровни прогестерона в сыворотке крови во время фолликулярной фазы менструального цикла происходят из-за взаимодействия между яичниками и корой надпочечников | Репродукция человека
Аннотация
ИСТОРИЯ ВОПРОСА: Преовуляторный подъем прогестерона важен для овуляции, но как его регуляция, так и его происхождение спорны.Было проведено три эксперимента, чтобы определить, возникает ли прогестерон фолликулярной фазы из яичников, коры надпочечников или из обоих. МЕТОДЫ. Первое исследование было проведено на пациентах, которым была назначена вспомогательная репродуктивная система, которые получали агонист ГнРГ длительного действия либо во время приема орального контрацептива, либо во время лютеиновой фазы менструального цикла, не подвергавшегося лечению. Второе исследование также проводилось во время понижающей регуляции агонистом ГнРГ: некоторые пациенты с повышенным уровнем прогестерона получали дексаметазон (ДХМ).Другие пациенты с таким же повышенным базальным уровнем прогестерона и пациенты с низким уровнем прогестерона не получали ДХМ и служили контролем. Наконец, тесты на адренокортикотропный гормон (АКТГ) проводились у нормоциклических добровольцев как во время ранней и поздней фолликулярной фазы, так и во время приема противозачаточных таблеток. РЕЗУЛЬТАТЫ: Во время подавления секреции эндогенного гонадотропина уровень прогестерона повышался после введения АКТГ, но не ГнРГ. ДХМ не предотвращал преовуляторного повышения концентрации прогестерона в сыворотке.Концентрация прогестерона и 17α-гидроксипрогестерона, стимулированная АКТГ, значительно снижалась во время приема этинилэстрадиола. ВЫВОДЫ: Прогестерон возникает в коре надпочечников на протяжении большей части фолликулярной фазы, в результате чего его функция модулируется неизвестным фактором яичников, который подавляется этинилэстрадиолом. Источник прогестерона перемещается в яичники до овуляции.
Введение
Повышение сывороточных концентраций прогестерона и 17α-гидроксипрогестерона считается первым признаком надвигающейся овуляции, предшествующей всплеску ЛГ примерно на 12 часов (Hoff et al., 1983). У многих видов, включая человека, успешную овуляцию можно предотвратить с помощью антагонистов прогестерона или ингибиторов синтеза прогестерона (Collins and Hodgen, 1986; Liu et al. , 1987; Shoupe et al. , 1987; Batista et al. др. , 1992; Hibbert и др. , 1996). Гомозиготные трансгенные мыши, лишенные рецептора прогестерона, неспособны к овуляции, поэтому их ооциты остаются в ловушке неразорвавшихся фолликулов (Lydon et al., 1995). Несмотря на это экспериментальное свидетельство, рецептор прогестерона лишь слабо и временно экспрессируется в гранулезе зрелых графианских фолликулов (Iwai et al. , 1990; Park and Mayo, 1991). Сам по себе прогестерон не может вызвать овуляцию, но, по-видимому, опосредует действие ЛГ на фолликул Граафа до и во время овуляции (Brännström and Janson, 1989).
Несмотря на очевидную роль прогестерона в процессе овуляции, его источник в этот период менструального цикла не определен.Фермент, ответственный за синтез прогестерона, 3β-гидроксистероид дегидрогеназа (3β-HSD), экспрессируется в коре надпочечников, внутренней теке и, по крайней мере, у некоторых видов, также в гранулезе фолликула Граафия (Dupont et al. , 1990). В то время как некоторые авторы утверждают, что надпочечники вносят значительный вклад в преовуляторный прогестерон (Eldar-Geva et al. , 1998), другие считают яичник основным источником (Fanchin et al. , 1997; Urman et al., 1999). Помимо этих неопределенностей, ничего не известно о регуляторных сигналах, которые вызывают повышение уровня прогестерона в конце развития фолликулов.
В этом сообщении обобщены результаты трех проспективных экспериментов, которые были проведены для определения происхождения и регуляции секреции прогестерона в фолликулярной фазе у регулярно менструирующих женщин. Две серии экспериментов были выполнены во время десенсибилизации агонистом ГнРГ длительного действия у пациентов, получавших ЭКО или ИКСИ, поскольку это лечение эффективно снижает вклад стероидогенеза яичников.Третий эксперимент проводился на добровольцах с нормальной менструацией во время их естественного цикла, не получавшего лечения, а затем во время приема противозачаточных таблеток.
Материалы и методы
Первое исследование было разработано для изучения влияния любой остаточной гормональной активности предыдущего менструального цикла на уровни циркулирующего прогестерона во время последующего цикла. С этой целью пациенты получали этинилэстрадиол и дезогестрел во время приема агониста гонадолиберин пролонгированного действия.Второе исследование было разработано для оценки роли коры надпочечников на уровнях прогестерона во время фолликулярной фазы с использованием супрессора эндогенной активности кортикостероидов надпочечников, дексаметазона (ДХМ), у пациентов во время десенсибилизации агонистом ГнРГ длительного действия. Наконец, в третьем исследовании стимулятор стероидогенеза надпочечников, аденокортикотропный гормон (АКТГ), давали женщинам во время естественного менструального цикла, а затем во время приема орального контрацептива, содержащего этинилэстрадиол и дезогестрел.Три экспериментальных протокола визуализированы на Рисунке 1. Первое и второе клинические исследования, представленные ниже, были проведены в Институте репродуктивной медицины Университета Мюнстера, Германия, тогда как третье исследование проводилось в Университетской женской больнице Базеля. Швейцария. Все исследования были представлены в местные этические комитеты, и участники подписали форму информированного согласия.
Первое исследование: источник прогестерона во время подавления с помощью агониста ГнРГ длительного действия
В ходе рандомизированного проспективного исследования 23 пациента лечили гормональными противозачаточными таблетками, содержащими 50 мкг этинилэстрадиола и 0.125 мг дезогестрела, вводимого последовательно (Ovidol, Nourypharma, Oss, Нидерланды) во время менструального цикла, предшествующего лечению гонадотропинами. Во время лечения оральным контрацептивом внутримышечно вводили агонист ГнРГ длительного действия. (трипторелина ацетат, декапептил ретард; Ferring, Wallisellen, Швейцария) для последующего лечения с помощью ЭКО или ИКСИ. Другая группа из 32 женщин получала ацетат трипторелина во время лютеиновой фазы нелеченого менструального цикла. Все включенные пациенты имели нормальные овуляторные менструальные циклы, и ни у одной из них не было синдрома поликистозных яичников (СПКЯ) или каких-либо других эндокринных аномалий, влияющих на яичники или надпочечники.Рандомизация основывалась на месяце рождения женщины; те, у кого был четный месяц, получали гормональные противозачаточные средства, а те, у кого был неравный месяц, не получали никаких лекарств. Восемь пациентов отказались от участия в проспективном исследовании. После менструации была инициирована гиперстимуляция яичников гонадотропинами, и ее контролировали с помощью повторных измерений сывороточных концентраций 17β-эстрадиола и прогестерона вместе с вагинальными ультразвуковыми исследованиями, как описано ранее (De Geyter et al., 1994). Каждая пара была включена в исследование только один раз.
Кроме того, у 11 женщин тест на ГнРГ, состоящий из болюсной инъекции 100 мкг ГнРГ (Ферринга), и у 18 женщин тест на АКТГ, состоящий из болюса в / в. инъекции 250 мкг АКТГ (Synacthen; Ferring) были выполнены для оценки активности гипофизарно-яичниковой и гипофизарно-надпочечниковой оси соответственно во время десенсибилизации трипторелина ацетатом. Ответ ЛГ в тесте на заражение ГнРГ считается оптимальным для оценки десенсибилизации гипофиза во время лечения агонистами ГнРГ (Scheele et al., 1996). Тесты на ГнРГ и АКТГ были выполнены перед началом стимуляции яичников гонадотропинами. Все образцы сыворотки хранили замороженными при –20 ° C до анализа.
Второе исследование: подавление сывороточного уровня прогестерона в фолликулярной фазе с помощью DXM
ДХМ использовался для подавления выработки прогестерона надпочечниками и для наблюдения за вкладом яичников в уровни прогестерона во время фолликулярной фазы. Пациенты с регулярным менструальным циклом и нормальным овариальным резервом (по оценке уровня ФСГ третьего дня цикла <9 МЕ / л), но страдающие трубным бесплодием или мужским иммунологическим бесплодием, были набраны до их первого лечения с помощью ЭКО.У всех участников был нормальный овуляторный менструальный цикл, и ни один из них не страдал от СПКЯ или каких-либо явных эндокринных аномалий яичников или надпочечников. Концентрация прогестерона в сыворотке определялась в трех образцах сыворотки, взятых каждые 10 мин, во время подавления секреции эндогенного гонадотропина, что было достигнуто с помощью ацетата трипторелина на 2–3 недели ранее (декапептил ретард; Ferring). Пациенты, у которых все три базальные концентрации прогестерона в сыворотке равномерно> 2 нмоль / л во время подавления яичников получали ДХМ (1 мг в день, принимаемый перорально) для подавления секреции прогестерона надпочечниками на протяжении всей стимуляции яичников гонадотропинами.Одна контрольная группа пациентов с тремя последующими концентрациями прогестерона в сыворотке> 2 нмоль / л не получала ДХМ во время стимуляции яичников. Пациенты были рандомизированы по месяцу их рождения (пациенты с четным месяцем рождения лечились DXM, а пациенты с неравномерным месяцем рождения — нет). Пациенты с тремя последующими концентрациями прогестерона в сыворотке <2 нмоль / л и получавшие ЭКО впервые в течение того же периода составили дополнительную контрольную группу. Каждая пара была включена в исследование только один раз.Образцы сыворотки отбирали до стимуляции яичников и в день индукции овуляции с помощью ХГЧ (Profasi; Serono, Zug, Switzerland). Эти образцы сыворотки хранили замороженными при –20 ° C до анализа. Клинические данные пациентов, участвовавших в этом исследовании, и результаты лечения ДХМ обобщены в Таблице II.
Третье исследование: происхождение прогестерона в поздней фолликулярной фазе
Стимулирующие тесты надпочечников с помощью АКТГ были выполнены у девяти нормоциклических добровольцев для проверки их функции надпочечников во время естественного менструального цикла или во время приема 50 мкг этинилэстрадиола (Ovidol; Nourypharma).У всех участниц были регулярные менструальные циклы, и они не принимали никаких других лекарств. Их средний возраст составлял 28 лет (диапазон 22–39).
Все тесты на АКТГ проводились рано утром (с 8.00 до 10.00), и девяти участникам разрешили отдыхать, лежа на протяжении всей процедуры. Болюс внутривенный инъекции АКТГ (250 мкг болюса в / в) делали на 3-й день необработанного менструального цикла. Образцы сыворотки крови брали натощак в утренние часы за 30 и 0 минут до, а также через 30 и 60 минут после болюсного введения АКТГ.Второй тест на АКТГ проводился во время преовуляторного подъема прогестерона, который определялся путем ежедневного измерения ранним утром (например, 7.00–9.00) концентрации прогестерона в сыворотке, начиная с 12 дня необработанного менструального цикла. Дополнительный тест на АКТГ был проведен на 3 день следующего менструального цикла, после чего участники начали принимать 50 мкг этинилэстрадиола в течение 7 дней, затем 50 мкг этинилэстрадиола и 0,125 мг дезогестрела в течение дополнительных 15 дней (Ovidol; Nourypharma).Четвертый тест на АКТГ проводился через 7 дней лечения 50 мкг этинилэстрадиола ежедневно перед приемом дезогестрела. Образцы сыворотки хранили замороженными при –20 ° C до анализа.
Измерение концентрации гормонов
Все концентрации гормонов были измерены с помощью имеющихся в продаже наборов для анализа. Надежное измерение уровней прогестерона во время фолликулярной фазы менструального цикла требует систем анализа с высокой точностью на нижнем конце стандартной кривой.Для измерения прогестерона использовали две чувствительные системы анализа: SR1 (ImmunoChem, Фрайбург, Германия) и Elecsys (Roche Diagnostics, Базель, Швейцария), обе с аналитической чувствительностью 0,48 нмоль / л и функциональной чувствительностью 1,43 нмоль / л. , то есть самая низкая концентрация, которая может быть измерена воспроизводимо с коэффициентом вариации между анализами 20%. Во время первоначального тестирования результаты набора иммуноферментного анализа SR1 (ELISA) для измерения низких концентраций прогестерона сравнивались с коммерчески доступным радиоиммуноанализом (RIA; Biermann, Bad Nauheim, Германия), и была обнаружена высокая корреляция. значительный (0.811, P <0,00001). Коэффициенты вариаций между анализами и внутри анализов для измерений прогестерона, эстрадиола и ЛГ были ниже 10,1, 5,7 и 9,0% соответственно, определенные с контрольными растворами с концентрациями, установленными на уровне 5 нмоль / л, 196 пмоль / л и 15 МЕ / л соответственно. Концентрацию андростендиона измеряли с помощью RIA от Diagnostic Systems Laboratories I7nc. (DSL, Вебстер, Техас, США). Концентрацию 17β-гидроксипрогестерона измеряли с помощью RIA от Diagnostic Products Corporation (DPC, Лос-Анджелес, Калифорния, США).Для андростендиона и 17α-гидроксипрогестерона коэффициенты вариации между анализами и внутри анализов были ниже 7,1 и 8,4% соответственно, определенные с растворами с низкой концентрацией при 3,3 и 2,6 нмоль / л соответственно.
Статистический анализ
Данные были проанализированы с помощью теста Манна-Уитни U , Крускала Уоллиса или теста χ 2 , в зависимости от ситуации, с использованием пакета статистического программного обеспечения Statgraphics (Manugistics Inc., Роквилл, Массачусетс, США). Данные были представлены средними значениями вместе с их 95% доверительным интервалом во всех случаях.Уровень статистической значимости был установлен на уровне 5%.
Результаты
Происхождение прогестерона в ранней фолликулярной фазе
Клинические данные пациентов, участвовавших в этой части исследования, и результаты, полученные с помощью ЭКО или ИКСИ, суммированы в таблице I. Наблюдаемые сывороточные концентрации прогестерона во время начальной фазы фолликулярной фазы были ниже после предварительной обработки этинилэстрадиолом и дезогестрела, чем в циклах без предварительной обработки, но различия между обеими группами не достигли статистической значимости.Статистика Колмогорова-Смирнова, которая использовалась для анализа распределения концентраций прогестерона в обеих группах, была значительно ниже в циклах, предварительно обработанных этинилэстрадиолом и дезогестрелом (0,87 против 1,75, P <0,01), что указывает на более низкую дисперсию концентрации прогестерона после предварительной обработки оральными противозачаточными таблетками на последних стадиях развития фолликулов. Однако не было обнаружено различий ни в концентрации прогестерона в сыворотке, ни в их распределении между обеими группами.
Никаких изменений в циркулирующих сывороточных концентрациях прогестерона не было вызвано дозой 100 мкг ГнРГ во время десенсибилизации ацетатом трипторелина (рис. 2А), тогда как 250 мкг АКТГ вызывали немедленное и значительное повышение уровня прогестерона в сыворотке (рис. 2Б).
Влияние ДХМ на концентрацию прогестерона в сыворотке
Клинические данные вовлеченных пациентов и результаты их лечения сведены в Таблицу II. ДХМ вводили перорально во время стимуляции яичников (1 мг в день), чтобы изучить влияние подавления стероидогенеза надпочечников на сывороточные уровни прогестерона.
ДХМ эффективно снижал концентрацию прогестерона в сыворотке во время развития фолликулов у пациентов с изначально повышенными концентрациями прогестерона, но частота наступления беременности среди пациентов, получавших ДХМ, не отличалась от таковых с повышенным базальным уровнем прогестерона в сыворотке крови, оставшимся без лечения, и пациентов с низким базальным уровнем сывороточные уровни прогестерона. Концентрация прогестерона в сыворотке крови в день введения ХГЧ — у пациентов, не получавших ДХМ, несмотря на повышенную исходную концентрацию прогестерона в сыворотке, — повысилась значительно выше, чем у пациентов, получавших ДХМ ( P < 0.001).
Влияние АКТГ на секрецию стероидов коры надпочечников во время естественного менструального цикла и при приеме оральных контрацептивов
Более высокий рост уровня прогестерона у пациентов, у которых отсутствует подавление адренокортикального стероидогенеза под действием DXM, предполагает значительный вклад надпочечников в позднюю фолликулярную фазу. Таким образом, происхождение преовуляторного прогестерона было дополнительно проверено с использованием АКТГ для стимуляции стероидогенеза надпочечников. Для этого исследования были отобраны девять участниц с нормальным, нелеченным менструальным циклом.Результаты двух участников были исключены, поскольку овуляция произошла до второго теста на АКТГ. Результаты семи оставшихся участников были суммированы на рисунке 3. В то время как сывороточные концентрации прогестерона и 17α-гидроксипрогестерона значительно выросли через 30 и 60 минут после в / в. При введении АКТГ изменения, наблюдаемые для концентраций андростендиона до и после введения АКТГ, были статистически недостоверными ( P <0,05 и P <0.001 для прогестерона, P <0,001 для 17α-гидроксипрогестерона). Базальные концентрации прогестерона и 17α-гидроксипрогестерона до введения АКТГ были выше в поздней фолликулярной фазе по сравнению с ранней фолликулярной фазой. Однако различия базальных значений 17α-гидроксипрогестерона и прогестерона были значительными только по сравнению с таковыми после 7 дней лечения этинилэстрадиолом ( P, <0,02 и <0,01 соответственно).Изменения концентраций прогестерона и 17α-гидроксипрогестерона, вызванные АКТГ, во время поздней фолликулярной фазы не отличались от таковых во время ранней фолликулярной фазы. Повышение концентрации прогестерона, вызванное АКТГ, было значительно ниже во время приема этинилэстрадиола, чем во всех других проведенных тестах ( P <0,05).
Обсуждение
Несмотря на неопровержимые доказательства решающей роли прогестерона в овуляции, его происхождение и регуляция его секреции на протяжении фолликулярной фазы менструального цикла остаются плохо изученными.Фермент 3β-HSD, который необходим для превращения прегненолона в прогестерон, сильно экспрессируется во всей фолликулярной фазе в внутренней теке, а также в коре надпочечников, но не в клетках гранулезы (Bao and Garverick, 1998). У некоторых видов 3β-HSD может экспрессироваться в некоторых клетках гранулезы доминантного фолликула во время поздней фолликулярной фазы (Richards, 1994). Было обнаружено, что у морской свинки 3β-HSD экспрессируется в единственном слое гранулезных клеток, окружающих зрелый ооцит (Dupont et al., 1990), тогда как в клетках гранулез преовуляторных фолликулов свиней не удалось обнаружить экспрессию 3β-HSD (Conley et al. , 1994). Источник прогестерона поздней фолликулярной фазы в яичниках вызывает особую загадку в свете недавнего сообщения, демонстрирующего, что биосинтез прогестерона 3β-HSD ингибируется в присутствии высоких концентраций эстрадиола (Gilling-Smith et al. , 1997).
Кора надпочечников также может рассматриваться как важный источник прогестерона в поздней фолликулярной фазе (Eldar-Geva et al., 1998). Рецепторы ЛГ были обнаружены в коре надпочечников человека (Pabon et al. , 1996), что свидетельствует об участии этого органа в процессе овуляции. Напротив, у пациентов с СПКЯ повышенные уровни прогестерона и 17α-гидроксипрогестерона возникают в яичниках, а не в надпочечниках (Lachelin et al. , 1979; Chetkowski et al. , 1984; Azziz et al. , 1990). ). В настоящем сообщении описывается вклад коры надпочечников в циркуляцию прогестерона во время фолликулярной фазы у женщин с регулярными овуляторными менструальными циклами.
Настоящие данные четко показывают, что надпочечники являются основным секреторным источником циркулирующего прогестерона во время ранней фолликулярной фазы. Об этом свидетельствует быстрое повышение уровня прогестерона после введения АКТГ во время подавления секреции эндогенного гонадотропина ацетатом трипторелина. АКТГ стимулирует превращение холестерина в прегненолон в коре надпочечников (Simpson and Waterman, 1988), который быстро превращается в прогестерон, 17α-гидроксипрогестерон и андростендион ферментами 3β-HSD и 17α-гидроксилаза / 17,20-лиаза (цитохром P450c17) соответственно.Хотя длительное введение АКТГ, по-видимому, нарушает стероидогенез яичников (Viveiros and Liptrap, 2000), кратковременное введение, используемое в этом исследовании, могло не повлиять ни на одну из функций яичников.
Во время поздней фолликулярной фазы основной источник циркулирующего прогестерона смещается в сторону яичников, о чем свидетельствует отсутствие подавления ДХМ к концу развития фолликулов. На активность надпочечников не влияет циклическая активность яичников, о чем свидетельствует сходная реакция секреции прогестерона и 17α-гидроксипрогестерона, индуцированная АКТГ как в ранней, так и в поздней фолликулярной фазе естественного менструального цикла.
Однако важный аспект настоящего исследования выявил основной вклад коры надпочечников в уровни циркулирующего прогестерона во время преовуляторной фазы. Высокая концентрация прогестерона у некоторых пациентов значительно увеличивалась во время поздней фолликулярной фазы по сравнению с пациентами со стабильно низким уровнем прогестерона. По-видимому, существует индивидуальная уставка, которая определяет скорость секреции прогестерона как во внутренней теке, так и в коре надпочечников как в ранней фолликулярной фазе, так и в преовуляторной фазе.Яичники опосредуют роль коры надпочечников. Это демонстрируется подавляющим действием этинилэстрадиола как на базальную, так и на стимулируемую АКТГ концентрации прогестерона и 17α-гидроксипрогестерона. Аналогичный результат был представлен ранее Lobo et al. , которые обнаружили значительно сниженный выход андрогенов надпочечников после стимуляции АКТГ у женщин с овариэктомией по сравнению с женщинами с регулярной овуляцией (Lobo et al. , 1982). Хотя в этом исследовании было продемонстрировано прямое стимулирующее действие конъюгированных эстрогенов на стероидогенез надпочечников, наши данные предполагают скорее подавляющее действие этинилэстрадиола на реактивность надпочечников к АКТГ.
Пероральный этинилэстрадиол вызывает повышение уровня транскортина, который связывает не только кортизол, но и прогестерон (Rosner, 1991). Эффекты этинилэстрадиола в этом исследовании можно объяснить снижением доступности прогестерона из-за повышенного связывания с транскортином. Однако обе системы анализа измеряли общий сывороточный прогестерон: связанный и несвязанный. Таким образом, наши экспериментальные результаты предполагают снижение секреции прогестерона надпочечниками при подавлении функции яичников.
Присутствие эндокринных перекрестных помех между яичниками и корой надпочечников в гормональной регуляции менструального цикла предполагалось как экспериментально, так и клинически в прошлом. У всех трансгенных мышей с дефицитом α-субъединицы ингибина развиваются опухоли гонад (Matzuk et al. , 1994; Kananen et al. , 1995). У этих животных опухоли надпочечников будут развиваться после гонадэктомии, а смещение онкогенеза от гонад к коре надпочечников опосредуется ЛГ (Rilianawati et al., 1998). Другие примеры перекрестного взаимодействия между надпочечниками и яичниками обнаруживаются при СПКЯ, поскольку резекция клина яичников приводит к снижению реактивности прогестерона и концентраций 17α-гидроксипрогестерона после введения АКТГ (Wu et al. , 2000), а также у женщин с овариэктомией, у которых надпочечники андрогенез подавлен по сравнению с контрольной группой с регулярной овуляцией (Lobo et al. , 1982).
Настоящие результаты ясно демонстрируют, что надпочечники являются основным источником циркулирующего прогестерона во время раннего фолликулярного развития, тогда как яичники обеспечивают большую часть циркулирующего прогестерона во время поздней фолликулярной фазы.Наши данные также демонстрируют, что на стероидогенез надпочечников влияет действие яичников. Перекрестное взаимодействие между надпочечниками и яичниками может быть аналогично взаимодействию между гранулезой и внутренней текой, в которой синтез прогестерона в текальной области стимулируется гранулезой (Makris and Ryan, 1977; Kotsuji et al. , 1990; Yada et al. ). , 1999). Молекулярная природа эндокринных и паракринных медиаторов между гранулезой, внутренней текой и корой надпочечников еще предстоит определить.
Таблица I.Клинические характеристики пациенток, предварительно получавших 50 мкг этинилэстрадиола вместе с 0,125 мг дезогестрела и агониста ГнРГ, по сравнению с теми, кто получал только агонист ГнРГ во время предшествующего естественного менструального цикла
| . | Естественный цикл . | с предварительной обработкой . |
|---|---|---|
| a Ни одно из различий не было статистически значимым (критерий Манна – Уитни U ). | ||
| b Ни одно из различий не было статистически значимым (χ 2 -тест). | ||
| Кол-во пациентов | 32 | 23 |
| Возраст пациента (лет) | 33,9 ± 1,7 | 32,9 ± 2,1 a |
| лет 3615 лет ± 2,3 | 35,7 ± 2,5 a | |
| Продолжительность бесплодия (лет) | 6.6 ± 1,4 | 5,6 ± 1,1 a |
| Начальная концентрация прогестерона (нмоль / л) | 1,72 ± 0,64 | 1,16 ± 0,30 a |
| Прогестерон при введении ХГЧ 9040 нмоль / л | 4,53 ± 1,22 | 4,58 ± 1,34 a |
| Эстрадиол при введении ХГЧ (нмоль / л) | 6,14 ± 0,41 | 6,19 ± 0,84 a |
| Окоциты | 81/155 (52.3%) | 77/105 (73,3%) b |
| Достигнутая беременность (%) | 7 (21,9%) | 6 (26,1%) b |
| Естественный цикл . | с предварительной обработкой . | |||
|---|---|---|---|---|
| a Ни одно из различий не было статистически значимым (критерий Манна – Уитни U ). | ||||
| b Ни одно из различий не было статистически значимым (χ 2 -тест). | ||||
| Кол-во пациентов | 32 | 23 | ||
| Возраст пациента (лет) | 33,9 ± 1,7 | 32,9 ± 2,1 a | ||
| лет 3615 лет ± 2,3 | 35,7 ± 2,5 a | |||
| Продолжительность бесплодия (лет) | 6,6 ± 1,4 | 5,6 ± 1,1 a | ||
| Начальная концентрация прогестерона (нмоль / л) | 1 | 72 ± 0,64 | 1,16 ± 0,30 a | |
| Прогестерон при введении ХГЧ (нмоль / л) | 4,53 ± 1,22 | 4,58 ± 1,34 a | ||
| Эстрадиол при введении ХГЧ (нмоль / л) | 6,14 ± 0,41 | 6,19 ± 0,84 a | ||
| Оплодотворенные / осемененные ооциты (%) | 81/155 (52,3%) | 77/105 (73,3%) b 3 b | 3 90 достигнуто (%)7 (21.9%) | 6 (26,1%) b |
Клинические характеристики пациентов, предварительно получавших 50 мкг этинилэстрадиола вместе с 0,125 мг дезогестрела и агониста ГнРГ, по сравнению с пациентами, получавшими ГнРГ только агонист в течение предыдущего естественного менструального цикла
| . | Естественный цикл . | с предварительной обработкой . |
|---|---|---|
| a Ни одно из различий не было статистически значимым (критерий Манна – Уитни U ). | ||
| b Ни одно из различий не было статистически значимым (χ 2 -тест). | ||
| Кол-во пациентов | 32 | 23 |
| Возраст пациента (лет) | 33,9 ± 1,7 | 32,9 ± 2,1 a |
| лет 3615 лет ± 2,3 | 35,7 ± 2,5 a | |
| Продолжительность бесплодия (лет) | 6.6 ± 1,4 | 5,6 ± 1,1 a |
| Начальная концентрация прогестерона (нмоль / л) | 1,72 ± 0,64 | 1,16 ± 0,30 a |
| Прогестерон при введении ХГЧ 9040 нмоль / л | 4,53 ± 1,22 | 4,58 ± 1,34 a |
| Эстрадиол при введении ХГЧ (нмоль / л) | 6,14 ± 0,41 | 6,19 ± 0,84 a |
| Окоциты | 81/155 (52.3%) | 77/105 (73,3%) b |
| Достигнутая беременность (%) | 7 (21,9%) | 6 (26,1%) b |
| Естественный цикл . | с предварительной обработкой . | |||
|---|---|---|---|---|
| a Ни одно из различий не было статистически значимым (критерий Манна – Уитни U ). | ||||
| b Ни одно из различий не было статистически значимым (χ 2 -тест). | ||||
| Кол-во пациентов | 32 | 23 | ||
| Возраст пациента (лет) | 33,9 ± 1,7 | 32,9 ± 2,1 a | ||
| лет 3615 лет ± 2,3 | 35,7 ± 2,5 a | |||
| Продолжительность бесплодия (лет) | 6,6 ± 1,4 | 5,6 ± 1,1 a | ||
| Начальная концентрация прогестерона (нмоль / л) | 1 | 72 ± 0,64 | 1,16 ± 0,30 a | |
| Прогестерон при введении ХГЧ (нмоль / л) | 4,53 ± 1,22 | 4,58 ± 1,34 a | ||
| Эстрадиол при введении ХГЧ (нмоль / л) | 6,14 ± 0,41 | 6,19 ± 0,84 a | ||
| Оплодотворенные / осемененные ооциты (%) | 81/155 (52,3%) | 77/105 (73,3%) b 3 b | 3 90 достигнуто (%)7 (21.9%) | 6 (26,1%) б |
Влияние совместного лечения с ДХМ (принимаемым внутрь, 1 мг в день) во время стимуляции яичников гонадотропинами на концентрацию прогестерона в сыворотке во время развития фолликулов
| Концентрация прогестерона . | <2 нмоль / л . | > 2 нмоль / л с ДХМ . | > 2 нмоль / л без ДХМ . | ||||
|---|---|---|---|---|---|---|---|
| a Статистически значимая разница (тест Манна – Уитни U , P <0,001). | |||||||
| b Статистически значимая разница по сравнению с обоими другими значениями (тест Манна – Уитни U , P <0,0001). | |||||||
| Кол-во пациентов | 21 | 12 | 8 | ||||
| Продолжительность бесплодия (лет) | 6.0 ± 0,7 | 6,8 ± 0,9 | 5,6 ± 0,5 | ||||
| Возраст пациента (лет) | 32,0 ± 0,9 | 31,7 ± 1,5 | 32,1 ± 1,7 | ||||
| Возраст мужа (лет) | 35,0 ± 1,1 | 35,0 ± 2,7 | 35,9 ± 2,3 | ||||
| Исходный прогестерон (нмоль / л) | 1,05 ± 0,10 | 3,28 ± 0,19 a | 3,72 ± 0,73 a | Прогестерон при введении ХГЧ (нмоль /) | 4.23 ± 0,29 | 3,47 ± 0,57 | 7,38 ± 1,49 b |
| Эстрадиол при введении ХГЧ (нмоль / л) | 7,34 ± 1,47 | 7,71 ± 1,10 | 9,54 ± 2,20 9038 фолликулярная фаза (дни) | 12,9 ± 0,4 | 12,6 ± 0,4 | 12,7 ± 0,5 | |
| Введенный ФСГ (МЕ) | 4443 ± 348 | 4437 ± 530 | 3919 ± 556 | оплодотворенных / осемененных (%) | 66/102 (64.7) | 44/55 (80,0) | 34/40 (85,0) | |
| Достигнутая беременность (%) | 11 (52,4) | 7 (58,3) | 6 (75,0) | ||||
| Концентрация прогестерона . | <2 нмоль / л . | > 2 нмоль / л с ДХМ . | > 2 нмоль / л без ДХМ . | |||
|---|---|---|---|---|---|---|
| a Статистически значимая разница (тест Манна – Уитни U , P <0.001). | ||||||
| b Статистически значимая разница по сравнению с обоими другими значениями (тест Манна – Уитни U , P <0,0001). | ||||||
| Кол-во пациентов | 21 | 12 | 8 | |||
| Продолжительность бесплодия (лет) | 6,0 ± 0,7 | 6,8 ± 0,9 | 5,6 ± 0,5 | Пациент s возраст (лет)32,0 ± 0.9 | 31,7 ± 1,5 | 32,1 ± 1,7 |
| Возраст мужа (лет) | 35,0 ± 1,1 | 35,0 ± 2,7 | 35,9 ± 2,3 | |||
| Прогестерон исходный (нмоль2 / л) | 1,05 ± 0,10 | 3,28 ± 0,19 a | 3,72 ± 0,76 a | |||
| Прогестерон при введении ХГЧ (нмоль /) | 4,23 ± 0,29 | 3,47 ± 0,57 | b | |||
| Эстрадиол при введении ХГЧ (нмоль / л) | 7.34 ± 1,47 | 7,71 ± 1,10 | 9,54 ± 2,20 | |||
| Продолжительность фолликулярной фазы (дни) | 12,9 ± 0,4 | 12,6 ± 0,4 | 12,7 ± 0,5 | |||
| FSH402 4443 ± 348 | 4437 ± 530 | 3919 ± 556 | ||||
| Оплодотворенные / осемененные ооциты (%) | 66/102 (64,7) | 44/55 (80,0) | 34/40 (85,0) | |||
| Достигнутая беременность (%) | 11 (52.4) | 7 (58,3) | 6 (75,0) | |||
Влияние совместного лечения с ДХМ (принимаемым внутрь, 1 мг в день) во время стимуляции яичников гонадотропинами на концентрацию прогестерона в сыворотке во время развития фолликулов
| Концентрация прогестерона . | <2 нмоль / л . | > 2 нмоль / л с ДХМ . | > 2 нмоль / л без ДХМ . | ||||
|---|---|---|---|---|---|---|---|
| a Статистически значимая разница (тест Манна – Уитни U , P <0,001). | |||||||
| b Статистически значимая разница по сравнению с обоими другими значениями (тест Манна – Уитни U , P <0,0001). | |||||||
| Кол-во пациентов | 21 | 12 | 8 | ||||
| Продолжительность бесплодия (лет) | 6.0 ± 0,7 | 6,8 ± 0,9 | 5,6 ± 0,5 | ||||
| Возраст пациента (лет) | 32,0 ± 0,9 | 31,7 ± 1,5 | 32,1 ± 1,7 | ||||
| Возраст мужа (лет) | 35,0 ± 1,1 | 35,0 ± 2,7 | 35,9 ± 2,3 | ||||
| Исходный прогестерон (нмоль / л) | 1,05 ± 0,10 | 3,28 ± 0,19 a | 3,72 ± 0,73 a | Прогестерон при введении ХГЧ (нмоль /) | 4.23 ± 0,29 | 3,47 ± 0,57 | 7,38 ± 1,49 b |
| Эстрадиол при введении ХГЧ (нмоль / л) | 7,34 ± 1,47 | 7,71 ± 1,10 | 9,54 ± 2,20 9038 фолликулярная фаза (дни) | 12,9 ± 0,4 | 12,6 ± 0,4 | 12,7 ± 0,5 | |
| Введенный ФСГ (МЕ) | 4443 ± 348 | 4437 ± 530 | 3919 ± 556 | оплодотворенных / осемененных (%) | 66/102 (64.7) | 44/55 (80,0) | 34/40 (85,0) | |
| Достигнутая беременность (%) | 11 (52,4) | 7 (58,3) | 6 (75,0) | ||||
| Концентрация прогестерона . | <2 нмоль / л . | > 2 нмоль / л с ДХМ . | > 2 нмоль / л без ДХМ . | |||
|---|---|---|---|---|---|---|
| a Статистически значимая разница (тест Манна – Уитни U , P <0.001). | ||||||
| b Статистически значимая разница по сравнению с обоими другими значениями (тест Манна – Уитни U , P <0,0001). | ||||||
| Кол-во пациентов | 21 | 12 | 8 | |||
| Продолжительность бесплодия (лет) | 6,0 ± 0,7 | 6,8 ± 0,9 | 5,6 ± 0,5 | Пациент s возраст (лет)32,0 ± 0.9 | 31,7 ± 1,5 | 32,1 ± 1,7 |
| Возраст мужа (лет) | 35,0 ± 1,1 | 35,0 ± 2,7 | 35,9 ± 2,3 | |||
| Прогестерон исходный (нмоль2 / л) | 1,05 ± 0,10 | 3,28 ± 0,19 a | 3,72 ± 0,76 a | |||
| Прогестерон при введении ХГЧ (нмоль /) | 4,23 ± 0,29 | 3,47 ± 0,57 | b | |||
| Эстрадиол при введении ХГЧ (нмоль / л) | 7.34 ± 1,47 | 7,71 ± 1,10 | 9,54 ± 2,20 | |||
| Продолжительность фолликулярной фазы (дни) | 12,9 ± 0,4 | 12,6 ± 0,4 | 12,7 ± 0,5 | |||
| FSH402 4443 ± 348 | 4437 ± 530 | 3919 ± 556 | ||||
| Оплодотворенные / осемененные ооциты (%) | 66/102 (64,7) | 44/55 (80,0) | 34/40 (85,0) | |||
| Достигнутая беременность (%) | 11 (52.4) | 7 (58,3) | 6 (75,0) | |||
Рисунок 1.
Диаграммы трех экспериментальных протоколов.
Рисунок 1.
Диаграммы трех экспериментальных протоколов.
Рисунок 2.
Концентрации прогестерона в сыворотке крови в нмоль / л (черные столбцы) и ЛГ в МЕ / л (пустые столбцы) до и после болюса в / в. инъекция 100 мкг GnRH ( A ) или 250 мкг ACTH ( B ) во время подавления секреции эндогенного гонадотропина агонистом GnRH длительного действия.В то время как концентрации прогестерона и ЛГ не изменялись под действием ГнРГ, после введения АКТГ наблюдалось быстрое повышение концентрации прогестерона. * P <0,01 по сравнению с 0 мин.
Рис. 2.
Концентрации прогестерона в сыворотке крови в нмоль / л (черные столбцы) и ЛГ в МЕ / л (пустые столбцы) до и после болюса в / в. инъекция 100 мкг GnRH ( A ) или 250 мкг ACTH ( B ) во время подавления секреции эндогенного гонадотропина агонистом GnRH длительного действия.В то время как концентрации прогестерона и ЛГ не изменялись под действием ГнРГ, после введения АКТГ наблюдалось быстрое повышение концентрации прогестерона. * P <0,01 по сравнению с 0 мин.
Рисунок 3.
( a ) Концентрации прогестерона в сыворотке (верхняя панель), 17α-гидроксипрогестерона (средняя панель) и андростендиона (нижняя панель) за 30 минут до, непосредственно перед, 30 и 60 минут после болюсного внутривенного введения. инъекция 250 мкг АКТГ.Тесты на АКТГ проводились во время ранней фолликулярной фазы (A и C), один раз во время поздней фолликулярной фазы (B) и через 7 дней лечения 50 мкг этинилэстрадиола (D). Над каждым тестом на АКТГ указывается, был ли эндокринный ответ статистически значимым (Kruskal Wallis) от a до e и i, j и k P <0,05 f, g и h P <0,01 ( b ). Тесты на АКТГ во время поздней фолликулярной фазы (столбец B на рисунке 3a) проводились во время преовуляторного повышения прогестерона, показанного здесь.Последний определяли путем ежедневного измерения прогестерона ранним утром, начиная с 12-го дня необработанного менструального цикла.
Рисунок 3.
( a ) Концентрации прогестерона в сыворотке (верхняя панель), 17α-гидроксипрогестерона (средняя панель) и андростендиона (нижняя панель) за 30 минут до, непосредственно перед, через 30 и 60 минут после болюса внутривенно. инъекция 250 мкг АКТГ. Тесты на АКТГ проводились во время ранней фолликулярной фазы (A и C), один раз во время поздней фолликулярной фазы (B) и через 7 дней лечения 50 мкг этинилэстрадиола (D).Над каждым тестом на АКТГ указывается, был ли эндокринный ответ статистически значимым (Kruskal Wallis) от a до e и i, j и k P <0,05 f, g и h P <0,01 ( b ). Тесты на АКТГ во время поздней фолликулярной фазы (столбец B на рисунке 3a) проводились во время преовуляторного повышения прогестерона, показанного здесь. Последний определяли путем ежедневного измерения прогестерона ранним утром, начиная с 12-го дня необработанного менструального цикла.
Это исследование было поддержано грантом медицинского факультета Базельского университета.Мы благодарим г-жу Энн Катрин Фоэдж за техническую помощь. Мы также благодарны профессору Дж. Дж. Стаубу за его ценные советы при настройке протокола эксперимента.
Список литературы
Аззиз Р., Рафи А., Смит Б. Р., Брэдли Э. и Закур, Х.В. (
1990
) О происхождении повышенных уровней 17-гидроксипрогестерона после стимуляции надпочечников при гиперандрогении.J. Clin. Эндокринол. Метаб.
,70
,431
–436.Бао Б. и Гарверик Х.А. (
1998
) Экспрессия стероидогенных ферментов и генов рецепторов гонадотропина в фолликулах крупного рогатого скота во время фолликулярных волн яичников: обзор.J. Anim. Sci.
,76
,1903
–1921.Батиста, М.С., Картледж, Т.П., Зеллмер, А.В., Ниман, Л.К., Мерриам, Г.Р. и Loriaux, D.L. (
1992
) Доказательства критической роли прогестерона в регуляции выброса гонадотропинов в середине цикла и овуляции.J. Clin. Эндокринол. Метаб.
,74
,565
–570.Brännström, M. и Janson, P.O. (
1989
) Прогестерон является посредником в овуляторном процессе яичника крысы, перфузированного in vitro.Biol. Репродукция.
,40
,1170
–1178.Четковски, Р.Дж., Чанг, Р.Дж., ДеФазио, Дж., Мелдрам, Д. and Judd, H.L. (
1984
) Происхождение сывороточных прогестинов при СПКЯ.Акушерство. Гинеколь.
,64
,27
–31.Коллинз Р.Л. и Ходген Г.Д. (
1986
) Блокада спонтанного выброса гонадотропинов в середине цикла у обезьян с помощью RU486: антагонист или агонист прогестерона?J. Clin. Эндокринол. Метаб.
,63
,1270
–1276.Конли, А.Дж., Ховард, Х.Дж., Сленджер, В.Д. и Форд, Д.Дж. (
1994
) Стероидогенез в преовуляторном фолликуле свиньи.Biol. Репродукция.
,51
,655
–661.De Geyter, Ch., De Geyter, M., Simoni M., Castro, E., Bals-Pratsch, M., Nieschlag, E. and Schneider, H.P.G. (
1994
) Пульсирующее подкожное или болюсное внутримышечное введение гонадотропина после подавления гипофиза аналогом ГнРГ длительного действия: контролируемое проспективное исследование.Hum. Репродукция.
,9
,1070
–1076.Dupont, E., Luu-The, V., Labrie, F. и Pelletier, G. (
1990
) Световая микроскопическая иммуноцитохимическая локализация 3β-гидрокси-5-ен-стероиддегидрогеназы / β 5 -β 4 -изомераза в гонадах и надпочечниках морской свинки.Эндокринология
,126
,2906
–2909.Эльдар-Гева, Т., Маргалиот, Э.Дж., Брукс, Б., Алгур, Н., Зильбер-Харан, Э. и Диамант, Ю.З. (
1998
) Происхождение сывороточного прогестерона во время фолликулярной фазы менотропин-стимулированных циклов.Hum. Репродукция.
,13
,9
–14.Fanchin, R., Righini, C., Olivennes, R., Taieb, J., de Ziegler, D. and Frydman, R. (
1997
) Преждевременное повышение уровня прогестерона и андрогенов в плазме не предотвращается подавлением надпочечников в экстракорпоральное оплодотворение.Fertil. Стерил.
,67
,115
–119.Гиллинг-Смит, К., Уиллис, Д.С. и Фрэнкс, С. (
1997
) Эстрадиоловая обратная стимуляция биосинтеза андрогенов тека-клетками человека.Hum. Репродукция.
,12
,1621
–1628.Хибберт, М., Стоуфер, Р.Л., Вольф, Д.П. и Зелински-Вутен, М. (
1996
) Введение в середине цикла ингибитора синтеза прогестерона предотвращает овуляцию у приматов.Proc.Natl Acad. Sci. США
,93
,1897
–1901.Hoff, J.D., Quigley, M.E. and Yen, S.S.C. (
1983
) Гормональная динамика в середине цикла: переоценка.J. Clin. Эндокринол. Метаб.
,57
,792
–796.Iwai, T., Nanbu, Y., Iwai, M., Taii, S., Fujii, S. и Mori, T. (
1990
) Иммуногистохимическая локализация рецепторов эстрогена и рецепторов прогестерона в яичниках человека на всем протяжении менструальный цикл.Арка Вирхова. A. Pathol. Анат. Histopathol.
,417
,369
–375.Кананен, К., Марккула, М., Райнио, Ф., Су, Дж. Г. Сюэ, А.Дж. and Huhtaniemi, I.T. (
1995
) Гонадный онкогенез у трансгенных мышей, несущих промотор альфа-субъединицы мышиного ингибина / гибридный ген Т-антигена обезьяньего вируса: характеристика опухолей яичников и создание линий клеток гранулезы, чувствительных к гонадотрофам.Мол. Эндокринол.
,9
,616
–627.Коцудзи Ф., Камитани Н., Гото К. и Томинага Т. (
1990
) Взаимодействие тека и гранулезы крупного рогатого скота влияет на их рост, морфологию и функцию.Biol. Репродукция.
,43
,726
–732.Lachelin, G.C.L., Barnett, M., Hopper, B.R., Brink, G. and Yen, S.S.C. (
1979
) Функция надпочечников у здоровых женщин и женщин с СПКЯ.J. Clin. Эндокринол. Метаб.
,49
,892
–898.Лю Дж.H., Garzo, G., Morris, S., Stuenkel, C., Ulmann, A. и Yen, S.S.C. (
1987
) Нарушение созревания фолликулов и задержка овуляции после введения антипрогестерона RU486.J. Clin. Эндокринол. Метаб.
,65
,1135
–1140.Lobo, R.A., Goebelsmann, U., Brenner, P.F. и Мишелл, Д. Jr (
1982
) Влияние эстрогена на андрогены надпочечников у женщин после овариэктомии.г. J. Obstet. Гинеколь.
,142
,471
–478.Лайдон, Д.П., ДеМайо, Ф.Дж., Функ, К.Р., Мани, С.К., Хьюз, А.Р., Монтгомери-младший, К.А., Шьямала, Г., Коннели, О.М. и О’Мэлли, Б. (
1995
) У мышей, лишенных рецептора прогестерона, наблюдаются плейотропные репродуктивные аномалии.Genes Dev.
,9
,2266
–2278.Макрис А. и Райан Дж. Дж. (
1977
) Доказательства взаимодействия между клетками гранулезы и текой при раннем синтезе прогестерона.Endocr. Res. Comm.
,4
,233
–246.Мацук, М.М., Файнголд, М.Дж., Мазер, Дж. П., Краммен, Л., Лу, Х. и Брэдли, А. (
1994
) Развитие рака, кахексиального синдрома и опухолей надпочечников у мышей с дефицитом ингибина.Proc. Natl Acad. Sci. США
,91
,8817
–8821.Pabon, J.E., Li, X., Lei, Z.M., Sanfilippo, J.S. и Рао, К.В. (
1996
) Новое присутствие рецепторов лютеинизирующего гормона / хорионического гонадотропина в надпочечниках человека.J. Clin. Эндокринол.Метаб.
,81
,2397
–2400.Парк, О. К. и Мэйо, К. Э. (
1991
) Временная экспрессия матричной РНК рецептора прогестерона в клетках гранулезы яичников после преовуляторного выброса лютеинизирующего гормона.Мол. Эндокринол.
,5
,967
–978.Ричардс, Дж. (
1994
) Гормональный контроль экспрессии генов в яичнике.Endocr. Ред.
,15
,725
–751.Рилианавати, Паукку, Т., Kero, J., Zhang, F.-P., Rahman, N., Kananen, K. and Huhtaniemi, I. (
1998
) Прямое действие лютеинизирующего гормона запускает адренокортикальный туморогенез у кастрированных мышей, трансгенных по мышиному ингибину α. -субъединичный промотор / ген слияния 40 Т-антигена обезьяньего вируса.Мол. Эндокринол.
,12
,801
–809.Rosner, W. (
1991
) Стероид-связывающие белки плазмы.Endocr. Метаб. Clin. North Am.
,20
,697
–720.Scheele, F., Hompes, P.G.A., Lambalk, C..B., Schoute E., Broekmans, F.J. и Schoemaker, F.J. (
1996
) Тест на заражение GnRH: количественный показатель десенсибилизации гипофиза во время введения агониста GnRH.Clin. Эндокринол.
(Oxf.) ,44
,581
–586.Шоуп, Д., Мишелл, Д. Младший, Пейдж, М.А., Мадкур, Х., Шпиц, И.М. и Лобо, Р.А. (
1987
) Эффекты антипрогестерона RU 486 у нормальных женщин.II. Применение в поздней фолликулярной фазе.г. J. Obstet. Гинеколь.
,157
,1421
–1426.Simpson, E.R. и Waterman, M.R. (
1988
) Регулирование синтеза стероидогенных ферментов в клетках коры надпочечников с помощью АКТГ.Ann. Rev. Physiol.
,50
,427
–440.Урман, Б., Алатас, К., Аксой, С., Меркан, Р., Исиклар, А. и Балабан, Б. (
1999
) Повышенный уровень прогестерона в сыворотке крови в день введения ХГЧ не оказывает отрицательного воздействия. частота имплантации после интрацитоплазматической инъекции сперматозоидов и переноса эмбрионов.Fertil. Стерил.
,72
,975
–979.Вивейрос, М. и Liptrap, R.M. (
2000
) Лечение АКТГ нарушает выработку яичникового IGF-I и стероидных гормонов.J. Endocrinol.
,164
,255
–264.Wu, X.-K., Zhou, S.-Y., Sallinen, K., Pöllänen, P. and Erkkola, R. (
2000
) Перекрестные помехи между яичниками и надпочечниками при СПКЯ: данные клиновидной резекции.евро. J. Endocrinol.
,143
,383
–388.Яда, Х., Хосокава, К., Таджима, К., Хасегава, Й. и Коцудзи, Ф. (
1999
) Роль взаимодействия тека и гранулезных клеток яичника в выработке гормонов и росте клеток во время созревания фолликулов крупного рогатого скота процесс.Biol. Репродукция.
,61
,1480
–1486.© Европейское общество репродукции человека и эмбриологии
Уровни прогестерона в сыворотке крови во время фолликулярной фазы менструального цикла происходят из-за взаимодействия между яичниками и корой надпочечников | Репродукция человека
Аннотация
ИСТОРИЯ ВОПРОСА: Преовуляторный подъем прогестерона важен для овуляции, но как его регуляция, так и его происхождение спорны.Было проведено три эксперимента, чтобы определить, возникает ли прогестерон фолликулярной фазы из яичников, коры надпочечников или из обоих. МЕТОДЫ. Первое исследование было проведено на пациентах, которым была назначена вспомогательная репродуктивная система, которые получали агонист ГнРГ длительного действия либо во время приема орального контрацептива, либо во время лютеиновой фазы менструального цикла, не подвергавшегося лечению. Второе исследование также проводилось во время понижающей регуляции агонистом ГнРГ: некоторые пациенты с повышенным уровнем прогестерона получали дексаметазон (ДХМ).Другие пациенты с таким же повышенным базальным уровнем прогестерона и пациенты с низким уровнем прогестерона не получали ДХМ и служили контролем. Наконец, тесты на адренокортикотропный гормон (АКТГ) проводились у нормоциклических добровольцев как во время ранней и поздней фолликулярной фазы, так и во время приема противозачаточных таблеток. РЕЗУЛЬТАТЫ: Во время подавления секреции эндогенного гонадотропина уровень прогестерона повышался после введения АКТГ, но не ГнРГ. ДХМ не предотвращал преовуляторного повышения концентрации прогестерона в сыворотке.Концентрация прогестерона и 17α-гидроксипрогестерона, стимулированная АКТГ, значительно снижалась во время приема этинилэстрадиола. ВЫВОДЫ: Прогестерон возникает в коре надпочечников на протяжении большей части фолликулярной фазы, в результате чего его функция модулируется неизвестным фактором яичников, который подавляется этинилэстрадиолом. Источник прогестерона перемещается в яичники до овуляции.
Введение
Повышение сывороточных концентраций прогестерона и 17α-гидроксипрогестерона считается первым признаком надвигающейся овуляции, предшествующей всплеску ЛГ примерно на 12 часов (Hoff et al., 1983). У многих видов, включая человека, успешную овуляцию можно предотвратить с помощью антагонистов прогестерона или ингибиторов синтеза прогестерона (Collins and Hodgen, 1986; Liu et al. , 1987; Shoupe et al. , 1987; Batista et al. др. , 1992; Hibbert и др. , 1996). Гомозиготные трансгенные мыши, лишенные рецептора прогестерона, неспособны к овуляции, поэтому их ооциты остаются в ловушке неразорвавшихся фолликулов (Lydon et al., 1995). Несмотря на это экспериментальное свидетельство, рецептор прогестерона лишь слабо и временно экспрессируется в гранулезе зрелых графианских фолликулов (Iwai et al. , 1990; Park and Mayo, 1991). Сам по себе прогестерон не может вызвать овуляцию, но, по-видимому, опосредует действие ЛГ на фолликул Граафа до и во время овуляции (Brännström and Janson, 1989).
Несмотря на очевидную роль прогестерона в процессе овуляции, его источник в этот период менструального цикла не определен.Фермент, ответственный за синтез прогестерона, 3β-гидроксистероид дегидрогеназа (3β-HSD), экспрессируется в коре надпочечников, внутренней теке и, по крайней мере, у некоторых видов, также в гранулезе фолликула Граафия (Dupont et al. , 1990). В то время как некоторые авторы утверждают, что надпочечники вносят значительный вклад в преовуляторный прогестерон (Eldar-Geva et al. , 1998), другие считают яичник основным источником (Fanchin et al. , 1997; Urman et al., 1999). Помимо этих неопределенностей, ничего не известно о регуляторных сигналах, которые вызывают повышение уровня прогестерона в конце развития фолликулов.
В этом сообщении обобщены результаты трех проспективных экспериментов, которые были проведены для определения происхождения и регуляции секреции прогестерона в фолликулярной фазе у регулярно менструирующих женщин. Две серии экспериментов были выполнены во время десенсибилизации агонистом ГнРГ длительного действия у пациентов, получавших ЭКО или ИКСИ, поскольку это лечение эффективно снижает вклад стероидогенеза яичников.Третий эксперимент проводился на добровольцах с нормальной менструацией во время их естественного цикла, не получавшего лечения, а затем во время приема противозачаточных таблеток.
Материалы и методы
Первое исследование было разработано для изучения влияния любой остаточной гормональной активности предыдущего менструального цикла на уровни циркулирующего прогестерона во время последующего цикла. С этой целью пациенты получали этинилэстрадиол и дезогестрел во время приема агониста гонадолиберин пролонгированного действия.Второе исследование было разработано для оценки роли коры надпочечников на уровнях прогестерона во время фолликулярной фазы с использованием супрессора эндогенной активности кортикостероидов надпочечников, дексаметазона (ДХМ), у пациентов во время десенсибилизации агонистом ГнРГ длительного действия. Наконец, в третьем исследовании стимулятор стероидогенеза надпочечников, аденокортикотропный гормон (АКТГ), давали женщинам во время естественного менструального цикла, а затем во время приема орального контрацептива, содержащего этинилэстрадиол и дезогестрел.Три экспериментальных протокола визуализированы на Рисунке 1. Первое и второе клинические исследования, представленные ниже, были проведены в Институте репродуктивной медицины Университета Мюнстера, Германия, тогда как третье исследование проводилось в Университетской женской больнице Базеля. Швейцария. Все исследования были представлены в местные этические комитеты, и участники подписали форму информированного согласия.
Первое исследование: источник прогестерона во время подавления с помощью агониста ГнРГ длительного действия
В ходе рандомизированного проспективного исследования 23 пациента лечили гормональными противозачаточными таблетками, содержащими 50 мкг этинилэстрадиола и 0.125 мг дезогестрела, вводимого последовательно (Ovidol, Nourypharma, Oss, Нидерланды) во время менструального цикла, предшествующего лечению гонадотропинами. Во время лечения оральным контрацептивом внутримышечно вводили агонист ГнРГ длительного действия. (трипторелина ацетат, декапептил ретард; Ferring, Wallisellen, Швейцария) для последующего лечения с помощью ЭКО или ИКСИ. Другая группа из 32 женщин получала ацетат трипторелина во время лютеиновой фазы нелеченого менструального цикла. Все включенные пациенты имели нормальные овуляторные менструальные циклы, и ни у одной из них не было синдрома поликистозных яичников (СПКЯ) или каких-либо других эндокринных аномалий, влияющих на яичники или надпочечники.Рандомизация основывалась на месяце рождения женщины; те, у кого был четный месяц, получали гормональные противозачаточные средства, а те, у кого был неравный месяц, не получали никаких лекарств. Восемь пациентов отказались от участия в проспективном исследовании. После менструации была инициирована гиперстимуляция яичников гонадотропинами, и ее контролировали с помощью повторных измерений сывороточных концентраций 17β-эстрадиола и прогестерона вместе с вагинальными ультразвуковыми исследованиями, как описано ранее (De Geyter et al., 1994). Каждая пара была включена в исследование только один раз.
Кроме того, у 11 женщин тест на ГнРГ, состоящий из болюсной инъекции 100 мкг ГнРГ (Ферринга), и у 18 женщин тест на АКТГ, состоящий из болюса в / в. инъекции 250 мкг АКТГ (Synacthen; Ferring) были выполнены для оценки активности гипофизарно-яичниковой и гипофизарно-надпочечниковой оси соответственно во время десенсибилизации трипторелина ацетатом. Ответ ЛГ в тесте на заражение ГнРГ считается оптимальным для оценки десенсибилизации гипофиза во время лечения агонистами ГнРГ (Scheele et al., 1996). Тесты на ГнРГ и АКТГ были выполнены перед началом стимуляции яичников гонадотропинами. Все образцы сыворотки хранили замороженными при –20 ° C до анализа.
Второе исследование: подавление сывороточного уровня прогестерона в фолликулярной фазе с помощью DXM
ДХМ использовался для подавления выработки прогестерона надпочечниками и для наблюдения за вкладом яичников в уровни прогестерона во время фолликулярной фазы. Пациенты с регулярным менструальным циклом и нормальным овариальным резервом (по оценке уровня ФСГ третьего дня цикла <9 МЕ / л), но страдающие трубным бесплодием или мужским иммунологическим бесплодием, были набраны до их первого лечения с помощью ЭКО.У всех участников был нормальный овуляторный менструальный цикл, и ни один из них не страдал от СПКЯ или каких-либо явных эндокринных аномалий яичников или надпочечников. Концентрация прогестерона в сыворотке определялась в трех образцах сыворотки, взятых каждые 10 мин, во время подавления секреции эндогенного гонадотропина, что было достигнуто с помощью ацетата трипторелина на 2–3 недели ранее (декапептил ретард; Ferring). Пациенты, у которых все три базальные концентрации прогестерона в сыворотке равномерно> 2 нмоль / л во время подавления яичников получали ДХМ (1 мг в день, принимаемый перорально) для подавления секреции прогестерона надпочечниками на протяжении всей стимуляции яичников гонадотропинами.Одна контрольная группа пациентов с тремя последующими концентрациями прогестерона в сыворотке> 2 нмоль / л не получала ДХМ во время стимуляции яичников. Пациенты были рандомизированы по месяцу их рождения (пациенты с четным месяцем рождения лечились DXM, а пациенты с неравномерным месяцем рождения — нет). Пациенты с тремя последующими концентрациями прогестерона в сыворотке <2 нмоль / л и получавшие ЭКО впервые в течение того же периода составили дополнительную контрольную группу. Каждая пара была включена в исследование только один раз.Образцы сыворотки отбирали до стимуляции яичников и в день индукции овуляции с помощью ХГЧ (Profasi; Serono, Zug, Switzerland). Эти образцы сыворотки хранили замороженными при –20 ° C до анализа. Клинические данные пациентов, участвовавших в этом исследовании, и результаты лечения ДХМ обобщены в Таблице II.
Третье исследование: происхождение прогестерона в поздней фолликулярной фазе
Стимулирующие тесты надпочечников с помощью АКТГ были выполнены у девяти нормоциклических добровольцев для проверки их функции надпочечников во время естественного менструального цикла или во время приема 50 мкг этинилэстрадиола (Ovidol; Nourypharma).У всех участниц были регулярные менструальные циклы, и они не принимали никаких других лекарств. Их средний возраст составлял 28 лет (диапазон 22–39).
Все тесты на АКТГ проводились рано утром (с 8.00 до 10.00), и девяти участникам разрешили отдыхать, лежа на протяжении всей процедуры. Болюс внутривенный инъекции АКТГ (250 мкг болюса в / в) делали на 3-й день необработанного менструального цикла. Образцы сыворотки крови брали натощак в утренние часы за 30 и 0 минут до, а также через 30 и 60 минут после болюсного введения АКТГ.Второй тест на АКТГ проводился во время преовуляторного подъема прогестерона, который определялся путем ежедневного измерения ранним утром (например, 7.00–9.00) концентрации прогестерона в сыворотке, начиная с 12 дня необработанного менструального цикла. Дополнительный тест на АКТГ был проведен на 3 день следующего менструального цикла, после чего участники начали принимать 50 мкг этинилэстрадиола в течение 7 дней, затем 50 мкг этинилэстрадиола и 0,125 мг дезогестрела в течение дополнительных 15 дней (Ovidol; Nourypharma).Четвертый тест на АКТГ проводился через 7 дней лечения 50 мкг этинилэстрадиола ежедневно перед приемом дезогестрела. Образцы сыворотки хранили замороженными при –20 ° C до анализа.
Измерение концентрации гормонов
Все концентрации гормонов были измерены с помощью имеющихся в продаже наборов для анализа. Надежное измерение уровней прогестерона во время фолликулярной фазы менструального цикла требует систем анализа с высокой точностью на нижнем конце стандартной кривой.Для измерения прогестерона использовали две чувствительные системы анализа: SR1 (ImmunoChem, Фрайбург, Германия) и Elecsys (Roche Diagnostics, Базель, Швейцария), обе с аналитической чувствительностью 0,48 нмоль / л и функциональной чувствительностью 1,43 нмоль / л. , то есть самая низкая концентрация, которая может быть измерена воспроизводимо с коэффициентом вариации между анализами 20%. Во время первоначального тестирования результаты набора иммуноферментного анализа SR1 (ELISA) для измерения низких концентраций прогестерона сравнивались с коммерчески доступным радиоиммуноанализом (RIA; Biermann, Bad Nauheim, Германия), и была обнаружена высокая корреляция. значительный (0.811, P <0,00001). Коэффициенты вариаций между анализами и внутри анализов для измерений прогестерона, эстрадиола и ЛГ были ниже 10,1, 5,7 и 9,0% соответственно, определенные с контрольными растворами с концентрациями, установленными на уровне 5 нмоль / л, 196 пмоль / л и 15 МЕ / л соответственно. Концентрацию андростендиона измеряли с помощью RIA от Diagnostic Systems Laboratories I7nc. (DSL, Вебстер, Техас, США). Концентрацию 17β-гидроксипрогестерона измеряли с помощью RIA от Diagnostic Products Corporation (DPC, Лос-Анджелес, Калифорния, США).Для андростендиона и 17α-гидроксипрогестерона коэффициенты вариации между анализами и внутри анализов были ниже 7,1 и 8,4% соответственно, определенные с растворами с низкой концентрацией при 3,3 и 2,6 нмоль / л соответственно.
Статистический анализ
Данные были проанализированы с помощью теста Манна-Уитни U , Крускала Уоллиса или теста χ 2 , в зависимости от ситуации, с использованием пакета статистического программного обеспечения Statgraphics (Manugistics Inc., Роквилл, Массачусетс, США). Данные были представлены средними значениями вместе с их 95% доверительным интервалом во всех случаях.Уровень статистической значимости был установлен на уровне 5%.
Результаты
Происхождение прогестерона в ранней фолликулярной фазе
Клинические данные пациентов, участвовавших в этой части исследования, и результаты, полученные с помощью ЭКО или ИКСИ, суммированы в таблице I. Наблюдаемые сывороточные концентрации прогестерона во время начальной фазы фолликулярной фазы были ниже после предварительной обработки этинилэстрадиолом и дезогестрела, чем в циклах без предварительной обработки, но различия между обеими группами не достигли статистической значимости.Статистика Колмогорова-Смирнова, которая использовалась для анализа распределения концентраций прогестерона в обеих группах, была значительно ниже в циклах, предварительно обработанных этинилэстрадиолом и дезогестрелом (0,87 против 1,75, P <0,01), что указывает на более низкую дисперсию концентрации прогестерона после предварительной обработки оральными противозачаточными таблетками на последних стадиях развития фолликулов. Однако не было обнаружено различий ни в концентрации прогестерона в сыворотке, ни в их распределении между обеими группами.
Никаких изменений в циркулирующих сывороточных концентрациях прогестерона не было вызвано дозой 100 мкг ГнРГ во время десенсибилизации ацетатом трипторелина (рис. 2А), тогда как 250 мкг АКТГ вызывали немедленное и значительное повышение уровня прогестерона в сыворотке (рис. 2Б).
Влияние ДХМ на концентрацию прогестерона в сыворотке
Клинические данные вовлеченных пациентов и результаты их лечения сведены в Таблицу II. ДХМ вводили перорально во время стимуляции яичников (1 мг в день), чтобы изучить влияние подавления стероидогенеза надпочечников на сывороточные уровни прогестерона.
ДХМ эффективно снижал концентрацию прогестерона в сыворотке во время развития фолликулов у пациентов с изначально повышенными концентрациями прогестерона, но частота наступления беременности среди пациентов, получавших ДХМ, не отличалась от таковых с повышенным базальным уровнем прогестерона в сыворотке крови, оставшимся без лечения, и пациентов с низким базальным уровнем сывороточные уровни прогестерона. Концентрация прогестерона в сыворотке крови в день введения ХГЧ — у пациентов, не получавших ДХМ, несмотря на повышенную исходную концентрацию прогестерона в сыворотке, — повысилась значительно выше, чем у пациентов, получавших ДХМ ( P < 0.001).
Влияние АКТГ на секрецию стероидов коры надпочечников во время естественного менструального цикла и при приеме оральных контрацептивов
Более высокий рост уровня прогестерона у пациентов, у которых отсутствует подавление адренокортикального стероидогенеза под действием DXM, предполагает значительный вклад надпочечников в позднюю фолликулярную фазу. Таким образом, происхождение преовуляторного прогестерона было дополнительно проверено с использованием АКТГ для стимуляции стероидогенеза надпочечников. Для этого исследования были отобраны девять участниц с нормальным, нелеченным менструальным циклом.Результаты двух участников были исключены, поскольку овуляция произошла до второго теста на АКТГ. Результаты семи оставшихся участников были суммированы на рисунке 3. В то время как сывороточные концентрации прогестерона и 17α-гидроксипрогестерона значительно выросли через 30 и 60 минут после в / в. При введении АКТГ изменения, наблюдаемые для концентраций андростендиона до и после введения АКТГ, были статистически недостоверными ( P <0,05 и P <0.001 для прогестерона, P <0,001 для 17α-гидроксипрогестерона). Базальные концентрации прогестерона и 17α-гидроксипрогестерона до введения АКТГ были выше в поздней фолликулярной фазе по сравнению с ранней фолликулярной фазой. Однако различия базальных значений 17α-гидроксипрогестерона и прогестерона были значительными только по сравнению с таковыми после 7 дней лечения этинилэстрадиолом ( P, <0,02 и <0,01 соответственно).Изменения концентраций прогестерона и 17α-гидроксипрогестерона, вызванные АКТГ, во время поздней фолликулярной фазы не отличались от таковых во время ранней фолликулярной фазы. Повышение концентрации прогестерона, вызванное АКТГ, было значительно ниже во время приема этинилэстрадиола, чем во всех других проведенных тестах ( P <0,05).
Обсуждение
Несмотря на неопровержимые доказательства решающей роли прогестерона в овуляции, его происхождение и регуляция его секреции на протяжении фолликулярной фазы менструального цикла остаются плохо изученными.Фермент 3β-HSD, который необходим для превращения прегненолона в прогестерон, сильно экспрессируется во всей фолликулярной фазе в внутренней теке, а также в коре надпочечников, но не в клетках гранулезы (Bao and Garverick, 1998). У некоторых видов 3β-HSD может экспрессироваться в некоторых клетках гранулезы доминантного фолликула во время поздней фолликулярной фазы (Richards, 1994). Было обнаружено, что у морской свинки 3β-HSD экспрессируется в единственном слое гранулезных клеток, окружающих зрелый ооцит (Dupont et al., 1990), тогда как в клетках гранулез преовуляторных фолликулов свиней не удалось обнаружить экспрессию 3β-HSD (Conley et al. , 1994). Источник прогестерона поздней фолликулярной фазы в яичниках вызывает особую загадку в свете недавнего сообщения, демонстрирующего, что биосинтез прогестерона 3β-HSD ингибируется в присутствии высоких концентраций эстрадиола (Gilling-Smith et al. , 1997).
Кора надпочечников также может рассматриваться как важный источник прогестерона в поздней фолликулярной фазе (Eldar-Geva et al., 1998). Рецепторы ЛГ были обнаружены в коре надпочечников человека (Pabon et al. , 1996), что свидетельствует об участии этого органа в процессе овуляции. Напротив, у пациентов с СПКЯ повышенные уровни прогестерона и 17α-гидроксипрогестерона возникают в яичниках, а не в надпочечниках (Lachelin et al. , 1979; Chetkowski et al. , 1984; Azziz et al. , 1990). ). В настоящем сообщении описывается вклад коры надпочечников в циркуляцию прогестерона во время фолликулярной фазы у женщин с регулярными овуляторными менструальными циклами.
Настоящие данные четко показывают, что надпочечники являются основным секреторным источником циркулирующего прогестерона во время ранней фолликулярной фазы. Об этом свидетельствует быстрое повышение уровня прогестерона после введения АКТГ во время подавления секреции эндогенного гонадотропина ацетатом трипторелина. АКТГ стимулирует превращение холестерина в прегненолон в коре надпочечников (Simpson and Waterman, 1988), который быстро превращается в прогестерон, 17α-гидроксипрогестерон и андростендион ферментами 3β-HSD и 17α-гидроксилаза / 17,20-лиаза (цитохром P450c17) соответственно.Хотя длительное введение АКТГ, по-видимому, нарушает стероидогенез яичников (Viveiros and Liptrap, 2000), кратковременное введение, используемое в этом исследовании, могло не повлиять ни на одну из функций яичников.
Во время поздней фолликулярной фазы основной источник циркулирующего прогестерона смещается в сторону яичников, о чем свидетельствует отсутствие подавления ДХМ к концу развития фолликулов. На активность надпочечников не влияет циклическая активность яичников, о чем свидетельствует сходная реакция секреции прогестерона и 17α-гидроксипрогестерона, индуцированная АКТГ как в ранней, так и в поздней фолликулярной фазе естественного менструального цикла.
Однако важный аспект настоящего исследования выявил основной вклад коры надпочечников в уровни циркулирующего прогестерона во время преовуляторной фазы. Высокая концентрация прогестерона у некоторых пациентов значительно увеличивалась во время поздней фолликулярной фазы по сравнению с пациентами со стабильно низким уровнем прогестерона. По-видимому, существует индивидуальная уставка, которая определяет скорость секреции прогестерона как во внутренней теке, так и в коре надпочечников как в ранней фолликулярной фазе, так и в преовуляторной фазе.Яичники опосредуют роль коры надпочечников. Это демонстрируется подавляющим действием этинилэстрадиола как на базальную, так и на стимулируемую АКТГ концентрации прогестерона и 17α-гидроксипрогестерона. Аналогичный результат был представлен ранее Lobo et al. , которые обнаружили значительно сниженный выход андрогенов надпочечников после стимуляции АКТГ у женщин с овариэктомией по сравнению с женщинами с регулярной овуляцией (Lobo et al. , 1982). Хотя в этом исследовании было продемонстрировано прямое стимулирующее действие конъюгированных эстрогенов на стероидогенез надпочечников, наши данные предполагают скорее подавляющее действие этинилэстрадиола на реактивность надпочечников к АКТГ.
Пероральный этинилэстрадиол вызывает повышение уровня транскортина, который связывает не только кортизол, но и прогестерон (Rosner, 1991). Эффекты этинилэстрадиола в этом исследовании можно объяснить снижением доступности прогестерона из-за повышенного связывания с транскортином. Однако обе системы анализа измеряли общий сывороточный прогестерон: связанный и несвязанный. Таким образом, наши экспериментальные результаты предполагают снижение секреции прогестерона надпочечниками при подавлении функции яичников.
Присутствие эндокринных перекрестных помех между яичниками и корой надпочечников в гормональной регуляции менструального цикла предполагалось как экспериментально, так и клинически в прошлом. У всех трансгенных мышей с дефицитом α-субъединицы ингибина развиваются опухоли гонад (Matzuk et al. , 1994; Kananen et al. , 1995). У этих животных опухоли надпочечников будут развиваться после гонадэктомии, а смещение онкогенеза от гонад к коре надпочечников опосредуется ЛГ (Rilianawati et al., 1998). Другие примеры перекрестного взаимодействия между надпочечниками и яичниками обнаруживаются при СПКЯ, поскольку резекция клина яичников приводит к снижению реактивности прогестерона и концентраций 17α-гидроксипрогестерона после введения АКТГ (Wu et al. , 2000), а также у женщин с овариэктомией, у которых надпочечники андрогенез подавлен по сравнению с контрольной группой с регулярной овуляцией (Lobo et al. , 1982).
Настоящие результаты ясно демонстрируют, что надпочечники являются основным источником циркулирующего прогестерона во время раннего фолликулярного развития, тогда как яичники обеспечивают большую часть циркулирующего прогестерона во время поздней фолликулярной фазы.Наши данные также демонстрируют, что на стероидогенез надпочечников влияет действие яичников. Перекрестное взаимодействие между надпочечниками и яичниками может быть аналогично взаимодействию между гранулезой и внутренней текой, в которой синтез прогестерона в текальной области стимулируется гранулезой (Makris and Ryan, 1977; Kotsuji et al. , 1990; Yada et al. ). , 1999). Молекулярная природа эндокринных и паракринных медиаторов между гранулезой, внутренней текой и корой надпочечников еще предстоит определить.
Таблица I.Клинические характеристики пациенток, предварительно получавших 50 мкг этинилэстрадиола вместе с 0,125 мг дезогестрела и агониста ГнРГ, по сравнению с теми, кто получал только агонист ГнРГ во время предшествующего естественного менструального цикла
| . | Естественный цикл . | с предварительной обработкой . |
|---|---|---|
| a Ни одно из различий не было статистически значимым (критерий Манна – Уитни U ). | ||
| b Ни одно из различий не было статистически значимым (χ 2 -тест). | ||
| Кол-во пациентов | 32 | 23 |
| Возраст пациента (лет) | 33,9 ± 1,7 | 32,9 ± 2,1 a |
| лет 3615 лет ± 2,3 | 35,7 ± 2,5 a | |
| Продолжительность бесплодия (лет) | 6.6 ± 1,4 | 5,6 ± 1,1 a |
| Начальная концентрация прогестерона (нмоль / л) | 1,72 ± 0,64 | 1,16 ± 0,30 a |
| Прогестерон при введении ХГЧ 9040 нмоль / л | 4,53 ± 1,22 | 4,58 ± 1,34 a |
| Эстрадиол при введении ХГЧ (нмоль / л) | 6,14 ± 0,41 | 6,19 ± 0,84 a |
| Окоциты | 81/155 (52.3%) | 77/105 (73,3%) b |
| Достигнутая беременность (%) | 7 (21,9%) | 6 (26,1%) b |
| Естественный цикл . | с предварительной обработкой . | |||
|---|---|---|---|---|
| a Ни одно из различий не было статистически значимым (критерий Манна – Уитни U ). | ||||
| b Ни одно из различий не было статистически значимым (χ 2 -тест). | ||||
| Кол-во пациентов | 32 | 23 | ||
| Возраст пациента (лет) | 33,9 ± 1,7 | 32,9 ± 2,1 a | ||
| лет 3615 лет ± 2,3 | 35,7 ± 2,5 a | |||
| Продолжительность бесплодия (лет) | 6,6 ± 1,4 | 5,6 ± 1,1 a | ||
| Начальная концентрация прогестерона (нмоль / л) | 1 | 72 ± 0,64 | 1,16 ± 0,30 a | |
| Прогестерон при введении ХГЧ (нмоль / л) | 4,53 ± 1,22 | 4,58 ± 1,34 a | ||
| Эстрадиол при введении ХГЧ (нмоль / л) | 6,14 ± 0,41 | 6,19 ± 0,84 a | ||
| Оплодотворенные / осемененные ооциты (%) | 81/155 (52,3%) | 77/105 (73,3%) b 3 b | 3 90 достигнуто (%)7 (21.9%) | 6 (26,1%) b |
Клинические характеристики пациентов, предварительно получавших 50 мкг этинилэстрадиола вместе с 0,125 мг дезогестрела и агониста ГнРГ, по сравнению с пациентами, получавшими ГнРГ только агонист в течение предыдущего естественного менструального цикла
| . | Естественный цикл . | с предварительной обработкой . |
|---|---|---|
| a Ни одно из различий не было статистически значимым (критерий Манна – Уитни U ). | ||
| b Ни одно из различий не было статистически значимым (χ 2 -тест). | ||
| Кол-во пациентов | 32 | 23 |
| Возраст пациента (лет) | 33,9 ± 1,7 | 32,9 ± 2,1 a |
| лет 3615 лет ± 2,3 | 35,7 ± 2,5 a | |
| Продолжительность бесплодия (лет) | 6.6 ± 1,4 | 5,6 ± 1,1 a |
| Начальная концентрация прогестерона (нмоль / л) | 1,72 ± 0,64 | 1,16 ± 0,30 a |
| Прогестерон при введении ХГЧ 9040 нмоль / л | 4,53 ± 1,22 | 4,58 ± 1,34 a |
| Эстрадиол при введении ХГЧ (нмоль / л) | 6,14 ± 0,41 | 6,19 ± 0,84 a |
| Окоциты | 81/155 (52.3%) | 77/105 (73,3%) b |
| Достигнутая беременность (%) | 7 (21,9%) | 6 (26,1%) b |
| Естественный цикл . | с предварительной обработкой . | |||
|---|---|---|---|---|
| a Ни одно из различий не было статистически значимым (критерий Манна – Уитни U ). | ||||
| b Ни одно из различий не было статистически значимым (χ 2 -тест). | ||||
| Кол-во пациентов | 32 | 23 | ||
| Возраст пациента (лет) | 33,9 ± 1,7 | 32,9 ± 2,1 a | ||
| лет 3615 лет ± 2,3 | 35,7 ± 2,5 a | |||
| Продолжительность бесплодия (лет) | 6,6 ± 1,4 | 5,6 ± 1,1 a | ||
| Начальная концентрация прогестерона (нмоль / л) | 1 | 72 ± 0,64 | 1,16 ± 0,30 a | |
| Прогестерон при введении ХГЧ (нмоль / л) | 4,53 ± 1,22 | 4,58 ± 1,34 a | ||
| Эстрадиол при введении ХГЧ (нмоль / л) | 6,14 ± 0,41 | 6,19 ± 0,84 a | ||
| Оплодотворенные / осемененные ооциты (%) | 81/155 (52,3%) | 77/105 (73,3%) b 3 b | 3 90 достигнуто (%)7 (21.9%) | 6 (26,1%) б |
Влияние совместного лечения с ДХМ (принимаемым внутрь, 1 мг в день) во время стимуляции яичников гонадотропинами на концентрацию прогестерона в сыворотке во время развития фолликулов
| Концентрация прогестерона . | <2 нмоль / л . | > 2 нмоль / л с ДХМ . | > 2 нмоль / л без ДХМ . | ||||
|---|---|---|---|---|---|---|---|
| a Статистически значимая разница (тест Манна – Уитни U , P <0,001). | |||||||
| b Статистически значимая разница по сравнению с обоими другими значениями (тест Манна – Уитни U , P <0,0001). | |||||||
| Кол-во пациентов | 21 | 12 | 8 | ||||
| Продолжительность бесплодия (лет) | 6.0 ± 0,7 | 6,8 ± 0,9 | 5,6 ± 0,5 | ||||
| Возраст пациента (лет) | 32,0 ± 0,9 | 31,7 ± 1,5 | 32,1 ± 1,7 | ||||
| Возраст мужа (лет) | 35,0 ± 1,1 | 35,0 ± 2,7 | 35,9 ± 2,3 | ||||
| Исходный прогестерон (нмоль / л) | 1,05 ± 0,10 | 3,28 ± 0,19 a | 3,72 ± 0,73 a | Прогестерон при введении ХГЧ (нмоль /) | 4.23 ± 0,29 | 3,47 ± 0,57 | 7,38 ± 1,49 b |
| Эстрадиол при введении ХГЧ (нмоль / л) | 7,34 ± 1,47 | 7,71 ± 1,10 | 9,54 ± 2,20 9038 фолликулярная фаза (дни) | 12,9 ± 0,4 | 12,6 ± 0,4 | 12,7 ± 0,5 | |
| Введенный ФСГ (МЕ) | 4443 ± 348 | 4437 ± 530 | 3919 ± 556 | оплодотворенных / осемененных (%) | 66/102 (64.7) | 44/55 (80,0) | 34/40 (85,0) | |
| Достигнутая беременность (%) | 11 (52,4) | 7 (58,3) | 6 (75,0) | ||||
| Концентрация прогестерона . | <2 нмоль / л . | > 2 нмоль / л с ДХМ . | > 2 нмоль / л без ДХМ . | |||
|---|---|---|---|---|---|---|
| a Статистически значимая разница (тест Манна – Уитни U , P <0.001). | ||||||
| b Статистически значимая разница по сравнению с обоими другими значениями (тест Манна – Уитни U , P <0,0001). | ||||||
| Кол-во пациентов | 21 | 12 | 8 | |||
| Продолжительность бесплодия (лет) | 6,0 ± 0,7 | 6,8 ± 0,9 | 5,6 ± 0,5 | Пациент s возраст (лет)32,0 ± 0.9 | 31,7 ± 1,5 | 32,1 ± 1,7 |
| Возраст мужа (лет) | 35,0 ± 1,1 | 35,0 ± 2,7 | 35,9 ± 2,3 | |||
| Прогестерон исходный (нмоль2 / л) | 1,05 ± 0,10 | 3,28 ± 0,19 a | 3,72 ± 0,76 a | |||
| Прогестерон при введении ХГЧ (нмоль /) | 4,23 ± 0,29 | 3,47 ± 0,57 | b | |||
| Эстрадиол при введении ХГЧ (нмоль / л) | 7.34 ± 1,47 | 7,71 ± 1,10 | 9,54 ± 2,20 | |||
| Продолжительность фолликулярной фазы (дни) | 12,9 ± 0,4 | 12,6 ± 0,4 | 12,7 ± 0,5 | |||
| FSH402 4443 ± 348 | 4437 ± 530 | 3919 ± 556 | ||||
| Оплодотворенные / осемененные ооциты (%) | 66/102 (64,7) | 44/55 (80,0) | 34/40 (85,0) | |||
| Достигнутая беременность (%) | 11 (52.4) | 7 (58,3) | 6 (75,0) | |||
Влияние совместного лечения с ДХМ (принимаемым внутрь, 1 мг в день) во время стимуляции яичников гонадотропинами на концентрацию прогестерона в сыворотке во время развития фолликулов
| Концентрация прогестерона . | <2 нмоль / л . | > 2 нмоль / л с ДХМ . | > 2 нмоль / л без ДХМ . | ||||
|---|---|---|---|---|---|---|---|
| a Статистически значимая разница (тест Манна – Уитни U , P <0,001). | |||||||
| b Статистически значимая разница по сравнению с обоими другими значениями (тест Манна – Уитни U , P <0,0001). | |||||||
| Кол-во пациентов | 21 | 12 | 8 | ||||
| Продолжительность бесплодия (лет) | 6.0 ± 0,7 | 6,8 ± 0,9 | 5,6 ± 0,5 | ||||
| Возраст пациента (лет) | 32,0 ± 0,9 | 31,7 ± 1,5 | 32,1 ± 1,7 | ||||
| Возраст мужа (лет) | 35,0 ± 1,1 | 35,0 ± 2,7 | 35,9 ± 2,3 | ||||
| Исходный прогестерон (нмоль / л) | 1,05 ± 0,10 | 3,28 ± 0,19 a | 3,72 ± 0,73 a | Прогестерон при введении ХГЧ (нмоль /) | 4.23 ± 0,29 | 3,47 ± 0,57 | 7,38 ± 1,49 b |
| Эстрадиол при введении ХГЧ (нмоль / л) | 7,34 ± 1,47 | 7,71 ± 1,10 | 9,54 ± 2,20 9038 фолликулярная фаза (дни) | 12,9 ± 0,4 | 12,6 ± 0,4 | 12,7 ± 0,5 | |
| Введенный ФСГ (МЕ) | 4443 ± 348 | 4437 ± 530 | 3919 ± 556 | оплодотворенных / осемененных (%) | 66/102 (64.7) | 44/55 (80,0) | 34/40 (85,0) | |
| Достигнутая беременность (%) | 11 (52,4) | 7 (58,3) | 6 (75,0) | ||||
| Концентрация прогестерона . | <2 нмоль / л . | > 2 нмоль / л с ДХМ . | > 2 нмоль / л без ДХМ . | |||
|---|---|---|---|---|---|---|
| a Статистически значимая разница (тест Манна – Уитни U , P <0.001). | ||||||
| b Статистически значимая разница по сравнению с обоими другими значениями (тест Манна – Уитни U , P <0,0001). | ||||||
| Кол-во пациентов | 21 | 12 | 8 | |||
| Продолжительность бесплодия (лет) | 6,0 ± 0,7 | 6,8 ± 0,9 | 5,6 ± 0,5 | Пациент s возраст (лет)32,0 ± 0.9 | 31,7 ± 1,5 | 32,1 ± 1,7 |
| Возраст мужа (лет) | 35,0 ± 1,1 | 35,0 ± 2,7 | 35,9 ± 2,3 | |||
| Прогестерон исходный (нмоль2 / л) | 1,05 ± 0,10 | 3,28 ± 0,19 a | 3,72 ± 0,76 a | |||
| Прогестерон при введении ХГЧ (нмоль /) | 4,23 ± 0,29 | 3,47 ± 0,57 | b | |||
| Эстрадиол при введении ХГЧ (нмоль / л) | 7.34 ± 1,47 | 7,71 ± 1,10 | 9,54 ± 2,20 | |||
| Продолжительность фолликулярной фазы (дни) | 12,9 ± 0,4 | 12,6 ± 0,4 | 12,7 ± 0,5 | |||
| FSH402 4443 ± 348 | 4437 ± 530 | 3919 ± 556 | ||||
| Оплодотворенные / осемененные ооциты (%) | 66/102 (64,7) | 44/55 (80,0) | 34/40 (85,0) | |||
| Достигнутая беременность (%) | 11 (52.4) | 7 (58,3) | 6 (75,0) | |||
Рисунок 1.
Диаграммы трех экспериментальных протоколов.
Рисунок 1.
Диаграммы трех экспериментальных протоколов.
Рисунок 2.
Концентрации прогестерона в сыворотке крови в нмоль / л (черные столбцы) и ЛГ в МЕ / л (пустые столбцы) до и после болюса в / в. инъекция 100 мкг GnRH ( A ) или 250 мкг ACTH ( B ) во время подавления секреции эндогенного гонадотропина агонистом GnRH длительного действия.В то время как концентрации прогестерона и ЛГ не изменялись под действием ГнРГ, после введения АКТГ наблюдалось быстрое повышение концентрации прогестерона. * P <0,01 по сравнению с 0 мин.
Рис. 2.
Концентрации прогестерона в сыворотке крови в нмоль / л (черные столбцы) и ЛГ в МЕ / л (пустые столбцы) до и после болюса в / в. инъекция 100 мкг GnRH ( A ) или 250 мкг ACTH ( B ) во время подавления секреции эндогенного гонадотропина агонистом GnRH длительного действия.В то время как концентрации прогестерона и ЛГ не изменялись под действием ГнРГ, после введения АКТГ наблюдалось быстрое повышение концентрации прогестерона. * P <0,01 по сравнению с 0 мин.
Рисунок 3.
( a ) Концентрации прогестерона в сыворотке (верхняя панель), 17α-гидроксипрогестерона (средняя панель) и андростендиона (нижняя панель) за 30 минут до, непосредственно перед, 30 и 60 минут после болюсного внутривенного введения. инъекция 250 мкг АКТГ.Тесты на АКТГ проводились во время ранней фолликулярной фазы (A и C), один раз во время поздней фолликулярной фазы (B) и через 7 дней лечения 50 мкг этинилэстрадиола (D). Над каждым тестом на АКТГ указывается, был ли эндокринный ответ статистически значимым (Kruskal Wallis) от a до e и i, j и k P <0,05 f, g и h P <0,01 ( b ). Тесты на АКТГ во время поздней фолликулярной фазы (столбец B на рисунке 3a) проводились во время преовуляторного повышения прогестерона, показанного здесь.Последний определяли путем ежедневного измерения прогестерона ранним утром, начиная с 12-го дня необработанного менструального цикла.
Рисунок 3.
( a ) Концентрации прогестерона в сыворотке (верхняя панель), 17α-гидроксипрогестерона (средняя панель) и андростендиона (нижняя панель) за 30 минут до, непосредственно перед, через 30 и 60 минут после болюса внутривенно. инъекция 250 мкг АКТГ. Тесты на АКТГ проводились во время ранней фолликулярной фазы (A и C), один раз во время поздней фолликулярной фазы (B) и через 7 дней лечения 50 мкг этинилэстрадиола (D).Над каждым тестом на АКТГ указывается, был ли эндокринный ответ статистически значимым (Kruskal Wallis) от a до e и i, j и k P <0,05 f, g и h P <0,01 ( b ). Тесты на АКТГ во время поздней фолликулярной фазы (столбец B на рисунке 3a) проводились во время преовуляторного повышения прогестерона, показанного здесь. Последний определяли путем ежедневного измерения прогестерона ранним утром, начиная с 12-го дня необработанного менструального цикла.
Это исследование было поддержано грантом медицинского факультета Базельского университета.Мы благодарим г-жу Энн Катрин Фоэдж за техническую помощь. Мы также благодарны профессору Дж. Дж. Стаубу за его ценные советы при настройке протокола эксперимента.
Список литературы
Аззиз Р., Рафи А., Смит Б. Р., Брэдли Э. и Закур, Х.В. (
1990
) О происхождении повышенных уровней 17-гидроксипрогестерона после стимуляции надпочечников при гиперандрогении.J. Clin. Эндокринол. Метаб.
,70
,431
–436.Бао Б. и Гарверик Х.А. (
1998
) Экспрессия стероидогенных ферментов и генов рецепторов гонадотропина в фолликулах крупного рогатого скота во время фолликулярных волн яичников: обзор.J. Anim. Sci.
,76
,1903
–1921.Батиста, М.С., Картледж, Т.П., Зеллмер, А.В., Ниман, Л.К., Мерриам, Г.Р. и Loriaux, D.L. (
1992
) Доказательства критической роли прогестерона в регуляции выброса гонадотропинов в середине цикла и овуляции.J. Clin. Эндокринол. Метаб.
,74
,565
–570.Brännström, M. и Janson, P.O. (
1989
) Прогестерон является посредником в овуляторном процессе яичника крысы, перфузированного in vitro.Biol. Репродукция.
,40
,1170
–1178.Четковски, Р.Дж., Чанг, Р.Дж., ДеФазио, Дж., Мелдрам, Д. and Judd, H.L. (
1984
) Происхождение сывороточных прогестинов при СПКЯ.Акушерство. Гинеколь.
,64
,27
–31.Коллинз Р.Л. и Ходген Г.Д. (
1986
) Блокада спонтанного выброса гонадотропинов в середине цикла у обезьян с помощью RU486: антагонист или агонист прогестерона?J. Clin. Эндокринол. Метаб.
,63
,1270
–1276.Конли, А.Дж., Ховард, Х.Дж., Сленджер, В.Д. и Форд, Д.Дж. (
1994
) Стероидогенез в преовуляторном фолликуле свиньи.Biol. Репродукция.
,51
,655
–661.De Geyter, Ch., De Geyter, M., Simoni M., Castro, E., Bals-Pratsch, M., Nieschlag, E. and Schneider, H.P.G. (
1994
) Пульсирующее подкожное или болюсное внутримышечное введение гонадотропина после подавления гипофиза аналогом ГнРГ длительного действия: контролируемое проспективное исследование.Hum. Репродукция.
,9
,1070
–1076.Dupont, E., Luu-The, V., Labrie, F. и Pelletier, G. (
1990
) Световая микроскопическая иммуноцитохимическая локализация 3β-гидрокси-5-ен-стероиддегидрогеназы / β 5 -β 4 -изомераза в гонадах и надпочечниках морской свинки.Эндокринология
,126
,2906
–2909.Эльдар-Гева, Т., Маргалиот, Э.Дж., Брукс, Б., Алгур, Н., Зильбер-Харан, Э. и Диамант, Ю.З. (
1998
) Происхождение сывороточного прогестерона во время фолликулярной фазы менотропин-стимулированных циклов.Hum. Репродукция.
,13
,9
–14.Fanchin, R., Righini, C., Olivennes, R., Taieb, J., de Ziegler, D. and Frydman, R. (
1997
) Преждевременное повышение уровня прогестерона и андрогенов в плазме не предотвращается подавлением надпочечников в экстракорпоральное оплодотворение.Fertil. Стерил.
,67
,115
–119.Гиллинг-Смит, К., Уиллис, Д.С. и Фрэнкс, С. (
1997
) Эстрадиоловая обратная стимуляция биосинтеза андрогенов тека-клетками человека.Hum. Репродукция.
,12
,1621
–1628.Хибберт, М., Стоуфер, Р.Л., Вольф, Д.П. и Зелински-Вутен, М. (
1996
) Введение в середине цикла ингибитора синтеза прогестерона предотвращает овуляцию у приматов.Proc.Natl Acad. Sci. США
,93
,1897
–1901.Hoff, J.D., Quigley, M.E. and Yen, S.S.C. (
1983
) Гормональная динамика в середине цикла: переоценка.J. Clin. Эндокринол. Метаб.
,57
,792
–796.Iwai, T., Nanbu, Y., Iwai, M., Taii, S., Fujii, S. и Mori, T. (
1990
) Иммуногистохимическая локализация рецепторов эстрогена и рецепторов прогестерона в яичниках человека на всем протяжении менструальный цикл.Арка Вирхова. A. Pathol. Анат. Histopathol.
,417
,369
–375.Кананен, К., Марккула, М., Райнио, Ф., Су, Дж. Г. Сюэ, А.Дж. and Huhtaniemi, I.T. (
1995
) Гонадный онкогенез у трансгенных мышей, несущих промотор альфа-субъединицы мышиного ингибина / гибридный ген Т-антигена обезьяньего вируса: характеристика опухолей яичников и создание линий клеток гранулезы, чувствительных к гонадотрофам.Мол. Эндокринол.
,9
,616
–627.Коцудзи Ф., Камитани Н., Гото К. и Томинага Т. (
1990
) Взаимодействие тека и гранулезы крупного рогатого скота влияет на их рост, морфологию и функцию.Biol. Репродукция.
,43
,726
–732.Lachelin, G.C.L., Barnett, M., Hopper, B.R., Brink, G. and Yen, S.S.C. (
1979
) Функция надпочечников у здоровых женщин и женщин с СПКЯ.J. Clin. Эндокринол. Метаб.
,49
,892
–898.Лю Дж.H., Garzo, G., Morris, S., Stuenkel, C., Ulmann, A. и Yen, S.S.C. (
1987
) Нарушение созревания фолликулов и задержка овуляции после введения антипрогестерона RU486.J. Clin. Эндокринол. Метаб.
,65
,1135
–1140.Lobo, R.A., Goebelsmann, U., Brenner, P.F. и Мишелл, Д. Jr (
1982
) Влияние эстрогена на андрогены надпочечников у женщин после овариэктомии.г. J. Obstet. Гинеколь.
,142
,471
–478.Лайдон, Д.П., ДеМайо, Ф.Дж., Функ, К.Р., Мани, С.К., Хьюз, А.Р., Монтгомери-младший, К.А., Шьямала, Г., Коннели, О.М. и О’Мэлли, Б. (
1995
) У мышей, лишенных рецептора прогестерона, наблюдаются плейотропные репродуктивные аномалии.Genes Dev.
,9
,2266
–2278.Макрис А. и Райан Дж. Дж. (
1977
) Доказательства взаимодействия между клетками гранулезы и текой при раннем синтезе прогестерона.Endocr. Res. Comm.
,4
,233
–246.Мацук, М.М., Файнголд, М.Дж., Мазер, Дж. П., Краммен, Л., Лу, Х. и Брэдли, А. (
1994
) Развитие рака, кахексиального синдрома и опухолей надпочечников у мышей с дефицитом ингибина.Proc. Natl Acad. Sci. США
,91
,8817
–8821.Pabon, J.E., Li, X., Lei, Z.M., Sanfilippo, J.S. и Рао, К.В. (
1996
) Новое присутствие рецепторов лютеинизирующего гормона / хорионического гонадотропина в надпочечниках человека.J. Clin. Эндокринол.Метаб.
,81
,2397
–2400.Парк, О. К. и Мэйо, К. Э. (
1991
) Временная экспрессия матричной РНК рецептора прогестерона в клетках гранулезы яичников после преовуляторного выброса лютеинизирующего гормона.Мол. Эндокринол.
,5
,967
–978.Ричардс, Дж. (
1994
) Гормональный контроль экспрессии генов в яичнике.Endocr. Ред.
,15
,725
–751.Рилианавати, Паукку, Т., Kero, J., Zhang, F.-P., Rahman, N., Kananen, K. and Huhtaniemi, I. (
1998
) Прямое действие лютеинизирующего гормона запускает адренокортикальный туморогенез у кастрированных мышей, трансгенных по мышиному ингибину α. -субъединичный промотор / ген слияния 40 Т-антигена обезьяньего вируса.Мол. Эндокринол.
,12
,801
–809.Rosner, W. (
1991
) Стероид-связывающие белки плазмы.Endocr. Метаб. Clin. North Am.
,20
,697
–720.Scheele, F., Hompes, P.G.A., Lambalk, C..B., Schoute E., Broekmans, F.J. и Schoemaker, F.J. (
1996
) Тест на заражение GnRH: количественный показатель десенсибилизации гипофиза во время введения агониста GnRH.Clin. Эндокринол.
(Oxf.) ,44
,581
–586.Шоуп, Д., Мишелл, Д. Младший, Пейдж, М.А., Мадкур, Х., Шпиц, И.М. и Лобо, Р.А. (
1987
) Эффекты антипрогестерона RU 486 у нормальных женщин.II. Применение в поздней фолликулярной фазе.г. J. Obstet. Гинеколь.
,157
,1421
–1426.Simpson, E.R. и Waterman, M.R. (
1988
) Регулирование синтеза стероидогенных ферментов в клетках коры надпочечников с помощью АКТГ.Ann. Rev. Physiol.
,50
,427
–440.Урман, Б., Алатас, К., Аксой, С., Меркан, Р., Исиклар, А. и Балабан, Б. (
1999
) Повышенный уровень прогестерона в сыворотке крови в день введения ХГЧ не оказывает отрицательного воздействия. частота имплантации после интрацитоплазматической инъекции сперматозоидов и переноса эмбрионов.Fertil. Стерил.
,72
,975
–979.Вивейрос, М. и Liptrap, R.M. (
2000
) Лечение АКТГ нарушает выработку яичникового IGF-I и стероидных гормонов.J. Endocrinol.
,164
,255
–264.Wu, X.-K., Zhou, S.-Y., Sallinen, K., Pöllänen, P. and Erkkola, R. (
2000
) Перекрестные помехи между яичниками и надпочечниками при СПКЯ: данные клиновидной резекции.евро. J. Endocrinol.
,143
,383
–388.Яда, Х., Хосокава, К., Таджима, К., Хасегава, Й. и Коцудзи, Ф. (
1999
) Роль взаимодействия тека и гранулезных клеток яичника в выработке гормонов и росте клеток во время созревания фолликулов крупного рогатого скота процесс.Biol. Репродукция.
,61
,1480
–1486.© Европейское общество репродукции человека и эмбриологии
Фолликулярная фаза — обзор
Фолликулярная фаза
Фолликулярная фаза названа так потому, что она характеризуется быстрым ростом фолликулов яичников.Под влиянием ФСГ некоторые третичные фолликулы в каждом яичнике увеличиваются в размере во время фолликулярной фазы, а некоторые достигают в диаметре от 14 до 21 мм к 10-12 дням. Другие фолликулы, которые ранее подвергались быстрому росту, становятся атретичными (дегенерируют). ). К 13 дню обычно только один крупный фолликул Граафа диаметром от 20 до 25 мм присутствует только в одном яичнике; этот большой фолликул выглядит как волдырь на поверхности яичника. Остальные крупные фолликулы в каждом яичнике становятся атретичными к 13-му дню.
Эстрадиол секретируется более крупными фолликулами в каждом яичнике, включая те, которые позже могут стать атретичными. Повышение уровня эстрогена вызывает разрастание (утолщение) эндометрия матки во время фолликулярной фазы. Таким образом, применительно к матке эту фазу менструального цикла часто называют пролиферативной фазой . Под эстрогенным влиянием маточные железы начинают увеличиваться (рис. 3-2). Эндометрий становится более насыщенным кровеносными сосудами, и вода накапливается между клетками в тканях — состояние, известное как отек .Кроме того, гладкие мышцы миометрия начинают мягко ритмично сокращаться, хотя женщина обычно не замечает этих небольших сокращений.
Уровни эстрадиола в крови продолжают расти на протяжении большей части фолликулярной фазы, достигая максимума (пика) на 12 или 13 день (рис. 3-2). Примерно через 24–48 часов после пика эстрадиола в крови происходит всплеск (заметное и быстрое увеличение) ЛГ (рис. 3-2). Этот выброс ЛГ инициирует возобновление мейоза в ооците внутри самого большого фолликула, а также вызывает овуляцию этого фолликула (Глава 2).Всплеск ЛГ длится около 36 часов, а овуляция происходит через 9-12 часов после пика всплеска. Уровни прогестерона и ФСГ остаются низкими в фолликулярной фазе непосредственно перед овуляцией. В это время небольшой всплеск ФСГ сопровождает более сильный всплеск ЛГ, а уровень прогестерона немного повышается непосредственно перед овуляцией (рис. 3-2). Этот прогестерон поступает из стенки самого большого фолликула под влиянием выброса ЛГ (см. Главу 2) и может (наряду с эстрадиолом) играть важную роль в регулировании выброса ЛГ.
Во время фолликулярной фазы действуют сложные механизмы обратной связи. Давайте сначала посмотрим на эффекты обратной связи эстрадиола на секрецию гонадотропин-рилизинг-гормона гипоталамусом. Помните из главы 1, что гипоталамус мозга может секретировать только один гонадолиберин, который контролирует секрецию как ФСГ, так и ЛГ гипофизом. Теперь посмотрите на рис. 3-3, и вы увидите, что умеренные уровни циркулирующего эстрадиола имеют отрицательный эффект обратной связи на секрецию гонадолиберина. В начале фолликулярной фазы, когда уровни эстрадиола низкие, уровни ФСГ повышаются из-за отсутствия отрицательной обратной связи эстрадиола на секрецию гонадолиберина.После того, как эстрадиол достигает умеренно высоких уровней в середине фолликулярной фазы, он оказывает отрицательную обратную связь на секрецию гонадолиберина, и уровни ФСГ начинают снижаться. Фолликулы яичников человека содержат вещество (ингибин), которое ингибирует секрецию ФСГ (но не ЛГ), и это вещество также может оказывать негативное влияние на обратную связь. Родственный пептид яичников под названием активин стимулирует секрецию ФСГ. Яичник также производит фоллистатин , гликопротеин, который ингибирует секрецию ФСГ, связываясь с активином и нейтрализуя его эффекты.В последние дни фолликулярной фазы уровни эстрадиола очень высоки (секретируются несколькими крупными фолликулами в каждом яичнике) и теперь оказывают положительное влияние на секрецию гонадолиберина. Это увеличение ГнРГ вызывает всплеск ЛГ на 14-й день. Импульсы ГнРГ (а также ФСГ и ЛГ) увеличиваются в 10 раз по амплитуде и происходят каждые 30 минут во время всплеска ЛГ (рис. 3-4).
Рисунок 3-3. Влияние повышения уровня эстрадиола в крови во время фолликулярной фазы менструального цикла на секрецию гонадотропина (ФСГ и ЛГ) гипофизом.Обратите внимание, что в ранней фолликулярной фазе (EFP) уровни эстрадиола низкие, а выработка гонадотропина высока из-за отсутствия отрицательной обратной связи эстрадиола на секрецию гонадотропина. В среднефолликулярной фазе (MFP) уровни эстрадиола умеренно высоки и оказывают отрицательную обратную связь на секрецию гонадотропинов. В поздней фолликулярной фазе (LFP) очень высокие уровни эстрадиола теперь оказывают положительную обратную связь на секрецию гонадотропина, что приводит к выбросу ЛГ.
Остается много вопросов о контроле секреции ФСГ и ЛГ во время фолликулярной фазы.Например, почему ФСГ и ЛГ не циклируются одинаково (рис. 3-2), если существует только один гонадолиберин? Ответ не ясен, но возможное объяснение состоит в том, что изменение уровня эстрадиола не только влияет на секрецию ГнРГ гипоталамусом, но также изменяет чувствительность передней доли гипофиза к ГнРГ. Более конкретно, похоже, что данный уровень эстрадиола может по-разному влиять на чувствительность клеток гипофиза, которые секретируют ФСГ и ЛГ. Например, высокие уровни эстрадиола в поздней фолликулярной фазе могут положительно влиять на ГнРГ, но одновременно снижают чувствительность секретирующих ФСГ клеток к ГнРГ.Кроме того, поскольку паттерн импульсов гонадолиберина изменяется во время цикла (рис. 3-4), на секрецию ФСГ и ЛГ влияют по-разному. Кроме того, ингибин может избирательно подавлять секрецию ФСГ, но не ЛГ. Почему на 14-й день наблюдается небольшой всплеск ФСГ вместе с всплеском ЛГ? Может случиться так, что гипофиз неспособен выпускать сильный импульс ЛГ, не высвобождая при этом некоторое количество ФСГ. Если женщине сделать инъекцию эстрадиола, следует всплеск ЛГ. Однако, если за этой инъекцией эстрадиола следует инъекция прогестерона, в крови повышается уровень как ФСГ, так и ЛГ.Сам по себе прогестерон не вызывает выброс гонадотропинов. Наконец, эстроген может вызвать выброс ЛГ, воздействуя непосредственно на гипофиз, а не на гипоталамус. Дальнейшие исследования того, как стероидные гормоны вызывают изменения гонадотропинов, которые приводят к овуляции, представляют большой интерес для ученых-клиницистов, поскольку они могут использовать эти знания, чтобы помочь бесплодным женщинам овулировать (см. Главу 16).
Посмотрите на рис. 3-2 и обратите внимание, что уровень эстрадиола быстро падает непосредственно перед овуляцией.Самый большой фолликул в яичнике снижает секрецию эстрадиола и начинает вырабатывать прогестерон непосредственно перед овуляцией. Это падение эстрадиола может привести к легкому маточному кровотечению во время овуляции, называемому кровянистыми выделениями или прорывным кровотечением , довольно редким явлением. Кровянистые выделения — это не менструация.
Есть также много загадок относительно изменений яичников, которые происходят в фолликулярной фазе. Например, хотя в яичнике присутствует много растущих фолликулов, мы не понимаем, почему в конечном итоге для овуляции выбирается только один.Другие фолликулы, хотя и растут и первоначально выделяют эстрогены, становятся атретичными. Мы знаем, что если большой фолликул, который собирается овулировать, будет удален на ранней стадии фолликулярной фазы, его место займет другой фолликул. Таким образом, фолликул, который был запрограммирован на смерть, теперь остается жизнеспособным и овулирует. Мы также не понимаем механизмов, контролирующих чередование овуляции. Если правый яичник женщины овулирует одну яйцеклетку в конкретный месяц, велика вероятность, что ее левый яичник овулирует в следующий раз.Как происходит это чередование, не ясно, но мы знаем, что у женщин, у которых был удален один яичник ( овариэктомия или овариэктомия ), оставшийся яичник будет овулировать каждый месяц, а не каждые 2 месяца.
Вы и ваши гормоны от Общества эндокринологов
Что такое прогестерон?
Прогестерон принадлежит к группе стероидных гормонов, называемых прогестагенами. В основном он секретируется желтым телом яичников во второй половине менструального цикла.Он играет важную роль в менструальном цикле и в поддержании ранних стадий беременности.
Во время менструального цикла, когда яйцеклетка выходит из яичника во время овуляции (примерно на 14-й день), остатки фолликула яичника, окружающего развивающееся яйцо, образуют структуру, называемую желтым телом. Это высвобождает прогестерон и, в меньшей степени, эстрадиол. Прогестерон подготавливает организм к беременности в случае оплодотворения выпущенной яйцеклетки. Если яйцеклетка не оплодотворяется, желтое тело разрушается, производство прогестерона падает, и начинается новый менструальный цикл.
Если яйцеклетка оплодотворена, прогестерон стимулирует рост кровеносных сосудов, которые снабжают слизистую оболочку матки (эндометрий), и стимулирует железы в эндометрии выделять питательные вещества, которые питают ранний эмбрион. Затем прогестерон подготавливает тканевую оболочку матки для имплантации оплодотворенной яйцеклетки и помогает поддерживать эндометрий на протяжении всей беременности. На ранних стадиях беременности прогестерон все еще вырабатывается желтым телом и необходим для поддержания беременности и формирования плаценты.Как только плацента сформировалась, она берет на себя выработку прогестерона примерно на 8-12 неделе беременности. Во время беременности прогестерон играет важную роль в развитии плода; стимулирует рост тканей груди матери; препятствует лактации; и укрепляет мышцы тазовой стенки при подготовке к родам. Уровень прогестерона в организме неуклонно повышается на протяжении всей беременности, пока не начнутся роды и не появится ребенок.
Хотя желтое тело в яичниках является основным местом выработки прогестерона у людей, прогестерон также в меньших количествах вырабатывается самими яичниками, надпочечниками и, во время беременности, плацентой.
Как контролируется прогестерон?
Формирование желтого тела (которое производит большую часть прогестерона) вызвано резким увеличением выработки лютеинизирующего гормона передней долей гипофиза. Обычно это происходит примерно на 14 день менструального цикла и стимулирует выход яйцеклетки из яичника и образование желтого тела. Затем желтое тело выделяет прогестерон, который подготавливает организм к беременности. Если яйцеклетка не оплодотворена и эмбрион не зачат, желтое тело разрушается и выработка прогестерона снижается.Поскольку слизистая оболочка матки больше не поддерживается прогестероном из желтого тела, он отрывается и возникает менструальное кровотечение, знаменующее начало нового менструального цикла.
Однако, если овулировавшая яйцеклетка оплодотворяется и дает начало эмбриону, клетки, окружающие этот ранний эмбрион (которым суждено сформировать плаценту), будут секретировать хорионический гонадотропин человека. ‘Data-content =’ 1392 ‘> хорионический гонадотропин человека. Этот гормон имеет очень похожую химическую структуру с лютеинизирующим гормоном.Это означает, что он может связываться с теми же рецепторами, что и лютеинизирующий гормон, и активировать их, а это означает, что желтое тело не разрушается и вместо этого продолжает вырабатывать прогестерон до тех пор, пока не установится плацента.
Что произойдет, если у меня будет слишком много прогестерона?
Нет никаких известных серьезных медицинских последствий приема слишком большого количества прогестерона. Как упоминалось выше, уровень прогестерона повышается естественным образом во время беременности.
Высокий уровень прогестерона связан с состоянием «врожденная гиперплазия надпочечников» data-content = ‘1315’> врожденная гиперплазия надпочечников.Однако высокий уровень прогестерона является следствием, а не причиной этого состояния. Кроме того, высокий уровень прогестерона связан с повышенным риском развития рака груди.
Прогестерон, отдельно или в комбинации с эстрогеном, женщины принимают в качестве орального контрацептива («таблетки»). «Таблетка» предотвращает овуляцию, что делает ее почти 100% эффективной в предотвращении беременности.
Прогестерон используется в заместительной гормональной терапии для облегчения симптомов менопаузы у женщин.Есть много признанных плюсов и минусов заместительной гормональной терапии — см. Статью о менопаузе для получения дополнительной информации.
Что произойдет, если у меня слишком мало прогестерона?
Если прогестерон отсутствует или его уровень слишком низкий, могут возникнуть нерегулярные и обильные менструальные кровотечения. Снижение уровня прогестерона во время беременности может привести к выкидышу и преждевременным родам. Матерям с риском слишком ранних родов можно дать синтетическую форму прогестерона, чтобы отсрочить начало родов.
Недостаток прогестерона в кровотоке может означать, что яичник не может освободить яйцеклетку во время овуляции, что может происходить у женщин с синдромом поликистозных яичников.
Последний раз рассмотрено: фев 2018
Физиология женской репродуктивной системы
Оогенез
Оогенез — это созревание женских гамет посредством мейотического деления.
Цели обучения
Различать стадии оогенеза и действия гормонов на каждой стадии
Основные выводы
Ключевые точки
- Оогенез начинается с процесса развития оогониев через превращение примордиальных фолликулов в первичные ооциты, процесс, называемый ооцитогенезом.
- Ооцитогенез у человека завершается до или вскоре после рождения. Во время менструального цикла первичные ооциты завершают созревание посредством последующих мейотических делений.
- Первое мейотическое деление координируется гормонами: фолликулостимулирующим гормоном (ФСГ), эстрогеном, лютеинизирующим гормоном (ЛГ) и прогестероном.
- Ооцит останавливается в клеточном делении до второго мейотического деления, которое происходит только после оплодотворения.
Ключевые термины
- полярное тело : небольшая гаплоидная клетка, образовавшаяся одновременно как яйцеклетка во время оогенеза, но не способная к оплодотворению.
- яйцеклетка : почти зрелая яйцеклетка, которая является результатом
мейотического деления вторичного ооцита. - лютенизирующий гормон : гормон, вырабатываемый передней долей гипофиза. У женщин резкое повышение уровня ЛГ вызывает овуляцию и развитие желтого тела.
- фолликул : Небольшая полость или мешочек, который является местом развития ооцитов в яичнике.
- фолликулостимулирующий гормон : гонадотропный гликопротеиновый гормон, секретируемый частью гипофиза, который стимулирует рост фолликулов яичников у самок млекопитающих и индуцирует сперматогенез у самцов млекопитающих.
Менструальный цикл начинается с созревания ооцитов в процессе оогенеза, а также с одновременным развитием фолликулов, которые стимулируют овуляцию. Оогенез начинается с процесса развития оогониев через превращение примордиальных фолликулов в первичные ооциты, процесс, называемый ооцитогенезом. Ооцитогенез у человека завершается до или вскоре после рождения. Во время менструального цикла первичные ооциты завершают созревание посредством последующих мейотических делений.
Развитие фолликула сигнализирует о начале менструального цикла. В начале менструального цикла около 12-20 первичных фолликулов начинают развиваться под влиянием повышенного уровня фолликулостимулирующего гормона (ФСГ) с образованием вторичных фолликулов. Первичные фолликулы формируются из примордиальных фолликулов, которые развиваются в яичнике как плод во время зачатия и останавливаются в профазном состоянии клеточного цикла.
Примерно к 9 дню менструального цикла остается только один здоровый вторичный фолликул.Остальные реабсорбируются в яичниках. Оставшийся фолликул, называемый доминантным фолликулом, отвечает за выработку большого количества эстрогена во время поздней фолликулярной фазы.
На 14 день цикла выброс лютеинизирующего гормона запускается положительной обратной связью эстрогена. Это приводит к тому, что вторичный фолликул превращается в третичный фолликул, который затем покидает яичник через 24–36 часов. Важное событие в развитии третичного фолликула происходит, когда первичный ооцит завершает первое мейотическое деление, что приводит к образованию полярного тельца и вторичного ооцита.Пустой фолликул затем образует желтое тело, которое позже выделяет прогестерон для поддержания потенциальной беременности.
Сразу после мейоза I гаплоидный вторичный ооцит инициирует мейоз II. Однако этот процесс также останавливается на стадии метафазы II до тех пор, пока не произойдет оплодотворение. Когда мейоз II завершается, формируется яйцеклетка и другое полярное тело.
Оба полярных тельца распадаются в конце мейоза II, оставляя только яйцеклетку, которая в конечном итоге развивается в зрелую яйцеклетку.Образование полярных телец служит для отбрасывания лишних гаплоидных наборов хромосом, которые возникли в результате мейоза.
Процесс оогенеза : Диаграмма, показывающая созревание яйцеклетки.
Яичниковый цикл
Менструальный цикл — это физиологический процесс, которому плодородные женщины подвергаются в целях воспроизводства и оплодотворения.
Цели обучения
Различать фазы менструального цикла
Основные выводы
Ключевые точки
- Яичниковый цикл представляет собой серию изменений в яичнике, во время которых фолликул созревает, яйцеклетка опадает и развивается желтое тело.
- Фолликулярная фаза описывает развитие фолликула в ответ на гормон стимуляции фолликулов (ФСГ). По мере увеличения уровней лютеинизирующего гормона (ЛГ) и ФСГ они стимулируют овуляцию или выброс зрелого ооцита в маточные трубы.
- В лютеиновой фазе желтое тело формируется на яичнике и выделяет много гормонов, в первую очередь прогестерона, который делает эндометрий матки готовым к имплантации эмбриона.
- Если имплантация не происходит, желтое тело разрушается, что приводит к менструации.
- Если происходит имплантация, желтое тело сохраняется.
Ключевые термины
- ишемическая фаза : заключительная часть секреторной фазы. Эндометрий
становится бледным, а артерии сужаются из-за более низкого выброса гормонов распадающимся желтым телом
. - гранулезных клеток : Эти клетки производят
гормонов и факторов роста, которые взаимодействуют с ооцитом во время его
развития. - менструальный цикл : повторяющийся цикл физиологических изменений у самок некоторых видов животных, связанный с репродуктивной фертильностью.
- лютеиновая фаза : последняя часть менструального цикла, которая наступает после овуляции, во время которой желтое тело выделяет прогестерон для подготовки эндометрия к имплантации эмбриона.
- фолликулярная фаза : Фаза эстрального цикла, которая включает созревание фолликулов в яичнике и контролируется гормоном эстрадиолом.
Менструальный цикл — это научный термин, обозначающий физиологические изменения, которые происходят у фертильных женщин с целью полового размножения.Менструальный цикл контролируется эндокринной системой и обычно делится на три фазы: фолликулярная фаза, овуляция и лютеиновая фаза. Однако в некоторых источниках эти фазы определяются как менструация, пролиферативная фаза и секреторная фаза. Менструальный цикл отсчитывается с первого дня менструального кровотечения.
Фолликулярная фаза
Фолликулярная фаза (или пролиферативная фаза) — это фаза менструального цикла у людей и человекообразных обезьян, во время которой фолликулы в яичнике созревают и заканчиваются овуляцией.Основным гормоном, контролирующим эту стадию, является эстрадиол. Во время фолликулярной фазы фолликулостимулирующий гормон (ФСГ) секретируется передней долей гипофиза. Уровни ФСГ начинают расти в последние несколько дней предыдущего менструального цикла и достигают пика в первую неделю фолликулярной фазы. Повышение уровня ФСГ привлекает от пяти до семи фолликулов яичников на третичной стадии (также известных как графианские или антральные фолликулы) для вступления в менструальный цикл. Эти фолликулы конкурируют друг с другом за доминирование.
ФСГ вызывает пролиферацию клеток гранулезы в развивающихся фолликулах и экспрессию рецепторов лютеинизирующего гормона (ЛГ) на этих клетках гранулезы. За два или три дня до начала повышения уровня ЛГ, обычно к седьмому дню цикла, один или иногда два привлеченных фолликула становятся доминирующими. Многие эндокринологи считают, что секреция эстрогена доминантным фолликулом увеличивается до уровня, который косвенно снижает уровни ЛГ и ФСГ. Это замедление производства ЛГ и ФСГ приводит к атрезии (гибели) большинства задействованных фолликулов, хотя доминантный фолликул продолжает созревать.
Эти высокие уровни эстрогена инициируют образование нового слоя эндометрия в матке. Крипты в шейке матки также стимулируются для производства плодородной цервикальной слизи, которая снижает кислотность влагалища, создавая более благоприятную среду для спермы. Кроме того, базальная температура тела может немного снизиться под влиянием высокого уровня эстрогена. Овуляция обычно происходит через 30 (± 2) часов после начала всплеска ЛГ (когда ЛГ впервые обнаруживается в моче).
Овуляция
Овуляция — это фаза, в которой зрелый фолликул яичника разрывается и выделяет яйцеклетку (также известную как ооцит, женская гамета или яйцеклетка).Овуляция также происходит в эстральном цикле других самок млекопитающих, который во многом отличается от менструального цикла. Время, непосредственно предшествующее овуляции, называется фазой овуляции или периовуляторным периодом.
Лютеиновая фаза
Лютеиновая фаза (или секреторная фаза) — это последняя часть менструального или эстрального цикла. Он начинается с образования желтого тела и заканчивается беременностью или лютеолизом. Основным гормоном, связанным с этой стадией, является прогестерон, содержание которого в лютеиновой фазе значительно выше, чем в других фазах цикла.Некоторые источники определяют окончание лютеиновой фазы как отдельную ишемическую фазу.
После овуляции гормоны гипофиза ФСГ и ЛГ вызывают превращение оставшихся частей доминантного фолликула в желтое тело. Он продолжает расти в течение некоторого времени после овуляции и вырабатывает значительное количество гормонов, особенно прогестерона и, в меньшей степени, эстрогена. Прогестерон играет жизненно важную роль в обеспечении восприимчивости эндометрия к имплантации бластоцисты и способствует ранней беременности.Он также повышает базальную температуру тела женщины. Гормоны, вырабатываемые желтым телом, подавляют выработку ФСГ и ЛГ, в результате чего желтое тело атрофируется. Гибель желтого тела приводит к падению уровня прогестерона и эстрогена. Это, в свою очередь, вызывает повышение уровня ФСГ, что приводит к привлечению фолликулов для следующего цикла. Продолжительное снижение уровня эстрогена и прогестерона приводит к окончанию лютеиновой фазы, менструации и началу следующего цикла.
Потерю желтого тела можно предотвратить путем имплантации эмбриона. После имплантации человеческие эмбрионы продуцируют хорионический гонадотропин человека (ХГЧ), который структурно подобен ЛГ и может сохранять желтое тело. Поскольку гормон является уникальным для эмбриона, большинство тестов на беременность проверяют наличие ХГЧ. Если происходит имплантация, желтое тело будет продолжать вырабатывать прогестерон (и поддерживать высокую базальную температуру тела) в течение восьми-двенадцати недель, после чего эту функцию берет на себя плацента.
Яичниковый цикл : Яичниковый цикл — это серия изменений, которые происходят в яичниках во время менструального цикла, которые вызывают созревание фолликула, овуляцию и развитие желтого тела.
Маточный (менструальный) цикл
Маточный цикл описывает серию изменений, которые происходят в слизистой оболочке матки или эндометрия во время типичного менструального цикла.
Цели обучения
Обрисовать процесс маточного цикла
Основные выводы
Ключевые точки
- Маточный цикл включает увеличение эндометрия при подготовке к имплантации и отслаивание слизистой оболочки после отсутствия имплантации, что называется менструацией.
- Менструальный цикл отсчитывается с первого дня менструального кровотечения.
- Утолщение эндометрия стимулируется увеличением количества эстрогена в фолликулярной фазе.
- Если имплантация не происходит, уровень прогестерона и эстрогена снижается, что стимулирует менструацию.
Ключевые термины
- эндометрий : слизистая оболочка, выстилающая матку у млекопитающих, в которую имплантируются оплодотворенные яйца.
- менструальный цикл : У самок некоторых видов животных повторяющийся цикл физиологических изменений, связанных с репродуктивной фертильностью.
- decidua : слизистая оболочка, выстилающая матку: она выделяется во время менструации и изменяется во время беременности.
Несколько изменений слизистой оболочки матки (эндометрия) происходят во время менструального цикла, также называемого маточным циклом. Эндометрий — это самый внутренний железистый слой матки. Во время менструального цикла эндометрий разрастается до толстой ткани, богатой кровеносными сосудами, что представляет собой оптимальную среду для имплантации бластоцисты по прибытии в матку.Менструальный цикл отсчитывается с первого дня менструального кровотечения и обычно длится 28 дней.
Во время менструации организм снова начинает готовиться к овуляции. Уровень эстрогена постепенно повышается, сигнализируя о начале фолликулярной фазы или фазы пролиферации менструального цикла. Отток крови замедляется, а затем прекращается в ответ на повышение уровня гормонов, а слизистая оболочка матки утолщается или разрастается. Овуляция вызывается выбросом лютеинизирующего гормона.Внезапное изменение гормонов во время овуляции иногда вызывает незначительные изменения эндометрия и легкий средний кровоток.
После овуляции под влиянием прогестерона эндометрий превращается в секреторную выстилку, готовясь к возможной имплантации эмбриона для установления беременности. Если бластоциста имплантируется, то выстилка остается децидуальной оболочкой. Он становится частью плаценты и обеспечивает поддержку и защиту эмбриона во время вынашивания.
Если имплантация не произойдет в течение примерно двух недель, желтое тело, вырабатывающее прогестерон, в яичнике отступит, что приведет к резкому падению уровней как прогестерона, так и эстрогена. Это снижение гормона заставляет матку терять слизистую оболочку и яйцеклетку во время менструации. Прекращение менструального цикла в конце репродуктивного периода женщины называется менопаузой. Средний возраст менопаузы у женщин составляет 52 года, но она может наступить в любое время между 45 и 55 годами.
Цикл матки : Высокие уровни эстрогена и прогестерона стимулируют увеличение толщины эндометрия, но после их снижения из-за отсутствия имплантации эндометрий отшелушивается и наступает менструация.
Менструальные выделения могут быть нормальными, хотя овуляции не происходит. Это называется ановуляторным циклом. Развитие фолликулов может начаться, но не завершиться, хотя эстроген по-прежнему будет стимулировать слизистую оболочку матки. Ановуляторный кровоток, возникающий из-за очень толстого эндометрия, вызванного длительным, продолжающимся высоким уровнем эстрогена, называется прорывным кровотечением эстрогена . Однако, если это вызвано внезапным падением уровня эстрогена, это называется кровотечением отмены.Ановуляторные циклы обычно возникают перед менопаузой и у женщин с синдромом поликистозных яичников.
Гормональная регуляция женского репродуктивного цикла
Менструальный цикл контролируется серией изменений уровня гормонов, в первую очередь эстрогена и прогестерона.
Цели обучения
Различать фазы менструального цикла
Основные выводы
Ключевые точки
- Фолликулярная фаза начинается с повышения уровня фолликулостимулирующего гормона (ФСГ), который вызывает повышение уровня лютеинизирующего гормона (ЛГ) и гонадотропин-рилизинг-гормона (ГнРГ).Одновременное повышение уровня эстрогена вызывает повышение прогестерона, стимулируя разрастание эндометрия.
- Всплеск ЛГ и ФСГ («всплеск ЛГ») вызывает овуляцию после подавления ГнРГ.
- Уровни эстрогена продолжают расти после овуляции и образования желтого тела, которое секретирует прогестерон в значительных количествах и вызывает снижение уровней ЛГ и ФСГ.
- Без имплантации уровни эстрогена и прогестерона упадут, а желтое тело разрушится.
Ключевые термины
- эстроген : Гормон, ответственный за появление вторичных половых признаков у женщин в период полового созревания, а также за созревание и поддержание репродуктивных органов в их функциональном состоянии.
- кучевые облака : скопление клеток, окружающих ооцит как в фолликуле яичника, так и после овуляции. Эти клетки
координируют развитие фолликулов и созревание ооцитов. - прогестерон : стероидный гормон, секретируемый яичниками, который подготавливает матку к имплантации оплодотворенной яйцеклетки и последующей беременности.
- клеток теки : Группа эндокринных клеток яичника состоит из соединительной ткани, окружающей фолликул. Они обеспечивают
синтез андрогенов и передачу сигналов между гранулезными клетками
и ооцитами во время развития. - Всплеск лютеинизирующего гормона : Резкое повышение уровня ЛГ, которое вызывает овуляцию и развитие желтого тела.
Менструальный цикл — это физиологическое изменение, которое происходит под контролем эндокринной системы у фертильных женщин в целях полового размножения и оплодотворения.
Менструальный цикл : Менструальный цикл контролируется эндокринной системой, при этом отдельные фазы коррелируют с изменениями концентрации гормонов.
Фазы менструального цикла
Менструальный цикл делится на три стадии: фолликулярная фаза, овуляция и лютеиновая фаза.
Фолликулярная фаза
Во время фолликулярной фазы (или фазы пролиферации) фолликулы в яичнике созревают под контролем эстрадиола.Фолликулостимулирующий гормон (ФСГ) секретируется передней долей гипофиза, начиная с последних нескольких дней предыдущего менструального цикла. Пик уровня ФСГ в первую неделю фолликулярной фазы. Повышение уровня ФСГ привлекает фолликулы яичников на третичной стадии (антральные фолликулы) для вступления в менструальный цикл.
Фолликулостимулирующий гормон вызывает пролиферацию клеток гранулезы в развивающихся фолликулах и экспрессию рецепторов лютеинизирующего гормона (ЛГ) на этих клетках.Под влиянием ФСГ клетки гранулезы начинают секрецию эстрогена. Этот повышенный уровень эстрогена стимулирует выработку гонадотропин-рилизинг-гормона (ГнРГ), который увеличивает выработку ЛГ. ЛГ индуцирует синтез андрогенов клетками теки, стимулирует пролиферацию и дифференцировку и увеличивает экспрессию рецептора ЛГ на клетках гранулезы.
На протяжении всей фолликулярной фазы повышение уровня эстрогена в крови стимулирует рост эндометрия и миометрия матки.Это также заставляет клетки эндометрия вырабатывать рецепторы прогестерона, который помогает эндометрию подготовиться к поздней пролиферативной фазе и лютеиновой фазе. За два или три дня до того, как уровень ЛГ начнет повышаться, один или иногда два привлеченных фолликула становятся доминирующими. Многие эндокринологи считают, что секреция эстрогена доминантным фолликулом снижает уровни ЛГ и ФСГ, что приводит к атрезии (смерти) большинства других задействованных фолликулов. Уровень эстрогена будет продолжать расти в течение нескольких дней.
Высокий уровень эстрогена инициирует образование нового слоя эндометрия в матке, пролиферативного эндометрия. Крипты в шейке матки стимулируются для производства плодородной цервикальной слизи, которая снижает кислотность влагалища, создавая более благоприятную среду для спермы. Кроме того, базальная температура тела может немного снизиться под влиянием высокого уровня эстрогена.
Овуляция
Уровень эстрогена самый высокий прямо перед началом всплеска ЛГ. Кратковременное падение уровня стероидных гормонов между началом выброса ЛГ и овуляцией может вызвать мажущие выделения или кровотечение в середине цикла.Под влиянием преовуляторного выброса ЛГ завершается первое мейотическое деление ооцитов. Всплеск также инициирует лютеинизацию клеток теки и гранулезы. Овуляция обычно происходит через 30 (± 2) часов после начала выброса ЛГ.
Овуляция — это процесс менструального цикла женщины, при котором зрелый фолликул яичника разрывается и выделяет яйцеклетку (ооцит). Время, непосредственно предшествующее овуляции, называется фазой овуляции или периовуляторным периодом.В преовуляторной фазе менструального цикла фолликул яичника подвергается расширению кумулюса, стимулируемому ФСГ. Затем яйцеклетка покидает фолликул через образовавшееся рыльце. Овуляция запускается резким скачком количества ФСГ и ЛГ, выделяемых гипофизом.
Лютеиновая фаза
Лютеиновая фаза начинается с образования желтого тела, стимулируемого ФСГ и ЛГ, и заканчивается беременностью или лютеолизом. Основным гормоном, связанным с этой стадией, является прогестерон, который вырабатывается растущим желтым телом, и его содержание в лютеиновой фазе значительно выше, чем в других фазах цикла.Прогестерон играет жизненно важную роль в обеспечении восприимчивости эндометрия к имплантации бластоцисты и способствует ранней беременности. Он также повышает базальную температуру тела женщины.
Через несколько дней после овуляции увеличивающееся количество эстрогена, вырабатываемого желтым телом, может вызвать один или два дня фертильной цервикальной слизи, снижение базальной температуры тела или и то, и другое. Это называется вторичным выбросом эстрогена. Гормоны, вырабатываемые желтым телом, подавляют выработку ФСГ и ЛГ, что приводит к его атрофии.Гибель желтого тела приводит к падению уровня прогестерона и эстрогена, что приводит к окончанию лютеиновой фазы. Повышенный уровень ФСГ начинает рекрутировать фолликулы для следующего цикла.
В качестве альтернативы, потерю желтого тела можно предотвратить путем имплантации эмбриона: после имплантации человеческие эмбрионы вырабатывают хорионический гонадотропин человека (ХГЧ). Хорионический гонадотропин человека структурно подобен ЛГ и может сохранять желтое тело. Поскольку гормон является уникальным для эмбриона, большинство тестов на беременность проверяют наличие ХГЧ.В случае имплантации желтое тело будет продолжать вырабатывать прогестерон (и поддерживать высокую базальную температуру тела) в течение 8–12 недель, после чего эту функцию берет на себя плацента.
Внеутробные эффекты эстрогенов и прогестерона
Эстроген и прогестерон имеют несколько эффектов, выходящих за рамки их непосредственной роли в менструальном цикле, беременности и родах.
Цели обучения
Опишите функции прогестерона и эстрогена
Основные выводы
Ключевые точки
- Эстроген способствует развитию вторичных половых признаков у женщин и выполняет структурные и метаболические функции, включая формирование костей, задержку соли и воды, а также повышение уровня кортизола.
- Эффекты прогестерона в значительной степени усиливаются эстрогеном и включают повышение внутренней температуры, противовоспалительные эффекты, повышенное использование жира для получения энергии и регулирование высвобождения инсулина.
- Прогестерон иногда называют «гормоном беременности», поскольку он выполняет множество функций, связанных с развитием плода, включая подготовку матки к имплантации, увеличение количества цервикальной слизи и снижение иммунного ответа матери.
Ключевые термины
- эстроген : Гормон, ответственный за появление вторичных половых признаков у женщин в период полового созревания, а также за созревание и поддержание половых органов в их зрелом функциональном состоянии.
- альдостерон : минералокортикоидный гормон, секретируемый корой надпочечников, который регулирует баланс натрия и калия в организме.
- прогестерон : стероидный гормон, секретируемый яичниками, который подготавливает матку к имплантации оплодотворенной яйцеклетки и последующей беременности.
И эстрогены, и прогестерон служат в организме не только при менструации, беременности и родах.
Обзор эстрогенов
Эстрадиол : один из эстрогенов, вырабатываемых в организме человека, преобладающий в репродуктивном возрасте женщины.
Эстрогены — это группа соединений, названных в честь их важности в эстральном цикле человека и других животных. Это основные женские половые гормоны, хотя они есть и у мужчин. Тремя основными естественными формами эстрогена у женщин являются эстрон (E1), эстрадиол (E2) и эстриол (E3). Эстетрол (Е4) вырабатывается только во время беременности.
Природные эстрогены — это стероидные гормоны, а некоторые синтетические разновидности — нестероидные. Эстрогены синтезируются у всех позвоночных, а также у некоторых насекомых, и их присутствие у обоих предполагает, что у них древняя эволюционная история.Как и все стероидные гормоны, эстроген легко проникает через клеточную мембрану. Попав внутрь клетки, он связывается с рецепторами эстрогена и активирует их, которые, в свою очередь, модулируют экспрессию многих генов.
Функции эстрогенов
Эстриол : еще один из трех основных эстрогенов, вырабатываемых человеком.
Хотя эстрогены присутствуют как у мужчин, так и у женщин, они обычно значительно выше у женщин репродуктивного возраста. Они способствуют развитию вторичных половых признаков у женщин, таких как грудь, волосы на лобке и распределение женского жира.Они также участвуют в утолщении эндометрия и других аспектах регуляции менструального цикла.
Другие функции и структурные изменения, вызванные эстрогеном, включают:
- Формирование вторичных половых признаков самок
- Ускорение обмена веществ
- Увеличение жировых запасов
- Стимуляция роста эндометрия
- Увеличение роста матки
- Повышение смазки влагалища
- Утолщение стенки влагалища
- Поддержание кровеносных сосудов и кожи
- Уменьшение резорбции костной ткани, увеличение костеобразования
- Снижение мышечной массы
Влияние на либидо
Половое влечение зависит от уровня андрогенов только в присутствии эстрогена.Без эстрогена уровень свободного тестостерона фактически снижает сексуальное желание, как это было продемонстрировано у женщин с гипоактивным расстройством сексуального влечения. Сексуальное желание у этих женщин можно восстановить путем введения эстрогена с помощью оральных контрацептивов.
Психическое здоровье
Эстроген играет важную роль в психическом здоровье женщин. Внезапная отмена эстрогена, колебания эстрогена и периоды устойчивого низкого уровня эстрогена коррелируют со значительными изменениями настроения. Восстановление или стабилизация уровня эстрогена клинически эффективны для восстановления после послеродовой депрессии, перименопаузы и постменопаузы.
Обзор прогестерона
Прогестерон : принадлежит к классу гормонов прогестагенов и является преобладающим примером в организме человека.
Прогестерон — стероидный гормон, участвующий в женском менструальном цикле, беременности (поддерживает беременность) и эмбриогенезе человека и других видов.
Прогестерон принадлежит к классу гормонов, называемых прогестагенами, и является основной природной формой человека в этой категории. Прогестерон проявляет свое основное действие через внутриклеточный рецептор прогестерона, хотя также постулируется отдельный мембраносвязанный рецептор прогестерона.
Функции прогестерона
Прогестерон обладает рядом физиологических эффектов, которые усиливаются в присутствии эстрогена. Эстроген через рецепторы эстрогена усиливает экспрессию рецепторов прогестерона. Кроме того, повышенные уровни прогестерона сильно снижают активность альдостерона в удержании натрия, что приводит к натрийурезу и уменьшению объема внеклеточной жидкости. С другой стороны, отмена прогестерона связана с временным увеличением задержки натрия (снижение натрийуреза с увеличением объема внеклеточной жидкости) из-за компенсаторного увеличения выработки альдостерона.Это борется с блокадой рецептора минералокортикоидов из-за ранее повышенного уровня прогестерона.
Прогестерон оказывает ключевые эффекты через негеномную передачу сигналов на человеческую сперму, поскольку она мигрирует по женскому тракту до оплодотворения, хотя рецептор (ы) пока не идентифицирован. Подробная характеристика событий, происходящих в сперматозоидах в ответ на прогестерон, пролила свет на переходные процессы внутриклеточного кальция, поддерживаемые изменения и медленные колебания кальция, которые, как теперь полагают, могут регулировать подвижность.
Прогестерон иногда называют «гормоном беременности», и он играет важную роль в развитии плода. Он переводит эндометрий в секреторную стадию, чтобы подготовить матку к имплантации. В то же время он воздействует на эпителий влагалища и слизь шейки матки, делая их густыми и непроницаемыми для сперматозоидов.
Если беременность не наступит, уровень прогестерона снизится, что приведет к менструации. Нормальное менструальное кровотечение — это кровотечение отмены прогестерона. Если овуляция не происходит и желтое тело не развивается, его уровень может быть низким, что приводит к ановуляторному дисфункциональному маточному кровотечению.Во время имплантации и беременности прогестерон, по-видимому, снижает иммунный ответ матери, что позволяет принять беременность и снизить сократительную способность гладких мышц матки.
Кроме того, прогестерон подавляет лактацию во время беременности. Снижение его уровня способствует началу родов. Еще одно падение после родов — один из триггеров производства молока. Плод метаболизирует плацентарный прогестерон с образованием стероидов надпочечников.
Женский сексуальный ответ
Женское половое возбуждение вызывает физиологические изменения, включая усиление кровотока к гениталиям, увеличение и смазывание влагалища.
Цели обучения
Объясните процесс женской сексуальной реакции
Основные выводы
Ключевые точки
- Ответы, характерные для женщин, включают нагрубание нескольких тканей, включая соски, вульву, клитор и стенки влагалища.
- Дальнейшие изменения включают изменения формы влагалища и положения матки в тазу, а также повышение артериального давления и частоты сердечных сокращений.
- Оргазмы, испытываемые мужчинами и женщинами, контролируются непроизвольной или вегетативной нервной системой.
- Возрастные изменения сексуальной реакции могут быть связаны с изменениями уровня эстрогена.
Ключевые термины
- вульва : влагалище, ведущее к матке.
- эстроген : Гормон, ответственный за появление вторичных половых признаков у женщин в период полового созревания, а также за созревание и поддержание половых органов в их зрелом функциональном состоянии.
- клитор : Маленький, чувствительный и удлиненный эректильный орган в передней части вульвы у женщин, гомологичный пенису.
Сексуальное возбуждение вызвано сексуальным желанием во время или в ожидании сексуальной активности. Ряд физиологических изменений происходит в теле и разуме при подготовке к сексу и продолжается во время полового акта. У женщин эти изменения включают усиление кровотока к соскам, вульве, клитору и стенкам влагалища, а также усиление вагинальной смазки.
Физиологический ответ
Характеристики вульвы : Клитор и губные складки промаркированы.
Начало полового возбуждения в теле женщины обычно отмечается вагинальной смазкой, нагрубанием наружных половых органов и внутренним увеличением влагалища.Дальнейшая стимуляция может привести к повышенной влажности влагалища и дальнейшему нагрубанию и набуханию клитора и половых губ, а также к усилению покраснения или потемнения кожи в этих областях. Также изменяется внутренняя форма влагалища и положение матки в тазу.
Другие телесные изменения включают учащение пульса и артериального давления, а также приливы крови к груди и верхней части тела. Если сексуальная стимуляция продолжается, то сексуальное возбуждение может достигнуть пика в оргазме, что приведет к ритмичным мышечным сокращениям в области таза, характеризующимся интенсивным ощущением удовольствия.Оргазмы, испытываемые мужчинами и женщинами, контролируются непроизвольной или вегетативной нервной системой.
С возрастом у женщин уровень эстрогена снижается. Снижение уровня эстрогена может быть связано с повышенной сухостью влагалища и меньшей эрекцией клитора при возбуждении, но не связано напрямую с другими аспектами сексуального интереса или возбуждения. У пожилых женщин снижение тонуса мышц таза может увеличить время достижения оргазма, снизить интенсивность оргазма и вызвать более быстрое разрешение.У некоторых женщин сокращения матки во время оргазма могут вызывать боль или дискомфорт.
Психологический ответ
Психические и физические раздражители, такие как прикосновение и внутреннее колебание гормонов, влияют на сексуальное возбуждение. Когнитивные факторы, такие как сексуальная мотивация, предполагаемые ожидания в отношении гендерных ролей и сексуальные установки, играют важную роль в самооценке уровня сексуального возбуждения женщин. Бассон предполагает, что потребность женщин в близости побуждает их использовать сексуальные стимулы, что приводит к сексуальному желанию и психологическому сексуальному возбуждению.
Исследования Голди и ван Андерса показали, что сексуальные познания влияют на уровень гормонов у женщин. Например, сексуальные мысли приводят к быстрому повышению уровня тестостерона у женщин, которые не использовали гормональные противозачаточные средства.

 6-106
6-106