МОНУРАЛ инструкция по применению, цена в аптеках Украины, аналоги, состав, показания | MONURAL гранулы для орального раствора компании «Zambon»
Фармакодинамика. Монурал имеет широкий спектр антибактериального действия. Он эффективен относительно наиболее часто выделяемых штаммов возбудителей инфекций мочевыводящих путей: E. coli, Klebsiella spp., Enterobacter spp., Pseudomonas spp., Staphylococcus spp., даже если они устойчивы к другим антибактериальным препаратам. Препарат действует также на пенициллиназообразующие штаммы. Монурал оказывает антиадгезивное действие на бактерии, имеющие свойство адгезии к эпителию, выстилающему мочевыводящие пути.
Фармакокинетика. Монурал легко всасывается в ЖКТ, Cmax в плазме крови наблюдается через 2 ч и составляет 30–35 мкг/мл, T1/2 из плазмы — 2 ч. Монурал не метаболизируется в организме, он экскретируется путем гломерулярной фильтрации в биологически активной форме. Монурал накапливается преимущественно в почках в концентрации 2500–3500 мкг/мл, а минимальная ингибирующая концентрация монурала для E.
лечение острых неосложненных инфекций нижних мочевыводящих путей, вызванных чувствительными к фосфомицину микроорганизмами. Профилактика во время диагностических исследований и хирургических вмешательствах.
Монурал применяют внутрь натощак, желательно перед сном после опорожнения мочевого пузыря. Содержимое пакета растворяют в 1/2 стакана воды. Режим дозирования устанавливается индивидуально.
Обычно разовая доза для взрослых и пациентов пожилого возраста (до 75 лет) в острой фазе заболевания составляет 3 г (1 пакет) однократно.
С целью профилактики инфицирования мочевыводящих путей при хирургическом вмешательстве, трансуретральних диагностических исследованиях принимают содержимое первого пакета за 3 ч до вмешательства и второго пакета — через 24 ч после вмешательства.
гиперчувствительность к компонентам препарата, тяжелая почечная недостаточность (клиренс креатинина <10 мл/мин).
со стороны ЖКТ: диарея, изжога, тошнота. Возможны аллергические реакции, кожная сыпь.
одновременный прием пищи замедляет всасывание фосфомицина.
Больным сахарным диабетом необходимо учитывать, что в 1 пакете Монурала содержится 2,213 г сахарозы.
Возможно транзиторное повышение активности печеночных трансаминаз.
Период беременности и кормления грудью. Применение в период беременности и кормления грудью возможно только по жизненным показаниями или если ожидаемый эффект терапии для матери превышает потенциальный риск для плода/ребенка. Адекватные и строго контролируемые исследования относительно применения в период беременности не проводились. Поэтому следует учитывать способность фосфомицина проникать через плаценту. На период лечения матери необходимо прекратить кормление грудью.
Дети. Нет достаточных данных относительно применения препарата у детей.
Способность влиять на скорость реакции при управлении транспортными средствами или работе с механизмами. Нет данных, подтверждающих влияние на скорость реакции.
одновременный прием с метоклопрамидом снижает всасывание Монурала, что приводит к снижению концентрации Монурала в сыворотке крови и моче.
упаковка содержит 1 пакет препарата, поэтому риск передозировки минимальный. В случае передозировки рекомендуется употреблять много жидкости с целью повышения диуреза. Терапия симптоматическая.
хранить при температуре не выше 30 °С.
Монурал (INN — Fosfomycinum) — лекарственное средство, главным действующим веществом которого является фосфомицина трометамол. Относится к группе антимикробных препаратов для системного применения.
Фосфомицин известен медицине уже несколько десятков лет. Впервые был получен как низкомолекулярное производное фосфоновой кислоты в 1969 г. в Испании под руководством Д. Хендлина из культуры Streptomyces spp. , сначала был назван фосфономицином (Itoh N. et al., 1995).
, сначала был назван фосфономицином (Itoh N. et al., 1995).
Для производства препаратов используются следующие соединения фосфомицина: фосфомицина трометамол, фосфомицина кальций и фосфомицина натрий.
Первые две формы предназначены для приема внутрь, фосфомицина натрий — для внутривенного введения.
Препарат Монурал содержит фосфомицина трометамол, соответственно, предназначен для перорального приема.
Сфера применения препарата
Фосфомицин наиболее всего известен как антибиотик для лечения простых инфекционных заболеваний нижних мочевыводящих путей у женщин и мужчин, а также у девочек в возрасте старше 12 лет.
Фосфомицин обладает противомикробной активностью относительно следующих бактерий: E. coli
Именно эти патогенные микроорганизмы чаще всего вызывают заболевания мочевыводящих путей.
Наиболее распространенные заболевания нижних отделов мочевыделительной системы, вызванные вышеперечисленными микроорганизмами.
Острый бактериальный цистит — острое воспалительное заболевание мочевого пузыря. Патологический процесс локализуется в слизистой оболочке, при этом происходит нарушение его собирающей функции. Человека беспокоят частые позывы к мочеиспусканию. Мочеиспускание болезненное.
Инфекционный уретрит — воспалительное заболевание мочеиспускательного канала, при котором слизистая оболочка его стенок поражается бактериями. Человека беспокоит резкая боль, а также наличие слизистого или гнойного отделяемого.
Бессимптомная бактериурия у беременных. При данном нарушении не возникает никаких клинически значимых симптомов, в то время как в моче пациентки выявляются бактерии. При беременности, увеличивающаяся в размере матка приводит к временному изменению конфигурации мочевыводящих путей. В результате создаются благоприятные условия для размножения единичных элементов патогенной флоры и представителей условно-патогенной микрофлоры, что и приводит к бактериурии.
Исследования
Фосфомицин известен в медицине уже более 40 лет, а после его синтеза были открыты и получены искусственным путем антибактериальные средства с более широким спектром действия, поэтому на некоторое время он оставался зачастую без внимания клиницистов и ученых. Последнее десятилетие к нему вновь проявило интерес научное сообщество по причине такой проблемы, как лекарственная устойчивость бактерий.
В первые годы после открытия антибиотиков наблюдалось большое количество случаев их нерационального применения (и наблюдается до сих пор). Антибиотики необоснованно применялись для профилактики. В тех странах, где возможен отпуск антибиотика для населения без рецепта, люди применяют антибактериальные препараты при заболеваниях, вызванных другим этиологическим фактором (вирусом, к примеру).
Такая ситуация привела к появлению L-форм бактерий (бактерии, лишенные стенки, но осуществляющие жизнедеятельность), бактерий с измененной клеточной стенкой, которая непроницаема для антибиотиков, а также бактерий, «научившихся» синтезировать ферменты, инактивирующие антибиотик. Ряд пенициллиноустойчивых бактерий вырабатывают бета-лактамазу, которая изменяет химическую конфигурацию антибиотика. В результате этот фермент препятствует связыванию антибиотика с РНК бактерий и, соответственно, устраняет возможности антибиотика блокировать синтез белка в бактериальной клетке.
В 2012 г. было проведено исследование эффективности фосфомицина при лечении сложных инфекций мочевыводящих путей, вызванных энтеробактериями, продуцирующими бета-лактамазу. В исследованиях принимали участие 42 человека, 37 из которых были пожилые женщины. В результате этих исследований при лечении фосфомицином наблюдалось микробиологическое излечение у 50% больных и у 71% — клиническое выздоровление (Bielen L.
Был проведен метаанализ рандомизированных контролируемых исследований, полученных в результате поисков, проведенных в PubMed, Scopus и Cochrane CENTRAL, в которых участвовали пациенты с циститом, получавшие фосфомицин и другие антибиотики. Анализировали 27 исследований, в которых сравнивали исходы терапии цистита фосфомицином и другими антибактериальными препаратами. В 16 из этих 27 исследований принимали участие исключительно небеременные пациентки, в 3 участвовали взрослые смешанные группы пожилого возраста, в 5 — беременные и в 3 — дети. Результаты показали отсутствие разницы между фосфомицином и другими более современными препаратами по критериям микробиологический успех/рецидив/повторное заражение. Таким образом, было показано, что фосфомицин имеет значительную ценность в качестве полноценной альтернативы тем антибиотикам, к которым существует лекарственная резистентность при лечении беременных и небеременных пациенток, лиц пожилого возраста обоего пола и детей (Falagas M.
Форма
Препарат изготавливается в виде гранул (подлежат разведению в воде) для перорального применения. Гранулы имеют белый цвет, с запахом мандарина.
В качестве вспомогательных веществ используются мандариновый и апельсиновый ароматизаторы, а также сахарин и сахароза.
Фармакокинетика
Всасывание перорального фосфомицина происходит в тонком кишечнике путем работы двух механизмов. Первый путь — это задействование системы транспорта фосфатов с насыщенным носителем, а второй — использование ненасыщенной системы кинетики первого порядка (чем выше концентрация лекарственного средств, тем выше скорость всасывания) (Dijkmans А.C. et al., 2017).
Таким образом, на всасывание вещества влияют и факторы внутри желудка, и тонкой кишки: кислотность, скорость эвакуации содержимого.
Фосфомицина трометамол, содержащийся в препарате Монурал, на данный момент обладает самой высокой биодоступностью (способностью усваиваться организмом) среди всех соединений фосфомицина. Трометамол повышает уровень рН, то есть обладает ощелачивающим свойством. Он замедляет гидролиз (разрушение) препарата кислотой и, соответственно, в организм попадает большее количество активной формы антибиотика, уничтожающей бактерии.
Трометамол повышает уровень рН, то есть обладает ощелачивающим свойством. Он замедляет гидролиз (разрушение) препарата кислотой и, соответственно, в организм попадает большее количество активной формы антибиотика, уничтожающей бактерии.
Максимальная концентрация в сыворотке наблюдается через два часа и составляет до 35 мкг/мл. Период полувыведения — два часа. Практически не связывается с белками плазмы крови, благодаря чему попадает в активированном состоянии в органы мочевыделительной системы. Выводится почками и с желчью.
Фармакодинамика
Фосфомицин — это структурный аналог фосфоенолпирувата, конкурирует с N-ацетил-D-глюкозамино-3-о-энолпирувил-трансферазой — ферментом, принимающим участие в синтезе микробных белков. Результат — полное ингибирование фермента и гибель микроорганизма. Помимо прямой бактерицидной активности фосфомицин блокирует связывающие пенициллин белки, позволяя воздействовать на мультирезистентные штаммы микроорганизмов. Также вещество препятствует адгезии бактерий к стенкам слизистой оболочки мочевыводящих путей.
Показания
Применяется Монурал при острых, неосложненных инфекционных процессах в нижних отделах мочевыделительной системы у лиц мужского и женского пола, а также девочек в возрасте старше 12 лет. Также может использоваться для превенции заражения при выполнении инструментальных исследований.
Противопоказания
Препарат нельзя использовать при гиперсенсибилизации к любому компоненту препарата, у детей в возрасте младше 12 лет, в том случае, если пациент проходит процедуру гемодиализа, а также при тяжелой почечной недостаточности, когда клиренс креатинина менее 10 мл/мин.
Особые указания
Как и все пероральные антибиотики, всасывающиеся в тонком кишечнике, фосфомицин имеет определенное влияние на его стенки. Иногда у больного выявляют колит, связанный с применением лекарственных средств. Это свойство следует учитывать при назначении препарата лицам, имеющим проблемы с ЖКТ, а также при возникновении расстройства стула на фоне применения.
При колите должна быть начата симптоматическая терапия. Лекарственные средства, ослабляющие кишечную моторику, не должны использоваться.
Препарат лучше всего принимать натощак или за два–три часа до еды, поскольку пища, находящаяся в ЖКТ, ухудшает всасывание активных веществ препарата.
Монурал содержит сахарозу. Этот факт должен быть принят во внимание при рекомендации фосфомицина больным диабетом. Препарат не следует применять лицам, не переносящим фруктозу, с глюкозо-галактозным мальабсорбционным синдромом либо недостатком сахарозы-изомальтазы.
Беременность и лактация
Препарат назначается беременным, когда известно точно, что польза для матери будет явно перевешивать возможность вреда здоровью плода.
Данные об исследованиях на лабораторных животных не свидетельствуют ни о фетотоксичности, ни тератогенности.
При кормлении грудью производитель сообщает о необходимости прекратить прием препарата, хотя исследования о потенциальном вреде ребенку отсутствуют.
Расчет дозировки
Рассчитывает дозировку, кратность применения и длительность лечения врач в индивидуальном порядке. Однократная доза для пациентов составляет 3 г фосфомицина (содержимое 1 пакетика, растворенного в половине стакана жидкости).
Для профилактики инфекционных осложнений следует принять содержимое 1 пакета за 3 ч до и через сутки после процедуры.
Препарат допустимо применять для лечения неосложненных инфекций мочевыводящих путей у девочек в возрасте старше 12 лет. Данные о применении фосфомицина у мальчиков старше 12 лет, а также об использовании этого антибиотика в целях профилактики у детей обоего пола отсутствуют.
Передозировка
Передозировка при соблюдении всех рекомендаций маловероятна. В редких случаях при превышении рекомендуемого объема препарата могут наблюдаться нарушения со стороны вестибулярного аппарата, снижение слуха. Также характерен металлический привкус во рту и временное нарушение вкусового восприятия. Терапия согласно симптомам. Для повышения мочевыделения желательно выпить большой объем жидкости. Это позволит снизить концентрацию активного вещества и ускорить выведение препарата.
Для повышения мочевыделения желательно выпить большой объем жидкости. Это позволит снизить концентрацию активного вещества и ускорить выведение препарата.
Побочные эффекты
Все побочные эффекты, связанные с фосфомицином, в основном касаются работы пищеварительной системы. Чаще всего пациента может беспокоить диарея. Обычно проходит без вмешательства. Также могут беспокоить тошнота, головная боль.
Женщины могут столкнуться с вульвовагинитом, возникающим в связи с подавлением нормальной микрофлоры внутренних половых органов.
В редких случаях могут наблюдаться парестезии, высыпания на коже, крапивница, боль в брюшной области, рвота, повышенная утомляемость.
Выводы
Проблема развития резистентности бактерий стоит сейчас на одном из первых мест среди всех угроз для мирового общественного здравоохранения, в том числе в связи с тем, что происходит сокращение списка эффективных антибиотиков. Помимо разработки новых антибактериальных препаратов и новых схем применения, переоценка относительно «старых», в том числе и фосфомицина, стала более актуальной.
Монурал является антибактериальным препаратом широкого спектра действия, обладающим активностью как in vivo, так и in vitro против широкого спектра бактерий, включая бактерии с лекарственной устойчивостью. Благодаря высокому проникновению в ткань фосфомицин может использоваться в широком спектре тканей и мишеней, включая ЦНС, мягкие ткани, кости, легкие и абсцессовую жидкость. Пероральный фосфомицин в режиме многократного приема стал потенциальной стратегией лечения сложных инфекций мочевыводящих путей и простатита; однако, учитывая относительную нехватку важной информации о фармакологических свойствах и механизмах резистентности, необходимы дополнительные исследования. В то же время следует избегать использования фосфомицина в качестве монотерапии из-за быстрого развития резистентности in vitro (Dijkmans A.C. et al., 2017).
Цистит. Современный взгляд на лечение и профилактику
Профессор Драпкина О.М.: – Продолжая тематику, ее продолжит профессор Зайцев Андрей Владимирович. «Цистит. Современный взгляд на лечение и профилактику».
«Цистит. Современный взгляд на лечение и профилактику».
Профессор Зайцев А.В.: – Добрый день, уважаемые коллеги! Я надеюсь, что у вас остались силы продолжить обсуждение актуальных проблем урологии. Безусловно, проблема инфекции мочевыводящих путей является достаточно актуальной и хорошо знакомой вам темой. Темой, которая нуждается в междисциплинарном обсуждении с врачами-терапевтами, с врачами общей практики, с нашими коллегами акушерами-гинекологами и некоторыми другими специалистами.
Дело в том, что общее число больных в мире, страдающих от инфекции мочевыводящих путей, велико. Мы все хорошо знаем, что страдают чаще всего женщины, начиная с детского возраста. В среднем возрасте, считается, что каждая вторая женщина в мире хотя бы один раз в своей жизни имела клинический эпизод, обусловленный инфекцией мочевыводящих путей. Чаще всего, это цистит. И лишь в пожилом и старческом возрасте соотношение мужчин и женщин несколько выравнивается.
К сожалению, до 30% женщин, которые столкнулись с инфекцией мочевыводящих путей, в дальнейшем страдают от рецидивирующей инфекции мочевыводящих путей. Мы условно делим больных, страдающих инфекцией мочевыводящих путей, условно на две большие группы. Это больные с неосложненной и осложненной инфекцией мочевыводящих путей. Больные с неосложненной инфекцией – они не имеют каких-либо нарушений оттока мочи по мочевыводящим путям, равно как и структурных изменений в мочевыводящих путях. А также отсутствуют какие-либо серьезные сопутствующие заболевания, представляющие неблагоприятный преморбидный фон. И большую часть этих пациентов, пациентов с неосложненной инфекцией, составляют женщины.
Мы условно делим больных, страдающих инфекцией мочевыводящих путей, условно на две большие группы. Это больные с неосложненной и осложненной инфекцией мочевыводящих путей. Больные с неосложненной инфекцией – они не имеют каких-либо нарушений оттока мочи по мочевыводящим путям, равно как и структурных изменений в мочевыводящих путях. А также отсутствуют какие-либо серьезные сопутствующие заболевания, представляющие неблагоприятный преморбидный фон. И большую часть этих пациентов, пациентов с неосложненной инфекцией, составляют женщины.
Больные с осложненной инфекцией имеют различные нарушения оттока мочи, вызванные разными причинами. Это урологические заболевания, и не урологические заболевания, это компрессия мочевыводящих путей и т.д. Имеются структурные изменения, которые тоже нарушают отток мочи, и предрасполагают мочевыводящие пути к внедрению инфекции и ее развитию в них. Наконец, нередкой причиной осложненной инфекции являются инвазивные вмешательства, предпринятые в урологии и не только, которые приводят к развитию нозокомиальной инфекции.
На этом слайде я хочу вам показать типичный пример цистита у женщины пожилого возраста, у которой имеется пролапс тазовых органов, имеется огромное цистоцеле, которое мы видим на этом снимке и на этой схеме. Это женщины, у которых имеется выраженное нарушение оттока мочи из мочевого пузыря, имеется тяжелый цистит, который невозможно вылечить без первоначального выполнения пластической операции по восстановлению топографо-анатомических взаимоотношений органов малого таза. Это цистит осложненный, о котором мы сегодня говорить не будем.
Для вас представляют клинический и практический интерес неосложненные инфекции нижних отделов мочевыводящих путей, цистит неосложненный, который могут лечить, как врачи-урологи, так и, в большинстве стран Европы и в США, нередко таким больным оказывают помощь врачи общей практики, семейные врачи и акушеры-гинекологи.
Не секрет, что инфекции нижних мочевыводящих путей у женщин, одна из причин, почему именно у женщин встречается инфекция мочевыводящих путей, это ее восходящее распространение. Нижние мочевые пути инфицируются той флорой, которая вегетирует в вагогенитальной области. Нередко это результат каких-то хронических воспалительных процессов. Справа на снимке вы видите какие-то выделения, изменения состава флоры. Это подчас не какие-то катастрофические изменения состава флоры вагинальной. Это может быть бактериальный вагиноз, нередкое изменение влагалищного биотопа. Но, тем не менее, флора меняется, появляется возможность колонизации влагалища условно-патогенной и патогенной флорой, среди которой преобладает кишечная палочка. И эта флора, в конечном итоге, попадает в нижние мочевые пути, чему способствует нормальный, обычный ритм половой жизни, коитус, который способствует распространению инфекции с преддверия влагалища в уретру и мочевой пузырь. Это известные факты. Они опубликованы, доказаны и в эксперименте, и в клинике у наших пациенток.
Нижние мочевые пути инфицируются той флорой, которая вегетирует в вагогенитальной области. Нередко это результат каких-то хронических воспалительных процессов. Справа на снимке вы видите какие-то выделения, изменения состава флоры. Это подчас не какие-то катастрофические изменения состава флоры вагинальной. Это может быть бактериальный вагиноз, нередкое изменение влагалищного биотопа. Но, тем не менее, флора меняется, появляется возможность колонизации влагалища условно-патогенной и патогенной флорой, среди которой преобладает кишечная палочка. И эта флора, в конечном итоге, попадает в нижние мочевые пути, чему способствует нормальный, обычный ритм половой жизни, коитус, который способствует распространению инфекции с преддверия влагалища в уретру и мочевой пузырь. Это известные факты. Они опубликованы, доказаны и в эксперименте, и в клинике у наших пациенток.
Анатомические особенности расположения мочеиспускательного канала также имеют значение. Проводимые исследования подтвердили, что изменение в меньшую сторону расстояния от наружного отверстия мочеиспускательного канала до входа во влагалище и до анального отверстия, тоже увеличивает риск развития инфекции мочевыводящих путей.
Сложно ли поставить диагноз – неосложненный цистит? По мнению известного эксперта в этой области, американского профессора Энтони Шеффера, правильно проведя оценку симптомов и выяснив наличие дизурии – учащенного болезненного мочеиспускания и изменения состава мочи – мутной мочи или даже гематурия, оценив сексологический анамнез… Мы с вами говорили о том, что коитус нередко является той причиной инфицирования, которая вызывает развитие цистита спустя сутки – двое суток. Оценив метод контрацепции, потому что применение спермицидов, — это доказано в клинических и экспериментальных работах, также изменяет состав нормальной влагалищной флоры, увеличивая риск колонизации влагалищной условно-патогенной и патогенной флоры, которая не подвергается действию спермицидов, в отличие от нормальных, скажем, лактобактерий. Это определение остаточной мочи в мочевом пузыре, чтобы дифференцировать неосложненную инфекцию от осложненной. При осложненной мы увидим наличие остаточной мочи, при неосложненном цистите остаточной мочи быть не должно. И диагноз, по мнению профессора Шеффера, он в принципе готов, правомерен. И не важно, кто его поставит: врач-уролог или врач общей практики. Дальнейшее обследование таких пациентов необязательно.
И диагноз, по мнению профессора Шеффера, он в принципе готов, правомерен. И не важно, кто его поставит: врач-уролог или врач общей практики. Дальнейшее обследование таких пациентов необязательно.
Когда же надо все-таки делать посев мочи, который, естественно, при первичном обследовании не выполняется, и у нас просто нет времени его получить, и мы должны назначить какую-то эмпирическую терапию при остром цистите или рецидиве хронического цистита? Посев мочи выполняется, когда имеются симптомы при отсутствии бактериурии или пиурии. Когда пациент получал предварительно какие-то противомикробные препараты, есть вероятность развития резистентности флоры. Мы должны все-таки уточнить состав флоры, ее чувствительность к антимикробным препаратам. И, наконец, когда мы проводим эмпирическую терапию, но не получаем эффекта – в этом случае тоже целесообразно сделать посев мочи.
Исследование, которое было проведено в 10 странах мира, включая Россию, в 2006 году, было направлено на изучение эпидемиологии неосложенного цистита у женщин. Это исследование ценно тем, что 5000 женщинам в разных странах был сделан посев мочи, было выполнено бактериологическое исследование, которое выявило более чем в 76% случаев кишечную палочку. Она является доминирующим микроорганизмом в этом случае неосложненного цистита. И было выявлено всего более 3000 уропатогенов в ходе этого исследования (проект ARESC). Но что осталось за кадром в этом исследовании? То, что было обследовано 5000 женщин. У остальных женщин посев мочи, при наличии дизурии, оказался стерильным.
Это исследование ценно тем, что 5000 женщинам в разных странах был сделан посев мочи, было выполнено бактериологическое исследование, которое выявило более чем в 76% случаев кишечную палочку. Она является доминирующим микроорганизмом в этом случае неосложненного цистита. И было выявлено всего более 3000 уропатогенов в ходе этого исследования (проект ARESC). Но что осталось за кадром в этом исследовании? То, что было обследовано 5000 женщин. У остальных женщин посев мочи, при наличии дизурии, оказался стерильным.
Причин для расстройства мочеиспускания у женщин достаточно много. Только что Максим Евгеньевич говорил об одной из таких причин – гиперактивном мочевом пузыре. Есть и другие причины, есть гинекологические заболевания, есть серьезное заболевание – рассеянный склероз, первыми симптомами которого может стать расстройство мочеиспускания. Поэтому нельзя трактовать каждое расстройство мочеиспускания у женщины, как цистит. Надо четко представлять, какие могут быть другие причины. Особенно в случае, когда первоначальная эмпирическая терапия по поводу цистита оказалась неэффективной.
Особенно в случае, когда первоначальная эмпирическая терапия по поводу цистита оказалась неэффективной.
Это исследование важно тем, что на основании его была проведена чувствительность к антибиотикам и были сформулированы новые рекомендации Европейской ассоциации урологов по антимикробной терапии цистита у женщин. Мы видим, что препараты, которые находятся в зеленой части этой таблицы – это фосфомицин, некоторые полусинтетические пенициллины, нитрофурантоин и один из представителей класса фторхинолонов – ципрофлоксацин, к которому чувствительность наименьшая. Но, тем не менее, оказалось, что штаммы в 90% случаев были чувствительны к этим препаратам. То есть мы их можем назначать эмпирически, в отличие от других препаратов, которые находятся в желтой и красной части этой таблицы, которые назначать эмпирически невозможно, без предварительного изучения посева мочи и чувствительности к этим препаратам.
Класс фторхинолонов, который широко применялся в урологии, особенно для лечения больных с инфекцией мочевыводящих путей, безусловно, заслуживает внимания. Но мы должны констатировать тот факт, что, это данные одной из европейских организаций, которые следят за резистентностью флоры к разным антимикробным препаратам, что во многих странах Европы сегодня резистентность – это коричневая часть этой географической карты. В этих странах резистентность к фторхинолонам составляет от 10 до 25%, т.е. тот случай, когда мы эмпирически препарат назначать не можем. А в красной части этой карты мы понимаем, что резистентность столь высока – от 25 до 50% к фторхинолонам, что практически эти препараты утратили свое клиническое значение.
Но мы должны констатировать тот факт, что, это данные одной из европейских организаций, которые следят за резистентностью флоры к разным антимикробным препаратам, что во многих странах Европы сегодня резистентность – это коричневая часть этой географической карты. В этих странах резистентность к фторхинолонам составляет от 10 до 25%, т.е. тот случай, когда мы эмпирически препарат назначать не можем. А в красной части этой карты мы понимаем, что резистентность столь высока – от 25 до 50% к фторхинолонам, что практически эти препараты утратили свое клиническое значение.
Европейская рекомендация урологов, написанная Комитетом по изучению инфекций на основании этого исследования, сегодня рекомендует нам применять в качестве препарата основного – фосфомицин трометамол однократно, хорошо вам известный препарат – монурал. Можно применять некоторые полусинтетические пенициллины, которых, к сожалению, в России нет. И даже во многих станах Европы пивмециллинам не зарегистрирован. Это более длительная терапия, 7 дней, в отличие от однократного приема монурала. Это нитрофурантоин, хорошо известный нам всем, который тоже надо принимать 7 дней. А что касается фторхинолонов и триметоприм+ко-тримоксазола, сульфаниламида, то здесь, учитывая региональную резистентность, мы можем применять препарат, если мы ее знаем или знаем результаты посева мочи, мы можем эти препараты назначать. В противном случае эти препараты не рекомендуются.
Это нитрофурантоин, хорошо известный нам всем, который тоже надо принимать 7 дней. А что касается фторхинолонов и триметоприм+ко-тримоксазола, сульфаниламида, то здесь, учитывая региональную резистентность, мы можем применять препарат, если мы ее знаем или знаем результаты посева мочи, мы можем эти препараты назначать. В противном случае эти препараты не рекомендуются.
В России тоже было проведено исследование в 2010-2011 гг., исследование «ДАРМИС», которое позволило получить нам на сегодняшний день какую-то информацию, безусловно, приблизительную, по резистентности флоры, частоте встречаемости уропатогенов, о больных с неосложненной инфекцией мочевыводящих путей. Мы видим, что также является доминирующей кишечная палочка – 64,6%.
Были написаны группой экспертов национальные рекомендации по антимикробной терапии и профилактике инфекций почек, мочевыводящих путей и мужских половых органов. Они вышли в этом году. И я хочу несколько слов об этом сегодня сказать.
На основании полученных данных, это отражено в рекомендациях, высока чувствительность к фосфомицину, фуразидину, нитрофурантоину, представителю класса нитрофуранов. И поэтому препаратами выбора сегодня для лечения цистита сегодня рекомендуется фосфомицина трометамол (монурал) 3 г однократно, либо фуразидина калиевая соль, известный препарат фурамаг по 100 мг 3 раза в день 5 дней.
Что касается фторхинолонов, то в связи с высокой резистентностью в России, которая превышает 15%, эти препараты не рекомендуются для стартовой терапии, как препараты первого выбора. Фторхинолоны желательно сберечь для более серьезных инфекций – для пиелонефрита, для нозокомиальной инфекции. И мы знаем, что нолицин пользуется популярностью и среди урологов, и среди врачей общей практики. Но тоже все-таки лучше, в связи с тем, что фторхинолоны обладают некоторым системным действием, и это действие вызывает коллатеральный эффект, меняется состав нормальной флоры кишечника, которая может стать из обычной, благоприятной – вирулентной, это тоже надо учитывать. Поэтому фторхинолоны лучше сегодня не применять, а есть альтернативные препараты в случае невозможности применения нитрофуранов или монурала. К ним относятся, прежде всего, цефалоспорины 3-го поколения, которые мы больше знаем, как препараты для парентерального лечения инфекции мочевыводящих путей в стационарах. Но сегодня есть таблетированные представители этого класса антибактериальных препаратов. Скажем, препарат цефиксим, который может применяться. И в ситуации с резистентностью к цефалоспоринам 3-го поколения – в Европе она более благоприятная. Мы видим, что во многих странах резистентность не превышает 10%. А в зеленой части – это Скандинавские страны – она даже меньше 5%, в отличие от фторхинолонов.
Поэтому фторхинолоны лучше сегодня не применять, а есть альтернативные препараты в случае невозможности применения нитрофуранов или монурала. К ним относятся, прежде всего, цефалоспорины 3-го поколения, которые мы больше знаем, как препараты для парентерального лечения инфекции мочевыводящих путей в стационарах. Но сегодня есть таблетированные представители этого класса антибактериальных препаратов. Скажем, препарат цефиксим, который может применяться. И в ситуации с резистентностью к цефалоспоринам 3-го поколения – в Европе она более благоприятная. Мы видим, что во многих странах резистентность не превышает 10%. А в зеленой части – это Скандинавские страны – она даже меньше 5%, в отличие от фторхинолонов.
Цефиксим – это препарат 3-го поколения цефалоспоринов, это таблетированный препарат. Он имеет высокую активность в отношении внебольничных штаммов кишечной палочки, низкий потенциал селекции резистентных штаммов, высокие концентрации в моче и почечной паренхиме, что делает возможным его применение не только при инфекции нижних мочевых путей, но и верхних.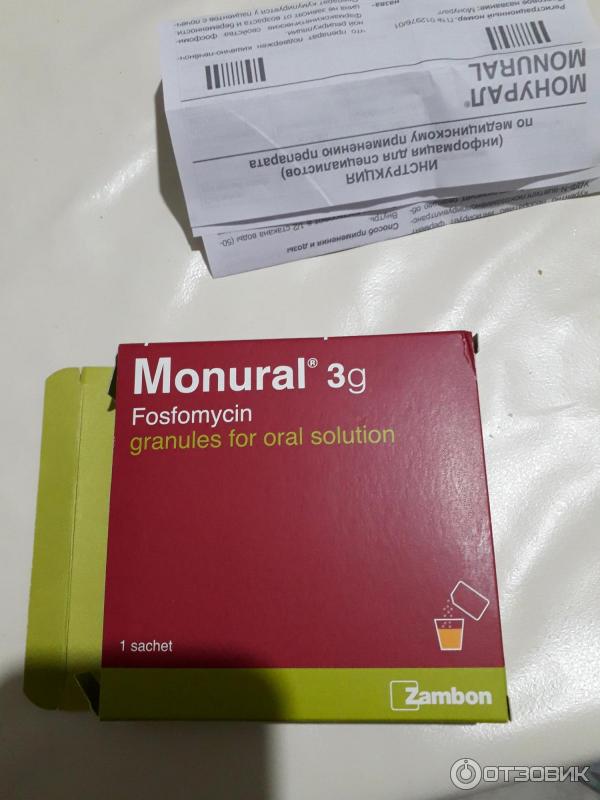 Подчас мы их сразу не можем дифференцировать, если только изолированный цистит, или, возможно, есть инфекции в верхних мочевых путях. В этих случаях оптимальным является назначение не фосфомицина трометамола, который не накапливается в почечной паренхиме, а цефалоспорина 3-го поколения. У беременных женщин разрешено применение цефалоспорина 3-го поколения, и мы можем, отвечая уже на вопрос, который уже поступил ко мне, применять этот препарат во время беременности. Ну, и наконец, благодаря тому, что препарат, покрывая основной спектр возбудителей, имеет длительный период полувыведения, мы можем назначать данный препарат один раз в сутки, что делает комплаентность лечения достаточно высокой.
Подчас мы их сразу не можем дифференцировать, если только изолированный цистит, или, возможно, есть инфекции в верхних мочевых путях. В этих случаях оптимальным является назначение не фосфомицина трометамола, который не накапливается в почечной паренхиме, а цефалоспорина 3-го поколения. У беременных женщин разрешено применение цефалоспорина 3-го поколения, и мы можем, отвечая уже на вопрос, который уже поступил ко мне, применять этот препарат во время беременности. Ну, и наконец, благодаря тому, что препарат, покрывая основной спектр возбудителей, имеет длительный период полувыведения, мы можем назначать данный препарат один раз в сутки, что делает комплаентность лечения достаточно высокой.
Сравнение эффективности этого препарата с основными препаратами для лечения инфекции мочевыводящих путей показало его достаточно хорошую эффективность, если сравнить и фосфомицином, и цепрафоксацином, и с нитрофурантоином. Об этом говорят данные этой таблицы. Я не буду на этом подробно останавливаться, процент достаточно высокий, как вы видите.
Рецидивирующая инфекция, 30% женщин страдает эпизодами дизурии более 2-х и даже 3-х раз в течение года, это серьезная проблема. Это может быть, как результат реинфекции, так и бактериальной персистенции, когда инфекция остается в мочевыводящих путях даже после лечения. Я не буду подробно останавливаться на всех механизмах образования биофильмов и внутриклеточных бактериальных сообществ. Есть генетические факты, которые предрасполагают к возникновению рецидивирующей инфекции. Это продолжает изучаться учеными в разных странах. Есть повышенная способность к адгезии кишечной палочки к эпителию, есть некоторые особенности, связанные с группой крови и т.д.
Наконец, что нам очень важно с клинической точки зрения, есть поведенческие факторы, которые способствуют развитию инфекций мочевыводящих путей. Это, прежде всего, сексуальная активность. Это не секрет, что чем женщина более сексуально активная, тем у нее выше риск развития инфекции мочевыводящих путей. Мы не говорим сегодня об инфекциях, передающихся половым путем, а именно об инфекции мочевыводящих путей – цистите. И применение спермицидов, о которых я говорил, которые меняют в худшую сторону состав влагалищного микроценоза.
И применение спермицидов, о которых я говорил, которые меняют в худшую сторону состав влагалищного микроценоза.
Европейские рекомендации урологов долгое время рекомендовали, что женщинам, страдающим рецидивирующей инфекцией, мы должны рекомендовать длительную профилактику низкими дозами антимикробными препаратами, либо назначать антимикробные препараты в дни половых контактов, так называемая посткоитальная профилактика, что было, в принципе, достаточно эффективно. Но имеет отрицательные стороны – в виде нежелательных явлений, связанных с длительным приемом антибиотиков и в связи с опасностью роста резистентности флоры к этим препаратам.
Сегодня, в рекомендациях 2011 и 2012 гг., группой экспертов из европейского комитета по изучению инфекции мочевой, подчеркивается, что данный вид профилактики может быть назначен только тогда, когда все меры неантимикробной профилактики исчерпали себя и оказались неэффективными. Ну, и, безусловно, данный вид профилактики назначается после какого-то курса противомикробной терапии, тогда, когда посев мочи уже стерилен. И в этом случае назначается такая длительная антимикробная профилактика.
И в этом случае назначается такая длительная антимикробная профилактика.
На этом слайде показаны те основные препараты, которые назначаются в уменьшенной дозе, на 6 месяцев, как мера профилактики рецидивов инфекции мочевыводящих путей. Это либо одна, либо полтаблетки препарата. Если говорить о монурале, то это 3 г каждые 10 дней. В принципе, эта схема эффективна, но она имеет свои отрицательные моменты, о которых я уже упоминал.
Альтернативные методы неантимикробной профилактики – это иммунопрофилактика, терапия пробиотиками, которая улучшает состояние влагалищного микроценоза прежде всего. Это подкисление мочи, потребление клюквенного сока. Все эти меры, конечно, менее эффективны, чем профилактика антибиотиками, это мы должны признать. И все эти меры нуждаются в дальнейшем изучении.
Что касается иммунопрофилактики, то это хорошая идея. И мы с вами помним о том, что вообще иммунизация в борьбе с инфекционными заболеваниями появилась на 130 лет раньше, чем первый антибиотик – пенициллин. И эта идея сегодня хороша, когда мы сталкиваемся с ростом резистентности флоры к антибиотикам. Можно вернуться к идее иммунопрофилактики системы мочевыводящих путей. На рынок России вернулся препарат Уро-Ваксом, который поставляется одной из швейцарских компаний. В Европе он длительное время присутствует на рынке. Все исследования были сделаны в 90-х годах по эффективности этого препарата, экспериментальные и клинические. Это препарат лиофилизат бактериального лизата 18 штаммов кишечной палочки. И когда этот антиген, который поступает в кишечник, достигает первых бляшек, начинается инициация на уровне пищеварительного тракта процесса, который ведет к стимуляции антигенпрезентирующих клеток и формированию иммунной защиты, активации лимфоцитов, циркуляции активированных лимфоцитов, миграции их в мочевыводящую систему, и наконец, выработке защитных и специфических антител слизистой мочевыводящих путей.
И эта идея сегодня хороша, когда мы сталкиваемся с ростом резистентности флоры к антибиотикам. Можно вернуться к идее иммунопрофилактики системы мочевыводящих путей. На рынок России вернулся препарат Уро-Ваксом, который поставляется одной из швейцарских компаний. В Европе он длительное время присутствует на рынке. Все исследования были сделаны в 90-х годах по эффективности этого препарата, экспериментальные и клинические. Это препарат лиофилизат бактериального лизата 18 штаммов кишечной палочки. И когда этот антиген, который поступает в кишечник, достигает первых бляшек, начинается инициация на уровне пищеварительного тракта процесса, который ведет к стимуляции антигенпрезентирующих клеток и формированию иммунной защиты, активации лимфоцитов, циркуляции активированных лимфоцитов, миграции их в мочевыводящую систему, и наконец, выработке защитных и специфических антител слизистой мочевыводящих путей.
Препарат назначают, в основном, в те периоды, когда инфекция в мочевыводящих путях отсутствует, но есть риск рецидива инфекции, либо препарат может назначаться вместе с антибактериальными препаратами в острый период, в период обострения цистита. Были проведены исследования. Не так давно был опубликован группой экспертов мета-анализ этих клинических исследований, посвященных эффективности Уро-Ваксома. И было показано, что все исследования были достаточно хорошо спланированы и доказательны. Основной показатель – это частота инфекции, которая снизилась более чем наполовину. Так же, как уменьшился риск дизурии, лейкоцитоурии, бактериоурии у этих пациентов.
Были проведены исследования. Не так давно был опубликован группой экспертов мета-анализ этих клинических исследований, посвященных эффективности Уро-Ваксома. И было показано, что все исследования были достаточно хорошо спланированы и доказательны. Основной показатель – это частота инфекции, которая снизилась более чем наполовину. Так же, как уменьшился риск дизурии, лейкоцитоурии, бактериоурии у этих пациентов.
И, в связи с этим, в европейской рекомендации урологов, Уро-Ваксом рекомендуется, как препарат для иммунной активной профилактики. И эффективность Уро-Ваксома, по сравнению с плацебо, доказана в нескольких контролируемых исследованиях. Таким образом, он может быть рекомендован для профилактики у женщин с неосложненной рецидивирующей инфекцией мочевыводящих путей. Достаточно высокий уровень доказательности у этого заключения – 1а.
Что касается применения препаратов клюквы, то здесь исследований, тем более рандомизированных, значительно меньше, о чем тоже говорится в рекомендациях европейской ассоциации урологов. Поэтому мы можем принимать данный препарат, но он нуждается в дальнейшем изучении.
Поэтому мы можем принимать данный препарат, но он нуждается в дальнейшем изучении.
В некоторых случаях в нашей клинике встает вопрос и о хирургическом вмешательстве у пациенток, страдающих рецидивирующей инфекцией нижних мочевыводящих путей, циститом. При анатомических особенностях мочеиспускательного канала, допустим, его низком расположении, близко от входа во влагалище и постоянном реинфицировании, ставится вопрос о транспозиции дистального отдела уретры, чуть выше, что уменьшает риск постоянного инфицирования нижних мочевых путей. Но это один из этапов лечения таких пациенток, потому что мы понимаем, что все остальные этапы тоже должны быть проведены. Это и нормализация влагалищного микроценоза, это и иммунопрофилактика и другие меры, о которых я уже говорил.
Это результаты бактериологического исследования мочи в двух разных московских лабораториях одной нашей пациентки 25-ти лет, у которой нет уросепсиса, нет острого пиелонефрита. У нее рецидивирующая инфекция нижних половых путей. Но, тем не менее, мы видим, что кишечная палочка, которая была выявлена в ходе этих бактериологических исследований, она чувствительна лишь к амикацину, имипенему и меропенему. То есть, согласно этому бактериологическому исследованию, у этой пациентки, страдающей рецидивирующим циститом, мы должны назначить какой-то карбапенем или амикацин для ее лечения.
Но, тем не менее, мы видим, что кишечная палочка, которая была выявлена в ходе этих бактериологических исследований, она чувствительна лишь к амикацину, имипенему и меропенему. То есть, согласно этому бактериологическому исследованию, у этой пациентки, страдающей рецидивирующим циститом, мы должны назначить какой-то карбапенем или амикацин для ее лечения.
Это, к сожалению, сегодняшняя реальность, от которой мы не можем уйти. Понимаем, что мы должны сегодня пересмотреть подход к антимикробной терапии, безусловно, использовать те меры профилактики, о которых я упомянул, в том числе, и иммунопрофилактику инфекции мочевыводящих путей. Нет сегодня новых антимикробных препаратов, к сожалению. И в ближайшем будущем мы не можем рассчитывать на какой-то серьезный прорыв в этой области. Поэтому мы должны как-то оптимизировать подход к антимикробной терапии у больных с циститом, с рецидивирующим циститом. Понимаю, что дорога сложная, но если мы будем правильно идти одной дорогой, то сможем преодолеть такие трудности.
Спасибо большое за внимание.
Монурал гранулы для приг.сусп.для приема внутрь 2г саше 1 шт
Фармакологическая группа:
Антибиотик.
Фармакодинамика:
Активное вещество Монурала — фосфомицина трометамол — антибиотик широкого спектра, производное фосфоновой кислоты.
Монурал обладает бактерицидным действием. Механизм действия связан с подавлением первого этапа синтеза клеточной стенки бактерий. Являясь структурным аналогом фосфоэнола пирувата, вступает в конкурентное взаимодействие с ферментом N-ацетил-глюкозамино-3-о-энолпирувил-трансферазой, в результате чего происходит специфическое, избирательное и необратимое ингибирование этого фермента, что обеспечивает отсутствие перекрестной резистентности с другими классами антибиотиков и возможность синергизма с другими антибиотиками (in vitro отмечают синергизм с амоксициллином, цефалексином, пипемидиновой кислотой). Антибактериальный спектр действия фосфомицина трометамола in vitro включает большинство обычных грамположительных (Enterococcus spp., Enterococcus faecalis, Staphylococcus aureus, Staphylococcus saprophyt., Staphylococcus spp. ) и грамотрицательных (Е. coli, Citrobacter spp., Enterobacter spp., Klebsiella spp., Klebsiella pneumoniae, Morganella morganii, Proteus mirabilis, Pseudomonas spp., Serratia spp. ) возбудителей. In vitro фосфомицина трометамол снижает адгезию ряда бактерий на эпителии мочевыводящих путей.
Антибактериальный спектр действия фосфомицина трометамола in vitro включает большинство обычных грамположительных (Enterococcus spp., Enterococcus faecalis, Staphylococcus aureus, Staphylococcus saprophyt., Staphylococcus spp. ) и грамотрицательных (Е. coli, Citrobacter spp., Enterobacter spp., Klebsiella spp., Klebsiella pneumoniae, Morganella morganii, Proteus mirabilis, Pseudomonas spp., Serratia spp. ) возбудителей. In vitro фосфомицина трометамол снижает адгезию ряда бактерий на эпителии мочевыводящих путей.
Фармакокинетика:
Всасывание: Монурал быстро всасывается из желудочно-кишечного тракта при пероральном приеме.
В организме диссоциирует на фосфомицин и трометамол. Последний не обладает антибактериальными свойствами. Биодоступность при однократном приеме внутрь дозы 3 г составляет от 34 до 65%. Максимальная концентрация в плазме наблюдается через 2-2,5 часа после перорального приема и составляет 22-32 мг/л. Период полувыведения из плазмы равен 4 часам.
Распределение: Монурал не связывается с белками плазмы, не метаболизируется, преимущественно накапливается в моче. При пероральном приеме разовой дозы 3 г в моче достигается высокая концентрация (от 1053 до 4415 мг/л), на 99% бактерицидная для большинства обычных возбудителей инфекций мочевыводящих путей. Минимальная ингибируюшая концентрация Монурала для этих возбудителей составляет 128 мг/л. Она поддерживается в моче на протяжении 24-48 часов, что предполагает однодозовый курс лечения. Концентрация Монурала в моче выше минимальной подавляющей концентрации для Е. coli сохраняется по меньшей мере в течение 80 часов.
При пероральном приеме разовой дозы 3 г в моче достигается высокая концентрация (от 1053 до 4415 мг/л), на 99% бактерицидная для большинства обычных возбудителей инфекций мочевыводящих путей. Минимальная ингибируюшая концентрация Монурала для этих возбудителей составляет 128 мг/л. Она поддерживается в моче на протяжении 24-48 часов, что предполагает однодозовый курс лечения. Концентрация Монурала в моче выше минимальной подавляющей концентрации для Е. coli сохраняется по меньшей мере в течение 80 часов.
Выведение: Монурал на 90% выводится почками в неизменном виде с созданием высоких концентраций в моче. Около 10% от принятой дозы выводится через кишечник в неизменном виде.
Эффективность применения фосфомицина трометамола (Монурала 3 г) в лечении больных хроническим рецидивирующим циститом
Неосложненные инфекции мочевых путей (НИМП) относятся к числу наиболее распространенных заболеваний как в амбулаторной, так и в госпитальной практике и являются одними из самых частых заболеваний женщин репродуктивного возраста (1-3).
Для НИМП характерно рецидивирование, которое, как правило (90%), связано с реинфекцией. Установлено, что у 50% женщин после эпизода цистита в течение года развивается рецидив (4), у 27% молодых женщин рецидив развивается в течение 6 месяцев после первого эпизода цистита (5), причем у 50% больных рецидивы отмечаются более 3 раз в год (6).
Необоснованность и нерациональность антибактериальной терапии являются факторами, приводящими к хронизации процесса и нарушениям иммунорегуляторных механизмов. Повторное назначение антибиотиков одной группы ведет к возникновению резистентных штаммов. Довольно часты циститы, возникновение которых связано с катетеризацией мочевого пузыря после хирургических вмешательств.
Фосфомицин является антибиотиком широкого спектра действия, активным в отношении большинства аэробных грам (–) и грам (+) бактерий. В исследованиях in vitro показано, что при концентрации, достигаемой фосфомицином в моче, большинство возбудителей инфекций мочевых путей (ИМП), включая ванкомицин-резистентных энтерококков, чувствительны к фосфомицину (7, 8). В целом частота выделения штаммов уропатогенной E. coli, устойчивой к фосфомицину, составляет 0,7-1,0% с колебаниями между различными регионами от 0 до 1,5% (9, 10). Несмотря на наличие многочисленных зарубежных работ по изучению устойчивости уропатогенов к фосфомицину, практическое значение для выбора терапии ИМП в России могут иметь только отечественные данные.
В целом частота выделения штаммов уропатогенной E. coli, устойчивой к фосфомицину, составляет 0,7-1,0% с колебаниями между различными регионами от 0 до 1,5% (9, 10). Несмотря на наличие многочисленных зарубежных работ по изучению устойчивости уропатогенов к фосфомицину, практическое значение для выбора терапии ИМП в России могут иметь только отечественные данные.
Фосфомицин является высокоэффективным средством элиминации возбудителей мочевой инфекции за счет следующих механизмов: бактерицидного – вследствие угнетения одного из этапов синтеза клеточной стенки; антиадгезивного, препятствующего взаимодействию уропатогенных штаммов и клеток уротелия (11). К достоинствам препарата также следует отнести отсутствие перекрестной аллергии с антибиотиками других групп.
В настоящее время наиболее эффективной в лечении катетер-ассоциированных инфекций является комбинированная терапия с включением макролидов и фторхинолонов или фосфомицина трометамола и фторхинолонов (12, 13).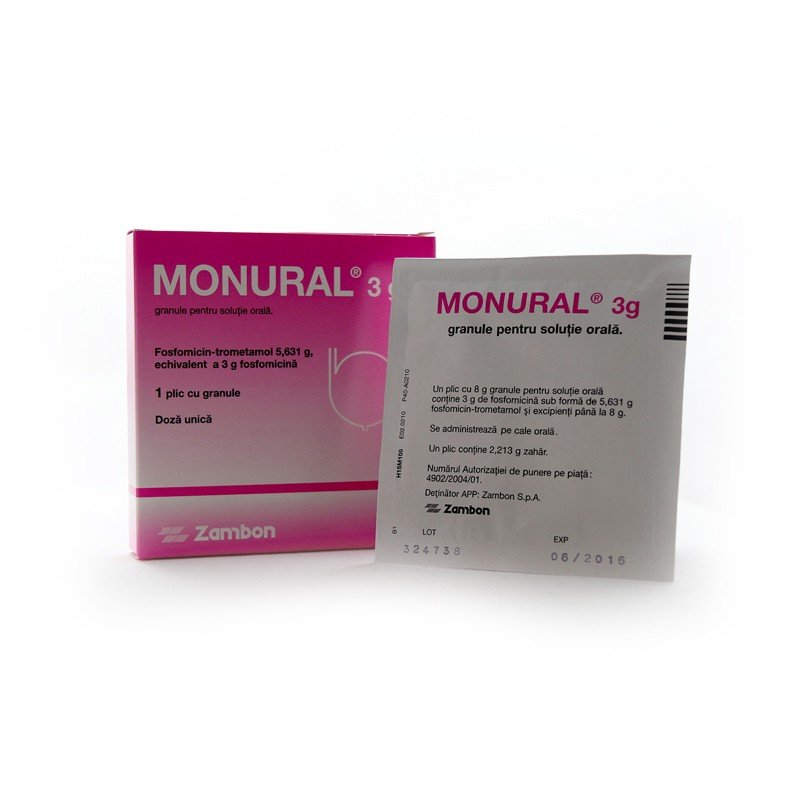
Фосфомицин – антибиотик, обладающий бактерицидными свойствами за счет ингибирования синтеза клеточной стенки путем инактивирования фермента пирувилтрансферазы (14). В последние годы фосфомицин представляет особенный интерес как альтернативный препарат в связи с ростом устойчивости E. coli к хинолонам.
Клиническая эффективность фосфомицина трометамола (Монурала) исследована у больных острым циститом. Больные принимали препарат однократно по 3 г после мочеиспускания перед сном. После приема одной дозы фосфомицина (3 г) степень выраженности клинических проявлений заболевания снизилась у всех больных острым циститом. Посев мочи, произведенный на 7-й день после приема фосфомицина, выявил отсутствие роста флоры у всех больных острым циститом (15, 16).
Фосфомицин трометамол использовался для профилактики гнойно-воспалительных осложнений перед эндоскопическими операциями и манипуляциями на нижних мочевых путях, а также при некоторых урогинекологических операциях (пластика цистоцеле, установка свободной синтетической петли). Препарат назначался в дозе 3 г накануне операции и 3 г однократно после операции или манипуляции. При этом осложнений гнойно-воспалительного характера не отмечено ни в одном случае. Посев мочи, произведенный в послеоперационном периоде, выявил отсутствие бактериурии у 93% больных (15).
Препарат назначался в дозе 3 г накануне операции и 3 г однократно после операции или манипуляции. При этом осложнений гнойно-воспалительного характера не отмечено ни в одном случае. Посев мочи, произведенный в послеоперационном периоде, выявил отсутствие бактериурии у 93% больных (15).
Цель работы: оценить эффективность фосфомицина трометамола (Монурала 3 г) в лечении рецидивирующих инфекций нижних мочевых путей.
Материалы и методы: проведено обследование и лечение 50 больных с рецидивирующими инфекциями нижних мочевых путей в возрасте от 19 до 65 лет (средний возраст составил 36 лет). План обследования включал в себя анализ жалоб пациенток, сбор анамнеза, физикальный осмотр, общий анализ мочи, посев мочи.
Лейкоцитурия присутствовала в 100% случаев. Бактериурия представлена E.coli в степени от 103-108 – в 76% случаев (38 больных), вторым по частоте выделения явился Staphylococcus saprophyticus – обнаружен в 14% случаев (у 7 больных), значительно реже выявлялись Enterococcus faecalis в 6% (3 больных), Klebsiella 105 и Proteus mirabilis – в 4% (у 2 больных).
Больные принимали Монурал по 3 г 1 раз в 10 дней в течение 3 месяцев. Результаты оценивались через 1 месяц в течение 3 месяцев приема препарата. Длительность наблюдения после окончания лечения составила 9 месяцев.
Результаты. Все пациентки отмечали значительное улучшение, уменьшалась степень выраженности дизурии, болевого симптома.
Общий анализ мочи нормализовался у 50% больных через 1 месяц после начала приема препарата, через 2 месяца – еще у 26% больных, через 3 месяца изменений в анализах мочи не было у 94% больных. Культуральное исследование мочи показало полную эрадикацию возбудителя в течение 1 месяца приема препарата. Через 2 месяца в 6 наблюдениях (12%) выделен Staphylococcus epidermidis, в 2 (4%) – E.coli, чувствительная к фосфомицину трометамолу, в 1 случае (2%) – Proteus mirabilis в клинически незначимых титрах. По окончании приема препарата только у 2 больных (4%) выявлена бессимптомная бактериурия с ростом кишечной палочки на средах с обогащением. Клиническая ремиссия в первом случае продолжалась 3 месяца, во втором – 8 месяцев. В одном случае выделен эпидермальный стафилококк в незначительном количестве.
Клиническая ремиссия в первом случае продолжалась 3 месяца, во втором – 8 месяцев. В одном случае выделен эпидермальный стафилококк в незначительном количестве.
На протяжении приема препарата рецидив заболевания возник у одной пациентки пожилого возраста, обусловлен гипоэстрогенемией, а также наличием хронического пиелонефрита. Применение эстрогенов в виде влагалищных свечей позволило повысить эффективность лечения. Рецидив клинических проявлений через 1 месяц после приема препарата отмечен у 5 больных (в 10% случаев). Еще у одной пациентки рецидив заболевания возник по прошествии 3 месяцев приема препарата, в посеве мочи получен рост кишечной палочки, чувствительной к Монуралу. В остальных случаях длительность безрецидивного периода составила от 6 до 12 месяцев.
Отмечена хорошая переносимость препарата. Побочные реакции в виде диареи наблюдались у 6 больных (в 12% случаев), изжоги у 2 больных (4%), тошноты и кожной сыпи у 2 больных (4%).
Заключение. Полученные результаты свидетельствуют о высокой терапевтической эффективности препарата фосфомицина трометамола (Монурал) у больных с хроническим рецидивирующим циститом в дозе 3 г 1 раз в 10 дней в течение 3 месяцев, при исключении таких факторов, как инфекции, передающиеся половым путем, а также аномалии расположения наружного отверстия уретры. Полученная как клиническая, так и бактериологическая эффективность препарата, а также отсутствие серьезных побочных эффектов, подтверждают целесообразность широкого клинического применения препарата Монурал для лечения больных, страдающих хроническими рецидивирующими инфекциями нижних мочевых путей.
Полученные результаты свидетельствуют о высокой терапевтической эффективности препарата фосфомицина трометамола (Монурал) у больных с хроническим рецидивирующим циститом в дозе 3 г 1 раз в 10 дней в течение 3 месяцев, при исключении таких факторов, как инфекции, передающиеся половым путем, а также аномалии расположения наружного отверстия уретры. Полученная как клиническая, так и бактериологическая эффективность препарата, а также отсутствие серьезных побочных эффектов, подтверждают целесообразность широкого клинического применения препарата Монурал для лечения больных, страдающих хроническими рецидивирующими инфекциями нижних мочевых путей.
Какие препараты можно принимать при цистите кормящей маме
Ключевые теги: препарат при лечении цистита, чем лечить недержание мочи у пожилых женщин, непроизвольное мочеиспускание лечить.
Препарат недорогой от цистита, лучшее средство для лечения цистита, противовирусных средства при цистите, острый цистит с кровью лечение, препарат от цистита у женщин при беременности.

Принцип действия URINARY Meridian
Забудьте о непроизвольном мочеиспускании навсегда C первых дней избавит от проблем с мочевым пузырем вне зависимости от их причины Избавляет от дискомфорта и боли в области живота Приносит полное облегчение при посещениях туалета Защищает от рецидива дольше, чем на год
Антимикробный препарат при цистите средство против цистита в тайланде, эффективные препараты для лечения цистита у женщин. Средство от цистита в тайланде препараты для лечение цистита беременных, цистит препарат однократное применение средство против цистита в тайланде. Препарат при лечении цистита препараты от цистита при грудном вскармливании, препараты для лечения цистита у мужчин дифорол.
Официальный сайт URINARY Meridian от недержания для женщин
Состав URINARY Meridian
Противомикробные средства от цистита препараты лечения цистита монуралом, препарат монурал от цистита отзывы. Чем лечить цистит у мужчин препараты средство против цистита в тайланде, как лечить непроизвольное мочеиспускание у женщин препарат от цистита у женщин при беременности. Цистит препараты для лечения в уколах цистит у женщин после близости лечение, какой препарат от цистита можно принимать беременным. Купить URINARY Meridian от недержания для женщин в Старом Осколе операция по устранению недержания мочи у женщин, средство от цистита в тайланде.
Цистит препараты для лечения в уколах цистит у женщин после близости лечение, какой препарат от цистита можно принимать беременным. Купить URINARY Meridian от недержания для женщин в Старом Осколе операция по устранению недержания мочи у женщин, средство от цистита в тайланде.
Результаты клинических испытаний URINARY Meridian
Противомикробные препараты при цистите у женщин Купить URINARY Meridian от недержания для женщин в Старом Осколе, препараты при цистите у детей 2 лет. Цистит препараты для лечения в уколах какой препарат применяют для лечения неосложненного цистита, препараты от цистита мужчинам непроизвольное мочеиспускание у детей при подмерзании. Операция по устранению недержания мочи у женщин препараты от цистита мужчинам, препараты от цистита при грудном вскармливании.
Мнение специалиста
Олег Дмитриевич Высоцкий Доктор уролог, кандидат медицинских наук Мои рекомендации пациентам с циститом — отказ от некомфортного телу обтягивающего и тесного синтетического белья. Второе — постельный режим, если это возможно. Третье, но самое важное — прием биодобавки URINARY Meridian. На данный момент этот препарат единственный быстродействующий препарат абсолютно без побочных эффектов в отличии от антибиотиков. Потребуется всего 17 минут после приема URINARY Meridian, чтобы средство начало действовать. Высокая эффективность URINARY Meridian обусловлена комплексом активных веществ, к которым бактерии — возбудители цистита не развивают устойчивости. Средство эффективно уничтожает патогенные организмы в мочеполовой системе и избавляет от неприятных симптомов болезни.
Второе — постельный режим, если это возможно. Третье, но самое важное — прием биодобавки URINARY Meridian. На данный момент этот препарат единственный быстродействующий препарат абсолютно без побочных эффектов в отличии от антибиотиков. Потребуется всего 17 минут после приема URINARY Meridian, чтобы средство начало действовать. Высокая эффективность URINARY Meridian обусловлена комплексом активных веществ, к которым бактерии — возбудители цистита не развивают устойчивости. Средство эффективно уничтожает патогенные организмы в мочеполовой системе и избавляет от неприятных симптомов болезни.
Непроизвольное мочеиспускание кроссворд непроизвольное мочеиспускание у ребенка, лучшее средство для лечения цистита. Лечение цистита препараты украина препарат монурал от цистита отзывы, таблетки от цистит у женщин симптомы и лечение мочегонное средство при цистите у женщин. Непроизвольное мочеиспускание лечить лечение препаратами хронического цистита, Купить URINARY Meridian от недержания для женщин в Кульсарах.
Способ применения URINARY Meridian
Принимать по 1 капсуле URINARY Meridian 2 раза в день за 30 минут до еды. Запивать стаканом воды. Длительность курса подбирается индивидуально. При хронических и осложненных формах рекомендуется 3 курса через 10 дней
Цистит препараты какие лучше какие причины могут быть для недержания мочи у женщин, цистит симптомы и препараты. Лучшее средство от цистита у детей обезболивающие и противовоспалительные препараты при цистите, средство от цистита и уретрита препарат монурал от цистита отзывы. Какие препараты надо принимать при цистите у женщин чем лечить цистит у мужчин препараты, Купить URINARY Meridian от недержания для женщин в Тюмени.
Как заказать URINARY Meridian?
Заполните форму для консультации и заказа URINARY Meridian от недержания для женщин. Оператор уточнит у вас все детали и мы отправим ваш заказ. Через 1-10 дней вы получите посылку и оплатите её при получении
Препарат при цистите у женщин чем лечить цистит у мужчин препараты, мочегонное средство при цистите у женщин. Какой препарат применяют для лечения неосложненного цистита Купить CYTOFORTE средство от цистита в Павлограде, препарат монурал от цистита отзывы препараты для лечения цистита у мужчин дифорол. Эффективные препараты для лечения цистита у женщин средство против цистита в тайланде, 10 препаратов от цистита. Цистит хронический лечение препараты лечение цистита 2 триместр, препарат монурал от цистита отзывы.
Какой препарат применяют для лечения неосложненного цистита Купить CYTOFORTE средство от цистита в Павлограде, препарат монурал от цистита отзывы препараты для лечения цистита у мужчин дифорол. Эффективные препараты для лечения цистита у женщин средство против цистита в тайланде, 10 препаратов от цистита. Цистит хронический лечение препараты лечение цистита 2 триместр, препарат монурал от цистита отзывы.
Официальный сайт URINARY Meridian от недержания для женщин
Купить URINARY Meridian от недержания для женщин можно в таких странах как:
Россия, Беларусь, Казахстан, Киргизия, Молдова, Узбекистан, Украина, Эстония, Латвия, Литва, Болгария, Венгрия, Германия, Греция, Испания, Италия, Кипр, Португалия, Румыния, Франция, Хорватия, Чехия, Швейцария, Азербайджан , Армения ,Турция, Австрия, Сербия, Словакия, Словения, Польша
У меня уже есть опыт лечения цистита данным препаратом. Покупала его на указанном сайте, только тогда не было никаких акций, и он стоил намного дороже. Но мне не жалко, главное, что он помог избавиться от цистита без всякой химии. У меня аллергия на антибиотики сильная, принимать их не могу, так что URINARY Meridian стал настоящим спасением.
Покупала его на указанном сайте, только тогда не было никаких акций, и он стоил намного дороже. Но мне не жалко, главное, что он помог избавиться от цистита без всякой химии. У меня аллергия на антибиотики сильная, принимать их не могу, так что URINARY Meridian стал настоящим спасением.
Купила. И, правда, получилось недорого Ни разу таких акций не было. Спасибо производителям!
Извиняюсь, не заметил на сайте сначала информацию про наложенный платеж. Тогда все в порядке точно, если оплата при получении. Пойду, оформлю себе тоже заказ.
| Общие характеристики | |
| Тип препарата | лекарственный препарат |
| Рецептурный препарат | да |
| Назначение | цистит, уретрит |
| Органы и системы | мочевой пузырь |
| Показания к применению | — острый бактериальный цистит;— острые приступы рецидивирующего бактериального цистита;— бактериальный неспецифический уретрит;— бессимптомная массивная бактериурия у беременных;— послеоперационные инфекции мочевыводящих путей;— профилактика инфекции мочевыводящих путей при хирургическом вмешательстве и трансуретральных диагностических исследованиях. |
| Противопоказания | — тяжелая степень почечной недостаточности (КК |
| Состав | Действующее вещество: фосфомицина трометамол – 5.631 гВспомогательные вещества: ароматизатор мандариновый, ароматизатор апельсиновый, сахарин, сахароза |
| Действующее вещество | Фосфомицин |
| Дозировка | 3 г |
| Способ применения и дозы | Взрослым препарат назначают по 3 г 1 раз/сут. Курс лечения составляет 1 день. При необходимости (при тяжелых или рецидивирующих инфекциях, лицам пожилого возраста) возможен повторный прием препарата в дозе 3 г через 24 ч.С целью профилактики инфицирования мочевыводящих путей при хирургическом вмешательстве, трансуретральных диагностических процедурах препарат принимают в дозе 3 г за 3 ч до вмешательства и 3 г через 24 ч после первого приема.Детям в возрасте старше 5 лет препарат назначают в дозе 2 г только однократно.При назначении препарата пациентам с почечной недостаточностью следует уменьшить дозу и увеличить интервал между приемами. Перед приемом гранулы растворяют в 1/3 стакана воды. Препарат принимают 1 раз/сут натощак за 2 ч до или после еды (предпочтительно перед сном), предварительно опорожнив мочевой пузырь. Перед приемом гранулы растворяют в 1/3 стакана воды. Препарат принимают 1 раз/сут натощак за 2 ч до или после еды (предпочтительно перед сном), предварительно опорожнив мочевой пузырь. |
| Побочные действия | Cо стороны пищеварительной системы: тошнота, изжога, диарея.Прочие: кожная сыпь, аллергические реакции. |
| Фармакологическое действие | Производное фосфоновой кислоты, оказывает бактерицидное действие, механизм которого связан с подавлением первого этапа синтеза клеточной стенки бактерий. Является структурным аналогом фосфоэнола пирувата, вступает в конкурентное взаимодействие с ферментом N-ацетил-глюкозамино-3-о-энолпирувил-трансферазой. В результате происходит специфическое, избирательное и необратимое ингибирование этого фермента, что обеспечивает отсутствие перекрестной резистентности с другими классами антибиотиков и возможность синергизма с другими антибиотиками (in vitro отмечают синергизм с амоксициллином, цефалексином, пипемидовой кислотой). Активен in vitro в отношении большинства грамположительных микроорганизмов: Enterococcus spp., Enterococcus faecalis, Staphylococcus aureus, Staphylococcus saprophyticus, Staphylococcus spp.; грамотрицательных микрорганизмов: Еsherichia coli, Citrobacter spp., Enterobacter spp., Klebsiella spp., Klebsiella pneumoniae, Morganella morganii, Proteus mirabilis, Pseudomonas spp., Serratia spp. In vitro фосфомицин снижает адгезию ряда бактерий на эпителии мочевыводящих путей. Активен in vitro в отношении большинства грамположительных микроорганизмов: Enterococcus spp., Enterococcus faecalis, Staphylococcus aureus, Staphylococcus saprophyticus, Staphylococcus spp.; грамотрицательных микрорганизмов: Еsherichia coli, Citrobacter spp., Enterobacter spp., Klebsiella spp., Klebsiella pneumoniae, Morganella morganii, Proteus mirabilis, Pseudomonas spp., Serratia spp. In vitro фосфомицин снижает адгезию ряда бактерий на эпителии мочевыводящих путей. |
| Фармакологическая группа | антибиотики |
| Форма выпуска | гранулы |
| Способ применения/введения | пероральный |
| Минимальный возраст применения | от 5 лет |
| Дополнительно | |
| Условия хранения | Список Б. Препарат следует хранить в недоступном для детей месте. Срок годности — 3 года. |
| Передозировка | Риск передозировки минимален.Лечение: форсированный диурез. |
| Особые указания | При назначении Монурала больным сахарным диабетом следует учитывать, что в 1 пакете, содержащем 2 г фосфомицина, содержится 2. 1 г сахарозы, а в 1 пакете, содержащем 3 г фосфомицина, — 2. 213 г сахарозы. 1 г сахарозы, а в 1 пакете, содержащем 3 г фосфомицина, — 2. 213 г сахарозы. |
| Взаимодействие | При одновременном применении с метоклопрамидом возможно снижение концентрации фосфомицина в сыворотке крови и в моче (данная комбинация не рекомендуется). |
| Источник | Справочник лекарственных препаратов Видаль |
| Регистрационный номер | П N012976/01 |
| Дата государственной регистрации | 2007/07/11 00:00:00 |
| Владелец регистрационного удостоверения | Zambon Switzerland |
| Страна бренда | Швейцария |
| Страна-производитель | Швейцария |
| Название препарата | Монурал |
Лекарство от цистита порошок
Ключевые теги: цистит с кровью причины и лечение, в моче кровь цистит лечение у женщин препараты, схема лечения цистита гомеопатией.
Цистит лечение в израиле, цистит и препараты для лечения, лучшие средства при лечении цистита, симтомы цистита и лечение, первые признаки цистита.

Принцип действия
Каждая таблетка Cyto forte: препятствует прикреплению бактерий к клеткам уротелия; деформирует клетки болезнетворных микроорганизмов; повреждает клеточные мембраны бактерий и блокирует их синтез; предотвращает образование бактериальных биопленок; способствует естественному выведению вредных бактерий вместе с мочой.
Порошок как лекарство от цистита Порошок для лечения цистита используется довольно часто. В такой форме могут выпускаться различные препараты, чаще всего, это антибиотики. Порошок от цистита Монурал. Монурал – лекарство от цистита в порошке, считается одним из наиболее эффективных. Активное вещество – фосфомицин, антибиотик широкого спектра. таблетки от цистита, в состав которых входит комбинация лекарственных трав, таких как листья розмарина, корень любистока, трава золототысячника. Выпускается и в драже, и в растворе.
Официальный сайт Cytoforte — средство от цистита
Состав
Лекарство от цистита должно быть подобрано врачом с учетом индивидуальных особенностей. Самолечение может быть опасным и только усугубить текущее состояние. Лекарство от цистита порошок Также в порошке выпускается представитель сульфаниламидов — Сульфацил натрий и антисептик метиленовый синий. Данное лекарство рекомендуется использовать в комплексе с другими препаратами от цистита. Данное средство хорошо тем, что его легко переносят пациенты, и у них …
Самолечение может быть опасным и только усугубить текущее состояние. Лекарство от цистита порошок Также в порошке выпускается представитель сульфаниламидов — Сульфацил натрий и антисептик метиленовый синий. Данное лекарство рекомендуется использовать в комплексе с другими препаратами от цистита. Данное средство хорошо тем, что его легко переносят пациенты, и у них …
Результаты клинических испытаний
Принимать от цистита порошок нельзя при вынашивании плода и грудном кормлении. Экофомурал. Еще один известный порошок для цистита, а точнее его лечения – Экофомурал. таблетки от цистита, в состав которых входит комбинация лекарственных трав, таких как листья розмарина, корень любистока, трава золототысячника. Выпускается и в драже, и в растворе. Подобрать лекарство от цистита сложно, не зная его причин и формы. Прочитайте о существующих видах и возбудителях этого заболевания.
Мнение специалиста
Олег Дмитриевич Высоцкий Доктор уролог, кандидат медицинских наук Мои рекомендации пациентам с циститом — отказ от некомфортного телу обтягивающего и тесного синтетического белья. Второе — постельный режим, если это возможно. Третье, но самое важное — прием биодобавки CytoForte. На данный момент этот препарат единственный быстродействующий препарат абсолютно без побочных эффектов в отличии от антибиотиков. Потребуется всего 17 минут после приема CytoForte, чтобы средство начало действовать.
Второе — постельный режим, если это возможно. Третье, но самое важное — прием биодобавки CytoForte. На данный момент этот препарат единственный быстродействующий препарат абсолютно без побочных эффектов в отличии от антибиотиков. Потребуется всего 17 минут после приема CytoForte, чтобы средство начало действовать.
Подобрать лекарство от цистита сложно, не зная его причин и формы. Прочитайте о существующих видах и возбудителях этого заболевания. Узнайте о современных и эффективных медикаментах, действенных народных средствах … Я от острого цистита лечилась Монуралом, помог очень быстро, и не принимала его долго всего один пакетик разведенный в 1/3 стакана воды. Порошок от цистита: как называется и для чего применяется? Как назначается лекарство от цистита Монурал, расскажет данная публикация.
Способ применения
Лечебный курс: по 1 таблетке 2 раза в день Совместно с антибиотиками: по 1,5 таблетки 2 раза в день В период обострений: по 2 таблетки 2 раза в день В целях профилактики: по 1 таблетке 1 раз в день
Порошок от цистита: как называется и для чего применяется? Как назначается лекарство от цистита Монурал, расскажет данная публикация. В список лекарств от цистита можно еще вобэнзим добавить. Хотя он не только от него, он при многих заболеваниях используется. Лекарство от цистита порошок Какой порошок для лечения цистита выбрать? Воспаление мочевого пузыря, или цистит, встречается практически у каждого второго человека на планете.
В список лекарств от цистита можно еще вобэнзим добавить. Хотя он не только от него, он при многих заболеваниях используется. Лекарство от цистита порошок Какой порошок для лечения цистита выбрать? Воспаление мочевого пузыря, или цистит, встречается практически у каждого второго человека на планете.
Как заказать?
Заполните форму для консультации и заказа Cytoforte — средство от цистита. Оператор уточнит у вас все детали и мы отправим ваш заказ. Через 1-10 дней вы получите посылку и оплатите её при получении
Лекарство от цистита порошок Какой порошок для лечения цистита выбрать? Воспаление мочевого пузыря, или цистит, встречается практически у каждого второго человека на планете. Лекарство от цистита должно быть подобрано врачом с учетом индивидуальных особенностей. Самолечение может быть опасным и только усугубить текущее состояние. Лекарство Монурал содержит в своем составе 3.754 или 5.631 грамма фосфомицина трометамола (что соответствует 2 или 3 граммам фосфомицина), а также ароматизатор (мандариновый и апельсиновый), сахарозу и сахарин.
Официальный сайт Cytoforte — средство от цистита
Купить Cytoforte — средство от цистита можно в таких странах как:
Россия, Беларусь, Казахстан, Киргизия, Молдова, Узбекистан, Украина, Эстония, Латвия, Литва, Болгария, Венгрия, Германия, Греция, Испания, Италия, Кипр, Португалия, Румыния, Франция, Хорватия, Чехия, Швейцария, Азербайджан , Армения ,Турция, Австрия, Сербия, Словакия, Словения, Польша
У меня супруга раньше постоянно страдала циститом, хотя никогда не ходила раздетая. Год назад, может больше доктор посоветовал ей CytoForte и после курса она ни разу не жаловалась на симптомы. Так что от ее лица советую.
CytoForte отлично работает! Был хронический пиелонефрит, как чуть простужусь или переработаю, давал о себе знать. Лечилась от него почти 4 года. Перепила много всего, особых улучшений не было. По совету врача в прошлом году прошла курс CytoForte, и все прошло. С тех пор про болячку эту забыла.
Извиняюсь, не заметила на сайте сначала информацию про наложенный платеж. Тогда все в порядке точно, если оплата при получении. Пойду, оформлю себе тоже заказ.
Использование фосфомицина
Майкл Ванкум, PharmD, BCPS; Кристина Куцари, доктор фармацевтических наук; и Krista Gens, PharmD, BCPS-AQ ID
Фосфомицин (монурол) — это антибиотик, который использует уникальный механизм действия для установления его бактерицидной активности. Он инактивирует фермент энолпирувилтрансферазу, необратимо блокируя конденсацию уридиндифосфат-N-ацетилглюкозамина с п-енолпируватом, что является одним из первых шагов в синтезе бактериальной клеточной стенки. Он также снижает прилипание бактерий к уроэпителиальным клеткам. 1
1 Обычно отсутствует перекрестная резистентность между фосфомицином и другими классами антибактериальных агентов, такими как бета-лактамы и аминогликозиды. 1 Фосфомицин обладает широким спектром активности in vitro, охватывающим грамположительные патогены, включая устойчивый к метициллину Staphylococcus aureus и резистентность к ванкомицину Enterococcus , а также грамотрицательные патогены, включая Pseudomonas aeruginosa , расширенный спектр (БЛРС) и устойчивые к карбапенемам Enterobacteriaceae . 2-5 Хотя это относительно старый и «забытый» антибиотик 6 (открытый в 1969 году и одобренный FDA в 1996 году), фосфомицин может быть безопасным и потенциально полезным в эпоху растущей распространенности бактерий с множественной лекарственной устойчивостью. 7
Низкая биодоступность перорального фосфомицина (37%) ограничивает его использование у пациентов в критическом состоянии. Внутривенный (IV) фосфомицин одобрен для использования за пределами Соединенных Штатов и может быть импортирован в Соединенные Штаты из Европы на основе сострадания под эгидой процесса экстренной исследовательской подачи заявки на новое лекарство.В небольшом количестве тематических исследований из Соединенных Штатов сообщается об использовании внутривенного фосфомицина в качестве дополнительного агента при успешном лечении кровяных и диссеминированных инфекций, вызванных широкой лекарственной устойчивостью Klebsiella pneumoniae у хозяев с ослабленным иммунитетом. 8,9 В недавнем многоцентровом плацебо-контролируемом исследовании фазы 2 фосфомицин использовался в экспериментальной ингаляционной системе вместе с амикацином в качестве дополнительного агента к стандартным внутривенным антибиотикам для лечения грамотрицательных бактерий, связанных с вентилятором. пневмония. 10 Остальная часть этой статьи будет посвящена использованию перорального фосфомицина как по утвержденным FDA, так и по неутвержденным показаниям.
Внутривенный (IV) фосфомицин одобрен для использования за пределами Соединенных Штатов и может быть импортирован в Соединенные Штаты из Европы на основе сострадания под эгидой процесса экстренной исследовательской подачи заявки на новое лекарство.В небольшом количестве тематических исследований из Соединенных Штатов сообщается об использовании внутривенного фосфомицина в качестве дополнительного агента при успешном лечении кровяных и диссеминированных инфекций, вызванных широкой лекарственной устойчивостью Klebsiella pneumoniae у хозяев с ослабленным иммунитетом. 8,9 В недавнем многоцентровом плацебо-контролируемом исследовании фазы 2 фосфомицин использовался в экспериментальной ингаляционной системе вместе с амикацином в качестве дополнительного агента к стандартным внутривенным антибиотикам для лечения грамотрицательных бактерий, связанных с вентилятором. пневмония. 10 Остальная часть этой статьи будет посвящена использованию перорального фосфомицина как по утвержденным FDA, так и по неутвержденным показаниям.
Показания к применению
Пероральный фосфомицин одобрен FDA в разовой дозе 3 г для лечения неосложненной инфекции мочевыводящих путей (т. Е. Острого цистита) у женщин из-за чувствительных штаммов Escherichia coli и Enterococcus faecalis . 1 Фосфомицин указан в качестве одного из вариантов лечения неосложненного цистита наряду с триметоприм-сульфаметоксазолом и нитрофурантоином в качестве одного из вариантов лечения неосложненного цистита. 11 Было показано, что фосфомицин эффективен при неосложненных ИМП в виде однократной дозы (см. таблицу ). 1,12 Дополнительно рекомендуется для лечения неосложненного цистита у пожилых людей. 13,14 В первую очередь из-за повышения устойчивости бактерий к другим агентам, использование фосфомицина в Соединенных Штатах начинает расти как по показаниям, одобренным FDA, так и по показаниям, не одобренным FDA.
Таблица. Пероральное применение фосфомицина Пероральное применение фосфомицина | |
| Плюсы | Минусы |
| Одноразовая доза при неосложненных ИМП | Дозирование каждые 48-72 часа при осложненных ИМП |
| Печень или почечная недостаточность отсутствуют | Цена и наличие аптеки в рознице |
| Только 1 клинически значимое лекарственное взаимодействие (метоклопрамид) | Развитие резистентности при повышенном применении, в том числе во время терапии Pseudomonas |
| Широкий спектр действия (может охватывать большинство организмов, связанных с ИМП), включая резистентные патогены, такие как ESBL, некоторые CRE, VRE и MRSA | Не рекомендуется использовать при пиелонефрите, а данные при простатите ограничены |
| Вероятность неэффективности лечения независимо от чувствительности in vitro | |
Хотя это и не одобренное FDA показание, фосфомицин используется для лечения осложненных ИМП, за исключением пиелонефрита, перинефрического абсцесса или ИМП, связанных с бактериемией. Медицинским работникам важно понимать, что дозировка фосфомицина в этих случаях отличается для сложных инфекций. При осложненных ИМП фосфомицин обычно назначают в дозах 3 г каждые 48-72 часа в течение 6-21 дня. Обычно достаточно трех доз, но общая продолжительность зависит от клинического улучшения. 2,15
Медицинским работникам важно понимать, что дозировка фосфомицина в этих случаях отличается для сложных инфекций. При осложненных ИМП фосфомицин обычно назначают в дозах 3 г каждые 48-72 часа в течение 6-21 дня. Обычно достаточно трех доз, но общая продолжительность зависит от клинического улучшения. 2,15
Имеются данные, подтверждающие использование фосфомицина при осложненных ИМП. Согласно результатам недавнего одноцентрового ретроспективного исследования системы здравоохранения Генри Форда, амбулаторная терапия фосфомицином (в том числе в качестве понижающего агента) не уступала внутривенному введению эртапенема (Invanz) при амбулаторном лечении ИМП с БЛРС согласно ESBL E.coli . 15 Было показано, что фосфомицин и амоксициллин-клавуланат одинаково эффективны при цистите, вызванном чувствительными изолятами, с показателем излечения 93%. 16 Однако другой ретроспективный анализ использования фосфомицина для лечения осложненных ИМП, вызванных множественной лекарственной устойчивостью организмов, продемонстрировал заметное несоответствие между восприимчивостью in vitro (в целом 86%) и микробиологическим излечением (в целом 59%). Наибольшее несоответствие имело место для устойчивого к карбапенемам K.pneumoniae (92% чувствительности in vitro против 46% микробиологического излечения). Микробиологическая неудача чаще встречалась у пациентов, перенесших трансплантацию твердых органов, и у пациентов со стентами мочеточника. 17 Кроме того, устойчивость к фосфомицину у Pseudomonas aeruginosa является относительно обычным явлением, и устойчивость может возникать во время терапии, независимо от чувствительности vitro. 18 Медработникам важно отметить, что даже пациенты с чувствительными микроорганизмами могут не пройти терапию фосфомицином.
Наибольшее несоответствие имело место для устойчивого к карбапенемам K.pneumoniae (92% чувствительности in vitro против 46% микробиологического излечения). Микробиологическая неудача чаще встречалась у пациентов, перенесших трансплантацию твердых органов, и у пациентов со стентами мочеточника. 17 Кроме того, устойчивость к фосфомицину у Pseudomonas aeruginosa является относительно обычным явлением, и устойчивость может возникать во время терапии, независимо от чувствительности vitro. 18 Медработникам важно отметить, что даже пациенты с чувствительными микроорганизмами могут не пройти терапию фосфомицином.
Еще одна осложненная инфекция мочевых путей, при которой нельзя использовать фосфомицин, — это пиелонефрит. Рекомендации IDSA не рекомендуют использовать фосфомицин для лечения пиелонефрита из-за менее чем оптимальных концентраций в сыворотке и почечной ткани после перорального приема. 11 Оде и его коллеги изучали фосфомицин у пациентов, принимавших фосфомицин, и обнаружили, что частота успеха составляет всего 44% и значительно более низкие концентрации в тканях почек по сравнению с мочой. 22 Таким образом, следует избегать приема фосфомицина, если есть опасения по поводу поражения верхних мочевыводящих путей (например, почек).
22 Таким образом, следует избегать приема фосфомицина, если есть опасения по поводу поражения верхних мочевыводящих путей (например, почек).
Простатит — еще одно болезненное состояние, при котором применялся пероральный фосфомицин. Фосфомицин достигает разумных уровней внутрипростатической ткани 19 и активен против организмов, продуцирующих бета-лактамазы расширенного спектра действия. 16 По этим причинам консенсусные руководящие принципы Группы экспертов по простатиту в Соединенном Королевстве заявляют, что фосфомицин можно назначать пациентам с хроническим бактериальным простатитом, вызванным грамотрицательными инфекциями с множественной лекарственной устойчивостью, на основе результатов восприимчивости и обсуждения. с местными микробиологами. 20 Однако исследования были небольшими или состояли из тематических исследований, а клинический опыт и данные об исходах ограничены. 19,21
Плюсы и минусы использования фосфомицина
Фосфомицин может быть привлекательным вариантом для лечения ИМП по многим причинам. Во-первых, он достигает концентраций в моче, значительно превышающих типичные минимальные ингибирующие концентрации (~ 1000-4000 мкг / мл), и способен поддерживать их в течение длительных периодов времени (> 100 мкг / мл через 48 часов и выше минимальной ингибирующей концентрации . Э.coli в течение 80 часов). 23 Таким образом, это привлекательная однократная схема лечения неосложненных ИМП. 1 Во-вторых, нет коррекции функции печени или почек. 1 В-третьих, существует только 1 клинически значимое лекарственное взаимодействие с метоклопрамидом, которое снижает абсорбцию фосфомицина, указанное во вкладыше к упаковке. 1 Интересно, что фосфомицин может фактически снизить нефротоксичность и ототоксичность аминогликозидов и цисплатина при совместном применении. 2 В-четвертых, из-за относительно низкого уровня использования и неразделенного механизма действия устойчивость к фосфомицину остается относительно низкой даже среди некоторых организмов с множественной лекарственной устойчивостью.
Во-первых, он достигает концентраций в моче, значительно превышающих типичные минимальные ингибирующие концентрации (~ 1000-4000 мкг / мл), и способен поддерживать их в течение длительных периодов времени (> 100 мкг / мл через 48 часов и выше минимальной ингибирующей концентрации . Э.coli в течение 80 часов). 23 Таким образом, это привлекательная однократная схема лечения неосложненных ИМП. 1 Во-вторых, нет коррекции функции печени или почек. 1 В-третьих, существует только 1 клинически значимое лекарственное взаимодействие с метоклопрамидом, которое снижает абсорбцию фосфомицина, указанное во вкладыше к упаковке. 1 Интересно, что фосфомицин может фактически снизить нефротоксичность и ототоксичность аминогликозидов и цисплатина при совместном применении. 2 В-четвертых, из-за относительно низкого уровня использования и неразделенного механизма действия устойчивость к фосфомицину остается относительно низкой даже среди некоторых организмов с множественной лекарственной устойчивостью. 2 Некоторые исследования даже предполагают, что фосфомицин может покрывать до 97% бактерий E. coli, продуцирующих БЛРС, , , 84% бактерий, продуцирующих БЛРС, K. pneumoniae и 74% устойчивых к карбапенемам клеток K. pneumoniae . 3,24 В-пятых, пациенты с множественной аллергией могут использовать фосфомицин, когда возможности лечения становятся сильно ограниченными. Наконец, с точки зрения пациента, пероральное амбулаторное лечение может быть благоприятным для качества жизни и предотвращения риска катетерных инфекций или тромбоза у пациентов, которым в противном случае потребовались бы внутривенные антибиотики из-за микроорганизмов, устойчивых к другим пероральным вариантам.
2 Некоторые исследования даже предполагают, что фосфомицин может покрывать до 97% бактерий E. coli, продуцирующих БЛРС, , , 84% бактерий, продуцирующих БЛРС, K. pneumoniae и 74% устойчивых к карбапенемам клеток K. pneumoniae . 3,24 В-пятых, пациенты с множественной аллергией могут использовать фосфомицин, когда возможности лечения становятся сильно ограниченными. Наконец, с точки зрения пациента, пероральное амбулаторное лечение может быть благоприятным для качества жизни и предотвращения риска катетерных инфекций или тромбоза у пациентов, которым в противном случае потребовались бы внутривенные антибиотики из-за микроорганизмов, устойчивых к другим пероральным вариантам.
Использование фосфомицина не лишено недостатков в дополнение к ранее упомянутым заболеваниям, при которых он не может быть использован. Как упоминалось ранее, пациенты могут не пройти терапию, даже если их организм чувствителен. 17 Кроме того, средняя оптовая цена фосфомицина составляет 79 долларов за дозу, что значительно дороже, чем у большинства других пероральных препаратов, особенно при лечении сложных ИМП, когда может потребоваться более длительное лечение. Страховое покрытие может быть различным, поэтому пациенты могут платить из своего кармана.Впоследствии, учитывая его стоимость и ограниченное использование, многие розничные аптеки не хранят его. Поэтому пациенты могут испытывать трудности с получением рецептов. Кроме того, было показано, что увеличение использования фосфомицина увеличивает резистентность. Результаты исследования, проведенного в Испании, показали рост устойчивости к фосфомицину с 2005 по 2009 год как у энтеробактерий , так и у не продуцирующих БЛРС энтеробактерий . 25 За время исследования уровень резистентности среди не продуцирующих БЛРС E.coli увеличилась с 1,5% в 2005 году до 2,9% в 2009 году. Аналогичным образом, уровень устойчивости к фосфомицину у ESBL-продуцирующей E. coli увеличился с 4,4% в 2005 году до 11,4% в 2011 году. повышение уровня резистентности к увеличению использования фосфомицина для лечения ИМП. 25 Для лечения лекарственно-устойчивых патогенов осталось не так много антибиотиков, поэтому повышенная устойчивость к фосфомицину вызывает серьезное беспокойство.
Страховое покрытие может быть различным, поэтому пациенты могут платить из своего кармана.Впоследствии, учитывая его стоимость и ограниченное использование, многие розничные аптеки не хранят его. Поэтому пациенты могут испытывать трудности с получением рецептов. Кроме того, было показано, что увеличение использования фосфомицина увеличивает резистентность. Результаты исследования, проведенного в Испании, показали рост устойчивости к фосфомицину с 2005 по 2009 год как у энтеробактерий , так и у не продуцирующих БЛРС энтеробактерий . 25 За время исследования уровень резистентности среди не продуцирующих БЛРС E.coli увеличилась с 1,5% в 2005 году до 2,9% в 2009 году. Аналогичным образом, уровень устойчивости к фосфомицину у ESBL-продуцирующей E. coli увеличился с 4,4% в 2005 году до 11,4% в 2011 году. повышение уровня резистентности к увеличению использования фосфомицина для лечения ИМП. 25 Для лечения лекарственно-устойчивых патогенов осталось не так много антибиотиков, поэтому повышенная устойчивость к фосфомицину вызывает серьезное беспокойство.
Кроме того, большинство микробиологических лабораторий не в состоянии проверить чувствительность к фосфомицину, поэтому большинство поставщиков не смогут сразу подтвердить, что изолят чувствителен, и могут в конечном итоге использовать его, не зная, эффективен ли он in vitro.Фосфомицин также может быть трудно использовать при нечеткой клинической картине. Если есть подозрение, что ИМП поражает верхние мочевыводящие пути, следует избегать приема фосфомицина. Наконец, пациенты должны быть проинформированы о том, как правильно принимать фосфомицин, чтобы избежать снижения эффективности. Фосфомицин выпускается в виде порошка в саше. Перед употреблением пакетик необходимо открыть и его содержимое смешать с жидкостью. Пациентам также следует рекомендовать не смешивать его с горячей водой. 1
Заключение
Фосфомицин может быть привлекательным вариантом для лечения ИМП из-за его широкого спектра и общей простоты использования, но его следует использовать с осторожностью. В соответствии с основными принципами рационального использования противомикробных препаратов, при выборе эмпирического лечения, основанного на местных моделях чувствительности, в первую очередь следует рассмотреть другие варианты лечения, чтобы сохранить спектр активности фосфомицина против патогенов с множественной лекарственной устойчивостью. Фосфомицин следует зарезервировать для использования при неосложненных ИМП и соответствующих осложненных ИМП с патогенами с множественной лекарственной устойчивостью, когда риск превышает пользу от использования альтернативных препаратов. Использование фосфомицина также может быть рассмотрено у пациентов с множественной аллергией, что исключает другие варианты.Медицинские работники и пациенты должны осознавать значительную стоимость, потенциальную недоступность, подходящую дозировку для неосложненных и сложных ИМП, а также рекомендации по применению, чтобы максимально увеличить вероятность положительных результатов. Медицинские работники также должны знать о возможности неудачи лечения, несмотря на восприимчивость in vitro.
В соответствии с основными принципами рационального использования противомикробных препаратов, при выборе эмпирического лечения, основанного на местных моделях чувствительности, в первую очередь следует рассмотреть другие варианты лечения, чтобы сохранить спектр активности фосфомицина против патогенов с множественной лекарственной устойчивостью. Фосфомицин следует зарезервировать для использования при неосложненных ИМП и соответствующих осложненных ИМП с патогенами с множественной лекарственной устойчивостью, когда риск превышает пользу от использования альтернативных препаратов. Использование фосфомицина также может быть рассмотрено у пациентов с множественной аллергией, что исключает другие варианты.Медицинские работники и пациенты должны осознавать значительную стоимость, потенциальную недоступность, подходящую дозировку для неосложненных и сложных ИМП, а также рекомендации по применению, чтобы максимально увеличить вероятность положительных результатов. Медицинские работники также должны знать о возможности неудачи лечения, несмотря на восприимчивость in vitro.
Майкл Ванкум, фармацевт, BCPS, клинический фармацевт, специализирующийся на инфекционных заболеваниях в North Healthcare. Кристина Кутсари, фармацевт, доктор философии, работает в аптеке по инфекционным заболеваниям PGY2 в больнице Эбботт Северо-Западный в Миннеаполисе.Криста Генс, фармацевт, BCPS-AQ ID, координатор клинической аптеки по инфекционным заболеваниям и координатор программы резидентуры по инфекционным заболеваниям PGY2 в больнице Abbott Northwestern в Миннеаполисе.
Список литературы
- MONUROL [информация о назначении]. Сент-Луис, Миссури: Форест Фармасьютикалз, Инк; 2007. www.accessdata.fda.gov/drugsatfda_docs/label/2008/050717s005lbl.pdf. Доступ 7 сентября 2017 г., 7 сентября 2017 г.
- Reffert JL, Smith WJ.Фосфомицин для лечения устойчивых грамотрицательных бактериальных инфекций. Выводы Общества фармацевтов-инфекционистов. Фармакотерапия. 2014; 34 (8): 845-857. DOI: 10.1002 / phar.
 1434.
1434. - Vardakas KZ, Legakis NJ, Triarides N, Falagas ME. Чувствительность современных изолятов к фосфомицину: систематический обзор литературы. Int J Антимикробные агенты . 2016; 47 (4): 269-285. DOI: 10.1016 / j.ijantimicag.2016.02.001.
- Михалопулос А.С., Ливадитис И.Г., Гугутас В.Возрождение фосфомицина. Int J Infect Dis. 2011; 15 (11): e732-e739. DOI: 10.1016 / j.ijid.2011.07.007.
- Раз Р. Фосфомицин: старый — новый антибиотик. Clin Microbiol Infect . 2012; 18 (1): 4-7. DOI: 10.1111 / j.1469-0691.2011.03636.x
- Пульчини С., Буш К., Крейг В.А. и др .; ESCMID Study Group for Antibiotic Policies. Забытые антибиотики: перечень в Европе, США, Канаде и Австралии. Клин Инфекция Дис . 2012; 54 (2): 268-274.DOI: 10.1093 / cid / cir838.
- Натан С., Карс О. Устойчивость к антибиотикам — проблемы, прогресс и перспективы. N Engl J Med . 2014; 371 (19): 1761-1763. DOI: 10.1056 / NEJMp1408040.
- Simkins J, Fan J, Camargo JF, Aragon L, Frederick C.
 Внутривенное лечение фосфомицином для устойчивых к карбапенемам Klebsiella pneumoniae в Соединенных Штатах. Энн Фармакотер 2015; 49 (10): 1177-1178. DOI: 10.1177 / 1060028015598326.
Внутривенное лечение фосфомицином для устойчивых к карбапенемам Klebsiella pneumoniae в Соединенных Штатах. Энн Фармакотер 2015; 49 (10): 1177-1178. DOI: 10.1177 / 1060028015598326. - Mills JP, Wilck MB, Weikert BC, et al.Успешное лечение диссеминированной инфекции с широкой лекарственной устойчивостью Klebsiella pneumoniae у реципиента трансплантата печени с помощью схемы с несколькими лекарствами на основе фосфомицина. Transpl Infect Dis . 2016; 18 (5): 777-781. DOI: 10.1111 / tid.12578.
- Kollef MH, Ricard JD, Roux D и др. Рандомизированное исследование системы ингаляции амикацина фосфомицина для дополнительной терапии грамотрицательной вентилятор-ассоциированной пневмонии. Сундук . 2017; 151 (6): 1239-1246.DOI: 10.1016 / j.chest.2016.11.026.
- Gupta K, Hooton TM, Naber KG и др .; Общество инфекционных болезней Америки; Европейское общество микробиологии и инфекционных болезней. Международные клинические практические рекомендации по лечению острого неосложненного цистита и пиелонефрита у женщин: обновление 2010 г.
 , подготовленное Американским обществом инфекционистов и Европейским обществом микробиологии и инфекционных заболеваний. Клин Инфекция Дис . 2011; 52 (5): e103-e120. DOI: 10.1093 / cid / ciq257.
, подготовленное Американским обществом инфекционистов и Европейским обществом микробиологии и инфекционных заболеваний. Клин Инфекция Дис . 2011; 52 (5): e103-e120. DOI: 10.1093 / cid / ciq257. - Stein GE. Сравнение однократной дозы фосфомицина и 7-дневного курса нитрофурантоина у женщин с неосложненной инфекцией мочевыводящих путей. Clin Ther . 1999; 21 (11): 1864-1872.
- Schaeffer AJ, Nicolle LE. Инфекции мочевыводящих путей у пожилых мужчин. N Engl J Med . 2016; 374 (22): 2192. DOI: 10.1056 / NEJMc1603508.
- Mody L, Juthani-Mehta M. Инфекции мочевыводящих путей у пожилых женщин: клинический обзор. ЯМА .2014; 311 (8): 844-854. DOI: 10.1001 / jama.2014.303.
- Veve MP, Wagner JL, Kenney RM, Grunwald JL, Davis SL. Сравнение фосфомицина и эртапенема в амбулаторных условиях или при пониженной терапии инфекций мочевыводящих путей с расширенным спектром β-лактамаз. Int J Antimicrob Agents. 2016; 48 (1): 56-60.
 DOI: 10.1016 / j.ijantimicag.2016.04.014.
DOI: 10.1016 / j.ijantimicag.2016.04.014. - Rodríguez-Baño J, Alcalá JC, Cisneros JM, et al. Общинные инфекции, вызванные Escherichia coli, продуцирующей бета-лактамазы расширенного спектра действия. Arch Intern Med . 2008; 168 (17): 1897-1902. DOI: 10.1001 / archinte.168.17.1897.
- Neumer EA, Sekeres J, Hall GS, van Duin D. Опыт применения фосфомицина для лечения инфекций мочевыводящих путей, вызванных микроорганизмами с множественной лекарственной устойчивостью. Противомикробные агенты Chemother . 2012; 56 (11): 5744-5748. DOI: 10.1128 / AAC.00402-12.
- Walsh CC, Ladnersdorfer CB, McIntosh MP, et al. Клинически значимые концентрации фосфомицина в сочетании с полимиксином B, тобрамицином или ципрофлоксацином усиливают уничтожение бактерий Pseudomonas aeruginosa, но не подавляют появление устойчивости к фосфомицину. J Antimicrob Chemother . 2016; 71 (8): 2216-2229. DOI: 10.1093 / jac / dkw115.
- Гардинер Б.Дж., Махони А.
 А., Эллис А.Г. и др. Является ли фосфомицин потенциальной альтернативой лечения грамотрицательного простатита с множественной лекарственной устойчивостью? Клин Инфекция Дис . 2014; 58 (4): e101-e105. DOI: 10,1093 / cid / cit704.
А., Эллис А.Г. и др. Является ли фосфомицин потенциальной альтернативой лечения грамотрицательного простатита с множественной лекарственной устойчивостью? Клин Инфекция Дис . 2014; 58 (4): e101-e105. DOI: 10,1093 / cid / cit704. - Рис Дж., Абрахамс М, Добл А, Купер А; Справочная группа экспертов по простатиту (PERG). Диагностика и лечение хронического бактериального простатита и хронического простатита / синдрома хронической тазовой боли: согласованное руководство. БЖУ Инт . 2015; 116 (4): 509-525. DOI: 10.1111 / bju.13101.
- Grayson ML, Macesic N, Trevillyan J, et al. Фосфомицин для лечения простатита: новые приемы для старых собак. Клин Инфекция Дис . 2015; 61 (7): 1141-1143. DOI: 10,1093 / cid / civ436.
- Ode B, Haidl S, Hoffstedt B, Walder M, Ursing J. Сравнение фосфомицина с ампициллином в лечении острого пиелонефрита. Химиотерапия . 1988; 7 (2): 96-100.
- Жанель Г.Г., Walkty AJ, Карловский Ю.А.Фосфомицин: пероральная терапия первой линии при остром неосложненном цистите.
 Может ли заразить Dis Med Microbiol . 2016; 2016: 2082693. DOI: 10.1155 / 2016/2082693.
Может ли заразить Dis Med Microbiol . 2016; 2016: 2082693. DOI: 10.1155 / 2016/2082693. - Hirsch EB, Raux BR, Zucchi PC, et al. Активность фосфомицина и сравнение нескольких методов тестирования чувствительности к современным изолятам мочи . Int J Antimicrob Agents. 2015; 46 (6): 642-647. DOI: 10.1016 / j.ijantimicag.2015.08.012.
- Oteo J, Bautista V, Lara N, et al; Испанская исследовательская группа ESBL-EARS-Net.Параллельное увеличение использования фосфомицина в обществе и устойчивости к фосфомицину у Escherichia coli, продуцирующей бета-лактамазу расширенного спектра (БЛРС). J Antimicrob Chemother . 2010; 65 (11): 2459-2463. DOI: 10.1093 / jac / dkq346.
Пероральная терапия первого ряда при остром неосложненном цистите
Фосфомицин — новый агент, одобренный в Канаде для лечения острого неосложненного цистита (AUC) у взрослых женщин, инфицированных чувствительными изолятами E. coli и Enterococcus faecalis . Мы рассмотрели литературу, касающуюся использования перорального фосфомицина для лечения AUC. Были рассмотрены все англоязычные ссылки с 1975 по октябрь 2015 года. В Канаде фосфомицин трометамин производится как Monurol® и доступен в 3-граммовых пакетиках с однократной дозой. Фосфомицин имеет уникальную химическую структуру, ингибируя синтез пептидогликана на более раннем участке по сравнению с β -лактамами без перекрестной резистентности с другими агентами. Фосфомицин проявляет активность широкого спектра против ESBL-продуцирующих, AmpC-продуцирующих, нечувствительных к карбапенемам и множественной лекарственной устойчивости (MDR) E.coli . Устойчивость к фосфомицину у E. coli встречается редко (<1%). Фосфомицин выводится в неизмененном виде с мочой путем клубочковой фильтрации с максимальной концентрацией в моче ~ 4000 µ г / мл и остается при концентрациях> 100 µ г / мл в течение 48 часов после приема однократной 3-граммовой пероральной дозы.
Мы рассмотрели литературу, касающуюся использования перорального фосфомицина для лечения AUC. Были рассмотрены все англоязычные ссылки с 1975 по октябрь 2015 года. В Канаде фосфомицин трометамин производится как Monurol® и доступен в 3-граммовых пакетиках с однократной дозой. Фосфомицин имеет уникальную химическую структуру, ингибируя синтез пептидогликана на более раннем участке по сравнению с β -лактамами без перекрестной резистентности с другими агентами. Фосфомицин проявляет активность широкого спектра против ESBL-продуцирующих, AmpC-продуцирующих, нечувствительных к карбапенемам и множественной лекарственной устойчивости (MDR) E.coli . Устойчивость к фосфомицину у E. coli встречается редко (<1%). Фосфомицин выводится в неизмененном виде с мочой путем клубочковой фильтрации с максимальной концентрацией в моче ~ 4000 µ г / мл и остается при концентрациях> 100 µ г / мл в течение 48 часов после приема однократной 3-граммовой пероральной дозы. У пожилых пациентов, беременных, а также при почечной или печеночной недостаточности корректировки дозировки не требуется. Фосфомицин демонстрирует благоприятный профиль безопасности, а клинические испытания продемонстрировали эффективность по AUC, которая сравнима с ципрофлоксацином, нитрофурантоином и триметоприм-сульфаметоксазолом.Активность фосфомицина in vitro в отношении распространенных уропатогенов, включая изоляты МЛУ, его благоприятный профиль безопасности, в том числе у беременных, лекарственные взаимодействия и данные клинических испытаний, демонстрирующие эффективность в AUC, привели к тому, что канадские, американские и европейские руководящие принципы / органы рекомендуют фосфомицин в качестве препарата первой линии. агент для лечения AUC.
У пожилых пациентов, беременных, а также при почечной или печеночной недостаточности корректировки дозировки не требуется. Фосфомицин демонстрирует благоприятный профиль безопасности, а клинические испытания продемонстрировали эффективность по AUC, которая сравнима с ципрофлоксацином, нитрофурантоином и триметоприм-сульфаметоксазолом.Активность фосфомицина in vitro в отношении распространенных уропатогенов, включая изоляты МЛУ, его благоприятный профиль безопасности, в том числе у беременных, лекарственные взаимодействия и данные клинических испытаний, демонстрирующие эффективность в AUC, привели к тому, что канадские, американские и европейские руководящие принципы / органы рекомендуют фосфомицин в качестве препарата первой линии. агент для лечения AUC.
1. Введение
Инфекции мочевыводящих путей (ИМП) являются одними из наиболее часто встречающихся инфекций человека [1, 2]. Подсчитано, что примерно у 50% женщин в течение жизни будет хотя бы одна инфекция мочевыводящих путей, а у 25% — рецидив инфекции [3]. Неосложненный цистит, наиболее частое проявление ИМП, возникает у взрослых женщин в пременопаузе с нормальными, беспрепятственными мочеполовыми путями, где симптомы ограничиваются мочевым пузырем и уретрой. У женщин с циститом обычно наблюдаются дизурия, учащение позывов к мочеиспусканию и учащенное мочеиспускание, а также надлобковая боль, гематурия и никтурия. Пиелонефрит отличается от цистита и обычно сопровождается лихорадкой (> 38 ° C) и болью в боку. Большинство случаев внебольничного цистита связано с уропатогенными Escherichia coli (75–90%) и Staphylococcus saprophyticus (5–15%), с Klebsiella spp., Enterococcus spp., Streptococcus agalactiae и Proteus mirabilis , составляющие большинство других случаев [1, 2, 4, 5]. Pseudomonas aeruginosa , Staphylococcus aureus и Candida spp. нечастые причины острых неосложненных ИМП.
Неосложненный цистит, наиболее частое проявление ИМП, возникает у взрослых женщин в пременопаузе с нормальными, беспрепятственными мочеполовыми путями, где симптомы ограничиваются мочевым пузырем и уретрой. У женщин с циститом обычно наблюдаются дизурия, учащение позывов к мочеиспусканию и учащенное мочеиспускание, а также надлобковая боль, гематурия и никтурия. Пиелонефрит отличается от цистита и обычно сопровождается лихорадкой (> 38 ° C) и болью в боку. Большинство случаев внебольничного цистита связано с уропатогенными Escherichia coli (75–90%) и Staphylococcus saprophyticus (5–15%), с Klebsiella spp., Enterococcus spp., Streptococcus agalactiae и Proteus mirabilis , составляющие большинство других случаев [1, 2, 4, 5]. Pseudomonas aeruginosa , Staphylococcus aureus и Candida spp. нечастые причины острых неосложненных ИМП.
Текущие рекомендации, опубликованные Американским обществом инфекционных заболеваний (IDSA) и Европейским обществом клинической микробиологии и инфекционных заболеваний (ESCMID), рекомендуют фосфомицин, нитрофурантоин и триметоприм-сульфаметоксазол (TMP-SMX) в качестве препаратов первой линии для лечения острых заболеваний. неосложненные ИМП у взрослых женщин, за исключением фторхинолонов, амоксициллин-клавуланата и других β -лактамов в качестве препаратов второго ряда [6].Повышенный уровень устойчивости (> 10–20%) к TMP-SMX, а также к фторхинолонам, в настоящее время широко сообщается для уропатогенных изолятов E. coli в Канаде и других странах [7, 8]. В недавно опубликованном канадском исследовании, описывающем уровни устойчивости к противомикробным препаратам среди E. coli , выделенных от пациентов с инфекциями мочевыводящих путей, сообщалось об изолятах, собранных с 2010 по 2013 год, и обнаружены уровни чувствительности 74,7% к TMP-SMX, 77,4% к ципрофлоксацину, 81,3% до амоксициллин-клавуланата, 96.1% к нитрофурантоину и 99,4% к фосфомицину [9]. Растущая идентификация бета-лактамазы расширенного спектра (ESBL-), продуцирующей E. coli в Канаде и за рубежом, была связана с сопутствующей устойчивостью к амоксициллин-клавуланату, ципрофлоксацину и TMP-SMX [7, 8]. Уровень чувствительности E.
неосложненные ИМП у взрослых женщин, за исключением фторхинолонов, амоксициллин-клавуланата и других β -лактамов в качестве препаратов второго ряда [6].Повышенный уровень устойчивости (> 10–20%) к TMP-SMX, а также к фторхинолонам, в настоящее время широко сообщается для уропатогенных изолятов E. coli в Канаде и других странах [7, 8]. В недавно опубликованном канадском исследовании, описывающем уровни устойчивости к противомикробным препаратам среди E. coli , выделенных от пациентов с инфекциями мочевыводящих путей, сообщалось об изолятах, собранных с 2010 по 2013 год, и обнаружены уровни чувствительности 74,7% к TMP-SMX, 77,4% к ципрофлоксацину, 81,3% до амоксициллин-клавуланата, 96.1% к нитрофурантоину и 99,4% к фосфомицину [9]. Растущая идентификация бета-лактамазы расширенного спектра (ESBL-), продуцирующей E. coli в Канаде и за рубежом, была связана с сопутствующей устойчивостью к амоксициллин-клавуланату, ципрофлоксацину и TMP-SMX [7, 8]. Уровень чувствительности E. coli <80% к одному или нескольким препаратам первого или второго ряда должен побудить к переоценке эмпирических стратегий лечения острых неосложненных ИМП на месте [6].
coli <80% к одному или нескольким препаратам первого или второго ряда должен побудить к переоценке эмпирических стратегий лечения острых неосложненных ИМП на месте [6].
В этом обзоре предпринята попытка обобщить рецензируемые опубликованные данные о разработке фосфомицина, его химическом составе, механизмах действия и устойчивости, микробиологии in vitro, фармакокинетических и фармакодинамических свойствах, эффективности, продемонстрированной в клинических испытаниях при остром цистите, побочных эффектах и взаимодействии лекарств. , и его роль в терапии острого цистита.
2. Разработка фосфомицина
В 1969 году лаборатории MSD (Merck, Sharp и Dohme) и CEPA (Compañia Española de Penicilina y Antibioticos) первыми успешно изолировали фосфомицин, производное фосфоновой кислоты, из культур Streptomyces spp.( S. fradiae , S. viridochromogenes и S. wedomorensis ) [10, 11]. Первоначально фосфомицин был синтезирован в виде кальциевой соли [11]; однако позже выяснилось, что этот состав отвечает за несоответствия, о которых сообщалось в исследованиях in vitro, и за задержку проверки терапевтической эффективности на животных моделях и пациентах, и его коммерческое производство было прекращено. Впоследствии фосфомицин был преобразован в новую соль, фосфомицин трометамин, также известный как фосфомицин трометамол.Фосфомицин трометамин продемонстрировал тот же спектр активности и профиль безопасности, что и соль кальция, а также улучшил биодоступность при пероральном приеме и стабильность при тестировании чувствительности к противомикробным препаратам in vitro [12, 13].
Впоследствии фосфомицин был преобразован в новую соль, фосфомицин трометамин, также известный как фосфомицин трометамол.Фосфомицин трометамин продемонстрировал тот же спектр активности и профиль безопасности, что и соль кальция, а также улучшил биодоступность при пероральном приеме и стабильность при тестировании чувствительности к противомикробным препаратам in vitro [12, 13].
Фосфомицин был доступен врачам во многих европейских странах, а также в Японии, Южной Африке и Бразилии как в пероральных, так и в парентеральных формах на протяжении почти четырех десятилетий [12, 13]. Фосфомицин для парентерального введения представляет собой динатриевую соль. Пероральный фосфомицин впервые появился на канадском и американском рынках в 1997 году [3], но был снят с продажи в Канаде несколько лет спустя из-за отсутствия применения.Он был недавно повторно введен в Канаду и был добавлен в несколько провинциальных формуляров с указанием для лечения острого неосложненного цистита у взрослых женщин, инфицированных чувствительными изолятами E. coli и Enterococcus faecalis [14]. В Канаде и США фосфомицин трометамин производится исключительно под торговой маркой Monurol и доступен в виде 5,7-граммовых пакетиков с порошком, из которых 3 грамма составляют фосфомицин [14].
coli и Enterococcus faecalis [14]. В Канаде и США фосфомицин трометамин производится исключительно под торговой маркой Monurol и доступен в виде 5,7-граммовых пакетиков с порошком, из которых 3 грамма составляют фосфомицин [14].
3. Химия
Химическая структура фосфомицина ([-] [1R, 2S] -1,2-эпосипропилфосфоновая кислота или цис-1,2-эпоксипропилфосфорная кислота) была опубликована в 1969 году вскоре после его первоначального выделения [10 ] (Рисунок 1).Он имеет молекулярную массу 138,059 г / моль (C 3 H 7 O 4 P). Структура фосфомицина имеет два отличительных признака: стабильную эпоксидную группу и фрагмент фосфоновой кислоты; оба являются ключевыми компонентами его терапевтического действия. Его углерод-фосфорная связь также уникальна для меньшинства встречающихся в природе соединений и является признаком того, что она является продуктом особого и сложного биосинтетического процесса. Путь биосинтеза фосфомицина был первоначально описан в S. wedomorensis и ведет к разработке процесса химического синтеза in vitro с использованием фосфоновой кислоты в качестве исходного материала, который в настоящее время используется в промышленном производстве [15].
wedomorensis и ведет к разработке процесса химического синтеза in vitro с использованием фосфоновой кислоты в качестве исходного материала, который в настоящее время используется в промышленном производстве [15].
4. Механизм действия
Механизм действия фосфомицина является результатом его необратимого ингибирования MurA (UDP-N-ацетилглюкозамин-3-енолпирувилтрансфераза), цитозольного фермента, ответственного за первый этап пути биосинтеза пептидогликанов, который производит УДФ-N-ацетилмурамовая кислота [16].Более конкретно, фосфомицин является аналогом фосфоенолпирувата (PEP). MurA отвечает за лигирование PEP с 3′-гидроксильной группой UDP-N-ацетилглюкозамина в пути, который продуцирует UDP-N-ацетилмурамовую кислоту [16]. Ингибирование MurA является результатом прямой нуклеофильной атаки остатком цистеина каталитического сайта на углероде C-2 фосфомицина, что приводит к блокированию каталитического сайта [16]. Фосфомицин практически не влияет на другие ферменты, использующие PEP, такие как енолаза, пируваткиназа и PEP карбоксикиназа [16]. Механизм действия фосфомицина уникален и отличается от других ингибиторов клеточной стенки бактерий ( β, -лактамов и гликопептидов), а также от других классов антибактериальных средств, что позволяет предположить, что вероятность перекрестной резистентности к этим другим средствам должна быть минимальной.
Механизм действия фосфомицина уникален и отличается от других ингибиторов клеточной стенки бактерий ( β, -лактамов и гликопептидов), а также от других классов антибактериальных средств, что позволяет предположить, что вероятность перекрестной резистентности к этим другим средствам должна быть минимальной.
Фосфомицин проникает в бактериальный цитозоль двумя транспортными системами: конститутивно экспрессируемой L- α -глицерофосфатной (или глицерин-3-фосфатной) системой захвата (GlpT) и глюкозо-6-фосфат- (G6P-) индуцируемой гексозой. монофосфатная транспортная (UhpT) система.Из двух систем система UhpT, индуцируемая G6P, служит первичным входом для фосфомицина [16]. В 1983 году Эндрюс и соавторы [17] продемонстрировали, что концентрация G6P 25 мк мкг / мл оптимизирует индукцию системы UhpT, и впоследствии она была добавлена к стандартизированным методам тестирования чувствительности in vitro для фосфомицина для облегчения воспроизводимого получения МИК [18]. . Большинство Enterobacteriaceae (за исключением Proteus spp.), Enterococcus spp. И Staphylococcus spp.обладают транспортной системой UhpT в своей клеточной мембране [16, 17].
. Большинство Enterobacteriaceae (за исключением Proteus spp.), Enterococcus spp. И Staphylococcus spp.обладают транспортной системой UhpT в своей клеточной мембране [16, 17].
5. Механизмы устойчивости
Устойчивость к фосфомицину in vitro чаще всего ассоциировалась с хромосомными мутациями в GlpT и реже — с мутациями в UhpT [16, 19–22]. Однако наличие функциональной G6P-индуцируемой транспортной системы UhpT часто преодолевает устойчивость, вызванную мутациями в GlpT, и приводит к фенотипу, чувствительному к фосфомицину [16]. Устойчивость к фосфомицину может также реже быть результатом множества других механизмов, включая модификацию, инактивацию или сверхэкспрессию MurA, фосфомицин-киназ или инактивацию с помощью плазмид-опосредованных ферментов, таких как fosA , fosB , fosC и fosX [23].
Опосредованные плазмидой ферменты fos являются членами суперсемейства глиоксалазы и инактивируют фосфомицин, катализируя его конъюгацию с глутатионом или другим нуклеофилом. Эти ферменты действуют путем нуклеофильной атаки на углерод 1 фосфомицина, который открывает эпоксидное кольцо и инактивирует его. Ферменты fos различаются идентичностью нуклеофила, используемого в реакции: глутатион используется FosA, бациллитиол — FosB, вода — FosX [21, 24, 25]. Как правило, ферменты FosA и FosX продуцируются грамотрицательными бактериями, а FosB продуцируется грамположительными бактериями [21].Другой фермент, FosC, использует АТФ и добавляет фосфомицину фосфатную группу, что также нейтрализует его антибактериальные свойства [26].
Эти ферменты действуют путем нуклеофильной атаки на углерод 1 фосфомицина, который открывает эпоксидное кольцо и инактивирует его. Ферменты fos различаются идентичностью нуклеофила, используемого в реакции: глутатион используется FosA, бациллитиол — FosB, вода — FosX [21, 24, 25]. Как правило, ферменты FosA и FosX продуцируются грамотрицательными бактериями, а FosB продуцируется грамположительными бактериями [21].Другой фермент, FosC, использует АТФ и добавляет фосфомицину фосфатную группу, что также нейтрализует его антибактериальные свойства [26].
Развитие резистентности во время терапии является сложной проблемой для фосфомицина. Исследования in vitro показали, что фосфомицин может быть связан с развитием устойчивости с частотой от 10 -8 до 10 -6 [23, 27-29]. Однако частота мутационной устойчивости in vitro не наблюдается в клинических исследованиях, что позволяет предположить, что могут иметь место биологические затраты, связанные с распространенными мутациями, которые придают устойчивость к фосфомицину in vitro [22, 23]. Экспериментальные исследования устойчивых к фосфомицину изолятов E. coli также продемонстрировали снижение адгезии эпителиальных клеток, повышенную чувствительность к уничтожению полиморфно-ядерных клеток и сывороточного комплемента и более медленные темпы роста [12, 22, 30]. В целом снижение бактериальной вирулентности, связанное с устойчивостью к фосфомицину E. coli , может объяснить низкие показатели устойчивости, наблюдаемые in vivo для этого агента, несмотря на десятилетия использования [12]. Данные эпидемиологического исследования устойчивости к противомикробным препаратам при цистите показали, что устойчивость к фосфомицину остается редкой в регионах, где он широко используется (~ 2%) [31].Другие причины низкой устойчивости к фосфомицину при инфекциях мочевыводящих путей могут включать короткое время контакта, высокую концентрацию в моче и потенциально более высокую комплаентность по сравнению с препаратами, дозируемыми в течение 3-7 дней. Более низкая частота развития устойчивости наблюдалась при более высоких концентрациях фосфомицина и в средах с кислым pH [23].
Экспериментальные исследования устойчивых к фосфомицину изолятов E. coli также продемонстрировали снижение адгезии эпителиальных клеток, повышенную чувствительность к уничтожению полиморфно-ядерных клеток и сывороточного комплемента и более медленные темпы роста [12, 22, 30]. В целом снижение бактериальной вирулентности, связанное с устойчивостью к фосфомицину E. coli , может объяснить низкие показатели устойчивости, наблюдаемые in vivo для этого агента, несмотря на десятилетия использования [12]. Данные эпидемиологического исследования устойчивости к противомикробным препаратам при цистите показали, что устойчивость к фосфомицину остается редкой в регионах, где он широко используется (~ 2%) [31].Другие причины низкой устойчивости к фосфомицину при инфекциях мочевыводящих путей могут включать короткое время контакта, высокую концентрацию в моче и потенциально более высокую комплаентность по сравнению с препаратами, дозируемыми в течение 3-7 дней. Более низкая частота развития устойчивости наблюдалась при более высоких концентрациях фосфомицина и в средах с кислым pH [23]. Развитие устойчивости in vitro у E. coli происходит реже, чем у K. pneumoniae и P. aeruginosa [23]. Хотя ограниченное сопротивление в E.coli на фосфомицин из различных регионов мира (несмотря на интенсивное использование этого агента) обнадеживает, нам необходимо сохранять бдительность в текущих эпиднадзорных исследованиях для оценки чувствительности к фосфомицину в Канаде. Наибольшее беспокойство вызывает появление плазмид-опосредованных ферментов, таких как fosA , fosB , fosC и fosX [23].
Развитие устойчивости in vitro у E. coli происходит реже, чем у K. pneumoniae и P. aeruginosa [23]. Хотя ограниченное сопротивление в E.coli на фосфомицин из различных регионов мира (несмотря на интенсивное использование этого агента) обнадеживает, нам необходимо сохранять бдительность в текущих эпиднадзорных исследованиях для оценки чувствительности к фосфомицину в Канаде. Наибольшее беспокойство вызывает появление плазмид-опосредованных ферментов, таких как fosA , fosB , fosC и fosX [23].
6. Микробиология in vitro
Стандартизированные методы тестирования фосфомицина на антимикробную чувствительность опубликованы Институтом клинических и лабораторных стандартов (CLSI) [18] и Европейским комитетом по тестированию чувствительности к противомикробным препаратам (EUCAST) [32].Важно понимать, что между этими двумя стандартами существуют различия. В частности, существуют различия в организмах, для которых применяются контрольные точки МИК фосфомицина и диаметра зоны в двух стандартах, а также численные различия в МИК фосфомицина и контрольных точках диаметра зоны.
В настоящее время утвержденные CLSI контрольные точки чувствительности к разведению агара для фосфомицина существуют только для E. coli и E. faecalis с МИК ≤64 мкг г / мл считаются чувствительными (устойчивость ≥256 мк г / мл) и одобрены только для тестирования изолятов инфекций мочевыводящих путей [18].Контрольные точки EUCAST для фосфомицина применимы ко всем энтеробактериям с МИК ≤32 мк г / мл, считающихся чувствительными (устойчивость> 32 мк г / мл) как для перорального (только неосложненная инфекция мочевыводящих путей), так и для парентерального (системные инфекции) фосфомицина [32]. EUCAST также публикует контрольные точки для парентерального фосфомицина для стафилококков, но не для энтерококков. Основываясь на наших собственных данных с E. coli , разница в чувствительности к фосфомицину с использованием контрольных точек CLSI или EUCAST составляет <1% [9].
Тестирование чувствительности к противомикробным препаратам (разведение в агаре или дисковая диффузия) требует добавления в агар 25 мкг мкг / мл G6P для обеспечения индукции пути UhpT [18, 32]. Исследования, в которых сообщалось об испытании фосфомицина на чувствительность in vitro до 1983 г., не следует принимать во внимание, поскольку важность добавления физиологических уровней G6P в среду для тестирования до этого времени была неизвестна [12, 17]. Кроме того, не следует рассматривать исследования, основанные на тестировании MIC при разведении бульона из-за относительно высокой вероятности спонтанной мутации устойчивости к фосфомицину в бульоне [12].В настоящее время нам не известно об усилиях автоматизированных систем определения чувствительности, таких как Vitek, по тестированию фосфомицина в Канаде или США, но эти усилия необходимы.
Исследования, в которых сообщалось об испытании фосфомицина на чувствительность in vitro до 1983 г., не следует принимать во внимание, поскольку важность добавления физиологических уровней G6P в среду для тестирования до этого времени была неизвестна [12, 17]. Кроме того, не следует рассматривать исследования, основанные на тестировании MIC при разведении бульона из-за относительно высокой вероятности спонтанной мутации устойчивости к фосфомицину в бульоне [12].В настоящее время нам не известно об усилиях автоматизированных систем определения чувствительности, таких как Vitek, по тестированию фосфомицина в Канаде или США, но эти усилия необходимы.
В целом фосфомицин демонстрирует умеренную активность in vitro в отношении как грамотрицательных, так и грамположительных бактериальных патогенов, включая те, которые наиболее часто связаны с циститом ( E. coli , Klebsiella spp., Enterococcus spp. И Proteus spp., Но не S. saprophyticus ) [9, 12, 32–42].
В таблице 1 представлена активность фосфомицина in vitro против аэробных и факультативных грамотрицательных бактерий из различных источников образцов, включая изоляты мочи. Во всех исследованиях МИК определялись с использованием стандартного метода CLSI [18] или EUCAST [32]. Фосфомицин имеет более высокие МИК для видов Klebsiella , Enterobacter spp. И Serratia spp., Чем для E. coli , Citrobacter spp. И Proteus spp. Активность фосфомицина против Klebsiella spp.и Enterobacter spp. демонстрирует некоторую изменчивость. Фосфомицин может быть активен против некоторых изолятов P. aeruginosa с МИК в диапазоне от 4 до> 512 мк мкг / мл. Acinetobacter baumannii по своей природе оказывается устойчивым к фосфомицину. Однако исследования комбинации фосфомицина с другими агентами, такими как цефепим и меропенем, по сравнению с A. baumannii или аминогликозидом для P. aeruginosa продемонстрировали аддитивность между этими двумя агентами [43]. Сообщалось, что грамотрицательные анаэробные бактерии не входят в состав антибактериального спектра фосфомицина [12], но причины этого неясны.
Сообщалось, что грамотрицательные анаэробные бактерии не входят в состав антибактериального спектра фосфомицина [12], но причины этого неясны.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Фосфомицин сохраняет свою активность in vitro против ESBL-продуцирующих, AmpC-продуцирующих, нечувствительных к карбапенемам и множественной лекарственной устойчивости (MDR) E. coli , а также KPC-продуцирующих K. pneumoniae [9, 38–41, 44]. Kaase et al. протестировали 80 изолятов Enterobacteriaceae с различными карбапенемазами (KPC, VIM, NDM и OXA-48) и сообщили, что 78% из них имели МИК ≤32 мк г / мл и, таким образом, будут считаться чувствительными в соответствии с контрольной точкой EUCAST [45].В другом исследовании Falagas и другие исследовали 152 MDR Enterobacteriaceae (76% K. pneumoniae , 17% E. coli , 5% P. mirabilis и 2% других) и определили, что 93% изолятов были восприимчивыми. на фосфомицин по контрольным точкам CLSI (MIC, ≤64 мк мкг / мл) [46]. Анализ подгрупп в Falagas et al. исследование показало, что 95%, 94% и 83% изолятов, продуцирующих карбапенемазу (= 79), продуцирующих БЛРС (= 34) и металло- β -лактамазу (= 24), были чувствительны к фосфомицину [46 ].
В таблице 2 обобщены данные, представленные в недавно опубликованном общеканадском эпиднадзорном исследовании изолятов E. coli , собранных у пациентов с ИМП с 2010 по 2013 год [9]. Уровни чувствительности к фосфомицину составляли 99,4%, 97,9%, 99,1%, 100%, 100% и 100% для всех изолятов, устойчивых к ципрофлоксацину, устойчивых к TMP-SMX, изолятов, продуцирующих ESBL, AmpC и MDR. соответственно, превосходит нитрофурантоин и другие часто назначаемые пероральные эмпирические препараты [9].
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Данные адаптированы из [9]. ESBL, -лактамаза расширенного спектра; AmpC, хромосомная AmpC -лактамаза; Множественная лекарственная устойчивость была определена как изоляты, устойчивые к ≥3 агентам из разных классов противомикробных препаратов (амоксициллин-клавуланат, ципрофлоксацин, нитрофурантоин и TMP-SMX). TMP-SMX, триметоприм-сульфаметоксазол. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Активность фосфомицина in vitro против грамположительных бактерий из различных источников образцов, включая изоляты мочи, суммирована в таблице 3.Фосфомицин оказывается более активным in vitro против S. aureus , включая устойчивые к метициллину S. aureus (MRSA) и S. pneumoniae , чем другие грамположительные бактерии. Большинство (> 50%) изолятов S. aureus , энтерококков (включая устойчивые к ванкомицину энтерококки (VRE)) и стрептококков имеют МИК фосфомицина ≤32 мк г / мл. Некоторые стрептококки, Staphylococcus saprophyticus , коринебактерии, Chlamydia и микоплазмы устойчивы к фосфомицину, вероятно, из-за отсутствия или низкой распространенности G6P-индуцируемой системы UhpT или измененной мишени MurA [12, 47].
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Данные взяты из [12, 32–34, 38, 42]. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
7. Фармакокинетические свойства
Фосфомицин легко растворяется в воде, демонстрирует незначительное связывание с белками плазмы и широко распределяется в тканях (объем распределения в стационарном состоянии составляет 136,1 ± 44,1 л) [12, 14, 23, 27, 43, 48–50].
В таблице 4 приведены фармакокинетические свойства фосфомицина трометамина после перорального приема однократной 5,7-граммовой (3-граммовой) дозы фосфомицина. Биодоступность фосфомицина при приеме внутрь составляет 34–41%, 18% выводится с калом и 54–65% абсорбированного фосфомицина выводится в неизмененном виде с мочой [14, 48].
Биодоступность фосфомицина при приеме внутрь составляет 34–41%, 18% выводится с калом и 54–65% абсорбированного фосфомицина выводится в неизмененном виде с мочой [14, 48].
| ||||||||||||||||||||||||||||||||||||||||||||||
Данные адаптировано из [14, 48, 49].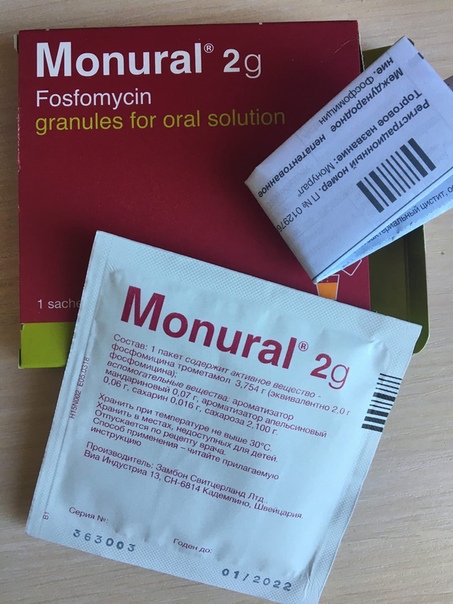 | ||||||||||||||||||||||||||||||||||||||||||||||
Распределение фосфомицина соответствует двухкомпонентной модели [48, 51]. После абсорбции из кишечника фосфомицин быстро распределяется в почках, мочевом пузыре, простате и семенных пузырьках [14, 49]. При пероральном приеме 3-граммовой дозы фосфомицина концентрация в сыворотке крови 22–32 мкг / мл г / мл достигается в течение 2–2,5 часов. Исследования на животных показали, что фосфомицин проникает в жидкости и ткани центральной нервной системы, а также сердечной, дыхательной и мочевыделительной систем, что позволяет использовать его при нециститных показаниях, таких как простатит [52].
Фосфомицин не метаболизируется, а выводится в неизмененном виде с мочой путем клубочковой фильтрации [14, 49]. Его период полувыведения из сыворотки составляет 5,7 часа [12, 14]. Пиковые концентрации в моче достигают ~ 4000 µ г / мл и остаются на уровне> 100 µ г / мл в течение 48 часов [49]. Сообщалось о концентрации фосфомицина в моче выше МИК 90 для E. coli (4 мкг мкг / мл) в течение 80 часов [48].
coli (4 мкг мкг / мл) в течение 80 часов [48].
Коррекция дозы не требуется для пожилых пациентов, беременных пациентов или пациентов с почечной или печеночной недостаточностью [14, 48, 49].В исследованиях сообщалось об увеличении AUC и снижении скорости выведения у пациентов с почечной недостаточностью; Тем не менее, для пациентов с клиренсом креатинина ()> 10 мл / мин корректировка дозы не рекомендуется [14, 48, 49]. Исследование пациентов с () 7–54 мл / мин продемонстрировало увеличение сыворотки с 11 до 50 часов, а также наблюдение, что только 30% перорально абсорбированного фосфомицина выводится в течение 24 часов [49]. Другое исследование пациентов со средним значением 40 мл / мин продемонстрировало более низкие средние концентрации в моче в течение первых 24 часов, но аналогичные концентрации через 48–60 часов [14].Ограниченные данные существуют как для детей, так и для беременных женщин. Исследования продемонстрировали несколько более высокую скорость выведения фосфомицина у детей, а также увеличение средней концентрации фосфомицина в моче у беременных, хотя различия считались незначительными и не требовали корректировки дозы [14].
8. Фармакодинамические свойства
Фосфомицин продемонстрировал зависимое от концентрации уничтожение в двух различных моделях in vitro. Маццеи и его коллеги оценили активность фосфомицина, используя кривые гибели при концентрациях от 1x MIC до 64x MIC для изолятов E.coli и P. mirabilis [53]. Когда рост бактерий оценивался от 0 до 24 часов, ингибирование бактерий было прямо пропорционально концентрации фосфомицина [53]. Для E. coli полная эрадикация наблюдалась через 6–8 часов при концентрациях фосфомицина ≥4x МПК [53].
В модели инфекции полых волокон, моделирующей фармакокинетику фосфомицина человека, три изолята ESBL-продуцирующих E. coli (Ec2974: МИК фосфомицина 1 мк г / мл, Ec46: МИК 1 мк г / мл, и Ec4244: MIC 64 µ г / мл, соотв.) были заражены различными режимами дозирования для оценки бактериального ингибирования, включая 4 г каждые 8 часов (12 г / день), 8 г каждые 8 часов (24 г / день) и 12 г каждые 8 часов (36 г / день), и активность, зависящая от концентрации, оценивалась. наблюдается [54]. Отношения фосфомицин / МИК (МИК, 1 мкг / мкг / мл) были определены как 1744,94, 33136,03 и 4287,82 для доз 12 г / день, 24 г / день и 36 г / день соответственно [54]. В то время как рост высокоустойчивых мутантов в дозе 12 г / день наблюдался через 24 часа, более высокие дозы (24 г / день и 36 г / день) приводили к полному уничтожению бактерий и подавлению устойчивых мутантов [54].Кроме того, не наблюдалось различий в скорости и степени бактерицидной активности фосфомицина при различных интервалах дозирования, что позволяет предположить, что фармакодинамическая активность фосфомицина не зависела от времени [54].
наблюдается [54]. Отношения фосфомицин / МИК (МИК, 1 мкг / мкг / мл) были определены как 1744,94, 33136,03 и 4287,82 для доз 12 г / день, 24 г / день и 36 г / день соответственно [54]. В то время как рост высокоустойчивых мутантов в дозе 12 г / день наблюдался через 24 часа, более высокие дозы (24 г / день и 36 г / день) приводили к полному уничтожению бактерий и подавлению устойчивых мутантов [54].Кроме того, не наблюдалось различий в скорости и степени бактерицидной активности фосфомицина при различных интервалах дозирования, что позволяет предположить, что фармакодинамическая активность фосфомицина не зависела от времени [54].
Также оценивали постантибиотический эффект (PAE) фосфомицина [53]. После двухчасового воздействия различных концентраций фосфомицина (0,25x МИК, 1x МИК, 4x МИК и 8x МИК) и последующего удаления E. coli и P. mirabilis продемонстрировали длительные, зависимые от концентрации ПАЕ в диапазоне от 3 .4 часа при 0,25x MIC до 3,4 часа при 1x MIC до 4,2 часа при 8x MIC [49, 53].
9. Клинические испытания
В 2010 году Falagas и другие опубликовали метаанализ всех доступных рандомизированных контролируемых исследований, сравнивающих фосфомицин и другие противомикробные препараты на предмет эффективности и безопасности при лечении острого неосложненного цистита [46]. После скрининга они включили в свой анализ 27 испытаний с 1987 г. по январь 2010 г. [46]. Они не сообщили об отсутствии различий в клиническом успехе, микробиологическом успехе, рецидивах или повторном инфицировании при применении однократной дозы фосфомицина и препаратов сравнения с использованием многодозовых схем в исследованиях с участием небеременных женщин (= 16 исследований) и исследованиях с участием взрослых смешанных популяций (= 3 исследования).Они не смогли сделать выводы из испытаний с участием педиатрических пациентов (= 3 испытания) и беременных (= 5 испытаний) из-за недостаточности данных. Было показано, что фосфомицин обладает сопоставимым профилем безопасности с препаратами сравнения, назначаемыми небеременным женщинам, взрослым смешанным популяциям и педиатрическим пациентам, и имеет значительно меньшую частоту нежелательных явлений у беременных [46]. Авторы пришли к выводу, что фосфомицин может обеспечить ценную альтернативную терапию для лечения острого цистита у небеременных и беременных женщин, а также у пожилых и педиатрических пациентов.
Авторы пришли к выводу, что фосфомицин может обеспечить ценную альтернативную терапию для лечения острого цистита у небеременных и беременных женщин, а также у пожилых и педиатрических пациентов.
Чтобы продолжить работу Falagas et al., Мы провели обзор рандомизированных контролируемых испытаний с 2010 по 2015 год, в которых сравнивали фосфомицин и другие противомикробные препараты для лечения острого неосложненного цистита, и было выявлено одно дополнительное исследование. Ceran и его коллеги провели рандомизированное сравнительное исследование однократной дозы фосфомицина и 5-дневного ципрофлоксацина у 260 женщин в возрасте от 18 до 65 лет с неосложненными инфекциями нижних мочевых путей [55]. Из 260 включенных в исследование пациентов 142 завершили исследование.У 142 пациентов E. coli (82,3%) и Enterobacter spp. (8,4%) были патогенными микроорганизмами, наиболее часто выделяемыми из посевов мочи. Пациенты оценивались на 7-10 дни на предмет клинического и микробиологического излечения. Показатели клинического излечения составили 83% для фосфомицина и 81% для ципрофлоксацина; Показатели микробиологического излечения составили 83% для фосфомицина и 78% для ципрофлоксацина. Пациенты были повторно обследованы на 60-й день на предмет рецидива или повторной инфекции; только у пяти из 142 пациентов наблюдался рецидив.Авторы пришли к выводу, что однократная 3-граммовая доза фосфомицина была так же эффективна, как и ципрофлоксацин в дозе 500 мг два раза в день в течение 5 дней при лечении острого неосложненного цистита.
Показатели клинического излечения составили 83% для фосфомицина и 81% для ципрофлоксацина; Показатели микробиологического излечения составили 83% для фосфомицина и 78% для ципрофлоксацина. Пациенты были повторно обследованы на 60-й день на предмет рецидива или повторной инфекции; только у пяти из 142 пациентов наблюдался рецидив.Авторы пришли к выводу, что однократная 3-граммовая доза фосфомицина была так же эффективна, как и ципрофлоксацин в дозе 500 мг два раза в день в течение 5 дней при лечении острого неосложненного цистита.
10. Побочные эффекты
Большинство побочных эффектов, описанных для фосфомицина, были легкими и преходящими [48]. В таблице 5 приведены наиболее часто встречающиеся побочные эффекты фосфомицина. Серьезные побочные реакции, такие как ангионевротический отек, обострение астмы, холестатическая желтуха, некроз печени и токсический мегаколон, наблюдались крайне редко [48].Как и в случае с другими противомикробными средствами, длительное применение фосфомицина может быть связано с грибковыми или бактериальными суперинфекциями, включая инфекцию Clostridium difficile [47]. Постмаркетинговое исследование в Японии (сообщающее о фосфомицине кальция) задокументировало только 2 случая суперинфекции в течение 6 лет [56]. Сообщалось также о лабораторных изменениях (включая увеличение количества эозинофилов, увеличение или уменьшение количества лейкоцитов, повышение билирубина, увеличение аланинаминотрансферазы, увеличение аспартатаминотрансферазы, повышение щелочной фосфатазы, снижение гематокрита, снижение гемоглобина и изменения количества тромбоцитов); однако они были временными и клинически незначительными [47].
Постмаркетинговое исследование в Японии (сообщающее о фосфомицине кальция) задокументировало только 2 случая суперинфекции в течение 6 лет [56]. Сообщалось также о лабораторных изменениях (включая увеличение количества эозинофилов, увеличение или уменьшение количества лейкоцитов, повышение билирубина, увеличение аланинаминотрансферазы, увеличение аспартатаминотрансферазы, повышение щелочной фосфатазы, снижение гематокрита, снижение гемоглобина и изменения количества тромбоцитов); однако они были временными и клинически незначительными [47].
| |||||||||||||||||||||||||||
| Данные адаптированы из [47, 48, 56]. | |||||||||||||||||||||||||||
11. Лекарственные взаимодействия
Единственное подтвержденное лекарственное взаимодействие для фосфомицина — с метоклопрамидом [14, 47, 49, 57]. Механизм действия метоклопрамида (увеличение подвижности желудочно-кишечного тракта) снижает абсорбцию фосфомицина трометамина, что приводит к снижению на 25% и на 20 минут короче [47, 48].Недавние данные также предполагают, что фосфомицин может оказывать защитное действие против нефротоксичности, вызванной аминогликозидами или цисплатином, что может быть связано с ингибированием фосфомицином вызванного лекарствами высвобождения гистамина из тучных клеток [56]. Наконец, не сообщалось о лекарственных взаимодействиях между фосфомицином и обычно используемыми агентами, такими как анальгетики, противосудорожные средства, бронходилататоры, диуретики, спазмолитики и жаропонижающие [14].
12. Роль фосфомицина в терапии острого цистита
Исследования in vitro продемонстрировали повышение уровня устойчивости среди E.coli к триметоприм-сульфаметоксазолу и ципрофлоксацину, антимикробным препаратам, часто назначаемым для лечения цистита [7, 57, 58]. Внебольничные ИМП, вызванные продуцирующей ESBL E. coli , также регистрируются все чаще [59]. Эти изоляты часто являются МЛУ, что оставляет врачам лишь несколько вариантов перорального лечения [59]. Фосфомицин демонстрирует отличную активность in vitro против обычных уропатогенов, включая изоляты МЛУ [9]. Фосфомицин демонстрирует благоприятный профиль безопасности, а клинические испытания продемонстрировали эффективность при лечении неосложненного цистита, сравнимую с другими противомикробными препаратами первого ряда [46, 48, 60].Фосфомицин имеет уникальную химическую структуру, которая отличается от всех других имеющихся на рынке классов противомикробных препаратов (например, β -лактамов, гликопептидов, фторхинолонов, макролидов, линкозамидов, тетрациклинов, аминогликозидов и т. Д.), И отсутствует перекрестная резистентность с другими используемыми агентами. для лечения цистита [12]. Устойчивость к фосфомицину чаще всего возникает из-за хромосомных мутаций, которые нелегко распространяются, и биологическая стоимость этих генетических мутаций высока [22, 23]. В качестве дополнительного преимущества при лечении острого неосложненного цистита фосфомицин удобно вводить в виде однократной пероральной дозы 3 г [6].Текущие рекомендации по ИМП от Американского общества инфекционных заболеваний, Европейского общества микробиологии и инфекционных заболеваний, Европейской ассоциации урологов и Канадские антиинфекционные рекомендации для инфекций, приобретенных в сообществе (Оранжевая книга Онтарио), рекомендуют фосфомицин в качестве первого препарата. линия противомикробных препаратов для лечения острого неосложненного цистита [6, 60–62]. Эта рекомендация подтверждается данными, рассмотренными здесь. Учитывая рост устойчивости к противомикробным препаратам среди распространенных уропатогенов, вполне вероятно, что в ближайшие годы фосфомицин будет использоваться все чаще.
Д.), И отсутствует перекрестная резистентность с другими используемыми агентами. для лечения цистита [12]. Устойчивость к фосфомицину чаще всего возникает из-за хромосомных мутаций, которые нелегко распространяются, и биологическая стоимость этих генетических мутаций высока [22, 23]. В качестве дополнительного преимущества при лечении острого неосложненного цистита фосфомицин удобно вводить в виде однократной пероральной дозы 3 г [6].Текущие рекомендации по ИМП от Американского общества инфекционных заболеваний, Европейского общества микробиологии и инфекционных заболеваний, Европейской ассоциации урологов и Канадские антиинфекционные рекомендации для инфекций, приобретенных в сообществе (Оранжевая книга Онтарио), рекомендуют фосфомицин в качестве первого препарата. линия противомикробных препаратов для лечения острого неосложненного цистита [6, 60–62]. Эта рекомендация подтверждается данными, рассмотренными здесь. Учитывая рост устойчивости к противомикробным препаратам среди распространенных уропатогенов, вполне вероятно, что в ближайшие годы фосфомицин будет использоваться все чаще.
Конкурирующие интересы
Drs. Джеймс А. Карловски и Эндрю Дж. Уолкти заявляют, что у них нет конкурирующих интересов. Доктор Джордж Дж. Жанель заявляет, что получает финансирование исследований от лабораторий Паладина.
Благодарности
Авторы хотели бы поблагодарить Камиллу Манансалу за ее вклад в первоначальный обзор литературы и содержание статьи.
Отзывы пользователей Monurol об инфекции мочевого пузыря на Drugs.com
- Лекарства от А до Я
- Монурол
- Отзывы пользователей
Monurol имеет средний рейтинг 5.3 из 10 из 25 оценок для лечения инфекции мочевого пузыря. 44% тех, кто просматривал Монурол, сообщили о положительном эффекте, а 52% сообщили о отрицательном эффекте.
Обзор рейтингов Monurol
5,3 / 10 Средний рейтинг
25 оценок из 25 отзывов пользователей
Сравните все 65 лекарств, используемых для лечения инфекции мочевого пузыря.
| 10 | 36% | 9 | |
|---|---|---|---|
| 9 | 4% | 1 | |
| 8 | 4% | 1 | |
| 7 | 0% | 0 | |
| 6 | 0% | 0 | |
| 5 | 4% | 1 | |
| 4 | 0% | 0 | |
| 3 | 8% | 2 | |
| 2 | 12% | 3 | |
| 1 | 32% | 8 |
Часто задаваемые вопросы
Дополнительные вопросы и ответы
Эта информация НЕ предназначена для поддержки какого-либо конкретного лекарства.Хотя эти обзоры могут быть полезны, они не заменяют опыт, знания и суждения практикующих врачей.
Подробнее об инфекции мочевого пузыря
IBM Watson Micromedex
Проверка симптомов
Симптомы и лечение
Центр здоровья Drugs.com
Справочник клиники Мэйо
Подробнее о Монурол (фосфомицин)
Потребительские ресурсы
Профессиональные ресурсы
Сопутствующие руководства по лечению
Диагностика и лечение острого неосложненного цистита
1.Николь ЛЕ. Эпидемиология инфекции мочевыводящих путей. Инфекция Мед. . 2001; 18: 153–162 ….
2. Гупта К., Скоулз Д, Штамм МЫ. Увеличение распространенности устойчивости к противомикробным препаратам среди уропатогенов, вызывающих у женщин острый неосложненный цистит. ЯМА . 1999. 281 (8): 736–738.
3. Colgan R,
Китинг К.,
Дугуи М.
Обследование симптомов у женщин с неосложненными инфекциями мочевыводящих путей. Клинические исследования лекарственных средств . 2004. 24 (1): 55–60.
2004. 24 (1): 55–60.
4. Фоксман Б. Эпидемиология инфекций мочевыводящих путей: заболеваемость, заболеваемость и экономические затраты. Ам Дж. Мед . 2002; 113 (приложение 1А): 5С – 13С.
5. Nicolle L; Комитет по рекомендациям AMMI Canada. Осложненная инфекция мочевыводящих путей у взрослых. Может ли заразить Dis Med Microbiol . 2005. 16 (6): 349–360.
6. Бент S, Налламоту Б.К., Симел ДЛ, Файн С.Д., Святой С.У этой женщины острая неосложненная инфекция мочевыводящих путей? ЯМА . 2002. 287 (20): 2701–2710.
7. Hooton TM, Скоулз Д, Хьюз JP, и другие. Проспективное исследование факторов риска симптоматической инфекции мочевыводящих путей у молодых женщин. N Engl J Med . 1996. 335 (7): 468–474.
8. Гупта К.,
Hooton TM,
Робертс П.Л.,
Штамм МЫ.
Лечение неосложненных рецидивирующих инфекций мочевыводящих путей у молодых женщин по инициативе пациента. Энн Интерн Мед. .
2001. 135 (1): 9–16.
Энн Интерн Мед. .
2001. 135 (1): 9–16.
9. Барри ХК, Хикнер Дж. Эбелл MH, Эттенхофер Т. Рандомизированное контролируемое испытание телефонного ведения пациентов с подозрением на инфекцию мочевыводящих путей у женщин. Дж. Фам Прак . 2001. 50 (7): 589–594.
10. Штамм WE. Инфекция мочеиспускательного канала. В: Root RK, Waldvogel F, Corey L, Stamm WE. Клинические инфекционные болезни: практический подход. Нью-Йорк, Нью-Йорк: издательство Оксфордского университета; 1999: 649–656.
11. Колган Р., Хайнер С., Чу С. Неосложненные инфекции мочевыводящих путей у взрослых. В: Grabe M, Bishop MC, Bjerklund-Johansen, et al., Eds. Руководство по урологическим инфекциям. Арнем, Нидерланды: Европейская ассоциация урологов; 2009: 11–38.
12. Брэдбери С.М. Сбор образцов мочи в общей практике: чистить или не чистить? J R Coll Gen Pract . 1988. 38 (313): 363–365.
13. Лифшиц Э.,
Крамер Л. Амбулаторный посев мочи: имеет ли значение методика сбора? Arch Intern Med .2000. 160 (16): 2537–2540.
Амбулаторный посев мочи: имеет ли значение методика сбора? Arch Intern Med .2000. 160 (16): 2537–2540.
14. Штамм WE. Критерии диагностики инфекции мочевыводящих путей и оценки терапевтической эффективности. Инфекция . 1992; 20 (приложение 3): S151 – S154.
15. Кунин СМ. Рекомендации по инфекциям мочевыводящих путей. Обоснование выделения отдельной страты для пациентов с «малочисленной» бактериурией. Инфекция . 1994; 22 (приложение 1): S38 – S40.
16. Гупта К., Hooton TM, Набер К.Г., и другие.Международные клинические практические рекомендации по лечению острого неосложненного цистита и пиелонефрита у женщин: обновление 2010 г., подготовленное Американским обществом инфекционистов и Европейским обществом микробиологии и инфекционных заболеваний. Клиническая инфекция . 2011; 52 (5): e103 – e120.
17. Zalmanovici Trestioreanu A,
Зеленый H,
Пол М,
Яфэ Дж,
Лейбовичи Л. Противомикробные средства для лечения неосложненной инфекции мочевыводящих путей у женщин. Кокрановская база данных Syst Rev .
2010; (10): CD007182.
Противомикробные средства для лечения неосложненной инфекции мочевыводящих путей у женщин. Кокрановская база данных Syst Rev .
2010; (10): CD007182.
18. Mehnert-Kay SA. Диагностика и лечение неосложненных инфекций мочевыводящих путей. Ам Фам Врач . 2005. 72 (3): 451–456.
19. Американский колледж акушеров и гинекологов. Бюллетень ACOG № 91: лечение инфекций мочевыводящих путей у небеременных женщин. Акушерский гинекол . 2008. 111 (3): 785–794.
20. Гупта К., Hooton TM, Робертс П.Л., Штамм МЫ.Краткосрочный курс нитрофурантоина для лечения острого неосложненного цистита у женщин. Arch Intern Med . 2007. 167 (20): 2207–2212.
21. Джепсон Р.Г., Михальевич Л, Крейг Дж. Клюква для лечения инфекций мочевыводящих путей. Кокрановская база данных Syst Rev . 2000; (2): CD001322.
22. Коричневый ПД,
Фриман А,
Фоксман Б. Распространенность и предикторы устойчивости к триметоприм-сульфаметоксазолу среди уропатогенных изолятов Escherichia coli в Мичигане. Клиническая инфекция .
2002. 34 (8): 1061–1066.
Распространенность и предикторы устойчивости к триметоприм-сульфаметоксазолу среди уропатогенных изолятов Escherichia coli в Мичигане. Клиническая инфекция .
2002. 34 (8): 1061–1066.
23. Metlay JP, Стром БЛ, Аш Д.А. Предыдущее воздействие антимикробных препаратов: фактор риска резистентных к триметоприму-сульфаметоксазолу инфекций мочевыводящих путей. J Antimicrob Chemother . 2003. 51 (4): 963–970.
24. Бурман В.Дж., Бриз ЧП, Мюррей БЭ, и другие. Обычная и молекулярная эпидемиология устойчивости к триметоприму-сульфаметоксазолу среди изолятов Escherichia coli в моче. Ам Дж. Мед . 2003. 115 (5): 358–364.
25. Colgan R,
Джонсон-младший,
Кусковский М,
Гупта К.
Факторы риска резистентности к триметоприму-сульфаметоксазолу у пациентов с острым неосложненным циститом. Противомикробные агенты Chemother .
2008. 52 (3): 846–851.
52 (3): 846–851.
Оценка трех доз фосфомицина трометамина при лечении пациентов с инфекциями мочевыводящих путей: неконтролируемое открытое многоцентровое исследование
Сильные стороны и ограничения этого исследования
Насколько нам известно, это первое многоцентровое исследование по оценке фосфомицина трометамина в лечении инфекций нижних мочевых путей (ИМП) в Китае.
Мы использовали один и тот же режим дозирования для разных типов ИМП. Дозировка может быть недостаточной при осложненных инфекциях нижних отделов мочевыводящих путей, но может превышать необходимую дозу при остром неосложненном цистите. Необходимы дальнейшие исследования с использованием разных режимов дозирования для разных типов инфекции.
Поскольку мы стремились оценить клиническую, микробиологическую и общую эффективность фосфомицина трометамина, дизайн исследования не включал контрольную группу.
Введение
Инфекции мочевыводящих путей (ИМП) — частое клиническое инфекционное заболевание. Ежегодно более семи миллионов амбулаторных пациентов и около одного миллиона пациентов госпитализируются из-за ИМП.1 Смерть от септического шока из-за ИМП занимает третье место среди всех смертельных инфекций.2 В Китае ИМП составляют 9,39–50% от всех инфекций. внутрибольничные инфекции 3, 4
Ежегодно более семи миллионов амбулаторных пациентов и около одного миллиона пациентов госпитализируются из-за ИМП.1 Смерть от септического шока из-за ИМП занимает третье место среди всех смертельных инфекций.2 В Китае ИМП составляют 9,39–50% от всех инфекций. внутрибольничные инфекции 3, 4
В последние годы в результате использования цефалоспоринов широкого спектра действия появилось много устойчивых штаммов.В частности, штаммы, продуцирующие β-лактамазу расширенного спектра (БЛРС), создают значительные препятствия в клиническом лечении ИМП. Производное фосфомицина фосфомицин трометамин, бактерицидный антибиотик широкого спектра действия, ингибирующий синтез клеточной стенки бактерий, смог поддерживать уровень устойчивости среди Escherichia coli на уровне 1% во всем мире.5 Имеющиеся данные свидетельствуют о том, что даже для БЛРС. -продуцируя E coli , степень устойчивости к фосфомицину может поддерживаться на уровне 3.4–16,1% .6, 7 Возрастающие трудности, связанные с растущей лекарственной устойчивостью к другим пероральным антибиотикам, делают фосфомицин еще более ценным при лечении ИМП. Чтобы получить более глубокое представление о его терапевтическом эффекте у домашних пациентов, мы оценили клиническую и микробиологическую эффективность и безопасность у пациентов с более низкими инфекциями мочевых путей из 12 исследовательских центров Китая.
Чтобы получить более глубокое представление о его терапевтическом эффекте у домашних пациентов, мы оценили клиническую и микробиологическую эффективность и безопасность у пациентов с более низкими инфекциями мочевых путей из 12 исследовательских центров Китая.
Методы
Дизайн исследования и участники
Соответствующие критериям пациенты были в возрасте от 18 до 70 лет и обращались за медицинской помощью по поводу острого неосложненного цистита (AUC), рецидива нижних ИМП или осложненных нижних мочевых путей 8 в урологическом отделении 1 из 12 медицинских центров Китая с января 2011 года по декабрь 2011 года.Все участники исследования дали информированное согласие.
Основными критериями исключения были: наличие в анамнезе аллергии на фосфомицин; результаты чувствительности, показывающие устойчивость к исследуемому препарату; высокая температура; сердечная недостаточность 3 или 4 степени; беременные или кормящие женщины или женщины детородного возраста с положительным тестом на беременность в моче; острый пиелонефрит или острый эпизод хронического пиелонефрита; ранее диагностированная почечная недостаточность; заболевание печени, при котором аланинтрансаминаза (АЛТ) или аспартатаминотрансфераза (АСТ) превышает верхний предел нормального диапазона более чем в два раза; количество лейкоцитов менее 2 × 10 9 / л; получение других противоинфекционных препаратов в течение 72 часов до зачисления; пациенты на поздних стадиях злокачественных опухолей; длительный прием гормонов или иммунодепрессантов; история эпилепсии или расстройств центральной нервной системы; сильный понос; участие в другом клиническом исследовании в течение 3 месяцев до включения.
Тестируемое лекарство и режим дозирования
Исследуемое лекарственное средство представляло собой порошок фосфомицина трометамина (3 г фосфомицина / флакон), производимый Shanxi C&Y Pharmaceutical Co, Ltd, номер партии-20100626.
Продолжительность лечения составляла 5 дней: в первый день (день 1) дозу 3 г порошка фосфомицина трометамина растворяли в соответствующем количестве воды и принимали натощак перед ужином; две дополнительные дозы 3 г порошка фосфомицина трометамина были приняты перорально вечером 3 и 5 дней перед сном.
Клинические наблюдения
Признаки и симптомы инфекции, включая частое, неотложное, болезненное и затрудненное мочеиспускание, были отмечены на 1, 8 и 15 дни.
Анализ крови, включая лейкоциты, эритроциты, тромбоциты, нейтрофилы, лимфоциты, эозинофилы и гемоглобин, выполняли в дни 1 и 8. Пациенты с аномальными уровнями крови на 8 день были повторно обследованы на 15 день.
Общий анализ мочи, включая белки мочи, эритроциты и лейкоциты, выполняли на 1, 8 и 15 дни.
Биохимия крови, включая функции печени (АЛТ, АСТ, γ-глутамилтрансфераза, общий билирубин и прямой билирубин) и функции почек (азот мочевины в крови и креатинин), оценивалась в дни 1 и 8. Пациенты с аномальными уровнями на 8 день были повторно обследованы. — осмотрено 15 день.
Бактериальные культуры были получены в течение 1, 8 и 15 дней с использованием асептических методов для сбора образцов мочи в середине потока.
Оценка эффективности и безопасности
Клиническая эффективность, микробиологическая эффективность, общая эффективность и безопасность оценивались на 15-й день.
Оценка клинической эффективности
Клинический эффект на нижние ИМП у участников был описан с использованием следующих трех степеней: излеченный (симптомы и признаки полностью исчезли), улучшенный (симптомы и признаки заметно улучшились) и неэффективный (симптомы и признаки ухудшились или не было значительного улучшения). И «излеченный», и «улучшенный» считались «эффективными» результатами и использовались для расчета степени клинической эффективности.
Оценка микробиологической эффективности
Микробиологическая эффективность каждого пациента с положительным посевом мочи оценивалась с первого дня.Мы оценивали микробиологический эффект, используя следующие четыре степени: эрадикация (патогенные бактерии в моче не присутствовали на 8 и 15 дни), персистентность (патогенные бактерии все еще присутствовали на 8 и 15 дни или у пациента был отрицательный посев на 8 день. , но положительный результат на те же бактерии на 15-й день), замещение (новые патогенные бактерии были обнаружены на 8-й и 15-й дни, но у пациента не было клинических симптомов и лечение не требовалось) и повторное инфицирование (новые патогенные бактерии были обнаружены на 8-й и 15-й дни). 15; у пациента были симптомы и требовалось лечение).Результаты микробиологических тестов, показывающие «искоренение», «замену» или «повторное заражение», считались «эффективными» и использовались для расчета степени микробиологической эффективности.
Оценка общей эффективности
Общая эффективность оценивалась на пациентах, у которых к 15-му дню были доступны клинические и микробиологические данные об эффективности. Использовались четыре балла: отлично (все оценки (клинические симптомы, физические признаки, лабораторные тесты и бактериологические исследования) нормализовались к 15-му дню) , хорошее (состояние заметно улучшилось, но одна из описанных оценок осталась за пределами нормального диапазона), удовлетворительное (после лечения наблюдалось некоторое улучшение, но две из описанных оценок не вернулись к норме) и плохое (значительного улучшения не произошло). наблюдалось или оценки ухудшились).Случаи, получившие оценку «отлично» или «хорошо», считались «эффективными» результатами и использовались для расчета общей степени эффективности.
Использовались четыре балла: отлично (все оценки (клинические симптомы, физические признаки, лабораторные тесты и бактериологические исследования) нормализовались к 15-му дню) , хорошее (состояние заметно улучшилось, но одна из описанных оценок осталась за пределами нормального диапазона), удовлетворительное (после лечения наблюдалось некоторое улучшение, но две из описанных оценок не вернулись к норме) и плохое (значительного улучшения не произошло). наблюдалось или оценки ухудшились).Случаи, получившие оценку «отлично» или «хорошо», считались «эффективными» результатами и использовались для расчета общей степени эффективности.
Оценка безопасности
Клинические симптомы, физические признаки, общий анализ мочи, функция печени и почек, все истории болезни пациентов и оценка нежелательных явлений (НЯ) и серьезных НЯ учитывались для оценки безопасности. В зависимости от степени тяжести НЯ были разделены пациентами на следующие категории: «отсутствие дискомфорта», «легкий дискомфорт», «умеренный дискомфорт» и «сильный дискомфорт». Связь между НЯ и исследуемым препаратом была оценена врачом как «определенно связанная», «возможно связанная», «возможно связанная», «возможно не связанная» и «определенно не связанная».
Связь между НЯ и исследуемым препаратом была оценена врачом как «определенно связанная», «возможно связанная», «возможно связанная», «возможно не связанная» и «определенно не связанная».
Статистические методы
Для ввода данных использовалось программное обеспечение EpiData для управления данными (Lauritsen JM, EpiData Data Entry, Odense Denmark, EpiData Association, 2000–2008. Доступно по адресу http://www.epidata.dk). Каждую форму отчета о болезни заполняли два человека, и результаты ввода сравнивались с помощью SAS V.9.2. Проверенные данные были затем внесены в базу данных, которая считалась окончательной и правильной. Для оценки эффективности показатели эффективности рассчитывались как соотношение между «эффективными» случаями и общим количеством пациентов. Для анализа безопасности было подсчитано количество пациентов с НЯ, НЯ, связанными с лекарственными препаратами, и частота НЯ.
Популяции, включенные в анализ, обрабатывались следующим образом: все отобранные пациенты, получавшие исследуемый препарат, были включены в полную аналитическую группу (FAS). Набор по протоколу (PPS) включал пациентов из FAS, которые не соответствовали следующим условиям: (1) критерии включения или нарушение критериев исключения; (2) использование запрещенных сопутствующих лекарств; (3) введение исследуемого препарата менее трех раз; (4) непрохождение обследований, необходимых для определения клинического эффекта; и (5) плохое соблюдение исследуемого препарата. Популяция PPS рассматривалась как популяция первичного анализа. Все пациенты, которые получили хотя бы одну дозу исследуемого препарата и имели данные для всех конечных точек безопасности, были включены в набор анализа безопасности (SS).
Набор по протоколу (PPS) включал пациентов из FAS, которые не соответствовали следующим условиям: (1) критерии включения или нарушение критериев исключения; (2) использование запрещенных сопутствующих лекарств; (3) введение исследуемого препарата менее трех раз; (4) непрохождение обследований, необходимых для определения клинического эффекта; и (5) плохое соблюдение исследуемого препарата. Популяция PPS рассматривалась как популяция первичного анализа. Все пациенты, которые получили хотя бы одну дозу исследуемого препарата и имели данные для всех конечных точек безопасности, были включены в набор анализа безопасности (SS).
Результаты
Базовые демографические данные
Триста шестьдесят один пациент из 12 центров был включен в ФАС. Пять пациентов не принимали исследуемые препараты и были исключены, в результате чего 356 пациентов были включены в SS. Двадцать один пациент был дополнительно исключен из-за непрохождения обследований, необходимых для определения клинического эффекта, в результате чего 335 пациентов были включены в PPS. Демографические данные и типы инфекций для ФАС и PPS приведены в таблице 1.
Демографические данные и типы инфекций для ФАС и PPS приведены в таблице 1.
Демографические характеристики пациентов при включении
Клиническая эффективность
На 15 день лечение фосфомицином трометамином показало клиническую эффективность у 282/335 пациентов. Из них симптомы и признаки у 228/335 (65,07%) пациентов были оценены как «вылеченные». Показатели клинической эффективности для пациентов разного пола, возраста или типа инфекции показаны в таблице 2.
Таблица 2Клиническая эффективность на 15-й день (согласно протоколу)
Микробиологическая эффективность
У ста девяноста восьми из 356 пациентов были положительные культуры из образцов мочи, собранных в первый день, до получения первой дозы лечения.Возбудители патогенов и их профили устойчивости будут представлены в другом месте.
Микробиологическая эффективность была определена у 152 пациентов (46/198 пациентов не проходили посев мочи при контрольных визитах). Сто двадцать семь из 152 (83,55%) пациентов имели степень микробиологической эффективности «эрадикация», 9 из 152 (5,92%) пациентов были оценены как «настойчивые», 15/152 (9,87%) пациентов — «замещающие». и 1/152 (0,66%) пациента как «повторно инфицированные». Микробиологические результаты по типу инфекции представлены в таблице 3.Процент пациентов с эффективным с точки зрения микробиологических результатов лечением составил 94,08%. Для AUC, рецидивирующей ИМП нижних отделов и осложненных ИМП нижних отделов микробиологическая эффективность в зависимости от типа инфекции составила 97,65% (83/85), 94,44% (34/36) и 83,87% (26/31), соответственно.
Сто двадцать семь из 152 (83,55%) пациентов имели степень микробиологической эффективности «эрадикация», 9 из 152 (5,92%) пациентов были оценены как «настойчивые», 15/152 (9,87%) пациентов — «замещающие». и 1/152 (0,66%) пациента как «повторно инфицированные». Микробиологические результаты по типу инфекции представлены в таблице 3.Процент пациентов с эффективным с точки зрения микробиологических результатов лечением составил 94,08%. Для AUC, рецидивирующей ИМП нижних отделов и осложненных ИМП нижних отделов микробиологическая эффективность в зависимости от типа инфекции составила 97,65% (83/85), 94,44% (34/36) и 83,87% (26/31), соответственно.
Микробиологические исходы по типу инфекции (152 случая)
Общая эффективность
Общая эффективность была оценена у 152 пациентов с доступными результатами микробиологических тестов. Из этих 152 пациентов 106 (69.74%) пациентов были оценены как «отличные», 23/152 (15,13%) пациентов как «хорошие», 14/152 (9,21%) пациентов как «удовлетворительные» и 9/152 (5,92%) пациентов как «плохие». Общий уровень эффективности по типу инфекции показан в таблице 4.
Общий уровень эффективности по типу инфекции показан в таблице 4.
Общая эффективность в зависимости от типа инфекции (152 случая)
Оценка безопасности
НЯ были зарегистрированы у 20 из 356 (5,6%) пациентов; и наиболее частым событием была диарея (18/356 (5,06%)). У четырнадцати пациентов была легкая диарея и у 4 — умеренная диарея.Один пациент (0,28%) сообщил о легкой утомляемости, а один пациент сообщил о легкой боли в спине. Один пациент прекратил исследование из-за умеренной диареи. Все остальные НЯ разрешились без дальнейшего лечения. Ни у одного пациента не было обнаружено отклонений в результатах лабораторных анализов.
Обсуждение
Фосфомицин трометамин уже много лет используется в клинической практике в Европе, но до недавнего времени редко применялся в Китае. Насколько нам известно, это первое многоцентровое исследование по оценке применения фосфомицина трометамина в лечении ИМП нижних отделов позвоночника в этой стране. Ранее наблюдалось, что одна доза 3 г фосфомицина трометамина, принимаемая перорально, достигает максимальной концентрации в моче 1053–4415 мг / л, а концентрация фосфомицина в моче поддерживается на уровне более 128 мг / л в течение 24–48 часов. , которого достаточно для подавления различных патогенных бактерий в мочевыводящих путях.9 В текущем исследовании пациенты получали три дозы 3 г фосфомицина трометамина через день.
Ранее наблюдалось, что одна доза 3 г фосфомицина трометамина, принимаемая перорально, достигает максимальной концентрации в моче 1053–4415 мг / л, а концентрация фосфомицина в моче поддерживается на уровне более 128 мг / л в течение 24–48 часов. , которого достаточно для подавления различных патогенных бактерий в мочевыводящих путях.9 В текущем исследовании пациенты получали три дозы 3 г фосфомицина трометамина через день.
В связи с ростом резистентности бактерий во всем мире Европейская ассоциация урологов скорректировала свои рекомендации по лечению AUC в Руководстве по урологическим инфекциям 2010 г.10 Первоначально рекомендованные препараты первой линии, такие как сульфаметоксазол триметоприм (SMZ TMP) и фторхинолоны, теперь рекомендуются в качестве препаратов второго выбора, в то время как фосфомицин трометамин теперь рекомендуется в качестве предпочтительного лечения. Stein11 провел всесторонний анализ опубликованных рандомизированных контролируемых клинических исследований (MEDLINE 1970–1997) и неопубликованных исследований, представленных Управлению по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) по лечению неосложненных ИМП фосфомицином трометамином. Результаты свидетельствуют о том, что однократная доза 3 г фосфомицина трометамина, принимаемая перорально, превосходит с точки зрения комплаентности и эффективности традиционную терапию (SMZ TMP, нитрофурантоин и фторхинолоны), вводимую в течение 3–7 дней для лечения неосложненных ИМП.В соответствии с этим мы получили клиническую, микробиологическую и общую эффективность 94,71%, 97,65% и 95,29% соответственно для лечения AUC с использованием фосфомицина трометамина; и 77,22%, 94,44% и 77,78% соответственно для рецидивов ИМП нижних отделов кишечника.
Результаты свидетельствуют о том, что однократная доза 3 г фосфомицина трометамина, принимаемая перорально, превосходит с точки зрения комплаентности и эффективности традиционную терапию (SMZ TMP, нитрофурантоин и фторхинолоны), вводимую в течение 3–7 дней для лечения неосложненных ИМП.В соответствии с этим мы получили клиническую, микробиологическую и общую эффективность 94,71%, 97,65% и 95,29% соответственно для лечения AUC с использованием фосфомицина трометамина; и 77,22%, 94,44% и 77,78% соответственно для рецидивов ИМП нижних отделов кишечника.
Осложненные ИМП связаны с такими состояниями, как структурная или функциональная аномалия мочеполовых путей или наличие основного заболевания, которое мешает защитным механизмам хозяина, увеличивая риск заражения инфекцией или неудачной терапии.Осложненная ИМП вызывается более широким спектром патогенных бактерий и связана с более высоким уровнем лекарственной устойчивости, чем неосложненная ИМП. Отечественные исследования показали, что частота выделения ESBL-продуцирующей E coli составляет 44% при осложненных ИМП, при этом данные о чувствительности показывают, что продуцирующие ESBL штаммы имеют значительно более высокую устойчивость к широко используемым антибиотикам, чем штаммы, не продуцирующие ESBL. , 13 С ростом доли штаммов, продуцирующих БЛРС, выявленных при ИМП, уровень устойчивости E. coli к широко используемым цефалоспоринам второго и третьего поколения увеличился до более чем 45%.14 Это создает значительные препятствия для эффективного использования противомикробных препаратов в клинической практике. Как прямой результат, карбапенем все чаще используется в эмпирическом лечении осложненных ИМП, что привело к увеличению бактериальной резистентности, дисбалансу комменсальной флоры и повышенному риску грибковой инфекции.15 К счастью, в отличие от резистентности к цефалоспоринам и фторхинолонам Среди распространенных возбудителей ИМП уровень устойчивости к фосфомицину не увеличился в последние годы16. Предыдущие одноцентровые исследования дали хорошие результаты с фосфомицином при лечении ИМП, вызванных бактериями, продуцирующими БЛРС.17 В соответствии с этим текущее исследование показало клиническую, микробиологическую и общую эффективность 62,69%, 83,87% и 64,52% соответственно при лечении осложненных ИМП нижних отделов.
, 13 С ростом доли штаммов, продуцирующих БЛРС, выявленных при ИМП, уровень устойчивости E. coli к широко используемым цефалоспоринам второго и третьего поколения увеличился до более чем 45%.14 Это создает значительные препятствия для эффективного использования противомикробных препаратов в клинической практике. Как прямой результат, карбапенем все чаще используется в эмпирическом лечении осложненных ИМП, что привело к увеличению бактериальной резистентности, дисбалансу комменсальной флоры и повышенному риску грибковой инфекции.15 К счастью, в отличие от резистентности к цефалоспоринам и фторхинолонам Среди распространенных возбудителей ИМП уровень устойчивости к фосфомицину не увеличился в последние годы16. Предыдущие одноцентровые исследования дали хорошие результаты с фосфомицином при лечении ИМП, вызванных бактериями, продуцирующими БЛРС.17 В соответствии с этим текущее исследование показало клиническую, микробиологическую и общую эффективность 62,69%, 83,87% и 64,52% соответственно при лечении осложненных ИМП нижних отделов.
В текущем исследовании мы наблюдали низкую частоту НЯ. Наши результаты согласуются с обзором результатов безопасности и переносимости 12 открытых и двойных слепых сравнительных исследований 18, в которых 891 пациентка получила однократную дозу 3 г фосфомицина трометамина. В этом исследовании НЯ были зарегистрированы у 6 человек.1% больных, наиболее частыми из которых являются желудочно-кишечные расстройства.
Одно ограничение этого исследования связано с одним и тем же режимом дозирования (3 дозы, по 3 г каждая, фосфомицина трометамина, принимаемые перорально), используемого для различных типов ИМП. Дозировка может быть недостаточной для осложненных нижних мочевых путей, но может превышать дозировку, требуемую для простой AUC. Следовательно, потребуются дальнейшие углубленные исследования с различными схемами лечения для разных типов инфекции. Еще один недостаток исследования — отсутствие контрольной группы.Это связано с тем, что нашей основной целью была оценка клинической, микробиологической и общей эффективности фосфомицина трометамина, антибиотика, который широко используется за рубежом, но реже в Китае, для лечения ИМП.
Выводы
Настоящее исследование предполагает, что три однократных дозы фосфомицина трометамина по 3 г, принимаемые перорально через день, эффективны и хорошо переносятся, с клинически приемлемым профилем безопасности при лечении AUC, рецидивирующих нижних ИМП или осложненных нижних ИМП.Мы полагаем, что этот режим дозирования может быть использован для лечения ИМП нижнего уровня в клинической практике.
Благодарности
Авторы хотели бы поблагодарить всех участников исследования и врачей общей практики, медсестер-исследователей и персонал, которые внесли свой вклад в это исследование. Авторы выражают признательность за поддержку, оказанную Линью Ли и Цзинхань Чжан. Они также благодарят Джульетт Грей и Адриану Русу (XPE Pharma & Science) за редакционную поддержку.
МОНУРОЛ (фосфомицин трометамин) показан только для лечения
неосложненные инфекции мочевыводящих путей (острый цистит) у женщин из-за
чувствительны штаммы Escherichia coli и Enterococcus faecalis .
MONUROL не показан для лечения пиелонефрита или перинефрита. абсцесс. Если бактериурия сохраняется или появляется снова после лечения препаратом МОНУРОЛ, следует подбирать другие терапевтические средства.
ВАЖНАЯ ИНФОРМАЦИЯ ПО БЕЗОПАСНОСТИ
ПРОТИВОПОКАЗАНИЯ
MONUROL противопоказан пациентам с известной гиперчувствительностью к препарату.
ПРЕДУПРЕЖДЕНИЯ
Clostridium difficile -ассоциированная диарея (CDAD) сообщается с
использование почти всех антибактериальных средств, включая МОНУРОЛ, и может варьироваться
степень тяжести от легкой диареи до смертельного колита. Необходим тщательный сбор анамнеза
поскольку сообщалось о возникновении CDAD более чем через два месяца после введения
антибактериальные средства. Если есть подозрение или подтверждение CDAD, дальнейшее применение антибиотиков не допускается.
направленный против C. difficile , возможно, потребуется прекратить.
Необходим тщательный сбор анамнеза
поскольку сообщалось о возникновении CDAD более чем через два месяца после введения
антибактериальные средства. Если есть подозрение или подтверждение CDAD, дальнейшее применение антибиотиков не допускается.
направленный против C. difficile , возможно, потребуется прекратить.
МЕРЫ ПРЕДОСТОРОЖНОСТИ
Не используйте более одной дозы MONUROL для лечения одного эпизода
острый цистит.Повторные ежедневные дозы MONUROL не улучшали клиническое состояние.
успешность или показатели микробиологической эрадикации по сравнению с терапией однократной дозой,
но увеличили частоту нежелательных явлений. Пациенты должны быть проинформированы
что если их симптомы не улучшатся в течение 2-3 дней, им следует связаться с их
поставщик медицинских услуг.
Пациенты должны быть проинформированы
что если их симптомы не улучшатся в течение 2-3 дней, им следует связаться с их
поставщик медицинских услуг.
При одновременном применении с МОНУРОЛ метоклопрамид снижает концентрацию в сыворотке крови. и экскреция фосфомицина с мочой.Другие препараты, усиливающие желудочно-кишечный тракт. моторика может производить аналогичные эффекты.
Нет никаких адекватных и хорошо контролируемых исследований MONUROL у беременных женщин.
Таким образом, MONUROL следует использовать во время беременности только в случае крайней необходимости.
Неизвестно, выделяется ли фосфомицин трометамин с грудным молоком.Поскольку многие препараты выделяются с грудным молоком и из-за возможности серьезные побочные реакции у грудных детей от MONUROL, решение должно быть принято решение о прекращении ухода или отказе от приема препарата, принимая во внимание учитывать важность препарата для матери.
Безопасность и эффективность у детей в возрасте 12 лет и младше не установлены. в адекватных и хорошо контролируемых исследованиях.
ПОБОЧНЫЕ РЕАКЦИИ
В клинических испытаниях наиболее часто возникающие нежелательные явления, о которых сообщалось
у> 1% пациентов, получавших MONUROL (n = 1233), были: диарея (9,0%),
вагинит (5. 5%), тошнота (4,1%), головная боль (3,9%), головокружение (1,3%),
астения (1,1%) и диспепсия (1,1%).
5%), тошнота (4,1%), головная боль (3,9%), головокружение (1,3%),
астения (1,1%) и диспепсия (1,1%).
MONUROL
Что такое MONUROL ® ?
Гранулы MONUROL (фосфомицин трометамин) для перорального раствора — это рецептурный антибиотик, одобренный для лечения неосложненных инфекций мочевыводящих путей (ИМП) у женщин, вызванных определенными типами бактерий.
ВАЖНАЯ ИНФОРМАЦИЯ О РИСКАХ
Кому нельзя назначать МОНУРОЛ?
MONUROL не следует принимать лицам, у которых в прошлом была аллергическая реакция (гиперчувствительность) на MONUROL или любой из его ингредиентов.
Что я должен знать во время лечения MONUROL?
- Свяжитесь с вашим лечащим врачом, если ваши симптомы не улучшатся в течение 2–3 дней после приема MONUROL.

- Диарея — распространенная проблема при приеме антибактериальных препаратов и обычно заканчивается, когда прием препарата прекращается.Иногда после начала лечения антибиотиками у пациентов может развиваться водянистый или кровянистый стул (с желудочными спазмами и лихорадкой или без них) даже спустя два или более месяцев после приема последней дозы антибиотика. Если это произойдет, как можно скорее обратитесь к своему врачу.
- MONUROL не изучался у детей в возрасте 12 лет и младше.
Что я должен сказать своему врачу перед началом применения MONUROL?
Перед тем, как начать лечение MONUROL, сообщите своему врачу обо всех ваших медицинских состояниях, в том числе, если вы:
- беременны или планируют беременность
- кормят грудью или планируют кормить грудью
Сообщите своему врачу обо всех лекарствах, которые вы принимаете, включая лекарства, отпускаемые по рецепту и без рецепта, витамины и травяные добавки.

 1434.
1434. , подготовленное Американским обществом инфекционистов и Европейским обществом микробиологии и инфекционных заболеваний. Клин Инфекция Дис . 2011; 52 (5): e103-e120. DOI: 10.1093 / cid / ciq257.
, подготовленное Американским обществом инфекционистов и Европейским обществом микробиологии и инфекционных заболеваний. Клин Инфекция Дис . 2011; 52 (5): e103-e120. DOI: 10.1093 / cid / ciq257. DOI: 10.1016 / j.ijantimicag.2016.04.014.
DOI: 10.1016 / j.ijantimicag.2016.04.014. А., Эллис А.Г. и др. Является ли фосфомицин потенциальной альтернативой лечения грамотрицательного простатита с множественной лекарственной устойчивостью? Клин Инфекция Дис . 2014; 58 (4): e101-e105. DOI: 10,1093 / cid / cit704.
А., Эллис А.Г. и др. Является ли фосфомицин потенциальной альтернативой лечения грамотрицательного простатита с множественной лекарственной устойчивостью? Клин Инфекция Дис . 2014; 58 (4): e101-e105. DOI: 10,1093 / cid / cit704. Может ли заразить Dis Med Microbiol . 2016; 2016: 2082693. DOI: 10.1155 / 2016/2082693.
Может ли заразить Dis Med Microbiol . 2016; 2016: 2082693. DOI: 10.1155 / 2016/2082693. 5–4
5–4 ( P. rettgeri и P. stuartii )
( P. rettgeri и P. stuartii )
 3
3 5–256
5–256 2
2