Диагностика и лечение ротавирусной инфекции у детей
Диагностика ротавирусной инфекции
Для подтверждения ротавирусной инфекции используют молекулярно-генетические, серологические методы. Материалом для исследования служат фекалии. Исследования, направленные на обнаружение антигенов вируса или нуклеиновых кислот вирусов, желательно проводить в первые 4 дня болезни. Наиболее распространенный способ диагностики — обнаружение антигенов ротавируса в фекалиях с помощью иммуноферментного анализа (ИФА), реакции латекс-агглютинации (РЛА). В повседневной практике широко используется ПЦР-диагностика — полимеразная цепная реакция, которая относится к молекулярно-генетическим методам исследования. Существуют экспресс-тесты для выявления антигена ротавируса в фекалиях на основе иммунохроматографического метода (рота-тест).
Как лечить ротавирус у детей
Основа терапии и лечения острых кишечных инфекций — нормализация процессов, к нарушению которых привел возбудитель, микробные или вирусные токсины (воздействие на симптомы общей интоксикации, водно-электролитные нарушения, нарушение процессов пищеварения, изменения микробного пейзажа кишечника).
Еще до приезда врача родители могут оказать первую помощь заболевшему ребенку.
Начать ее необходимо со снижения температуры (если она выше 38,5 °С): раздеть ребенка, обтереть прохладной водой, можно поставить жаропонижающую свечу (на основе парацетамола) в прямую кишку (ректально) или, при отсутствии многократных рвот, перорально (через рот) дать средства на основе парацетамола или ибупрофена в виде сиропа или таблетки (растереть в порошок) в возрастной дозе.
Оральная регидратация
После оказания первой помощи необходимо приступить к оральной регидратации (отпаиванию или инфузионной терапии). Для оральной регидратации используются специальные глюкозо-солевые растворы (Хумана Электролит, Гидровит, ОРС-200, Супер-ОРС, Регидрон).
При отпаивании самым важным является дробность введения жидкости.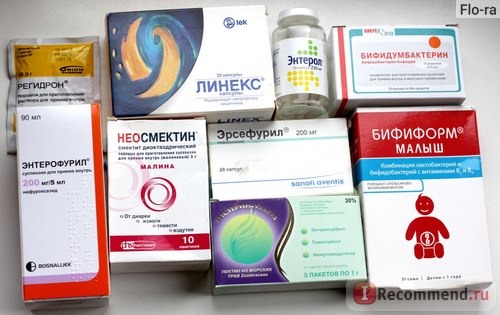 Для этого родители должны набраться терпения и поить ребенка малыми порциями через 10–12 минут.
Для этого родители должны набраться терпения и поить ребенка малыми порциями через 10–12 минут.
Ребенку в возрасте до года за раз можно давать до 5 мл (1 чайная ложка) жидкости, от 1 до 3 лет — до 10 мл (2 чайных или 1 десертная ложка), более старшим детям — до 15 мл (1 столовая ложка). Жидкость ребенку нужно давать из ложки, можно вливать за щеку из шприца (разумеется, без иголки) или отливать необходимый разовый объем жидкости в маленький рожок. Не следует давать ребенку чашку с большим объемом жидкости, т. к. у малыша имеется жажда, самостоятельно он может выпить много жидкости (80–150 мл) и этим спровоцировать рвоту.
Следует знать, что оральную регидратацию проводить нельзя при: неукротимой рвоте, общем тяжелом состоянии ребенка и обезвоживании II–III степени, резком снижении выделения мочи (олигоанурии), что может быть проявлением острой почечной недостаточности. В этих случаях она неэффективна, и драгоценное время на оказание адекватной медицинской помощи будет упущено.
Диетотерапия и питание при ротавирусе
Рациональное питание, или диетотерапия является важнейшей частью лечения детей, переносящих острые кишечные инфекции, т. к. при неадекватном питании возможно формирование длительной диареи, развитие гипотрофии (снижения массы тела), синдрома мальабсорбции (нарушения переваривания и всасывания пищевых веществ) и т. п. Основой диетотерапии является рациональный режим питания и коррекция диеты в зависимости от фазы заболевания. Адекватный подбор питания и специальная диета при ротавирусе способствует повышению сопротивляемости организма и благоприятному исходу ОКИ.
Доказано, что даже при тяжелых формах кишечных инфекций основные функции кишечника сохраняются, а длительное нахождение ребенка без пищи (так называемые водно-чайные паузы, которые раньше широко практиковали в лечении кишечных инфекций за неимением информации о том, чем кормить ребенка при ротавирусе) приводит к задержке восстановительных процессов в слизистой оболочке желудочно-кишечного тракта, способствует развитию белково-калорийной недостаточности и снижению массы тела.
Для детей первого года жизни, переносящих ОКИ, оптимальным видом пищи является грудное молоко, т. к. оно содержит огромное число защитных факторов (иммуноглобулин А, лизоцим, интерферон, лактоферрин, комплемент, бифидо- и лактобактерии и т. д.), чрезвычайно необходимых больному ребенку.
Ребенка необходимо чаще прикладывать к груди. Количество грудного молока, получаемого ребенком за одно кормление, можно контролировать, взвесив ребенка до начала кормления и после его завершения, высчитав разницу в массе тела, которая и будет являться количеством съеденного. В отдельных случаях ребенка можно кормить сцеженным грудным молоком.
Ротавирусная инфекция у детей: особенности иммунного ответа и опыт применения нового релиз-активного препарата | Малышев
 JAMA Pediatr, 2016. doi:10.1001/jamapediatrics. 2015.4276.
JAMA Pediatr, 2016. doi:10.1001/jamapediatrics. 2015.4276.2. Горелов А.В. Интерферонотерапия при острых кишечных инфекциях у детей (Актуальные вопросы интерферонотерапии в случае инфекционной патологии у детей). Эффективная фармакотерапия, 2015, 3: 49-50.
3. Soares-Weiser K, Maclehose H, Bergman H, Ben-Aharon I, Nagpal S, Goldberg E. et al. Vaccines for preventing rotavirus diarrhea: vaccines in use. Cochrane Database Syst Rev, 2012, 11: CD008521.
4. Das JK, Bhutta ZA. Global challenges in acute diarrhea. Curr Opin Gastroenterol, 2016, 32(1): 18-23.
5. Ogilvie I, Khoury H, Goetghebeur MM, El Khoury AC, Giaquinto C. Burden of communityacquired and nosocomial rotavirus gastroenteritis in the pediatric population of Western Europe: a scoping review.
6. Маянский Н.А., Маянский А.Н., Куличенко Т.В. Ротавирусная инфекция: эпидемиология, патология, вакцинопрофилактика. Вестник РАМН, 2015, 1: 47-55.
7. Лукьянова А.М., Бехтерева М.К., Птичникова Н.Н. Клинико-эпидемиологическая характеристика вирусных диарей у детей. Журнал инфектологии, 2014, 6(1): 60-66.
8. Cho H, Kelsall BL. The role of type I interferons in intestinal infection, homeostasis, and inflammation. Immunol Rev, 2014, 260(1): 145-167.
9. Feng N, Kim B, Fenaux M, Nguyen H, Vo P, Omary MB et al. Role of Interferon in Homologous and Heterologous Rotavirus nfection in the Intestines and Extraintestinal Organs of Suckling Mice. J Virol, 2008, 82(15): 7578-7590.
J Virol, 2008, 82(15): 7578-7590.
11. Swain SL, McKinstry KK, Strutt TM. Expanding roles for CD4+ T cells in immunity to viruses. Nature reviews Immunology, 2012, 12(2): 136-148.
12. Dong H, Qu S, Chen X, Zhu H, Tai X, Pan J. Changes in the cytokine expression of peripheral Treg and Th27 cells in children with rotavirus enteritis. Exp Ther Med, 2015, 10(2): 679-682.
13. Kim B., Feng N, Narváez CF, HeX-S, Eo SK, Lim CW et al. The Influence of CD4+ CD25+ Foxp3+ Regu la tory T Cells on the Immune Response to Rota virus Infection. Vaccine, 2008, 26(44): 5601-5611.
14. Jaimes MC, Rojas OL, González AM, Cajiao I, Charpilienne A, Pothier P, et al. Frequencies of virus- specific CD4(+) and CD8(+) T lymphocytes secreting gamma interferon after acute natural rotavirus infection in children and adults. J Virol, 2002, 76(10): 4741-9.
Jaimes MC, Rojas OL, González AM, Cajiao I, Charpilienne A, Pothier P, et al. Frequencies of virus- specific CD4(+) and CD8(+) T lymphocytes secreting gamma interferon after acute natural rotavirus infection in children and adults. J Virol, 2002, 76(10): 4741-9.
15. Parra M, Herrera D, Jácome MF, Mesa MC, Rodríguez LS, Guzmán C, et al. Circulating rotavirus- specific T cells have a poor functional profile. Virology, 2014, 468-470: 340-50.
16. Луцкий А.А., Жирков А.А., Лобзин Д.Ю., Рао М., Алексеева Л.А., Мейрер М. и др. Интерферон- : биологическая функция и значение для диагностики клеточного иммунного ответа. Журнал инфектологии, 2015, 7(4): 10-22.
17. Arnold MM, Sen A, Greenberg HB, Patton JT. The Battle between Rotavirus and Its Host for Control of the Interferon Signaling Pathway. PLoS Pathog, 2013, 9(1): e1003064.
PLoS Pathog, 2013, 9(1): e1003064.
18. McNeal MM, Stone SC, Basu M, Clements JD, Choi AH, Ward RL. IFN-gamma is the only antirotavirus cytokine found after in vitro stimulation of memory CD4+ T cells from mice immunized with a chimeric VP6 protein. Viral Immunol, 2007, 20(4): 571-84.
19. Jiang B, Snipes-Magaldi L, Dennehy P, Keyserling H, Holman RC, Bresee J et al. Cytokines as mediators for or effectors against rotavirus disease in children. Clin Diagn Lab Immunol, 2003, 10(6): 995-1001.
20. Tate JE, Burton AH, Boschi-Pinto C, Steele AD, Duque J, Parashar UD. 2008 Estimate of worldwide rotavirus-associated mortality in children younger than 5 years before the introduction of universal rotavirus vaccination programmes: a systematic review and meta-analysis. Lancet Infect Dis, 2012, 12: 136-4110.
Lancet Infect Dis, 2012, 12: 136-4110.
21. Дмитриев А.Н. Релиз-активные лекарственные препараты – новое направление в лечении острых респираторных вирусных инфекций (обзор литературы). Практическая медицина, 2014, 7(83): 14-20.
22. Тхакушинова Н.Х., Соболева Н.Г. Современные возможности эффективного лечения ротавирусной инфекции у детей раннего возраста (результаты двойного слепого плацебоконтролируемого исследования лечебной эффективности анаферона детского). Педиатрия, 2012, 91(1): 63-67.
23. Горелов А.В., Плоскирева А.А., Тхакушинова Н.Х. Клинико-вирусологическая оценка эффективности индуктора интерферона, содержащего антитела к гамма-интерферону в релизактивной форме, в терапии острых вирусных кишечных инфекций. Инфекционные болезни, 2012, 10(3): 56-62.
24. Мартынова Г.П., Соловьева И.А., Кузнецова Н.Ф., Дорошенко Л.Г., Комарова Б.Л., Щеголева Ю.Е. и др. Ротавирусная инфекция: клинико-эпидемиологические особенности, опыт применения препарата Анаферон детский в комплексной терапии детей первого года жизни. Практическая медицина, 2015, 7(92): 138-144.
25. Калугина Т.В., Аверьянов О.Ю., Малявина Т.Е. Оценка клинической и санационной эффективности препарата «Анаферон детский» при назначении его в комплексной терапии у детей первого полугодия жизни с ротавирусным гастроэнтеритом. Поликлиника, 2012, 6: 1-2.
26. Николаева И.В. Опыт применения Анаферона детского в лечении ОРВИ с гастроинтестинальным синдромом и вирусных диарей у детей. Обзор литературы. Эффективная фармакотерапия. Педиатрия, 2013, 1: 8-12.
27. Павлова Е.Б. Эффективная стратегия лечения ОРВИ: противовоспалительное действие нового противовирусного препарата. Internal Medicine. Clinical SleepMedicine (Доктор.Ру), 2014, 9(97): 20-24.
Павлова Е.Б. Эффективная стратегия лечения ОРВИ: противовоспалительное действие нового противовирусного препарата. Internal Medicine. Clinical SleepMedicine (Доктор.Ру), 2014, 9(97): 20-24.
ВНИМАНИЕ, РОТАВИРУС! 10 мифов о коварной болезни Каждый родитель рано или поздно сталкивается с этой «болячкой». Тем не менее, вокруг инфекции ходит столько домыслов, что чувство растерянности зачастую приходит вместе с ней. Лечить ли антибиотиками и обязательно ли ложиться в больницу? Сдавать ли анализы и делать ли прививки? Советчиком нередко становится Интернет, но всем ли рекомендациям из Сети стоит доверять? Развеем мифы и внесем ясность. 🔹Миф 1. Ротавирус называется так потому, что распространяется через рот, через грязные руки Это утверждение часто вызывает улыбку у врачей, но, тем не менее, оно достаточно прочно укрепилось в сознании многих. Свое название ротавирус получил благодаря строению вирусных частиц, которые на электронных микрофотографиях выглядят как колесо («rota» на латинском).
 Ротавирус передается не только через рот и грязные руки, но и наиболее опасным воздушно-капельным путем. Ребенку для заражения достаточно получить 10 вирусных частиц, в то время как инфицированный человек выделяет их миллиардами. Вспышки отмечаются всесезонно, но чаще в холодный период. 🔹Миф 2. Если поставили диагноз «ротавирусная инфекция», обязательно должны назначить антибиотики или противовирусные препараты К сожалению, в современном мире не существует специфического лечения ротавирусной инфекции. Противоротавирусные препараты не разработаны, а антибактериальные препараты на вирусы не действуют, но ухудшают течение ротавирусной инфекции и оттягивают выздоровление. Лечение должно быть исключительно симптоматическим и направленным на восстановление жидкости, потерянной с рвотой и жидким стулом. Основа лечения – выпаивание. Предпочтение отдается специальным слабосоленым растворам (оралит, регидрон, тригидрон). В первые 3-4 часа нужно напоить ребёнка жидкостью из расчета 50-100 мл на 1 кг веса.
Ротавирус передается не только через рот и грязные руки, но и наиболее опасным воздушно-капельным путем. Ребенку для заражения достаточно получить 10 вирусных частиц, в то время как инфицированный человек выделяет их миллиардами. Вспышки отмечаются всесезонно, но чаще в холодный период. 🔹Миф 2. Если поставили диагноз «ротавирусная инфекция», обязательно должны назначить антибиотики или противовирусные препараты К сожалению, в современном мире не существует специфического лечения ротавирусной инфекции. Противоротавирусные препараты не разработаны, а антибактериальные препараты на вирусы не действуют, но ухудшают течение ротавирусной инфекции и оттягивают выздоровление. Лечение должно быть исключительно симптоматическим и направленным на восстановление жидкости, потерянной с рвотой и жидким стулом. Основа лечения – выпаивание. Предпочтение отдается специальным слабосоленым растворам (оралит, регидрон, тригидрон). В первые 3-4 часа нужно напоить ребёнка жидкостью из расчета 50-100 мл на 1 кг веса. По 5 мл каждые 5 минут. Выпаивание маленьким объемом позволяет не спровоцировать повторную рвоту. Сладкие напитки не рекомендованы. Применение сорбентов в первые часы заболевания значительно улучшает его исход. Наиболее эффективными являются препараты диосмектита. Принимать противорвотные и противодиарейные средства можно только после назначения врача. Обычно они необходимы только в случае тяжелого течения инфекции и выраженного обезвоживания. По некоторым данным противодиарейные препараты могут привести к размножению патогенной микрофлоры и ухудшению течения заболевания. 🔹Миф 3. Ротавирус опасен осложнениями, его нужно лечить в стационаре В большинстве случаев лечение ротавирусной инфекции проводится дома. Госпитализация может потребоваться для восстановления потерь жидкости, которое не удается устранить путем выпаивания. Тяжелое обезвоживание может приводить к судорогам, шоку или даже смерти.
Когда нужно вызывать скорую? — при диарее больше 8 раз. 🔹Миф 4. Ротавирусной инфекцией болеют только маленькие дети Такой миф связан с тем, что у большинства взрослых ротавирусная инфекция протекает бессимптомно.
По 5 мл каждые 5 минут. Выпаивание маленьким объемом позволяет не спровоцировать повторную рвоту. Сладкие напитки не рекомендованы. Применение сорбентов в первые часы заболевания значительно улучшает его исход. Наиболее эффективными являются препараты диосмектита. Принимать противорвотные и противодиарейные средства можно только после назначения врача. Обычно они необходимы только в случае тяжелого течения инфекции и выраженного обезвоживания. По некоторым данным противодиарейные препараты могут привести к размножению патогенной микрофлоры и ухудшению течения заболевания. 🔹Миф 3. Ротавирус опасен осложнениями, его нужно лечить в стационаре В большинстве случаев лечение ротавирусной инфекции проводится дома. Госпитализация может потребоваться для восстановления потерь жидкости, которое не удается устранить путем выпаивания. Тяжелое обезвоживание может приводить к судорогам, шоку или даже смерти.
Когда нужно вызывать скорую? — при диарее больше 8 раз. 🔹Миф 4. Ротавирусной инфекцией болеют только маленькие дети Такой миф связан с тем, что у большинства взрослых ротавирусная инфекция протекает бессимптомно. У ротавируса есть такая особенность — с каждым последующим контактом заболевание протекает легче. На самом деле ротавирусная инфекция способна поражать все возрастные категории, но чаще всего болеют дети до 2-х лет. 🔹Миф 5. Больной перестаёт заражать окружающих, как только прекращаются диарея и рвота Во внешней среде ротавирус сохраняется от нескольких дней до нескольких недель. Выделение вируса продолжается в течение 1,5 лет после перенесенной инфекции. 🔹Миф 6. Для уборки дома в период заболевания нужно применять хлорсодержащие средства Учитывая устойчивость ротавируса к хлорсодержащим средствам бытовой химии, даже очень строгие меры гигиены (в том числе мытье рук после каждого контакта с больным) зачастую могут оказаться неэффективными. 🔹Миф 7. Чтобы восстановить микрофлору, в период выздоровления полезно попить кисломолочные продукты и пробиотики Споров вокруг применения пробиотиков очень много. Есть исследования, доказывающие эффективность применения некоторых пробиотиков, которые могут помочь при острых диареях — снизить их тяжесть и длительность (примерно на 1 сутки).
У ротавируса есть такая особенность — с каждым последующим контактом заболевание протекает легче. На самом деле ротавирусная инфекция способна поражать все возрастные категории, но чаще всего болеют дети до 2-х лет. 🔹Миф 5. Больной перестаёт заражать окружающих, как только прекращаются диарея и рвота Во внешней среде ротавирус сохраняется от нескольких дней до нескольких недель. Выделение вируса продолжается в течение 1,5 лет после перенесенной инфекции. 🔹Миф 6. Для уборки дома в период заболевания нужно применять хлорсодержащие средства Учитывая устойчивость ротавируса к хлорсодержащим средствам бытовой химии, даже очень строгие меры гигиены (в том числе мытье рук после каждого контакта с больным) зачастую могут оказаться неэффективными. 🔹Миф 7. Чтобы восстановить микрофлору, в период выздоровления полезно попить кисломолочные продукты и пробиотики Споров вокруг применения пробиотиков очень много. Есть исследования, доказывающие эффективность применения некоторых пробиотиков, которые могут помочь при острых диареях — снизить их тяжесть и длительность (примерно на 1 сутки). Но применять их нужно только с целью лечения в острый период. В период восстановления после перенесенной ротавирусной инфекции применение пробиотиков не оправдано. 🔹Миф 8. Чтобы были силы, надо обязательно что-нибудь поесть Этот миф, конечно, связан с беспокойством мамы болеющего ребенка. Важнее все-таки восстанавливать количество потерянной жидкости, именно это даст силы ребенку и позволит избежать обезвоживания. Аппетит обязательно появится на 2-3 день от начала заболевания, и тогда можно будет вернуться к прежнему режиму питания. 🔹Миф 9. При подозрении на ротавирусную инфекцию нужно обязательно сдать анализ Точный диагноз можно поставить только после анализа кала, но в большинстве случаев анализы не нужны, так как результаты не влияют на лечение. Анализ кала при подозрении на ротавирусную инфекцию необходим в редких случаях (например, детям до 3 месяцев или при иммунодефиците), тогда врач его и назначит. 🔹Миф 10. Защититься от ротавируса невозможно – рано или поздно ребёнок им всё равно заболеет, поэтому прививаться нет смысла Действительно, вакцинация на 100% не защищает от заражения ротавирусом.
Но применять их нужно только с целью лечения в острый период. В период восстановления после перенесенной ротавирусной инфекции применение пробиотиков не оправдано. 🔹Миф 8. Чтобы были силы, надо обязательно что-нибудь поесть Этот миф, конечно, связан с беспокойством мамы болеющего ребенка. Важнее все-таки восстанавливать количество потерянной жидкости, именно это даст силы ребенку и позволит избежать обезвоживания. Аппетит обязательно появится на 2-3 день от начала заболевания, и тогда можно будет вернуться к прежнему режиму питания. 🔹Миф 9. При подозрении на ротавирусную инфекцию нужно обязательно сдать анализ Точный диагноз можно поставить только после анализа кала, но в большинстве случаев анализы не нужны, так как результаты не влияют на лечение. Анализ кала при подозрении на ротавирусную инфекцию необходим в редких случаях (например, детям до 3 месяцев или при иммунодефиците), тогда врач его и назначит. 🔹Миф 10. Защититься от ротавируса невозможно – рано или поздно ребёнок им всё равно заболеет, поэтому прививаться нет смысла Действительно, вакцинация на 100% не защищает от заражения ротавирусом. Она снижает заболеваемость, процент тяжелых ротавирусных инфекций, частоту госпитализаций и создает иммунитет на 5 и более лет. #ротавирус… — Центр медицинской реабилитации, восстановительной и спортивной медицины
Она снижает заболеваемость, процент тяжелых ротавирусных инфекций, частоту госпитализаций и создает иммунитет на 5 и более лет. #ротавирус… — Центр медицинской реабилитации, восстановительной и спортивной медициныВНИМАНИЕ, РОТАВИРУС! 10 мифов о коварной болезни
Каждый родитель рано или поздно сталкивается с этой «болячкой». Тем не менее, вокруг инфекции ходит столько домыслов, что чувство растерянности зачастую приходит вместе с ней. Лечить ли антибиотиками и обязательно ли ложиться в больницу? Сдавать ли анализы и делать ли прививки? Советчиком нередко становится Интернет, но всем ли рекомендациям из Сети стоит доверять? Развеем мифы и внесем ясность.
🔹Миф 1. Ротавирус называется так потому, что распространяется через рот, через грязные руки
Это утверждение часто вызывает улыбку у врачей, но, тем не менее, оно достаточно прочно укрепилось в сознании многих.
Свое название ротавирус получил благодаря строению вирусных частиц, которые на электронных микрофотографиях выглядят как колесо («rota» на латинском). Ротавирус передается не только через рот и грязные руки, но и наиболее опасным воздушно-капельным путем. Ребенку для заражения достаточно получить 10 вирусных частиц, в то время как инфицированный человек выделяет их миллиардами. Вспышки отмечаются всесезонно, но чаще в холодный период.
Ротавирус передается не только через рот и грязные руки, но и наиболее опасным воздушно-капельным путем. Ребенку для заражения достаточно получить 10 вирусных частиц, в то время как инфицированный человек выделяет их миллиардами. Вспышки отмечаются всесезонно, но чаще в холодный период.
🔹Миф 2. Если поставили диагноз «ротавирусная инфекция», обязательно должны назначить антибиотики или противовирусные препараты
К сожалению, в современном мире не существует специфического лечения ротавирусной инфекции. Противоротавирусные препараты не разработаны, а антибактериальные препараты на вирусы не действуют, но ухудшают течение ротавирусной инфекции и оттягивают выздоровление.
Лечение должно быть исключительно симптоматическим и направленным на восстановление жидкости, потерянной с рвотой и жидким стулом. Основа лечения – выпаивание. Предпочтение отдается специальным слабосоленым растворам (оралит, регидрон, тригидрон). В первые 3-4 часа нужно напоить ребёнка жидкостью из расчета 50-100 мл на 1 кг веса. По 5 мл каждые 5 минут. Выпаивание маленьким объемом позволяет не спровоцировать повторную рвоту. Сладкие напитки не рекомендованы. Применение сорбентов в первые часы заболевания значительно улучшает его исход. Наиболее эффективными являются препараты диосмектита. Принимать противорвотные и противодиарейные средства можно только после назначения врача. Обычно они необходимы только в случае тяжелого течения инфекции и выраженного обезвоживания. По некоторым данным противодиарейные препараты могут привести к размножению патогенной микрофлоры и ухудшению течения заболевания.
По 5 мл каждые 5 минут. Выпаивание маленьким объемом позволяет не спровоцировать повторную рвоту. Сладкие напитки не рекомендованы. Применение сорбентов в первые часы заболевания значительно улучшает его исход. Наиболее эффективными являются препараты диосмектита. Принимать противорвотные и противодиарейные средства можно только после назначения врача. Обычно они необходимы только в случае тяжелого течения инфекции и выраженного обезвоживания. По некоторым данным противодиарейные препараты могут привести к размножению патогенной микрофлоры и ухудшению течения заболевания.
🔹Миф 3. Ротавирус опасен осложнениями, его нужно лечить в стационаре
В большинстве случаев лечение ротавирусной инфекции проводится дома. Госпитализация может потребоваться для восстановления потерь жидкости, которое не удается устранить путем выпаивания. Тяжелое обезвоживание может приводить к судорогам, шоку или даже смерти.
Когда нужно вызывать скорую?
— при наличии признаков обезвоживания и неукротимой рвоты;
— при диарее больше 8 раз.
🔹Миф 4. Ротавирусной инфекцией болеют только маленькие дети
Такой миф связан с тем, что у большинства взрослых ротавирусная инфекция протекает бессимптомно. У ротавируса есть такая особенность — с каждым последующим контактом заболевание протекает легче. На самом деле ротавирусная инфекция способна поражать все возрастные категории, но чаще всего болеют дети до 2-х лет.
🔹Миф 5. Больной перестаёт заражать окружающих, как только прекращаются диарея и рвота
Во внешней среде ротавирус сохраняется от нескольких дней до нескольких недель. Выделение вируса продолжается в течение 1,5 лет после перенесенной инфекции.
🔹Миф 6. Для уборки дома в период заболевания нужно применять хлорсодержащие средства
Учитывая устойчивость ротавируса к хлорсодержащим средствам бытовой химии, даже очень строгие меры гигиены (в том числе мытье рук после каждого контакта с больным) зачастую могут оказаться неэффективными.
🔹Миф 7. Чтобы восстановить микрофлору, в период выздоровления полезно попить кисломолочные продукты и пробиотики
Споров вокруг применения пробиотиков очень много. Есть исследования, доказывающие эффективность применения некоторых пробиотиков, которые могут помочь при острых диареях — снизить их тяжесть и длительность (примерно на 1 сутки). Но применять их нужно только с целью лечения в острый период. В период восстановления после перенесенной ротавирусной инфекции применение пробиотиков не оправдано.
Есть исследования, доказывающие эффективность применения некоторых пробиотиков, которые могут помочь при острых диареях — снизить их тяжесть и длительность (примерно на 1 сутки). Но применять их нужно только с целью лечения в острый период. В период восстановления после перенесенной ротавирусной инфекции применение пробиотиков не оправдано.
🔹Миф 8. Чтобы были силы, надо обязательно что-нибудь поесть
Этот миф, конечно, связан с беспокойством мамы болеющего ребенка. Важнее все-таки восстанавливать количество потерянной жидкости, именно это даст силы ребенку и позволит избежать обезвоживания. Аппетит обязательно появится на 2-3 день от начала заболевания, и тогда можно будет вернуться к прежнему режиму питания.
🔹Миф 9. При подозрении на ротавирусную инфекцию нужно обязательно сдать анализ
Точный диагноз можно поставить только после анализа кала, но в большинстве случаев анализы не нужны, так как результаты не влияют на лечение. Анализ кала при подозрении на ротавирусную инфекцию необходим в редких случаях (например, детям до 3 месяцев или при иммунодефиците), тогда врач его и назначит.
🔹Миф 10. Защититься от ротавируса невозможно – рано или поздно ребёнок им всё равно заболеет, поэтому прививаться нет смысла
Действительно, вакцинация на 100% не защищает от заражения ротавирусом. Она снижает заболеваемость, процент тяжелых ротавирусных инфекций, частоту госпитализаций и создает иммунитет на 5 и более лет.
#ротавирус #инфекция #мифы #болезнь
Ротавирусная инфекция
О центре — Учимся быть здоровыми
Обновлено 05.04.2019 05.04.2019
Автор: ManagerРотавирусный гастроэнтерит – острая инфекционная болезнь с фекально–оральным механизмом передачи возбудителя.
Источником инфекции являются инфицированные взрослые и дети — больные или вирусоносители, выделяющие ротавирусы с фекалиями. В течение первых 5–и дней болезни пациенты представляют наибольшую эпидемиологическую опасность для окружающих.
Механизм передачи: фекально-оральный, реализация — вода, пища; контактно-бытовой путь, не исключен и воздушно-пылевой. Наиболее важный фактор передачи — вода.
Из пищевых продуктов опасны молоко и молочные продукты, зараженные при хранении или реализации.
Контактно-бытовая передача происходит чаще в семье, в местах коллективного проживания при несоблюдении правил личной гигиены.
Среди детей и взрослых ротавирусная инфекция может проявляться в виде спорадических случаев, локальных групповых заболеваний, вспышек и имеет повсеместное распространение. Характерна сезонность – зимне-весенний период. Естественная восприимчивость к ротавирусной инфекции высокая, наибольшее число заболевших отмечается среди детей в возрасте от 6 мес. до 2-х лет.
до 2-х лет.
При ротавирусной инфекции отмечается высокая очаговость, особенно в детских дошкольных коллективах. Ротавирусы рассматривают также как один из основных агентов при внутрибольничных вспышках гастроэнтерита в родильных домах и детских стационарах разного профиля. Взрослые и дети старшего возраста инфицируются от больных детей, посещающих детские коллективы.
У переболевших ротавирусной инфекцией формируется строго специфический иммунитет, но продолжительность его неизвестна.
Клиника заболевания
Инкубационный период — от нескольких часов до 1-2 суток.
Периоды болезни:
- Начальная фаза — 12-24 часа;
- Острый период (разгар болезни) – 3-4 дня;
- Период реконвалесценции с 4-7 дня.
Степени тяжести
Первыми признаками болезни являются диарея, рвота, боль в животе. Диарея — постоянный симптом, после дефекации — облегчение.
Испражнения обильные, водянистые, желтого цвета, пенистого вида, с резким кислым запахом.
При легкой степени: температура тела нормальная или повышается до 37,5º, симптомы интоксикации выражены слабо. Рвоты не бывает. Стул густой кашицеобразный, коричневого цвета, до 5 раз в сутки. Больные жалуются на тяжесть в эпигастральной области, снижение аппетита и другие диспепсические явления.
При средней степени тяжести: температура тела 37,5º и выше, умеренно выражены симптомы интоксикации. Рвота возникает у больных одновременно с диареей или раньше, повторяется 3-4 раза и прекращается в течение первых суток. Частота стула 10–15 раз в сутки, имеет мутно-белую окраску , иногда с примесью слизи. Боль в животе локализуется в эпигастральной и пупочной областях или носит диффузный характер.
Тяжелая степень заболевания: температура тела 38,0º и выше, держится 1-3 дня, может быть озноб. Боль в животе может быть очень сильной. Рвота при тяжелом течении болезни возникает после приема пищи или воды. Рвотные массы обильные, содержат примесь пищи и слизи. Испражнения более 15 раз в сутки, обильные, водянистые, желтого цвета, пенистые, с резким запахом. При осмотре больных на слизистой оболочке мягкого неба, небных дужках, языке — гиперемия, зернистость. У детей могут быть признаки ринита, диффузная гиперемия барабанной перепонки. Другие органы и системы также вовлекаются в патологический процесс, но по сравнению с кишечником реже. При тяжелом течении болезни могут развиться острая сердечно — сосудистая недостаточность, обморок.
Испражнения более 15 раз в сутки, обильные, водянистые, желтого цвета, пенистые, с резким запахом. При осмотре больных на слизистой оболочке мягкого неба, небных дужках, языке — гиперемия, зернистость. У детей могут быть признаки ринита, диффузная гиперемия барабанной перепонки. Другие органы и системы также вовлекаются в патологический процесс, но по сравнению с кишечником реже. При тяжелом течении болезни могут развиться острая сердечно — сосудистая недостаточность, обморок.
Лабораторная диагностика: материалом для вирусологического исследования служат фекалии больных. Определяют антиген ротавируса в первые 2-3 дня болезни.
Лечение:
— Диета № 4: исключение овощей, фруктов, молока, молочных продуктов, копченостей, солений, кондитерских изделий, газированных напитков, соков;
— Ограничение сахара;
— Противовирусные препараты: кипферон, арбидол;
— Абсорбенты и вяжущие вещества: смекта, энтеросгель, активированный уголь;
— Полиморфные препараты: мезим форте, фестал, панзинорм.
Профилактика заболевания:
Профилактические меры при ротавирусном гастроэнтерите являются общими, как и для всей группы кишечных инфекций с фекально-оральным механизмом заражения.
Тщательно мойте овощи и фрукты, употребляемые в пищу в сыром виде, мойте руки с мылом перед приготовлением еды и после разделки сырых рыбы, мяса или птицы, после прогулок, игр с животными. Избегайте контакта между сырыми и готовыми пищевыми продуктами. Храните все скоропортящиеся продукты и готовую пищу в холодильнике.
Показания для госпитализации:
1. Лихорадка выше 38,0º;
2. Рвота более 5 раз за сутки;
3. Диарея более 10 раз за сутки.
Заведующая инфекционным отделением КДЦ № 1 Ольга Ивановна Исакова
Виноваты ротавирус и норовирус | Biocodex Microbiote Institut
Виноваты ротавирус и норовирус
Если брать все возрастные группы, основной причиной гастроэнтерита является норовирус. Однако во всем мире у детей в возрасте до пяти лет именно ротавирусные инфекции являются главной причиной тяжелой и острой диареи. Бедные страны наиболее подвержены их влиянию, несмотря на вакцины и противовирусные препараты.
Однако во всем мире у детей в возрасте до пяти лет именно ротавирусные инфекции являются главной причиной тяжелой и острой диареи. Бедные страны наиболее подвержены их влиянию, несмотря на вакцины и противовирусные препараты.
Ротавирус был идентифицирован в 1973 году и обязан таким названием своему отличительному строению наподобие колеса3 . Существует десять различных видов ротавирусов, наиболее распространенным из которых является вид A. Помимо диареи, которая не является кровавой и быстро проходит, в отличие от бактериальной диареи, эта инфекция вызывает рвоту, которая способствует обезвоживанию больных и может препятствовать эффективности лечения. Инфекция, спровоцированная ротавирусом, обычно более тяжелая, чем диарея, вызванная другими инфекционными возбудителями: защитными реакциями на инфекцию являются повышение температуры, головокружение, упадок сил. Если она длится более недели или если диарея/ рвота усиливается, требуется обращение к врачу и специальное лечение. Передача ротавирусной инфекции возможна круглый год и в основном происходит путем прямого или опосредованного контакта с инфицированными людьми. Осложнения редки, но возможны: при попадании в кровоток вирус может вызывать инфекции внекишечной локализации, главным образом неврологические (менингит, энцефалит, энцефалопатия). Введение вакцинации в 2006 году во всем мире имело два последствия в богатых странах: инфицироваться стали лица из других возрастных групп (подростки или те, кому за 70), а вспышки стали сезонными.
Передача ротавирусной инфекции возможна круглый год и в основном происходит путем прямого или опосредованного контакта с инфицированными людьми. Осложнения редки, но возможны: при попадании в кровоток вирус может вызывать инфекции внекишечной локализации, главным образом неврологические (менингит, энцефалит, энцефалопатия). Введение вакцинации в 2006 году во всем мире имело два последствия в богатых странах: инфицироваться стали лица из других возрастных групп (подростки или те, кому за 70), а вспышки стали сезонными.
Будьте внимательны с питанием и близкими контактами
10 !Норовирус чрезвычайно заразен, обладает высокой патогенностью и относительной устойчивостью к дезинфицирующим средствам. Таким образом, он передается главным образом при употреблении зараженной пищи или воды или через контакт с инфицированными предметами или людьми. Также возможно заражение воздушно-капельным путем. Просто отдельные случаи могут быстро приводить к эпидемиям в ограниченном пространстве (на круизных судах, в медицинских учреждениях, больницах и т. д.), а острые формы способны вызывать серьезные кишечные осложнения (постинфекционный синдром раздраженного кишечника, опасное для жизни обезвоживание и т. д.). Обычно гастроэнтерит, вызванный норовирусом, длится от одного до четырех дней и сопровождается теми же симптомами, что и ротавирусный гастроэнтерит: болями в животе, тошнотой, рвотой и диареей без примеси крови. Чаще всего он проходит самостоятельно, но может потребоваться несколько месяцев для уничтожения вируса у здоровых носителей (инфицированных, но без симптомов), а иногда и несколько лет у людей с ослабленной иммунной системой; и поскольку они становятся хронически больными, то, вероятно, также становятся резервуарами болезни.
д.), а острые формы способны вызывать серьезные кишечные осложнения (постинфекционный синдром раздраженного кишечника, опасное для жизни обезвоживание и т. д.). Обычно гастроэнтерит, вызванный норовирусом, длится от одного до четырех дней и сопровождается теми же симптомами, что и ротавирусный гастроэнтерит: болями в животе, тошнотой, рвотой и диареей без примеси крови. Чаще всего он проходит самостоятельно, но может потребоваться несколько месяцев для уничтожения вируса у здоровых носителей (инфицированных, но без симптомов), а иногда и несколько лет у людей с ослабленной иммунной системой; и поскольку они становятся хронически больными, то, вероятно, также становятся резервуарами болезни.
10 Baldridge MT et al. Norovirus Regulation by Host and Microbe. Trends Mol Med. 2016 Dec
Stomatidine
Лечение ОРВИ у детей и взрослых зависят от двух основных факторов: типа вируса и активности иммунитета. В борьбе с любой болезнью действует принцип: «лучшая битва та, которая не состоялась». Поэтому профилактика всегда лучше, чем лечение ОРВИ.
Поэтому профилактика всегда лучше, чем лечение ОРВИ.
Диагностика ОРВИ
При установлении диагноза, врачи пользуются двумя инструментами: дифференциальная диагностика и лабораторные исследования. В большинстве случаев второй этап не обязателен, хотя является показательным.
Дифференциальная диагностика включает общий осмотр пациента и анализ симптоматики. Кроме общих проявлений, таких как температура и слабость, при ОРВИ могут увеличиваться селезенка и печень, что тоже учитывается при постановке диагноза.
Лабораторная диагностика определяет наличие антител в крови к тому или иному вирусу. Ее назначают, чтобы подтвердить диагноз или выявить точный вид вируса, когда картина болезни расплывчата.
Профилактика ОРВИ
Наиболее распространенный способ заражения – воздушно-капельный. Частицы живого вируса способны жить сутки в теплом месте без носителя. Поэтому качественный воздухообмен в помещении – залог здоровья. Каждую комнату в доме необходимо проветривать минимум один раз в сутки. Если кто-то из жителей уже заболел, то проветривание проводят чаще. Одной из причин частых ОРВИ у ребенка становится не детский сад, как таковой, а плохая циркуляция воздуха в помещении группы. При этом дети всегда в тесном контакте и всегда есть кто-то с насморком.
Каждую комнату в доме необходимо проветривать минимум один раз в сутки. Если кто-то из жителей уже заболел, то проветривание проводят чаще. Одной из причин частых ОРВИ у ребенка становится не детский сад, как таковой, а плохая циркуляция воздуха в помещении группы. При этом дети всегда в тесном контакте и всегда есть кто-то с насморком.
Кроме проветривания нужна влажная уборка помещений, желательно с дезинфицирующими растворами.
На улице риск поймать вирус повышается. Марлевые повязки в разгар эпидемий – хороший вариант защиты. Вспышки респираторных заболеваний попадают на осень и зиму, когда погода неустойчива. В эти периоды важно не переохлаждаться.
Ротавирусная инфекция распространяется через тесный контакт с зараженными предметами быта: тарелками, игрушками, канцелярскими принадлежностями. Следующий шаг профилактики очевиден: своевременное мытье рук. Чем чаще, тем лучше.
Быстрое лечение ОРВИ возможно только с помощью противовирусных средств, поэтому чтобы встать на ноги и легко перенести болезнь, нужно укреплять иммунитет. Это самая надежная мера профилактики.
Это самая надежная мера профилактики.
Иммунная система тесно связана со стрессами. Соблюдение правил здорового образа жизни и сон не менее 8 часов в сутки – первое, что необходимо наладить. Систематические прогулки на свежем воздухе полезны и детям, и взрослым. Еще один важный фактор – здоровое питание. Установлена связь между качеством еды и частотой возникновения болезней. Полезная пища легче переваривается, не оставляет лишнего в организме и положительно влияет на работу внутренних органов.
В последние годы популярными стали прививки от вирусных инфекций. Это одно из эффективных средств поддержания иммунитета и защиты от заболеваний.
Ротавирусная инфекция у детей: симптомы и лечение — Цитовир-3
Немного о недуге
Каждый день через нашу пищеварительную систему проходит большое количество воды и еды. Даже при самой тщательной обработке попадания вредных микроорганизмов и бактерий не избежать. Именно поэтому желудочно-кишечный тракт – наиболее уязвимый элемент в нашем организме и важно о нем заботиться. Ведь все вирусы, попадая в желудок и кишечник, могут привести к сильным нарушениям работы системы в целом.
Ведь все вирусы, попадая в желудок и кишечник, могут привести к сильным нарушениям работы системы в целом.
В этой статье мы разберем один из самых частых случаев заболевания – ротавирусную кишечную инфекцию у детей, уделим внимание симптомам и признакам и расскажем об эффективных способах лечения.
Статистика сообщает неутешительные данные: каждый год регистрируется несколько миллионов стационарных случаев по всему миру. И как минимум 1-2 раза за этот промежуток ложится в больницу один человек. Ребенок рискует заболеть больше, чем взрослый: его неокрепшее тело только приспосабливается к жизни вне утробы матери.
Родители же заражаются при уходе за своим чадом: это достаточно распространенная практика, когда сначала кашляет и чихает один, а на следующий день – уже вся семья.
Так как у этого вируса достаточно широкая сфера действия и распространения, просим не затягивать с обращением к доктору. Если вы чувствуете себя нехорошо, обратитесь при первой же возможности к врачу.
Как болезнь действует на тело
Рассмотрим принцип попадания вируса в ЖКТ. Бактерии, осевшие на продуктах, одежде, предметах гигиены, достаточно тяжело истребить, так как у них много механизмов выживания. Инкубационный период ротавирусной инфекции у детей начинается с того, что болезнетворные клетки минуют желудок и попадают в толстую кишку. Оседая там, они начинают размножаться: как только подходит время созревания – они высвобождаются. Часть выводится вместе с продуктами жизнедеятельности, часть – продолжает разрушать организм.
Если не прибегнуть к своевременному лечению, возможно скорое прогрессирование заболевания и ухудшение состояния.
Что способствует заражению
Среда распространения вируса очень широка, так как один человек способен во время болезни заразить практически всех, с кем он контактирует. Бактерии, попадая на верхнюю одежду, предметы быта и гигиены, пищу, очень быстро проникают внутрь. Именно поэтому специалисты советуют не контактировать с пациентами во время лечения.
Когда кто-то в семье начинает болеть, то всем остальным сложно избежать появления симптомов. Как бы человека ни изолировали, находиться в одном помещении – большой риск для групповой вспышки недуга.
Осложнения ротавирусной инфекции у детей могут появиться и после контакта с людьми, работающими в общественных заведениях. Именно поэтому необходимо всегда заботиться о своей гигиене. Повара, работники таможни, транспорта, официанты, даже билетеры в кинотеатре – не все обращаются за необходимой помощью, а потому микробы легко переходят от одного человека к другому.
Признаки заболевания
Начальные симптомы похожи на те, которые человек испытывает при ОРЗ. У пациента наблюдается повышение температуры тела до 37 градусов и першение в горле. Заболевший не может избавиться от ощущения вялости и слабости.
Данный вид недуга в народе именуют желудочным гриппом, так как через пару дней признаки ОРЗ дополняются новыми, затрагивающими нарушения в работе ЖКТ.
Расстройства кишечника и тяжелое токсическое отравление могут проявиться тяжело: человек не встанет с кровати в течение нескольких недель. Действие ротавирусной инфекции на детей очень сильное, а потому у взрослых должны быть точные знания об эффективном лечении и профилактике болезни.
Действие ротавирусной инфекции на детей очень сильное, а потому у взрослых должны быть точные знания об эффективном лечении и профилактике болезни.
Поговорим о выраженных симптомах. У ребенка этот вид гриппа проявляется так:
- Боль и колики в животе. Неприятные ощущения появляются при надавливании на кожу. Дают о себе знать умеренно, чувства неострые.
- Выходы рвотных масс. Маленький ребенок страдает от этого признака меньше, чем подросток или взрослый человек. Рвота продолжается до суток и способствует общему обезвоживанию организма.
- Диарея. Стул обычно жидкий, содержит слизь, а у маленьких (до года) – выходит в виде пены. Продолжаться такая ситуация может до полного выздоровления.
- Высокая температура. Она может достигать 39 градусов (и чуть выше) и длиться до нескольких дней. В тяжелых случаях подобное состояние продолжается около 1,5 недель. Именно поэтому лечение ротавирусной инфекции у детей в домашних условиях не всегда допустимо – необходим стационар.

- Интоксикация. Или общее отравление организма. Проявляется в общей слабости ребенка, головокружении, головной боли. У некоторых пациентов отмечается холодный пот и потеря аппетита.
Все перечисленные выше признаки кишечного гриппа проявляются в разной степени. Чем старше человек, тем легче и быстрее он перенесет заболевание (не относится к людям пожилого возраста). Если вы чувствуете ухудшение собственного состояния или состояния вашего чада, не затягивайте с походом к специалисту.
Опасные проявления
Эти показатели могут свидетельствовать о тяжелом состоянии ребенка и необходимости срочной госпитализации. Такие сигналы не говорят ни о чем хорошем – оставаться дома недопустимо. Помните о том, что ребенок не в силах адекватно оценить свою группу риска, а потому сами следите за всеми признаками гриппа.
К этому перечню врачи относят:
- Сыпь на внешних кожных покровах. Маленькие красные пятна, которые говорят о появлении других заболеваний.

- Острая боль внизу живота. Ощущения выражены слабо и практически не приносят дискомфорта. Появление подобного симптома говорит о сильном повреждении стенок толстой кишки.
- Жидкий стул заставляет ходить в туалет до 12 раз в сутки. Схема лечения ротавирусной инфекции у детей в таком случае должна в обязательном порядке содержать посещение врача. В стационаре восполнят потерянный объем необходимых микроорганизмов с помощью введения лекарства внутривенно.
- Кровянистые выделения в кале. При подобном проявлении желудочного гриппа не стоит ждать промедления, так как данный признак свидетельствует о сильном повреждении кишечника. При наличии температуры выше 39-40 градусов незамедлительно вызывайте бригаду скорой помощи.
Характерная клиническая картина
Инфекция схожа с некоторыми заболеваниями типа ОРЗ и обычной простуды. Однако существуют сигналы, которые позволят вам точно отделить одно от другого.
Специалисты к ним относят:
- Острая начальная стадия развития болезни.
 Ухудшение состояния после созревания вируса развивается стремительно и может занимать до 6 часов.
Ухудшение состояния после созревания вируса развивается стремительно и может занимать до 6 часов. - Всплеск групповых заражений приходится на осень-зиму каждого года. Но исключить появление признаков летом нельзя ввиду большого количества вариантов распространения гриппа.
- Высыпаний на коже чаще всего не наблюдается, а потому спутать с другой болезнью достаточно сложно.
- Повышение температуры у больного обычно до 39 градусов с небольшими отклонениями, однако продолжается она только несколько дней.
Не забывайте при лечении вовремя принимать противовирусные препараты – так ротавирусная инфекция у детей пройдет быстрее и легче.
Диагностика заболевания специалистами
Если вы сдадите общий анализ мочи и крови во время болезни, то показатели не будут иметь специфических изменений. Выявить недуг могут только специальные лабораторные исследования.
Так как часть вредных возбудителей выводится вместе с калом, то именно его просят для проведения анализа. Берутся возбудители и подселяются к здоровым клеткам: специалисты смотрят, как одни действуют на другие, и делаются соответствующие выводы. Именно так и определяется природа микробов.
Берутся возбудители и подселяются к здоровым клеткам: специалисты смотрят, как одни действуют на другие, и делаются соответствующие выводы. Именно так и определяется природа микробов.
Действие прививки основывается на следующем принципе: в организм подселяется небольшое количество возбудителя, тот в свою очередь реагирует на это и выделяет антитела. Из этого исходит серологический анализ крови: во время болезни нужно сдать небольшое количество жидкости для определения выработки борющихся с болезнью клеток.
Не затягивайте с терапией, ожидая результатов из лаборатории. Приступайте к лечению чада, как только появляются первые признаки ухудшения состояния, предупредите окружающих о том, что он начинает заболевать и выделите ему свободное время на уход и восстановление.
Что делать при ротавирусной инфекции у ребенка
Большинство пациентов предпочитают отлеживаться дома и обходиться подручными средствами, часто в этот список попадают и народные рецепты. Это действительно помогает, но только при случаях легкой и средней тяжести. В ситуациях, угрожающих жизни и здоровью детей, лучше не рисковать и обращаться к специалисту.
Это действительно помогает, но только при случаях легкой и средней тяжести. В ситуациях, угрожающих жизни и здоровью детей, лучше не рисковать и обращаться к специалисту.
Рассмотрим несколько важных составляющих быстрого выздоровления.
Изменение рациона питания
Полезны некоторые корректировки в качестве и количестве приемов пищи. Грудничков продолжают кормить в том же режиме – до 5 раз в день. В материнском молоке содержатся все необходимые полезные микроорганизмы, которые помогают укреплять иммунитет.
Если мама кормит чадо искусственными смесями, то в этот непростой для ребенка период необходимо перейти на питание, в котором отсутствует лактоза. Оно поможет восстановить стенки кишечника и уменьшить длительность жидкого стула.
Малышам в возрасте от 4 лет и подросткам рекомендуется исключить некоторые продукты, которые усугубляют состояние. К ним относят:
- сухие ягоды, например, курага или сушеные яблоки;
- экзотические фрукты, транспортированные из-за рубежа;
- большое количество мучных изделий;
- острые блюда с добавлением большого количества соли;
- молоко и кефир;
- куриный бульоны.

Несмотря на огромную пользу этих продуктов, употреблять их в разгар болезни не стоит, так как они способствуют усилению диареи. Специалисты выяснили, как вылечить ротавирусную инфекцию у ребенка, используя полезное питание и правильные медикаменты.
Чтобы избавиться от жидкого стула, детям рекомендуется употреблять слегка подсоленные каши на воде: овсянку или пшенку.
Устранение симптомов
Прежде чем идти в аптеку и купить какое-либо лекарство, обязательно проконсультируйтесь с лечащим врачом. Употребление некоторых препаратов в том или ином состоянии либо не поможет, либо усугубит ситуацию. Терапевты предлагают употреблять следующие группы препаратов:
- Сорбирующие. Они необходимы, чтобы убрать со стенок кишечника размножающиеся бактерии. В больнице для этих целей назначают непродолжительный курс приема активированного угля.
- Сиропы и растворы. Груднички не могут выпить или разжевать целую таблетку, поэтому для этих случаев существуют жидкие средства с сахаром.
 Причем в таком возрасте не стоит самостоятельно подбирать микстуру – это может привести к серьезным последствиям.
Причем в таком возрасте не стоит самостоятельно подбирать микстуру – это может привести к серьезным последствиям. - Противовирусные. Помогают сократить время болезни на несколько дней.
- Пробиотики. Необходимы, чтобы восстановить работу кишечника после длительных нарушений. Улучшение состояния ЖКТ положительно сказывается на состоянии в целом.
Сколько длится лечение и как проявляется в связи с этим ротавирусная инфекция у маленьких детей? Помните о том, что они очень тяжело переносят это заболевание, а потому срок может затянуться на несколько недель. Обеспечьте грамотный уход своему ребенку.
Профилактика кишечного гриппа
Чтобы защитить себя от недуга, необходимо придерживаться таких методов:
- Тщательно следить за своей гигиеной. Здесь работают все правила: мыть руки перед едой, чистить или промывать фрукты и овощи, кипятить воду, не давать другим пользоваться своими средствами гигиены, по минимуму контактировать с заболевшими людьми.
 Да, проследить за тем, чтобы все это соблюдал ребенок, достаточно сложно. Приучите своего малыша с ранних лет, и в дальнейшем он сам будет следовать всем предписаниям.
Да, проследить за тем, чтобы все это соблюдал ребенок, достаточно сложно. Приучите своего малыша с ранних лет, и в дальнейшем он сам будет следовать всем предписаниям.
- Регулярно делать прививки. Они помогают в дальнейшем легче переносить грипп. Таким образом вполне можно избежать посещения врача и лечения в стационаре.
Часто возникающие вопросы
Если переболел несколько раз, возможно ли снова подхватить грипп?
Иммунитет против этого заболевания формируется ненадолго, а потому здесь только точный ответ – да. Чтобы создать мощную защиту, необходимо серьезно заниматься профилактикой, в частности, использовать вакцины и пить противовирусные препараты.
Когда болит живот, можно ли принимать обезболивающее средство?
Острая боль – симптом серьезный, а потому требует срочного осмотра врачом. Принимать такие медикаменты здесь не рекомендуется.
Чем лечить ротавирусную инфекцию у детей
Обычно это противовирусные препараты комплексного действия. К примеру, врач может назначить «Цитовир-3».
К примеру, врач может назначить «Цитовир-3».Как он действует на организм? Медикамент активизирует неспецифическую защиту иммунитета от вирусов: содержащиеся в его составе компоненты помогают умеренно увеличивать интерферон, в то время как другие способствуют быстрому выбросу этого элемента. Действие этого лекарства намного эффективнее, так как после приема других препаратов- конкурентов реакция организма на выработку антител снижается.
В чем преимущества перед другими средствами?
- Поддержание необходимого для борьбы с вирусами уровня интерферона (своих белков, которые обладают противовирусной активностью), отменяя фазу ослабления и прекращения.
- Все другие таблетки или порошки основаны на пиковом механизме действия. После их применения клетки не отвечают ни на какие стимулы, что создает благоприятные условия для развития болезнетворных бактерий.
В этой статье мы разобрались, что же такое ротавирусная инфекция и каков механизм ее действия на организм, узнали об основных и опасных симптомах заболевания, рассмотрели группы лекарств для лечения и профилактики при разных формах недуга. Надеемся, эта статья стала для вас полезной. Будьте здоровы!
Надеемся, эта статья стала для вас полезной. Будьте здоровы!
Противовирусная активность ресвератрола против ротавируса in vitro и in vivo.
Ротавирус (RV) является основным возбудителем вирусного гастроэнтерита среди младенцев и детей раннего возраста во всем мире. В настоящее время не существует клинически одобренного и эффективного противовирусного препарата для лечения инфекции RV.
Мы исследовали потенциальную активность ресвератрола против RV и основные механизмы, с помощью которых ресвератрол действует против RV.
Активность ресвератрола in vitro против RV оценивали с помощью анализов уменьшения образования бляшек.Влияние ресвератрола на выход потомства вириона, экспрессию вирусного полипротеина и синтез геномной РНК исследовали, соответственно, с использованием иммуноферментных анализов, вестерн-блоттинга и qRT-PCR. Кроме того, мы также измерили противовирусный эффект ресвератрола путем оценки клиренса антигена и оценки изменений провоспалительных цитокинов / хемокинов на модели новорожденных мышей, инфицированных RV.
Наши результаты показали, что 20 мкМ ресвератрола значительно ингибировали репликацию RV в клеточной линии Caco-2, подавляя синтез РНК RV, экспрессию белка, образование бляшек вироплазмы, продукцию вирионов потомства и RV-индуцированную цитопатию независимо от различных штаммов и клеточных линий Фургон, который мы использовали.Анализ влияния времени после добавления ресвератрола показал, что его применение ингибировало ранние процессы в цикле репликации правого желудочка. Дальнейшее изучение основного механизма анти-RV активности показало, что ресвератрол ингибировал репликацию RV, подавляя экспрессию мРНК и белка белка теплового шока 90 (HSP90), и что эффект проявлялся в зависимости от дозы. Было обнаружено, что сверхэкспрессия HSP90 ослабляет ингибирующий эффект ресвератрола на репликацию RV.Интересно, что применение ресвератрола снижает уровень ингибирования RV-опосредованного фосфорилирования MEK1 / 2 и ERK. Используя модель сосущих мышей, инфицированных RV, мы обнаружили, что применение ресвератрола значительно уменьшало тяжесть диареи, уменьшало титры вируса и облегчало сопутствующие симптомы. Было обнаружено, что уровни экспрессии мРНК интерлейкина-2, интерлейкина-10, фактора некроза опухоли-α, интерферона-γ, воспалительного белка макрофагов 1 и хемотаксического белка моноцитов-1 были резко снижены в ткани кишечника мышей, которые были обработанные ресвератролом (10 или 20 мг / кг) после инфицирования RV (p <0.05).
Было обнаружено, что уровни экспрессии мРНК интерлейкина-2, интерлейкина-10, фактора некроза опухоли-α, интерферона-γ, воспалительного белка макрофагов 1 и хемотаксического белка моноцитов-1 были резко снижены в ткани кишечника мышей, которые были обработанные ресвератролом (10 или 20 мг / кг) после инфицирования RV (p <0.05).
Эти данные свидетельствуют о том, что ресвератрол проявляет противовирусную активность и может быть многообещающим средством лечения ротавирусной инфекции.
Авторские права © 2020 Elsevier GmbH. Все права защищены.
Список литературы
PubMed
антибиотиков помогают контролировать ротавирусные инфекции и повышают антиротавирусный иммунитет: серьезно ли вы? | Журнал инфекционных болезней
(См. Основную статью Учиямы и др. На страницах 171–82.)
Да и нет.Да, мы должны понимать новые интригующие открытия; но нет, мы далеки от серьезного отношения к широкому использованию противомикробных препаратов при плановой иммунизации. В этом выпуске Учияма и его коллеги [1] раскрывают наши взгляды на резидентную микробиоту и устойчивость организма к кишечным вирусным инфекциям. Они описывают, как антибиотики (ампициллин и неомицин, вводимые в течение 2-8 недель) уменьшают инфекции и симптомы ротавирусной инфекции у мышей и усиливают иммуноглобулин (Ig) A, специфичный для ротавируса, эффекты, которые частично имитируются у стерильных мышей.Кроме того, они показывают, что легкий экспериментальный колит декстрансульфат натрия (DSS) (что отражается повышенным содержанием липокалина-2 в кале, что, возможно, отражает «энтеропатию», наблюдаемую в развивающихся регионах, где нарушены кишечные реакции на вакцины), ухудшает поздний (возможно приобретенный) фекальный и сывороточный IgA. ответные меры на ротавирусные инфекции. Каким бы еретическим ни звучало использование антибиотиков для лечения вирусных инфекций, это не беспрецедентно. Как отмечают авторы, Kuss et al [2] ранее показали, что бактериальный липополисахарид (LPS) кишечника (или Bacillus cereus , пептидогликан или N-ацетилглюкозамин [GlcNAc] -содержащие полисахариды) могут связываться с полиовирусом или реовирусом, чтобы облегчить их поглощение.
В этом выпуске Учияма и его коллеги [1] раскрывают наши взгляды на резидентную микробиоту и устойчивость организма к кишечным вирусным инфекциям. Они описывают, как антибиотики (ампициллин и неомицин, вводимые в течение 2-8 недель) уменьшают инфекции и симптомы ротавирусной инфекции у мышей и усиливают иммуноглобулин (Ig) A, специфичный для ротавируса, эффекты, которые частично имитируются у стерильных мышей.Кроме того, они показывают, что легкий экспериментальный колит декстрансульфат натрия (DSS) (что отражается повышенным содержанием липокалина-2 в кале, что, возможно, отражает «энтеропатию», наблюдаемую в развивающихся регионах, где нарушены кишечные реакции на вакцины), ухудшает поздний (возможно приобретенный) фекальный и сывороточный IgA. ответные меры на ротавирусные инфекции. Каким бы еретическим ни звучало использование антибиотиков для лечения вирусных инфекций, это не беспрецедентно. Как отмечают авторы, Kuss et al [2] ранее показали, что бактериальный липополисахарид (LPS) кишечника (или Bacillus cereus , пептидогликан или N-ацетилглюкозамин [GlcNAc] -содержащие полисахариды) могут связываться с полиовирусом или реовирусом, чтобы облегчить их поглощение.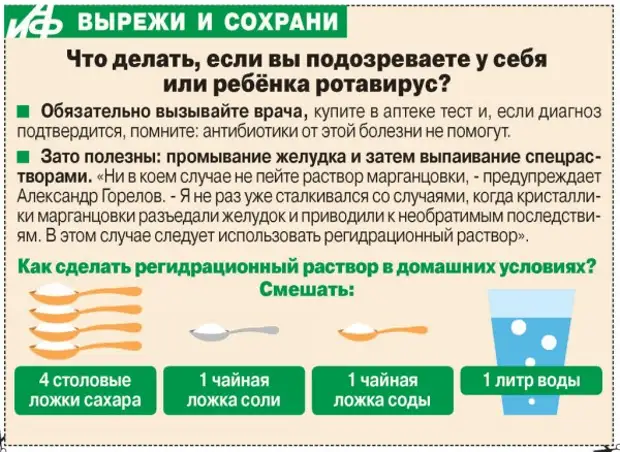 и инфекционность в кишечном тракте.Kuss et al [2] использовали человеческий рецептор полиовируса (PVR) — трансгенный интерферон, альфа / бета-рецептор — инактивированный (PVRtg- Ifnar 1 — / — ), чувствительных к полиовирусу мышей и клетки HeLa, чтобы показать, что антибиотики снижают инфекционность полиовируса, а также неродственного кишечного вируса, реовируса (т. е. повышенная восприимчивость к кишечной (а не парентеральной или внутрибрюшинной) инфекции полиовируса без антибиотиков, и повышенная жизнеспособность полиовируса, инкубированного в фекалиях стерильных мышей с добавлением бактерий ( B .cereus , Escherichia coli или Enterococcus faecalis ) или продукты микробной поверхности (ЛПС, пептидогликан, муцин, хитин или полисахарид, содержащий GlcNAc)). Открытие Учиямой неизменных соотношений цепей ротавируса +: — предполагает, что проникновение вируса, а не внутриклеточная репликация вируса, изменяется под действием антибиотиков. Хотя недавно были предложены другие объяснения, такие как прямая противовирусная активность тиазолидов, например, нитазоксанид [3], возможно, открытие Учиямы о том, что антибиотики могут снижать вирусную инфекционность за счет изменения микробиоты резидента, еще больше объясняет озадачивающую пользу нитазоксанида при ротавирусных инфекциях [3].
и инфекционность в кишечном тракте.Kuss et al [2] использовали человеческий рецептор полиовируса (PVR) — трансгенный интерферон, альфа / бета-рецептор — инактивированный (PVRtg- Ifnar 1 — / — ), чувствительных к полиовирусу мышей и клетки HeLa, чтобы показать, что антибиотики снижают инфекционность полиовируса, а также неродственного кишечного вируса, реовируса (т. е. повышенная восприимчивость к кишечной (а не парентеральной или внутрибрюшинной) инфекции полиовируса без антибиотиков, и повышенная жизнеспособность полиовируса, инкубированного в фекалиях стерильных мышей с добавлением бактерий ( B .cereus , Escherichia coli или Enterococcus faecalis ) или продукты микробной поверхности (ЛПС, пептидогликан, муцин, хитин или полисахарид, содержащий GlcNAc)). Открытие Учиямой неизменных соотношений цепей ротавируса +: — предполагает, что проникновение вируса, а не внутриклеточная репликация вируса, изменяется под действием антибиотиков. Хотя недавно были предложены другие объяснения, такие как прямая противовирусная активность тиазолидов, например, нитазоксанид [3], возможно, открытие Учиямы о том, что антибиотики могут снижать вирусную инфекционность за счет изменения микробиоты резидента, еще больше объясняет озадачивающую пользу нитазоксанида при ротавирусных инфекциях [3]. 4, 5]? Могут ли эти интригующие новые концепции вирусного патогенеза также пролить свет на дифференциальную пользу от добавления пробиотиков ( Saccharomyces boulardii отдельно или в комбинации с Lactobacillus acidophilus , Lactobacillus rhamnosus и Bifidobacterium re-Hydration® (пероральные растворы ORS longum )). ) для детей с ротавирусом по сравнению с монотерапией ПРС [6]? Аналогичным образом, как взаимодействия между резидентной флорой и другими избранными небактериальными энтеропатогенами, включая паразитов и вирусы, влияют на патогенез? Hayes et al., Например, показали, что кишечные микробы могут вызывать вылупление яиц кишечных нематод ( Trichuris muris ) у мышей [7].
4, 5]? Могут ли эти интригующие новые концепции вирусного патогенеза также пролить свет на дифференциальную пользу от добавления пробиотиков ( Saccharomyces boulardii отдельно или в комбинации с Lactobacillus acidophilus , Lactobacillus rhamnosus и Bifidobacterium re-Hydration® (пероральные растворы ORS longum )). ) для детей с ротавирусом по сравнению с монотерапией ПРС [6]? Аналогичным образом, как взаимодействия между резидентной флорой и другими избранными небактериальными энтеропатогенами, включая паразитов и вирусы, влияют на патогенез? Hayes et al., Например, показали, что кишечные микробы могут вызывать вылупление яиц кишечных нематод ( Trichuris muris ) у мышей [7].
Однако эти еретические мысли, подразумевающие, что антибиотики могут помочь при ротавирусной диарее, контролировать вспышки или даже улучшить реакцию на вакцины, противоречат нашему общепринятому мнению о том, что опосредованное антибиотиками истощение резидентной микробиоты увеличивает восприимчивость к некоторым инфекциям и что чрезмерное использование антибиотиков вызывает все более тревожную устойчивость к лекарствам. Резидентная микробиота необходима для нормального развития лимфоидной ткани, ассоциированной с кишечником, управляет ответами Т-клеток и В-клеток, а также дендритных клеток и макрофагов на вирусные инфекции гриппа и лимфоцитарного хориоменингита (LCM) [8, 9] (ссылки 11 и 12 в Uchiyama [1]) и играют очевидную защитную роль в предотвращении таких все более тревожных кишечных угроз, как инфекции Clostridium difficile и Salmonella .Чувствительная к неомицину нормальная флора ( Lactobacillus ) или LPS, CpG или поли (I: C) (лиганды Toll-подобного рецептора [TLR]), вводимые интраназально или интраректально, важны для миграции дендритных клеток в лимфатические узлы средостения и инициируют T -клеточные ответы на грипп с вирус-специфическими CD4, CD8 и ответы антител на респираторные инфекции гриппа [8]. Abt et al. Отмечают, что антибиотики (ампициллин, гентамицин, метронидазол, неомицин и ванкомицин, вводимые в течение 2–4 недель с питьевой водой) увеличивают тяжесть вируса системного лимфоцитарного хориоменингита и инфекций гриппа слизистых оболочек у мышей с нарушением как врожденного, так и адаптивного иммунитета.
Резидентная микробиота необходима для нормального развития лимфоидной ткани, ассоциированной с кишечником, управляет ответами Т-клеток и В-клеток, а также дендритных клеток и макрофагов на вирусные инфекции гриппа и лимфоцитарного хориоменингита (LCM) [8, 9] (ссылки 11 и 12 в Uchiyama [1]) и играют очевидную защитную роль в предотвращении таких все более тревожных кишечных угроз, как инфекции Clostridium difficile и Salmonella .Чувствительная к неомицину нормальная флора ( Lactobacillus ) или LPS, CpG или поли (I: C) (лиганды Toll-подобного рецептора [TLR]), вводимые интраназально или интраректально, важны для миграции дендритных клеток в лимфатические узлы средостения и инициируют T -клеточные ответы на грипп с вирус-специфическими CD4, CD8 и ответы антител на респираторные инфекции гриппа [8]. Abt et al. Отмечают, что антибиотики (ампициллин, гентамицин, метронидазол, неомицин и ванкомицин, вводимые в течение 2–4 недель с питьевой водой) увеличивают тяжесть вируса системного лимфоцитарного хориоменингита и инфекций гриппа слизистых оболочек у мышей с нарушением как врожденного, так и адаптивного иммунитета. ответы [9].Lantier и др. Продемонстрировали, что комбинация ампициллина, ванкомицина, колистина и стрептомицина устраняет защитные эффекты поли (I: C), но не CpG, у новорожденных мышей Cryptosporidium , инфицированных, отмечая необходимость дополнительных сигналов кишечной флорой. через сигнализацию TLR-5 [12]. Несколько лет назад Isolauri et al [10] и совсем недавно Preidis et al [11] предположили, что Lactobacillus casei GG или Lactobacillus reuteri могут усиливать ротавирусную вакцину или иммунный ответ на инфекцию.В качестве альтернативы, специфические комменсальные организмы, такие как Clostridium или Fecalibacterium prausnitzii , могут усиливать контроль регуляторных Т-клеток (Treg) чрезмерных провоспалительных реакций хозяина в моделях аутоиммунных заболеваний (воспалительное заболевание кишечника [ВЗК]) [13-15], в то время как сегментированные нитчатые бактерии (SFB) могут изменять реакцию провоспалительного интерлейкина (IL) -17 на мышиных моделях, ухудшая аутоиммунный артрит и рассеянный склероз у мышей, но защищая от диабета [16-19].
ответы [9].Lantier и др. Продемонстрировали, что комбинация ампициллина, ванкомицина, колистина и стрептомицина устраняет защитные эффекты поли (I: C), но не CpG, у новорожденных мышей Cryptosporidium , инфицированных, отмечая необходимость дополнительных сигналов кишечной флорой. через сигнализацию TLR-5 [12]. Несколько лет назад Isolauri et al [10] и совсем недавно Preidis et al [11] предположили, что Lactobacillus casei GG или Lactobacillus reuteri могут усиливать ротавирусную вакцину или иммунный ответ на инфекцию.В качестве альтернативы, специфические комменсальные организмы, такие как Clostridium или Fecalibacterium prausnitzii , могут усиливать контроль регуляторных Т-клеток (Treg) чрезмерных провоспалительных реакций хозяина в моделях аутоиммунных заболеваний (воспалительное заболевание кишечника [ВЗК]) [13-15], в то время как сегментированные нитчатые бактерии (SFB) могут изменять реакцию провоспалительного интерлейкина (IL) -17 на мышиных моделях, ухудшая аутоиммунный артрит и рассеянный склероз у мышей, но защищая от диабета [16-19]. То, как изменения в резидентной микробиоте влияют на иммунные ответы, может быть специфичным для антибиотика и / или зависеть от пути введения вакцины. Ву и др. Отметили, что, хотя ампициллин усиливает ответы антител IgM на вакцину слизистой оболочки Ty21a у мышей, некоторые другие антибиотики (кларитромицин и доксициклин) нарушают Т-клеточно-зависимые и независимые ответы на парентеральные (столбнячный, пневмококковый или поверхностный антиген гепатита В) вакцины. [20]. Такие переменные последующие эффекты антибиотиков могут зависеть от различного воздействия на определенные иммуногенные комменсалы, такие как Bacteroides fragilis , который обладает способностью как формировать абсцесс, так и противовоспалительно за счет стимуляции Treg, продуцирующей IL-10 [21].Более того, чрезмерное использование противомикробных препаратов ведет к эволюционной скрытности резистентности к лекарственным средствам у резидентной микробиоты, что ведет к быстрому сокращению арсенала антибиотиков против инвазивных патогенных бактерий [22, 23].
То, как изменения в резидентной микробиоте влияют на иммунные ответы, может быть специфичным для антибиотика и / или зависеть от пути введения вакцины. Ву и др. Отметили, что, хотя ампициллин усиливает ответы антител IgM на вакцину слизистой оболочки Ty21a у мышей, некоторые другие антибиотики (кларитромицин и доксициклин) нарушают Т-клеточно-зависимые и независимые ответы на парентеральные (столбнячный, пневмококковый или поверхностный антиген гепатита В) вакцины. [20]. Такие переменные последующие эффекты антибиотиков могут зависеть от различного воздействия на определенные иммуногенные комменсалы, такие как Bacteroides fragilis , который обладает способностью как формировать абсцесс, так и противовоспалительно за счет стимуляции Treg, продуцирующей IL-10 [21].Более того, чрезмерное использование противомикробных препаратов ведет к эволюционной скрытности резистентности к лекарственным средствам у резидентной микробиоты, что ведет к быстрому сокращению арсенала антибиотиков против инвазивных патогенных бактерий [22, 23].
Этим находкам, несомненно, суждено вызвать интриги и споры. Безусловно, следует признать важные предостережения. По какому механизму (-ам) усиливались ответы IgA? Uchiyama et al. Обнаружили повышенную концентрацию ротавирус-специфических IgA-продуцирующих антитела клеток у мышей, получавших антибиотики [1].Но какие другие типы клеток (например, клетки Панета, М-клетки, секретирующие слизь клетки, макрофаги и другие антигенпрезентирующие клетки) также были количественно или функционально затронуты в условиях введения антибиотиков? Как эти результаты влияют на лучшее понимание резидентной микробиоты как модуляторов иммунитета слизистых оболочек в условиях хронического кишечного воспаления («энтеропатии»), которое часто встречается в популяциях детей, демонстрирующих снижение иммуногенности и эффективности ротавирусной вакцины.Может ли энтеропатия и / или коинфекционные энтеропатогены ухудшать антиротавирусные IgA-ответы, аналогично результатам модели колита DSS Учиямы? Эти данные на мышах C57Bl6, безусловно, необходимо подтвердить на людях, которым вводят ротавирусную вакцину. Намного более короткое (возможно, однократное) применение противомикробных препаратов будет иметь решающее значение для потенциального практического применения этих результатов, которые, к сожалению, показали, что 2 недели меньше 8 недель лечения в этой мышиной модели. Действительно, усиление проникновения вируса в условиях LPS и других макромолекул, описанное Куссом и др., Хотя это прямо не рассматривается в исследовании Uchiyama, поднимает важные соображения относительно временных соотношений между введением антибиотика и возникающими в результате изменениями относительных концентраций этих макромолекул, высвобождаемых из резидентной микробиоты. .Например, даже временное повышение содержания сиаловой кислоты сразу после приема антибиотиков способствует избыточному росту C. difficile и Salmonella typhimurium в моделях на животных [24]. Такие уточнения могут помочь направить более конкретную оценку компонентов / манипуляций адъювантной вакцины с меньшими посторонними последствиями для резидентной микробиоты.
Намного более короткое (возможно, однократное) применение противомикробных препаратов будет иметь решающее значение для потенциального практического применения этих результатов, которые, к сожалению, показали, что 2 недели меньше 8 недель лечения в этой мышиной модели. Действительно, усиление проникновения вируса в условиях LPS и других макромолекул, описанное Куссом и др., Хотя это прямо не рассматривается в исследовании Uchiyama, поднимает важные соображения относительно временных соотношений между введением антибиотика и возникающими в результате изменениями относительных концентраций этих макромолекул, высвобождаемых из резидентной микробиоты. .Например, даже временное повышение содержания сиаловой кислоты сразу после приема антибиотиков способствует избыточному росту C. difficile и Salmonella typhimurium в моделях на животных [24]. Такие уточнения могут помочь направить более конкретную оценку компонентов / манипуляций адъювантной вакцины с меньшими посторонними последствиями для резидентной микробиоты. Особенно важно в этом отношении растущее понимание широко распространенных преимуществ, которыми обладает, по крайней мере, многие «нормальные» микробиоты; следовательно, широкий спектр рисков может сопровождать широкое использование антибиотиков с такими процедурами, как иммунизация.Мы только начинаем осознавать огромное значение кишечной микробиоты для статуса питания (от ожирения до квашиоркора) [25, 26], сердечно-сосудистых заболеваний [27, 28], воспалительных заболеваний [13-15, 29] и растущей устойчивости к антибиотикам. [22, 23]. Эти провокационные открытия требуют, чтобы мы более тщательно продумали факторы защиты организма от потенциально разрушительных кишечных инфекций.
Особенно важно в этом отношении растущее понимание широко распространенных преимуществ, которыми обладает, по крайней мере, многие «нормальные» микробиоты; следовательно, широкий спектр рисков может сопровождать широкое использование антибиотиков с такими процедурами, как иммунизация.Мы только начинаем осознавать огромное значение кишечной микробиоты для статуса питания (от ожирения до квашиоркора) [25, 26], сердечно-сосудистых заболеваний [27, 28], воспалительных заболеваний [13-15, 29] и растущей устойчивости к антибиотикам. [22, 23]. Эти провокационные открытия требуют, чтобы мы более тщательно продумали факторы защиты организма от потенциально разрушительных кишечных инфекций.
Собирая вместе все эти фрагментарные свидетельства (см. Таблицу 1), мы обнаруживаем, что задаем несколько вопросов:
Каковы различия между отдельными резидентами микробиоты, которые либо подавляют, либо усиливают защиту и иммунитет хозяина, не говоря уже о других состояниях здоровья.
 исходы от ВЗК до ожирения, недоедания и сердечно-сосудистых заболеваний?
исходы от ВЗК до ожирения, недоедания и сердечно-сосудистых заболеваний?Каковы различия между возбудителями и инфекционными заболеваниями, которые по-разному влияют на их восприимчивость к резидентной микробиоте?
Каковы конкретные компоненты резидентных микробных сообществ, которые ответственны за ослабленные иммунные ответы на отдельные кишечные инфекции или, альтернативно, за усиление защиты хозяина, которая может быть вызвана пре- или пробиотическими подходами?
Доказательства того, что резидентная микробиота может быть плохой или хорошей
| Ссылка . | Сообщение . |
|---|---|
| Плохо: Примеры доказательств того, что резидентная микробиота может быть вредной и что антибиотики могут помочь | |
| Uchiyama et al. [1] | Антибиотики защищают ротавирусную инфекцию мышей и усиливают вирус-специфические IgA-ответы |
Kuss et al. [2] [2] | Нормальная флора ( Bacillus cereus , ЛПС, пептидогликан или N-ацетилглюкозамин-полисахарид) способствует проникновению полиомиелита и реовируса |
| Rossignol et al. [4] | Нитазоксанид улучшает исходы при ротавирусной инфекции |
| Hayes et al. [7] | Микробиота кишечника усиливает Trichuris muris вылупление яиц и инфицирование; Энофлоксацин-чувствительная флора ( Escherichia coli , Staphylococcus aureus , Salmonella typhimurium , Pseudomonas aeruginosa или маннозочувствительные фибрии 1-го типа) усиливают T.muris яйцеклетка |
| Иванов и др. [16], Ли и др. [18], Wu et al. [19] | SFB увеличивают провоспалительные клетки CD4 Th27 и ухудшают аутоиммунную ВЗК, артрит и рассеянный склероз |
| Woo et al. [20] | Антибиотики улучшают ответ на вакцину Ty21a |
| Хорошо: Примеры полезной местной микробиоты или антибиотиков, повышающих риск | |
Grandy et al. [6] [6] | Sacchyromyces boulardii снижает продолжительность диареи и лихорадки при острой ротавирусной инфекции; польза уменьшается при сочетании с Lactobacillus acidophilus , Lactobacillus rhamnosus и Bifidobacterium longum |
| Ichinohe et al.[8] | Чувствительный к неомицину Lactobacillus или LPS на слизистой оболочке стимулируют Т-клеточный иммунитет к гриппу |
| Abt et al. [9] | Мыши, получавшие антибиотики, демонстрируют более тяжелые системные LCM и инфекции слизистых оболочек гриппа из-за нарушения врожденного и адаптивного иммунитета |
| Lantier et al. [12] | Микробиота кишечника обеспечивает необходимую передачу сигналов Toll-подобного рецептора-5 для поли (I: C) инфекции у мышей Cryptosporidium |
| Isolauri et al.[10] | Lactobacillus casei GG усиливает ответы IgM и IgA на вакцину против резус-ротавируса у младенцев. |
| Preidis et al. [11] | Lactobacillus reuteri уменьшает ротавирусную диарею у мышей |
| Sartor [13] | Fecalibacterium prausnitzii может улучшить контроль Treg IBD |
| Atarashi et al. [15] | Commensal Clostridium sp. индуцирует Treg-клетки |
| Kriegel et al.[17] | SFB увеличивают CD4-клетки Th27, защищая от диабета на мышиных моделях |
| Pons et al. [22], Mathers et al. [23] | Комменсалы накапливают дополнительные гены устойчивости к антибиотикам |
| Ley et al. [25], Smith et al. [26] | Микробиота квашиоркора вызывает потерю веса у мышей; микробиота, не относящаяся к квашиоркору, вызывает увеличение веса |
| Wang et al. [27] | Микробиота определяет выработку холина и сердечно-сосудистые заболевания из пищевого фосфатидилхолина |
| Mazmanian et al.[29] | Bacteroides fragilis полисахарид-A снижает провоспалительный IL14 через IL10 у мышей H. hepatica колит hepatica колит |
| Ссылка . | Сообщение . |
|---|---|
| Плохо: Примеры доказательств того, что резидентная микробиота может быть вредной и что антибиотики могут помочь | |
| Uchiyama et al. [1] | Антибиотики защищают ротавирусную инфекцию мышей и усиливают вирус-специфические IgA-ответы |
| Kuss et al.[2] | Нормальная флора ( Bacillus cereus , ЛПС, пептидогликан или N-ацетилглюкозамин-полисахарид) способствует проникновению полиомиелита и реовируса |
| Rossignol et al. [4] | Нитазоксанид улучшает исходы при ротавирусной инфекции |
| Hayes et al. [7] | Микробиота кишечника усиливает Trichuris muris вылупление яиц и инфицирование; Энофлоксацин-чувствительная флора ( Escherichia coli , Staphylococcus aureus , Salmonella typhimurium , Pseudomonas aeruginosa или маннозочувствительные фибрии 1-го типа) усиливают T. muris яйцеклетка muris яйцеклетка |
| Иванов и др. [16], Ли и др. [18], Wu et al. [19] | SFB увеличивают провоспалительные клетки CD4 Th27 и ухудшают аутоиммунную ВЗК, артрит и рассеянный склероз |
| Woo et al. [20] | Антибиотики улучшают ответ на вакцину Ty21a |
| Хорошо: Примеры полезной местной микробиоты или антибиотиков, повышающих риск | |
| Grandy et al. [6] | Sacchyromyces boulardii снижает продолжительность диареи и лихорадки при острой ротавирусной инфекции; польза уменьшается при сочетании с Lactobacillus acidophilus , Lactobacillus rhamnosus и Bifidobacterium longum |
| Ichinohe et al.[8] | Чувствительный к неомицину Lactobacillus или LPS на слизистой оболочке стимулируют Т-клеточный иммунитет к гриппу |
| Abt et al. [9] | Мыши, получавшие антибиотики, демонстрируют более тяжелые системные LCM и инфекции слизистых оболочек гриппа из-за нарушения врожденного и адаптивного иммунитета |
Lantier et al. [12] [12] | Микробиота кишечника обеспечивает необходимую передачу сигналов Toll-подобного рецептора-5 для поли (I: C) инфекции у мышей Cryptosporidium |
| Isolauri et al.[10] | Lactobacillus casei GG усиливает ответы IgM и IgA на вакцину против резус-ротавируса у младенцев. |
| Preidis et al. [11] | Lactobacillus reuteri уменьшает ротавирусную диарею у мышей |
| Sartor [13] | Fecalibacterium prausnitzii может улучшить контроль Treg IBD |
| Atarashi et al. [15] | Commensal Clostridium sp. индуцирует Treg-клетки |
| Kriegel et al.[17] | SFB увеличивают CD4-клетки Th27, защищая от диабета на мышиных моделях |
| Pons et al. [22], Mathers et al. [23] | Комменсалы накапливают дополнительные гены устойчивости к антибиотикам |
Ley et al. [25], Smith et al. [26] [26] | Микробиота квашиоркора вызывает потерю веса у мышей; микробиота, не относящаяся к квашиоркору, вызывает увеличение веса |
| Wang et al. [27] | Микробиота определяет выработку холина и сердечно-сосудистые заболевания из пищевого фосфатидилхолина |
| Mazmanian et al.[29] | Bacteroides fragilis полисахарид-A снижает провоспалительный IL14 через IL10 у мышей H. hepatica колит |
Доказательства, свидетельствующие о том, что резидентная микробиота может быть плохой или хорошей
| Ссылка . | Сообщение . |
|---|---|
| Плохо: Примеры доказательств того, что резидентная микробиота может быть вредной и что антибиотики могут помочь | |
| Uchiyama et al.[1] | Антибиотики защищают ротавирусную инфекцию мышей и усиливают вирус-специфические IgA-ответы |
Kuss et al..gif) [2] [2] | Нормальная флора ( Bacillus cereus , ЛПС, пептидогликан или N-ацетилглюкозамин-полисахарид) способствует проникновению полиомиелита и реовируса |
| Rossignol et al. [4] | Нитазоксанид улучшает исходы при ротавирусной инфекции |
| Hayes et al. [7] | Микробиота кишечника усиливает Trichuris muris вылупление яиц и инфицирование; Энофлоксацин-чувствительная флора ( Escherichia coli , Staphylococcus aureus , Salmonella typhimurium , Pseudomonas aeruginosa или маннозочувствительные фибрии 1-го типа) усиливают T.muris яйцеклетка |
| Иванов и др. [16], Ли и др. [18], Wu et al. [19] | SFB увеличивают провоспалительные клетки CD4 Th27 и ухудшают аутоиммунную ВЗК, артрит и рассеянный склероз |
| Woo et al. [20] | Антибиотики улучшают ответ на вакцину Ty21a |
| Хорошо: Примеры полезной местной микробиоты или антибиотиков, повышающих риск | |
| Grandy et al. [6] | Sacchyromyces boulardii снижает продолжительность диареи и лихорадки при острой ротавирусной инфекции; польза уменьшается при сочетании с Lactobacillus acidophilus , Lactobacillus rhamnosus и Bifidobacterium longum |
| Ichinohe et al.[8] | Чувствительный к неомицину Lactobacillus или LPS на слизистой оболочке стимулируют Т-клеточный иммунитет к гриппу |
| Abt et al. [9] | Мыши, получавшие антибиотики, демонстрируют более тяжелые системные LCM и инфекции слизистых оболочек гриппа из-за нарушения врожденного и адаптивного иммунитета |
| Lantier et al. [12] | Микробиота кишечника обеспечивает необходимую передачу сигналов Toll-подобного рецептора-5 для поли (I: C) инфекции у мышей Cryptosporidium |
| Isolauri et al.[10] | Lactobacillus casei GG усиливает ответы IgM и IgA на вакцину против резус-ротавируса у младенцев. |
| Preidis et al. [11] | Lactobacillus reuteri уменьшает ротавирусную диарею у мышей |
| Sartor [13] | Fecalibacterium prausnitzii может улучшить контроль Treg IBD |
| Atarashi et al. [15] | Commensal Clostridium sp. индуцирует Treg-клетки |
| Kriegel et al.[17] | SFB увеличивают CD4-клетки Th27, защищая от диабета на мышиных моделях |
| Pons et al. [22], Mathers et al. [23] | Комменсалы накапливают дополнительные гены устойчивости к антибиотикам |
| Ley et al. [25], Smith et al. [26] | Микробиота квашиоркора вызывает потерю веса у мышей; микробиота, не относящаяся к квашиоркору, вызывает увеличение веса |
| Wang et al. [27] | Микробиота определяет выработку холина и сердечно-сосудистые заболевания из пищевого фосфатидилхолина |
| Mazmanian et al.[29] | Bacteroides fragilis полисахарид-A снижает провоспалительный IL14 через IL10 у мышей H. hepatica колит |
| Ссылка . | Сообщение . |
|---|---|
| Плохо: Примеры доказательств того, что резидентная микробиота может быть вредной и что антибиотики могут помочь | |
| Uchiyama et al. [1] | Антибиотики защищают ротавирусную инфекцию мышей и усиливают вирус-специфические IgA-ответы |
| Kuss et al.[2] | Нормальная флора ( Bacillus cereus , ЛПС, пептидогликан или N-ацетилглюкозамин-полисахарид) способствует проникновению полиомиелита и реовируса |
| Rossignol et al. [4] | Нитазоксанид улучшает исходы при ротавирусной инфекции |
| Hayes et al. [7] | Микробиота кишечника усиливает Trichuris muris вылупление яиц и инфицирование; Энофлоксацин-чувствительная флора ( Escherichia coli , Staphylococcus aureus , Salmonella typhimurium , Pseudomonas aeruginosa или маннозочувствительные фибрии 1-го типа) усиливают T.muris яйцеклетка |
| Иванов и др. [16], Ли и др. [18], Wu et al. [19] | SFB увеличивают провоспалительные клетки CD4 Th27 и ухудшают аутоиммунную ВЗК, артрит и рассеянный склероз |
| Woo et al. [20] | Антибиотики улучшают ответ на вакцину Ty21a |
| Хорошо: Примеры полезной местной микробиоты или антибиотиков, повышающих риск | |
| Grandy et al. [6] | Sacchyromyces boulardii снижает продолжительность диареи и лихорадки при острой ротавирусной инфекции; польза уменьшается при сочетании с Lactobacillus acidophilus , Lactobacillus rhamnosus и Bifidobacterium longum |
| Ichinohe et al.[8] | Чувствительный к неомицину Lactobacillus или LPS на слизистой оболочке стимулируют Т-клеточный иммунитет к гриппу |
| Abt et al. [9] | Мыши, получавшие антибиотики, демонстрируют более тяжелые системные LCM и инфекции слизистых оболочек гриппа из-за нарушения врожденного и адаптивного иммунитета |
| Lantier et al. [12] | Микробиота кишечника обеспечивает необходимую передачу сигналов Toll-подобного рецептора-5 для поли (I: C) инфекции у мышей Cryptosporidium |
| Isolauri et al.[10] | Lactobacillus casei GG усиливает ответы IgM и IgA на вакцину против резус-ротавируса у младенцев. |
| Preidis et al. [11] | Lactobacillus reuteri уменьшает ротавирусную диарею у мышей |
| Sartor [13] | Fecalibacterium prausnitzii может улучшить контроль Treg IBD |
| Atarashi et al. [15] | Commensal Clostridium sp. индуцирует Treg-клетки |
| Kriegel et al.[17] | SFB увеличивают CD4-клетки Th27, защищая от диабета на мышиных моделях |
| Pons et al. [22], Mathers et al. [23] | Комменсалы накапливают дополнительные гены устойчивости к антибиотикам |
| Ley et al. [25], Smith et al. [26] | Микробиота квашиоркора вызывает потерю веса у мышей; микробиота, не относящаяся к квашиоркору, вызывает увеличение веса |
| Wang et al. [27] | Микробиота определяет выработку холина и сердечно-сосудистые заболевания из пищевого фосфатидилхолина |
| Mazmanian et al.[29] | Bacteroides fragilis полисахарид-A снижает провоспалительный IL14 через IL10 у мышей H. hepatica колит |
Да, , мы должны серьезно относиться к необходимости лучше понять и, надеюсь, использовать с пользой эффекты наблюдается с разной резидентной микробиотой и разными ответами патогенов. Но нет , мы , а не готовы начать широкую противомикробную атаку на нашу комменсальную флору, поскольку на карту поставлены безвозвратные и потенциально опасные для жизни изменения в экологии «жизни на людях».
Банкноты
Финансовая поддержка. Эта работа была поддержана Национальными институтами здравоохранения (NIH) через грант на обучение инфекционным заболеваниям Университета Вирджинии (грант NIH 5T32AI007046-37) для L. B.
Возможный конфликт интересов. Все авторы: о конфликтах не сообщалось.
Все авторы подали форму ICMJE для раскрытия информации о потенциальных конфликтах интересов. Выявлены конфликты, которые редакция считает относящимися к содержанию рукописи.
Список литературы
1Uchiyama
R
,Chassaing
B
,Zhang
B
,Gerwertz
AT
.Лечение антибиотиками подавляет ротавирусную инфекцию и повышает специфический гуморальный иммунитет
,J Infect Dis
,2014
, vol.210
(стр.171
—82
) 2Кусс
SK
,Best
GT
,Etheredge
CA
и др.Кишечная микробиота способствует репликации кишечных вирусов и системному патогенезу
,Science
,2011
, vol.334
(стр.249
—52
) 3LaFrazia
S
,Ciucci
A
,Arnoldi
F
и др.Тиазолиды, новый класс противовирусных агентов, эффективных против ротавирусной инфекции, нацелены на морфогенез вирусов, ингибируют образование вироплазмы
,J Virol
,2013
, vol.87
(стр.11096
—106
) 4Rossignol
JF
,Abu-Zekry
M
,Hussein
A
,Santoro
Эффект нитазоксанида для лечения тяжелой ротавирусной диареи: рандомизированное двойное слепое плацебо-контролируемое исследование
,Lancet
,2006
, vol.368
(стр.124
—9
) 5Teran
CG
,Teran-Escalera
CN
,Villarroel
P
.Нитазоксанди в сравнении с пробиотиками для лечения острой ротавирусной диареи у детей: рандомизированное, слепое, контролируемое испытание на боливийских детях
,Int J Inf Dis
,2009
, vol.13
(стр.518
—23
) 6Гранди
G
,Медина
M
,Soria
R
,Teran
CG
M
,CG
M
Пробиотики в лечении острой ротавирусной диареи.Рандомизированное двойное слепое контролируемое испытание с использованием двух различных пробиотических препаратов на боливийских детях
,BMC Infect Dis
,2010
, vol.10
стр.253
7Hayes
KS
,Bancroft
AJ
,Goldrick
M
,Portsmouth
C
,Roberts
IS
cЭксплуатация кишечной микробиоты паразитарными нематодами Trichuris muris
,Science
,2010
, vol.328
(стр.1391
—4
) 8Ichinohe
T
,Pang
IK
,Kumamoto
Y
и др.Микробиота регулирует иммунную защиту от респираторной инфекции вируса гриппа A
,Proc Natl Acad Sci U S A
,2011
, vol.108
(стр.5354
—9
) 9Abt
MC
,Osborne
LC
,Monticelli
LA
и др.Комменсальные бактерии калибруют порог активации врожденного противовирусного иммунитета
,Иммунитет
,2012
, т.37
(стр.158
—70
) 10Lantier
L
,Drouet
F
,Guesdon
W
и др.Poly (I: C) -индуцированная защита новорожденных мышей от кишечной инфекции Cryptosporidium parvum требует дополнительного сигнала TLR5, обеспечиваемого флорой кишечника
,J Infect Dis
,2014
, vol.209
(стр.457
—67
) 11Исолаури
E
,Йоэнсуу
J
,Суомалайнен
H
,M Luomala
M Luomala
Повышенная иммуногенность пероральной реассортантной ротавирусной вакцины DxRRV с помощью Lactobacillus casei GG
,Vaccine
,1995
, vol.13
(стр.310
—12
) 12Preidis
GA
,Saulnier
DM
,Blutt
SE
и др.Ответ хозяина на пробиотики определяется статусом питания инфицированных ротавирусом новорожденных мышей
,J Pediatr Gastroenterol Nutr
,2012
, vol.55
(стр.299
—307
) 13Sartor
RB
.Лечебные манипуляции с кишечной микробиотой при воспалительных заболеваниях кишечника: антибиотики, пробиотики и пребиотики
,Гастроэнтерол
,2004
, vol.126
(стр.1620
—33
) 14Li
E
,Hamm
CM
,Gulati
AS
и др.Фенотип воспалительных заболеваний кишечника, C. difficile и генотип NOD2 связаны со сдвигами в микробном составе подвздошной кишки человека
,PLoS One
,2012
, vol.7
стр.e26284
15Atarashi
K
,Tanoue
T
,Shima
T
и др.Индукция регуляторных Т-клеток толстой кишки аборигенными видами Clostridium
,Science
,2011
, vol.331
(стр.337
—41
) 16Иванов
II
,Атараши
K
,Манель
N
и др.Индукция кишечных клеток Th27 сегментированными нитчатыми бактериями
,Cell
,2009
, vol.139
(стр.485
—98
) 17Kriegel
MA
,Sefik
E
,Hill
JA
,Wu
oist,oist,oМатис
D
.Естественно передающиеся сегментированные нитчатые бактерии разделяются с защитой от диабета у мышей без ожирения
,Proc Natl Acad Sci U S A
,2011
, vol.108
(стр.11548
—53
) 18Lee
YK
,Menezes
JS
,Umesaki
Y
,Mazmanian
SK
.Реакция провоспалительных Т-клеток на кишечную микробиоту способствует экспериментальному аутоиммунному энцефаломиелиту
,Proc Natl Acad Sci U S A
,2011
, vol.108
Дополнение 1
(стр.4615
—22
) 19Wu
HJ
,Иванов
II
,Darce
J
и др.Проживающие в кишечнике сегментированные нитчатые бактерии вызывают аутоиммунный артрит через Т-хелперные 17 клеток
,Иммунитет
,2010
, vol.32
(стр.815
—27
) 20Woo
PY
,Tsoi
HW
,Wong
LP
,Leung
HC
en,Антибиотики модулируют индуцированный вакциной гуморальный иммунный ответ
,Clin Diagn Lab Immunol
,1999
, vol.6
(стр.832
—7
) 21Surana
NJ
,Kasper
DL
.инь янь бактериальных полисахаридов: уроки, извлеченные из B. fragilis PSA
,Immunol Rev
,2012
, vol.245
(стр.13
—26
) 22Pons
MJ
,Mosquito
S
,Gomes
C
,Del Valle
OJ2 ,Руис
Дж
.Анализ устойчивости к хинолонам у комменсалов и диареи Изолятов Escherichia coli от младенцев в Лиме, Перу
,Trans R Soc Trop Med Hyg
,2014
, vol.108
(стр.22
—8
) 23Mathers
AJ
,Guerrant
RL
.Раскрытие эволюционной скрытности нашей флоры против антибиотиков
,Trans R Soc Trop Med Hyg
,2014
, vol.108
(стр.121
—2
) 24Ng
KM
,Ferreyra
JA
,Higginbottom
SK
и др.Высвобожденные микробиотой сахара хозяина способствуют распространению кишечных патогенов после приема антибиотиков
,Nature
,2013
, vol.502
(стр.96
—9
) 25Ley
RE
,Turnbaugh
PJ
,Klein
S
,Gordon
JI
JI
Микробная экология: кишечные микробы человека, связанные с ожирением
,Nature
,2006
, vol.444
(стр.1022
—3
) 26Smith
MI
,Yatsunenko
T
,Manary
MJ
и др.Микробиомы кишечника малавийских пар близнецов, дискордантные по квашиоркору
,Science
,2013
, vol.339
(стр.548
—54
) 27Ван
Z
,Клипфелл
E
,Беннет
BJ
и др.Метаболизм фосфатидилхолина в кишечной флоре способствует сердечно-сосудистым заболеваниям
,Nature
,2011
, vol.472
(стр.57
—63
) 28Тан
WH
,Ван
Z
,Левисон
BS
и др.Кишечный микробный метаболизм фосфатидилхолина и сердечно-сосудистый риск
,N Engl J Med
,2013
, vol.368
(стр.1575
—84
) 29Mazmanian
SK
,Round
JL
,Kasper
DL
.Фактор микробного симбиоза предотвращает воспалительные заболевания кишечника
,Nature
,2008
, vol.453
(стр.620
—5
) © Автор, 2014. Опубликовано Oxford University Press от имени Общества инфекционистов Америки. Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected].Оценка ингибирующего действия экстрактов съедобных растений против ротавирусной инфекции | Журнал вирусологии
Tate JE, Burton AH, Boschi-Pinto C, Steele AD, Duque J, Parashar UD: Оценка смертности детей младше 5 лет от ротавируса во всем мире за 2008 г. до введения программ всеобщей ротавирусной вакцинации: систематический обзор и мета анализ. Lancet Infect Dis 2012, 12: 136-141. 10.1016 / S1473-3099 (11) 70253-5
PubMed Статья Google Scholar
Дэвидсон Г.П., Уайт П.Б., Дэниэлс Э., Франклин К., Нунан Х., МакКлауд П.И., Мур А.Г., Мур Д.Д.: Пассивная иммунизация детей бычьим молозивом, содержащим антитела к ротавирусу человека. Lancet 1989, 2: 709-712.
PubMed CAS Статья Google Scholar
Книппинг К., МакНил М.М., Криенен А., ван Амеронген Дж., Гарссен Дж., Ван’т Лэнд В: Модель на мышах с желудочно-кишечной ротавирусной инфекцией для исследований иммуномодуляции. Virol J 2011, 8: 8-8. 10.1186 / 1743-422X-8-8
Артикул Google Scholar
Murphy TV, Gargiullo PM, Massoudi MS, Nelson DB, Jumaan AO, Okoro CA, Zanardi LR, Setia S, Fair E, LeBaron CW, и др. .: Инвагинация у младенцев, получивших пероральную ротавирусную вакцину. N Engl J Med 2001, 344: 564-572. 10.1056 / NEJM200102223440804
PubMed CAS Статья Google Scholar
Tu HA, Woerdenbag HJ, Kane S, Rozenbaum MH, Li SC, Postma MJ: Экономические оценки ротавирусной иммунизации в развивающихся странах: обзор литературы. Expert Rev Vaccines 2011, 10: 1037-1051. 10.1586 / erv.11.65
PubMed Статья Google Scholar
Гу И, Гу Q, Кодама Х, Мюллер В.Е., Ушидзима Х: Разработка антиротавирусных агентов в Азии. Pediatr Int 2000, 42: 440-447. 10.1046 / j.1442-200x.2000.01248.x
PubMed CAS Статья Google Scholar
Раббани Г.Х., Тека Т., Заман Б., Маджид Н., Хатун М., Фукс Г.Дж.: Клинические исследования стойкой диареи: управление питанием с использованием зеленого банана или пектина у детей Бангладеш. Гастроэнтерология 2001, 121: 554-560. 10.1053 / gast.2001.27178
PubMed CAS Статья Google Scholar
Субботина М.Д., Тимченко В.Н., Воробьев М.М., Конунова Ю.С., Александровых Ю.С., Шушунов S: Влияние перорального приема экстракта корня торментилл (Potentilla tormentilla) на ротавирусную диарею у детей: рандомизированное, двойное слепое, контролируемое пробный. Pediatr Infect Dis J 2003, 22: 706-711. 10.1097 / 01.inf.0000078355.29647.d0
PubMed Статья Google Scholar
Vanderhoof JA, Murray ND, Paule CL, Ostrom KM: Использование соевых волокон при острой диарее у младенцев и детей ясельного возраста. Clin Pediatr (Phila) 1997, 36: 135-139. 10.1177 / 0009
703600303
CAS Статья Google Scholar
Там К.И., Ронер MR: Характеристика in vivo антиротавирусной активности экстрактов сапонинов из Quillaja saponaria Molina. Antiviral Res 2011, 90: 231-241. 10.1016 / j.antiviral.2011.04.004
PubMed CAS PubMed Central Статья Google Scholar
Кларк К.Дж., Грант П.Г., Сарр А.Б., Белакер Дж.Р., Сваггерти К.Л., Филлипс Т.Д., Вуд GN: Исследование теафлавинов, экстрагированных из черного чая, для нейтрализации ротавирусной инфекции крупного рогатого скота и коронавируса крупного рогатого скота. Vet Microbiol 1998, 63: 147-157. 10.1016 / S0378-1135 (98) 00242-9
PubMed CAS Статья Google Scholar
Андрес А., Донован С.М., Kuhlenschmidt TB, Kuhlenschmidt MS: Изофлавоны в концентрациях, присутствующих в соевой детской смеси, ингибируют ротавирусную инфекцию in vitro. J Nutr 2007, 137: 2068-2073.
PubMed CAS Google Scholar
Такахаши К., Мацуда М., Охаши К., Танигучи К., Накагоми О., Абэ Й., Мори С., Сато Н., Окутани К., Шигета С. Анализ антиротавирусной активности экстракта из Stevia rebaudiana. Antiviral Res 2001, 49: 15-24. 10.1016 / S0166-3542 (00) 00134-0
PubMed CAS Статья Google Scholar
Lipson SM, Sethi L, Cohen P, Gordon RE, Tan IP, Burdowski A, Stotzky G: Противовирусное действие клюквенного сока на бактериофаги и ротавирус. Фитомедицина 2007, 14: 23-30.
PubMed CAS Статья Google Scholar
Guerrero CA, Zarate S, Corkidi G, Lopez S, Arias CF: Биохимическая характеристика рецепторов ротавируса в клетках MA104. J Virol 2000, 74: 9362-9371. 10.1128 / JVI.74.20.9362-9371.2000
PubMed CAS PubMed Central Статья Google Scholar
Almeida JD, Hall T, Banatvala JE, Totterdell BM, Chrystie IL: Влияние трипсина на рост ротавируса. J Gen Virol 1978, 40: 213-218. 10.1099 / 0022-1317-40-1-213
PubMed CAS Статья Google Scholar
Arias CF, Romero P, Alvarez V, Lopez S: Путь активации трипсином инфекционности ротавируса. J Virol 1996, 70: 5832-5839.
PubMed CAS PubMed Central Google Scholar
Crawford SE, Mukherjee SK, Estes MK, Lawton JA, Shaw AL, Ramig RF, Prasad BV: Расщепление трипсином стабилизирует шип ротавируса VP4. J Virol 2001, 75: 6052-6061. 10.1128 / JVI.75.13.6052-6061.2001
PubMed CAS PubMed Central Статья Google Scholar
Идальго И.Дж., Рауб Т.Дж., Борчардт RT: Характеристика линии клеток карциномы толстой кишки человека (Caco-2) в качестве модельной системы для проницаемости кишечного эпителия. Гастроэнтерология 1989, 96: 736-749.
PubMed CAS Google Scholar
Дикман К.Г., Хемпсон С.Дж., Андерсон Дж., Липпе С., Чжао Л., Буракофф Р., Шоу RD: Ротавирус изменяет параклеточную проницаемость и энергетический метаболизм в клетках Caco-2. Am J Physiol Gastrointest Liver Physiol 2000, 279: G757-766.
PubMed CAS Google Scholar
Reed LJ, Muench H: Простой метод оценки пятидесятипроцентных конечных точек. Am J Hyg 1938, 27: 493-497.
Google Scholar
Георгиу Н.А., Гарссен Дж., Виткамп РФ: Интерфейс между фармацевтикой и питанием: разрыв сокращается. Eur J Pharmacol 2011, 651: 1-8. 10.1016 / j.ejphar.2010.11.007
PubMed CAS Статья Google Scholar
Kashiwada Y, Aoshima A, Ikeshiro Y, Chen YP, Furukawa H, Itoigawa M, Fujioka T., Mihashi K, Cosentino LM, Morris-Natschke SL, Lee KH: Бензилизохинолиновые алкалоиды против ВИЧ и флаволиновые алкалоиды листья Nelumbo nucifera и взаимосвязь между структурой и активностью с родственными алкалоидами. Bioorg Med Chem 2005, 13: 443-448. 10.1016 / j.bmc.2004.10.020
PubMed CAS Статья Google Scholar
Kuo YC, Lin YL, Liu CP, Tsai WJ: Размножение вируса простого герпеса типа 1 в клетках HeLa прервано Nelumbo nucifera. J Biomed Sci 2005, 12: 1021-1034. 10.1007 / s11373-005-9001-6
PubMed Статья Google Scholar
Uncini Manganelli RE, Zaccaro L, Tomei PE: Противовирусная активность in vitro Urtica dioica L., Parietaria diffusa M. et K. и Sambucus nigra L. J Ethnopharmacol 2005, 98: 323-327. 10.1016 / j.jep.2005.01.021
PubMed CAS Статья Google Scholar
Balzarini J, Neyts J, Schols D, Hosoya M, Van Damme E, Peumans W., De Clercq E: Маннозоспецифические растительные лектины из гибрида Cymbidium и Helleborine Epipactis и (N-ацетилглюкозамин) n -специфический растительный лектин из Urtica dioica — мощные и селективные ингибиторы вируса иммунодефицита человека и репликации цитомегаловируса in vitro. Antiviral Res 1992, 18: 191-207. 10.1016 / 0166-3542 (92) -7
PubMed CAS Статья Google Scholar
Kwon HJ, Kim HH, Ryu YB, Kim JH, Jeong HJ, Lee SW, Chang JS, Cho KO, Rho MC, Park SJ, Lee WS: Антиротавирусная активность выделенных полифенольных соединений in vitro от корней Glycyrrhiza uralensis. Bioorg Med Chem 2010, 18: 7668-7674.10.1016 / j.bmc.2010.07.073
PubMed CAS Статья Google Scholar
Fiore C, Eisenhut M, Krausse R, Ragazzi E, Pellati D, Armanini D, Bielenberg J: Противовирусные эффекты видов Glycyrrhiza. Phytother Res 2008, 22: 141-148. 10.1002 / ptr.2295
PubMed CAS Статья Google Scholar
Pompei R, Flore O, Marccialis MA, Pani A, Loddo B: Глицирризиновая кислота подавляет рост вируса и инактивирует вирусные частицы. Природа 1979, 281: 689-690. 10.1038 / 281689a0
PubMed CAS Статья Google Scholar
Badam L: In vitro противовирусная активность местного глицирризина, солодки и глицирризиновой кислоты (Sigma) на вирус японского энцефалита. J Commun Dis 1997, 29: 91-99.
PubMed CAS Google Scholar
Micol V, Caturla N, Perez-Fons L, Mas V, Perez L, Estepa A: Экстракт оливковых листьев проявляет противовирусную активность против вирусного геморрагического сепсиса рабдовируса (VHSV). Antiviral Res 2005, 66: 129-136. 10.1016 / j.antiviral.2005.02.005
PubMed CAS Статья Google Scholar
Lin JC, Cherng JM, Hung MS, Baltina LA, Baltina L, Kondratenko R: Ингибирующие эффекты некоторых производных глицирризиновой кислоты против инфекции вируса Эпштейна-Барра: взаимосвязь структура-активность. Antiviral Res 2008, 79: 6-11. 10.1016 / j.antiviral.2008.01.160
PubMed CAS Статья Google Scholar
Chingwaru W, Majinda RT, Yeboah SO, Jackson JC, Kapewangolo PT, Kandawa-Schulz M, Cencic A: Tylosema esculentum (Marama) Экстракты клубней и бобов являются сильными противовирусными средствами против ротавирусной инфекции. Evid Based Complement Alternat Med 2011, 2011: 1-11.2011
Статья Google Scholar
Goncalves JL, Lopes RC, Oliveira DB, Costa SS, Miranda MM, Romanos MT, Santos NS, Wigg MD: Антиротавирусная активность in vitro некоторых лекарственных растений, используемых в Бразилии против диареи. J Ethnopharmacol 2005, 99: 403-407. 10.1016 / j.jep.2005.01.032
PubMed CAS Статья Google Scholar
Manach C, Williamson G, Morand C, Scalbert A, Remesy C: Биодоступность и биоэффективность полифенолов у людей. I. Обзор 97 исследований биодоступности. Am J Clin Nutr 2005, 81: 230S-242S.
PubMed CAS Google Scholar
Cho SY, Kim JS, Li H, Shim C, Linhardt RJ, Kim YS: Усиление параклеточного транспорта дисахарида гепарина через монослои клеток Caco-2. Arch Pharm Res 2002, 25: 86-92. 10.1007 / BF02975268
PubMed CAS Статья Google Scholar
Ротавирус | Воробей
Если ваш ребенок заболел, предложите ему небольшое количество жидкости. Если вы кормите грудью, позвольте ребенку кормить грудью.
Если ваш ребенок пьет смесь, предложите небольшое количество жидкости для пероральной регидратации или обычной смеси. Не разбавляйте детскую смесь.
Если ваш старший ребенок плохо себя чувствует, посоветуйте ему или ей отдохнуть.Предлагайте мягкую пищу без добавления сахара, например цельнозерновой хлеб или крекеры, нежирное мясо, йогурт, фрукты и овощи.
Также важно много жидкости, в том числе жидкость для пероральной регидратации. Избегайте газированных напитков, яблочного сока, молочных продуктов, кроме йогурта, и сладких продуктов, которые могут усугубить диарею.
Избегайте всего, что может вызвать раздражение желудка, включая сильно приправленные продукты, кофеин, алкоголь и никотин.
Запись на прием
Если вам или вашему ребенку необходимо обратиться к врачу, вы, скорее всего, сначала обратитесь к своему основному лечащему врачу.Если есть вопросы по поводу диагноза, врач может направить вас к гастроэнтерологу или инфекционисту.
Что вы можете сделать
Подготовка списка вопросов поможет вам максимально эффективно проводить время с врачом. Вот некоторые вопросы, которые вы можете задать своему врачу или лечащему врачу вашего ребенка:
- Какова вероятная причина этих симптомов? Есть ли другие возможные причины?
- Нужны ли тесты?
- Каков наилучший подход к лечению? Есть ли альтернативы?
- Есть ли необходимость принимать какие-либо лекарства?
- Как облегчить симптомы?
Чего ожидать от врача
Некоторые вопросы, которые может задать врач, включают:
- Когда появились симптомы?
- Симптомы носят постоянный характер или они приходят и уходят?
- Насколько серьезны симптомы?
- Кажется, что-нибудь улучшает симптомы?
- Что может ухудшить симптомы?
Что вы можете сделать тем временем
Пейте много жидкости.Придерживайтесь мягкой пищи, чтобы снизить нагрузку на пищеварительную систему. Если ваш ребенок болен, придерживайтесь того же подхода — предлагайте много жидкости и мягкую пищу.
Если вы кормите грудью или используете смесь, продолжайте кормить ребенка как обычно. Спросите у врача, уместно ли давать ребенку жидкость для пероральной регидратации.
Справочное руководство по ротавирусным заболеваниям — Drugs.com
На этой странице
Проверено с медицинской точки зрения Drugs.com. Последнее обновление 2 марта 2021 г.
Обзор
Ротавирус — очень заразный вирус, вызывающий диарею. Это самая распространенная причина диареи у младенцев и детей во всем мире, от которой ежегодно умирает более 215 000 человек. До разработки вакцины большинство детей в Соединенных Штатах было инфицировано этим вирусом хотя бы один раз в возрасте 5 лет.
Хотя ротавирусные инфекции неприятны, обычно вы можете лечить эту инфекцию дома дополнительными жидкостями, чтобы предотвратить обезвоживание. Иногда при сильном обезвоживании требуется внутривенное введение жидкости в больнице.Обезвоживание — серьезное осложнение ротавируса и основная причина детской смертности в развивающихся странах.
Очень важна хорошая гигиена, например, регулярное мытье рук. Но вакцинация — лучший способ предотвратить ротавирусную инфекцию.
Симптомы
Ротавирусная инфекция обычно начинается в течение двух дней после заражения вирусом. Первоначальные симптомы — лихорадка и рвота, за которыми следует водянистая диарея от трех до восьми дней. Инфекция также может вызвать боль в животе.
У здоровых в остальном взрослых ротавирусная инфекция может вызывать только легкие признаки и симптомы или не вызывать их вовсе.
Когда обращаться к врачу
Позвоните своему ребенку, если ваш ребенок:
- Диарея более 24 часов
- Частые приступы рвоты
- Стул черный или дегтеобразный либо стул, содержащий кровь или гной
- Имеет температуру 104 F (40 C) или выше
- Вялость, раздражительность или боль
- Имеет признаки или симптомы обезвоживания, включая сухость во рту, плач без слез, слабое мочеиспускание или его отсутствие, необычную сонливость или отсутствие реакции.
Если вы взрослый, позвоните своему врачу, если вы:
- Не может удерживать жидкость в течение 24 часов
- Диарея более двух дней
- Кровь в рвоте или дефекации
- Иметь температуру выше 103 F (39.4 С)
- Есть признаки или симптомы обезвоживания, включая чрезмерную жажду, сухость во рту, небольшое или полное отсутствие мочеиспускания, сильную слабость, головокружение при стоянии или дурноту.
Причины
Ротавирус присутствует в кале инфицированного человека за несколько дней до появления симптомов и в течение 10 дней после их исчезновения. Вирус легко распространяется через контакт из рук в рот в течение всего этого времени, даже если у инфицированного человека нет симптомов.
Если у вас ротавирус, и вы не моете руки после посещения туалета — или у вашего ребенка есть ротавирус, и вы не моете руки после смены подгузника или помощи ребенку в туалет — вирус может распространиться на что угодно вы прикасаетесь, в том числе к еде, игрушкам и посуде.Если другой человек коснется ваших немытых рук или зараженного предмета, а затем коснется своего рта, может последовать инфекция. Вирус может оставаться заразным на поверхности в течение нескольких недель или дольше, если эта область не продезинфицирована.
Поскольку существует много типов ротавирусов, можно заразиться более одного раза, даже если вы были вакцинированы. Однако повторные инфекции обычно менее серьезны.
Факторы риска
Ротавирусные инфекции часто встречаются у детей в возрасте от 3 до 35 месяцев, особенно у тех, кто проводит время в детских учреждениях.Пожилые люди и взрослые, ухаживающие за маленькими детьми, также имеют повышенный риск заражения.
В США риск ротавируса наиболее высок зимой и весной.
Осложнения
Сильная диарея может привести к обезвоживанию, особенно у маленьких детей. При отсутствии лечения обезвоживание может стать опасным для жизни состоянием независимо от его причины.
Профилактика
Чтобы уменьшить распространение ротавируса, тщательно и часто мойте руки, особенно после посещения туалета, смены подгузника у ребенка или помощи ребенку в пользовании туалетом.Но даже строгая ручная стирка не дает никаких гарантий.
Для предотвращения ротавирусной инфекции доступны две вакцины:
- RotaTeq. Эта вакцина вводится перорально в трех дозах, часто в возрасте 2, 4 и 6 месяцев. Вакцина не одобрена для использования у детей старшего возраста и взрослых.
- Rotarix. Эта вакцина представляет собой жидкость, вводимую двумя дозами младенцам в возрасте 2 и 4 месяцев.
Иногда часть кишечника может загибаться сама на себя (инвагинация).Это может вызвать опасную для жизни непроходимость кишечника. Инвагинация — очень редкий, но опасный для жизни побочный эффект ротавирусной вакцины. Дети, у которых ранее была инвагинация, с большей вероятностью заболеют ею после вакцинации против ротавируса. По этой причине Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) не рекомендует вводить ротавирусную вакцину детям с инвагинацией в анамнезе.
Для детей, у которых в анамнезе не было инвагинации кишечника, существует очень небольшой риск ее развития после введения ротавирусной вакцины.Даже в этом случае преимущества вакцины намного перевешивают риски. С тех пор, как стали доступны ротавирусные вакцины, исследования показали, что они предотвращают ежегодное заболевание и госпитализацию тысяч детей.
Если у вашего ребенка боли в животе, рвота, диарея, кровь в стуле или изменение дефекации после вакцинации против ротавируса, немедленно обратитесь к врачу.
Диагноз
Ротавирус часто диагностируется на основании симптомов и физического осмотра.Образец стула может быть проанализирован в лаборатории для подтверждения диагноза.
Лечение
Специального лечения ротавирусной инфекции не существует. Антибиотики и противовирусные препараты не помогут при ротавирусной инфекции. Обычно инфекция проходит в течение трех-семи дней.
Предотвращение обезвоживания — самая большая проблема. Чтобы предотвратить обезвоживание во время распространения вируса, пейте много жидкости. Если у вашего ребенка тяжелая диарея, спросите своего врача о предложении жидкости для пероральной регидратации, такой как Pedialyte или Enfalyte, особенно если диарея длится дольше нескольких дней.
Для детей жидкость для регидратации может заменить потерянные минералы более эффективно, чем вода или другие жидкости. Сильное обезвоживание может потребовать внутривенного введения жидкости в больнице.
Противодиарейные препараты не рекомендуются при ротавирусной инфекции.
Образ жизни и домашние средства
Если ваш ребенок заболел, предложите ему небольшое количество жидкости. Если вы кормите грудью, позвольте ребенку кормить грудью.
Если ваш ребенок пьет смесь, предложите небольшое количество жидкости для пероральной регидратации или обычной смеси.Не разбавляйте детскую смесь.
Если ваш старший ребенок плохо себя чувствует, посоветуйте ему или ей отдохнуть. Предлагайте мягкую пищу без добавления сахара, например цельнозерновой хлеб или крекеры, нежирное мясо, йогурт, фрукты и овощи.
Также важно много жидкости, в том числе жидкость для пероральной регидратации. Избегайте газированных напитков, яблочного сока, молочных продуктов, кроме йогурта, и сладких продуктов, которые могут усугубить диарею.
Избегайте всего, что может вызвать раздражение желудка, включая сильно приправленные продукты, кофеин, алкоголь и никотин.
Запись на прием
Если вам или вашему ребенку необходимо обратиться к врачу, вы, скорее всего, сначала обратитесь к своему основному лечащему врачу. Если есть вопросы по поводу диагноза, врач может направить вас к гастроэнтерологу или инфекционисту.
Что вы можете сделать
Подготовка списка вопросов поможет вам максимально эффективно проводить время с врачом. Вот некоторые вопросы, которые вы можете задать своему врачу или лечащему врачу вашего ребенка:
- Какова вероятная причина этих симптомов? Есть ли другие возможные причины?
- Нужны ли тесты?
- Каков наилучший подход к лечению? Есть ли альтернативы?
- Есть ли необходимость принимать какие-либо лекарства?
- Как облегчить симптомы?
Чего ожидать от врача
Некоторые вопросы, которые может задать врач, включают:
- Когда появились симптомы?
- Симптомы носят постоянный характер или они приходят и уходят?
- Насколько серьезны симптомы?
- Кажется, что-нибудь улучшает симптомы?
- Что может ухудшить симптомы?
Что вы можете сделать тем временем
Пейте много жидкости.Придерживайтесь мягкой пищи, чтобы снизить нагрузку на пищеварительную систему. Если ваш ребенок болен, придерживайтесь того же подхода — предлагайте много жидкости и мягкую пищу.
Если вы кормите грудью или используете смесь, продолжайте кормить ребенка как обычно. Спросите у врача, уместно ли давать ребенку жидкость для пероральной регидратации.
© 1998-2019 Фонд медицинского образования и исследований Майо (MFMER). Все права защищены. Условия эксплуатации.
Лечение и профилактика ротавирусной инфекции у детей
Оценка профиля безопасности ротавирусной вакцины после выдачи лицензии
Инвагинация
Современные ротавирусные вакцины не были связаны с инвагинацией в крупных предварительных испытаниях.В результате обширного постлицензионного надзора, проводимого после внедрения вакцин против RV5 и RV1, предположения о повышенном риске инвагинации при использовании нынешних ротавирусных вакцин поступили из Мексики и Австралии, хотя и с гораздо более низким относительным риском, чем при использовании более ранней вакцины RotaShield. Исследование, проведенное в Австралии, в котором использовались два активных метода эпиднадзора (отчеты больниц и педиатров) для выявления случаев инвагинации и связанных случаев с записями о вакцинации, предполагало почти пятикратное увеличение относительного риска инвагинации кишечника после первой дозы ротавирусной вакцины RV5, но не повышенного риска. инвагинации в целом [18 •].Второе исследование, проведенное в Мексике и Бразилии, обнаружило примерно пятикратное повышение риска инвагинации в первую неделю после первой дозы RV1 в Мексике, но не в Бразилии [19 •]. В обоих этих исследованиях доверительные интервалы для относительного риска были широкими, и поэтому остается неопределенность в отношении истинного риска инвагинации кишечника после вакцинации против ротавируса. Третье постлицензионное исследование с использованием проспективного активного эпиднадзора за инвагинацией среди детей младше 1 года было проведено в 221 больнице по всей Мексике и оценило любую потенциальную временную связь между вакцинацией и инвагинацией [20 •].Временное увеличение риска инвагинации было замечено в течение 7 дней после введения первой дозы вакцины. Был оценен относительный риск трех-четырех дополнительных случаев инвагинации на 100 000 вакцинированных младенцев.
Три недавно опубликованных исследования были проведены для изучения риска инвагинации после введения RV5 у младенцев в США. Первое исследование, когортное исследование младенцев в возрасте 4–34 недель, включенных в базу данных по безопасности вакцин, показало, что риск инвагинации кишечника у вакцинированных младенцев не был повышен по сравнению с младенцами, не получавшими ротавирусную вакцину [21].Второе исследование выявило и проследило за младенцами с заявлением о страховании здоровья на RV5 в течение первых 2 лет доступности RV5. Относительный риск инвагинации у 85 000 детей, получавших RV5, составил 0,8 (95% доверительный интервал: 0,22–3,52) по сравнению с контрольной группой [22]. В третьем исследовании младенцев в 26 штатах США, составляющих 75% когорты новорожденных, исследователи изучили возрастные тенденции в показателях госпитализации при инвагинации кишечника на популяционном уровне до (2000–2005 гг.) И после (2007–2009 гг.) Внедрения ротавирусной вакцины [23 • •].Среди младенцев в возрасте 8–11 недель по сравнению с 2000–2005 гг. (6,9 на 100 000) небольшое, значительное увеличение наблюдалось в 2007 г. (11,4 на 100 000), 2008 г. (12,2 на 100 000) и 2009 г. (11,0 на 100 000). 100000).
В исследовании, опубликованном в 2013 году, исследователи предположили, что риск аналогичен международному, и сравнили потенциальные случаи инвагинации, связанные с вакцинацией, с преимуществами профилактики ротавирусного гастроэнтерита с помощью полностью внедренной программы вакцинации против ротавируса в США [24 ••].Чтобы подсчитать количество случаев инвагинации, они использовали национальные данные об охвате вакцинацией и исходной частоте инвагинации и предположили, что относительный риск инвагинации, связанный с вакциной, в первую неделю после первой дозы вакцины составляет 5,3, риск, наблюдаемый в международных условиях. Они использовали данные об эффективности вакцины после получения лицензии для расчета предотвращенного бремени ротавирусной инфекции. Они обнаружили, что для когорты новорожденных в США из 4,3 миллиона младенцев инвагинация, связанная с вакцинацией, может вызвать избыток 0.2 (диапазон: 0,1–0,3) летальных исхода, 45 (диапазон: 21–86) случаев госпитализации и 13 (диапазон: 6–25) случаев лечения в условиях краткосрочного пребывания или отделения неотложной помощи. Вакцинация предотвратила бы 14 (95% ДИ: 10–19) смертей, связанных с ротавирусом, 53 444 (95% ДИ: 37 622–72 882) госпитализаций и 169 949 (95% ДИ: 118 161–238 630) обращений в отделения неотложной помощи. Авторы пришли к выводу, что если в США существует риск инвагинации, аналогичный международному, то он значительно превосходит бремя ротавирусной инфекции, предотвращаемое вакцинацией.
Дополнительные агенты
В марте 2010 года группа исследователей, использовавших методы «глубокого секвенирования», идентифицировала нуклеиновые кислоты из придаточного цирковируса свиней-1 (PCV-1) в RV1 [25]. PCV — это вирус, который обычно поражает свиней и был обнаружен в 5% образцов стула взрослых в США, вероятно, в результате диетического потребления продуктов из свинины. Считается, что PCV не вызывает инфекцию или заболевание среди людей. Впоследствии Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) временно приостановило использование RV1.Дальнейшее тестирование RV5 также выявило генетический материал PCV-1 и PCV-2 в этой вакцине. Было обнаружено, что PCV-1 из RV1 включает ассоциированные с частицами полноразмерные геномы, способные расти в клеточных линиях, в то время как PCV-1 и PCV-2 в RV5 были небольшими и неинфекционными фрагментами [26]. Вероятно, что материал PCV был введен в обе ротавирусные вакцины через трипсин свиного происхождения — реагент, используемый в процессе выращивания клеточных культур при производстве вакцины, — и что побочные вирусы присутствовали в обеих вакцинах при оценке во время их клинических испытаний.На основе имеющихся данных только о теоретическом риске заражения PCV среди людей и наблюдаемых преимуществах ротавирусных вакцин FDA отменило ограничение RV1 в мае 2010 года. вакцины вряд ли могут причинить вред человеку, и рекомендуется предоставить информацию по этой теме до вакцинации. В США переход на RV5 происходил в период, когда RV1 был приостановлен [27], но U.В конце концов, S. педиатры не считают обнаружение генетического материала PCV препятствием для предоставления любой из вакцин [28].
Эпиднадзор за ротавирусами в США
Ротавирусный гастроэнтерит не регистрируется в США, и тестирование на ротавирусную инфекцию нечасто проводится, когда ребенок обращается за медицинской помощью по поводу острого гастроэнтерита. Методы эпиднадзора за ротавирусной болезнью на национальном уровне включают обзор национальных баз данных о выписке из больниц на предмет специфических ротавирусных или ротавирусных диагнозов, эпиднадзор за ротавирусной болезнью в трех центрах, которые участвуют в Новой сети эпиднадзора за вакцинами, и отчеты об обнаружении ротавируса из дозорная система лабораторий.В недавнем исследовании использовалась основанная на Google доля интернет-запросов (IQS) для поисковых запросов ротавирусов, и было обнаружено, что она хорошо коррелировала с обнаружениями ротавирусов в лабораториях США с 2004 по 2010 год, отражая сокращение, наблюдавшееся в годы после вакцинации (2008–2010) [29 •] . Авторы пришли к выводу, что анализ IQS может стать недорогим и надежным дополнением к мониторингу воздействия вакцинации против ротавируса в Соединенных Штатах.
На уровне штата и на местном уровне для мониторинга воздействия программы вакцинации используются меры эпиднадзора в дозорных больницах или путем анализа баз данных о выписках из больниц.Специальные исследования, такие как исследования «случай – контроль» и ретроспективные когортные исследования, используются для измерения эффективности ротавирусной вакцины при рутинном использовании в Соединенных Штатах. CDC создал национальную систему эпиднадзора за штаммами дозорных лабораторий для мониторинга циркулирующих штаммов ротавируса до и после внедрения ротавирусной вакцины. Эта система предназначена для обнаружения новых или необычных штаммов, вызывающих гастроэнтерит, которые нельзя эффективно предотвратить с помощью вакцинации, что может повлиять на успех программы вакцинации.
Эффективность ротавирусной вакцинации в профилактике ротавирусных заболеваний
В отличие от исследований эффективности, которые проводятся в тщательно контролируемых условиях, исследования эффективности вакцин сравнивают риски исходов заболеваний у вакцинированных и невакцинированных групп населения в реальных условиях. С момента включения ротавирусных вакцин в национальную программу иммунизации в 2006 г. в США было проведено семь исследований по оценке эффективности RV5 [30–36]. Полная серия RV5 показала эффективность от 78% до 100% в предотвращении тяжелых ротавирусных заболеваний (госпитализации и / или посещения отделения неотложной помощи) и 96% в предотвращении амбулаторных посещений.Эти данные согласуются с данными об эффективности, полученными в клинических испытаниях RV5. Кроме того, никаких признаков ослабления иммунитета, вызванного вакциной, пока не наблюдалось в период постлицензирования ротавирусной вакцины [31, 37]. В США не проводилось исследований для оценки эффективности вакцины против RV1.
Влияние ротавирусной вакцинации на бремя ротавирусной болезни в США.
Исследования воздействия вакцины показали, что с тех пор бремя ротавирусной болезни значительно снизилось внедрение ротавирусных вакцин.В девяти исследованиях оценивали влияние вакцинации на использование ресурсов здравоохранения в Соединенных Штатах [38–40, 41 •, 42–46]. К ним относятся исследования с использованием национальных данных эпиднадзора, а также исследования, оценивающие влияние внедрения вакцин в конкретных регионах или больницах. В четырех исследованиях использовались данные проспективного эпиднадзора [40, 44–46]. Остальные исследования были основаны на ретроспективном анализе источников данных, которые включали истории болезни, данные лабораторных отчетов и базы данных страховых возмещений.Воздействие вакцинации на госпитализацию, связанную с ротавирусной инфекцией, было наиболее частым результатом. Оценка периодов до и после вакцинации показала, что вакцинация против ротавирусной инфекции значительно снизила бремя госпитализаций, связанных с ротавирусами; варьируется от 60% до 93%, в зависимости от охвата вакцинацией, возрастной группы и изучаемого сезона ротавируса.
В исследованиях также оценивалось влияние ротавирусной вакцинации на госпитализации, связанные с гастроэнтеритом или диареей, неотложные визиты и посещения амбулаторных больных / врачей.Снижение всех этих параметров было отмечено в США. Число госпитализаций, связанных с гастроэнтеритом или диареей, в США снизилось с 16% до 50%. Три исследования в США выявили значительное сокращение количества посещений отделений неотложной помощи и кабинетов после введения ротавирусной вакцины [ 32, 38, 41 •]. Дополнительное свидетельство воздействия вакцины на ротавирусный гастроэнтерит легкой степени получено в исследовании, опубликованном в 2012 г., в котором использовалась новая платформа эпиднадзора, состоящая из данных сортировки по телефону для выявления легкого гастроэнтерита, не обнаруженного в других системах эпиднадзора [47].Это исследование показало, что доля звонков, связанных с гастроэнтеритом, снизилась на 8% в период после лицензирования, а снижение в пределах от 23% до 31% произошло в течение исторического сезона ротавируса во все три периода после получения лицензии. В сезон без ротавируса снижения не наблюдалось.
Исследования, сравнивающие количество или пропорцию положительных результатов тестов на ротавирус до и после введения программы вакцинации против ротавируса, полезны для оценки воздействия вакцины. Дозорный лабораторный надзор Национальной системы надзора за респираторными и кишечными вирусами CDC продемонстрировал снижение количества или доли положительных результатов тестов на ротавирус в США.S. в течение первых двух сезонов после введения RV5 по сравнению с периодом предвакцинации с 1991 по 2006 год [48]. Такое сокращение продолжалось в течение сезона ротавируса 2009–2010 гг. [49 •].
Коллективный иммунитет после вакцинации против ротавируса
Коллективный иммунитет возникает в результате снижения передачи ротавируса в обществе и обеспечивает непрямую защиту непривитым людям. График вакцинации против ротавируса должен быть завершен к 32-недельному возрасту в U.S., а программы наверстывающей вакцинации детей старшего возраста не проводились. Следовательно, свидетельства, свидетельствующие о коллективном иммунитете после широкого использования ротавирусных вакцин, получены от детей старшего возраста, которые вряд ли были вакцинированы.
Коллективный иммунитет был отмечен после плановой вакцинации против ротавируса в США [35, 45, 50, 51 •]. Данные о поствакцинации в первые годы после внедрения ротавирусных вакцин показывают значительное сокращение ротавирусной болезни среди членов возрастных групп, которые были слишком старыми и / или слишком молодыми для вакцинации.Это важный вывод, поскольку коллективный иммунитет будет иметь важное значение в условиях развивающихся стран, где эффективность вакцины и охват вакцинами, как правило, ниже.
Изменение эпидемиологии и сезонности ротавирусной болезни после внедрения вакцины в США
Эпиднадзор и мониторинг болезни после внедрения вакцины могут предоставить информацию об изменениях в возрастной заболеваемости. Вакцины против ротавируса показали устойчивую эффективность в течение первых 2–3 лет жизни в США.С. и Европа [52–54].
В США после введения ротавирусной вакцины в сезон ротавируса произошли изменения. CDC сравнил начало, продолжительность и величину сезонов ротавируса 2007–2008, 2008–2009 и 2009–2010 годов со средними значениями за предыдущие 15 лет. В 2007–2008 гг. Начало было отложено на 2–4 месяца, продолжительность была сокращена на 12 недель (14 против 26 недель), а медиана была на 11 недель позже медианы начала в 2000–2006 гг. Сезон ротавируса был более продолжительным в 2008–2009 гг. По сравнению с активностью ротавируса 2007–2008 гг. [49 •].
До внедрения вакцины ротавирус имел предсказуемую сезонность зима-весна и географическую картину в США: активность начиналась на западе в декабре – январе, распространялась по всей стране и заканчивалась на северо-востоке в мае – июне [55 ]. Исследования, проведенные в США, показывают, что смещение начала эпидемии на 1-2 месяца произошло после вакцинации против ротавируса; в течение сезона ротавируса 2010 г. в США активность ротавируса была ниже эпидемического порога, чего никогда не было за предыдущие 19 лет эпиднадзора за ротавирусами [49 •].Кроме того, после вакцинации произошли впечатляющие изменения в пространственно-временном распространении ротавирусной болезни в США [56].
Влияние вакцинации на циркуляцию и возникновение ротавирусного штамма
Ротавирусные вакцины должны обеспечивать перекрестную защиту от нескольких серотипов ротавируса, поскольку циркулирующие штаммы различаются, и несколько штаммов могут циркулировать в одном регионе одновременно.
Штаммы ротавирусов определяются двумя поверхностными белками, VP7 (гликопротеин [G-белок]) и VP4 (протеазно-расщепленный белок [P-белок]), обнаруженными во внешнем капсиде вируса.Эти два белка определяют серотип вируса и являются мишенями для нейтрализующих антител, которые могут обеспечивать как гомотипическую, так и гетеротипическую защиту. Ротавирус способен к значительному генетическому разнообразию, потому что он имеет сегментированный геном, который может подвергаться перегруппировке генов. Способность вируса к мутации и реассортировке учитывает потенциал новых и появляющихся серотипов ротавирусов. Одна только перегруппировка теоретически может привести почти к 200 различным комбинациям G и P. По крайней мере, 12 G-типов и 15 P-типов были идентифицированы у людей.
Поскольку окончательные данные о том, что вакцины будут защищать от широкого спектра штаммов ротавирусов, все еще отсутствуют, и поскольку вакцины могут оказывать определенное давление отбора, подробная картина глобальной распространенности штаммов эпохи до создания ротавирусных вакцин важна для оценки любого потенциала. изменения в циркулирующих штаммах наблюдались после широкого внедрения ротавирусных вакцин. Исследование Banyai et al. систематический обзор исследований генотипирования ротавирусов за 12-летний период с 1996 по 2007 год [57 •].Всего было генотипировано ~ 110 000 штаммов из 100 стран, представивших отчеты. На пять генотипов (G1 – G4 и G9) приходилось 88% всех штаммов, хотя наблюдались обширные географические и временные различия. Например, распространенность штаммов G1 снизилась с 2000 года, в то время как штаммы G3 вновь появились, а штаммы G9 и G12 появились в тот же период. Когда общие данные о распространенности штаммов были взвешены по регионам на основе вклада региона в глобальную смертность от ротавирусов, важность штаммов генотипов G1 и G9, которые были более распространены в регионах с низкой смертностью, уменьшилась, и, наоборот, важность штаммов G8, которые были более распространены в африканских странах, что привело к увеличению глобальной смертности от ротавирусов.
RV1, который содержит только человеческий штамм G1P [8], отличается от штаммов G2P [4] по G- и P-типу и геногруппе. Хотя RV5 содержит антиген G или P для всех распространенных штаммов, серотип-специфические иммунные ответы варьировали от штамма с самым низким ответом против G3P [8] в основном клиническом исследовании [52]. Несмотря на возможность снижения эффективности, вакцины против RV5 и RV1 обеспечивали хорошую перекрестную защиту от распространенных циркулирующих штаммов в испытаниях в Европе и США [52, 58].В латиноамериканском исследовании RV1, по-видимому, обеспечивает меньшую защиту от полностью гетеротипных штаммов ротавируса G2P [4] (эффективность вакцины составляла 44%), но важно отметить, что штамм G2P [4] не циркулировал в Латинской Америке во время период исследования и, таким образом, исследование не имело возможности окончательно оценить защиту от этого штамма [58]. Однако в двухлетнем исследовании эффективности, проведенном в шести европейских странах, RV1 обеспечивал 85% защиту от тяжелого ротавирусного гастроэнтерита, вызванного штаммами G2P [4] [53].В недавно опубликованных испытаниях, проведенных в Азии и Африке, обе вакцины показали одинаковую эффективность против широкого спектра штаммов, циркулировавших в течение периода исследования [59, 60, 61 •].
Вакцины против RV5 и RV1 обеспечили хорошую перекрестную защиту от распространенных циркулирующих штаммов в постлицензионных исследованиях вакцин. В двух исследованиях эффективности вакцины, проведенных в Бразилии в течение 2 лет, когда преобладала циркуляция штамма G2P [4], эффективность RV1 варьировала от 75% до 81% против тяжелого ротавирусного заболевания, вызываемого этим штаммом в течение первого года жизни [62, 63] .В аналогичном исследовании случай – контроль, проведенном в Австралии, во время вспышки гастроэнтерита, связанного с G2P [4], среди коренного населения эффективность RV1 составила 86% [64]. Постлицензионное исследование, проведенное в Австралии, показало высокую эффективность RV5 против тяжелого заболевания, вызванного штаммами G3P [8] [65]. В исследовании случай-контроль, проведенном в Мексике, после появления нового штамма G9P [4] эффективность RV1 против тяжелого ротавирусного гастроэнтерита составила 94% [66], а в исследовании случай-контроль в Бразилии после появления штамма нового штамма G9P [8] эффективность RV1 против тяжелого ротавирусного гастроэнтерита составила 82% [67].
Три общенациональных продольных исследования по надзору за штаммами касались экологии штаммов до и после плановой вакцинации детей. Общенациональное преобладание штаммов G2P [4] было отмечено в Бразилии в первые 2 года после введения RV1 [68]. В США более высокая распространенность штаммов G3P [8] произошла в некоторых городах после введения RV5 [69]. В Австралии отдельные штаты использовали исключительно RV1 или RV5. Более высокая распространенность штаммов G2P [4] была отмечена в штатах, в которых использовался исключительно RV1, по сравнению с состояниями, использующими RV5, и в состояниях RV5 была более высокая распространенность штаммов G3P [8], чем в штатах, использующих RV1 [70].
Как исследования эффективности, так и данные клинических испытаний предполагают, что естественное изменение штамма, не связанное с вакцинацией, является наиболее вероятным объяснением наблюдаемых краткосрочных изменений после вакцинации. Тем не менее, математическое моделирование показало, что даже незначительные различия в эффективности вакцины против конкретных штаммов ротавируса могут привести к отбору штамма и что такие изменения могут проявиться через несколько лет [71]. Ключевым моментом является постоянный мониторинг с надежным продольным надзором и эпидемиологическими исследованиями для более точной оценки долгосрочного воздействия вакцинации против ротавируса на экологию штамма.Эти более долгосрочные исследования могут помочь оценить, приводит ли сохраняющийся высокий уровень иммунитета к серотипам вакцины в конечном итоге к эволюции штаммов, которые ускользают от иммунитета вакцины.
И последнее беспокойство вызывает способность ротавируса подвергаться повторной сортировке со штаммами дикого типа или штаммами вакцинного происхождения. Мало что известно о частоте, с которой происходит перегруппировка, или ее клиническом исходе. В отчете из Техаса за 2012 год описывается пятеро детей с ВОЗРАСТОМ, у которых в ходе планового эпиднадзора было обнаружено выделение штаммов вакцины против ротавируса и / или штаммов реассортанта вакцины [72].Вклад вакцины или реассортантного штамма вакцины в болезнь каждого пациента был неясен. Исследование 2012 г., проведенное в Австралии, предполагает, что выделение ротавирусной вакцины естественным образом происходит среди значительной части вакцинированных младенцев и что реассортантные события, приводящие к вакцино-ассоциированному AGE, могут быть более распространенными, чем предполагалось первоначально [73]. Ротавирусная вакцина RV5 и штаммы вакцинного происхождения активно выявлялись в образцах стула 13 из 61 (21,3%) младенца, страдающего диареей в течение 2 недель после вакцинации против ротавируса, и у 3 из 460 (0.7%) случаев острого гастроэнтерита, зарегистрированных в рамках Австралийской программы надзора за ротавирусами. Шесть (37,5%) из этих 16 образцов вируса вакцинного происхождения были связаны со штаммом G1P [8], который, как считается, является результатом генетической реассортации между двумя компонентными штаммами RV5. Хотя почти половина этих случаев, связанных с реассортантами, имела сопутствующие заболевания, такие как тяжелое комбинированное иммунодефицитное расстройство, необходимы дальнейшие исследования, чтобы понять взаимосвязь между выделением вирусов, реассортантами вирусов и основными заболеваниями.
Сети в странах, проводящих эпиднадзор за ротавирусами после внедрения вакцины, должны учитывать, что штаммы вакцины могут быть связаны с AGE и что эти штаммы вакцинного происхождения могут присутствовать в образцах эпиднадзора. Были описаны методы обнаружения RV5 [73]. RV1 потенциально намного труднее обнаружить, чем RV5, поскольку он происходит от штамма ротавируса человека и проявляет сходство последовательностей со штаммами ротавируса G1P [8] дикого типа. Способы секвенирования, такие как описанные Boom et al.может быть необходимо для дифференциации RV1 от ротавирусов дикого типа [72]. Для оценки частоты встречаемости и клинической значимости вакцинных штаммов и вакцин-реассортантных штаммов при симптоматических и бессимптомных детских ротавирусных инфекциях необходимо будет продолжить наблюдение.
Границы | Врожденный противовирусный иммунитет кишечника и иммунобиотики: положительные эффекты против ротавирусной инфекции
Введение
Одной из основных причин детской смертности являются предотвратимые инфекционные заболевания (1, 2).Ротавирус (RV), калицивирус, астровирус и аденовирус относятся к вирусным этиологическим агентам гастроэнтерита у человека (3, 4). RV, вирус с голой двухцепочечной РНК (дцРНК), является наиболее частой причиной тяжелой дегидратирующей диареи у детей (5, 6). Основными симптомами гастроэнтерита RV являются тошнота, субфебрильная температура, рвота и острая водянистая диарея. Несмотря на то, что две пероральные вакцины, содержащие ослабленные живые вирусы, используются во всем мире, Rotarix (GlaxoSmithKline) и RotaTeq (Merck), эпидемия в развивающихся странах еще далека от контроля (6, 7).Эффективность вакцины снижается в развивающихся регионах, и некоторые возможные причины — это дети, инфицированные в раннем возрасте, высокая вирусная нагрузка и отсутствие переданных материнских антител (8, 9).
Некоторые штаммы молочнокислых бактерий (LAB) способны влиять на здоровье человека и животных, модулируя слизистую оболочку и системную иммунную систему. Эти иммунорегулирующие пробиотические LAB, известные как иммунобиотики, обеспечивают защиту от вирусных инфекций, модулируя врожденный и адаптивный противовирусный иммунитет.Таким образом, несколько сообщений показали, что иммунобиотические LAB сокращают продолжительность диареи, уменьшают количество эпизодов, уменьшают выделение RV, нормализуют проницаемость кишечника и увеличивают продукцию антител, специфичных для RV (10–12).
Цель этого обзора — предоставить обновленную информацию о текущем состоянии модуляции кишечного противовирусного врожденного иммунитета иммунобиотиками и их благотворном влиянии на инфекцию RV. Мы также выделяем некоторые результаты нашей группы, которые демонстрируют способность штаммов иммунобиотиков благотворно модулировать иммунный ответ, запускаемый toll-подобным рецептором (TLR) -3, в эпителиальных клетках кишечника (IEC), уменьшать нарушение гомеостаза кишечника, вызванное интраэпителиальными лимфоцитами. (IELs) и повысить устойчивость к инфекции RV.
Кишечный противовирусный врожденный иммунный ответ и ротавирус
После интернализации RV, капсид снимает оболочку, теряя VP4 и VP7, белки внешней поверхности, и дает транскрипционно активную двухслойную частицу. Одиннадцать сегментов вирусного генома дцРНК транскрибируются, управляя синтезом структурных и неструктурных белков и служащих матрицами для комплементарной цепи геномной РНК (13). IEC воспринимает вирусную дцРНК через рецепторы распознавания образов (PRR), такие как TLR3, ген-I, индуцируемый ретиноевой кислотой (RIG-I), и ген-5, связанный с дифференцировкой меланомы (MDA-5), и активируются клеточные сигнальные каскады. реагировать на вирусную инфекцию (14–16) (рис. 1).Один из основных врожденных ответов против вирусов дцРНК основан на активации этих PRR, что приводит к продукции цитокинов и хемокинов IECs и иммунными клетками. Таким образом, дцРНК RV запускает продукцию IL-8, IP-10, IL-6, TNF-α и IL-15 в IEC через TLR3-, RIG-I- и MDA5-активируемые пути, вызывая рекрутирование и активация макрофагов и NK-клеток и стимуляция адаптивного B- и T-клеточного иммунного ответа. В результате активации PRR также продуцируются интерфероны (IFN) и продукты генов, регулируемых IFN, и они играют ключевую роль в установлении антивирусного состояния для удаления вируса и ограничения распространения (рис. 1).IFN типа I и III ограничивают инфицирование RV in vitro , и их уровни повышаются у детей и животных, инфицированных RV (17–19). Оба семейства IFN немедленно продуцируются при инфицировании RV, вызывают ответы на различные типы рецепторов и регулируются во времени и пространстве в желудочно-кишечном тракте (20). Другое свидетельство того, что IFN имеют решающее значение для ограничения инфекции RV, основано на том факте, что этот вирус развил механизмы для управления передачей сигналов IFN, такие как IFN типа I, подавляющие белок NSP1 (21).В то время как TLR3 в основном распознает вирусные компоненты, такие как вирусная нуклеиновая кислота, в эндосомных компартментах, RIG-I и MDA-5 распознают цитоплазматическую дцРНК. Эти пути сходятся на уровне фактора регуляции IFN-3 (IRF3) (18, 22, 23). При фосфорилировании IRF3 противовирусные ответы инициируют активацию IFN типа I, который, в свою очередь, вызывает синтез генов, стимулированных интерфероном (ISG), секрецию провоспалительных цитокинов, а также активацию и созревание антигенпрезентирующих клеток (APC) (Рисунок 2). .
Рис. 1. Врожденный иммунный ответ против ротавируса в эпителиальных клетках кишечника (IEC) . Двухцепочечная геномная РНК ротавируса активирует толл-подобный рецептор 3 (TLR3), ген-I, индуцируемый ретиноевой кислотой (RIG-I), и ген-5, связанный с дифференцировкой меланомы (MDA-5), которые являются рецепторами распознавания образов (PRR). ), выраженные в МЭК. Клеточные сигнальные каскады активируются и сходятся на уровне регуляторного фактора 3 интерферона (IFN) (IRF3), который усиливает экспрессию IFN типа I (IFN-α, IFN-β) и типа III (IFNλ1, IFNλ2 / 3), что, в свою очередь, индуцирует синтез стимулированных IFN генов с противовирусной активностью (MxA, Mx1, RNase L, OAS, PKR).Противовирусные PRR также активируют путь ядерного фактора κB (NF-κB) и индуцируют секрецию провоспалительных цитокинов и хемокинов (IL-6, IL-8, MCP-1, CXCL10). Эти эффекты можно имитировать in vitro, и in vivo, , путем введения синтетического аналога дцРНК поли (I: C).
Рисунок 2. Врожденный иммунный ответ против ротавируса в слизистой оболочке кишечника . Двухцепочечная геномная РНК ротавируса активирует толл-подобный рецептор 3 (TLR3), ген-I, индуцируемый ретиноевой кислотой (RIG-I), и ген-5, связанный с дифференцировкой меланомы (MDA-5), которые являются рецепторами распознавания образов (PRR). ) экспрессируется в эпителиальных клетках кишечника (IEC) и дендритных клетках (DC).Активация противовирусных PRR в слизистой оболочке кишечника увеличивает продукцию IFN типа I (IFN-α, IFN-β), IFN-γ, провоспалительных цитокинов и хемокинов (TNF-α, IL-6, IL-8, IL-12). , MCP-1), который улучшает антивирусное состояние в IEC, вызывает рекрутинг и активацию иммунных клеток и созревание DC. Эти эффекты можно имитировать in vitro, и in vivo, , путем введения синтетического аналога дцРНК поли (I: C).
Poly (I: C), синтетический аналог дцРНК, при внутрибрюшинном введении мышам имитирует местный кишечный иммунный ответ, вызванный кишечной вирусной инфекцией (24, 25).И очищенная дцРНК RV, и поли (I: C) способны вызывать серьезные повреждения слизистой оболочки кишечника посредством активации TLR3 , включая атрофию ворсинок, эрозию слизистой оболочки и ослабление стенки кишечника (24). IELs, которые в основном представляют собой Т-клетки, распределенные в виде отдельных клеток в слое эпителиальных клеток, играют критическую роль в нарушении эпителиального гомеостаза, вызванного аномальной передачей сигналов TLR3 (Рисунок 3) (24). Благодаря своему ключевому расположению на границе между внутренней тканью кишечника и просветом, эти специализированные иммунные клетки важны как первая линия защиты от микробов и в поддержании гомеостаза эпителиального барьера.Большинство IEL — это CD8 + , которые просто классифицируются как CD8αα + или CD8αβ + . IEL CD8αβ + несут отличительные черты клеток адаптивного иммунитета, тогда как IEL CD8αα + считаются клетками врожденного иммунитета (26). Когда TLR3 ненормально активируется поли (I: C) и RV, геномная дцРНК, IL-15 и CD3 + NK1.1 + CD8αα + IELs участвуют в нарушении эпителиального гомеостаза. Кроме того, было продемонстрировано, что активация TLR3 в IECs индуцирует экспрессию ретиноевой кислоты ранней индуцибельной-1 (RAE1), которая опосредует разрушение эпителия и повреждение слизистой оболочки, взаимодействуя с рецептором NKG2D, экспрессируемым на IELs (27) (Рисунок 3).
Фигура 3. Воспалительное повреждение слизистой оболочки кишечника, вызванное ротавирусом в зависимости от toll-подобного рецептора 3-зависимого типа . И очищенная двухцепочечная геномная РНК ротавируса, и поли (I: C) вызывают серьезные повреждения слизистой оболочки кишечника через активацию TLR3 и взаимодействие эпителиальных клеток кишечника (IEC) и интраэпителиальных лимфоцитов (IEL). Активация TLR3 в IEC увеличивает экспрессию провоспалительных цитокинов и хемокинов (MCP-1, IL-8, IL-15) и ранней индуцибельной-1 ретиноевой кислоты (RAE1).IL-15, продуцируемый IECs, индуцирует рекрутирование IEL CD3 + NK1.1 + CD8αα + , которые опосредуют разрушение эпителия и повреждение слизистой оболочки рецептором NKG2D, экспрессируемым на этих клетках, который способен распознавать RAE1. Это кишечное взаимодействие TLR3-IECs-IELs вызывает атрофию ворсинок, эрозию слизистой оболочки и ослабление стенки кишечника.
Таким образом, углубление нашего понимания того, как PRR, такие как TLR3, активируются и регулируются в иммунных клетках и IEC, может помочь в разработке эффективных методов лечения для профилактики и / или лечения вирусных заболеваний.
Положительные эффекты иммунобиотиков при ротавирусной инфекции
Несколько исследований показали, что иммунобиотики могут улучшить исход инфекции RV у людей и сельскохозяйственных животных.
Эффекты иммунобиотиков у людей
Lactobacillus rhamnosus GG — вероятно, наиболее изученные пробиотические бактерии при кишечных вирусных инфекциях. Isolauri et al. (28) впервые за более чем 20 лет описали защитный эффект L.rhamnosus GG при гастроэнтерите РВ у младенцев и детей. В этом исследовании пациенты, которые получали кисломолочный продукт L. rhamnosus GG или лиофилизированный порошок L. rhamnosus GG после пероральной регидратации, имели значительно более короткую продолжительность диареи по сравнению с группой плацебо. Позже Majamaa et al. (29) провели исследование, в котором дети в возрасте от 6 до 35 месяцев с гастроэнтеритом РВ получали либо L. rhamnosus GG, Lactobacillus acidophilus , либо комбинацию Streptococcus thermophilus с L.delbrückii subsp. bulgaricus два раза в день в течение 5 дней. Только дети, получившие L. rhamnosus GG, имели более короткую продолжительность диареи. Защитный эффект был связан с повышенной концентрацией кишечного и сывороточного IgA, а также с большим количеством специфических секретирующих антитела клеток к RV. Дополнительные исследования показали, что употребление L. rhamnosus GG способно сократить диарейную фазу у детей, страдающих инфекцией RV, эффект, который также был связан с повышенными концентрациями антител IgA (28–33).Кроме того, метаанализ показал, что введение L. rhamnosus GG госпитализированным детям снижает общую заболеваемость диареей, связанной с оказанием медицинской помощи, включая симптоматический гастроэнтерит, вызванный ПЖ (34). Несмотря на эти данные, важно отметить, что сокращение диареи уже на 3-й день после лечения пробиотиками убедительно свидетельствует о том, что основной терапевтический эффект связан с врожденными иммунными ответами, а не с модуляцией адаптивного иммунитета (35).
Другим примером лечения пробиотиками для облегчения гастроэнтерита, вызванного RV, было использование Lactobacillus reuteri , которое ежедневно вводили госпитализированным детям с острой диареей на протяжении госпитализации (до 5 дней). L. reuteri сократил как продолжительность диареи правого желудочка, так и тяжесть заболевания по сравнению с группой плацебо (36). L. sporogenes , ежедневно вводимая новорожденным в течение 1 года, предотвращала заболеваемость, а также уменьшала продолжительность острой диареи правого желудочка (37). Fang et al. (38) продемонстрировали, что минимальная эффективная доза L. rhamnosus значительно снижает концентрацию фекальных выделений RV у педиатрических пациентов. Хотя введение лиофилизированного штамма ST11 Lactobacillus paracasei ежедневно в течение 5 дней имело клинически значимое преимущество в лечении диареи, не индуцированной RV, лечение ST11 против тяжелой диареи RV было неэффективным (39).У детей с инфекцией правого желудочка, получавших молочную смесь с добавлением либо B. animalis, Bb12, либо комбинации с S. thermophilus , было меньше инфекций, вызванных RV (40).
В Аргентине инфекции слизистых оболочек, такие как бронхит и диарея, являются наиболее распространенными инфекционными заболеваниями у детей (41–43). В рандомизированном контролируемом исследовании, проведенном Villena et al. (44), L. rhamnosus CRL1505 (вводимый в составе йогурта) улучшал иммунитет слизистых оболочек и снижал частоту и тяжесть кишечных и респираторных инфекций у детей.Следовательно, частота инфекционных событий снизилась с 66% в группе плацебо до 34% в группе, которая получала пробиотический йогурт. Кроме того, также наблюдалось значительное снижение показателей тяжести заболевания, таких как лихорадка и необходимость лечения антибиотиками у детей, получавших пробиотический йогурт (44). Таким образом, результаты этого исследования показали, что потребление йогурта, содержащего L. rhamnosus CRL1505, было полезным для снижения бремени общих детских заболеваний, особенно тех, которые связаны с вирусными инфекциями, включая RV (44).
Влияние иммунобиотиков на животных
Помимо положительного воздействия иммунобиотиков на людей, в некоторых исследованиях оценивалась их противовирусная и противовоспалительная активность на животных. Zhang et al. (45) сообщили, что введение пробиотиков свиньям-гнотобиотам, зараженным RV, не вызывало различий в титрах вирусов по сравнению с группой плацебо. Тем не менее, введение LAB подавляло рекрутирование активированных вирусами моноцитов / макрофагов в кишечном тракте, тем самым ограничивая воспаление, вызванное вирусом (45).
В другом исследовании было показано, что системные ответы моноцитов / макрофагов и APC модулируются иммунобиотиками в контексте инфекции RV (45). Пробиотический LAB индуцировал сильные TLR2-экспрессирующие APC-ответы в крови и селезенке, RV индуцировали TLR3-ответ в селезенке, а TLR9-ответы были вызваны RV (измерено в иммунных клетках, выделенных из селезенки) и LAB (как определено в циркулирующих в крови иммунных клетках) . Иммунобиотики и RV оказывали аддитивный эффект на ответы APC, экспрессирующие TLR2 и TLR9, что согласуется с адъювантным эффектом LAB.Иммунобиотики увеличивали уровни IFN-γ и IL-4 в сыворотке, но подавляли TLR3- и TLR9-экспрессирующие APC-ответы в селезенке и сывороточный IFN-α-ответ, индуцированный вирулентными RV (46).
Во время инфекций RV у свиней-отъемышей есть свидетельства нарушения барьерной функции, о чем свидетельствуют уменьшение высоты ворсинок и глубины крипт, более низкие уровни IgA, IL-4 и муцина 1, а также снижение транскрипции ZO-1, окклюдин и Bcl-2 в слизистой оболочке тощей кишки (47). Некоторые из этих эффектов были частично связаны с изменениями продукции трансформирующего фактора роста (TGF) -β (48).Азеведо и др. (48) продемонстрировали, что иммунобиотические LAB дополнительно усиливают ответы цитокинов Th2 и Th3 на инфекцию RV, на что указывают значительно более высокие концентрации IL-12, IFN-γ, IL-4 и IL-10 у свиней-гнотобиотиков, инфицированных RV. LAB также помогает поддерживать иммунологический гомеостаз во время инфекции RV, регулируя продукцию TGF-β. Также было показано, что обработка свиней L. rhamnosus GG модулировала TGF-β и способствовала усилению плотных контактов кишечного эпителия, что может способствовать сохранению и восстановлению гомеостаза кишечника после инфицирования RV (11).О дополнительных доказательствах сообщили Maragkoudakis et al. (12) демонстрируют, что Lactobacillus casei, Shirota и L. rhamnosus GG защищают эпителиальные клетки свиней и коз от RV и других вирусов трансмиссивного гастроэнтерита.
Клеточные и молекулярные механизмы действия иммунобиотиков
Взаимодействие IEC с люминальными антигенами и с иммунными клетками играет центральную роль в определении типа иммунного ответа, запускаемого кишечными микроорганизмами (5, 6).Важнейшим и практически универсальным ранним врожденным ответом клеток-хозяев на вирусную инфекцию является секреция факторов, принадлежащих к семейству IFN. Секреция IFN приводит к экспрессии нескольких продуктов ISG с противовирусной активностью.
В различных исследованиях мы показали, что первоначально созданная линия эпителиальных клеток кишечника свиней (клетки PIE) является полезным инструментом для изучения ответа IFN, запускаемого активацией TLR3, RIG-I и / или MDA-5. Эти клетки являются пермиссивными для свиней RV, а также отвечают на дцРНК и ее синтетический аналог поли (I: C) (49, 50).Кроме того, совместные культуры клеток PIE с иммунными клетками, выделенными из свиных пятен Пейера (PP), обеспечивают систему in vitro для изучения трансдукции сигнала от его обнаружения IEC на влияние на лежащие под ними иммунные клетки.
Была оценена реакция клеток PIE на заражение поли (I: C), и было обнаружено, что МСР-1, ИЛ-8, TNF-α, ИЛ-6, а также IFN-α и IFN-β были активированы в Клетки PIE после стимуляции (49). Мы также показали, что после стимуляции совместных культур поли (I: C) в иммунных клетках наблюдалась повышенная регуляция IFN-α, IFN-β, IFN-γ, IL-2 и IL-12p40 (49).TLR3 был рецептором, участвующим в распознавании люминального стимула, и ответственным за запуск экспрессии и высвобождения цитокинов, которые, в свою очередь, активировали лежащие в основе APC и эффекторные лимфоциты.
Ротавирусная инфекция стимулирует экспрессию IFN-β и раннего антивирусного гена с помощью сигнального пути, который требует MAVS, адаптивного белка, который рекрутируется в сигнальные комплексы после активации RIG-I или MDA-5 (51, 52). Кроме того, как RIG-I, так и MDA-5 участвуют в распознавании инфекции RV, что доказано снижением индукции IFN-β при потере этих факторов (51, 52).Принимая во внимание эти факты, мы оценили пригодность клеток PIE и совместных культур в качестве моделей для изучения этого сигнального пути после инфицирования RV. Наши результаты показали, что клетки PIE имеют функциональные рецепторы TLR3, RIG-I и MDA-5, которые передают сигналы через IRF3 и NF-κB, индуцируя IFN-β и повышая регуляцию ISG MxA и РНКазы L (50), которые являются важными противовирусными эффекторами пути IFN.
Мы использовали клетки PIE для скрининга иммунобиотических штаммов LAB с учетом их способности усиливать продукцию IFN-β при стимуляции поли (I: C) (49, 53).Таким образом, был выбран L. casei MEP221106 из-за его способности воздействовать на вирусные кишечные инфекции. L. casei MEP221106 имел наивысшую способность улучшать продукцию IFN-β в поли (I: C) -интенсивных клетках PIE. Более того, эксперимента по совместному культивированию in vitro, показали, что L. casei MEP221106 способны улучшать не только продукцию IFN-β, но и уровни других цитокинов, включая IFN-α, TNF-α, MPC-1, и Ил-6. В совместных культурах клеток PIE с иммунными клетками мы продемонстрировали, что L.casei MEP221106 улучшил продукцию воспалительных и противовирусных цитокинов клетками PPs по сравнению с контрольными клетками (49).
Система PIE также использовалась для скрининга штаммов бифидобактерий с эффектом против RV (50). Bifidobacterium infantis MCC12 и Bifidobacterium breve MCC1274 были отобраны для скрининга, поскольку они значительно повышали регуляцию IFN-β в ответ на провокацию поли (I: C). Кроме того, оба штамма MCC12 и MCC1274 значительно повышали устойчивость клеток PIE к инфекции RV (рис. 4), в то время как другие штаммы с умеренным эффектом или отсутствием эффекта на продукцию IFN-β не оказывали никакого влияния на репликацию RV (50).В результате повышенных уровней IFN-β имело место сопутствующее усиление регуляции ISG MxA и РНКазы L. Эти эффекторы противовирусного иммунитета имеют разные механизмы действия: РНКаза L разрушает дцРНК, а полученные фрагменты РНК активируют RLR для усиления продукции IFN. и вызывают апоптоз на инфицированных вирусом клетках (54), в то время как MxA захватывает вновь синтезированные вирусные белки в перинуклеарные комплексы. Тогда повышающая регуляция MxA, РНКазы L и, возможно, других ISG, индуцированная штаммами MCC12 и MCC1274 через IFN-β, будет связана с более низкой репликацией RV, обнаруженной в обработанных бифидобактериями клетках PIE.Это подтверждается тем фактом, что IFN-β является ключевым фактором для улучшения защиты от RV, поскольку репликация вируса ограничивается в пермиссивных клетках, когда они предварительно обрабатываются IFN-β (55). Соответственно, обработка IFN-β новорожденных телят и поросят до инфицирования RV снижает репликацию вируса и тяжесть заболевания (56).
Рис. 4. Благоприятное влияние иммунобиотических бифидобактерий на врожденный иммунный ответ против ротавируса в эпителиальных клетках кишечника (IEC) .Двухцепочечная геномная РНК ротавируса активирует толл-подобный рецептор 3 (TLR3), ген-I, индуцируемый ретиноевой кислотой (RIG-I), и ген-5, связанный с дифференцировкой меланомы (MDA-5), которые являются рецепторами распознавания образов (PRR). ), выраженные в МЭК. Клеточные сигнальные каскады, опосредованные регуляторным фактором-3 интерферона (IFN) (IRF3), повышают экспрессию IFN типа I (IFN-α, IFN-β) и типа III (IFNλ1, IFNλ2 / 3), что, в свою очередь, индуцирует синтез стимулированных IFN генов с противовирусной активностью (MxA, Mx1, RNase L, OAS, PKR).Противовирусные PRR также активируют путь ядерного фактора κB (NF-κB) и индуцируют секрецию провоспалительных цитокинов и хемокинов (IL-6, MCP-1, CXCL10). Профилактическое лечение IEC Bifidobacterium infantis MCC12 или Bifidobacterium breve MCC1274 снижает экспрессию A20, увеличивает активацию IRF3, улучшает продукцию противовирусных факторов IFN-α, IFN-β, MxA и РНКазы L, и дифференциально регулируют экспрессию IL-6, MCP-1 и CXCL10.
Несколько цитокинов индуцируются посредством передачи сигналов NF-κB в результате инфекции RV, включая IL-8, RANTES, GM-CSF, GRO-α, MIP-1β и IP-10 (57), что наблюдается в обоих случаях. клеточные линии и гистологические образцы кишечника.Секретируемые цитокины инициируют важную первичную линию защиты хозяина, но если этот ответ длится слишком долго или не регулируется, он может привести к повреждению тканей и дисфункции эпителиального барьера. В связи с этим мы сообщали, что эффективная регуляция воспалительного ответа, вызванного иммунобиотическими бактериями, необходима для достижения полной защиты от патогенов (58, 59). В соответствии с этим мы также показали, что штаммы бифидобактерий MCC12 и MCC1274 по-разному модулируют продукцию провоспалительных медиаторов в клетках PIE, инфицированных RV (рис. 4) (50).
Негативные регуляторы Toll-подобных рецепторов играют ключевую роль в поддержании гемостаза в кишечнике, регулируя передачу сигналов TLR. Белок цинкового пальца A20, благодаря своей деубиквитиназной и убиквитиназной лигазной активности E3, способен прекращать передачу сигналов TLR, что приводит к ингибированию активации NF-κB и снижению цитотоксичности, вызванной воспалением (60). Сайто и др. (61) сообщили, что активация IRF3 подавляется A20. Белок A20 способен вызывать подавление IFN-опосредованного иммунного ответа и IFN-промотор-зависимой транскрипции путем физического взаимодействия с IKK-i / IKKϵ и ингибирования димеризации IRF3 после вовлечения TLR3 дцРНК.Более того, нокдаун A20 приводит к усилению IRF3-зависимой транскрипции, запускаемой стимуляцией TLR3 или вирусной инфекции. Дендритные клетки (DC) человека, происходящие из моноцитов, стимулированные поли (I: C), активируют A20. Когда A20 подавляется в DC, они показывают более высокую активацию NF-κB и AP-1, что приводит к увеличению и устойчивой продукции IL-6, IL-10 и IL-12p70. Кроме того, DC усиливали стимулирующую способность Т-лимфоцитов (62). Отрицательные регуляторы, участвующие в передаче сигналов TLR, могут модулироваться иммунобиотическими штаммами в клеточных линиях кишечника человека (63).В связи с этим мы также сообщили, что как B. infantis MCC12, так и B. breve MCC1274 значительно снижали экспрессию A20 в инфицированных RVs PIE-клетках (Рисунок 4) (50), что соответствует способности оба штамма для улучшения активации IRF3 и продукции IFN-β. В соответствии с нашими выводами, MacPherson et al. (64) также изучали влияние пробиотиков на модуляцию вызванного поли (I: C) воспалительного ответа в клетках HT-29. Стимуляция клеток HT29 одним поли (I: C) увеличивала экспрессию A20, но совместная стимуляция поли (I: C) и пробиотиками значительно снижала уровни экспрессии A20.
Мы также использовали эти системы in vitro свиней для получения более глубоких знаний о механизмах, участвующих в иммуномодулирующем эффекте L. rhamnosus CRL1505, и сосредоточили наше внимание на перекрестных помехах между штаммом иммунобиотиков и IECs и APC свиней, чтобы объяснить его способность уменьшать количество эпизодов вирусной диареи у детей (44). Кроме того, мы провели сравнительные исследования с другим штаммом иммунобиотиков, Lactobacillus plantarum CRL1506, который способен стимулировать иммунитет кишечника на животных моделях (65).Исследования, сравнивающие иммунобиотические штаммы L. rhamnosus CRL1505 и L. plantarum CRL1506 в совместных культурах клеток PIE и APC, стимулированных поли (I: C), показали, что оба штамма улучшают продукцию IFN типа I в ответ. на поли (I: C) вызов (66). Кроме того, штаммы CRL1505 и CRL1506 модулировали экспрессию провоспалительных и регуляторных цитокинов и влияли на активацию и созревание APC (рис. 5). Однако L. rhamnosus CRL1505 оказывал более сильное действие как при применении отдельно, так и в сочетании с задним поли (I: C) провокационным препаратом.Об улучшении ответа Th2, индуцированного иммунобиотическими лактобациллами, свидетельствует усиленная экспрессия MHC-II, IL-1β, IL-6 и IFN-γ в DC (66, 67). Эти исследования дали научную основу для объяснения защиты от кишечных вирусных инфекций, обеспечиваемой L. rhamnosus CRL1505 у детей.
Рис. 5. Благоприятное влияние иммунобиотических лактобацилл на врожденный иммунный ответ против ротавируса в слизистой оболочке кишечника . Двухцепочечная геномная РНК ротавируса или поли (I: C) активирует толл-подобный рецептор 3 (TLR3), ген-I, индуцируемый ретиноевой кислотой (RIG-I), и ген-5, связанный с дифференцировкой меланомы (MDA-5), которые представляют собой рецепторы распознавания образов (PRR), экспрессируемые в эпителиальных клетках кишечника (IEC) и дендритных клетках (DC).Активация противовирусных PRR увеличивает продукцию IFN-α, IFN-β, IFN-γ, провоспалительных цитокинов и хемокинов (TNF-α, IL-6, IL-8, IL-12, MCP-1), что улучшает антивирусное состояние в IECs, вызывает набор и активацию иммунных клеток и созревание DC. Кроме того, как очищенная геномная дцРНК ротавируса, так и поли (I: C) активируют TLR3 в IEC, повышая экспрессию IL-15 и ранней индуцибельной-1 ретиноевой кислоты (RAE1). IL-15, продуцируемый IEC, индуцирует рекрутирование CD3 + NK1.1 + CD8αα + интраэпителиальных лимфоцитов (IEL), которые опосредуют разрушение эпителия и повреждение слизистой оболочки рецептором NKG2D, экспрессируемым в этих клетках, который способен распознавать RAE1. Профилактическое лечение Lactobacillus rhamnosus CRL1505 или Lactobacillus plantarum CRL1506 улучшает продукцию IFN типа I и IFN-γ в слизистой оболочке кишечника, усиливая противовирусное состояние и дифференцированно регулируя экспрессию воспалительных цитокинов и кишечных хемокинов. с взаимодействием TLR3 – IECs – IELs.
Рецепторы, которые активируются штаммами иммунобиотиков с противовирусными свойствами, штаммами MEP221106, MCC12, MCC1274, CRL1505 и CRL1506 в клетках PIE для уменьшения A20, улучшения активации IRF-3 и увеличения продукции IFN-β еще предстоит выяснить. Штаммы бифидобактерий с высокой способностью стимулировать TLR2, такие как B. longum BB536 и B. breve M-16V, были способны увеличивать экспрессию A20 в клетках PIE и снижать TLR4-опосредованный воспалительный ответ (68, 69).Напротив, штаммы с низкой способностью стимулировать TLR2 не изменяли экспрессию убиквитин-редактирующего фермента A20 в клетках PIE, зараженных агонистами TLR4. В наших экспериментах мы не смогли заблокировать увеличение IFN-β, вызванное лактобациллами и бифидобактериями, с помощью антител против TLR2 или против TLR9, что позволяет предположить, что другие рецепторы участвуют в иммунобиотической активности (66). Необходимы дальнейшие исследования, чтобы найти PRR, участвующие в распознавании лактобацилл и бифидобактерий, что приводит к модуляции A20 и IFN-β в клетках PIE.
Недавно мы подтвердили in vivo дифференциальную противовирусную иммуномодулирующую активность, запускаемую L. rhamnosus CRL1505 и L. plantarum CRL1506 (65). Оба штамма увеличивали продукцию IFN, причем обработка CRL1505 была наиболее эффективной для повышения уровней IFN-γ. Затем наши результаты предполагают, что эти два штамма лактобацилл могут быть использованы для улучшения исходов вирусных желудочно-кишечных заболеваний. Это также подтверждается клиническими испытаниями на людях, демонстрирующими емкость л.rhamnosus CRL1505 для улучшения показателей инфекционных заболеваний у детей (70). Недавно Zhang et al. (71) предложили активацию врожденного иммунитета флагеллином в качестве профилактической и терапевтической стратегии против инфекции RV. Они продемонстрировали, что внутрибрюшинная инъекция флагеллина снижает тяжесть и выделение РНК RVs у мышей с острой и хронической инфекцией через активацию TLR5 / NLRC4, что приводит к секреции IL-22 и IL-18 различными эффекторными клетками. Хотя механизм действия введения флагеллина существенно отличается от механизмов, вызываемых иммунобиотиками, оба подхода основываются на принципе борьбы с вирусной инфекцией путем усиления врожденной иммунной защиты.
Lactobacillus rhamnosus CRL1505 и L. plantarum CRL1506 также уменьшали TLR3-индуцированное повреждение тонкого кишечника за счет регуляции продукции провоспалительных цитокинов и взаимодействия IECs – IELs (65) (Рисунок 5). IEC и IEL являются первой линией защиты от патогенов, включая вирусы, и их взаимодействие важно для поддержания соответствующего иммунологического гомеостаза. IEC продуцируют множество цитокинов и хемокинов, включая IL-6, IL-7, IL-8, IL-15, TNF-α, TGF-β и GM-CSF.IL-15 действует как медиатор TLR3-индуцированного повреждения тонкого кишечника (24). Аномальная передача сигналов TLR3 приводит к повышенным уровням IL-15, который регулирует апоптоз IEC путем активации перфорин-опосредованного уничтожения с помощью CD3 + NK1.1 + IEL (70). Более того, IL-15 способен усиливать цитотоксическую активность IEL человека (72). Блокирование α-рецептора IL-15 частично защищает мышей от вызванного поли (I: C) повреждения тонкого кишечника, включая меньшую атрофию ворсинок и эрозию слизистой оболочки (24).Аутологичные лиганды, высвобождаемые клеточным стрессом и инфекцией, распознаются рецептором NKG2D в NK-клетках. Экспрессия лигандов NKG2D подавляется микробиотой кишечника, как показано на стерильных мышах, у которых была повышена поверхностная экспрессия этих лигандов (73). RAE1, лиганд NKG2D с высоким сродством, который минимально обнаруживается в нормальных клетках, активируется при активации TLR3. Фактически, блокада взаимодействия NKG2D – RAE1 позволяет избежать цитотоксического действия IELs на IECs и предотвращает острое повреждение тонкого кишечника у мышей, зараженных дцРНК (27).Следовательно, передача сигналов TLR3 стимулирует IECs для экспрессии IL-15 и RAE1 и индуцирует IEL CD3 + NK1.1 + CD8αα + для экспрессии NKG2D через IL-15, производный от IEC. В наших руках обработка мышей поли (I: C) увеличивала повреждение кишечника в зависимости от IL-15 и CD8αα + NKG2D + (65). Поли (I: C) индуцировал опосредованное воспалением повреждение ткани кишечника за счет увеличения CD3 + NK1.1 + и CD8αα + клеток NKG2D + , а также провоспалительных медиаторов (TNF-α, IL-1β , IFN-γ, IL-15, RAE1, IL-8).Мыши, предварительно обработанные иммунобиотическими лактобациллами до активации TLR3, ответили снижением уровней TNF-α, IL-15, RAE1, CD3 + NK1.1 + , CD3 + CD8αα + и CD8αα + NKG2D + ячеек (рисунок 5). Благоприятный эффект этих лактобацилл улучшил здоровье мышей, о чем свидетельствует значительное снижение потери веса тела и повреждения тканей кишечника после провокации поли (I: C) (65).
Хорошо известно, что комменсальные бактерии в кишечнике способны модулировать функцию IELs.Кроме того, IELs значительно снижены у мышей без микробов (74, 75), что лежит в основе важности микробиоты кишечника в поддержании IELs. Эти специализированные лимфоциты играют очень важную роль в защите слизистой оболочки; они, по-видимому, занимают уникальную временную нишу, из которой могут обнаруживать и ограничивать проникновение бактерий уже в первые часы после атаки патогена (76). Исмаил и др. (76) показали, что антибактериальный ответ IEL зависит от бактериальной стимуляции MyD88-зависимой передачи сигналов.Позже Цзян и др. (77) исследовали роль передачи сигналов NOD2 в поддержании IELs и обнаружили, что NOD2 поддерживает IELs посредством распознавания кишечной микробиоты. Они продемонстрировали, что стимуляция IEL требует активации передачи сигналов PRR в соседних IEC (76, 77).
Таким образом, было показано, что комменсальные бактерии создают регуляторную среду в здоровом кишечнике с повышенной экспрессией иммуно-ингибирующих цитокинов, таких как TGF-β и IL-10, которые, в свою очередь, подавляют поверхностную экспрессию лиганда NKG2D (78, 79).Это согласуется с нашими выводами для иммуномодулирующих штаммов L. rhamnosus CRL1505 и L. plantarum CRL1506, которые снижали экспрессию RAE-1 и повышали уровни кишечного IL-10. Вызываются ли иммуномодулирующие эффекты L. rhamnosus CRL1505 и L. plantarum CRL1506 прямым действием на IEC (косвенно на IEL) и / или прямым воздействием на IEL — открытый вопрос, который мы предлагаем рассмотреть в ближайшее будущее.
Заключение
Подробная характеристика клеточных и молекулярных механизмов, лежащих в основе врожденной защиты кишечника от инфекции RV, достигнутая за последние годы, открыла новые пути для разработки стратегий предотвращения и лечения этой вирусно-индуцированной диареи.В этом смысле использование иммунобиотических бактерий для благоприятной модуляции IFN и воспалительных сигнальных путей в IEC и иммунных клетках является привлекательной мишенью для профилактического или терапевтического вмешательства против инфекции RV. Более того, успехи в изучении молекулярных перекрестных помех между иммунобиотиками и врожденной иммунной системой кишечника пролили свет на сигналы, воспринимающие микроорганизмы, которые позволяют этим полезным микроорганизмам улучшать кишечные иммунные ответы. Эта новая молекулярная информация может быть полезна для улучшения разработки функциональных пищевых продуктов и / или фармабиотиков с использованием иммунобиотиков, направленных на снижение смертности и тяжести заболевания RV.
Авторские взносы
JV, MV-P и HK разработали, написали и отредактировали обзорную статью.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Финансирование
Это исследование было поддержано грантом на научные исследования (B) (2) (№ 16H05019), Challenging Exploratory Research (No.16K15028), а также совместные проекты открытого партнерства двусторонних совместных исследовательских проектов JSPS от Японского общества содействия науке (JSPS) доктору HK. Это исследование было поддержано грантом ANPCyT – FONCyT PICT-2013 (№ 3219) доктору СП.
Список литературы
1. Брайс Дж., Блэк Р. Э., Уокер Н., Бхутта З. А., Лаун Дж. Э., Стекети Р. У. Может ли мир позволить ежегодно спасать жизни 6 миллионов детей? Ланцет (2005) 365 (9478): 2193–200. DOI: 10.1016 / S0140-6736 (05) 66777-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2.Брайс Дж., Виктора К.Г. Выживание детей: обратный отсчет до 2015 года. Lancet (2005) 365 (9478): 2153–4. DOI: 10.1016 / S0140-6736 (05) 66752-9
CrossRef Полный текст | Google Scholar
4. Тран А., Талмуд Д., Лежен Б., Джовенен Н., Ренуа Ф., Паян С. и др. Распространенность ротавирусных, аденовирусных, норовирусных и астровирусных инфекций и коинфекций среди госпитализированных детей в северной Франции. J Clin Microbiol (2010) 48 (5): 1943–6. DOI: 10.1128 / JCM.02181-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7.Тейт Дж. Э., Патель М. М., Кортезе М. М., Лопман Б. А., Генч Дж. Р., Флеминг Дж. И др. Сохраняющиеся вопросы и проблемы для ротавирусной вакцины в предотвращении глобальной детской диарейной заболеваемости и смертности. Экспертные ревакцины (2012) 11 (2): 211–20. DOI: 10.1586 / erv.11.184
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Басу С., Пол Д. К., Гангули С., Чаттерджи М., Чандра П. К.. Эффективность высоких доз Lactobacillus rhamnosus GG в борьбе с острой водянистой диареей у индийских детей: рандомизированное контролируемое исследование. J Clin Gastroenterol (2009) 43 (3): 208–13. DOI: 10.1097 / MCG.0b013e31815a5780
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Лю Ф., Ли Дж., Вэнь К., Буй Т., Цао Д., Чжан Ю. и др. Линия эпителиальных клеток тонкого кишечника свиней (IPEC-J2) ротавирусной инфекции как новая модель для изучения врожденного иммунного ответа на ротавирусы и пробиотики. Viral Immunol (2010) 23 (2): 135–49. DOI: 10.1089 / vim.2009.0088
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12.Maragkoudakis PA, Chingwaru W., Gradisnik L, Tsakalidou E, Cencic A. Молочнокислые бактерии эффективно защищают эпителиальные и иммунные клетки кишечника человека и животных от кишечной вирусной инфекции. Int J Food Microbiol (2010) 141 (Приложение 1): S91–7. DOI: 10.1016 / j.ijfoodmicro.2009.12.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Frias AH, Jones RM, Fifadara NH, Vijay-Kumar M, Gewirtz AT. Индуцированный ротавирусом IFN-бета способствует передаче антивирусных сигналов и апоптозу, которые модулируют репликацию вируса в эпителиальных клетках кишечника. Врожденный иммунитет (2012) 18 (2): 294–306. DOI: 10.1177 / 1753425
1930CrossRef Полный текст | Google Scholar
15. Фриас А.Х., Виджай-Кумар М., Генч Дж. Р., Кроуфорд С.Е., Карвалью Ф.А., Эстес М.К. и др. Кишечный эпителий активирует передачу антивирусных сигналов посредством внутриклеточного восприятия структурных компонентов ротавируса. Mucosal Immunol (2010) 3 (6): 622–32. DOI: 10,1038 / mi.2010.39
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17.Сен А., Ротенберг М.Э., Мукерджи Г., Фенг Н., Калиски Т., Наир Н. и др. Врожденный иммунный ответ на гомологичную ротавирусную инфекцию в ворсинчатом эпителии тонкой кишки при одноклеточном разрешении. Proc Natl Acad Sci U S A (2012) 109 (50): 20667–72. DOI: 10.1073 / pnas.1212188109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Lin JD, Feng N, Sen A, Balan M, Tseng HC, McElrath C, et al. Различная роль интерферонов типа I и типа III в кишечном иммунитете к гомологичным и гетерологичным ротавирусным инфекциям. PLoS Pathog (2016) 12 (4): e1005600. DOI: 10.1371 / journal.ppat.1005600
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Барро М., Паттон Дж. Т.. Ротавирус NSP1 подавляет экспрессию интерферона I типа, противодействуя функции факторов регуляции интерферона IRF3, IRF5 и IRF7. J Virol (2007) 81 (9): 4473–81. DOI: 10.1128 / JVI.02498-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Loo YM, Fornek J, Crochet N, Bajwa G, Perwitasari O, Martinez-Sobrido L, et al.Различная передача сигналов RIG-I и MDA5 вирусами РНК при врожденном иммунитете. J Virol (2008) 82 (1): 335–45. DOI: 10.1128 / JVI.01080-07
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Zhou R, Wei H, Sun R, Tian Z. Распознавание двухцепочечной РНК с помощью TLR3 вызывает тяжелое повреждение тонкой кишки у мышей. J Immunol (2007) 178 (7): 4548–56. DOI: 10.4049 / jimmunol.178.7.4548
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25.Арая Р.Э., Жюри Дж., Бондарь К., Верду Э. Ф., Чирдо Ф. Г.. Внутрипросветное введение поли I: C вызывает энтеропатию, которая обостряется при пероральном введении диетического антигена. PLoS One (2014) 9 (6): e99236. DOI: 10.1371 / journal.pone.0099236
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Шайрс Дж., Теодоридис Э., Хейдей А.С. Биологические данные об интраэпителиальных лимфоцитах TCRgammadelta + и TCRalphabeta + получены с помощью серийного анализа экспрессии генов (SAGE). Иммунитет (2001) 15 (3): 419–34. DOI: 10.1016 / S1074-7613 (01) 00192-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Zhou R, Wei H, Sun R, Zhang J, Tian Z. Распознавание NKG2D опосредует индуцированное сигналом toll-подобного рецептора 3 нарушение эпителиального гомеостаза в тонком кишечнике мышей. Proc Natl Acad Sci U S A (2007) 104 (18): 7512–5. DOI: 10.1073 / pnas.0700822104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28.Isolauri E, Juntunen M, Rautanen T., Sillanaukee P, Koivula T. Человеческий штамм Lactobacillus ( Lactobacillus casei sp штамм GG) способствует выздоровлению от острой диареи у детей. Педиатрия (1991) 88 (1): 90–7.
PubMed Аннотация | Google Scholar
29. Majamaa H, Isolauri E, Saxelin M, Vesikari T. Молочнокислые бактерии в лечении острого ротавирусного гастроэнтерита. J Pediatr Gastroenterol Nutr (1995) 20 (3): 333–8. DOI: 10.1097 / 00005176-199504000-00012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Кайла М., Изолаури Э., Соппи Э., Виртанен Э., Лайне С., Арвиломми Х. Усиление ответа циркулирующих клеток, секретирующих антитела, при диарее человека штаммом Lactobacillus человека. Pediatr Res (1992) 32 (2): 141–4. DOI: 10.1203 / 00006450-19
00-00002PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Шорникова А.В., Касас И.А., Микканен Х., Сало Э., Весикари Т.Бактериотерапия Lactobacillus reuteri при ротавирусном гастроэнтерите. Pediatr Infect Dis J (1997) 16 (12): 1103–7. DOI: 10.1097 / 00006454-199712000-00002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Гуарино А., Канани Р. Б., Спаньоло М. И., Альбано Ф., Ди Бенедетто Л. Оральная бактериальная терапия сокращает продолжительность симптомов и уменьшает выделение вируса у детей с легкой диареей. J Pediatr Gastroenterol Nutr (1997) 25 (5): 516–9.DOI: 10.1097 / 00005176-199711000-00005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Szajewska H, Wanke M, Patro B. Мета-анализ: эффекты добавки Lactobacillus rhamnosus GG для профилактики диареи, связанной со здоровьем у детей. Aliment Pharmacol Ther (2011) 34 (9): 1079–87. DOI: 10.1111 / j.1365-2036.2011.04837.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Власова А.Н., Кандасами С., Чатта К.С., Раджашекара Г., Саиф Л.Дж.Сравнение эффектов пробиотических лактобацилл и бифидобактерий, иммунных ответов и ротавирусных вакцин и инфекции у разных видов хозяев. Vet Immunol Immunopathol (2016) 172: 72–84. DOI: 10.1016 / j.vetimm.2016.01.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Шорникова А.В., Касас И.А., Изолаури Э., Микканен Х., Весикари Т. Lactobacillus reuteri как лечебное средство при острой диарее у детей раннего возраста. J Pediatr Gastroenterol Nutr (1997) 24 (4): 399–404.DOI: 10.1097 / 00005176-199704000-00008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Chandra RK. Влияние Lactobacillus на частоту и тяжесть острой ротавирусной диареи у младенцев. Проспективное плацебо-контролируемое двойное слепое исследование. Nutr Res (2002) 22: 65–9. DOI: 10.1016 / S0271-5317 (01) 00367-0
CrossRef Полный текст | Google Scholar
38. Фанг С.Б., Ли Х.С., Ху Дж.Дж., Хоу С.Ю., Лю Х.Л., Фанг Х.В. Дозозависимый эффект Lactobacillus rhamnosus на количественное снижение фекального выделения ротавируса у детей. J Trop Pediatr (2009) 55 (5): 297–301. DOI: 10.1093 / tropej / fmp001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Саркер С.А., Султана С., Фукс Г.Дж., Алам Н.Х., Азим Т., Брюссов Х. и др. Lactobacillus paracasei Штамм ST11 не влияет на ротавирус, но улучшает исход неротавирусной диареи у детей из Бангладеш. Педиатрия (2005) 116 (2): e221–8. DOI: 10.1542 / педс.2004-2334
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40.Фуапрадит П., Варавитхья В., Ватанофас К., Сангчай Р., Подхипак А., Сутутворавут У. и др. Снижение ротавирусной инфекции у детей, получающих смесь с бифидобактериями. J Med Assoc Thai (1999) 82 (Дополнение 1): S43–8.
PubMed Аннотация | Google Scholar
41. Бардах А., Чаппони А., Гарсия-Марти С., Глюевски Д., Маццони А., Файад А. и др. Эпидемиология острого среднего отита у детей в Латинской Америке и Карибском бассейне: систематический обзор и метаанализ. Int J Pediatr Otorhinolaryngol (2011) 75 (9): 1062–70. DOI: 10.1016 / j.ijporl.2011.05.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Эдмонд К., Скотт С., Корчак В., Уорд С., Сандерсон С., Теодорату Е. и др. Долгосрочные последствия детской пневмонии; систематический обзор и метаанализ. PLoS One (2012) 7 (2): e31239. DOI: 10.1371 / journal.pone.0031239
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43.Джентиле А., Бардах А., Чаппони А., Гарсия-Марти С., Арудж П., Глузовский Д. и др. Эпидемиология внебольничной пневмонии у детей в Латинской Америке и Карибском бассейне: систематический обзор и метаанализ. Int J Infect Dis (2012) 16 (1): e5–15. DOI: 10.1016 / j.ijid.2011.09.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Виллена Дж., Сальва С., Нуньес М., Корсо Дж., Толаба Р., Фаедда Дж. И др. Пробиотики для всех! Новый иммунобиотик Lactobacillus rhamnosus CRL1505 и начало социальных пробиотических программ в Аргентине. Int J Biotechnol Wellness Ind (2012) 1: 189–98. DOI: 10.6000 / 1927-3037 / 2012.01.03.05
CrossRef Полный текст | Google Scholar
45. Чжан В., Вэнь К., Азеведо М.С., Гонсалес А., Саиф Л.Дж., Ли Г. и др. Колонизация молочнокислых бактерий и ротавирусная инфекция человека влияют на распределение и частоту моноцитов / макрофагов и дендритных клеток у новорожденных свиней-гнотобиотиков. Vet Immunol Immunopathol (2008) 121 (3–4): 222–31. DOI: 10.1016 / j.vetimm.2007.10.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46.Вен К., Ли Дж., Буй Т., Лю Ф., Ли Ю., Кочер Дж. И др. Высокая и низкая доза Lactobacillus acidophilus оказывала дифференциальное иммуномодулирующее действие на Т-клеточные иммунные ответы, вызванные пероральной ротавирусной вакциной человека у свиней-гнотобиотов. Vaccine (2012) 30 (6): 1198–207. DOI: 10.1016 / j.vaccine.2011.11.107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Мао X, Гу Ц., Ху Х, Тан Дж, Чен Д., Ю Б и др. Диета Добавка Lactobacillus rhamnosus GG улучшает барьерную функцию слизистой оболочки в кишечнике поросят-отъемышей, зараженных ротавирусом свиней. PLoS One (2016) 11 (1): e0146312. DOI: 10.1371 / journal.pone.0146312
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Азеведо М.С., Чжан В., Вен К., Гонсалес А.М., Саиф Л.Дж., Юсеф А.Е. и др. Lactobacillus acidophilus и Lactobacillus reuteri модулируют цитокиновые ответы у свиней-гнотобиотиков, инфицированных ротавирусом человека. Benef Microbes (2012) 3 (1): 33–42. DOI: 10.3920 / BM2011.0041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49.Хосоя С., Виллена Дж., Симадзу Т., Тоно М., Фуджи Х, Чиба Э и др. Иммунобиотические молочнокислые бактерии благотворно регулируют иммунный ответ, запускаемый поли (I: C) в эпителиальных клетках кишечника свиней. Ветеринарная служба (2011) 42 (1): 111. DOI: 10.1186 / 1297-9716-42-111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Ишизука Т., Канмани П., Кобаяши Х., Миядзаки А., Сома Дж., Суда Й. и др. Штаммы иммунобиотических бифидобактерий модулируют иммунный ответ ротавируса в эпителиоцитах кишечника свиней посредством передачи сигналов рецептора распознавания образов. PLoS One (2016) 11 (3): e0152416. DOI: 10.1371 / journal.pone.0152416
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Сен А., Пруйссерс А.Дж., Дермоди Т.С., Гарсия-Састре А., Гринберг HB. Ранний интерфероновый ответ на ротавирус регулируется PKR и зависит от MAVS / IPS-1, RIG-I, MDA-5 и IRF3. J Virol (2011) 85 (8): 3717–32. DOI: 10.1128 / JVI.02634-10
CrossRef Полный текст | Google Scholar
52. Броке А.Х., Хирата Ю., Макаллистер С.С., Кагнофф М.Ф.RIG-I / MDA5 / MAVS необходимы для передачи сигнала о защитном ответе IFN в инфицированном ротавирусом кишечном эпителии. J Immunol (2011) 186 (3): 1618–26. DOI: 10.4049 / jimmunol.1002862
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Хосоя С., Виллена Дж., Чиба Е., Симадзу Т., Суда Й., Асо Х. и др. Расширенное применение эпителиальных клеток кишечника свиней для выбора иммунобиотиков, модулирующих воспаление, опосредованное toll-подобным рецептором 3. J Microbiol Immunol Infect (2013).46: 474–81. DOI: 10.1016 / j.jmii.2012.04.005
CrossRef Полный текст | Google Scholar
55. Папп Х., Ласло Б., Якаб Ф., Ганеш Б., Де Грация С., Маттейнссенс Дж. И др. Обзор штаммов ротавируса группы А, обнаруженных у свиней и крупного рогатого скота. Vet Microbiol (2013) 165 (3–4): 190–9. DOI: 10.1016 / j.vetmic.2013.03.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Арнольд М.М., Сен А., Гринберг Х. Б., Паттон Дж. Т.. Битва между ротавирусом и его хозяином за контроль над сигнальным путем интерферона. PLoS Pathog (2013) 9 (1): e1003064. DOI: 10.1371 / journal.ppat.1003064
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Казола А., Эстес М.К., Кроуфорд С.Е., Огра П.Л., Эрнст П.Б., Гарофало Р.П. и др. Ротавирусная инфекция культивируемых эпителиальных клеток кишечника индуцирует секрецию хемокинов CXC и CC. Гастроэнтерология (1998) 114 (5): 947–55. DOI: 10.1016 / S0016-5085 (98) 70314-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58.Чиба Э., Виллена Дж., Хосоя С., Таканаши Н., Симадзу Т., Асо Х. и др. Недавно созданная линия эпителиальных клеток кишечника крупного рогатого скота эффективна для скрининга in vitro потенциальных противовирусных иммунобиотических микроорганизмов для крупного рогатого скота. Res Vet Sci (2012) 93 (2): 688–94. DOI: 10.1016 / j.rvsc.2011.10.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Селайя Х., Цукида К., Чиба Е., Марранзино Г., Альварес С., Китадзава Х. и др. Иммунобиотические лактобациллы уменьшают поражение легких, связанное с вирусами, за счет модуляции взаимодействий воспаления и коагуляции. Int Immunopharmacol (2014) 19 (1): 161–73. DOI: 10.1016 / j.intimp.2013.12.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Сайто Т., Ямамото М., Миягиши М., Тайра К., Наканиси М., Фудзита Т. и др. A20 является негативным регулятором передачи сигналов регулирующего фактора 3 IFN. J Immunol (2005) 174 (3): 1507–12. DOI: 10.4049 / jimmunol.174.3.1507
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Breckpot K, Aerts-Toegaert C, Heirman C, Peeters U, Beyaert R, Aerts JL, et al.Ослабленная экспрессия A20 заметно увеличивает эффективность двухцепочечных РНК-активированных дендритных клеток в качестве противораковой вакцины. J Immunol (2009) 182 (2): 860–70. DOI: 10.4049 / jimmunol.182.2.860
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Зайферт С., Родригес Гомес М., Ватцл Б., Хольцапфель В.Х., Франц С.М., Визосо Пинто М.Г. Дифференциальный эффект Lactobacillus johnsonii BFE 6128 на экспрессию генов, связанных с путями TLR и врожденным иммунитетом в эпителиальных клетках кишечника. Пробиотики, антимикробные белки (2010) 2: 211–7. DOI: 10.1007 / s12602-010-9055-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Макферсон С., Оди Дж., Матье О, Томпкинс Т.А. Многопозиционная пробиотическая модуляция иммунного ответа эпителиальных клеток кишечника на двухцепочечный лиганд РНК, поли (i.c). Appl Environ Microbiol (2014) 80 (5): 1692–700. DOI: 10.1128 / AEM.03411-13
CrossRef Полный текст | Google Scholar
65.Тада А., Селайя Х., Клуа П., Сальва С., Альварес С., Китадзава Х. и др. Штаммы иммунобиотиков Lactobacillus уменьшают повреждение тонкого кишечника, вызванное интраэпителиальными лимфоцитами после активации толл-подобного рецептора 3. Inflamm Res (2016) 65 (10): 771–83. DOI: 10.1007 / s00011-016-0957-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Виллена Дж., Чиба Е., Визосо-Пинто М.Г., Томосада Й., Такахаши Т., Исидзука Т. и др. Иммунобиотические штаммы Lactobacillus rhamnosus дифференциально модулируют противовирусный иммунный ответ в эпителиальных и антигенпредставляющих клетках кишечника свиней. BMC Microbiol (2014) 14 (1): 126. DOI: 10.1186 / 1471-2180-14-126
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Ивасаки А., Келсалл Б.Л. Уникальные функции дендритных клеток CD11b +, CD8 alpha + и дважды отрицательных пейеровских пятен. J Immunol (2001) 166 (8): 4884–90. DOI: 10.4049 / jimmunol.166.8.4884
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68. Кандасами С., Власова А.Н., Фишер Д., Кумар А., Чатта К.С., Рауф А. и др.Дифференциальные эффекты штамма GG Escherichia coli Nissle и Lactobacillus rhamnosus GG на связывание ротавируса человека, инфекцию и В-клеточный иммунитет. J Immunol (2016) 196 (4): 1780–9. DOI: 10.4049 / jimmunol.1501705
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Tomosada Y, Villena J, Murata K, Chiba E, Shimazu T., Aso H, et al. Иммунорегуляторный эффект штаммов бифидобактерий в эпителиальных клетках кишечника свиней посредством модуляции экспрессии фермента А20, редактирующего убиквитин. PLoS One (2013) 8 (3): e59259. DOI: 10.1371 / journal.pone.0059259
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Kinoshita N, Hiroi T., Ohta N, Fukuyama S, Park EJ, Kiyono H. Аутокринный IL-15 опосредует гибель кишечных эпителиальных клеток через активацию соседних интраэпителиальных NK-клеток. J Immunol (2002) 169 (11): 6187–92. DOI: 10.4049 / jimmunol.169.11.6187
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71.Чжан Б., Часайн Б., Ши З., Учияма Р., Чжан З., Деннинг Т.Л. и др. Вирусная инфекция. Профилактика и лечение ротавирусной инфекции посредством TLR5 / NLRC4-опосредованной продукции IL-22 и IL-18. Наука (2014) 346 (6211): 861–5. DOI: 10.1126 / science.1256999
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73. Hansen CH, Holm TL, Krych L, Andresen L, Nielsen DS, Rune I, et al. Микробиота кишечника регулирует экспрессию лиганда NKG2D на эпителиальных клетках кишечника. Eur J Immunol (2013) 43 (2): 447–57.DOI: 10.1002 / eji.201242462
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Кавагути М., Нанно М., Умесаки Ю., Мацумото С., Окада Ю., Цай З. и др. Цитолитическая активность кишечных интраэпителиальных лимфоцитов у стерильных мышей зависит от штамма и определяется Т-клетками, экспрессирующими гамма-дельта-Т-клеточные антигенные рецепторы. Proc Natl Acad Sci U S A (1993) 90 (18): 8591–4. DOI: 10.1073 / pnas.90.18.8591
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75.Suzuki H, Jeong KI, Itoh K, Doi K. Региональные различия в распределении интраэпителиальных лимфоцитов тонкого кишечника у мышей, свободных от микробов и специфических патогенов. Exp Mol Pathol (2002) 72 (3): 230–5. DOI: 10.1006 / exmp.2002.2433
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Исмаил А.С., Северсон К.М., Вайшнава С., Берендт С.Л., Ю. Х, Бенджамин Дж. Л. и др. Интраэпителиальные лимфоциты гаммадельта являются важными медиаторами микробного гомеостаза хозяина на поверхности слизистой оболочки кишечника. Proc Natl Acad Sci U S A (2011) 108 (21): 8743–8. DOI: 10.1073 / pnas.1019574108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Цзян В., Ван Х, Цзэн Б., Лю Л., Тардивел А., Вэй Х и др. Распознавание кишечной микробиоты с помощью NOD2 необходимо для гомеостаза кишечных интраэпителиальных лимфоцитов. J Exp Med (2013) 210 (11): 2465–76. DOI: 10.1084 / jem.20122490
PubMed Аннотация | CrossRef Полный текст | Google Scholar
78.Серрано А.Е., Менарес-Кастильо Е., Гарридо-Тапиа М., Рибейро С.Х., Эрнандес С.Дж., Мендоса-Наранхо А. и др. Интерлейкин 10 снижает экспрессию MICA на поверхности клеток меланомы. Immunol Cell Biol (2011) 89 (3): 447–57. DOI: 10.1038 / icb.2010.100
PubMed Аннотация | CrossRef Полный текст | Google Scholar
.

 Ухудшение состояния после созревания вируса развивается стремительно и может занимать до 6 часов.
Ухудшение состояния после созревания вируса развивается стремительно и может занимать до 6 часов.
.gif) Причем в таком возрасте не стоит самостоятельно подбирать микстуру – это может привести к серьезным последствиям.
Причем в таком возрасте не стоит самостоятельно подбирать микстуру – это может привести к серьезным последствиям..gif) Да, проследить за тем, чтобы все это соблюдал ребенок, достаточно сложно. Приучите своего малыша с ранних лет, и в дальнейшем он сам будет следовать всем предписаниям.
Да, проследить за тем, чтобы все это соблюдал ребенок, достаточно сложно. Приучите своего малыша с ранних лет, и в дальнейшем он сам будет следовать всем предписаниям. исходы от ВЗК до ожирения, недоедания и сердечно-сосудистых заболеваний?
исходы от ВЗК до ожирения, недоедания и сердечно-сосудистых заболеваний?