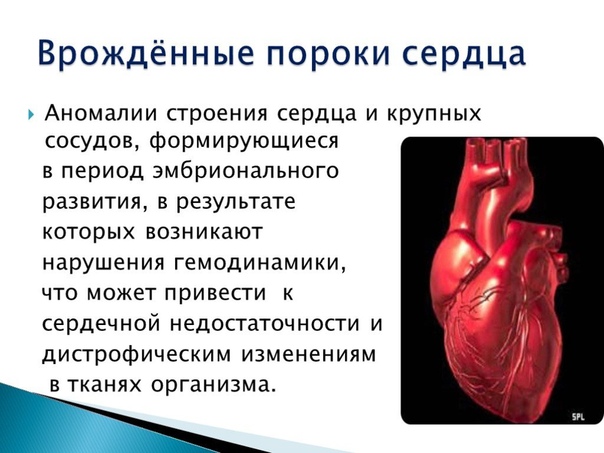
СГЛОС — Синдром гипоплазии левых отделов сердца плода (объяснение к задаче)
Для просмотра видео необходимо войти на сайт Четырехкамерный срез.
Ось сердца смещена влево 90 град. Грудная аорта находится слева от средней линии
Для просмотра видео необходимо войти на сайт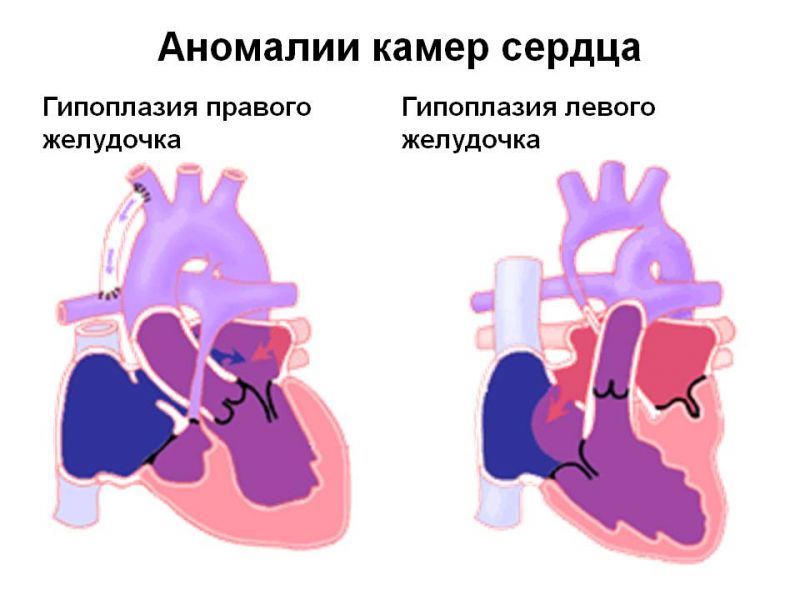 Из-за косого среза визуализирутся и желудок. Для просмотра изображений необходимо войти на сайт
Из-за косого среза визуализирутся и желудок. Для просмотра изображений необходимо войти на сайт Правый желудочек увеличен, левый — уменьшен. (При определении какой левый, какой правый желудочек — ориентируемся на позвонок — ближе к грудине правый желудочек). Межпредсердная первичная и вторичная перегородки отсутствуют. МЖП-межжелудочковая перегородка, ЛЖ-левый желудочек, ПЖ-правый желудочек, П-предсердие, звездочка- отсутствует первичная межпредсердная перегородка.
Четырехкамерный срез.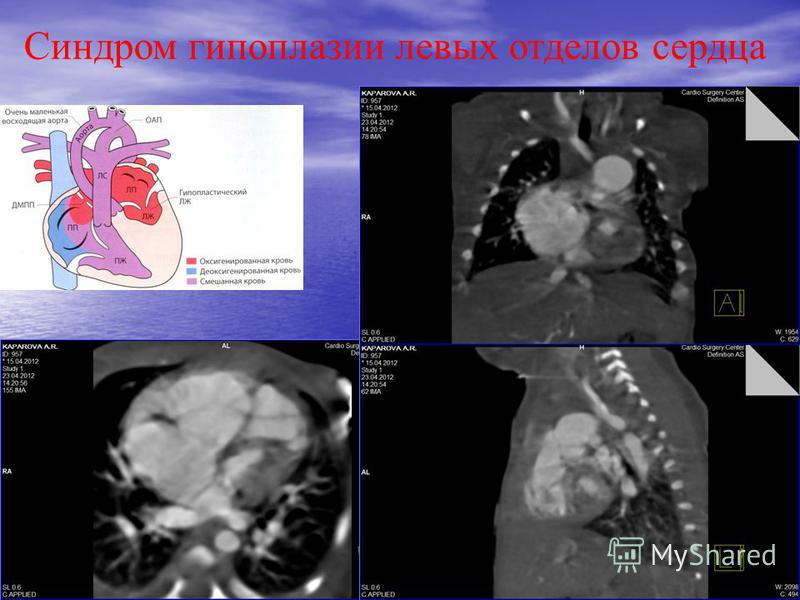
Работа створок митрального клапана не определяется Для просмотра изображений необходимо войти на сайт
Левый желудочек не окрашивается. ЛЖ-левый желудочек
Для просмотра изображений необходимо войти на сайт Аорта равна, или даже меньше диаметра верхней полой вены.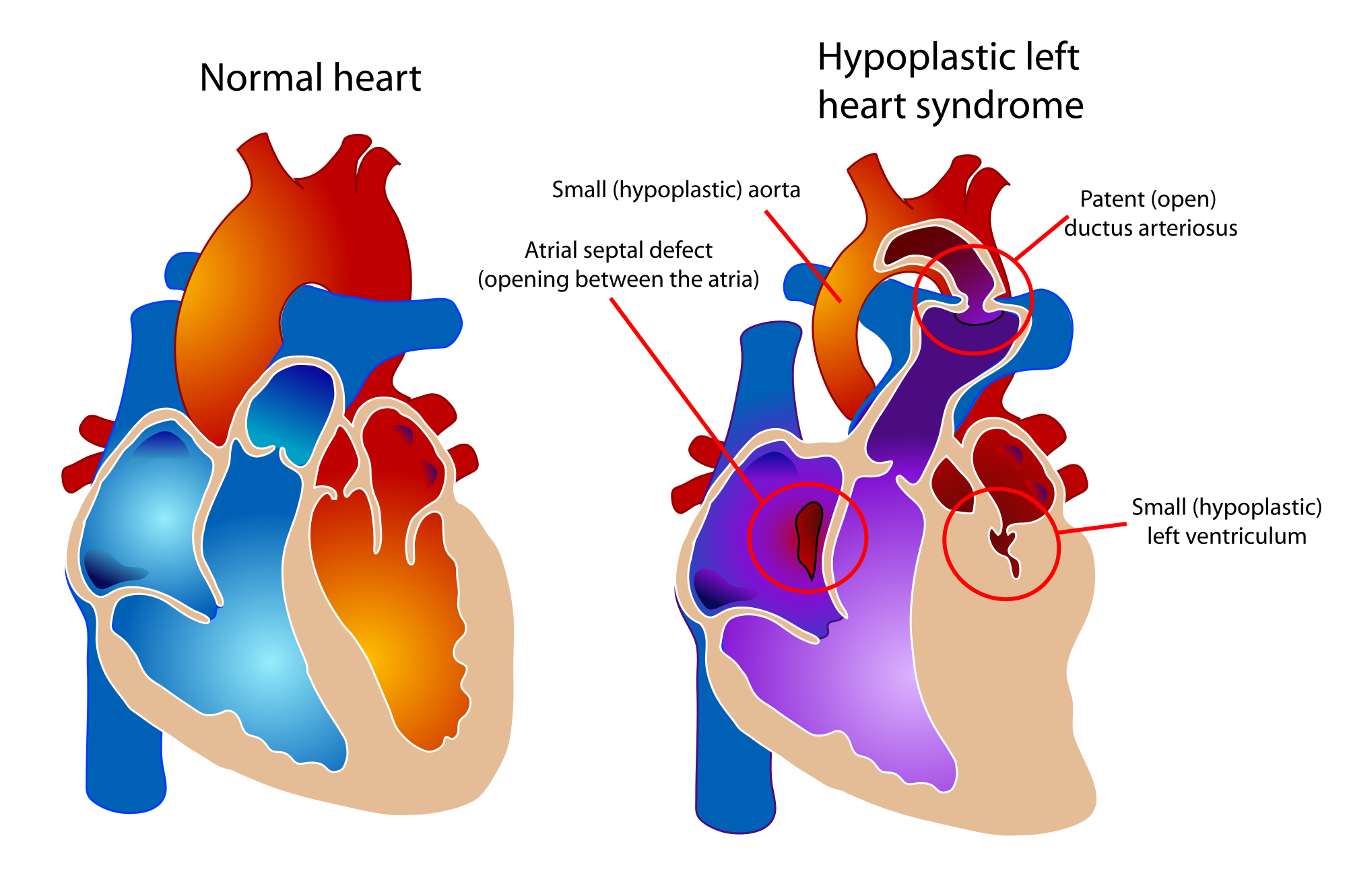
Срез через 3 сосуда ЦДК
Для просмотра видео необходимо войти на сайт Легочный ствол увеличен в диаметре, аорта уменьшена. Аорта окрашивается в красный цвет, т.е реверсный поток крови в аорте. Это обозначает атрезию аортального клапана, реверсный кровоток в аорте через артериальный проток. Нету антеградного потока в аорте в течении сердечного цикла.
Аорта окрашивается в красный цвет, т.е реверсный поток крови в аорте. Это обозначает атрезию аортального клапана, реверсный кровоток в аорте через артериальный проток. Нету антеградного потока в аорте в течении сердечного цикла.
Артериальный проток окрашивается в синий цвет — антеградный кровоток.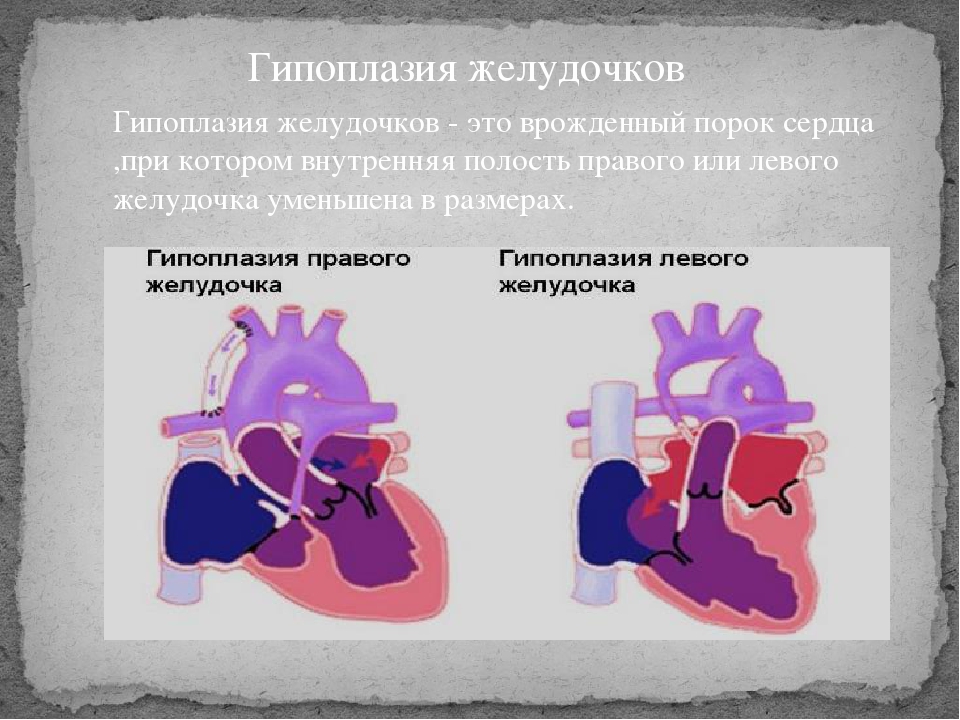 Обратите на скоростную шкалу 25 см/сек
Обратите на скоростную шкалу 25 см/сек
Сагитальный срез через дугу аорты
Для просмотра изображений необходимо войти на сайтДля регистрации ретроградного потока крови в аорте пришлось снизить скоростную шкалу.
Операции на сердце у плода
Операции на сердце у плода — реальность!
Синдром гипоплазии левых отделов сердца – самый сложный порок среди всех врожденных пороков сердца. Дети, рожденные с подобным пороком, живут не более двух недель без операции, а прооперированные малыши требуют серии операций, завершающей из которых будет пересадка сердца. Эти пациенты всю жизнь живут с единственным желудочком сердца, а качество жизни далеко не лучшее. Поэтому, в некоторых медицинских центрах беременным женщинам, ожидающих малыша с синдромом гипоплазии левых отделов сердца предлагают медицинский аборт. Не так давно стало известно, что причиной развития синдрома гипоплазии левых отделов сердца является критический стеноз аортального клапана. Было доказано, что критическое сужение выхода из левого желудочка тормозит его рост и развитие. Дилятация клапана аорты у плода на ранних сроках беременности в некоторых случаях приводит к росту полости левого желудочка и помогает предупредить синдром гипоплазии левых отделов сердца.
Прокол брюшной стенки беременной тоненькой иглой
В данной операции принимает участие мультидисциплинарная команда: кардиолог, врач ультразвуковой диагностики, акушер-гинеколог, анестезиолог и неонатолог. Операцию проводят следующим образом: под контролем УЗИ врач кардиолог прокалывает иглой переднюю брюшную стенку матери, матку, грудную клетку и сердце плода и заводит тоненький проводник в узкий аортальный клапан еще не родившегося малыша. Затем аортальный клапан расширяют с помощью баллончика.
Прокол верхушки сердца плода под контролем ультразвука
Стенозированный клапан раздувают миниатюрным баллоном
Подобные операции уже широко применяют и в Европе. Совсем скоро шанс на нормальное сердце и полноценную жизнь появится и у украинских малышей. В период с 17 по 20 февраля 2016 года в городе Варшава Европейской ассоциацией детских кардиологов проводился обучающий курс, посвященный вмешательствам на сердце у плода, так называемым «фетальным интервенциям». Курс посетили команда врачей из Украины: интервенционные кардиологи и кардиологи института Амосова – Богдан Владимирович Черпак, Наталья Сергеевна Ящук, Александра Павловна Коваль, а также врачи института Акушерства, педиатрии и гинекологии — акушер-гинеколог Юлия Владимировна Давыдова и врач ультразвуковой диагностики Ирина Сергеевна Лукьянова. Так же заключен договор с польскими врачами о взаимном сотрудничестве. Уже весной этого года ведущий фетальный кардиолог доктор Иоанна Дангель (Варшава, Польша), которая провела более 70 вмешательств у плода поможет нашим специалистам в их начинаниях.
В период с 17 по 20 февраля 2016 года в городе Варшава Европейской ассоциацией детских кардиологов проводился обучающий курс, посвященный вмешательствам на сердце у плода, так называемым «фетальным интервенциям». Курс посетили команда врачей из Украины: интервенционные кардиологи и кардиологи института Амосова – Богдан Владимирович Черпак, Наталья Сергеевна Ящук, Александра Павловна Коваль, а также врачи института Акушерства, педиатрии и гинекологии — акушер-гинеколог Юлия Владимировна Давыдова и врач ультразвуковой диагностики Ирина Сергеевна Лукьянова. Так же заключен договор с польскими врачами о взаимном сотрудничестве. Уже весной этого года ведущий фетальный кардиолог доктор Иоанна Дангель (Варшава, Польша), которая провела более 70 вмешательств у плода поможет нашим специалистам в их начинаниях.
Синдром гипоплазии левых отделов сердца. Симптомы, диагностика, лечение
Гипопластический синдром левого сердца является серьезным врожденным пороком сердца, который возникает из-за того, что левая сторона сердца не формируется должным образом в течение жизни плода.
Поражаются как камеры сердца, так и клапанные структуры на левой стороне сердца. Это включает в себя левое предсердие, левый желудочек, митральный клапан, который разделяет эти две камеры, аортальный клапан, который защищает отверстие левого желудочка в аорту и первую или восходящую часть аорты. Все эти структуры кардинально недоразвиты и очень малы по размеру, поэтому не могут функционировать, как ожидалось.
У многих детей с данным заболеванием также присутствует дефект межпредсердной перегородки. Это относится к сохранению отверстия в перегородке, разделяющей две верхние камеры сердца или предсердия. Этот тип отверстия присутствует в жизни плода, но становится патологическим, когда он сохраняется в послеродовой жизни, что приводит к ненормальной связи между предсердиями.
Читайте также: Женский инфаркт не похож на мужской. Проверь себя! Видео
Симптомы
Нормальное сердце имеет четыре камеры: два верхних предсердия (правое и левое) для приема деоксигенированной венозной крови и оксигенированной крови из легких, соответственно, а также два нижних желудочка, которые перекачивают кровь полученную из предсердий в легочную систему.
Однако у ребенка с данным заболеванием неразвитый левый желудочек не может перекачивать насыщенную кислородом кровь в организм. Эта кровь направляется на правую сторону сердца через два отверстия между левой и правой сторонами сердца, которые обычно присутствуют у новорожденного. Их называют открытым овальным отверстием и открытым артериальным протоком. Это позволяет смешивать насыщенную кислородом кровь (из левого сердца) и деоксигенированную кровь (с правой стороны сердца) в правом предсердии и правом желудочке. Эта смесь перекачивается как в легкие, так и в организм через правый желудочек.
Закрытие этих отверстий, которое происходит в течение нескольких дней после рождения, перекрывает этот путь эвакуации и предотвращает попадание оксигенированной крови в системный кровоток у детей. Это связано с тем, что их левый желудочек не способен перекачивать эту кровь через аорту во все тело. У детей без данного заболевания левый желудочек легко приспосабливается к закрытию правого левого канала.
Основные симптомы у младенцев
- диспноэ
- цианоз или наличие синеватого цвета вокруг рта и губ
- быстрое сердцебиение
- слабый пульс
Читайте также: Как укрепить наше сердце
Диагностика и лечение
Этот синдром диагностируется незадолго до рождения. После рождения наличие симптомов сердечно-сосудистых заболеваний в сочетании с шумом в сердце может привести к подозрению на врожденный цианотический порок сердца, подтвержденный эхокардиограммой.
Изначально лечение основывается на диуретиках, дигоксине и антигипертензивных препаратах.
Хирургическое лечение
Окончательное лечение, позволяющее ребенку выжить, является хирургическим и состоит из поэтапных операций. После коррекционной операции требуется пожизненное употребление лекарств. Осложнения могут возникать и сохраняться на протяжении всей жизни пациента. Следовательно, это состояние не излечивается хирургическим путем, а улучшается до такой степени, что пациент может выжить.
Следовательно, это состояние не излечивается хирургическим путем, а улучшается до такой степени, что пациент может выжить.
Читайте также: Как лечить сердечно-сосудисные заболевания?
Фото превью: academyexperts.ru
Синдром гипоплазии левых отделов сердца
Синдром гипоплазии левых отделов сердца – группа морфологически близких дефектов сердца, включающих недоразвитие его левых отделов, атрезию или стеноз аортального и/или митрального клапанного отверстия, резкую гипоплазию восходящей аорты или комбинацию этих дефектов. Проявления синдрома развиваются по мере закрытия артериального протока, в первые сутки жизни новорожденного и характеризуются признаками кардиогенного шока: тахипноэ, одышкой, слабым пульсом, бледностью и цианозом, гипотермией. Диагноз синдрома гипоплазии левых отделов сердца можно предположить на основании двухмерной эхокардиографии, катетеризации сердца, рентгенографии, ЭКГ.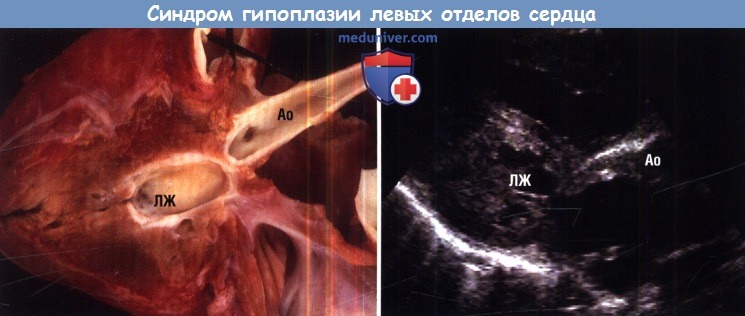 Ведение больных с синдромом гипоплазии левых отделов сердца предполагает инфузию простагландина Е1; проведение ИВЛ, коррекцию метаболического ацидоза; поэтапную хирургическую коррекцию порока (операция Норвуда — операция Гленна или Геми-Фонтена – операция Фонтена).
Ведение больных с синдромом гипоплазии левых отделов сердца предполагает инфузию простагландина Е1; проведение ИВЛ, коррекцию метаболического ацидоза; поэтапную хирургическую коррекцию порока (операция Норвуда — операция Гленна или Геми-Фонтена – операция Фонтена).
Общие сведения
Синдром гипоплазии левых отделов сердца
Причины СГЛОС
Причины гипоплазии левых отделов сердца достоверно неясны. Предполагается возможность аутосомно-рецессивного, аутосомно-доминантного и полигенного типов наследования. Наиболее вероятной является теория мультифакториальной этиологии порока.
Различают два морфологических варианта СГЛОС. Первый (наиболее тяжелый) вариант включает гипоплазию левого желудочка и атрезию устья аорты, которые могут сочетаться с атрезией либо стенозом митрального отверстия; при этом полость левого желудочка щелевидна, ее объем составляет не более 1 мл. При втором (наиболее распространенном) варианте порока имеет место гипоплазия левого желудочка, стеноз устья аорты и гипоплазия ее восходящего отдела в сочетании с митральным стенозом; объем полости левого желудочка равен 1-4,5 мл.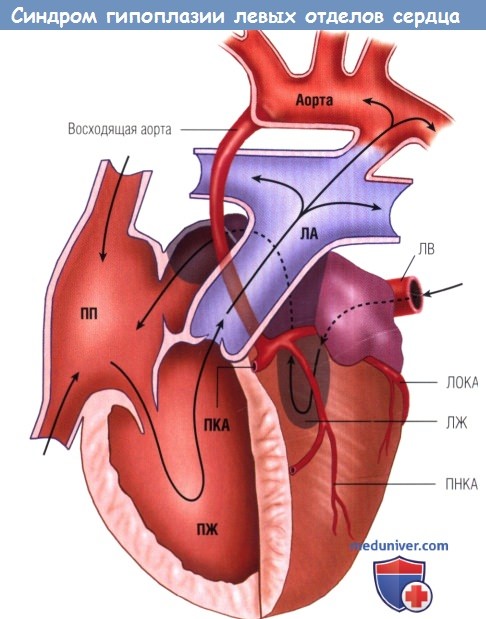
Оба варианта гипоплазия левых отделов сердца сопровождаются наличием широкого открытого артериального протока и открытого овального окна, расширением правых отделов сердца и ствола легочной артерии, гипертрофией миокарда правого желудочка; нередко — фиброэластозом эндокарда.
Особенности гемодинамики
Тяжелые расстройства кровообращения при гипоплазии левых отделов сердца развиваются вскоре после рождения и характеризуются в литературе как «гемодинамическая катастрофа». Сущность нарушения гемодинамики определяется тем фактом, что кровь из левого предсердия не может поступить в гипоплазированный левый желудочек, а вместо этого попадает через открытое овальное окно в правые отделы сердца, где происходит ее смешение с венозной кровью. Эта особенность приводит к объемной перегрузке правых отделов сердца и их дилатации, которые наблюдаются с момента рождения.
В дальнейшем основной объем смешанной крови из правого желудочка поступает в легочную артерию, остальная же часть недонасыщенной кислородом крови через открытый артериальный проток устремляется в аорту и большой круг кровообращения.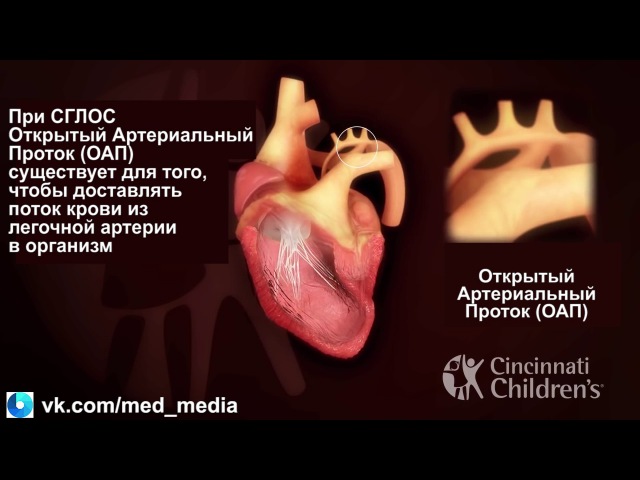 Ретроградным путем небольшое количество крови поступает в гипоплазированную часть восходящей аорты и венечные сосуды.
Ретроградным путем небольшое количество крови поступает в гипоплазированную часть восходящей аорты и венечные сосуды.
Фактически правый желудочек берет на себя двойную функцию, перекачивая кровь в легочный и системный круг кровообращения. Попадание крови в большой круг кровообращения возможно только по артериальному протоку, в связи с чем гипоплазия левых отделов сердца рассматривается как порок с дуктус-зависимым кровообращением. Прогноз для жизни ребенка зависит от сохранения артериального протока открытым.
Тяжелейшие расстройства гемодинамики приводят к выраженной легочной гипертензии вследствие высокого давления в системе сосудов малого круга; артериальной гипотонии, обусловленной неадекватным наполнением большого круга; артериальной гипоксемии, связанной со смешением крови в правом желудочке.
Симптомы СГЛОС
Клинические признаки, указывающие на гипоплазию левых отделов сердца, проявляются в первые часы или сутки после рождения.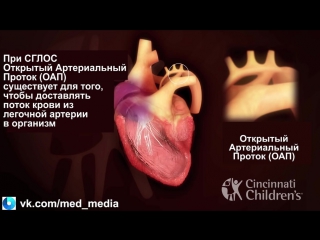 По своим проявлениям они схожи с респираторным дистресс-синдромом или кардиогенным шоком.
По своим проявлениям они схожи с респираторным дистресс-синдромом или кардиогенным шоком.
Как правило, дети с СГЛОС рождаются доношенными. У новорожденных наблюдается адинамия, сероватый цвет кожных покровов, тахипноэ, тахикардия, гипотермия. При рождении цианоз выражен незначительно, однако вскоре нарастает и становится диффузным либо дифференцированным, только на нижней половине туловища. Конечности наощупь холодные, периферическая пульсация на них ослаблена.
С первых дней жизни нарастает сердечная недостаточность с застойными хрипами в легких, увеличением печени, периферическими отеками. Характерно развитие метаболического ацидоза, олигурии и анурии. Нарушение системной циркуляции сопровождается неадекватной церебральной и коронарной перфузией, что приводит к развитию ишемии головного мозга и миокарда. В случае закрытия артериального протока ребенок быстро погибает.
Диагностика
Во многих случаях диагноз синдрома гипоплазии левых отделов сердца ставится еще до рождения ребенка при проведении ЭхоКГ плода. При объективном обследовании новорожденного ребенка определяется слабый пульс на руках и ногах, одышка в покое, усиленный сердечный толчок и видимая эпигастральная пульсация; выслушивается систолический шум изгнания, ритм галопа и одинарный II тон.
При объективном обследовании новорожденного ребенка определяется слабый пульс на руках и ногах, одышка в покое, усиленный сердечный толчок и видимая эпигастральная пульсация; выслушивается систолический шум изгнания, ритм галопа и одинарный II тон.
На ЭКГ отмечается отклонение ЭОС вправо, признаки резкой гипертрофии правых отделов сердца и левого предсердия. Фонокардиография фиксирует наличие низко- или среднеамплитудного систолического шума. Рентгенография грудной клетки при синдроме гипоплазии левых отделов сердца выявляет высокую степень кардиомегалии, шарообразные контуры сердечной тени, усиление легочного рисунка.
Эхокардиография обнаруживает следующие характерные признаки гипоплазии сердца: стеноз устья аорты и ее восходящего отдела, уменьшение размеров левого желудочка и увеличение правого желудочка, грубые изменения митрального клапана.
Зондирование полостей сердца обнаруживает пониженное насыщение крови кислородом в периферических артериях, лево-правый сброс крови на уровне предсердий, повышенное давление в правом желудочке и легочной артерии. Ангиокардиография позволяет визуализировать открытый артериальный проток, гипоплазированную восходящую аорту, резко дилатированный правый желудочек, расширенный легочный ствол и легочные артерии.
Ангиокардиография позволяет визуализировать открытый артериальный проток, гипоплазированную восходящую аорту, резко дилатированный правый желудочек, расширенный легочный ствол и легочные артерии.
Дифференциальный диагноз при синдроме гипоплазии левых отделов сердца необходим с гипоплазией правого желудочка, единственным желудочком сердца, аномальным дренажем легочных вен, транспозицией магистральных сосудов, изолированным аортальным стенозом. Из внесердечных аномалий необходимо исключить острую дыхательную недостаточность, травму черепа, кровоизлияние в мозг.
Лечение СГЛОС
Наблюдение за новорожденными осуществляется в отделении реанимации. Для предупреждения закрытия или попытки открытия артериального протока осуществляется инфузия простагландина Е1. Необходимо проведение ИВЛ, коррекция метаболического ацидоза, введение диуретиков и инотропных препаратов.
Хирургическая коррекция гипоплазии левых отделов сердца проводится поэтапно и последовательно.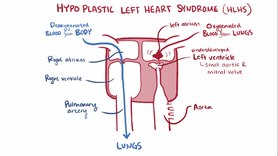 Первый этап лечения – паллиативный; проводится в первые 2 недели жизни и заключается в выполнении операции Норвуда для уменьшения нагрузки на легочную артерию, и в то же время, для обеспечения кровоснабжения аорты. На втором этапе, в возрасте 3-6 месяцев ребенку выполняется операция Геми-Фонтена (или операция Гленна по наложению двухстороннего двунаправленного кава-пульмонального анастомоза). Окончательная гемодинамическая коррекция порока проводится примерно через год путем выполнения операции Фонтена (наложения тотального кавопульмонального анастомоза), позволяющей полностью разобщить круги кровообращения.
Первый этап лечения – паллиативный; проводится в первые 2 недели жизни и заключается в выполнении операции Норвуда для уменьшения нагрузки на легочную артерию, и в то же время, для обеспечения кровоснабжения аорты. На втором этапе, в возрасте 3-6 месяцев ребенку выполняется операция Геми-Фонтена (или операция Гленна по наложению двухстороннего двунаправленного кава-пульмонального анастомоза). Окончательная гемодинамическая коррекция порока проводится примерно через год путем выполнения операции Фонтена (наложения тотального кавопульмонального анастомоза), позволяющей полностью разобщить круги кровообращения.
Прогноз
Порок является крайне неблагоприятным в отношении прогноза. В первый месяц жизни погибает около 90% детей с гипоплазией левых отделов сердца. Выживаемость после 1-го корригирующего этапа составляет 75 %, после 2-го — 95 %, после 3-го — 90 %. В целом через 5 лет после полной коррекции порока в живых остаются 70% детей.
Если гипоплазия левых отделов сердца выявляется у ребенка внутриутробно, ведение беременности и родоразрешение проводится в условиях специализированного перинатального медицинского центра.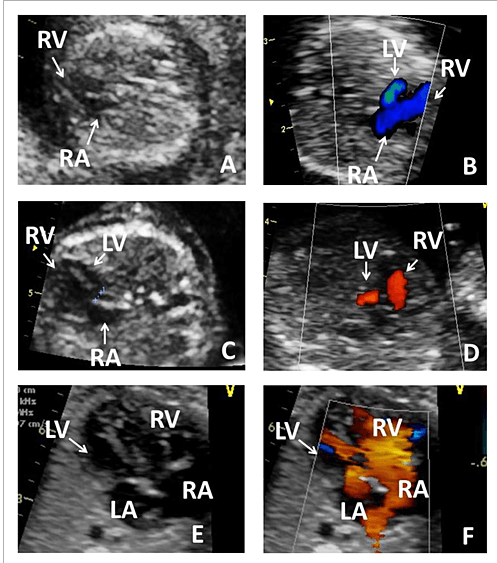 С первых дней жизни ребенок должен находиться под наблюдением неонатолога, детского кардиолога и кардиохирурга для проведения как можно более ранней коррекции порока.
С первых дней жизни ребенок должен находиться под наблюдением неонатолога, детского кардиолога и кардиохирурга для проведения как можно более ранней коррекции порока.
«Лечить ребенка, а не только его сердце». Кардиохирург — о пороках и риске | ЗДОРОВЬЕ: Медицина | ЗДОРОВЬЕ
Болезни сердечно-сосудистой системы уже много лет подряд занимают лидирующую строчку среди основных причин смерти. Нередко главный орган дает сбой не только у взрослых, но и у детей. «Настраивать» работу маленького сердца на операционном столе иногда приходится в первые часы после рождения ребенка.
Можно ли предотвратить пороки сердца, почему важно планировать беременность и случается ли чудо на операционном столе, корреспондент «АиФ-Тюмень» узнал у главного кардиохирурга Тюменской области Кирилла Горбатикова.
Сразу после рождения
Сирень Бабаева, «АиФ-Тюмень»: За вашими плечами тысячи операций на сердце.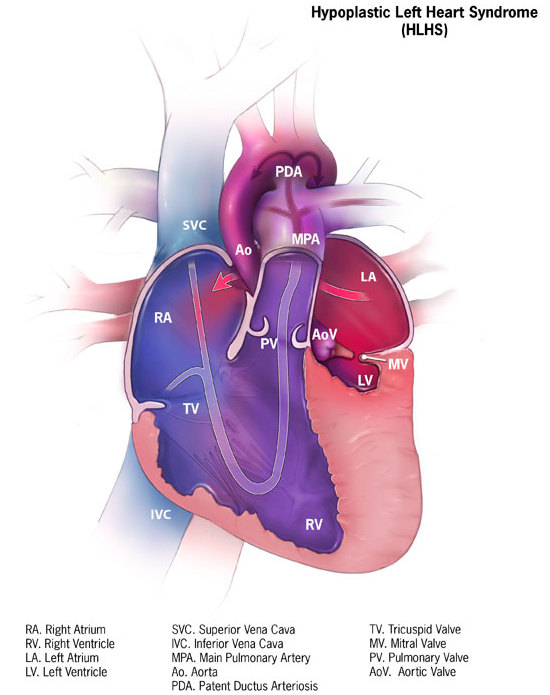 Говорят, с годами врачи становятся циничными, и уже нет того волнения, которое бывает в первое время. Что для вас сегодня значит больной? Это человек со своей бедой, историей или просто интересный клинический случай?
Говорят, с годами врачи становятся циничными, и уже нет того волнения, которое бывает в первое время. Что для вас сегодня значит больной? Это человек со своей бедой, историей или просто интересный клинический случай?
Кирилл Горбатиков: Безусловно, это маленький человек со своей бедой. Это не ребенок с больным сердцем, а больной малыш. Залог успеха — лечить ребенка, а не только сердце. Вылечить и выходить его — самое важное, но, к сожалению, детской реабилитации в нашей стране как таковой нет. Хотя по всей России уже на уровне Минздрава и законодательной власти идут разговоры о том, что необходимо создать детские реабилитационные центры после операции на сердце, эти пациенты нуждаются в особом наблюдении. Как показывает мировая практика, после операций на сердце ребенок должен находиться в поле зрения врачей, а есть хирургические вмешательства, после которых из больницы на Западе детей не выписывают. Положена следующая операция через три месяца, и все это время он проводит в стационаре.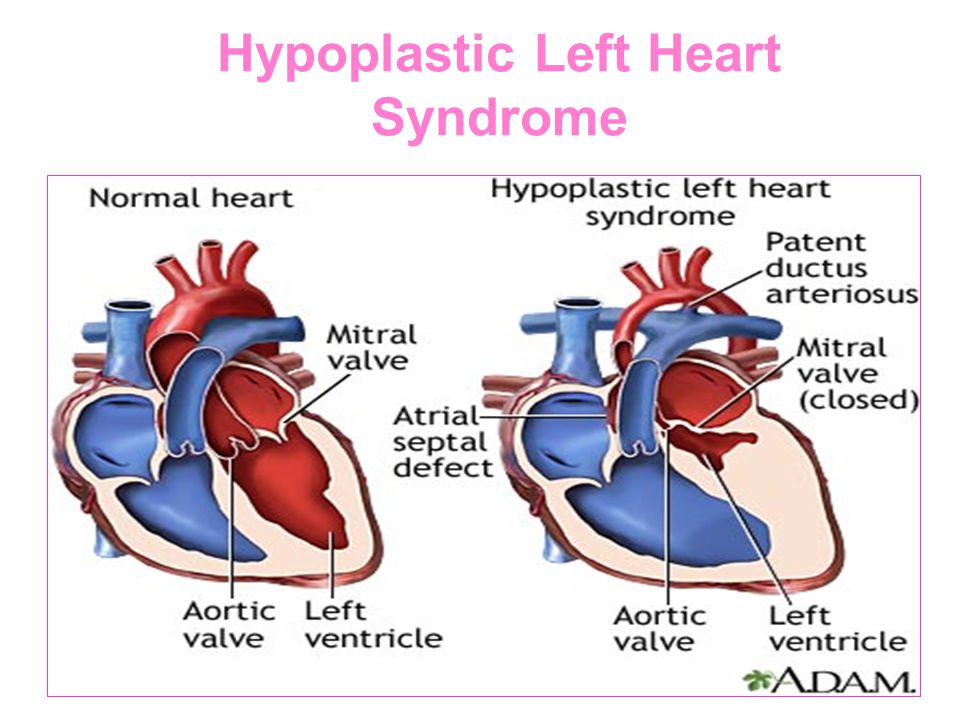 Сейчас назрела необходимость создания центра детской реабилитации. Эти пациенты должны быть под наблюдением детского кардиолога, чтобы знать, есть или нет сердечная недостаточность, в каких медикаментах они нуждаются, нужно ли лечение других органов. Радикальная операция необходима или просто подготовка к ней. Это целая наука, направление, которое существует во всем мире.
Сейчас назрела необходимость создания центра детской реабилитации. Эти пациенты должны быть под наблюдением детского кардиолога, чтобы знать, есть или нет сердечная недостаточность, в каких медикаментах они нуждаются, нужно ли лечение других органов. Радикальная операция необходима или просто подготовка к ней. Это целая наука, направление, которое существует во всем мире.
— Пациентов у вас с каждым годом прибавляется? Какова тенденция?
— Тенденция стабильна. Примерно у 13 детей из 1 тыс. новорожденных есть пороки сердца. Помимо пороков, увеличивается количество воспалительных заболеваний сердечной мышцы у новорожденных, так называемые внутриутробные кардиты.
— А в чем причина роста таких отклонений?
— Непланируемые беременности. Дело в том, что из года в год как на дрожжах растет число внутриутробных инфекций у беременных.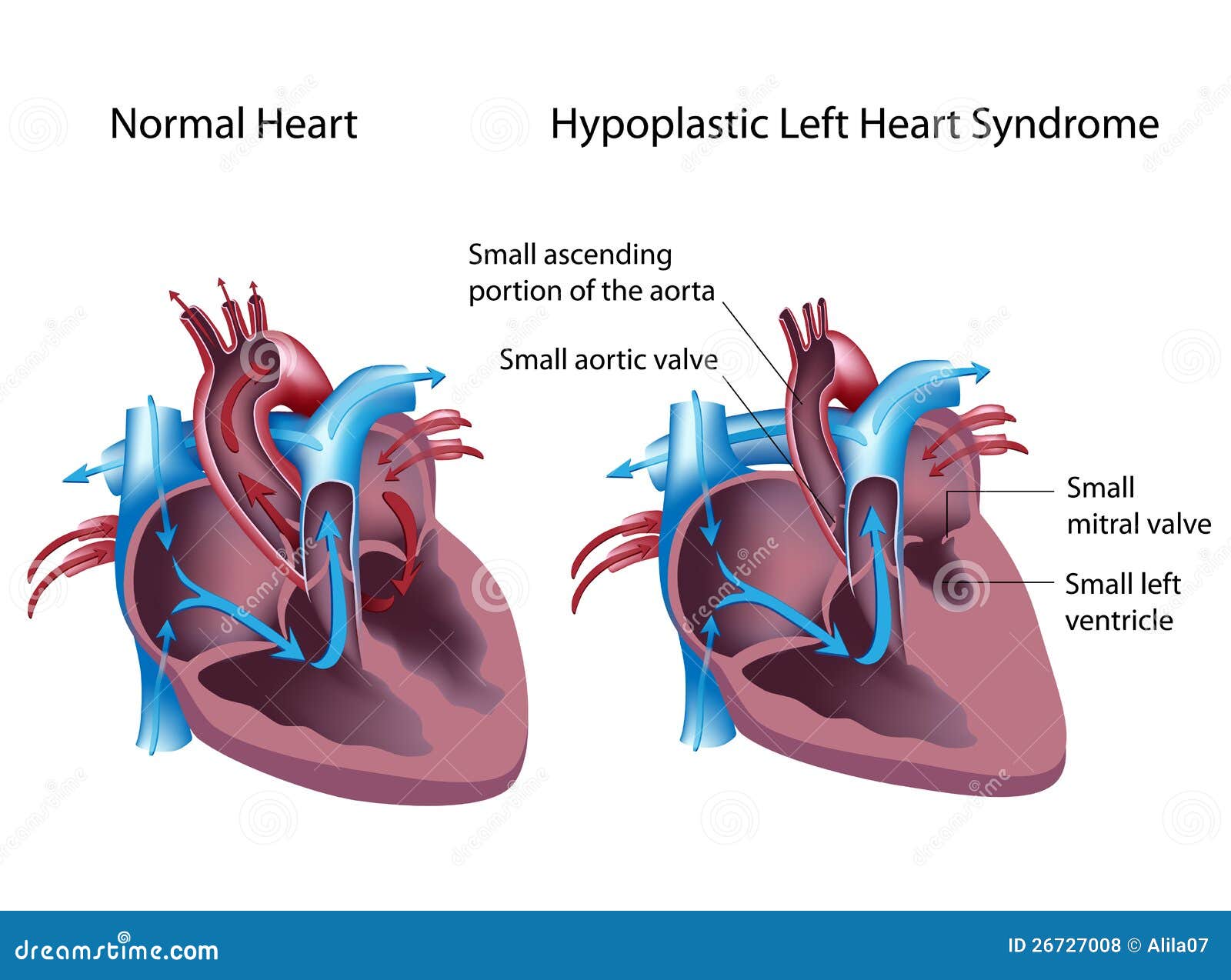 Перед тем как забеременеть, надо сдать хотя бы мазок и избавиться от ненужной микрофлоры. В противном случае рождается ребенок с тяжелыми воспалительными изменениями сердечной мышцы. Плюсом к этому всегда идут проблемы с другими органами. Та флора, которая поражает сердечную мышцу, поражает и кишечник, и почки, и даже головной мозг.
Перед тем как забеременеть, надо сдать хотя бы мазок и избавиться от ненужной микрофлоры. В противном случае рождается ребенок с тяжелыми воспалительными изменениями сердечной мышцы. Плюсом к этому всегда идут проблемы с другими органами. Та флора, которая поражает сердечную мышцу, поражает и кишечник, и почки, и даже головной мозг.
У таких детей нет порока сердца, но есть воспаление сердечной мышцы, которое потом, даже вылеченное, выливается в кардиосклероз. И тогда без операции уже не обойтись. Как правило, возникает поражение клапанов сердца, которые вылечить хирургически очень непросто. Операции на клапанах у детей — это четвертая категория сложности из пяти, она — самая сложная. К ней относятся новорожденные с комбинированными пороками сердца, когда операция должна быть сделана в первые несколько суток после рождения. Совсем недавно у меня был такой пациент с транспозицией магистральных сосудов, когда они перепутаны местами. Его привезли к нам в первые часы после рождения, поставили диагноз и тут же сделали очень непростую операцию. В противном случае он бы умер в течение нескольких суток. Как правило, такие дети не переживают 48 часов.
В противном случае он бы умер в течение нескольких суток. Как правило, такие дети не переживают 48 часов.
— Что вы испытываете, когда берете в руки маленькое сердце, есть ли волнение?
— Ответственность. Очень большую ответственность. Волнение есть всегда. Но оно бывает разным. У кого-то опускаются руки, появляется страх. А здесь такое волнение, от которого кровь приятно закипает, ты собран, осторожен и стараешься все сделать очень хорошо, иначе нельзя. Выживаемость этих детей на 100% зависит от того, как сделана операция, насколько качественно. Если, пришивая коронарный сосуд диаметром меньше миллиметра, немного сместишь его швами по оси, в течение первых суток ребенок умрет от тяжелого инфаркта миокарда. Надо быть собранным, потому что от того, как и какие швы ты наложишь, зависит жизнь ребенка.
Кирилл Горбатиков (крайний справа). Фото: ОКБ 1 Тюмень— Пороки сердца у детей — одна из самых частых причин для срочной операции. Можно ли их как-то предугадать?
Можно ли их как-то предугадать?
— Можно, есть целая группа пороков, связанных с генетическими аномалиями. Мы знаем, что две камеры в сердце вместо четырех почти в 30% случаях бывают при болезни Дауна. Если маме сделали анализ и сказали о том, что у нее родится ребенок с таким недугом, а она решила во что бы то ни стало рожать, то нужно быть готовой еще к тому, что у малыша, помимо прочего, будут проблемы с сердцем, понадобится большая и очень сложная операция. Если ребенку ставят генетический порок, то эту беременность лучше прервать. У него обязательно, помимо основной болезни, будут еще сопутствующие проблемы со здоровьем.
Часто пороки сердца плода видны на УЗИ. Конечно, не во всех случаях нужно прерывать беременность. Однако есть такие недуги, как, например, гипоплазия левых отделов сердца. Когда вместо левого и правого желудочка у ребенка только один правый желудочек. Вся его жизнь будет чередой поэтапных операций, а максимальная разрешенная активность — сидеть за компьютером. В таких случаях мы всегда спрашиваем у женщины: готова ли она свою жизнь положить на алтарь этого ребенка, готова ли к тому, что, скорее всего, муж уйдет из семьи. К сожалению, мужчины — это бегуны на короткую дистанцию, согласно мировой статистике, в 70% случаях браки, в которых есть больной ребенок, распадаются.
В таких случаях мы всегда спрашиваем у женщины: готова ли она свою жизнь положить на алтарь этого ребенка, готова ли к тому, что, скорее всего, муж уйдет из семьи. К сожалению, мужчины — это бегуны на короткую дистанцию, согласно мировой статистике, в 70% случаях браки, в которых есть больной ребенок, распадаются.
— И как будущие мамы реагируют на такие беседы? Соглашаются или надеются на чудо?
— В основном, надеются на чудо.
— Оно происходит?
— Что-то я не помню. Если порок сердца в виде дырочки в перегородке, есть какие-то проблемы с аортой, мы вылечим, все будет хорошо. Но если у ребенка нет половины сердца, то оно уже не вырастет.
«Атомный взрыв»
— Бывает, что при беременности не находят никаких отклонений в здоровье ребенка, а после рождения — серьезный недуг. Почему так происходит?
— Причина одна — недоглядели. На УЗИ в 14 недель видны только грубые пороки, и то, кто-то видит их, кто-то нет. На втором УЗИ, примерно в 20 недель, все проблемы как на ладони, но, увы, оно делается не в перинатальном центре, а в поликлиниках по месту жительства. Последнее УЗИ, в 30-32 недели, тоже делают в небольших медучреждениях, где могут просмотреть имеющиеся пороки. В итоге рождается ребенок с серьезным недугом, при смерти, мама в шоке. Поэтому очень важно делать УЗИ в перинатальных центрах у хороших врачей. Даже у самого лучшего врача информативность ультразвукового исследования составляет 80%. Мы много раз поднимали эту проблему, обсуждали, но пока ничего не решается. Особенно важен второй скрининг. По результатам которого, мы будем либо готовиться к рождению особенного ребенка, либо предложим прервать беременность.
На УЗИ в 14 недель видны только грубые пороки, и то, кто-то видит их, кто-то нет. На втором УЗИ, примерно в 20 недель, все проблемы как на ладони, но, увы, оно делается не в перинатальном центре, а в поликлиниках по месту жительства. Последнее УЗИ, в 30-32 недели, тоже делают в небольших медучреждениях, где могут просмотреть имеющиеся пороки. В итоге рождается ребенок с серьезным недугом, при смерти, мама в шоке. Поэтому очень важно делать УЗИ в перинатальных центрах у хороших врачей. Даже у самого лучшего врача информативность ультразвукового исследования составляет 80%. Мы много раз поднимали эту проблему, обсуждали, но пока ничего не решается. Особенно важен второй скрининг. По результатам которого, мы будем либо готовиться к рождению особенного ребенка, либо предложим прервать беременность.
— Говорят, у маленьких детей способности к восстановлению выше, это так?
— У них колоссальные способности к восстановлению, но болеют они гораздо тяжелее, чем взрослые. Этап восстановления, выхаживания у них более тяжелый. Ребенок только родился, ему нужно адаптироваться к жизни, а ему сделали операцию, запустили искусственное кровообращение, которое для маленького организма по воздействию, словно атомный взрыв. Этот этап, когда станет ясно: выживет или нет — может продлиться до двух-трех месяцев.
Этап восстановления, выхаживания у них более тяжелый. Ребенок только родился, ему нужно адаптироваться к жизни, а ему сделали операцию, запустили искусственное кровообращение, которое для маленького организма по воздействию, словно атомный взрыв. Этот этап, когда станет ясно: выживет или нет — может продлиться до двух-трех месяцев.
— Ваши пациенты в основном новорожденные?
— Не всегда. Детская кардиохирургия во многом — это этапная хирургия. Мы прооперировали порок сердца, все скорректировали, но у 20% все равно возникает недоразвитие клапана легочной артерии, он начинает дегенерировать, и надо делать повторную операцию. Сегодня кардиохирургию можно разделить на две группы: дети до года, и дети старше восьми-десяти лет. Середины нет. Все, что было посередине, мы сейчас корректируем до года.
Существует более 200 разновидностей пороков сердца, 80% не требуют больше никаких вмешательств, сделал — забыл. Но с 20% до 18 лет надо работать дальше.
— Не всегда операция заканчивается удачно. Что чувствуете, когда сердце не начинает биться вновь?
— Горечь, разочарование. Начинаешь копаться в себе. Но хирургии без летального случая в мире не бывает. Есть пороки сердца, где в Европе и Америке смертность достигает 15%. Все сделано хорошо, но умирают по другим причинам.
Ценить чужую жизнь
— Операции на сердце — всегда риск, а вы рисковый человек?
— Конечно. У меня такое правило: умеешь рисковать чужой жизнью, умей рисковать и своей. Это нужно как раз для того, чтобы пациенты не превращались в «интересный клинический случай».
Я достаточно активно прыгаю с парашютом, занимаюсь глубоководным дайвингом. Когда ты сам проходишь по грани, очень четко начинаешь ценить чужую жизнь. У меня было много раз, когда отказывал основной парашют и приходилось запускать запасной. Это очень страшно, ты ведь понимаешь, что он последний, больше нет. А земля близка, и ты падаешь со скоростью 200 км/ч.
Я всегда надеваю перчатку с левой руки
— А есть какие-то дооперационные «ритуалы», которые не нарушаете никогда?
— Я всегда надеваю перчатку с левой руки. Мои учителя делали так, и я также делаю.
— В операционной у вас всегда играет музыка. Зачем и для кого?
— Да, играет… Мягкая, ненавязчивая классическая музыка: Вивальди, Моцарт. Хард-рок здесь не подойдет. Металлика тоже. Но есть в плей-листе и группа «Белый орел», особая песня «Я куплю тебе новую жизнь». Она очень ласкает слух, когда операция заканчивается хорошо. Операция — это всегда напряженные нервы, и не только у хирурга, у всей бригады. У стола приходится стоять порой по восемь часов, а у хирурга нет «сменного пилота». Поэтому музыкальное сопровождение помогает немного снять напряжение.
— Есть мнение, что самые верующие среди врачей — хирурги. Вы можете это подтвердить?
— Да, безусловно, это так./57/57.jpg) Есть вещи, которым материалистического объяснения нет. Хоть застрелись. У меня есть знакомые, которые занимаются ядерной физикой: глубоко верующие люди. Хотя, казалось бы, наука, только факты. Но и там есть необъяснимые вещи. Если взять теорию перекисного окисления липидов, которая лежит в основе современной биохимии, то никто не знает, куда исчезают два протона водорода. Испариться они не могут, но их нет, и все.
Есть вещи, которым материалистического объяснения нет. Хоть застрелись. У меня есть знакомые, которые занимаются ядерной физикой: глубоко верующие люди. Хотя, казалось бы, наука, только факты. Но и там есть необъяснимые вещи. Если взять теорию перекисного окисления липидов, которая лежит в основе современной биохимии, то никто не знает, куда исчезают два протона водорода. Испариться они не могут, но их нет, и все.
— Бывает, что во время операции вы мысленно обращаетесь за поддержкой к Богу?
— Конечно. Порой, надежда остается только на Всевышнего. В самых тяжелых случаях я мысленно прошу помощи.
— Помогает?
— Иногда, да. Иногда.
Кирилл Горбатиков. Фото: ОКБ 1 Тюмень Кирилл Горбатиков — заслуженный работник здравоохранения Тюменской области. С 2001 года — заведующий отделением врожденных пороков сердца и детской кардиологии на ГБУЗ ТО ОКБ №1, по сегодняшний день. С 2006 года — главный кардиохирург департамента здравоохранения Тюменской области. С 2010 года — профессор кафедры ФПК и ППС ТГМУ. Заведующий курсом Сердечно-сосудистой хирургии. Лауреат премии им. Академика РАМН В. И. Бураковского. Государственная награда республики Казахстан «Шапагат» (милосердие) и др.
С 2010 года — профессор кафедры ФПК и ППС ТГМУ. Заведующий курсом Сердечно-сосудистой хирургии. Лауреат премии им. Академика РАМН В. И. Бураковского. Государственная награда республики Казахстан «Шапагат» (милосердие) и др.Гипоплазия левых отделов сердца х. Синдром гиполазии левого отдела сердца — серьезное заболевание с возможностью коррекции. Лечение синдрома гипоплазии левых отделов сердца
В этой статье я немного отойду от тематики врождённых пороков развития конечностей детей и расскажу ещё о некоторых видах аплазии и гипоплазии. Однако на этот раз речь идёт не о конечности, а о сердце. Гипоплазия сердца — это врождённое недоразвитие органа. В отличии от конечностей, сердце ребёнка начинает биться с самого начала беременности, поэтому оно выполняет важнейшие функции не только у родившегося ребёнка, а также и у плода, который находится в утробе матери. Именно поэтому гипоплазия и аплазия сердца (то есть всего органа) у родившихся детей не встречается, потому что плод с не функционирующим сердцем не может дожить до момента рождения.
Однако, существуют гипоплазии отдельных отделов сердца — при таком пороке развития сердца оно может частично выполнять свои функции, такие дети рождаются жизнеспособными, однако их дальнейшая жизнь находится в опасности, и во многих случаях для спасения жизни ребёнка требуется экстренная кардиохирургическая операция .
Наиболее часто встречаются гипоплазии правых или левых отделов сердца , а также аплазия (гипоплазия) сердечных клапанов . В случае аплазии сердечного клапана, у ребёнка полностью или частично отсутствие один или несколько сердечных клапанов. Если при этом сохраняется поток крови через отсутствующий клапан, то соответствующие отделы сердца могут функционировать без клапана, за счёт других нормально функционирующих клапанов. Однако в процессе роста и развития ребёнка у него могут начаться нарушения гемодинамики и постепенно будет нарастать сердечная недостаточность. Поэтому в подобных случаях может потребоваться кардиохирургическое протезирование сердечного клапана .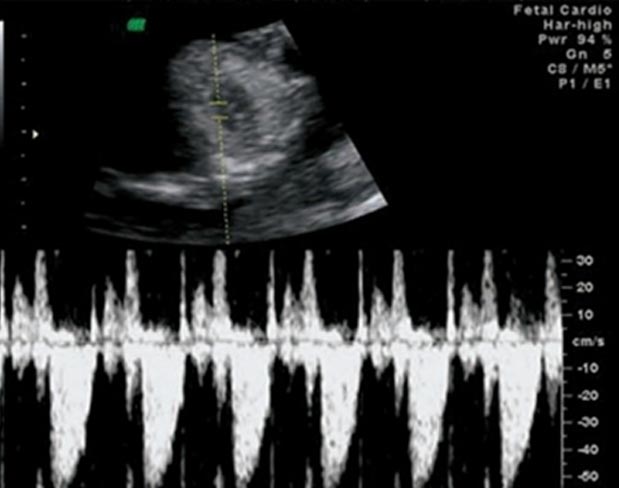
Гипоплазия правых или левых отделов сердца — это гораздо более серьёзная ситуация. При такой гипоплазии не развит один из отделов сердца — предсердия или желудочки. Наиболее известны диагнозы: гипоплазия правых отделов сердца, гипоплазия левых отделов сердца или аплазия межжелудочковой (межпредсердной) перегородки. Следует заметить, что гипоплазия отделов сердца может сопровождаться гипоплазией или аплазией соответствующих клапанов и артерий.
Гипоплазия правых отделов сердца — это недоразвитие правого желудочка и правого предсердия, которые отвечают за работу малого легочного круга кровообращения. При таком пороке ребёнку может потребоваться срочная кардиохирургическая операция сразу после рождения. В процессе операции кардиохирург должен решить задачу по восстановления нормального кровоснабжения легких, для того чтобы ребёнок мог нормально дышать. Зачастую это не возможно решить в процессе одной операции и может потребоваться несколько этапов оперативного вмешательства.
Гипоплазия левых отделов сердца (ГЛОС) — это ещё более серьёзный диагноз. В этом случае у ребёнка наблюдается недоразвитие левых отделов сердца, которые отвечают за снабжение кровью всего организма и всех органов (кроме лёгких). В таком состоянии ребёнок не сможет жить без операции. Однако даже после проведения операции могут быть проблемы, связанные с тем что сохранившиеся правые отделы сердца анатомически слабые и не могут работать за двоих, обеспечивая кровоснабжение лёгких и всего организма. Поэтому такой диагноз трудно поддаётся хирургической коррекции.
Аплазия сердечной перегородки — это врождённое отсутствие межпредсердной или межжелудочковой перегородок. При таком диагнозе левый и правые желудочки или предсердия не разделены между собой, поэтому чаще говорят что у ребёнка присутствует единый (общий) желудочек или предсердие. В этом случае также необходима кардиохирургическая коррекция порока сердца путём восстановления отсутствующей перегородки, либо гемодинамическая коррекция кровоснабжения таким образом, чтобы обеспечить кровоснабжения как всего организма, так и легочной системы.
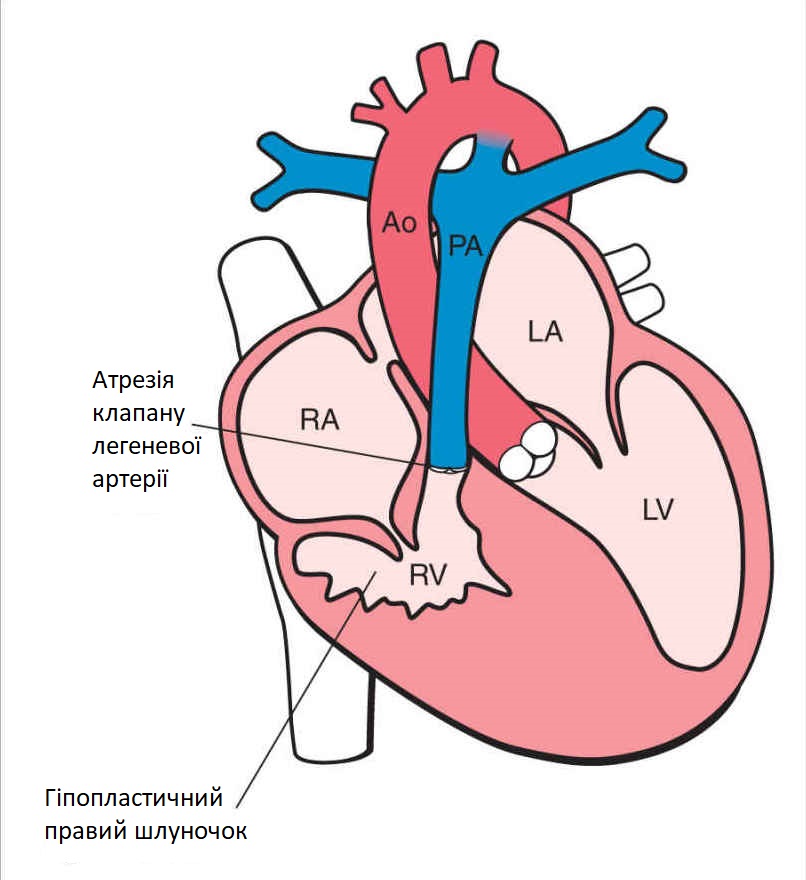
Аплазия аорты или легочной артерии — это тоже довольно серьёзный диагноз, который представляет из себя недоразвитие или отсутствие магистрального сосуда — аорты или легочной артерии. В этих случаях также необходима срочная операция, однако не всегда удаётся хорошо восстановить отсутствующий кровеносный сосуд. В некоторых случаях, у ребёнка вместо отсутствующей легочной артерии имеются обходные пути для кровоснабжения лёгких через дополнительные маленькие сосуды. Их называют большие аорто-легочные коллатерали (БАЛКИ). Эти обходные пути позволяют отсрочить необходимость проведения операции, однако они не могут полностью заменить отсутствующую артерию — потому операция всё равно понадобится, но позже.
Существует два принципиально разных способа хирургической коррекции гипоплазии отделов сердца. Наиболее предпочтительным видом хирургической коррекции является радикальная операция, при которой с помощью пластики и протезирования восстанавливается функционирование гипоплазированных отделов. Однако не всегда есть возможность сделать радикальную коррекцию, и тогда кардиохирурги применяют гемодинамическую коррекцию . Смысл гемодинамической коррекции заключается в том, что система кровообращения человека изменяется таким образом, чтобы легочной и системный круг кровообращения были изолированны друг от друга, но в то же время оба круга работали от одного нормально функционирующего отдела сердца (либо от единого желудочка в случае аплазии межжелудочковой перегородки). При этом кровь от сердца сначала поступает ко всем органам и тканям организма, после чего обеднённая кислородом кров поступает в легочную систему для газообмена. Такая гемодинамическая коррекция не является радикальной, то есть ребёнок не становится абсолютно здоровым, однако после такой коррекции, дети могут жить практически полноценной жизнью. Более подробно почитать о лечении различных видов гипоплазии и аплазии сердца можно на форуме родителей детей с ВПС . На форуме «Доброе сердце» мамы детей с различными пороками сердца со всех уголков нашей страны и не только.
Однако не всегда есть возможность сделать радикальную коррекцию, и тогда кардиохирурги применяют гемодинамическую коррекцию . Смысл гемодинамической коррекции заключается в том, что система кровообращения человека изменяется таким образом, чтобы легочной и системный круг кровообращения были изолированны друг от друга, но в то же время оба круга работали от одного нормально функционирующего отдела сердца (либо от единого желудочка в случае аплазии межжелудочковой перегородки). При этом кровь от сердца сначала поступает ко всем органам и тканям организма, после чего обеднённая кислородом кров поступает в легочную систему для газообмена. Такая гемодинамическая коррекция не является радикальной, то есть ребёнок не становится абсолютно здоровым, однако после такой коррекции, дети могут жить практически полноценной жизнью. Более подробно почитать о лечении различных видов гипоплазии и аплазии сердца можно на форуме родителей детей с ВПС . На форуме «Доброе сердце» мамы детей с различными пороками сердца со всех уголков нашей страны и не только. А для общения и обмена опытом взрослых пациентов, существует специализированный
А для общения и обмена опытом взрослых пациентов, существует специализированный
– группа морфологически близких дефектов сердца, включающих недоразвитие его левых отделов, атрезию или стеноз аортального и/или митрального клапанного отверстия, резкую гипоплазию восходящей аорты или комбинацию этих дефектов. Проявления синдрома развиваются по мере закрытия артериального протока, в первые сутки жизни новорожденного и характеризуются признаками кардиогенного шока: тахипноэ, одышкой, слабым пульсом, бледностью и цианозом, гипотермией. Диагноз синдрома гипоплазии левых отделов сердца можно предположить на основании двухмерной эхокардиографии, катетеризации сердца, рентгенографии, ЭКГ. Ведение больных с синдромом гипоплазии левых отделов сердца предполагает инфузию простагландина Е1; проведение ИВЛ, коррекцию метаболического ацидоза; поэтапную хирургическую коррекцию порока (операция Норвуда — операция Гленна или Геми-Фонтена – операция Фонтена).
Общие сведения
Синдром гипоплазии левых отделов сердца (СГЛОС) – термин, используемый для обозначения критического врожденного порока сердца , характеризующегося резким недоразвитием его левых камер и восходящей части аорты, а также митральным или аортальным стенозом . Синдром входит в пятерку наиболее часто встречающихся в кардиологии ВПС, наряду с дефектом межжелудочковой перегородки, транспозицией магистральных сосудов , тетрадой Фалло и коарктацией аорты . СГЛОС составляет 2-4% от всех встречающихся врожденных аномалий сердца, являясь ведущей причиной гибели новорожденных в первые дни и недели жизни. Мальчики страдают данным сочетанным пороком сердца в 2 раза чаще, чем девочки.
Синдром входит в пятерку наиболее часто встречающихся в кардиологии ВПС, наряду с дефектом межжелудочковой перегородки, транспозицией магистральных сосудов , тетрадой Фалло и коарктацией аорты . СГЛОС составляет 2-4% от всех встречающихся врожденных аномалий сердца, являясь ведущей причиной гибели новорожденных в первые дни и недели жизни. Мальчики страдают данным сочетанным пороком сердца в 2 раза чаще, чем девочки.
Причины СГЛОС
Причины гипоплазии левых отделов сердца достоверно неясны. Предполагается возможность аутосомно-рецессивного, аутосомно-доминантного и полигенного типов наследования. Наиболее вероятной является теория мультифакториальной этиологии порока.
Различают два морфологических варианта СГЛОС. Первый (наиболее тяжелый) вариант включает гипоплазию левого желудочка и атрезию устья аорты, которые могут сочетаться с атрезией либо стенозом митрального отверстия; при этом полость левого желудочка щелевидна, ее объем составляет не более 1 мл. При втором (наиболее распространенном) варианте порока имеет место гипоплазия левого желудочка, стеноз устья аорты и гипоплазия ее восходящего отдела в сочетании с митральным стенозом; объем полости левого желудочка равен 1-4,5 мл.
Оба варианта гипоплазия левых отделов сердца сопровождаются наличием широкого открытого артериального протока и открытого овального окна , расширением правых отделов сердца и ствола легочной артерии, гипертрофией миокарда правого желудочка; нередко — фиброэластозом эндокарда .
Особенности гемодинамики
Тяжелые расстройства кровообращения при гипоплазии левых отделов сердца развиваются вскоре после рождения и характеризуются в литературе как «гемодинамическая катастрофа». Сущность нарушения гемодинамики определяется тем фактом, что кровь из левого предсердия не может поступить в гипоплазированный левый желудочек, а вместо этого попадает через открытое овальное окно в правые отделы сердца, где происходит ее смешение с венозной кровью. Эта особенность приводит к объемной перегрузке правых отделов сердца и их дилатации, которые наблюдаются с момента рождения.
В дальнейшем основной объем смешанной крови из правого желудочка поступает в легочную артерию, остальная же часть недонасыщенной кислородом крови через открытый артериальный проток устремляется в аорту и большой круг кровообращения. Ретроградным путем небольшое количество крови поступает в гипоплазированную часть восходящей аорты и венечные сосуды.
Ретроградным путем небольшое количество крови поступает в гипоплазированную часть восходящей аорты и венечные сосуды.
Фактически правый желудочек берет на себя двойную функцию, перекачивая кровь в легочный и системный круг кровообращения. Попадание крови в большой круг кровообращения возможно только по артериальному протоку, в связи с чем гипоплазия левых отделов сердца рассматривается как порок с дуктус-зависимым кровообращением. Прогноз для жизни ребенка зависит от сохранения артериального протока открытым.
Тяжелейшие расстройства гемодинамики приводят к выраженной легочной гипертензии вследствие высокого давления в системе сосудов малого круга; артериальной гипотонии , обусловленной неадекватным наполнением большого круга; артериальной гипоксемии, связанной со смешением крови в правом желудочке.
Симптомы СГЛОС
Клинические признаки, указывающие на гипоплазию левых отделов сердца, проявляются в первые часы или сутки после рождения. По своим проявлениям они схожи с респираторным дистресс-синдромом или кардиогенным шоком .
Как правило, дети с СГЛОС рождаются доношенными. У новорожденных наблюдается адинамия, сероватый цвет кожных покровов, тахипноэ, тахикардия , гипотермия . При рождении цианоз выражен незначительно, однако вскоре нарастает и становится диффузным либо дифференцированным, только на нижней половине туловища. Конечности наощупь холодные, периферическая пульсация на них ослаблена.
С первых дней жизни нарастает сердечная недостаточность с застойными хрипами в легких, увеличением печени, периферическими отеками. Характерно развитие метаболического ацидоза, олигурии и анурии. Нарушение системной циркуляции сопровождается неадекватной церебральной и коронарной перфузией, что приводит к развитию ишемии головного мозга и миокарда. В случае закрытия артериального протока ребенок быстро погибает.
Диагностика
Во многих случаях диагноз синдрома гипоплазии левых отделов сердца ставится еще до рождения ребенка при проведении ЭхоКГ плода. При объективном обследовании новорожденного ребенка определяется слабый пульс на руках и ногах, одышка в покое, усиленный сердечный толчок и видимая эпигастральная пульсация; выслушивается систолический шум изгнания, ритм галопа и одинарный II тон.
Лечение СГЛОС
Наблюдение за новорожденными осуществляется в отделении реанимации. Для предупреждения закрытия или попытки открытия артериального протока осуществляется инфузия простагландина Е1. Необходимо проведение ИВЛ, коррекция метаболического ацидоза, введение диуретиков и инотропных препаратов.
Хирургическая коррекция гипоплазии левых отделов сердца проводится поэтапно и последовательно. Первый этап лечения – паллиативный; проводится в первые 2 недели жизни и заключается в выполнении операции Норвуда для уменьшения нагрузки на легочную артерию, и в то же время, для обеспечения кровоснабжения аорты. На втором этапе, в возрасте 3-6 месяцев ребенку выполняется операция Геми-Фонтена (или операция Гленна по наложению двухстороннего двунаправленного кава-пульмонального анастомоза). Окончательная гемодинамическая коррекция порока проводится примерно через год путем выполнения операции Фонтена (наложения тотального кавопульмонального анастомоза), позволяющей полностью разобщить круги кровообращения.
Прогноз
Порок является крайне неблагоприятным в отношении прогноза. В первый месяц жизни погибает около 90% детей с гипоплазией левых отделов сердца. Выживаемость после 1-го корригирующего этапа составляет 75 %, после 2-го — 95 %, после 3-го — 90 %. В целом через 5 лет после полной коррекции порока в живых остаются 70% детей.
Если гипоплазия левых отделов сердца выявляется у ребенка внутриутробно, ведение беременности и родоразрешение проводится в условиях специализированного перинатального медицинского центра. С первых дней жизни ребенок должен находиться под наблюдением неонатолога, детского кардиолога и кардиохирурга для проведения как можно более ранней коррекции порока.
Федоров Леонид Григорьевич
Синдром гипоплазии левых отделов сердца является опасной патологией. Она возникает еще во внутриутробном периоде. В этом состоянии сердце недостаточно сформировано, из-за чего нормальное кровообращение невозможно. Органы и ткани страдают от недостаточного поступления крови, и новорожденный гибнет в течение первых дней жизни. Но, если успеют провести хирургическую коррекцию аномалии, ребенок может выжить. Сделать это должны в течение первых недель жизни.
Но, если успеют провести хирургическую коррекцию аномалии, ребенок может выжить. Сделать это должны в течение первых недель жизни.
Что это за проблема
Для синдрома характерна недостаточность в развитии левой части органа. Также с отклонениями и восходящая часть аорты. Сопутствует патологии сужение сердечных клапанов, что еще больше усугубляет ситуацию.
Заболевание выявляют у четырех процентов детей, рожденных с .
Из-за чего возникает
Отклонение возникает в процессе формирования органов плода. Точные причины порока ученым выяснить, еще не удалось.
Риск развития проблемы повышается, если на организм женщины в период вынашивания ребенка влияют негативные факторы. Это может произойти:
- если будущая мать употребляет спиртосодержащие напитки и наркотики;
- если организм попал под воздействие ионизирующего излучения;
- под влиянием употребления некоторых медикаментов;
- после перенесенных инфекционных процессов, среди которых грипп, краснуха;
- в результате проживания в неблагоприятных экологических условиях.

Немалую роль в формировании патологического состояния отводят наследственной предрасположенности.
Классификация
Протекать патологический процесс может в нескольких вариантах:
- СГЛОС или гипоплазия левых отделов сердца и атрезия устья аорты.
- В сочетании со стенозом и гипоплазией устья аорты.
Каждый случай представляет серьезную опасность для жизни малыша.
Гемодинамика
После того как ребенок появился на свет, врачи могут обнаружить, что процесс кровообращения нарушен. Это патологическое состояние развивается в ускоренном темпе и сопровождается тяжелыми изменениями в функционировании органов и систем.
Такое состояние связано с тем, что поступление крови или левого предсердия в недостаточно развитый желудочек становится невозможным. Поэтому происходит проникновение крови в правые полости органа. В этом участке она смешивается с кровью из венозных сосудов.
Под влиянием этого процесса правые отделы перегружаются и дилатируются.
После того как кровь смешалась, большая ее часть попадает в полость легочной артерии. Все остальное через попадает в аорту и большой круг кровотока. В результате этого недостаточно насыщенная кислородом кровь распространяется по организму.
В этой ситуации наблюдается чрезмерная нагрузка на правые отделы сердца, так как они должны обеспечить достаточный ток крови по обоим кругам кровообращения.
Сколько проживет ребенок, зависит от того, как долго артериальный проток будет оставаться в открытом состоянии.
В результате тяжелых нарушений кровообращения постепенно развивается легочная гипертензия в выраженной форме, так как в сосудах малого круга кровотока повышается давление. По причине достаточного наполнения сосудов большого круга происходит развитие артериальной гипотонии.
Так как в полости левого желудочка смешивается кровь, также выявляют артериальную гипоксемию.
При патологии органы и ткани не получают необходимый кислород и питательные компоненты, что не позволяет им нормально выполнять свои функции.
Особенности проявлений
Синдром гипоплазии правых отделов сердца чаще всего диагностируют у детей, рожденных в срок. При данной патологии снижается приток крови к легким, из-за чего она не обогащается кислородом в достаточном количестве. Обычно отклонение протекает не в изолированной форме, а сочетается с другими нарушениями в развитии внутренних органов. При таком отклонении:
Сразу после родов наблюдают легкое посинение кожного покрова, но постепенно цианоз усиливается и сосредотачивается в нижней части тела. Ощущается снижение периферической пульсации в конечностях, и они холодные на ощупь.
Сердце не может полноценно работать с первых дней жизни. Это приводит к тому, что печень увеличивается, в определенных участках тела накапливается жидкость. Также уменьшается количество выведенной мочи, моча не поступает в мочевой пузырь, смещается кислотно-щелочной баланс в сторону повышения кислотности.
Возможен генетический синдром с гипоплазией мозолистого тела, развивается ишемия в сердечной мышце и тканях головного мозга.
Все эти патологические изменения представляют серьезную опасность для жизни ребенка. Очень часто новорожденного не успевают спасти.
Гипоплазия левого желудочка (синдром Раухфуса- Киселя) относится к редким врожденным порокам сердца и характеризуется недоразвитием и функциональной слабостью левого желудочка. Порок встречается с частотой от 0,5 до 7,5% от всех ВПС. У новорожденных детей эта аномалия развития является самой частой причиной смерти.
Анатомические дефекты заключаются в недоразвитии левого желудочка и левого предсердия в сочетании со стенозом или атрезией устья митрального или аортального отверстия и гипоплазии восходящей аорты. К сопутствующим дефектам развития относятся эндокардиальный фиброэластоз и дефекты межпредсердной и межжелудочковой перегородок. Полость левого желудочка уменьшена в размерах.
Кровообращение . При этом пороке левый желудочек практически не функционирует и кровоток в сосудах малого и большого кругов кровообращения обеспечивается за счет работы правого желудочка. Кровь, притекающая к левому предсердию через дефект межпредсердной перегородки или расширенное овальное отверстие, поступает из левых отделов сердца в правые, в которых смешивается с венозной кровью сосудов большого круга кровообращения.
Кровь, притекающая к левому предсердию через дефект межпредсердной перегородки или расширенное овальное отверстие, поступает из левых отделов сердца в правые, в которых смешивается с венозной кровью сосудов большого круга кровообращения.
При целой межжелудочковой перегородке кровь из правого желудочка целиком поступает в легочные артерии, а системная циркуляция обеспечивается за счет открытого артериального протока.
При сочетании с дефектом межжелудочковой перегородки кровь из правого желудочка поступает как в легочную артерию, так и в маленький левый желудочек и далее в аорту. Нарушения гемодинамики связаны с неадекватным кровообращением в системе большого круга кровообращения, гипертензией в системе легочных вен.
Клиническая картина и диагностика гипоплазии левого желудочка.
Порок протекает катастрофически тяжело с первых дней жизни. Недостаточность кровообращения чаще проявляется со вторых суток после рождения, протекает по тотальному типу и в течение нескольких дней приводит к гибели ребенка.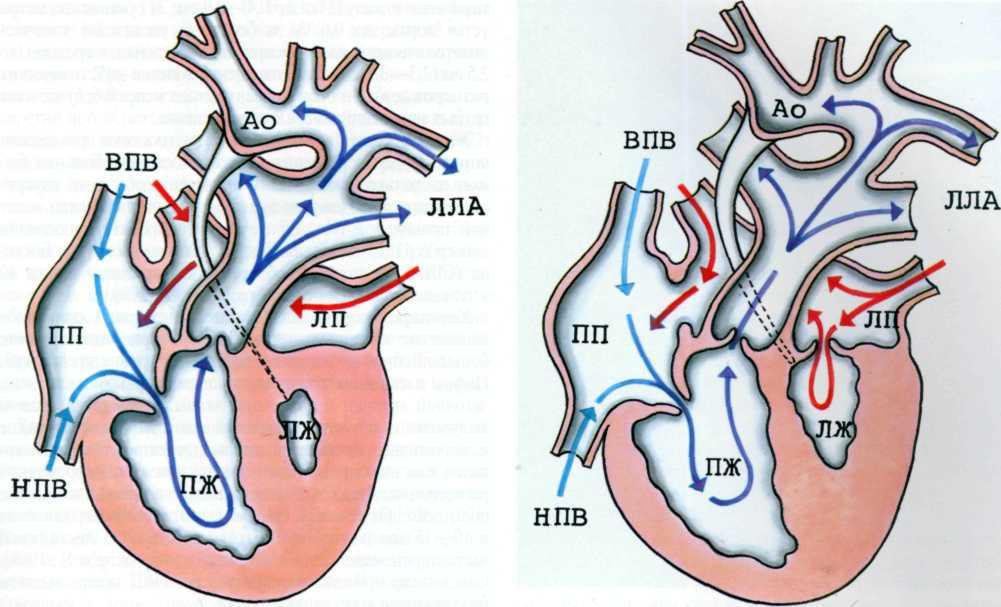
Первые признаки порока возникают после рождения и напоминают респираторный дистресс-синдром, перинатальное поражение ЦНС или шок. У всех новорожденных появляется выраженная одышка до 80-100 в минуту с втяжением уступчивых мест грудной клетки, влажные хрипы в легких, бледно-серый цвет кожных покровов, адинамия, гипорефлексия. Цианоз выражен умеренно. Характерен более слабый пульс на руках, чем на ногах, что обусловлено гипоплазией дуги аорты. Границы сердечной тупости расширены, особенно влево. Аускультативно определяется тахикардия до 160-200 в минуту, тоны сердца приглушены, может определяться негрубый, непродолжительный систолический шум. Сердечная недостаточность проявляется в основном в виде одышки и гепатомегалии. Печень, как правило, очень большая. У трети новорожденных в терминальной стадии развивается отечный синдром.
В течение первых 2 сут цианоз, как правило, незаметен, затем кожа ребенка приобретает серо-голубой цвет. При узком отверстии аортального клапана отмечается дифференцированный цианоз.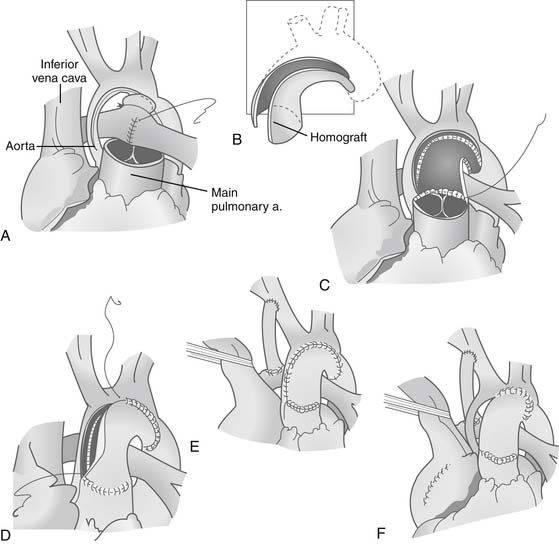 У ребенка в этом случае окраска правой руки и правой части головы и шеи не изменяется, другая половина приобретает цианотичный оттенок.
У ребенка в этом случае окраска правой руки и правой части головы и шеи не изменяется, другая половина приобретает цианотичный оттенок.
При перкуссии границы сердца расширены, у грудины пальпируется приподнимающий правожелудочковый толчок. Клинически характерен слабый пульс на верхних и нижних конечностях при усиленном сердечном толчке. Шум над областью сердца чаще не выслушивается или выслушивается слабый систолический шум без четкой локализации.
Рентгенологически в первые дни жизни размеры сердца значительно варьируют, затем быстро развивается кардиомегалия и усиливается легочный сосудистый рисунок за счет переполнения венозного русла. Кардиомегалия возникает с 4-6-го дня жизни. Кардиоторакальный индекс в этом случае равен 60-65%. Конфигурация тени сердца приближается к шаровидной. Характерным является отсутствие тени восходящей аорты по правому контуру сердца из-за ее гипоплазии.
На ЭКГ регистрируются низкий вольтаж комплексов QRS, отклонение электрической оси сердца вправо, увеличение правого и левого предсердий и правого желудочка.
С помощью одномерной эхоКГ диагностируют гипоплазию дуги аорты , малые (щелевидные) размеры левого желудочка, увеличенный правый желудочек, асимметричную гипертрофию межжелудочковой перегородки. Двухмерная эхоКГ, выполненная в проекции длинной оси из парастернального доступа, выявляет гипоплазию устья аорты. В проекции 4 камер с верхушки сердца различаются гипоплазированные левое предсердие и левый желудочек, резко расширенные правое предсердие и правый желудочек.
Прогноз при этом пороке очень плохой. Продолжительность жизни составляет от нескольких дней до 3 мес. Около 80% новорожденных умирает на первой неделе жизни. Причиной смерти являются прогрессирующая сердечная недостаточность, присоединение пневмонии.
Лечение симптоматическое . Хирургическая коррекция возможна в виде паллиативных операций.
(ГСЛОС) представляет собой спектр аномалий, характеризующихся недоразвитием левого желудочка с атрезией или выраженной гипоплазией митрального и/или аортального клапанов. ГСЛОС составляет 7-9% от всех ВПС у живорожденных детей и является одной из наиболее частых причин смерти.
ГСЛОС составляет 7-9% от всех ВПС у живорожденных детей и является одной из наиболее частых причин смерти.
В норме Желудочки сердца плода имеют одинаковые размеры, поэтому гипоплазия левого желудочка может быть диагностирована при изучении изображения четы рехкамерного среза, так как она характеризуется маленькими размерами левых отделов сердца в сравнении с обычными или увеличенными правыми отделами.
Гипопластический синдром левых отделов сердца нередко сопровождается аномальным развитием митрального и/или аортального клапанов. Диагноз атрезии митрального клапана достаточно легко устанавливается при изучении четырехкамерного среза сердца на основании визуализации отсутствия движения створок митрального клапана. Важное диагностическое значение при митральной атрезии имеет допплерэхокардиография, которая позволяет четко визуализировать отсутствие потока крови через митральный клапан при его сохранении через трикуспидальный клапан.
Согласно результатам L.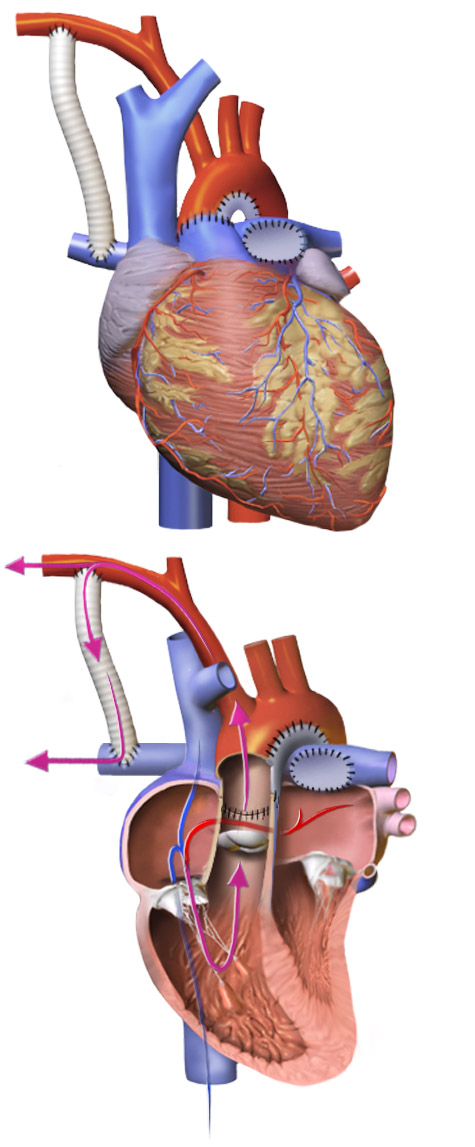 Allan и соавт., которые пренатально обнаружили 24 случая атрезии, или отсутствия митрального клапана, во всех наблюдениях, присланных для комплексного эхокардиографического исследования плода, при скрининговом ультразвуковом исследовании был обнаружен аномальный четырехкамер-ный срез сердца — выраженное превалирование размеров правого желудочка над левым. Срок выявления порока составил в среднем 26,3 нед (16-37 нед), причем в 12 из 24 случаев диагноз был установлен до 24 нед. В 4 из 24 наблюдений было произведено прерывание беременности, в одном случае отмечена внутриутробная смерть и в 10 случаях — в неонатальном периоде. Выжившим детям проведено хирургическое лечение.
Allan и соавт., которые пренатально обнаружили 24 случая атрезии, или отсутствия митрального клапана, во всех наблюдениях, присланных для комплексного эхокардиографического исследования плода, при скрининговом ультразвуковом исследовании был обнаружен аномальный четырехкамер-ный срез сердца — выраженное превалирование размеров правого желудочка над левым. Срок выявления порока составил в среднем 26,3 нед (16-37 нед), причем в 12 из 24 случаев диагноз был установлен до 24 нед. В 4 из 24 наблюдений было произведено прерывание беременности, в одном случае отмечена внутриутробная смерть и в 10 случаях — в неонатальном периоде. Выжившим детям проведено хирургическое лечение.
При атрезии митрального клапана в ходе оценки с использованием режима ЦДК регистрируется межпредсердный левоправыи (реверсныи) шунт. Его появление обусловлено тем, что поступающая кровь из правого в левое предсердие через овальное окно возвращается обратно из-за невозможности прохождения через атрезированный митральный клапан.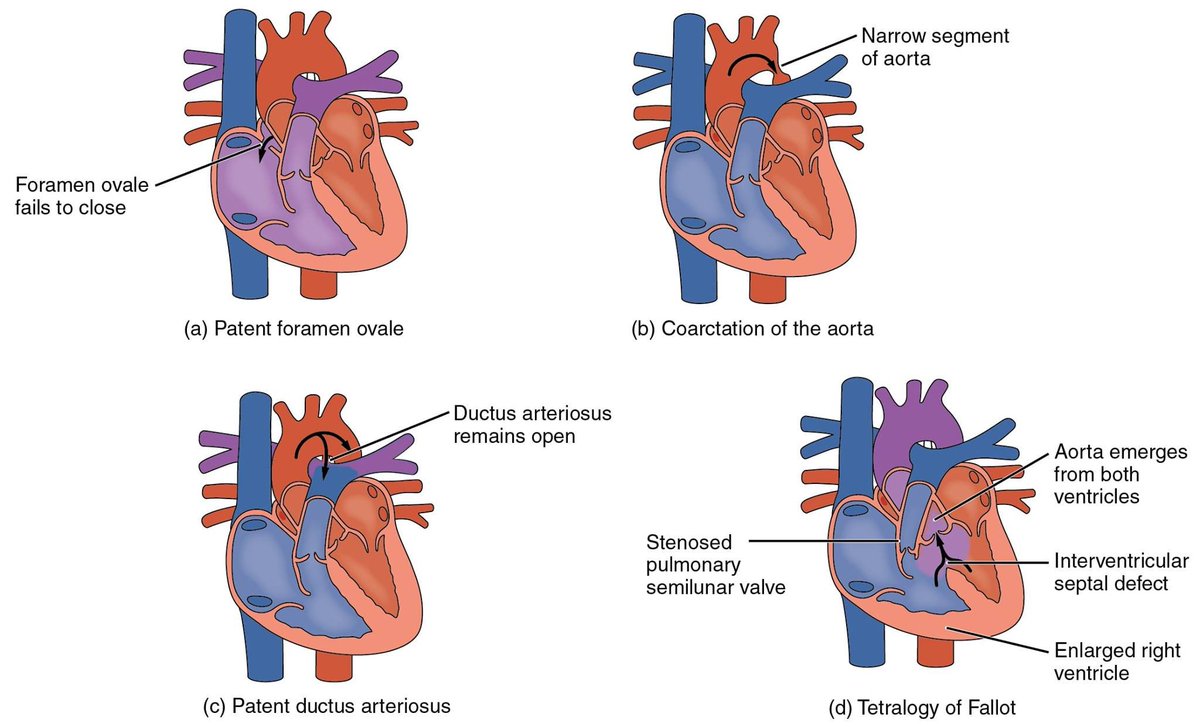 Кроме этого нередко при выраженных формах ГСЛОС, сопровождающихся неблагоприятным перинатальным исходом, в ходе оценки кривых скоростей кровотока в легочных венах регистрируются реверсные значения третьей волны.
Кроме этого нередко при выраженных формах ГСЛОС, сопровождающихся неблагоприятным перинатальным исходом, в ходе оценки кривых скоростей кровотока в легочных венах регистрируются реверсные значения третьей волны.
Нередко при ГСЛОС также выявляется атрезия аорты. В этих случаях аорта имеет маленький диаметр или не визуализируется. При этом основная легочная артерия может быть значительно расширена. При атрезии аорты кровь в ее восходящую часть поступает через артериальный проток. Поэтому в восходящей аорте при ее атрезии в режиме ЦДК регистрируется реверсныи поток крови.
Наряду с атрезиеи при ГСЛОС может наблюдаться гипоплазия аорты, которая также характеризуется уменьшением ее диаметра, что существенно затрудняет проведение дифференциальной диагностики при использовании только В-режима. Поэтому в этих случаях необходимо применять режим ЦДК. В отличие от атрезии аорты при ее гипоплазии в ходе допплеровского исследования регистрируется сниженный антеградный поток крови из левого желудочка в аорту.
По данным С. Stoll и соавт., чувствительность пренатальнои эхографии в диагностике при скрининговом обследовании в северо-восточных провинциях Франции составила 46%. Схожие данные по крупному региону Германии при обследовании 20 248 плодов за 5 лет приводят A. Queisser-Luft и соавт. — 40%.
Согласно данным мультицентрового анализа, осуществленного в 12 европейских странах, точность пренатальнои диагностики изолированного Гипопластического синдрома левых отделов сердца в конце 90-х годов составила 63%. При сочетании ГСЛОС с экстракардиальными аномалиями точность его пренатальной диагностики была практически аналогичной и составила 69,2%. При анализе аналогичного мультицентрового исследования, проведенного в 17 европейских странах в 1995-1999 гг., было установлено, что точность пренатальной ультразвуковой диагностики ГСЛОС составила 57%. Средний срок обнаружения ГСЛОС в этих исследованиях находился в пределах 20-22 нед беременности.
Следует отметить, что в отличие от скрининговых исследований, проведенных специалистами I уровня, точность дородового обнаружения Гипопластического синдрома левых отделов сердца существенно выше при обследовании в центре пренатальнои диагностики.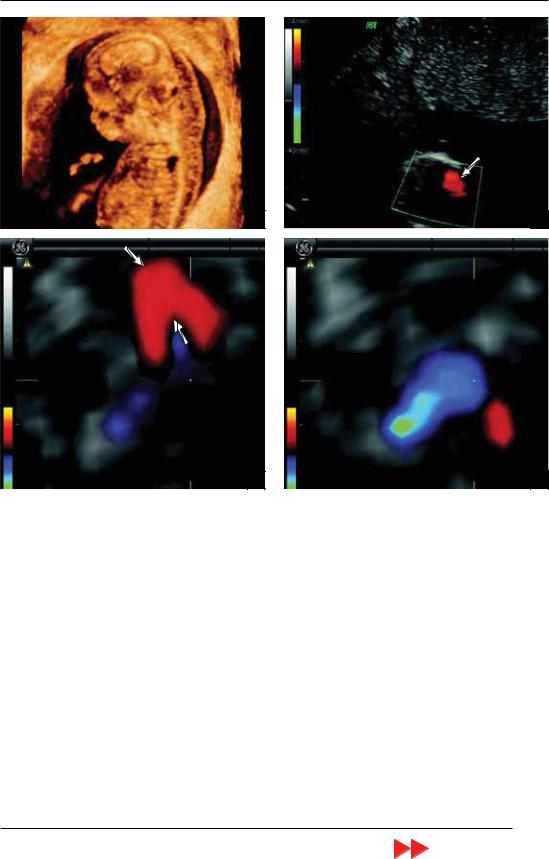 По данным О. Л. Галкиной, ни в одном из 7 случаев пренатальный диагноз ГСЛОС не был поставлен в кабинетах ультразвуковой диагностики родильных домов и центральных районных больниц Мурманской области.
По данным О. Л. Галкиной, ни в одном из 7 случаев пренатальный диагноз ГСЛОС не был поставлен в кабинетах ультразвуковой диагностики родильных домов и центральных районных больниц Мурманской области.
В большинстве случаев Гипопластического синдрома левых отделов сердца прогноз неблагоприятный. До 90% детей умирает в первый месяц жизни. В таблице представлены данные о перинатальных исходах в случаях пренатальнои диагностики ГСЛОС.
Учебное видео УЗИ сердца плода в норме
Симптомы и лечение синдрома гипоплазии левых отделов сердца
Сердце будет работать, как МОТОР!
Вы забудете об тахикардии, если перед сном.
В пятерке наиболее распространенных врожденных пороков сердца (ВПС), помимо дефекта межжелудочковой перегородки, стеноза митрального клапана и прочих заболеваний, находится синдром гипоплазии левых отделов сердца (СГЛОС). На самом деле, это не конкретная патология, а целый ряд врожденных аномалий сердца, которые характеризуются недоразвитием или нарушением строения его левой части.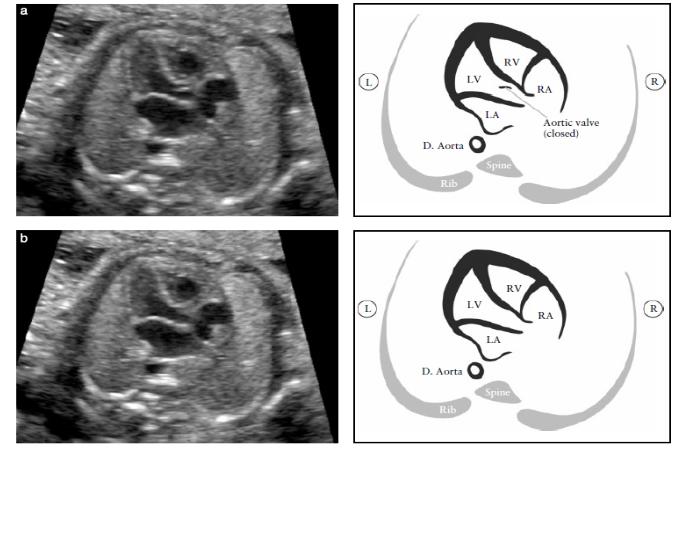 Подобные пороки всегда имеют серьезный прогноз, а их лечение порой должно быть проведено в первые часы жизни родившегося ребенка.
Подобные пороки всегда имеют серьезный прогноз, а их лечение порой должно быть проведено в первые часы жизни родившегося ребенка.
Особенности заболевания
Синдром гипоплазии левых отделов сердца обозначает группу патологий, которая рассматривается как критический ВПС с резким уменьшением размеров и неправильным строением левых камер, восходящей части аорты, дополняемого аортальным или митральным стенозом. Так как в результате гипоплазии левая часть сердца не функционирует на должном уровне, создается обструкция кровотока по аорте, что грозит тяжелыми последствиями. До 4-8 % всех врожденных сердечно-сосудистых аномалий связаны именно с СГЛОС, причем данная патология является ведущей предпосылкой гибели ребенка буквально за первые дни после рождения. СГЛОС у мальчиков наблюдается чаще, чем у девочек, примерно в 2 раза.
Классификация СГЛОС включает такие его виды:
Гипоплазия левого желудочка и атрезия устья аорты. Нередко данный тип заболевания сочетается со стенозом или атрезией митрального клапана. Размеры левого желудочка могут быть минимальными, буквально щелевидными (не более 1 мл в объеме). Данный тип патологии имеет самый плохой прогноз. Недоразвитость левого желудочка в комплексе с гипоплазией устья аорты, часто дополняемые стенозом митрального клапана. Является более распространенным типом СГЛОС, сопровождается фиброэластозом эндокарда. Желудочек составляет 1-4,5 мл в объеме.
Размеры левого желудочка могут быть минимальными, буквально щелевидными (не более 1 мл в объеме). Данный тип патологии имеет самый плохой прогноз. Недоразвитость левого желудочка в комплексе с гипоплазией устья аорты, часто дополняемые стенозом митрального клапана. Является более распространенным типом СГЛОС, сопровождается фиброэластозом эндокарда. Желудочек составляет 1-4,5 мл в объеме.
Оба типа СГЛОС могут сочетаться с гиперплазией стенок легочной артерии, открытым овальным окном, открытым артериальным протоком, а также сгиперплазией правой части сердца. Исходя из описанных аномалий, гемодинамические нарушения достигают серьезной степени тяжести и начинают себя проявлять уже во время внутриутробного развития плода.
Причины патологического изменения гемодинамики кроются в том, что артериальная кровь из предсердия не поступает в слишком маленький левый желудочек, зато через открытое овальное окно перетекает в правые отделы сердца и соединяется с венозной кровью.
Далее смешанная кровь попадает в легочную артерию, восходящую аорту и сосуды головного мозга, а вторая часть — через незакрытый артериальный проток в брюшную аорту и нижнюю половину тела. Итогом становится серьезная перегрузка правой части сердца буквально с самого рождения, ведь правому желудочку приходится работать для обоих кругов кровообращения, перекачивая венозную и артериальную кровь.
Итогом становится серьезная перегрузка правой части сердца буквально с самого рождения, ведь правому желудочку приходится работать для обоих кругов кровообращения, перекачивая венозную и артериальную кровь.
Кроме износа сердца наблюдается застой крови в легких, повышение артериального давления в сосудах малого круга, правом желудочке и предсердии, низкое давление в большом круге кровообращения. У младенца развивается ряд патологий сердечно-сосудистой системы, несовместимых с жизнью и приводящих к смерти в ранние сроки после появления на свет.
Причины возникновения
Причинами синдрома гипоплазии левых отделов сердца является нарушение эмбрионального развития плода, в результате которого сердце и сосуды являются патологически измененными и не могут нормально функционировать. Точные этиологические факторы, которые могли бы повлиять на недоразвитие сердца, пока не ясны. Предполагается, что, как и в случае с прочими ВПС, отрицательно сказываются на эмбриогенезе тератогенные факторы:
- получение рентгеновского, радиационного облучения во время беременности; курение, наркомания, прием алкоголя; прием лекарств, нарушающих нормальное развитие плода; перенесенные инфекции во время гестации — краснуха, грипп, герпес, токсоплазмоз, цитомегаловирус и т.
 д.
д.Считается, что генные мутации тоже могут оказывать роль на возникновение синдрома гипоплазии правых отделов сердца. В некоторых случаях отмечается и роль наследственности: если у матери имеются любые ВПС, это примерно в 4-5% случаев может провоцировать развитие заболеваний этой группы у ребенка.
Симптомы гипоплазии
Как правило, симптомы СГЛОС не заставляют себя ждать и наблюдаются буквально после рождения, либо возникают в течение первых 1-2 суток. Дисфункция сердечнососудистой системы начинает особенно тяжело проявляться, когда закрывается артериальный проток. Даже если малыш родился доношенным и с нормальным весом, уже с рождения он несколько ослаблен, мало двигается. В дальнейшем при тяжелой степени гипоплазии, полном закрытии клапана клиническая картина развивается схоже с проявлениями кардиогенного шока или серьезным поражением ЦНС и включает:
- резкое побледнение, серость кожи; холодность конечностей; тахипноэ; слабость пульса; снижение давления и температуры тела; одышка; цианоз лица; уменьшение количества мочи или нарушение ее оттока; метаболический ацидоз; нарушение функции почек; симптомы инфаркта миокарда; признаки инфаркта головного мозга; кома, смерть.

Как правило, спасти ребенка с первым типом СГЛОС не удается, он гибнет за несколько часов после рождения. Но при наличии проходимости отверстий клапанов и умеренной гипоплазии левых отделов сердца симптомы более сглаженные, развиваются медленнее, хотя они аналогичны указанным выше. Ребенок адинамичен, наблюдается одышка с втягиванием грудины, влажные хрипы в легких, умеренный цианоз кожи. Ноги и руки ребенка холодные, давление несколько снижено. Может отмечаться тахикардия, позже присоединяется одышка в покое, во сне. Часто диагностируются увеличение печени, периферические отеки.
Возможные осложнения
Дисфункция левого желудочка при умеренном его уменьшении частично компенсируется деятельностью правого желудочка, поэтому в некоторых случаях у врачей и родителей есть несколько дней и даже месяцев, чтобы провести оперативное лечение порока сердца. Но при атрезии аорты быстро развивается гипоперфузия мозга, микроцефалия, гипоксия, прогрессирующая сердечная недостаточность. В связи с такими осложнениями смерть более, чем 70% новорожденных происходит в течение первой недели после родов, при этом летальный исход у 38% детей наблюдается за 24-48 часов. К 6 месяцам без лечения умирает 100% детей с СГЛОС. Описаны единичные случаи, когда дети доживали до 3 лет, что связано с наличием дефекта межжелудочковой перегородки и большого межпредсердного сообщения.
В связи с такими осложнениями смерть более, чем 70% новорожденных происходит в течение первой недели после родов, при этом летальный исход у 38% детей наблюдается за 24-48 часов. К 6 месяцам без лечения умирает 100% детей с СГЛОС. Описаны единичные случаи, когда дети доживали до 3 лет, что связано с наличием дефекта межжелудочковой перегородки и большого межпредсердного сообщения.
Проведение диагностики
Постановка диагноза может быть проведена внутриутробно, поэтому при отсутствии возможности прерывания беременности или при отказе родителей от прерывания врачи должны подготовиться к рождению и сделать все для немедленного оказания помощи ребенку. В экстренном порядке малыша с подозрением на СГЛОС направляют на проведение таких методов диагностики:
Физикальное обследование — имеются серость кожи с цианотичным оттенком, похолодание конечностей, снижение пульса, давления. Аускультация — при прослушивании выявляется громкий одиночный тон сердца, изредка — мягкие неспецифичные шумы. Двухмерная ЭХО-КГ с цветной допплерографией — позволяет получить полное представление об имеющихся нарушениях развития сердца и сосудов. Чаще всего СГЛОС дополняется гипетрофией правой части сердца. Рентгенография грудной клетки — обнаруживает кардиомегалию, а также венозный застой в легочной ткани. Нередко имеется отек легких. ЭКГ — показывает отклонение оси сердца вправо, объективные признаки гипертрофии предсердий и правого желудочка. Катеризация сердца — нужна для последующей операции, чтобы уточнить строение сердца ребенка. Если операция не планируется, такой метод очень опасен для ребенка, так как до ¼ детей с СГЛОС погибали после процедуры. Желательно заменять внутрисердечные исследования КТ-ангиографией.
Двухмерная ЭХО-КГ с цветной допплерографией — позволяет получить полное представление об имеющихся нарушениях развития сердца и сосудов. Чаще всего СГЛОС дополняется гипетрофией правой части сердца. Рентгенография грудной клетки — обнаруживает кардиомегалию, а также венозный застой в легочной ткани. Нередко имеется отек легких. ЭКГ — показывает отклонение оси сердца вправо, объективные признаки гипертрофии предсердий и правого желудочка. Катеризация сердца — нужна для последующей операции, чтобы уточнить строение сердца ребенка. Если операция не планируется, такой метод очень опасен для ребенка, так как до ¼ детей с СГЛОС погибали после процедуры. Желательно заменять внутрисердечные исследования КТ-ангиографией.
Дифференцировать синдром гипоплазии левых отделов сердца следует с нарушениями ритма сердца, острой дыхательной недостаточностью, кровоизлиянием в головной мозг, родовой травмой мозга, сепсисом, геморрагическим диатезом.
Также нужно различать СГЛОС с другими пороками сердца, особенно с критическим изолированным стенозом клапана аорты, аномальным дренажем легочных вен, транспозицией магистральных сосудов и т. д.
д.
Методы лечения
К сожалению, в настоящее время нет такой операции, которая бы безопасно и эффективно устраняла симптомы гипоплазии левых отделов сердца. Летальность во время хирургического вмешательства составляет более 40%, а при учете того, что ребенку потребуется 2-3 этапа операций, выживает и в дальнейшем живет нормальной жизнью достаточное малое количество детей. Тем не менее, при умеренной гипоплазии и отсутствии осложнений, приводящих к гибели, родителям рекомендуется дать малышу хоть какой-то шанс на выздоровление и согласиться на операцию.
Сразу после рождения следует предпринять все для снижения потребностей в энергозатратах организма ребенка, для чего вводятся препараты для устранения сбоев метаболизма (простагландинов Е, натрия гидрокарбоната), обеспечивают комфортную температуру, исключают физическую активность малыша.
Чаще всего его подключают к аппарату искусственной вентиляции легких. Из препаратов применяются диуретики для уменьшения периферических отеков и недопущения отека головного мозга, седативные средства, препараты для улучшения кровообращения.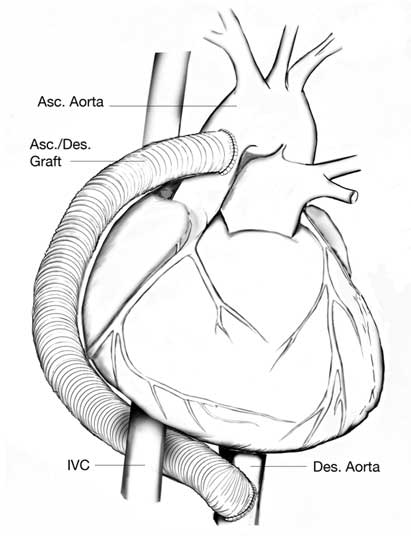
Во многих случаях прибегают к паллиативным действиям, несколько продляя жизнь ребенка, но только операция, выполненная в первые дни или недели после рождения, оставляет шанс на выживание. Чаще всего применяется многоэтапная реконструкция желудочков:
Первый этап — замена эластичным биологическим протезом восходящей части дуги аорты, при этом протез соединит единым сосудом, отходящим от правого желудочка, аорту и легочную артерию. Во время операции также расширяют отверстие в межпредсердной перегородке, чтобы кровь лучше перемешивалась. Смертность уже после этого этапа достигает около 30-40%. Второй этап — частичное разделение кругов кровообращения. Операцию проводят в возрасте 4-10 месяцев. Смертность — 10-15%. Третий этап — полное разделение кругов кровообращения. Вмешательство выполняется через 12 месяцев после второго. Выживаемость — 95%.
После операции, даже окончившейся успехом, только 70% детей живет дольше 5 лет. Многие из них являются инвалидами, причем по большей части это обусловлено нарушениями со стороны ЦНС.
Вторым способом оперативного вмешательства является трансплантация сердца. Решение об этом может быть предпринято до рождения ребенка, но чаще всего дети умирают, так и не дождавшись донорского органа. Даже после успешной пересадки сердца острая необходимость длительного приема угнетающих иммунитет препаратов приводит к развитию хронических инфекционных заболеваний и поражения коронарных сосудов, поэтому пятилетняя выживаемость практически не опережает указанную выше после многоэтапной операции. Таким детям почти всегда требуется повторная трансплантация сердца.
В последние годы ведущие клиники мира предлагают проведение нового типа операций. Среди них — баллонная дилатация клапана аорты у плода во время беременности, что не позволит остановить рост левой части сердца и перейти болезни в СГЛОС. Еще один вид операции позволяет выжить 90% детей с синдромом гипоплазии левых отделов сердца. Это — стентирование открытого артериального протока в комплексе с двусторонним сужением легочных артерий. Некоторые специалисты предпринимают шаги в направлении операций по двухжелудочковой коррекции, но технология пока не является отработанной.
Некоторые специалисты предпринимают шаги в направлении операций по двухжелудочковой коррекции, но технология пока не является отработанной.
Чего нельзя делать при СГЛОС
Основная рекомендация для родителей — довериться врачам и согласиться на операцию, которая может предотвратить гибель ребенка в первые недели или месяцы после рождения. Нельзя игнорировать мнение опытных специалистов и после удачного вмешательства, ведь ребенок будет сильно ослаблен, поэтому его образ жизни будет серьезно отличаться от сверстников. Физические нагрузки, инфекции, плохое питание — факторы риска, которые способны ускорить плохой исход, в связи с чем только предельно внимательное отношение к жизни малыша должно стать девизом его родителей.
Вы – один из миллионов, у которых больное сердце?
А все ваши попытки вылечить гипертонию не увенчались успехом?
И вы уже задумывались о радикальных мерах? Оно и понятно, ведь сильное сердце — это показатель здоровья и повод для гордости. Кроме того, это как минимум долголетие человека. А то, что человек, защищенный от сердечно-сосудистых заболеваний выглядит моложе – аксиома не требующая доказательств.
Кроме того, это как минимум долголетие человека. А то, что человек, защищенный от сердечно-сосудистых заболеваний выглядит моложе – аксиома не требующая доказательств.
Представленные материалы, являются информацией общего характера и не могут заменить консультации врача.
Методы диагностики и лечения гипоплазии левых отделов сердца
Гипоплазия левых отделов сердца – врожденный порок сердца, который заключается в недоразвитии левого желудочка или его функциональной слабости.
Сокращенная полость левого желудочка и недоразвитие левого предсердия сочетается с пороками митрального и аортального клапанов, с гипоплазией аорты. Среди дефектов клапанов возможны атрезия, гипоплазия и стеноз.
Это достаточно редкий порок, частота которого, по оценкам разных источников, находится в пределах от 1 до 6% в общем числе врожденных пороков сердца. Порок получил название синдром Раухфуса-Киселя. Он является самой распространенной причиной смерти у новорожденных.
Часть исследователей считают такой порок наследственной патологией.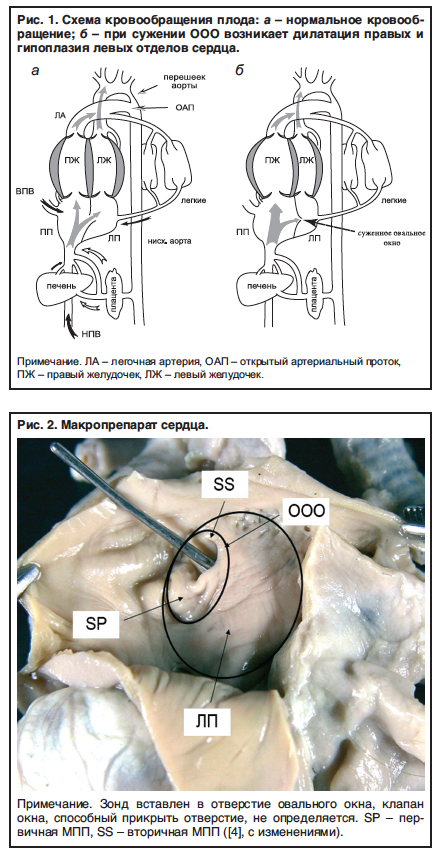 После рождения первого ребенка с патологией левых отделов сердца риск повторения возрастает до 4%, а после рождения второго такого ребенка — до 25%. Некоторые утверждают, что причиной появления синдрома гипоплазии сердечного отдела является преждевременное закрытие овального окна.
После рождения первого ребенка с патологией левых отделов сердца риск повторения возрастает до 4%, а после рождения второго такого ребенка — до 25%. Некоторые утверждают, что причиной появления синдрома гипоплазии сердечного отдела является преждевременное закрытие овального окна.
Виды гипоплазии
Порок подразделяют на два вида:
- Характеризуется недоразвитостью левого желудочка и атрезией устья аорты, может дополняться атрезией митрального клапана или стенозом митрального клапана. При этом полость левого желудочка щелевидная (минимальная). Этот вид гипоплазии наиболее тяжелый. Объем полости левого желудочка не превышает 1 мл. Характеризуется недоразвитостью левого желудочка, гипоплазией и стенозом устья аорты, дополняется стенозом митрального клапана. При этом недоразвитость полости левого желудочка не так велика. Такой вид порока сопровождается фиброэластозом эндокарда. Он более распространен, чем первый. Объем полости левого желудочка может составлять от 1 до 4,5 мл.

В обоих случаях наблюдается открытый артериальный проток и открытое овальное окно, увеличение правых сегментов сердца, увеличением толщины ствола легочной артерии.
Недоразвитый левый желудочек формируется у плода на задней поверхности сердца, вверху. А правый желудочек формирует верхушку сердца. При таком пороке, наблюдается дефект межжелудочковой перегородки.
Так как левый желудочек не выполняет своей функции, обеспечение кровотока по малому и большому кругам ложится на правый желудочек сердца. Он выполняет двойную нагрузку, прокачивая кровь, как в системный, так и в легочный круг кровообращения. Попасть в большой круг кровь может только по артериальному протоку.
Порок митрального клапана препятствует току крови из левого предсердия. Артериальная кровь движется в открытое овальное окно и правое предсердие. Затем попадает в правый желудочек. В правых сегментах сердца артериальная и венозная кровь из сосудов большого круга кровообращения смешиваются.
Если нет повреждений межжелудочковой перегородки, кровь идет в легочную артерию. Проходя открытый артериальный проток, кровь попадает в нисходящую аорту. В восходящую аорту и в коронарные сосуды небольшое количество артериальной крови поступает ретроградно. Если порок сочетается с дефектом межжелудочковой перегородки, то из правого желудочка кровь движется в легочную артерию и в недоразвитый левый желудочек, затем в аорту.
Диагностика порока
Гипоплазия левых отделов часто определяется до рождения во время ультразвукового исследования сердца — эхокардиографии плода, на 18-20 неделе беременности. Такое исследование чрезвычайно важно. Оно позволяет подготовиться к рождению больного ребенка и после родов быстро отправить его в специализированную клинику. Иногда в случаях персистирования, боталлова протока порок не диагностируется вовремя, не только при внутриутробном развитии плода, но и после рождения. В ближайшее время развития ребенка артериальный проток может закрыться, что грозит смертельным исходом.
Признаки порока похожи на респираторный дистресс-синдром, они сходны с признаками поражения центральной нервной системы и шока. У новорожденного наблюдается:
- тяжелая одышка с втяжением уступчивых мест грудной клетки; влажные хрипы в легких; бледно-серый цвет кожи; понижение рефлексов; низкая двигательная активность.
Слабый пульс на конечностях сочетается с сильным сердечным толчком. Причем на руках ребенка пульс более слабый, чем на ногах. Прослушивание выявляет тахикардию 160-200 ударов в минуту и приглушенный тон сердца. Данные замеров давления показывают систолическое не более 60-80 мм рт. ст., пульсовое — 20-25 мм рт. ст. У ребенка наблюдается патологическое увеличение размеров печени. У трети детей, родившихся с таким пороком, появляется отечный синдром.
В первые два дня после рождения при циркулировании смешанной крови в большом круге кровообращения цианоз сильно не проявляется. На третьи сутки проявляется значительный цианоз, кожа новорожденного становится серо-голубой.
Если дефект состоит в узости отверстия аортального клапана, цианоз проявляется дифференцировано. Правая сторона тела, шеи и головы сохраняют нормальный цвет, а на левой половине проявляется цианоз. Или он не проявляется на руках, но сильно выражен на ногах в связи с выбросом крови в нисходящую аорту через Боталлов проток.
Диагноз гипоплазии левых отделов сердца подтверждается данными ЭКГ, рентгенографии, двухмерной эхокардиографии, катетеризации.
Способы лечения
Новорожденные с недоразвитием левых сегментов сердца наблюдаются в реанимационном отделении. Задачей врача является недопущение закрытия артериального протока, а также пробы его открытия. Несколько лет назад помощь таким детям была невозможна. Сегодня существуют способы спасения, но риск летального исхода все еще велик. Без хирургического вмешательства помочь ребенку невозможно.
Хирургический способ лечения проходит в несколько этапов.
- Паллиативный. Операция Норвуда, которая должна снизить нагрузку на легочную артерию и обеспечить кровоснабжение аорты.
 Срок проведения – две первые недели жизни ребенка. Выживаемость детей после операции составляет 75%. Проведение операции Гленна, которую назвали двунаправленный кавопульмональный анастомоз. Она состоит в создании дополнительного сообщения верхней полой вены и левой легочной артерии. Ее цель – направить обходным путем легочный кровоток, минуя дефектный отдел сердца. Результатом операции является поток крови в двух направлениях. Операция проводится в возрасте ребенка от 3 до 6 месяцев и считается подготовительной для проведения следующего этапа. Выживаемость после вспомогательной операции составляет 95%. Операция Фонтена. Ее целью является разделение двух кругов кровообращения. При этом сердце будет прокачивать кровь к органам и тканям. Но не будет участвовать в накачивании крови в малый легочный круг, туда кровь попадет самостоятельно. Так как на эффективность операции влияет развитость мышечной массы, поэтому ее проводят не ранее, чем ребенок начинает ходить. Выживаемость составляет 90%.
Срок проведения – две первые недели жизни ребенка. Выживаемость детей после операции составляет 75%. Проведение операции Гленна, которую назвали двунаправленный кавопульмональный анастомоз. Она состоит в создании дополнительного сообщения верхней полой вены и левой легочной артерии. Ее цель – направить обходным путем легочный кровоток, минуя дефектный отдел сердца. Результатом операции является поток крови в двух направлениях. Операция проводится в возрасте ребенка от 3 до 6 месяцев и считается подготовительной для проведения следующего этапа. Выживаемость после вспомогательной операции составляет 95%. Операция Фонтена. Ее целью является разделение двух кругов кровообращения. При этом сердце будет прокачивать кровь к органам и тканям. Но не будет участвовать в накачивании крови в малый легочный круг, туда кровь попадет самостоятельно. Так как на эффективность операции влияет развитость мышечной массы, поэтому ее проводят не ранее, чем ребенок начинает ходить. Выживаемость составляет 90%.
Диагноз гипоплазии левых отделов сердца — тяжелый и неблагоприятный. После проведения трех этапов коррекции дефекта выживают 70% детей. 90% детей с таким пороком умирает в первый месяц жизни.
Синдром гипоплазии левых отделов сердца — Hypoplastic left heart syndrome
| Синдром гипоплазии левых отделов сердца | |
|---|---|
| Другие названия | Цианотическая болезнь сердца — гипоплазия левых отделов сердца |
| Иллюстрация сердца, страдающего синдромом гипоплазии левых отделов сердца | |
| Специальность | Кардиология |
Синдром гипоплазии левых отделов сердца ( HLHS ) — это редкий врожденный порок сердца, при котором левая сторона сердца сильно недоразвита. Это может повлиять на левый желудочек , аорту , аортальный или митральный клапан .
Признаки и симптомы
Младенец с цианозом из-за синдрома гипоплазии левых отделов сердца Закрытие артериального протока в сердце, которое сильно недоразвито слева, приводит к цианозу и респираторной недостаточности, которые могут прогрессировать до кардиогенного шока и смерти. Первые симптомы — цианоз, который не реагирует на введение кислорода или плохое питание. Периферический пульс может быть слабым, а конечности холодными на ощупь.
Первые симптомы — цианоз, который не реагирует на введение кислорода или плохое питание. Периферический пульс может быть слабым, а конечности холодными на ощупь.
HLHS часто сочетается с низкой массой тела при рождении и преждевременными родами.
У новорожденных с небольшим дефектом межпредсердной перегородки, называемым «рестриктивным», наблюдается неадекватное смешивание оксигенированной и деоксигенированной крови. У этих новорожденных быстро наступает декомпенсация, и у них развивается ацидоз и цианоз.
На ЭКГ отклонение оси вправо и гипертрофия правого желудочка встречаются часто, но не указывают на HLHS. Рентген грудной клетки может показать большое сердце ( кардиомегалия ) или увеличение легочной сосудистой сети. Новорожденные с HLHS обычно не имеют шума в сердце , но в некоторых случаях может быть слышен шум легочного кровотока или шум трикуспидальной регургитации .
Сопутствующая регургитация трикуспидального клапана или дисфункция правого желудочка могут вызвать развитие гепатомегалии .
Причины
Схема здорового сердца и сердца с синдромом гипоплазии левых отделов сердцаВ большинстве случаев HLHS неизвестна причина. Некоторые случаи могут иметь генетический компонент, поскольку было показано, что HLHS передается по наследству и связан с конкретными генными мутациями.
Не все, но некоторые случаи стеноза аорты у плода могут вызвать нагрузку на левый желудочек внутриутробно, что в конечном итоге может привести к снижению перфузии и остановке роста левого желудочка.
Экологические причины
В ходе ретроспективного анализа более 1300 новорожденных (родившихся в период с 1996 по 2006 год) из 24 детских больниц в США исследователи Детской больницы Цинциннати в Огайо обнаружили, что дети с HLHS чаще рождаются в летние месяцы, что позволяет предположить, что сезонность и факторы окружающей среды могут играть важную роль в причинно-следственной связи.
Генетика
Генетические локусы, связанные с HLHS, включают GJA1 (коннексин 43) , HAND1 , NKX2. 5 , 10q22 и 6q23. Существует небольшой риск рецидива при будущих беременностях, оцениваемый в 2-4%, который увеличивается до 25% в семьях с двумя пораженными детьми. Считается, что это связано с генетическими мутациями с неполной пенетрантностью .
5 , 10q22 и 6q23. Существует небольшой риск рецидива при будущих беременностях, оцениваемый в 2-4%, который увеличивается до 25% в семьях с двумя пораженными детьми. Считается, что это связано с генетическими мутациями с неполной пенетрантностью .
HLHS также связан с несколькими генетическими синдромами, в том числе трисомией 13 (синдром Патау) , трисомии 18 (синдром Эдвардса) , частичные трисомии 9 , синдром Тернера (ХО) , синдром Якобсен (11q делецию синдром) , синдром Холт-Орам и Смит Синдром Лемли-Опица .
Факторы риска
Наличие кистозной гигромы увеличивает риск HLHS у плода.
Патофизиология
При рождении артериальный проток все еще открыт, и сопротивление кровотоку в легких выше нормы. Это обеспечивает адекватную оксигенацию за счет смешивания предсердий и нормальный внешний вид при рождении. Когда проток начинает закрываться и сопротивление легочных сосудов уменьшается, кровоток через проток ограничивается, а кровоток в легкие увеличивается.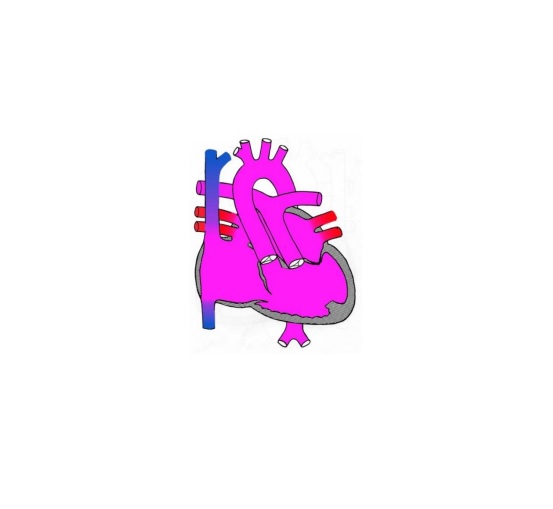
В типичной анатомии левая часть сердца получает кровь, богатую кислородом, из легких и перекачивает ее в остальное тело. У людей с HLHS аорта и левый желудочек недоразвиты (начинаются в утробе матери ), а аортальный и митральный клапаны либо слишком малы, чтобы обеспечить достаточный кровоток, либо полностью атретичны (закрыты). Поскольку кровь возвращается из легких в левое предсердие , левый желудочек не может перекачивать ее к остальной части тела. Новорожденный полагается на кровь, протекающую через дефект межпредсердной перегородки, чтобы смешивать оксигенированную и деоксигенированную кровь, и на открытый артериальный проток, позволяющий крови достигать аорты и большого круга кровообращения через правый желудочек. Это то, что определяет HLHS как дефект «единственного желудочка».
Из-за недоразвития левой части сердца в утробе матери повышенная постнагрузка вызывает гипертензию левого предсердия, отек легких и, следовательно, повреждение легких у плода до рождения.
Диагностика
Синдром гипоплазии левых отделов сердца может быть диагностирован пренатально или после рождения с помощью эхокардиографии. Типичные находки включают небольшой левый желудочек и аорту, аномалии митрального и аортального клапанов, ретроградный кровоток в поперечной дуге аорты и кровоток между предсердиями слева направо. Это часто распознается во втором триместре беременности, между 18 и 24 неделями.
Управление
Медицинское
Без вмешательств, продлевающих жизнь, HLHS фатален, но с вмешательством младенец может выжить. Кардио хирург может выполнить ряд операций или полную пересадку сердца . В то время как хирургическое вмешательство стало стандартом медицинской помощи в Соединенных Штатах, другие национальные системы здравоохранения, особенно во Франции, подходят к диагностике HLHS более консервативно, с акцентом на прерывание беременности или заботливую помощь после родов.
Перед операцией проток необходимо держать открытым, чтобы обеспечить кровоток при использовании препаратов, содержащих простагландин .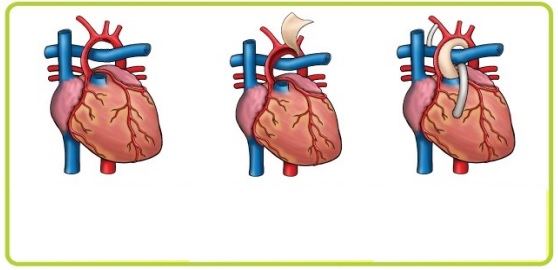 Воздух с меньшим содержанием кислорода, чем обычно, используется для младенцев с синдромом гипоплазии левых отделов сердца. Эти низкие уровни кислорода увеличивают сопротивление легочных сосудов (PVR) и, таким образом, улучшают приток крови к остальному телу из-за большей разницы давления между легкими и телом. Достижение уровня кислорода ниже атмосферного требует использования вдыхаемого азота. Оксид азота является сильнодействующим легочным вазодилататором и, таким образом, снижает ЛСС и улучшает венозный возврат. Любой фактор, увеличивающий PVR, будет препятствовать правостороннему потоку.
Воздух с меньшим содержанием кислорода, чем обычно, используется для младенцев с синдромом гипоплазии левых отделов сердца. Эти низкие уровни кислорода увеличивают сопротивление легочных сосудов (PVR) и, таким образом, улучшают приток крови к остальному телу из-за большей разницы давления между легкими и телом. Достижение уровня кислорода ниже атмосферного требует использования вдыхаемого азота. Оксид азота является сильнодействующим легочным вазодилататором и, таким образом, снижает ЛСС и улучшает венозный возврат. Любой фактор, увеличивающий PVR, будет препятствовать правостороннему потоку.
Хирургический
Хирургические операции по лечению гипоплазии левых отделов сердца сложны и должны быть индивидуализированы для каждого пациента. Кардиолог должен оценивать все медицинские и хирургические возможности в каждом конкретном случае.
В настоящее время младенцы подвергаются поэтапной реконструктивной хирургии ( процедура Норвуда или Сано в течение нескольких дней после рождения, процедура Гленна или Хеми-Фонтана в возрасте от 3 до 6 месяцев и процедура Фонтана в возрасте от 1,5 до 5 лет) или трансплантация сердца. Текущие ожидания состоят в том, что 70% людей с HLHS могут достичь совершеннолетия. Многие исследования показывают, что чем выше объем (количество проведенных операций) в больнице, тем ниже уровень смертности (смертности). Факторы, увеличивающие риск младенца, включают меньшую массу тела при рождении, дополнительные врожденные аномалии, генетический синдром или синдром с сильно ограничивающей перегородкой предсердия.) Для пациентов без этих дополнительных факторов риска 5-летняя выживаемость теперь приближается к 80%. Исследования показывают, что около 75% детей, переживших операцию, демонстрируют задержку развития в одной или нескольких областях, таких как двигательные, когнитивные или языковые нарушения, при этом около трети детей с одним желудочком без генетического синдрома имеют значительные нарушения. Текущие исследования сосредоточены на выявлении взаимосвязей между повреждениями нервного развития, хирургическими вмешательствами и процедурами интенсивной терапии и генетической предрасположенностью с целью изменения вмешательств, ухудшающих психологические и психологические исходы.
Текущие ожидания состоят в том, что 70% людей с HLHS могут достичь совершеннолетия. Многие исследования показывают, что чем выше объем (количество проведенных операций) в больнице, тем ниже уровень смертности (смертности). Факторы, увеличивающие риск младенца, включают меньшую массу тела при рождении, дополнительные врожденные аномалии, генетический синдром или синдром с сильно ограничивающей перегородкой предсердия.) Для пациентов без этих дополнительных факторов риска 5-летняя выживаемость теперь приближается к 80%. Исследования показывают, что около 75% детей, переживших операцию, демонстрируют задержку развития в одной или нескольких областях, таких как двигательные, когнитивные или языковые нарушения, при этом около трети детей с одним желудочком без генетического синдрома имеют значительные нарушения. Текущие исследования сосредоточены на выявлении взаимосвязей между повреждениями нервного развития, хирургическими вмешательствами и процедурами интенсивной терапии и генетической предрасположенностью с целью изменения вмешательств, ухудшающих психологические и психологические исходы. Альтернативой традиционному Норвуду является процедура Гибрид.
Альтернативой традиционному Норвуду является процедура Гибрид.
Некоторые врачи предлагают милосердную помощь вместо операции, которая приводит к смерти ребенка, обычно в течение 2 недель после рождения. За состраданием наблюдает врач, и он может осуществляться как в больнице, так и дома. Однако из-за значительного улучшения хирургического вмешательства, когда во многих больницах выживаемость превышает 90%, ведутся споры о том, следует ли по-прежнему предлагать семьям милосердный уход. Исследование, проведенное в 2003 году, показало, что группа врачей, являющихся экспертами по уходу за детьми с HLHS, была равномерно разделена, когда их спросили, что бы они сделали, если бы их собственные дети родились с HLHS, причем 1/3 заявили, что выбрали бы операцию1. / 3 заявили, что выбрали бы паллиативное (сострадательное) лечение без операции, и 1/3 заявили, что не уверены, какой выбор они сделают.
Трехэтапная процедура является паллиативной процедурой (а не лечением), поскольку кровообращение ребенка работает только с двумя из четырех камер сердца.
Процедура Норвуда
Первый шаг — процедура Норвуда . В этой процедуре правый желудочек используется для перекачки крови в большой круг кровообращения. Поскольку правый желудочек больше не перекачивает кровь напрямую в легкие, требуется шунт для прохождения дезоксигенированной крови через легкие. Либо подключичная артерия может быть подключена к малому кругу кровообращения ( шунт Блэлока-Тауссига ), либо шунт выполняется непосредственно из правого желудочка в малый круг кровообращения ( шунт Сано ). Узкая аорта увеличивается с помощью пластыря, чтобы улучшить приток крови к телу.
В это время ребенок может быть слабым с медицинской точки зрения и иметь проблемы с кормлением, потому что сердце очень сильно работает. В правом желудочке наблюдается значительная степень венозного перемешивания, что приводит к более низкому насыщению кислородом. Кроме того, как шунты Блэлока-Тауссига, так и шунты Сано подвергают легкие системному артериальному давлению, что приводит к долговременной легочной гипертензии и, в конечном итоге, к сердечной недостаточности.
Гибридная процедура
Гибридная процедура может использоваться вместо Норвуда. Гибридная процедура не требует использования искусственного кровообращения или выполнения стернотомии . Вместо шестичасовой операции «Гибрид» обычно занимает от одного до двух часов. В этой процедуре стент помещается в артериальный проток для поддержания его проходимости, а ленты накладываются на обе ветви левой и правой легочной артерии, чтобы ограничить давление и избыточное кровообращение в легких. Результаты гибридного подхода сравнимы с результатами применения Norwood.
Процедура Гленна
Вторая стадия — двунаправленная процедура Гленна или Хеми-Фонтана (см. Также процедуру Кавасима ) — снимает некоторые проблемы, вызванные паллиативной помощью Стадии I. При этой операции верхняя полая вена перевязана от сердца и соединена с малым кровообращением. В это время снимается шунт Блэлока-Тауссига или Сано. Легкие больше не подвергаются системному артериальному давлению, но гораздо более низкое венозное давление. Хотя венозная кровь из верхней половины тела больше не смешивается с насыщенной кислородом кровью в правом желудочке, венозная кровь из нижней части тела все еще смешивается, что приводит к некоторой степени десатурации кислородом.
Хотя венозная кровь из верхней половины тела больше не смешивается с насыщенной кислородом кровью в правом желудочке, венозная кровь из нижней части тела все еще смешивается, что приводит к некоторой степени десатурации кислородом.
Фонтан процедура
Последняя процедура, процедура Фонтана , завершает восстановление гипоплазии левого отдела сердца. Хотя существует несколько вариантов, функциональный эффект заключается в перенаправлении венозной крови из нижней части тела (через нижнюю полую вену) от правого предсердия в легочную артерию. Это должно исключить любое смешение оксигенированной и деоксигенированной крови в правом желудочке. Правый желудочек выполняет традиционную работу левого, снабжая организм насыщенной кислородом кровью, в то время как пассивное системное венозное давление выполняет традиционную работу правого желудочка, передавая дезоксигенированную кровь в легкие.
Хирургия плода
Вмешательства, проводимые во время внутриутробного развития плода, изучаются. У плодов с гипоплазией левого желудочка и неповрежденной межпредсердной перегородкой была предпринята попытка чрескожной септостомии предсердий .
У плодов с гипоплазией левого желудочка и неповрежденной межпредсердной перегородкой была предпринята попытка чрескожной септостомии предсердий .
Прогноз
95% нелеченных младенцев с HLHS умирают в первые недели жизни.
Ранняя выживаемость улучшилась с момента введения процедуры Норвуда. Поскольку долгосрочных исследований взрослых HLHS не проводилось, статистические данные обычно получают от пациентов, перенесших Фонтан; по оценкам, 70% пациентов с HLHS могут достичь совершеннолетия.
Прогноз зависит от состояния здоровья ребенка, так как при распространенных детских заболеваниях у младенцев повышается потребность в респираторной системе и частоте сердечных сокращений. У этого хрупкого населения небольшой сердечный резерв, чтобы удовлетворить эти потребности и обеспечить стабильность гемодинамики во время болезней.
Дети с HLHS и другими сопоставимыми заболеваниями одного желудочка, как группа, имеют более низкие результаты в области развития нервной системы, чем их здоровые сверстники. Был продемонстрирован дефицит речи, исполнительных функций и более высокий уровень тревожных и депрессивных расстройств. Некоторые из этих результатов могут быть следствием генетических факторов, связанных с HLHS, а другие могут быть изменены путем изменения процедур и условий здравоохранения. Клинический консенсус в отношении важности непрерывного наблюдения за развитием нервной системы с самых ранних лет до взрослого возраста формируется в настоящее время.
Был продемонстрирован дефицит речи, исполнительных функций и более высокий уровень тревожных и депрессивных расстройств. Некоторые из этих результатов могут быть следствием генетических факторов, связанных с HLHS, а другие могут быть изменены путем изменения процедур и условий здравоохранения. Клинический консенсус в отношении важности непрерывного наблюдения за развитием нервной системы с самых ранних лет до взрослого возраста формируется в настоящее время.
Как и у пациентов с другими типами пороков сердца, связанных с деформированными клапанами, пациенты с HLHS подвержены высокому риску эндокардита и должны находиться под наблюдением кардиолога до конца своей жизни, чтобы проверить свою сердечную функцию.
Может быть показана трансплантация сердца, как правило, после завершения операции по Фонтану. Одно многоцентровое исследование (пациентов, перенесших Фонтан в 1993-2001 гг.) Сообщило о 76% -ной годичной выживаемости у пациентов, доживших до трансплантации.
Эпидемиология
HLHS происходит примерно у 1 из 4 300 живорождений в Соединенных Штатах, или примерно у 960 живорождений в год в этой стране. В целом, по оценкам, он составляет 2-3% всех случаев врожденного порока сердца и является наиболее распространенным пороком одного желудочка. Считается, что он чаще встречается у младенцев мужского пола, в 1,5 раза чаще, чем у младенцев женского пола.
Рекомендации
внешние ссылки
Врожденные пороки сердца — факты о гипопластическом синдроме левых отделов сердца
Гипопластический (произносится как hi-puh-PLAS-tik) синдром левых отделов сердца или HLHS — это врожденный дефект, который влияет на нормальный кровоток через сердце.
Что такое синдром гипоплазии левых отделов сердца?
Синдром гипоплазии левых отделов сердца (HLHS) — это врожденный дефект, который влияет на нормальный кровоток через сердце. Поскольку ребенок развивается во время беременности, левая часть сердца формируется неправильно.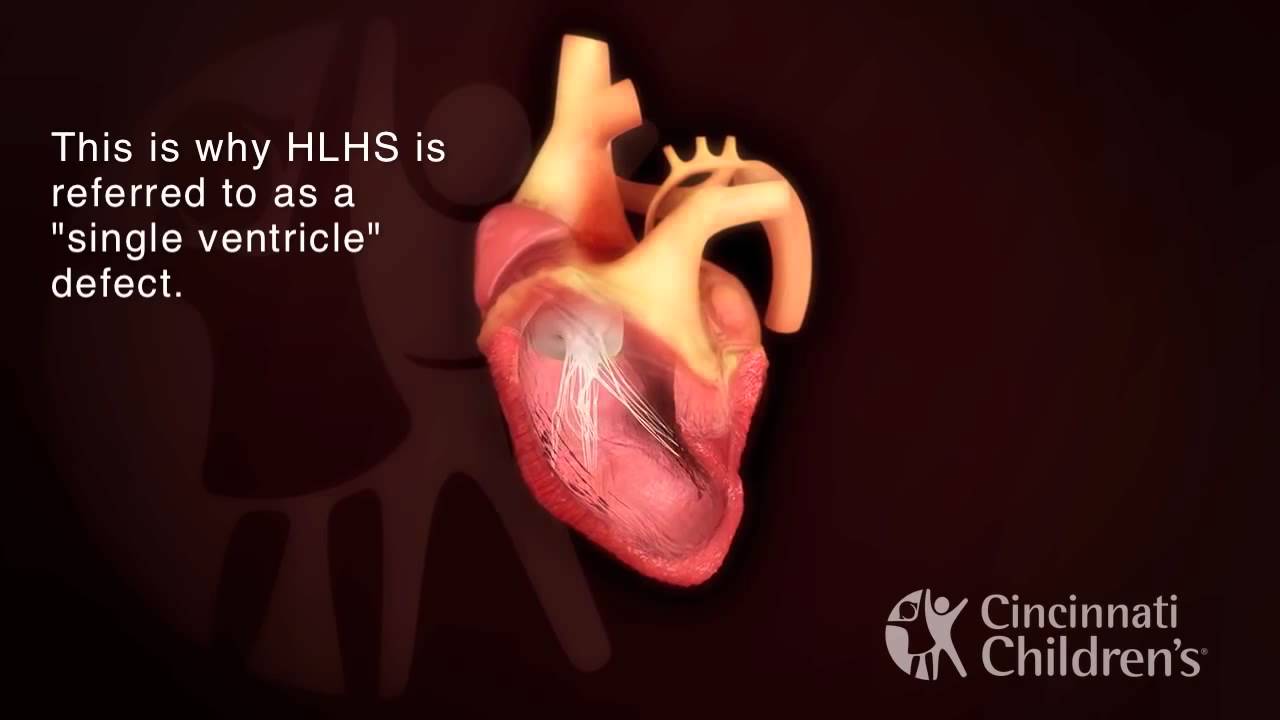 Синдром гипоплазии левых отделов сердца — это один из видов врожденного порока сердца. Врожденный означает наличие при рождении. Поскольку ребенку с этим дефектом требуется хирургическое вмешательство или другие процедуры вскоре после рождения, HLHS считается критическим врожденным пороком сердца (CCHD).
Синдром гипоплазии левых отделов сердца — это один из видов врожденного порока сердца. Врожденный означает наличие при рождении. Поскольку ребенку с этим дефектом требуется хирургическое вмешательство или другие процедуры вскоре после рождения, HLHS считается критическим врожденным пороком сердца (CCHD).
Синдром гипоплазии левых отделов сердца поражает ряд структур в левой части сердца, которые не полностью развиваются, например:
- Левый желудочек недоразвит и слишком мал.
- Митральный клапан не сформирован или очень мал.
- Аортальный клапан не сформирован или очень мал.
- Восходящая часть аорты недоразвита или слишком мала.
- Часто у детей с синдромом гипоплазии левых отделов сердца также имеется дефект межпредсердной перегородки, который представляет собой отверстие между левой и правой верхними камерами (предсердиями) сердца.
У ребенка без врожденного порока сердца правая сторона сердца перекачивает бедную кислородом кровь от сердца к легким. Левая часть сердца перекачивает богатую кислородом кровь к остальному телу. Когда ребенок растет в утробе матери во время беременности, между левой и правой сторонами сердца есть два небольших отверстия: открытый артериальный проток и открытый овальный проток . Обычно эти отверстия закрываются через несколько дней после рождения.
Левая часть сердца перекачивает богатую кислородом кровь к остальному телу. Когда ребенок растет в утробе матери во время беременности, между левой и правой сторонами сердца есть два небольших отверстия: открытый артериальный проток и открытый овальный проток . Обычно эти отверстия закрываются через несколько дней после рождения.
У младенцев с синдромом гипоплазии левых отделов сердца левая часть сердца не может перекачивать богатую кислородом кровь в организм должным образом. В течение первых нескольких дней жизни ребенка с синдромом гипоплазии левых отделов сердца богатая кислородом кровь обходит плохо функционирующую левую часть сердца через открытый артериальный проток и открытое овальное отверстие.Затем правая сторона сердца перекачивает кровь как к легким, так и к остальному телу. Однако у детей с синдромом гипоплазии левых отделов сердца, когда эти отверстия закрываются, богатой кислородом крови становится трудно добраться до остального тела.
Узнайте больше о том, как работает сердце »
происшествие
По оценкам Центров по контролю и профилактике заболеваний (CDC), каждый год в США рождается около 1025 детей с синдромом гипоплазии левых отделов сердца. 1 Другими словами, примерно 1 из каждых 3841 ребенка, рожденного в Соединенных Штатах каждый год, рождается с синдромом гипоплазии левых отделов сердца.
1 Другими словами, примерно 1 из каждых 3841 ребенка, рожденного в Соединенных Штатах каждый год, рождается с синдромом гипоплазии левых отделов сердца.
Женщины могут принимать меры до и во время беременности, чтобы снизить риск рождения ребенка с врожденными дефектами. Такие меры включают ежедневный прием поливитаминов с фолиевой кислотой (400 мкг), отказ от курения и отказа от алкоголя во время беременности.
Узнайте больше о том, как предотвратить врожденные дефекты »
Причины и факторы риска
Причины пороков сердца, таких как синдром гипоплазии левых отделов сердца у большинства младенцев, неизвестны.Некоторые дети имеют пороки сердца из-за изменений в их генах или хромосомах . Считается, что эти типы пороков сердца вызваны комбинацией генов и других факторов риска, таких как факторы, с которыми мать контактирует в окружающей среде, или то, что мать ест или пьет, или лекарства, которые она использует.
Подробнее о работе CDC над причинами и факторами риска »
Диагностика
Синдром гипоплазии левых отделов сердца может быть диагностирован во время беременности или вскоре после рождения ребенка..jpg)
Во время беременности
Во время беременности проводятся скрининговые тесты (также называемые пренатальными тестами) для выявления врожденных дефектов и других состояний. Синдром гипоплазии левых отделов сердца может быть диагностирован во время беременности с помощью ультразвука (который создает изображения тела). Некоторые результаты ультразвукового исследования могут заставить врача подозревать, что у ребенка синдром гипоплазии левых отделов сердца. Если это так, врач может запросить эхокардиограмму плода , ультразвуковое исследование сердца ребенка, чтобы подтвердить диагноз.Этот тест может показать проблемы со структурой сердца и то, как сердце работает с этим дефектом.
После рождения ребенка
Младенцы с синдромом гипоплазии левых отделов сердца могут не иметь проблем в течение первых нескольких дней жизни, пока открытый артериальный проток и открытое овальное отверстие (нормальные отверстия в сердце) открыты, но после закрытия этих отверстий быстро появляются признаки, в том числе :
- Проблемы с дыханием,
- Бьющееся сердце,
- Слабый пульс, или
- Пепельный или голубоватый цвет кожи.

Во время медицинского осмотра врач может увидеть эти признаки или услышать шум в сердце (ненормальный свистящий звук, вызванный неправильным кровотоком). Если слышен шум или присутствуют другие признаки, поставщик медицинских услуг может запросить один или несколько тестов для постановки диагноза, наиболее частым из которых является эхокардиограмма. Эхокардиография также помогает врачу следить за состоянием здоровья ребенка с течением времени.
HLHS — это дефект, который также может быть обнаружен при скрининге новорожденных с помощью пульсоксиметрии.Пульсоксиметрия — это простой прикроватный тест для определения количества кислорода в крови ребенка. Низкий уровень кислорода в крови может быть признаком ХБС. Скрининг новорожденных с использованием пульсоксиметрии может выявить некоторых младенцев с ХБП, например, HLHS, до того, как у них появятся какие-либо симптомы.
Процедуры
Лечение некоторых проблем со здоровьем, связанных с синдромом гипоплазии левых отделов сердца, может включать:
Лекарства
Некоторым младенцам и детям потребуются лекарства, которые помогут укрепить сердечную мышцу, снизить кровяное давление и помочь организму избавиться от лишней жидкости.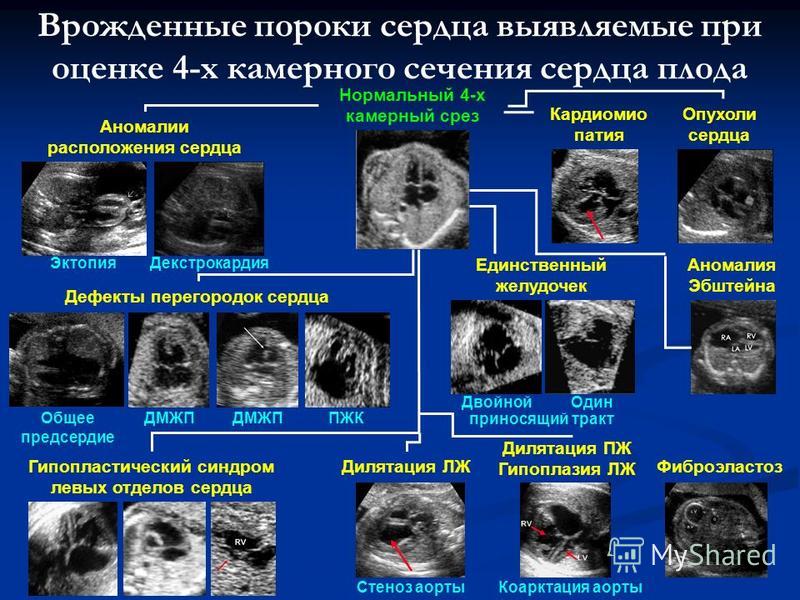
Питание
Некоторые дети с синдромом гипоплазии левых отделов сердца устают во время кормления и не едят достаточно, чтобы набрать вес. Чтобы обеспечить здоровую прибавку в весе младенцев, может быть прописана специальная высококалорийная смесь. Некоторые дети сильно устают во время кормления, и им может потребоваться кормление через зонд для кормления .
Хирургия
Вскоре после рождения ребенка с синдромом гипоплазии левых отделов сердца необходимо провести несколько операций в определенном порядке, чтобы увеличить приток крови к телу и обойти плохо функционирующую левую часть сердца.Правый желудочек становится главной насосной камерой тела. Эти операции не излечивают синдром гипоплазии левых отделов сердца, но помогают восстановить работу сердца. Иногда до или после операции назначают лекарства для лечения симптомов дефекта. Хирургия синдрома гипоплазии левых отделов сердца обычно проводится в три отдельных этапа:
- Процедура по Норвуду
Эта операция обычно проводится в течение первых 2 недель жизни ребенка. Хирурги создают «новую» аорту и соединяют ее с правым желудочком.Они также помещают трубку от аорты или правого желудочка к сосудам, снабжающим легкие (легочные артерии). Таким образом, правый желудочек может перекачивать кровь как к легким, так и к остальному телу. Это может быть очень сложная операция. После этой процедуры кожа младенца все еще может выглядеть голубоватой, потому что богатая кислородом и бедная кислородом кровь все еще смешиваются в сердце.
Хирурги создают «новую» аорту и соединяют ее с правым желудочком.Они также помещают трубку от аорты или правого желудочка к сосудам, снабжающим легкие (легочные артерии). Таким образом, правый желудочек может перекачивать кровь как к легким, так и к остальному телу. Это может быть очень сложная операция. После этой процедуры кожа младенца все еще может выглядеть голубоватой, потому что богатая кислородом и бедная кислородом кровь все еще смешиваются в сердце. - Процедура двунаправленного шунта Гленна
Обычно это выполняется, когда ребенку от 4 до 6 месяцев.Эта процедура создает прямую связь между легочной артерией и сосудом (верхней полой веной), возвращающим бедную кислородом кровь из верхней части тела в сердце. Это уменьшает работу, которую должен выполнять правый желудочек, позволяя крови, возвращающейся из тела, течь непосредственно в легкие. - Процедура Фонтана
Эта процедура обычно выполняется в период, когда младенцу от 18 месяцев до 3 лет. Врачи соединяют легочную артерию и сосуд (нижнюю полую вену), возвращая бедную кислородом кровь из нижней части тела к сердцу, позволяя остальной крови, возвращающейся из тела, идти в легкие.По завершении этой процедуры кровь, богатая и бедная кислородом, больше не смешивается в сердце, и кожа младенца больше не выглядит синеватой.
Врачи соединяют легочную артерию и сосуд (нижнюю полую вену), возвращая бедную кислородом кровь из нижней части тела к сердцу, позволяя остальной крови, возвращающейся из тела, идти в легкие.По завершении этой процедуры кровь, богатая и бедная кислородом, больше не смешивается в сердце, и кожа младенца больше не выглядит синеватой.
Младенцы, перенесшие эти операции, неизлечимы
У младенцев с синдромом гипоплазии левых отделов сердца могут быть пожизненные осложнения. Им потребуются регулярные контрольные визиты к кардиологу (кардиологу), чтобы следить за их прогрессом. Если синдром гипоплазии левых отделов сердца очень сложен или сердце становится слабым после операций, может потребоваться пересадка сердца.Младенцам, которым сделают пересадку сердца, необходимо будет принимать лекарства всю оставшуюся жизнь, чтобы их организм не отвергал новое сердце.
Список литературы
- Mai CT, Isenburg JL, Canfield MA, et al. для Национальной сети профилактики врожденных дефектов.
 Национальные популяционные оценки основных врожденных дефектов, 2010-2014 гг. Врожденные дефекты Res 2019; 1–16. Https://doi.org/10.1002/bdr2.1589.
Национальные популяционные оценки основных врожденных дефектов, 2010-2014 гг. Врожденные дефекты Res 2019; 1–16. Https://doi.org/10.1002/bdr2.1589.
Изображения находятся в общественном достоянии и, следовательно, свободны от каких-либо ограничений авторских прав.В порядке любезности мы просим, чтобы поставщик контента (Центры по контролю и профилактике заболеваний, Национальный центр по врожденным порокам и нарушениям развития) был указан и уведомлен о любом публичном или частном использовании этого изображения.
Изображения находятся в общественном достоянии и, следовательно, свободны от каких-либо ограничений авторских прав. В порядке любезности мы просим, чтобы поставщик контента (Центры по контролю и профилактике заболеваний, Национальный центр по врожденным порокам и нарушениям развития) был указан и уведомлен о любом публичном или частном использовании этого изображения.
Пренатальная помощь при гипопластическом синдроме левых отделов сердца | CS Mott Children’s Hospital
Синдром гипоплазии левых отделов сердца (HLHS) относится к недоразвитию левой части сердца, включая аорту, аортальный клапан, митральный клапан и левый желудочек.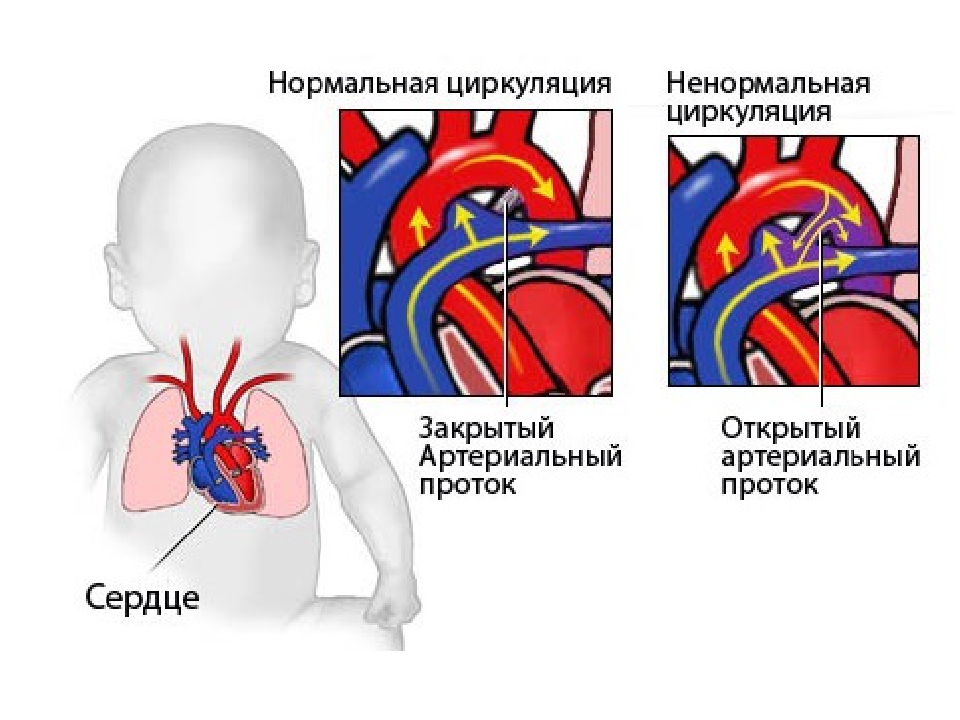 Левое сердце с гипоплазией не может перекачивать достаточно крови для удовлетворения потребностей организма и требует хирургического вмешательства вскоре после рождения. HLHS встречается примерно у 1 из 5000 рождений. Две трети пострадавших — мальчики.Более 85 процентов пациентов с HLHS, проходящих лечение в Мичиганском университете, доживают до выписки, что делает детскую больницу C.S. Mott Children’s Hospital мировым лидером в области лечения HLHS. Узнайте больше о синдроме гипоплазии левых отделов сердца. Достижения в области технологий привели к повышению способности диагностировать HLHS у младенцев до рождения . В Центре диагностики и лечения плода Michigan Medicine специалисты по материнской медицине плода (врачи, специализирующиеся на уходе за беременными с высоким риском) работают в тесном сотрудничестве со специалистами по сердечно-сосудистым заболеваниям из нашего центра врожденных пороков сердца, чтобы обеспечить беспрецедентную пренатальную диагностику и альтернативы лечения для матерей младенцев.
Левое сердце с гипоплазией не может перекачивать достаточно крови для удовлетворения потребностей организма и требует хирургического вмешательства вскоре после рождения. HLHS встречается примерно у 1 из 5000 рождений. Две трети пострадавших — мальчики.Более 85 процентов пациентов с HLHS, проходящих лечение в Мичиганском университете, доживают до выписки, что делает детскую больницу C.S. Mott Children’s Hospital мировым лидером в области лечения HLHS. Узнайте больше о синдроме гипоплазии левых отделов сердца. Достижения в области технологий привели к повышению способности диагностировать HLHS у младенцев до рождения . В Центре диагностики и лечения плода Michigan Medicine специалисты по материнской медицине плода (врачи, специализирующиеся на уходе за беременными с высоким риском) работают в тесном сотрудничестве со специалистами по сердечно-сосудистым заболеваниям из нашего центра врожденных пороков сердца, чтобы обеспечить беспрецедентную пренатальную диагностику и альтернативы лечения для матерей младенцев. поставлен диагноз HLHS.
поставлен диагноз HLHS.
Диагностика HLHS
Пренатальное УЗИ может определить проблемы с сердцем ребенка. Диагноз HLHS ставится на эхокардиограмме плода уже на 16 неделе беременности. В связи с тем, что в наш центр сердца плода обращается большое количество матерей со всей страны, наши специалисты по сердцу плода обладают беспрецедентным опытом точной диагностики HLHS пренатально.
Лечение плода HLHS
Лечение плода доступно для отдельных плодов с HLHS и рестриктивным дефектом межпредсердной перегородки.Потенциальные кандидаты на кардиологическое вмешательство плода пройдут всестороннюю оценку в центре сердца плода Micigan Medicine. Операция на сердце плода может потребовать разреза кожи матери для доступа к предсердию или, в зависимости от положения плода, может быть выполнена чрескожно. При чрескожной процедуре вводится баллонный катетер, чтобы открыть дефект межпредсердной перегородки. Это может предотвратить необратимое повреждение легочной сосудистой сети, а также предотвратить необходимость экстренного вмешательства с высоким риском при рождении.Это вмешательство может улучшить развитие сердца.
Операция на сердце плода может потребовать разреза кожи матери для доступа к предсердию или, в зависимости от положения плода, может быть выполнена чрескожно. При чрескожной процедуре вводится баллонный катетер, чтобы открыть дефект межпредсердной перегородки. Это может предотвратить необратимое повреждение легочной сосудистой сети, а также предотвратить необходимость экстренного вмешательства с высоким риском при рождении.Это вмешательство может улучшить развитие сердца.
Роды с HLHS
Если нет специального плана родов, рекомендуется вагинальное родоразрешение, а кесарево сечение — только по акушерским показаниям. Рекомендуется планировать роды в больнице, которая подготовлена к родам с высоким риском, а также включает в себя неонатальную интенсивную терапию, педиатрическую кардиологию и педиатрическую кардиоторакальную службу. Это поможет облегчить координацию медицинской помощи между специалистами и позволит при необходимости получить доступ к другим службам неотложной помощи.Мичиганский университет — один из немногих центров по всей стране, в котором родильный дом расположен в составе многопрофильной детской больницы. Эта уникальная установка обеспечивает бесшовную интеграцию между нашим частным родильным отделением, современным отделением интенсивной терапии новорожденных (NICU) и детским кардиоторакальным отделением интенсивной терапии в одном удобном месте.
Рекомендуется планировать роды в больнице, которая подготовлена к родам с высоким риском, а также включает в себя неонатальную интенсивную терапию, педиатрическую кардиологию и педиатрическую кардиоторакальную службу. Это поможет облегчить координацию медицинской помощи между специалистами и позволит при необходимости получить доступ к другим службам неотложной помощи.Мичиганский университет — один из немногих центров по всей стране, в котором родильный дом расположен в составе многопрофильной детской больницы. Эта уникальная установка обеспечивает бесшовную интеграцию между нашим частным родильным отделением, современным отделением интенсивной терапии новорожденных (NICU) и детским кардиоторакальным отделением интенсивной терапии в одном удобном месте.
Лечение синдрома гипоплазии левых отделов сердца после рождения
Центр врожденных пороков сердца Michigan Medicine предлагает комплексное лечение и долгосрочную помощь детям, рожденным с HLHS.
Может ли это повториться при другой беременности?
Большинство случаев HLHS вызвано случайным (спорадическим) событием; однако в некоторых семьях существует повышенный риск будущих беременностей, пораженных этим заболеванием. Приблизительный генетический риск для братьев и сестер ребенка с изолированным HLHS составляет 3%. Если выявлено изменение хромосомы, вероятность HLHS при будущих беременностях зависит от типа изменения хромосомы. В некоторых случаях может быть доступно пренатальное диагностическое тестирование. Ваш врач и генетический консультант встретятся с вами и обсудят риски вашей семьи.
Сделать следующий шаг
Если у вас есть вопросы о программе по работе с сердцем плода в детской больнице C.S. Mott, вы хотите записаться на прием или если мы можем оказать вам дополнительную помощь, позвоните по телефону 1-877-475-6688.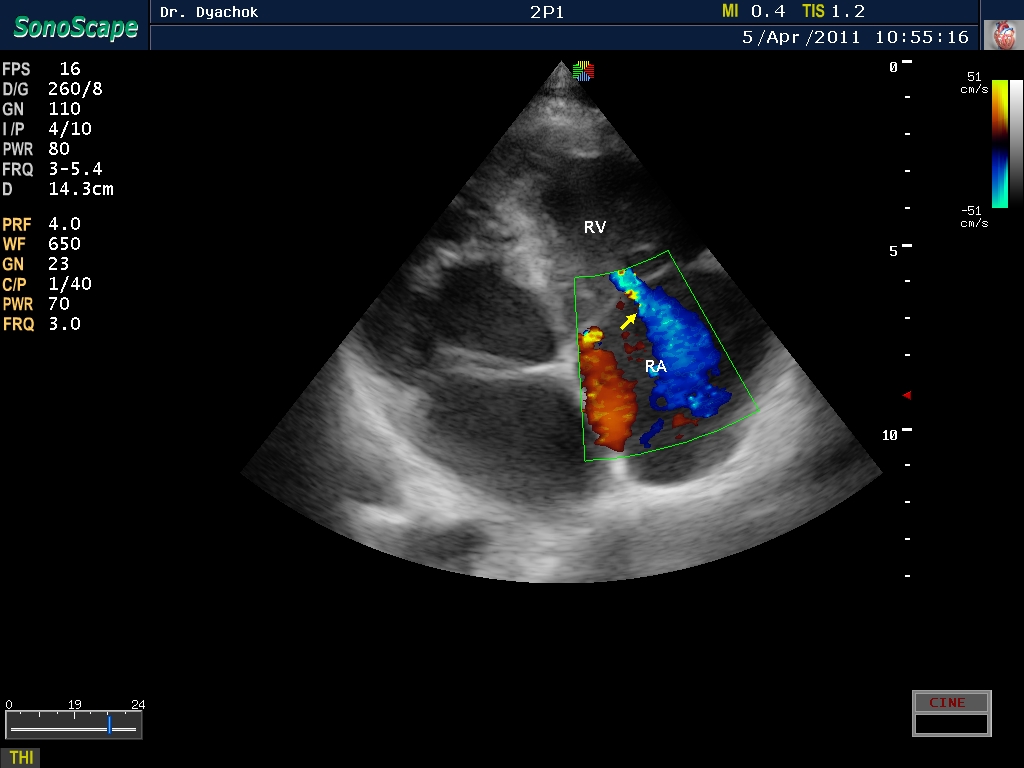
Синдром гипоплазии левых отделов сердца (HLHS)
Синдром гипоплазии левых отделов сердца (HLHS) — это тяжелый врожденный порок сердца, при котором левая сторона сердца недоразвита.
В нормальном сердце левая сторона сердца перекачивает насыщенную кислородом кровь в аорту, большую артерию, по которой кровь поступает в тело.У ребенка с HLHS:
- Митральный клапан, разделяющий две левые камеры сердца, слишком мал или полностью закрыт (атретический).
- Левый желудочек (нижняя, насосная камера) очень маленький.
- Аортальный клапан, разделяющий левый желудочек и аорту, слишком мал или полностью закрыт (атретический).
В дополнение к наиболее распространенной форме HLHS, показанной на анимации ниже, существует ряд сложных сердечных состояний с описанными вариациями структур.У этих детей, у которых один желудочек также мал (иногда их называют «вариантами HLHS»), стратегия лечения аналогична стратегиям лечения более типичных HLHS, которые показаны на анимации ниже.
Узнайте больше о HLHS от экспертов Кардиологического центра Детской больницы Филадельфии в этой серии видео.
Следующие симптомы синдрома гипоплазии левых отделов сердца могут присутствовать при рождении или через несколько дней:
- Синий или фиолетовый оттенок губ, кожи и ногтей (цианоз)
- Затрудненное дыхание
- Затруднение при кормлении
- Вялость (сонливость или отсутствие реакции)
Часто синдром гипоплазии левых отделов сердца диагностируется до рождения с помощью эхокардиограммы плода (УЗИ).Наша программа «Сердце плода» может помочь вам подготовить план родов и ухода сразу после рождения.
Иногда HLHS диагностируется через несколько часов или дней после рождения, и ребенку требуется немедленная терапия. Для диагностики HLHS могут потребоваться некоторые или все из следующих тестов:
- Эхокардиограмма (также называемая «эхо» или ультразвуком): звуковые волны создают изображение сердца
- Электрокардиограмма (ЭКГ): запись электрической активности сердца
- Рентген грудной клетки
- Пульсоксиметрия: неинвазивный способ контроля содержания кислорода в крови
- Катетеризация сердца: тонкая трубка вводится в сердце через вену и / или артерию в ноге или через пупок («пупок»).

- МРТ сердца: трехмерное изображение показывает аномалии сердца
Попав в Детскую больницу Филадельфии, вашему ребенку понадобятся внутривенные (IV) лекарства и, возможно, вентилятор для помощи при дыхании.В нашем отделении интенсивной терапии сердца Эвелин и Дэниел М. Табас (Evelyn and Daniel M. Tabas) группа преданных своему делу специалистов по кардиологической реанимации немедленно приступит к процедурам, которые помогут стабилизировать состояние вашего ребенка.
Синдром гипоплазии левых отделов сердца без раннего вмешательства чаще всего заканчивается летальным исходом. По сравнению с тем, что было 25 лет назад, сейчас существует множество различных вариантов лечения этого сложного сердечного заболевания; индивидуальный подход к каждому ребенку. Ваш врач объяснит каждый индивидуальный вариант и почему вашему ребенку может быть рекомендован один конкретный подход.
Хирургия синдрома гипопластической левого сердца
Как правило, вашему ребенку требуется операция на открытом сердце для перенаправления богатой кислородом («красной») крови и бедной кислородом («синей») крови.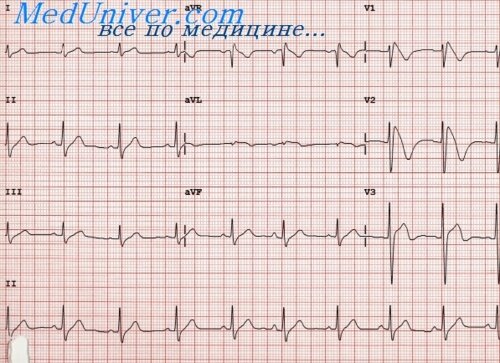 После этих операций:
После этих операций:
- Правая сторона сердца будет делать то, что обычно выполняет левая сторона — перекачивать насыщенную кислородом кровь в тело.
- Обезоксигенированная кровь будет течь из вен в легкие, не проходя через сердце.
Серия из трех реконструктивных операций по восстановлению HLHS — процедуры Норвуда, Гленна и Фонтана — известна как «Поэтапная реконструкция».«
Частое наблюдение в младенчестве и раннем детстве важно для минимизации факторов риска возможной операции Фонтана. Вашему ребенку также потребуется индивидуальная серия диагностических тестов между запланированными этапами операции и на протяжении всего детства. Также может быть рекомендована дополнительная хирургическая или катетерная терапия, а в редких случаях — трансплантация сердца.
Между операциями Norwood и Glenn
Хотя ранние исходы для пациентов с пороком сердца с одним желудочком после поэтапной реконструкции значительно улучшились, период между процедурой Норвуда и операцией Гленна остается очень уязвимым временем для младенцев. CHOP разработал программу мониторинга одного желудочка у младенцев, чтобы сосредоточить внимание на уходе и наблюдении за детьми с пороками сердца с одним желудочком, такими как HLHS, в период между первой и второй реконструктивной операцией.
CHOP разработал программу мониторинга одного желудочка у младенцев, чтобы сосредоточить внимание на уходе и наблюдении за детьми с пороками сердца с одним желудочком, такими как HLHS, в период между первой и второй реконструктивной операцией.
До 18 лет
Детям, которым была проведена хирургическая реконструкция по поводу HLHS, требуется пожизненная помощь кардиолога, имеющего опыт лечения врожденных пороков сердца. Иногда у них возникают серьезные проблемы со здоровьем. Многие продолжают принимать лекарства, и могут потребоваться дополнительные операции.
Пациенты с Фонтановым кровообращением относятся к пациентам с одним желудочком. По мере того, как эти пациенты становятся старше, врачи признают, что, хотя у некоторых все хорошо, у многих возникают осложнения. Эти осложнения могут включать заболевания легких, печени и желудочно-кишечного тракта. У CHOP есть специальная программа, Клиника выживания с одним желудочком, часть программы Фонтана по реабилитации, оздоровлению, развитию активности и устойчивости (FORWARD), которая специализируется на уходе за этими пациентами и исследует улучшенные методы лечения для них.
Как группа, дети со сложными врожденными пороками сердца, перенесшие операцию на открытом сердце в младенчестве, также подвержены более высокому риску нарушений нервного развития по сравнению с детьми без врожденных пороков сердца. Кардиологический центр при CHOP создал Программу последующего наблюдения за развитием кардиологических детей, чтобы обеспечить оценку, скрининг и клиническую помощь детям со сложными формами ИБС, которые подвержены риску нарушения психического развития.
Наши детские кардиологи наблюдают за пациентами, пока они не станут взрослыми, координируя лечение с врачами первичной помощи.
Во взрослую жизнь
Поможем пожилым пациентам с этим заболеванием перейти к взрослому кардиологу. Центр врожденных пороков сердца у взрослых в Филадельфии, совместная программа Детской больницы Филадельфии и Пенсильванского университета, удовлетворяет уникальные потребности взрослых, родившихся с пороками сердца.
Синдром гипоплазии левых отделов сердца (HLHS)
Обзор
Синдром гипоплазии левых отделов сердца (HLHS) — это сложный врожденный порок сердца, который возникает, когда левая сторона сердца не формируется должным образом. Митральный клапан, левый желудочек и аортальный клапан слишком малы, и через левую часть сердца перекачивается недостаточно крови, чтобы поддерживать остальную часть тела.
Митральный клапан, левый желудочек и аортальный клапан слишком малы, и через левую часть сердца перекачивается недостаточно крови, чтобы поддерживать остальную часть тела.
Связанные с этим состояния включают развитие HLHS, когда клапан начинает сужаться, и есть опасения, что у ребенка будет HLHS ко времени рождения, и пограничное левое сердце, где несколько левых структур меньше, чем они должны быть. Другие варианты HLHS включают гипопластический комплекс левых отделов сердца и стеноз аорты плода.
Texas Children’s имеет обширный опыт проведения внутриутробных вмешательств на сердце плода при всех трех состояниях с одними из самых успешных результатов в стране. На самом деле, Техасский детский кардиологический центр занимает первое место в стране по версии U.S. News & World Report.
Симптомы и причины
Младенцы, рожденные с синдромом гипоплазии левых отделов сердца, часто имеют синюю кожу, что свидетельствует о недостатке кислорода в их крови. Это происходит потому, что левая часть сердца не может работать должным образом.Легочная гипертензия или высокое кровяное давление в легких — частое осложнение, которое может вызвать долгосрочное повреждение легких. При отсутствии лечения состояние детей с HLHS быстро ухудшается.
Это происходит потому, что левая часть сердца не может работать должным образом.Легочная гипертензия или высокое кровяное давление в легких — частое осложнение, которое может вызвать долгосрочное повреждение легких. При отсутствии лечения состояние детей с HLHS быстро ухудшается.
По данным CDC, HLHS встречается примерно у 1 из 4344 живорождений. Только около 10 процентов этих случаев являются достаточно серьезными, чтобы потребовать внутриутробного лечения. Большинство из них лечатся после рождения.
Неизвестно, что вызывает синдром гипоплазии левых отделов сердца. По оценкам, дети с HLHS имеют связанное генетическое заболевание.
Тестирование и диагностика
Синдром гипоплазии левых отделов сердца может быть диагностирован с помощью обычного ультразвукового исследования во время беременности, обычно на 18-20 неделе. Другие тесты, такие как эхокардиография плода, обычно необходимы для подтверждения диагноза и получения дополнительной информации о дефекте.
Иногда HLHS не обнаруживается до рождения ребенка.
Семьям, которые приходят в Техасский детский фетальный центр для лечения HLHS своего ребенка, сначала назначается медсестра-координатор, которая помогает назначить множество необходимых встреч и служит источником вопросов.Эта медсестра-координатор доступна круглосуточно и без выходных, чтобы ответить на любые ваши вопросы, помочь вам в любое время обратиться к врачам и другим специалистам и в целом провести вас через это сложное и эмоциональное время.
Ваш координатор соберет все предыдущие диагностические тесты и проведет эхокардиограмму плода. Вы посетите отделение интенсивной терапии новорожденных и встретитесь со своей командой врачей, которая может включать акушера, специалиста по медицине плода, кардиолога плода, генетика, кардиоторакального хирурга и неонатолога.
HLHS — это сложное заболевание, которое требует совместной работы множества специалистов для создания плана лечения, который приведет к наилучшим результатам.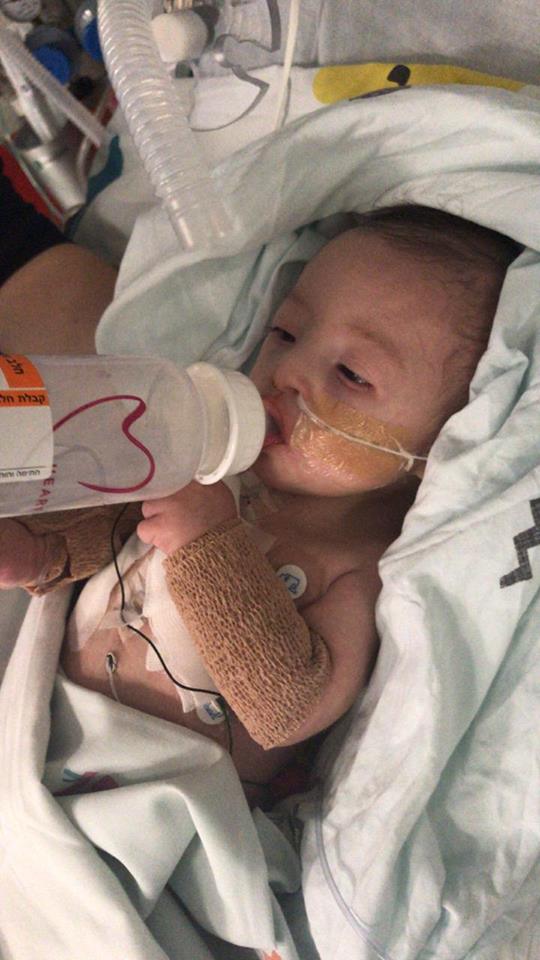 В дополнение к нескольким специалистам, упомянутым выше, вам также понадобятся анестезиолог для матери и один для ребенка, а также специалист по эхокардиографии плода.
В дополнение к нескольким специалистам, упомянутым выше, вам также понадобятся анестезиолог для матери и один для ребенка, а также специалист по эхокардиографии плода.
В Texas Children’s любого специалиста, который может понадобиться вашему ребенку, можно найти в той же больнице, где он родился.
Лечение — до родов
Детская больница Техаса — первая на юго-западе США.S. создать программу лечения этих дефектов внутриутробно. Наш Центр плода объединяет большую многопрофильную команду кардиологов, акушеров и гинекологов, интервенционных кардиологов, хирургов врожденных кардиохирургов, специалистов по визуализации плода, анестезиологов по материнству и плода и других клинических специалистов для лечения HLHS.
Если установлено, что у ребенка синдром гипоплазии левых отделов сердца (HLHS) с неповрежденной межпредсердной перегородкой, он может быть кандидатом на операцию на плоде, называемую баллонной септостомией предсердий.Эта процедура позволяет крови правильно течь между предсердиями.
Другим вариантом может быть процедура, называемая баллонной дилатацией аортального клапана.
Катетерная вальвулопластика аорты плода при стенозе аорты плода (развивающийся HLHS)
Мы выполняем эту катетерную процедуру для младенцев с тяжелым внутриутробным стенозом аорты (развивающийся HLHS). Крошечный баллон надувается внутри аортального клапана, чтобы открыть створки, которые затем удаляются. Это позволяет крови легче проходить через левую часть сердца плода и потенциально улучшать рост левых структур.
| Исходный уровень AS плода | Вальвулопластика плода при вмешательстве AS | АС плода после вмешательства |
Катетерные вмешательства на межпредсердной перегородке при HLHS с интактной или рестриктивной межпредсердной перегородкой (RAS)
Младенцы, у которых уже есть HLHS внутриутробно, без возможности роста левой структуры, зависят от отверстия в межпредсердной перегородке, которое поддерживает циркуляцию крови по всему телу.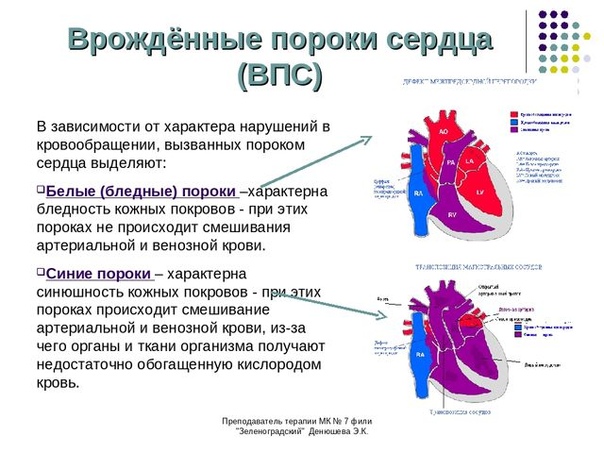 У некоторых младенцев этой дыры либо нет, либо она слишком мала, и у них высок риск осложнений и смерти. В процедуре на основе катетера мы используем баллон или стент для создания дефекта межпредсердной перегородки (отверстия между верхними камерами сердца), чтобы кровь продолжала течь через сердце плода.
У некоторых младенцев этой дыры либо нет, либо она слишком мала, и у них высок риск осложнений и смерти. В процедуре на основе катетера мы используем баллон или стент для создания дефекта межпредсердной перегородки (отверстия между верхними камерами сердца), чтобы кровь продолжала течь через сердце плода.
|
|
|
| HLHS с базовым уровнем RAS | HLHS с вмешательством RAS | HLHS с RAS после установки стента |
Хроническая гипероксигенация пограничных левых отделов сердца
Техасский детский фетальный центр для плодов с пограничным левым отделом сердца является первым в стране, предлагающим новый протокол исследования, согласно которому матери получают ежедневную кислородную терапию в течение третьего триместра.
Доставляя матери дополнительный кислород через лицевую маску или канюлю, мы надеемся увеличить количество кислорода в ее крови, количество кислорода, поступающего к плаценте и плоду, и, в конечном итоге, количество кислорода, поступающего в легкие плода и левая часть сердца ребенка. Улучшая приток крови к левой стороне сердца, также должен улучшиться рост.
Лечение — после родов
Если синдром гипоплазии левых отделов сердца не диагностируется до рождения ребенка, вмешивается Детский кардиологический центр Техаса.Согласно US News and World Report, наш кардиологический центр занимает первое место в стране, что делает нашу программу кардиологии плода идеальным местом, если у вашего будущего ребенка проблемы с сердцем, такие как HLHS.
Периодические осмотры в детстве являются обычным явлением, при этом встречи всей бригады назначаются за один день, чтобы облегчить жизнь семье.
Поскольку синдром гипоплазии левых отделов сердца сложно вылечить, большинству детей требуется три или более операций после рождения, в зависимости от тяжести дефекта и того, сколько времени требуется ребенку, чтобы набраться сил после рождения.Эти операции сопряжены с риском и требуют большого мастерства, потому что на этом этапе сердце ребенка размером с большую виноградину, а левый желудочек — с горошину.
Эти операции проводятся в следующем порядке:
.- Норвуд — Операция по Норвуду проводится в первую неделю жизни. Это серьезная операция на открытом сердце, направленная на восстановление дуги аорты, чтобы она могла лучше обеспечивать приток крови к телу. Детские кардиохирурги в Texas Children’s проводят процедуры Норвуда с 1995 года.Восстановление проходит в отделении интенсивной терапии интенсивной терапии и занимает от трех до четырех недель.
- Glenn — Через четыре-шесть месяцев происходит следующая операция — Glenn. Эта операция направляет половину крови из сердца непосредственно в легкие для реоксигенации, так что ей не нужно проходить через желудочек.
- Фонтан — Фонтан обычно выполняется через 18–36 месяцев после операции Гленна. Это создает отдельный канал для направления крови к легочной артерии.
Жизненно важно, чтобы ребенок с HLHS был доставлен в больницу с расширенными возможностями отделения интенсивной терапии и ухода за матерью. Это связано с тем, что младенцам с HLHS часто требуется агрессивная реанимация, чтобы повысить свои шансы на выживание.
Возможно, наиболее важным для вашей семьи является то, что команда техасских детей предложит вам лучший доступный план ухода с максимально возможным количеством вариантов, а затем позволит вашей семье принять решение без суждения.
Истории пациентов
Синдром гипоплазии левых отделов сердца | Информационный центр по генетическим и редким заболеваниям (GARD) — программа NCATS
Следующая информация может помочь ответить на ваш вопрос:
Что такое синдром гипоплазии левых отделов сердца (HLHS)?
Синдром гипоплазии левых отделов сердца (HLHS) — это заболевание сердца, присутствующее с рождения (врожденный порок сердца).При HLHS левая сторона сердца (включая аорту, аортальный клапан, левый желудочек и митральный клапан) недоразвита. [1] При рождении богатая кислородом кровь обходит недоразвитую левую часть сердца, проходя через отверстия между левой и правой стороной, которые обычно закрываются через несколько дней после рождения (открытый артериальный проток и открытое овальное отверстие). Затем правая сторона сердца перекачивает кровь в легкие и тело. Поэтому в течение нескольких дней симптомы могут отсутствовать. Однако, когда эти отверстия закрываются, богатая кислородом кровь не может легко добраться до остальной части тела.Затем симптомы развиваются быстро и могут включать проблемы с дыханием, учащенное сердцебиение, слабый пульс и / или пепельный или синеватый цвет кожи. У некоторых детей с HLHS также есть другие пороки сердца, такие как дефект межпредсердной перегородки. [2]У большинства детей с HLHS причина неизвестна. [2] Это обычно спорадически возникает у здоровых детей. [3] Известно, что у некоторых детей изолированные HLHS являются генетическими. Эти случаи могут быть связаны с мутациями в гене GJA1 с аутосомно-рецессивным наследованием или в гене NKX2-5 с аутосомно-доминантным наследованием. [4] [5] Сообщалось также о HLHS с некоторыми генетическими нарушениями, включая синдром Тернера, синдром Якобсена, трисомию 13 и трисомию 18. [3]
Если не лечить, HLHS является смертельным в течение первого несколько дней или недель жизни. [1] Хотя лечение затруднено, хирургическое и медицинское вмешательство повысило шансы на выживание. Лечение может включать в себя серию операций по восстановлению функции левой части сердца (поэтапная реконструкция) или трансплантация сердца.Однако даже при лечении возможны пожизненные осложнения и может сократиться продолжительность жизни. [3]
Последнее обновление: 05.06.2018
Каковы признаки и симптомы синдрома гипоплазии левых отделов сердца (HLHS)?
Новорожденный с HLHS может не иметь никаких симптомов сразу после рождения.Признаки и симптомы обычно развиваются в течение нескольких часов или дней после рождения. Эти симптомы могут включать: [6] [2] [7]- Цианоз (синеватое изменение цвета кожи или появление «пепельного» цвета)
- Холодные руки и ноги
- Недостаток энергии (вялость)
- Низкий диурез
- Слабый пульс
- Плохое вскармливание и кормление
- Бьющееся сердце
- Проблемы с дыханием (учащенное дыхание или одышка)
- Метаболический ацидоз
Последнее обновление: 07.09.2017
Насколько распространен синдром гипоплазии левых отделов сердца (HLHS)?
Центры по контролю и профилактике заболеваний (CDC) подсчитали, что каждый год в США рождается около 960 детей с синдромом гипоплазии левых отделов сердца (примерно 1 на каждые 4344 ребенка). [2] На HLHS приходится от 2 до 3 процентов всех врожденных пороков сердца. Число случаев может быть недооценено из-за неизвестной частоты выкидышей или планового прерывания беременности у нерожденных детей с HLHS. [3]Последнее обновление: 07.09.2017
Как лечить синдром гипоплазии левых отделов сердца (HLHS)?
После постановки диагноза HLHS ребенок, скорее всего, будет помещен в отделение интенсивной терапии новорожденных (NICU). [6] Варианты лечения должны быть четко объяснены родителям и семьям, чтобы они могли принять наиболее обоснованное решение. Варианты лечения могут включать поэтапные операции, трансплантацию сердца и меры по обеспечению комфорта (без хирургического вмешательства). Большинство детских кардиологов и хирургов в США рекомендуют поэтапное хирургическое вмешательство, и среди экспертов ведутся споры о том, следует ли вообще предлагать комфортный уход в качестве опции. Улучшения в медицинской и хирургической помощи значительно улучшили результаты для детей с HLHS. [3] Однако не гарантируется выживание детей, перенесших хирургическое вмешательство. Хотя некоторые врачи рассматривают трансплантацию сердца как альтернативу трехэтапной операции, для маленьких детей доступно несколько пожертвованных сердец. [6]Первоначальное лечение направлено на то, чтобы помочь ребенку дышать и сохранить открытый артериальный проток, чтобы кровь циркулировала по телу (с простагландином E1). Эти меры стабилизируют состояние ребенка до первой операции. [6] [3]
Поэтапное хирургическое вмешательство состоит из 3 процедур: одна для новорожденного, одна в возрасте от 3 до 6 месяцев и одна в возрасте от 18 до 30 месяцев. [3] Выбор конкретной процедуры для каждого этапа может варьироваться в зависимости от индивидуальных особенностей ребенка. Некоторым людям может потребоваться больше операций позже, если у них развиваются осложнения из-за состояния или из-за предыдущих операций. [6]
Последнее обновление: 8.09.2017
Каковы долгосрочные перспективы для людей с синдромом гипоплазии левых отделов сердца (HLHS)?
Если не лечить, HLHS приводит к летальному исходу.Показатели выживаемости при поэтапном хирургическом вмешательстве продолжают расти по мере улучшения хирургических методов и ухода после операции. [6] В настоящее время существуют оценки 3–5-летней выживаемости в 70% для младенцев, у которых восстановлена стадия I. Для детей, доживающих до 12 месяцев, долгосрочное выживание составляет около 90 процентов. [3] Размер и функция правого желудочка важны для определения исхода у ребенка после операции. [6]Данных о качестве жизни пациентов с HLHS немного.Поскольку все больше людей выживают после инсценированных операций, сейчас собирается больше информации о долгосрочном опыте людей, рожденных с HLHS. [3] У тех, кто выжил после лечения от HLHS, наблюдается значительная заболеваемость, включая повышенный риск тромботических осложнений (свертывания крови), снижение толерантности к физической нагрузке и нарушения развития нервной системы. Тромботические осложнения могут быть связаны со смертностью, инсультом и тромбоэмболией легочной артерии. [3]
Последнее обновление: 05.06.2018
Надеемся, эта информация будет вам полезна.Мы настоятельно рекомендуем вам обсудить эту информацию со своим врачом. Если остались вопросы, пожалуйста Связаться с нами.
Теплые пожелания,
Специалист по информации GARD
См. Наш отказ от ответственности.
Синдром гипоплазии левых отделов сердца (HLHS): обзор и гибридное лечение
Как лечится HLHS?
В Nationwide Children’s мы предлагаем программу лечения одного желудочка, которая ориентирована на особые потребности этих детей.Мы также предлагаем несколько лечебных подходов. Здесь был разработан один вариант, гибридный подход, который избавляет ребенка от операции на открытом сердце до тех пор, пока ребенок не станет старше и больше. Эта процедура включает стентирование открытого артериального протока (ОАП) и привязку кровеносных сосудов к легким (легочные артерии). Ребенок возвращается в возрасте от 4 до 6 месяцев для операции на открытом сердце. Другой вариант называется Норвуд. Здесь хирург соединяет основные кровеносные сосуды сердца, чтобы кровь могла перекачиваться в тело.Затем соединяют трубку от кровеносного сосуда тела (аорты) с кровеносным сосудом легкого (легочной артерией). Ребенку необходимо вернуться в возрасте от 4 до 6 месяцев для следующей операции. Оба вышеперечисленных варианта требуют от ребенка дальнейших процедур и операций. Другая возможность — пересадка сердца.
Вариант лечения 1: Гибридный подход
Гибридная процедура выполняется в Hybrid Suite. Этот специализированный комплекс представляет собой совмещенную операционную и комнату катетеризации сердца.На первом этапе ребенку не требуется искусственное кровообращение. Его можно использовать для младенцев с меньшим весом и для семей, которые запрашивают альтернативное лечение без использования крови. 1 этап обычно выполняется в течение первой недели жизни.
Hybrid Stage I состоит из:
Наложение бандажей вокруг правой и левой легочных артерий. Это ограничивает приток крови к легочным артериям, тем самым уравновешивая кровообращение (в легких и в теле).Это также уменьшает дополнительный приток крови к легким.
Стентирование КПК сохраняет КПК открытым и поддерживает связь с аортой и кровообращением тела.
Между двумя верхними камерами сердца (предсердиями) должно быть достаточное соединение, чтобы обеспечить открытый кровоток и смешивание крови, богатой и бедной кислородом. Это можно сделать с помощью баллонной септостомии предсердий. В этой процедуре через перегородку между двумя предсердиями проводится небольшая трубка (катетер).Затем надувается баллон на конце катетера и протягивается обратно через перегородку, чтобы увеличить отверстие.
Цели этого первого этапа операции включают:
Открытый кровоток через КПК,
Разблокированная перегородка предсердия
Сбалансированный кровоток через легкие и остальные части тела.
Восстановление: гибридный этап 1
Продолжительность пребывания в больнице может варьироваться в зависимости от выздоровления каждого ребенка.Средняя продолжительность пребывания обычно составляет 2-4 недели. После операции ребенок отправляется в отделение интенсивной терапии сердца для тщательного наблюдения. Ребенок может находиться на аппарате искусственного дыхания и у него будет внутривенная линия для наблюдения и введения лекарств. После того, как ребенок полностью выздоровеет после операции, ребенок будет переведен на обычное сердечное дно. Иногда младенцам, перенесшим операцию на сердце, необходимо научиться есть. Это связано с тем, что перед операцией ребенка не кормили ртом, и он может быстрее устать, чем ребенок без сердечных заболеваний.
Продолжение
Детский кардиолог будет очень внимательно следить за вашим ребенком, когда вы пойдете домой. Очень важно приводить ребенка на все назначенные встречи. Эти контрольные визиты обычно проводятся каждые 2 недели. Некоторых младенцев необходимо более внимательно наблюдать и осматривать каждую неделю.
II комплексный этап
Это операция на открытом сердце. Это делается в операционной и требует использования аппарата искусственного кровообращения.Обычно это делается в возрасте от 4 до 6 месяцев. Сюда входят:
Удаление стента ОАП и тяжей легочной артерии. Легочные артерии восстанавливаются, а межпредсердная перегородка увеличивается хирургическим путем.
Дуга аорты увеличивается путем отсоединения небольшой восходящей аорты и соединения аорты с корнем легкого, чтобы образовался один большой сосуд. (новая аорта)
Верхняя полая вена соединяется с легочной артерией.Это называется шунтом Гленна. Это позволяет потоку крови из верхней части тела поступать непосредственно в легочную артерию, и кровь не прокачивается сначала через сердце. Это пассивный приток крови к легким. Эту процедуру нельзя проводить сразу после рождения, поскольку сопротивление легких слишком велико, чтобы обеспечить пассивный приток крови к легким.
Восстановление: II этап комплексного
Продолжительность пребывания в больнице будет варьироваться. Среднее время восстановления — 1-3 недели.После операции ребенок отправится в отделение интенсивной терапии сердца (CICU), и ему будет поставлен дренажный зонд и внутривенные каналы (IV). Капельницы будут использоваться для наблюдения и выдачи лекарств. Пока ребенок находится на дыхательном аппарате или требует пристального наблюдения, он будет оставаться в CICU. Когда ребенок выздоравливает, его переводят в кардиологическое отделение на оставшуюся часть пребывания в больнице. Средняя продолжительность пребывания в больнице обычно составляет от 1 до 2 недель.
Этап III: Процедура Фонтана
Последняя операция обычно проводится в возрасте около 2 лет.На этом этапе требуется операция на открытом сердце в операционной. Ребенок находится на аппарате искусственного кровообращения на той же стадии, что и на стадии II. В это время кровь из нижней части тела, которая возвращается к сердцу через нижнюю полую вену, направляется напрямую в легочную артерию. Это делает всю кровь, возвращающуюся из тела, более «пассивным кровотоком». После завершения последней операции кровоток из верхней части тела вернется в легкие через соединение верхней полой вены. Кровь будет достигать легких из нижней части тела через соединение нижней полой вены.
Восстановление: этап III
Восстановление после операции будет аналогично процедуре Этапа II. Одно из важных отличий заключается в том, что у ребенка может быть более одной грудной трубки для отвода жидкости вокруг легкого. Теперь вся кровь из организма возвращается в легкие «пассивным путем», который требует более высокого давления. Следовательно, жидкость может вытекать вокруг легких, и ее необходимо слить. Иногда эти плевральные дренажные трубки должны оставаться внутри на более длительное время, чтобы слить жидкость.Ребенок может восстанавливаться с помощью обычного сердечного дна, и в это время рекомендуется вставать с постели и играть. Продолжительность пребывания варьируется от одной до трех недель.
Вариант лечения 2: Традиционный Норвуд
Традиционный подход на первом этапе для HLHS — это операция, широко известная как процедура Норвуда, названная в честь врача, который первым начал лечение. Ремонт требует использования шунтирования или аппарата искусственного кровообращения.
В ремонт Norwood входят:
Установка шунта или пути между аортой и легочной артерией.Шунт называется модифицированным шунтом Блэлока-Тауссига (BT Shunt).
Септэктомия предсердий или удаление мышечной перегородки между верхними камерами сердца (так называемыми предсердиями)
Отсоединение правой и левой легочной артерии от основной легочной артерии
Соединение главной легочной артерии с гипоплазированной аортой для создания «новой» аорты.
Увеличение или увеличение гипопластической дуги аорты
Восстановление: Норвуд
После операции ребенок будет помещен в отделение интенсивной терапии сердца (CICU).Ребенок будет находиться под пристальным наблюдением в CICU. Ребенок будет находиться на дыхательном аппарате и у него будет грудная трубка для отвода жидкости из области сердца и легких. Также у ребенка будут внутривенные трубки для наблюдения и введения лекарств. Продолжительность пребывания в больнице после Норвуда варьируется. Средняя продолжительность пребывания составляет 2-3 недели. После того, как ребенок полностью выздоровеет после операции, он будет переведен на обычное сердечное дно.
Часто после Норвуда ребенку нужно будет научиться есть.Это связано с тем, что ребенка не кормили ртом до операции, и он может быстрее устать, чем ребенок без сердечных заболеваний. В это время ребенок будет находиться на обычном сердечном дне. Иногда ребенку приходится идти домой с временным зондом для кормления. Ваш ребенок будет принимать сердечные препараты.
Этап II: Гленн Шант
Для этой процедуры ребенка снова помещают на аппарат искусственного кровообращения. Верхняя полая вена прикрепляется непосредственно к легочной артерии, и шунт BT удаляется.Эта операция на сердце менее сложна, чем процедура Норвуда, потому что большая часть работы была сделана, когда ребенок был новорожденным. Эта процедура обычно проводится в возрасте 6 месяцев.
Восстановление: этап II
Продолжительность пребывания в больнице будет разной, но средняя продолжительность пребывания составляет около недели. После операции ребенок отправится в отделение интенсивной терапии сердца (CICU). Пока ребенок находится на дыхательном аппарате или за ним необходимо пристальное наблюдение, он будет оставаться в CICU.После того, как ребенок полностью выздоровеет после операции, он будет переведен на обычное сердечное дно.
Этап III: Процедура Фонтана
Последняя операция обычно проводится в возрасте около 2 лет. На этом этапе требуется операция на открытом сердце в операционной. Ребенок находится на аппарате искусственного кровообращения на той же стадии, что и на стадии II. В это время кровь из нижней части тела, которая возвращается к сердцу через нижнюю полую вену, направляется напрямую в легочную артерию.Это делает всю кровь, возвращающуюся из тела, более «пассивным кровотоком». После завершения последней операции кровоток из верхней части тела вернется в легкие через соединение верхней полой вены. Кровь будет достигать легких из нижней части тела через соединение нижней полой вены.
Восстановление: этап III
Восстановление после операции будет аналогично процедуре Этапа II. Одно из важных отличий заключается в том, что у ребенка может быть более одной грудной трубки для отвода жидкости вокруг легкого.Теперь вся кровь из организма возвращается в легкие «пассивным путем», который требует более высокого давления. Следовательно, жидкость может вытекать вокруг легких, и ее необходимо слить. Иногда эти плевральные дренажные трубки должны оставаться внутри на более длительное время, чтобы слить жидкость. Ребенок может восстанавливаться с помощью обычного сердечного дна, и в это время рекомендуется вставать с постели и играть. Продолжительность пребывания варьируется от одной до трех недель.
Вариант лечения 3: Пересадка сердца
Пересадка сердца включает замену больного сердца новым сердцем (донорским сердцем).Трансплантация сердца сопряжена с риском. Детям необходимо будет принимать лекарства на протяжении всей жизни, чтобы их собственное тело не атаковало сердце, что называется отторжением. Долгосрочные осложнения трансплантата включают возможное отторжение, инфекцию, коронарную болезнь и особый тип лимфомы, связанный с иммуносупрессией. Дети, которым требуется трансплантация, будут помещены в список ожидания, составленный национальным агентством под названием United Network for Organ Sharing. Время ожидания может составлять дни, месяцы или даже больше года.Некоторые младенцы могут умереть, находясь в списке ожидания. Пересаженное сердце прослужит в среднем 8-14 лет. Некоторым детям также требуется повторная трансплантация.
Вариант лечения 4: Сострадательный уход
Иногда семьи отказываются от операции при рождении и позволяют своему ребенку родиться естественным путем. Это личное решение семьи, и Nationwide Children’s будет уважать и поддерживать вас в этом решении.
Синдром гипоплазии левых отделов сердца — NORD (Национальная организация редких заболеваний)
УЧЕБНИКИ
Mulreany M, Donner RM.Синдром гипоплазии левых отделов сердца. В: Справочник НОРД по редким заболеваниям. Липпинкотт Уильямс и Уилкинс. Филадельфия, Пенсильвания. 2003: 50-1.
Берман Р.Э., изд. Учебник педиатрии Нельсона, 15-е изд. Филадельфия, Пенсильвания: W.B. Компания Сондерс; 1996: 1325-28.
Буйс М.Л., изд. Энциклопедия врожденных пороков. Довер, Массачусетс: Научные публикации Блэквелла; Для: Центр информационных услуг по врожденным дефектам; 1990: 166-69.
Braunwald E, ed. Сердечное заболевание. Учебник сердечно-сосудистой медицины.3-е изд. Филадельфия, Пенсильвания: компания W. B. Saunders; 1988: 938-9.
СТАТЬИ ИЗ ЖУРНАЛА
Норвуд младший В.И., et al. Процедура Фонтана при синдроме гипоплазии левых отделов сердца. Ann Thorac Surg. 1992; 54: 1025-9; Обсуждение 1029-30.
Фаррелл младший PE, et al. Исход и оценка после модифицированной процедуры Фонтана при синдроме гипоплазии левых отделов сердца. Тираж. 1992; 85: 116-22.
Старнес В.А. и др. Современный подход к синдрому гипоплазии левых отделов сердца. Паллиативная терапия, трансплантация или и то, и другое? J Thorac Cardiovasc Surg.1992; 104: 189–94; Обсуждение 194-95.
Джобс Д. Р. и др. Углекислый газ предотвращает чрезмерную циркуляцию крови в легких при синдроме гипоплазии левых отделов сердца. Ann Thorac Surg. 1992; 54: 150-51.
Джексон GM, et al. Внутриродовое течение плодов с изолированным синдромом гипоплазии левых отделов сердца.


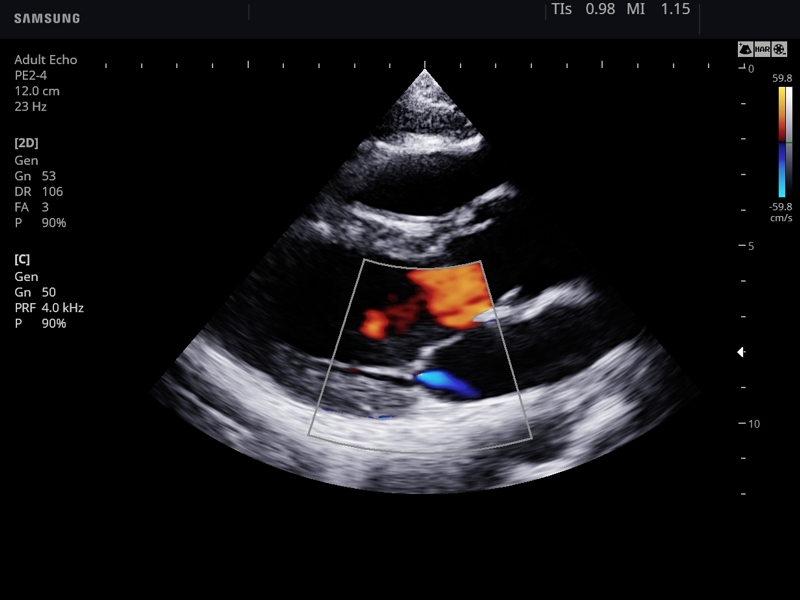 Хирурги создают «новую» аорту и соединяют ее с правым желудочком.Они также помещают трубку от аорты или правого желудочка к сосудам, снабжающим легкие (легочные артерии). Таким образом, правый желудочек может перекачивать кровь как к легким, так и к остальному телу. Это может быть очень сложная операция. После этой процедуры кожа младенца все еще может выглядеть голубоватой, потому что богатая кислородом и бедная кислородом кровь все еще смешиваются в сердце.
Хирурги создают «новую» аорту и соединяют ее с правым желудочком.Они также помещают трубку от аорты или правого желудочка к сосудам, снабжающим легкие (легочные артерии). Таким образом, правый желудочек может перекачивать кровь как к легким, так и к остальному телу. Это может быть очень сложная операция. После этой процедуры кожа младенца все еще может выглядеть голубоватой, потому что богатая кислородом и бедная кислородом кровь все еще смешиваются в сердце. Врачи соединяют легочную артерию и сосуд (нижнюю полую вену), возвращая бедную кислородом кровь из нижней части тела к сердцу, позволяя остальной крови, возвращающейся из тела, идти в легкие.По завершении этой процедуры кровь, богатая и бедная кислородом, больше не смешивается в сердце, и кожа младенца больше не выглядит синеватой.
Врачи соединяют легочную артерию и сосуд (нижнюю полую вену), возвращая бедную кислородом кровь из нижней части тела к сердцу, позволяя остальной крови, возвращающейся из тела, идти в легкие.По завершении этой процедуры кровь, богатая и бедная кислородом, больше не смешивается в сердце, и кожа младенца больше не выглядит синеватой.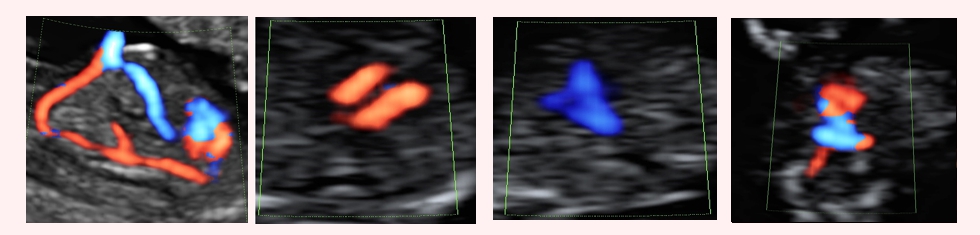 Национальные популяционные оценки основных врожденных дефектов, 2010-2014 гг. Врожденные дефекты Res 2019; 1–16. Https://doi.org/10.1002/bdr2.1589.
Национальные популяционные оценки основных врожденных дефектов, 2010-2014 гг. Врожденные дефекты Res 2019; 1–16. Https://doi.org/10.1002/bdr2.1589.