Опыт восстановления нормоценоза влагалища при лечении бактериального вагиноза у женщин репродуктивного возраста
HEALTH OF WOMAN. 2019.1(137):96–100; doi 10.15574/HW.2019.137.96
Бенюк В. А., Никонюк Т. Р., Ковалюк Т. В.
Национальный медицинский университет им. А.А. Богомольца, г. Киев
Нарушение микроэкологиии влагалища приводит к развитию бактериального вагиноза (БВ) – невоспалительного инфекционного синдрома, обусловленного дисбиотическим состоянием вагинального биотопа, пищеварительного тракта и мочевыделительной системы на фоне хронического иммунодефицита. На сегодня частота БВ в структуре инфекционных заболеваний женской половой сферы остается достаточно высокой и составляет 60–80%.
Цель исследования: снижение частоты рецидивов БВ у женщин репродуктивного возраста путем назначения комплексной двухкомпонентной терапии с применением вагинальных суппозиториев Флорика.
Материалы и методы.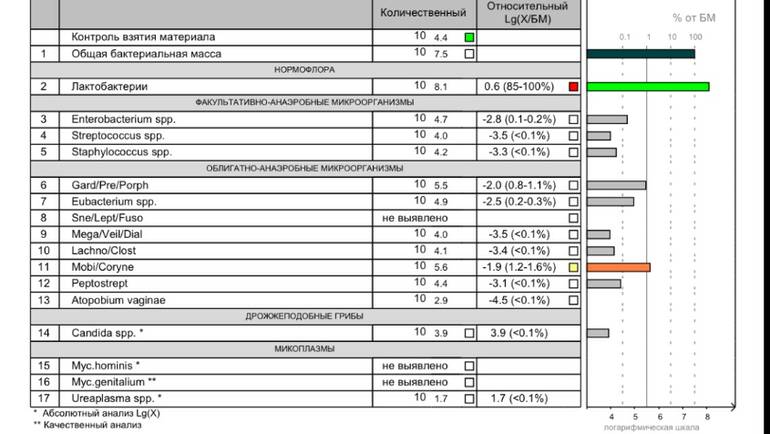
Результаты.
 Следует отметить, что при применении вагинальных суппозиториев Флорика не зафиксировано каких-либо местных или общих аллергических проявлений, побочных эффектов и нежелательных реакций.
Следует отметить, что при применении вагинальных суппозиториев Флорика не зафиксировано каких-либо местных или общих аллергических проявлений, побочных эффектов и нежелательных реакций.Ключевые слова: микробиоценоз влагалища, бактериальный вагиноз, двухкомпонентная терапия.
СПИСОК ЛИТЕРАТУРЫ
1. Бенюк В.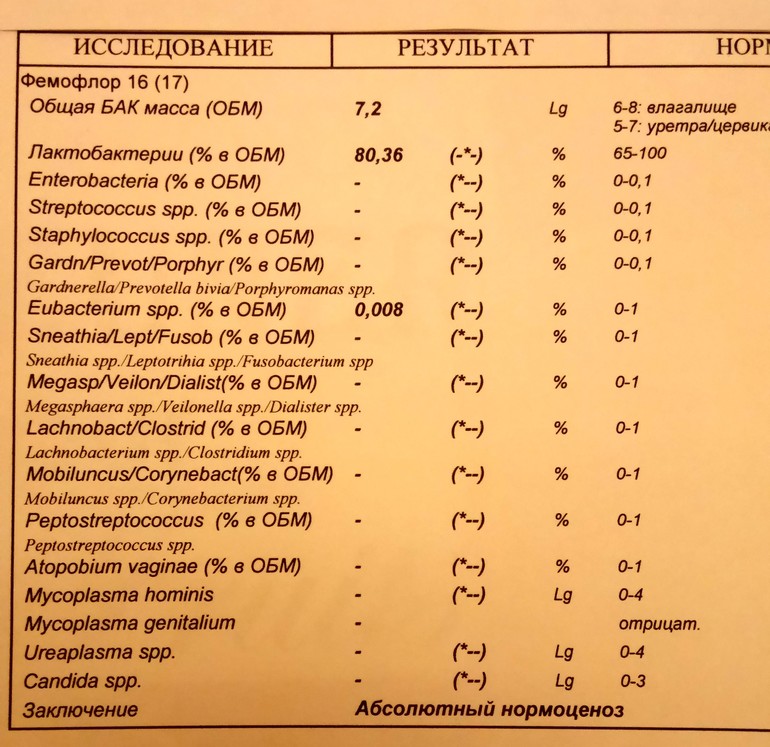 А., Никонюк Т.Р., Ластовецкая Л.Д., Мельник В.В. Бактериальный вагиноз и современные возможности его лечения у женщин репродуктивного возраста // Здоровье женщины. – 2012; 3 (69): 133-138.
А., Никонюк Т.Р., Ластовецкая Л.Д., Мельник В.В. Бактериальный вагиноз и современные возможности его лечения у женщин репродуктивного возраста // Здоровье женщины. – 2012; 3 (69): 133-138.
2. Бенюк В.О. Досвід лікування неспецифічного бактеріального вагініту // Здоров’я жінки. – 2010. – № 2 (48). – С. 146–151.
3. Грищенко О.В., Лахно И.В., Дудко В.Л. Выбор метода терапии и лекарственной формы препарата для лечения пациенток с вагинальным дисбиозом // Здоровье женщины. – 2010; 4 (50): 86-88.
4. Касихина Е.И. Хлоргексидин: Обзор лечебных возможностей… //Акуш. и гин. 2013. – № 4.
5. Кира Е.Ф. Бактериальный вагиноз// Медицинское информационное агентство–2012:472 с.
6. Летяева О.И. Терапия рецидивирующего бактериального вагиноза… //Акуш. и гин. – 2014. – № 4. – С. 88–92.
7. Пірогова В.І. Фейта Ю.Р., Шурпяк С.О. Клінічна ефективність корекції стану мікробіоти піхви у жінок з порушенням репродуктивного здоров’я і післяпологовими ускладненнями в анамнезі // Здоровье женщины. – 2018; 5 (131): 40-43.
– 2018; 5 (131): 40-43.
8. Aldunate M. et. al. Antimicrobial and immune modulatory effects… // Front Physiol. – 2015. – Vol. 6. – P. 164. https://doi.org/10.3389/fphys.2015.00164; PMid:26082720 PMCid:PMC4451362
9. Amsel R. Nonspecific vaginitis. Diagnostic criteria and microbial and epidemiologic associations. Am. J. Med. 1983; 74 (1): 14-22. https://doi.org/10.1016/0002-9343(83)91137-3
10. Sharma J.H., Tal R., Clark N.A., Segars J.H. Microbiotia and pelvic inflammatory disease. Semin. Reprod. Med. 2014; 32 (1): 48-49. https://doi.org/10.1055/s-0033-1361822; PMid:24390920 PMCid:PMC4148456
ЦНМТ, многопрофильная сеть специализированных клиник в Новосибирске — отзыв и оценка — Сумеречный луч
ЦНМТ… ЦНМТ..
Возникла необходимость и, с августа, я начала полное комплексное обследование своего здоровья. В сентябре, НЕ В ВАШЕЙ ЛАБОРАТОРИИ, сдала фемофлорскрин. Результат по всем показателям — отрицательный.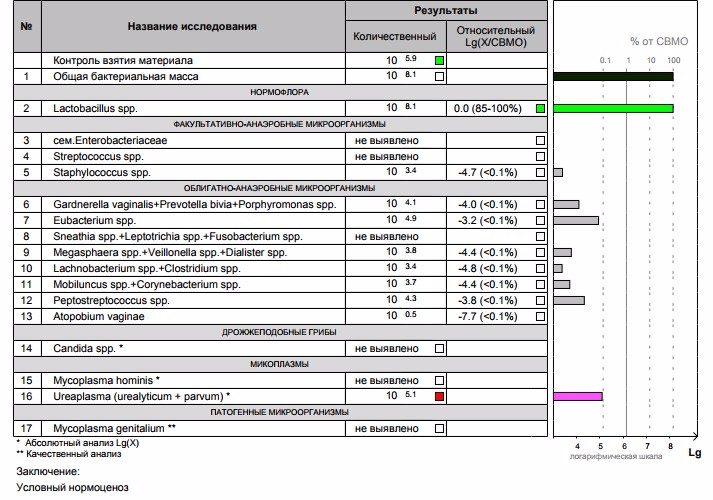
Показать целиком
ЦНМТ… ЦНМТ..
Возникла необходимость и, с августа, я начала полное комплексное обследование своего здоровья. В сентябре, НЕ В ВАШЕЙ ЛАБОРАТОРИИ, сдала фемофлорскрин. Результат по всем показателям — отрицательный. А в октябре пришла к вам, нужен был фемофлор 13 и посев. Результат по фемофлору: отрицательный по всем, и заключение: абсолютный нормоценоз! Посев, о вообще чудо, выполнялся всего 5 (ПЯТЬ!) дней. Вместо обычных 10-14! И результат поразительный: получен рост (кстати чего, как, непонятно — что это вообще за формулировка??!)
Странно, не правда ли?
Короче, запаниковала. Звоню в лабораторию, тишина.. Никто трубку не берет. Я человек настойчивый, звоню. Звоню. Но вы победили. Трубку так никто и не поднял. В последующие два дня я тоже набирала, и . .. гудки, гудки. Перестаньте морочить людям голову, уберите телефон лаборатории с бланка и операторам его запретите давать! Или на худой конец посадите туда живого человека!!!
.. гудки, гудки. Перестаньте морочить людям голову, уберите телефон лаборатории с бланка и операторам его запретите давать! Или на худой конец посадите туда живого человека!!!
Далее, обсудив все со своим доктором, которая к счастью, человек адекватный, не бросилась меня срочным образом лечить от заразы, а убедила меня сходить в КВД, тк нет у нее доверия к платным лабораториям. Засунув гордость в карман, я оказываюсь в КВД. Ндаа.. Не передать мою радость словами. Никогда бы не подумала, что там окажусь!
В общем, доктор венеролог меня выслушала, но смотреть результаты напрочь отказалась, сказала это все можно выкинуть. Взяла необходимые анализы и две недели я ждала. Положенные две недели! И да, волновалась. Но результат: ОТРИЦАТЕЛЬНЫЙ!!!!
Счастье в том, что муж у меня человек адекватный и даже не сомневался, что это ваша ошибка. За мной следом сдал все анализы, сначала платно (НЕ В ВАШЕЙ ЛАБОРАТОРИИ), а затем и в КВД. Все отрицательно. А будь он неадекватный? Голову отвернул бы мне.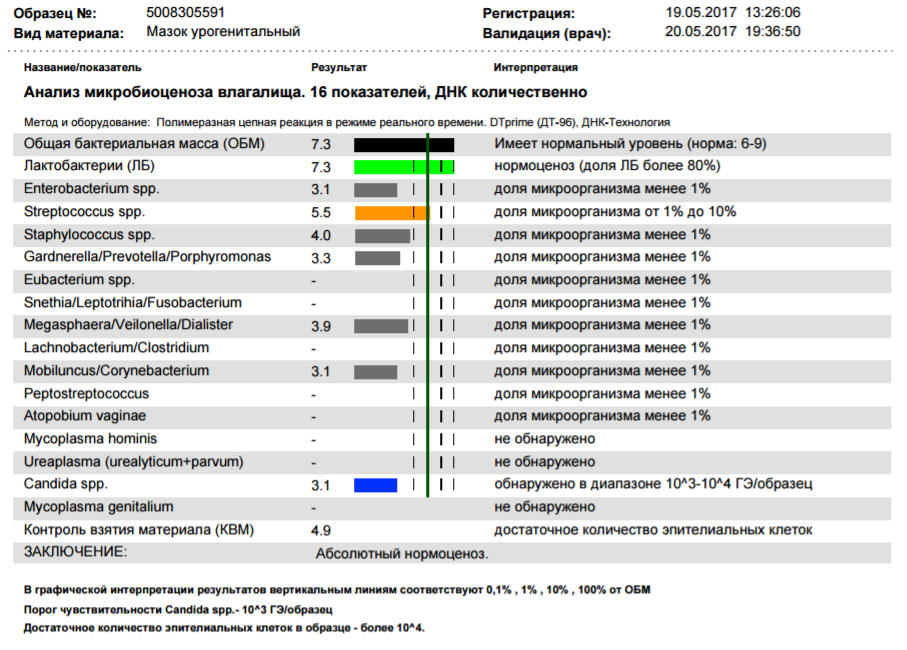
Кстати, врачи в КВД интересные вещи говорят, что ЗАЧАСТУЮ, неспециализированные лаборатории дают ложноположительные результаты. Что то с реактивами связано. Люди, будьте бдительны, и десять раз подумайте, стоит ли свое здоровье доверять таким профессионалам, которые на поверку, оказывается, лишь играют в «больничку».
Сейчас я думаю, как поступить дальше. Оставлять все как есть не хочу. Тк ваша ошибка непростительна!
Абсолютный нормоценоз и как его определить
Ноябрь 02, 2020 Нет комментариев
Состав микрофлоры влагалища уникален для каждой отдельной женщины. Это обусловлено индивидуальными особенностями того или иного организма, его гормональным статусом, состоянием здоровья и регулярностью половой жизни. Но в медицинской практике существует понятие нормы микрофлоры, независимо от всей уникальности и индивидуальности женского организма. Он определяется в виде диапазона показателей, которые колеблется в определенных рамках.
Полностью здоровая микрофлора подразумевает собой наличие разнообразных микроорганизмов, которые в ней присутствуют и имеют то или другое соотношение друг к другу. Нормоценоз – это доминирование лактобактерий и отсутствие грамотрицательной микрофлоры. Абсолютный нормоценоз – это один из возможных вариантов биоценоза, при котором доля нормофлоры в его составе была более чем в 90% относительно общей бактериальной массы. Узнать подробнее про абсолютный нормоценоз вы можете на сайте.
Другими словами, абсолютный нормоценоз это отсутствие на слизистых любых нетипичных для нее компонентов. На состав микрофлоры влияет множество факторов, это может быть и текущий гормональный фон, и состоянии нервной и иммунной системы на данный момент. Также микрофлора может меняться в тот или иной момент менструального цикла. Также очень важным параметром является наличие и активность половой жизни конкретной женщины.
Для определения количественного и качественного состава микрофлоры в обязательном порядке необходимо проведение лабораторных исследований. Для этого женщине нужно на приеме гинеколога получить образец выделений из влагалища, уретры и шейки матки. Все указанные процедуры являются абсолютно безболезненными и производятся только высококвалифицированными специалистами в лабораторных условиях. Самым простым способом определения состава микрофлоры – всевозможные микроскопические исследования. Образец взятый у женщины помещается в специальную питательную среду, после чего бактерии начинают быстро размножаться. Далее происходит исследование под микроскопом, а также подсчет количества и процентного соотношения тех или иных бактерий, которые обитают в представленном образце.
Для этого женщине нужно на приеме гинеколога получить образец выделений из влагалища, уретры и шейки матки. Все указанные процедуры являются абсолютно безболезненными и производятся только высококвалифицированными специалистами в лабораторных условиях. Самым простым способом определения состава микрофлоры – всевозможные микроскопические исследования. Образец взятый у женщины помещается в специальную питательную среду, после чего бактерии начинают быстро размножаться. Далее происходит исследование под микроскопом, а также подсчет количества и процентного соотношения тех или иных бактерий, которые обитают в представленном образце.
Похожие материалы:
Течение послеродового периода в зависимости от особенностей микробиоценоза и локального иммунитета влагалища у беременных перед родами
На правах рукописи
005045641
МЕДЖИДОВА МАРЖАНАТ КАПУРОВНА
ТЕЧЕНИЕ ПОСЛЕРОДОВОГО ПЕРИОДА В ЗАВИСИМОСТИ ОТ ОСОБЕННОСТЕЙ МИКРОБИОЦЕНОЗА И ЛОКАЛЬНОГО ИММУНИТЕТА ВЛАГАЛИЩА У БЕРЕМЕННЫХ ПЕРЕД РОДАМИ
14. 01.01. — акушерство и гинекология
01.01. — акушерство и гинекология
Автореферат диссертации на соискание ученой степени кандидата медицинских наук
— 7 ИЮН 2012
МОСКВА, 2012
005045641
Работа выполнена в Федеральном бюджетном государственном учреждении «Научный центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздравсоцразвития России и родильном доме № 6 им. A.A. Абрикосовой Департамента здравоохранения г. Москвы
Научные руководители:
доктор медицинских наук Тюпонник Виктор Леонидович
доктор биологических наук Трофимов Дмитрий Юрьевич
Официальные оппоненты:
доктор медицинских наук, профессор,
заведующий родильным отделением
ФГБУ «НЦ АГиП имени академика В.И. Кулакова»
Минздравсоцразвития России Баев Олег Радомирович
доктор медицинских наук, профессор, заведующий кафедрой акушерства и гинекологии лечебного факультета Московского Государственного медицинского
стоматологического университета Манухин Игорь Борисович
Ведущая организация — Российский национальный исследовательский медицинский университет имени Н. И. Пирогова
И. Пирогова
Защита диссертации состоится «19» июня 2012 года в 13 часов 00 минут на заседании диссертационного совета Д 208.125.01 ФГБУ «Научный центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздравсоцразвития России по адресу: 117997, Россия, Москва, ул. Академика Опарина, д. 4
С диссертацией можно ознакомиться в библиотеке ФГБУ «Научный центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздравсоцразвития России
Автореферат разослан «17» мая 2012 года Ученый секретарь
диссертационного совета, Калинина Елена Анатольевна
доктор медицинских наук
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ АКТУАЛЬНОСТЬ ПРОБЛЕМЫ
Многочисленные исследования показали, что ведущая роль в развитии послеродовых инфекционно-воспалительных заболеваний принадлежит восходящей инфекции влагалища, частота которой в популяции варьирует от 15 до 30% (Yokoe D.S. et al., 2001; Кира Е.Ф. и соавт., 2002; Jacobsson В. et al., 2002; Andrews W.W. et al., 2003; Стрижаков A.H. и соавт., 2003; Баев O.P. и соавт., 2010; Lee S.M. et al., 2011; Roberts C.L. et al., 2011).
et al., 2002; Andrews W.W. et al., 2003; Стрижаков A.H. и соавт., 2003; Баев O.P. и соавт., 2010; Lee S.M. et al., 2011; Roberts C.L. et al., 2011).
Применяемые сегодня способы оценки состояния микробиоценоза влагалища являются либо недостаточно информативными, либо дорогостоящими и субъективными. Кроме того, не всегда удается идентифицировать этиологически значимые условно-патогенные микроорганизмы, в частности анаэробы (Leitich G. et al., 2003; Bradshaw C.S. et al., 2006; Yoshimura K. et al., 2011). Следует отметить, что только учет количественных соотношений отдельных видов микроорганизмов может характеризовать состояние вагинального микробиоценоза и степень его нарушений (Анкирская A.C. и соавт., 2011; Deutscher M. et al., 2011). Применение некультуральных методов позволяет расширить спектр выявления данных изменений. Этим требованиям в большей степени отвечает анализ биотопа влагалища методом полимераз-ной цепной реакции в реальном режиме времени (Bradshaw C.S. et al., 2006; Шипицина Е.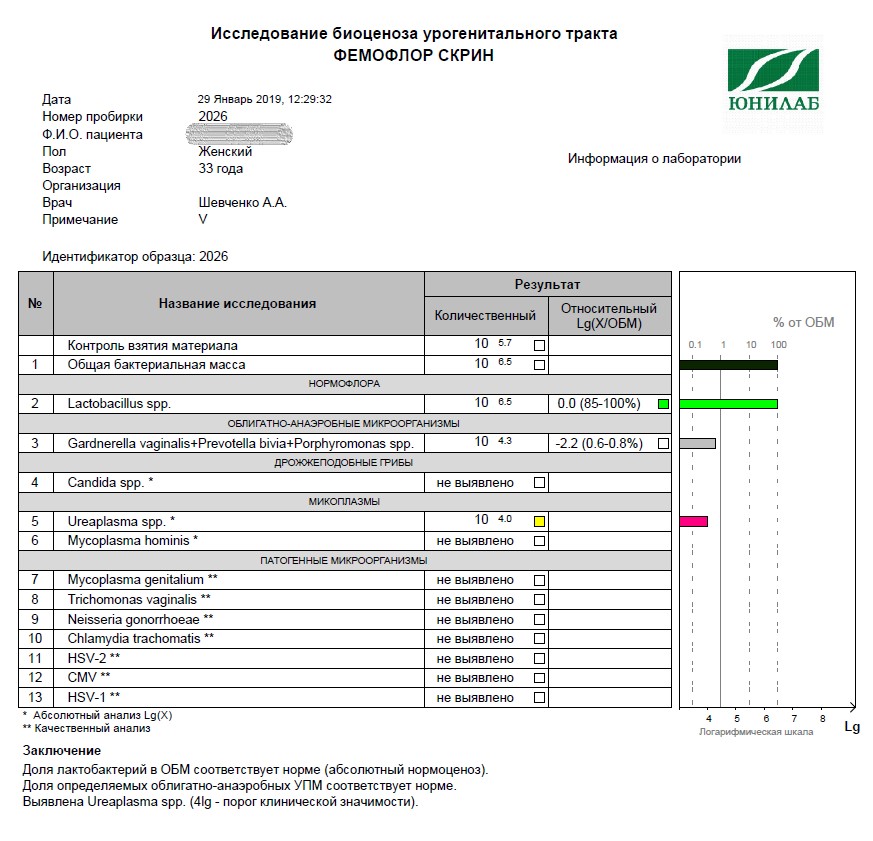 И. и соавт., 2009; Yoshimura К. et al., 2011; Плотко Е.Э. и соавт., 2011).
И. и соавт., 2009; Yoshimura К. et al., 2011; Плотко Е.Э. и соавт., 2011).
В современной литературе большое количество работ посвящено исследованию роли моноцитарно-макрофагального звена в регуляции иммунного ответа организма беременных (Hedges R.S. et al., 2006; Brown D.M. et al., 2009; Трофимов Д.Ю. и соавт., 2011). Изучение особенностей баланса про- и противовоспалительных цитокинов при физиологическом и осложненном течении беременности, как в периферической крови, так и на местном уровне представляется задачей крайне актуальной (Kutteh W.H. et al., 2001;
Орджоникидзе Н.В., Басиладзе Е.С., 2005; St John Е.Р. et al., 2007; Witkin S.S. et al., 2007; Anderson B.L. et al., 2011).
Сравнительный анализ микробиоценоза влагалища беременных перед родами, с применением классических микробиологических методов и поли-меразной цепной реакции в реальном времени, изучение соотношения про-воспалительных и противовоспалительных цитокинов в вагинальном отделяемом, позволят выработать меры по прогнозированию и профилактике послеродовых инфекционно-воспалительных осложнений. Вышеизложенные данные отечественной и зарубежной литературы свидетельствуют об актуальности выбранной темы исследования и перспективности дальнейшего внедрения, полученных результатов в клиническую практику.
Вышеизложенные данные отечественной и зарубежной литературы свидетельствуют об актуальности выбранной темы исследования и перспективности дальнейшего внедрения, полученных результатов в клиническую практику.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Определить особенности микробиоценоза и локального профиля экспрессии генов цитокинов влагалища при доношенной беременности и оценить их влияние на течение родов и послеродового периода.
ЗАДАЧИ ИССЛЕДОВАНИЯ
1. Изучить клиническую характеристику, течение беременности, родов, послеродового периода и состояние новорожденных у обследованных женщин.
2. Оценить состояние микробиоценоза влагалища и охарактеризовать видовой состав нормофлоры и дисбиотических состояний перед родами при доношенной беременности.
3. Определить профиль экспрессии генов провоспалительных (IL1B, IL6, IL8, ILIO, IL 12A, IL18, TNF, IFNG) и противовоспалительных (ILIO, TGFB) цитокинов в отделяемом влагалища у беременных перед родами.
4. Выявить роль нарушений микробиоценоза и локального иммунитета влагалища в развитии осложнений родового акта и послеродового периода.
5. Разработать прогностические критерии послеродовых инфекционно-воспалительных осложнений у родильниц на основании современных методов определения микробиоценоза и локального иммунитета влагалища.
НАУЧНАЯ НОВИЗНА
На современном уровне, с применением молекулярно-биологических методов проведена оценка микробиоценоза влагалища и охарактеризован видовой состав флоры влагалища в норме и при дисбиотических состояниях перед родами.
Использование современных методов лабораторной диагностики позволило изучить профиль экспрессии генов про- и противовоспалительных цитокинов в отделяемом влагалища при доношенной беременности.
Проведено типирование лактофлоры влагалища, показана связь определенных видов лактобактерий с экспрессией про- и противовоспалительных цитокинов, определена роль L. iners в развитии осложнений родового акта и послеродового периода.
Установлена взаимосвязь различных типов микробиоценоза влагалища с состоянием локального иммунитета и течением родового акта и послеродового периода. Определена роль Atopobium vaginae в развитии послеродовых осложнений.
ПРАКТИЧЕСКАЯ ЗНАЧИМОСТЬ
Исследование микробиоценоза влагалища методом полимеразной цепной реакции в режиме реального времени позволило своевременно диагностировать дисбиотические состояния и провести адекватную профилактику осложнений родового акта и послеродового периода.
Воспалительные заболевания нижних отделов репродуктивной системы беременных сопровождаются изменением профиля экспрессии мРНК цитокинов (повышаются IL1B, TNF, CD45, IL6, LIF, IL8, ILIO, IFNG, снижаются TGFB1, IL12A и IL 18), что позволяет использовать данные маркеры для оценки тяжести воспалительного процесса. В качестве объективного метода диагностики воспалительных заболеваний половых органов при беременности предложена модель с использованием значения уровней экспрессии мРНК генов IL1B, IL8, ILIO и IL18.
Определение профиля экспрессии генов цитокинов является важным диагностическим критерием, позволяющим объективно разграничить бессимптомное носительство условно-патогенной микрофлоры от проявлений вагинита.
Выявление грибов рода кандида и уреаплазм более 104 ГЭ/образец в отделяемом влагалища требует лечения только при наличии локальной воспалительной реакции.
Типирование лактобатерий способствует прогнозированию развития воспалительных заболевания половых органов и послеродовых осложнений.
Внедрение в клиническую практику современных методов исследования микробиоценоза и локального иммунитета влагалища у беременных перед родами позволяет своевременно предпринять меры по профилактике послеродовых воспалительных осложнений.
ПОЛОЖЕНИЯ, ВЫНОСИМЫЕ НА ЗАЩИТУ
1. Нарушение качественного и количественного состояния микробиоценоза влагалища является фактором риска осложнений родового акта и послеродового периода. Снижение доли лактобактерий менее 80% от общей бактериальной массы и/или повышение количества Atopobium vaginae выше 102’1 ГЭ/образец необходимо рассматривать как неблагоприятный прогностический признак.
2. Определение профиля экспрессии генов цитокинов является объективным диагностическим методом оценки локальной воспалительной реакции во влагалище и позволяет провести своевременную профилактику осложнений родов и послеродового периода.
3. Наличие грибов рода кандида и уреаплазм в количестве более 104 ГЭ/образец имеет клиническое значение только при наличии локальной воспалительной реакции. Типирование лактобактерий является важным в диагностике воспалительных заболеваний половых органов и в прогнозе осложнений родов и послеродового периода. Повышение Lactobacillus iners является неблагоприятным прогностическим критерием.
4. Дисбиотические состояния влагалища сопровождаются локальной воспалительной реакцией в 10 раз чаще, чем при нормоценозе. При сочетании дисбиотических состояний влагалища с локальной воспалительной реакцией риск осложненного течения родов и послеродового периода увеличивается в 2 раза.
ВНЕДРЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ В ПРАКТИКУ
Практические рекомендации, основанные на результатах исследования, используются в работе всех акушерских подразделений Федерального государственного бюджетного учреждения «Научный центр акушерства, гинекологии и перинатологии имени академика В. И. Кулакова» Министерства здравоохранения и социального развития Российской Федерации и рекомендованы к применению в деятельности родовспомогательных учреждений России, лечебно-педагогической работе кафедр акушерства и гинекологии медицинских ВУЗов, академий последипломного образования, врачей, при чтении лекций специалистам в области акушерства, гинекологии и перинатологии.
И. Кулакова» Министерства здравоохранения и социального развития Российской Федерации и рекомендованы к применению в деятельности родовспомогательных учреждений России, лечебно-педагогической работе кафедр акушерства и гинекологии медицинских ВУЗов, академий последипломного образования, врачей, при чтении лекций специалистам в области акушерства, гинекологии и перинатологии.
АПРОБАЦИЯ РАБОТЫ
Материалы диссертации представлены на 40М и 60М международных конгрессах по репродуктивной медицине (Москва, 2010, 2012), ХНСМ Всероссийском научном форуме «Мать и дитя» (Москва, 2011).
Обсуждение диссертации состоялось на заседании межклинической научной конференции 27 марта 2012 года и апробационной комиссии при Ученом Совете Д 208.125.01 ФГБУ «НЦ АГиП имени академика В.И. Кулакова» Минздравсоцразвития России 02 апреля 2012 года.
ЛИЧНЫЙ ВКЛАД АВТОРА
Автором самостоятельно проведен набор и анализ клинического материала, обследование, лечение и родоразрешение пациенток, статистическая обработка и научное обоснование полученных результатов.
СООТВЕТСТВИЕ ДИССЕРТАЦИИ ПАСПОРТУ НАУЧНОЙ СПЕЦИАЛЬНОСТИ
Научные положения диссертации соответствуют формуле специальности 14.01.01. — «акушерство и гинекология». Результаты проведенного исследования соответствуют области исследования специальности, конкретно пунктам 4 и 5 паспорта акушерства и гинекологии.
ПУБЛИКАЦИИ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ
По теме диссертации опубликовано 10 научных работ, в том числе 3 работы в журналах, рекомендуемых ВАК Минобразования и науки РФ.
СТРУКТУРА И ОБЪЕМ ДИССЕРТАЦИИ Диссертация изложена на 155 страницах компьютерного текста. Работа состоит из введения, 5 глав (обзор литературы, материалы и методы исследования, общая клиническая характеристика обследованных беременных, результаты исследования и их обсуждение), выводов, практических рекомендаций, списка использованной литературы и приложения (алгоритма). Работа иллюстрирована 35 таблицами и 17 рисунками. Библиографический указатель включает 210 работ цитируемых авторов, из них 92 на русском и 118 на иностранных языках.
СОДЕРЖАНИЕ РАБОТЫ МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Для решения поставленных задач проведено клинико-лабораторное обследование 157 женщин в сроках от 37 до 41 недель беременности без родовой деятельности с целым плодным пузырем.
Критериями исключения из исследования явились наличие у пациенток тяжелой экстрагенитальной и акушерской патологии, истмико-цервикальной недостаточности, преждевременного излитая околоплодных вод, а также инфекций, передаваемых половым путем и лечение вагинальной инфекции в течение 3-4-х недель до данного исследования.
Изучены данные соматического, инфекционного и репродуктивного анамнеза, проанализированы течение данной беременности, родов, послеродового периода.
Специальные методы исследования:
Микроскопический метод
Микроскопии вагинальных мазков, окрашенных по Граму. Метод использовали для оценки состояния вагинального микроценоза. Учитывали: характер вагинального эпителия, наличие «ключевых клеток», количество лейкоцитов, общую микробную обсемененность, морфологический состав микрофлоры, наличие дрожжеподобных грибов.
Исследование биоценоза влагалища, оценка локального иммунитета.
Исследование микрофлоры влагалища методом ПЦР в реальном режиме времени методом «Фемофлор»
Взятие биологического материала (соскоб с задней стенки влагалища) осуществляли в пробирки с физиологическим раствором. Осаждение клеток и бактериальных агентов проводили путем центрифугирования при 13000 об/мин в течение 10 минут. Полученные клетки ресуспендировали в 100 мкл физиологического раствора. Для выделения ДНК использовали наборы «Проба ГС» производства ООО (НПО «ДНК-Технология», Россия). Объем образцов после выделения составил 100 мкл.
Проводилась количественная оценка биоценоза влагалища («Фемофлор», ДНК-Технология, Россия). Так же было проведено обследование женщин методом ПЦР на наличие абсолютных патогенов: Chlamydia trachomatis, Neisseria gonorrhoeae, Trichomonas vaginalis и герпесвирусов (ВПГ-1, ВПГ-2, ЦМВ).
Амплификацию осуществляли в режиме «реального времени согласно инструкции производителя. Обработка результатов осуществлялась автоматически с помощью программного обеспечения к приборам.
Обработка результатов осуществлялась автоматически с помощью программного обеспечения к приборам.
Формирование лабораторного заключения по результатам исследования методом «Фемофлор» было основано на критериях разработаных Е.С. Ворошилиной и соавт. (2011).
Исследование профиля мРНК цитокинов методом ОТ-ПЦР
Для изучения состояния местного иммунитета определяли содержание провоспалительных цитокинов (ILB, TNF, IL6, IL8, IL18, IL12A/p35, ILIO, IFNG, TGFB, LIF, а также общий лейкоцитарный антиген CD45) на локальном уровне. Во избежание деградации РНК взятие материала (вагинальные соскобы) осуществляли в пробирки с раствором гуанидинтиоционата (лизирующий раствор наборы «Проба НК» ООО (НПО «ДНК-Технология», Россия). Осаждение РНК проводили изопропанолом в присутствии соосадителя, с последующими отмывками промывочными растворами. Объем образцов после выделения составил 50 мкл. Реакцию обратной транскрипции ставили в объеме 40 мкл (в реакцию брали 33 мкл образца). В качестве праймеров для обратной транскрипции использовали специфические олигонуклеотиды. Реакцию проводили при температуре 40°С в течение 30 мин, с последующей инактивацией обратной транскриптазы при 95°С в течение 5 минут. Для увеличения объемов образцов после ОТ кДНК разводили в 5 раз в ТЕ-буфере. Амплификацию осуществляли согласно инструкции производителя. Реакцию ставили в двух повторах для каждой точки. Нормировка проводилась по пяти референсным генам HPR.T1, ТВР, В2М, GUSB, ABL. Использован метод сравнения индикаторных циклов (метод AACq).
В качестве праймеров для обратной транскрипции использовали специфические олигонуклеотиды. Реакцию проводили при температуре 40°С в течение 30 мин, с последующей инактивацией обратной транскриптазы при 95°С в течение 5 минут. Для увеличения объемов образцов после ОТ кДНК разводили в 5 раз в ТЕ-буфере. Амплификацию осуществляли согласно инструкции производителя. Реакцию ставили в двух повторах для каждой точки. Нормировка проводилась по пяти референсным генам HPR.T1, ТВР, В2М, GUSB, ABL. Использован метод сравнения индикаторных циклов (метод AACq).
Ультразвуковой скрининг осуществлялся на протяжении всей беременности, проводились допплерометрическое исследование кровотока в системе мать-плацента-плод во II-III триместрах, кардиомониторный контроль за состоянием плода в III триместре.
Изучение здоровья новорожденных. Осмотр детей осуществлялся совместно с неонатологом сразу после рождения, определялось их состояние по шкале Апгар. В дальнейшем изучалась динамика массы новорожденных.
Статистические методы исследования
При разработке критериев диагностики вагинита был проведен дискриминантный анализ с использованием пакета программ Statistica 8.0. и построена математическая модель, позволяющая вычислить значение канонической линейной дискриминантной функции (КЛДФ) для каждого клинического образца. С использованием полученной КЛДФ была построена классификационная математическая модель. Для расчёта оптимального значения величины порога отсечения (точки cut off) использовали метода, получивший название ROC-анализ (Receiver Operator Characteristic -операционная характеристика приёмника). Основой данного анализа является построение так называемой ROC-кривой, которая наиболее часто используется для представления результатов бинарной классификации в машинном обучении. ROC-кривая показывает зависимость количества верно классифицированных положительных примеров от количества неверно классифицированных отрицательных примеров. Для установления точки cut off проводился пересмотр значений классификационной функции от максимального до минимального значения.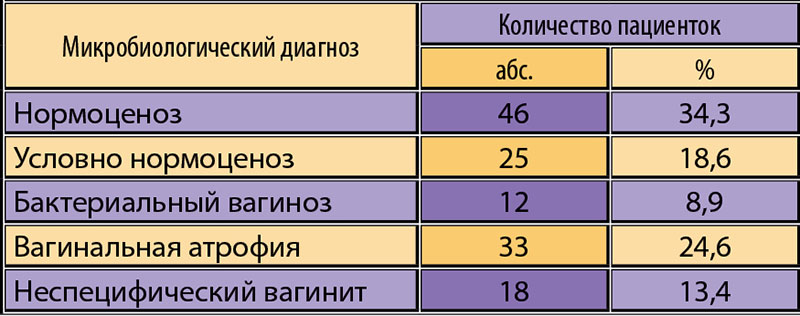 Для каждого значения проводилось разделение групп с определением чувствительности и специфичности. Критерием выбора порога отсечения выбрано требование максимальной суммарной чувствительности и специфичности модели.
Для каждого значения проводилось разделение групп с определением чувствительности и специфичности. Критерием выбора порога отсечения выбрано требование максимальной суммарной чувствительности и специфичности модели.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ В данной работе представлены результаты анализа особенностей течения и исходов беременности у 157 женщин. Наиболее распространенной экс-трагенитальной патологией были заболевания мочевыделительной системы, отмеченные у 60 (38,2%) женщин. У 124 (78,9%) пациенток менархе было своевременным, в возрасте от 12 до 14 лет. Длительность менструального цикла у большинства женщин колебалась от 25 до 35 дней. Самым распространенным и часто выявляемым состоянием была эктопия шейки матки -42,1% пациенток. Эндометриоз и/или аденомиоз — 15,3%, хронический саль-пингоофорит отмечен у 14,1% женщин, миома матки — 8,9%, бесплодие 5,1%.
Вагинальный кандидоз перенесли 24,8% женщин, бактериальный вагиноз -5,1%, микоплазменную инфекцию — 14,1%. Среди обследованных женщин было 45,9% первобеременных первородящих, 32,5% повторнобеременных повторнородящих и 21,6% повторнобеременных первородящих. Частота искусственного аборта составила 32,0%, самопроизвольных выкидышей -18,8%, неразвивающейся беременности -17,6%. Анамнез женщин был отягощен преждевременными родами — у 3,9%, гипотрофией новорожденных — у 5,8%, внутриутробной инфекцией плода — у 3,9%.
Среди обследованных женщин было 45,9% первобеременных первородящих, 32,5% повторнобеременных повторнородящих и 21,6% повторнобеременных первородящих. Частота искусственного аборта составила 32,0%, самопроизвольных выкидышей -18,8%, неразвивающейся беременности -17,6%. Анамнез женщин был отягощен преждевременными родами — у 3,9%, гипотрофией новорожденных — у 5,8%, внутриутробной инфекцией плода — у 3,9%.
Таким образом, обследованные женщины по исходной клинической характеристике, экстрагенитальной и генитальной патологии могут быть отнесены к группе низкого риска по развитию инфекционно-воспалительных осложнений, что позволило объективно оценить влияние именно изменений микробиоценоза влагалища и локальной воспалительной реакции на течение родов и послеродового периода.
Анализ течения настоящей беременности показал, что из осложнений преобладала угроза прерывания в I (40,7%) и во II (27,4%) триместрах, угроза преждевременных родов составила 10,2%. Достаточно часто встречались: анемия — 34,4%, ранний токсикоз — 25,4% и преэклампсия — 24,2%. По данным методов функциональных диагностики чаще встречались: многоводие -у 18,4% пациенток, маловодие — у 16,6%, умеренные нарушения реактивности сердечно-сосудистой системы плода — у 9,5%, нарушение кровотоков IБ степени — у 7,0%. ОРВИ с повышением температуры тела наблюдалась у 31,8% женщин. В период настоящей беременности у пациенток чаще встречались вагинальный кандидоз — у 19,1%, неспецифический вагинит — у 8,3%, бактериальный вагиноз — у 3,2%, микоплазменная инфекция у 3,2% женщин. Обследование всех 157 беременных в 34-36 недель показало, что микробный пейзаж влагалища был в норме.
По данным методов функциональных диагностики чаще встречались: многоводие -у 18,4% пациенток, маловодие — у 16,6%, умеренные нарушения реактивности сердечно-сосудистой системы плода — у 9,5%, нарушение кровотоков IБ степени — у 7,0%. ОРВИ с повышением температуры тела наблюдалась у 31,8% женщин. В период настоящей беременности у пациенток чаще встречались вагинальный кандидоз — у 19,1%, неспецифический вагинит — у 8,3%, бактериальный вагиноз — у 3,2%, микоплазменная инфекция у 3,2% женщин. Обследование всех 157 беременных в 34-36 недель показало, что микробный пейзаж влагалища был в норме.
Среди обследованных пациенток роды через естественные родовые пути произошли у 56,1% женщин, путем операции кесарева сечение родораз-решено 43,9% пациенток. Все роды в исследуемой группе женщин были
своевременными. Средняя продолжительность родов составила 7,8±2,6 часов. Объем кровопотери после родов через естественные пути в среднем составил 250,7+100,9 мл.
Из осложнений преобладало преждевременное излитие околоплодных вод — 19,1%. Длительность безводного промежутка в среднем составила 8,2+2,1 часа. В большинстве (54,0%) случаев показания к абдоминальному родоразрешению были сочетанными как со стороны матери, так и плода, в 21,0% они были только со стороны плода, и в 25,0% — со стороны матери. Средний объем кровопотери во время операции кесарева сечения составил 539,13+77,7 мл.
Длительность безводного промежутка в среднем составила 8,2+2,1 часа. В большинстве (54,0%) случаев показания к абдоминальному родоразрешению были сочетанными как со стороны матери, так и плода, в 21,0% они были только со стороны плода, и в 25,0% — со стороны матери. Средний объем кровопотери во время операции кесарева сечения составил 539,13+77,7 мл.
Осложнения послеродового периода в исследуемой нами группе были выявлены в 12,7%; из них в 9,5% — отмечалась субинволюция матки, в 1,9% -эндометрит, в 1,3% — раневая инфекция.
В нашем исследовании не выявилась зависимость частоты возникновения и клинического течения послеродовых осложнений от способа родораз-решения, что наглядно представлено на рисунке 1.
Рис. 1. Осложнения послеродового периода в зависимости от метода родо-разрешения
Исход родов для плода и течение раннего неонатального периода были проанализированы у 157 новорожденных. Все дети были доношенными. Масса новорожденных колебалась от 2750 до 4440 г и составила в среднем
3552,4±244,1 г. Основная часть детей (142 — 92,3%) родились без признаков асфиксии, а 12 (7,7%) новорожденных в асфиксии легкой степени. Внутриутробное инфицирование плода и реализация инфекции отмечены у 6 (3,8%) детей. Остальные дети (151 — 96,2%) на момент рождения и выписки из роддома были практически здоровы.
Основная часть детей (142 — 92,3%) родились без признаков асфиксии, а 12 (7,7%) новорожденных в асфиксии легкой степени. Внутриутробное инфицирование плода и реализация инфекции отмечены у 6 (3,8%) детей. Остальные дети (151 — 96,2%) на момент рождения и выписки из роддома были практически здоровы.
При количественном анализе биоценоза влагалища перед родами выявлено, что данный биотоп характеризуется высокой бактериальной обсеме-ненностью и широким видовым разнообразием. Основным компонентом биоценоза являлись лактобактерии их количество колебалось от 10 5-2 до 10 8’7 ГЭ/образец. Среди всех исследованных групп микроорганизмов можно выделить минорные группы, доля которых ни у одной пациентки не превысила 10%. К ним относятся стафилококки (максимальная доля 1,4%), моби-лункус (4,7%), пептострепоткокки (3,3%), а также генитальные микоплазмы -Mycoplasma hominis (0,9%) и Ureaplasma urealyticum (9,2%). Ряд микроорганизмов у некоторых пациенток были основным компонентом микробиоценоза. Так доля энтеробактерий и гарднерелл превышала 68%, а максимальная доля атопобиума достигала 59,1%. У большинства женщин основу микробиоценоза составляли лактобактерии и медиана доли остальных микроорганизмов не превышала 0,02%, а 75 процентиль — 0,38%.
Так доля энтеробактерий и гарднерелл превышала 68%, а максимальная доля атопобиума достигала 59,1%. У большинства женщин основу микробиоценоза составляли лактобактерии и медиана доли остальных микроорганизмов не превышала 0,02%, а 75 процентиль — 0,38%.
В нашем исследовании нормоценоз был выявлен у 141 (89,8%) пациентки. При этом абсолютный нормоценоз у 84 (53,5%) обследованных женщин, а относительный нормоценоз у 57 (36,3%). У 40,4% женщин на фоне сохранной нормофлоры обнаруживались различные ассоцианты, чаще всего наблюдалось увеличение количества Ureaplasma urealyticum (77,7%) и Candida spp. (35,1%). Частота встречаемости Ureaplasma urealyticum и грибов рода кандида не зависела от количества лактобактерий, что соотносится с данными литературы (Zhou Н. et al., 2006; Прилепская В.Н., 2010).
У пациенток, в микробиоценозе которых встречался атопобиум, чаще (р=0,057) развивались послеродовые осложнения (19,6%) по сравнению с 9,9% при отсутствии этого микроорганизма.
Доля анаэробных микроорганизмов при дисбиозе составила 52,87 (34,89-76,85)%, что было статистически значимо выше по сравнению с долей анаэробов при нормоценозе 0,13 (0,02-0,88)%. При этом доля аэробов у женщин с дисбиозом составила 0,02 (0,00-1,31)% у женщин с нормоценозом 0,01 (0,00-0,04)%, которое не было статистически значимым.
Данные об осложнениях течения родов и послеродового периода у женщин с различным типом биоценоза представлены в таблице 1.
Таблица 1
Осложнения родов и послеродового периода
Осложнения родов и послеродового периода Абсолютный нормоценоз (п=84) Относительный нормоценоз (п=57) Дисбиотические состояния влагалища (п=16) Всего ‘ (п=157)
Кол Кол % Кол % Кол %
Преждевременное излитие околоплодных вод 14 16,6 11 19,3 5 31,3 30 19,1
Травмы мягких тканей родовых путей 4 4,7* 3 5,3* 4 25,0* 11 7,0
Субинволюция матки 7 8,3* 5 8,7* 4 25,0* 15 9,5
Раневая инфекция 0 — 1 1,8 1 6,3 2 1,3
Послеродовой эндометрит 0 — 1 1,8* 2 12,5* 3 1,9
* — достоверные различия между группами (р<0,05)
Как видно из данных, представленных в таблице 1, наиболее часто встречающимся осложнением родового акта явилось преждевременное изли-тие околоплодных вод, которое отмечалось у 16,6% беременных с абсолютным нормоценозом влагалища, у 19,3% — с относительным нормоценозом влагалища и у 31,3% — с дисбиотическими нарушениями микрофлоры влагалища разной степени тяжести, что соответствует данным литературы (DiGiulio D. B. et al., 2008; Han Y.W., 2009).
B. et al., 2008; Han Y.W., 2009).
Травмы мягких тканей родовых путей были у 25,0% родильниц с дисбиотическими нарушениями микрофлоры влагалища и имели статистически
значимые различия (р<0,05) с пациентками с относительным нормоценозом 3 (5,3%) и абсолютным нормоценозом 4 (4,7%).
Особого внимания заслуживает факт достоверно высокой частоты (р<0,05) осложнений послеродового периода у женщин с дисбиотическими нарушениями микрофлоры влагалища, которая составила 43,8% случаев. Причем в 12,5% случаев из них был диагностирован послеродовой эндометрит, в 25,0% — субинволюция матки, в 6,3% — раневая инфекция.
100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0%
9.20%
90,80% 43,80% 56,20%
• осложнения норма
нориоцено]
Он <011 Ol
Рис. 2. Частота встречаемости осложнений послеродового периода среди женщин с различными типами биоценоза влагалища.
Для определения состояния локального иммунитета влагалища у беременных перед родами был проведен анализ экспрессии генов цитокинов и общего лейкоцитарного антигена (CD45). В результате было выявлено, что при наличии локальной воспалительной реакции (группа 2) повышены уровни экспрессии мРНК генов IL1B — в 9,1, TNF — в 2,7, CD45 — в 6,7, IL6 — в 13,1, LIF — в 5,9, IL8 — в 6,1, ILIO — в 5,2, IFNG — в 13,5 раз, а уровень экспрессии мРНК генов TGFB1 — в 1,8, IL12A — в 1,7 и IL 18 — в 3,7 раза снижены по сравнению с группой женщин с абсолютным нормоценозом (референс — группа).
В результате было выявлено, что при наличии локальной воспалительной реакции (группа 2) повышены уровни экспрессии мРНК генов IL1B — в 9,1, TNF — в 2,7, CD45 — в 6,7, IL6 — в 13,1, LIF — в 5,9, IL8 — в 6,1, ILIO — в 5,2, IFNG — в 13,5 раз, а уровень экспрессии мРНК генов TGFB1 — в 1,8, IL12A — в 1,7 и IL 18 — в 3,7 раза снижены по сравнению с группой женщин с абсолютным нормоценозом (референс — группа).
-4 -3 -2 -1 0 1 2 3 4 5 6
Значение КЛДФ1
Референс-группа — —Вагинит Рис 3. Гистограмма распределения беременных по значению КЛДФ в группах
Профиль экспрессии генов цитокинов в вагинальных мазках женщин с обильными выделениями без признаков воспаления не отличался от пациенток с абсолютным нормоценозом влагалища (таблица 2).
Бессимптомное носительство Candida spp. сопровождалось достоверным повышением ILIO и IFNG в 2,8 и 4,6 раза соответственно, и снижением LIF в 4,3 раза по сравнению с группой женщин с абсолютным нормоценозом. При этом повышения уровня провоспалительных цитокинов отмечено не было, что, по-видимому, связано с отсутствием воспалительной реакции.
При воспалительных процессах во влагалище беременных наблюдалась выраженная реакция клеток вагинальных соскобов в виде повышения уровня экспрессии ряда провоспалительных цитокинов (IL1B, TNF, IL6, LIF, IL8, IFNG), а также иммунорегуляторного ILIO и общего лейкоцитарного антигена CD45.
Профиль экспрессии мРНК генов цитокинов в вагинальных мазках представлен в таблице 2
Таблица 2
Сравнительный анализ профиля экспрессии мРНК генов цитокинов в
вагинальных мазках в исследуемых группах беременных
Ген Группа 1 (Нормоцсноз) Группа 2 Вагиниты (п=24)
Абсолютный Относительный
Референс-группа (п=42) Обильные выделения (п=8) Ureaplasma spp. более 104 ГЭ/образсц (п=16) Кандидо носитсль-ство (П=11)
IL1B 1 (0,47-1,79) 1,04 (0,57-3,18) 1,35 (0,30-2,07) 0,82 (0,55-1,33) 9,1 (6,8-12,8) р=5,0 х Ю’10
TNF 1 (0,62-1,90) 0,69 (0,38-1,76) 1,31 (0,62-3,38) 0,90 (0,66-1,10) 2,7 (1,9-4,1) р=4,4 х 10″5
CD45 1 (0,38-1,72) 0,86 (0,57-3,02) 0,70 (0,28-1,59) 0,79 (0,53-1,64) 6,7 (3,5-9,9) р=1,3 х 10″8
IL6 1 (0-3,72) 1,60 (0,17-2,92) 0,85 (0,00-9,67) 0,89 (0,55-1,21) 13,1 (5-73,6) р=2,8 х 10″6
L1F 1 (0,33-1,96) 1,27 (0,71-2,78) 0,80 (0,34-2,57) 0,23 (0,14-0,53) р=2,5 х 103 5,9 (3,5-48,8) р=7,3 х 10″6
1L8 1 (0,45-1,85) 0,74 (0,28-1,47) 1,20 (0,24-2,51) 0,52 (0,42-0,72) 6,1 (2,9-11,8) р=2,8 х 10″8
ILIO (0,34-2,36) 0,93 (0,69-2,40) 2,20 (0,93-5,58) 2,82 (1,99-3,97) р=5,5 х 10″3 5,2 (4,1-9,5) р=1,3 х 10″8
TGFB1 1 (0,68-2,23) 2,55 (1,29-2,93) 1,31 (0,69-1. 85) 0,75 (0,59-0,98) 0,55 (0,31-1,0) р=1,3 х 10″3
85) 0,75 (0,59-0,98) 0,55 (0,31-1,0) р=1,3 х 10″3
1L12A 1 (1,71-2,33) 1,18 (0,99-1,55) 0,93 (0,62-1,41) 0,79 (0,55-1,10) 0,59 (0,28-0,98) р=5,4 х 10″3
IL18 1 (0,64-1,40) 1,31 (1,17-1,49) 0,69 (0,39-1,38) 0,64 (0,53-1,02) 0,27 (0,15-0,45) р=3,2 х 10″7
IFNG 1 (0Л13) 0,00 (0,00-0,00) р=6,4 х 10″3 3,33 (0,00-9,97) 4,59 (4,00-5,62) р=3,8 х 10 «2 13,5 (0-28,3) р=6,5 х 103
Анализ течения родов показал, что структура методов родоразрешения не различалась между группами. Осложнения родов и послеродового периода статистически значимо чаще встречались в группе беременных с призна-
ками воспаления слизистой влагалища (р=1,3*105, OR=10,4 (3,28-32,94)), при этом различия между подгруппами женщин без признаков воспаления не были статистически значимыми. В подгруппе женщин с относительным нормо-ценозом из 12 женщин с осложнениями родов и послеродового периода у 9 выявлена уреаплазма в количестве более 104ГЭ/образец.
Таким образом, Ureaplasma spp. в количестве более 104 ГЭ/образец может рассматриваться как фактор риска осложнений родов и послеродового периода, что согласуется с данными зарубежных исследователей (Zhou Н. et al., 2006). Однако в нашем исследовании было установлено, что осложнения в послеродовом периоде возникали 2 раза чаще при сочетании Ureaplasma spp. более 104 ГЭ/образец и локальной воспалительной реакции.
в количестве более 104 ГЭ/образец может рассматриваться как фактор риска осложнений родов и послеродового периода, что согласуется с данными зарубежных исследователей (Zhou Н. et al., 2006). Однако в нашем исследовании было установлено, что осложнения в послеродовом периоде возникали 2 раза чаще при сочетании Ureaplasma spp. более 104 ГЭ/образец и локальной воспалительной реакции.
У женщин с бессимптомным носительством дрожжеподобных грибов рода Candida не было ни одного случая осложнений родов и послеродового периода, в то время как у женщин с кандидозным вагинитом осложнения родов и послеродового периода отмечались в 77,7% случаев. По данным литературы, более чем в 40% случаях при беременности ВВК, носит характер бессимптомного кандидоносительства и не вызывает осложнений (Sherrard J. et al., 2011), что согласуется с результатами нашего исследования. Candida spp. может рассматриваться как фактор риска осложнений родов и послеродового периода только при наличии локальной воспалительной реакции.
Наиболее часто встречающимся осложнением родового акта явилось преждевременное излитие околоплодных вод. Разрывы мягких тканей родовых путей достоверно чаще наблюдались во 2 группе — (29,2%) по сравнению с группой 1 (7,8%) (р=0,012, OR=4,87 (1,48-16,10)). Общее количество осложнений послеродового периода в группе с признаками воспаления слизистой влагалища было статистически значимо высоким (р=0,033) и составило 25,0% случаев по сравнению с группой беременных без признаков воспаления, где осложнения пуэрперия наблюдались в 7,8% (OR=3,94 (1,16-13,44)).
Данные об осложнениях течения родов и послеродового периода у женщин с различным профилем экспрессии генов цитокинов представлены в таблице 3.
Таблица 3
Осложнения родов и послеродового периода
Осложнения Группа 1 (Нормоценоз) Группа 2 Вагиниты (п=24)
Абсолютный нормоценоз (п=42) Относительный нормоценоз (п=35)
Кол. % Кол. % Кол. %
Преждевременное изли-тис околоплодных вод 7 16,7 6 17,1 7 29,2
Разрывы мягких тканей родовых путей 1 2,4 5 14,3 7 29,2*
Послеродовые осложнения, всего Из них: 3 7,1 3 8,6 6 25,0*
Раневая инфекция — — — — 1 2,4
Субинволюция матки 3 7,1 2 5,7 3 14,3
Послеродовый эндометрит — — 1 2,8 2 8,3*
Всего женщин с осложнениями 9 21,4 12 34,3 13 54,2*
* — достоверные различия между группами 1 и 2 (р<0,05)
Таким образом, помимо качественного и количественного состава мик-робиоты влагалища существенным фактором риска послеродовых осложнений является наличие локальной воспалительной реакции слизистой влагалища.
В качестве объективного метода диагностики воспалительных заболеваний при беременности была предложена модель с использованием оценки уровней экспрессии мРНК генов IL1B, IL8, ILIO и IL18, что позволило своевременно предпринять меры по профилактике послеродовых осложнений.
Кроме того, в рамках нашего исследования, мы провели типирование лактобактерий (рисунок 4).
100%
80%
60%
40%
20%
референс-группа обильные вагиниты (п=24)
[п=42) выделения (п=35)
■ Ь. сг1зраШз>90% ■ Ь. ¡епзепи>90%
■ Ь. gasseri>90% ■ Ь. >пеГ5>90% несколько видов, включая 10<Ь. ¡пег5<90%
Рис. 4. Частоты доминирования видов лактобактерий в группах исследования.
Из данных, представленных на рис. 4, видно, что доминирующими видами в составе лактофлоры были: Ь. спвраШв, Ь. §аззеп, Ь. ]еп5епп и Ь. теге. У женщин с нормоценозом влагалища в составе лактофлоры чаще доминировали Ь. раШв является благоприятным прогностическим признаком течения родов и послеродового периода при оценке микробиоценоза влагалища перед родами.
раШв является благоприятным прогностическим признаком течения родов и послеродового периода при оценке микробиоценоза влагалища перед родами.
Выявлено, что при наличии L. iners были повышены уровни экспрессии мРНК генов IL6, LIF, ILIO (рисунок 5).
У р
о в е
II
ь
э к с
п р
е с с и и
м р
н
к
Рис.5. Влияние Ьлпеге на уровень экспрессии мРНК генов цитокинов
Таким образом, на основании полученных результатов мы выделили два фактора, ассоциированных с осложненным течением послеродового периода — это дисбиотические нарушения влагалищной микрофлоры и локальная воспалительная реакция. Выявление «воспалительного» профиля экспрессии генов цитокинов во влагалище является признаком локальной воспалительной реакции и может быть важным дополнительным диагностическим критерием, позволяющим объективно различить бессимптомное носительст-во условно-патогенной микрофлоры от проявлений вагинита.
Лабораторная оценка профиля экспрессии генов цитокинов во влагалище позволяет существенно повысить эффективность диагностики инфек-ционно-воспалительных заболеваний и может быть использован для своевременной профилактики осложнений родов и послеродового периода.
16 14 12 10
8
IL6
ILIO
1L1X
LIF
L.ineni<10% L.iners>10%
выводы
1. Возраст большинства обследованных женщин составляет 25-29 лет (42,1%), паритет родов — первобеременные первородящие 45,9%. Репродуктивный анамнез пациенток не отягощен, предыдущие беременности закончились своевременными родами в 96,1% случаев. Частота встречаемости экстрагенитальной и генитальной патологии не отличается от популяцион-ных данных. Вышеизложенное позволяет отнести обследованных женщин к группе низкого риска по развитию инфекционно-воспалительных осложнений и оценить именно влияние микробиоценоза и локального иммунитета на течение родов и послеродового периода.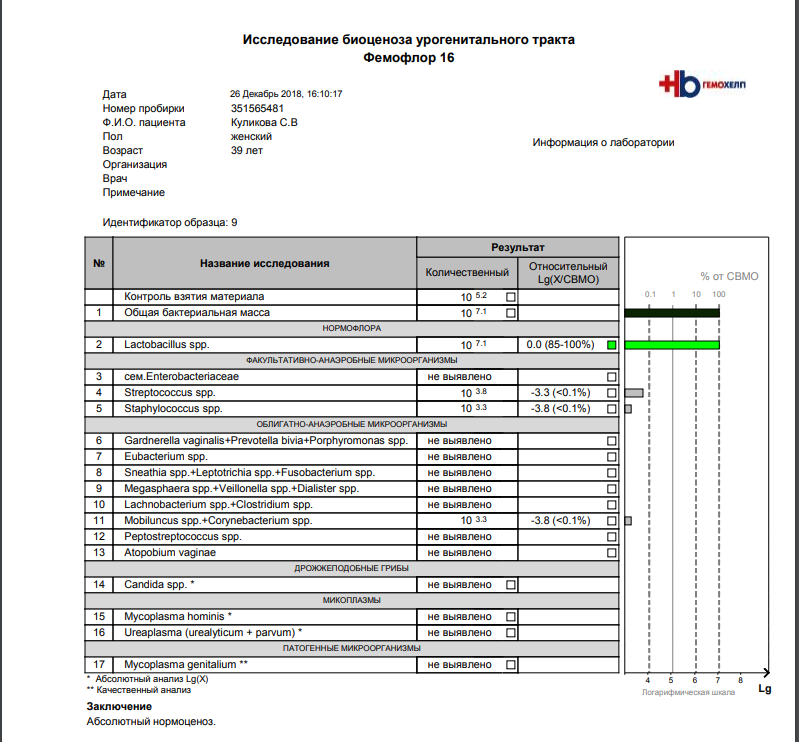
2. При доношенной беременности видовой состав нормофлоры не отличается от таковой вне и при беременности. Абсолютный нормоценоз выявлен в 53,5% случаев и характеризуется преобладанием доли лактобактерий — более 80% от общей бактериальной массы, содержанием условно-патогенных аэробных и анаэробных микрооганизмов — менее 10% от общей бактериальной массы, абсолютным количеством грибов рода Candida и ми-коплазм — не более 104ГЭ/образец. При относительном нормоценозе (36,3% случаев) на фоне высокого содержания лактобактерий выявляются грибы рода Candida и микоплазмы более 104 ГЭ/образец.
3. Дисбиотические состояния влагалища перед родами характеризуются снижением доли лактобактерий от 80% до 20% от общей бактериальной массы и увеличением доли аэробов и анаэробов (умеренный дисбиоз -7,6%), а также снижением доли лактобактерий менее 20% от общей бактериальной массы и резким увеличением аэробов и анаэробов (выраженный дисбиоз-2,5%).
4. Воспалительные заболевания нижних отделов репродуктивной системы беременных женщин сопровождаются изменением профиля экспрессии мРНК цитокинов. При этом повышается экспрессия генов IL1B в 9,1 раза, IL6 — в 13,1, IFNG — в 13,5, IL8 — в 6,1, CD45 — в 6,7, LIF — в 5,9, ILIO — в 5,2, TNF — в 2,7, снижается TGFB1 — в 1,8 раза, IL12A — в 1,7 и IL18 — в 3,7,
При этом повышается экспрессия генов IL1B в 9,1 раза, IL6 — в 13,1, IFNG — в 13,5, IL8 — в 6,1, CD45 — в 6,7, LIF — в 5,9, ILIO — в 5,2, TNF — в 2,7, снижается TGFB1 — в 1,8 раза, IL12A — в 1,7 и IL18 — в 3,7,
что позволяет использовать данные маркеры для диагностики воспалительного процесса.
5. Нарушение структуры микробиоценоза влагалища перед родами является значимым фактором риска осложненного течения родов и послеродового периода, что приводит к травме мягких тканей родовых путей (25,0%), субинволюции матки (25,0%), эндометриту (12,5%), раневой инфекции (6,3%).
6. Помимо дисбиотических состояний влагалища, существенным фактором риска осложнений родов и послеродового периода является наличие локальной воспалительной реакции, приводящей к осложнениям в 54,2% случаев. При абсолютном нормоценозе частота выявления «воспалительного» профиля экспрессии генов цитокинов составляет 3,7%, а при выраженном дисбиозе в 10 раз выше (33,3%).
7. Типирование лактобактерий является важным в диагностике воспалительных заболеваний половых органов. Повышенное количество Lactobacillus iners вызывает активацию локального иммунитета увеличением IL6 -в 2,9 раза, LIF — в 2,5 раза, IL10 — в 2 раза, что можно расценивать как неблагоприятный прогностический признак при оценке состояния микробиоценоза влагалища и прогнозе воспалительных заболеваний половых органов.
Повышенное количество Lactobacillus iners вызывает активацию локального иммунитета увеличением IL6 -в 2,9 раза, LIF — в 2,5 раза, IL10 — в 2 раза, что можно расценивать как неблагоприятный прогностический признак при оценке состояния микробиоценоза влагалища и прогнозе воспалительных заболеваний половых органов.
8. Наличие Candida spp. и Ureaplasma spp. в количестве более 104 ГЭ/образец во влагалище перед родами вне зависимости от сохранности нормофлоры приводит к осложнениям течения родов и послеродового периода только при наличии локальной воспалительной реакции (77,7% и 75% соответственно).
9. Высокий уровень Atopobium vaginae (1021 ГЭ/образец и более) может рассматриваться как фактор риска развития осложнений родов и послеродового периода вне зависимости от наличия локальной воспалительной реакции.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Структура биоценоза перед родами при доношенной беременности соответствует таковой вне и в течение беременности и может оцениваться по тем же критериям. «Абсолютный нормоценоз» характеризуется преобладанием лактобактерий более 80% от ОБМ, долей условно-патогенных аэробных и анаэробных микрооганизмов менее 10% от ОБМ, абсолютным количеством грибов рода кандида и микоплазм не более 104ГЭ/образец. «Относительный нормоценоз» характеризуется тем, что на фоне высокого содержания лактобактерий (более 80% от ОБМ) выявляются микоплазмы и/или грибы рода Candida более 104 ГЭ/образец. «Умеренный дисбиоз» — снижением лактобактерий от 80 до 20% ОБМ и увеличением доли аэробов и/или анаэробов. «Выраженный дисбиоз» — долей лактобактерий ниже 20% от ОБМ при резком увеличении анаэробов и аэробов.
«Абсолютный нормоценоз» характеризуется преобладанием лактобактерий более 80% от ОБМ, долей условно-патогенных аэробных и анаэробных микрооганизмов менее 10% от ОБМ, абсолютным количеством грибов рода кандида и микоплазм не более 104ГЭ/образец. «Относительный нормоценоз» характеризуется тем, что на фоне высокого содержания лактобактерий (более 80% от ОБМ) выявляются микоплазмы и/или грибы рода Candida более 104 ГЭ/образец. «Умеренный дисбиоз» — снижением лактобактерий от 80 до 20% ОБМ и увеличением доли аэробов и/или анаэробов. «Выраженный дисбиоз» — долей лактобактерий ниже 20% от ОБМ при резком увеличении анаэробов и аэробов.
2. Маркерами воспалительных заболеваний нижних отделов репродуктивной системы во время беременности являются изменения профиля экспрессии мРНК цитокинов. Наиболее информативно определение IL1B, IL8, ILIO, IL18.
3. Наличие абсолютного нормоценоза влагалища перед родами свидетельствует о низком риске возможных осложнений родов и послеродового периода.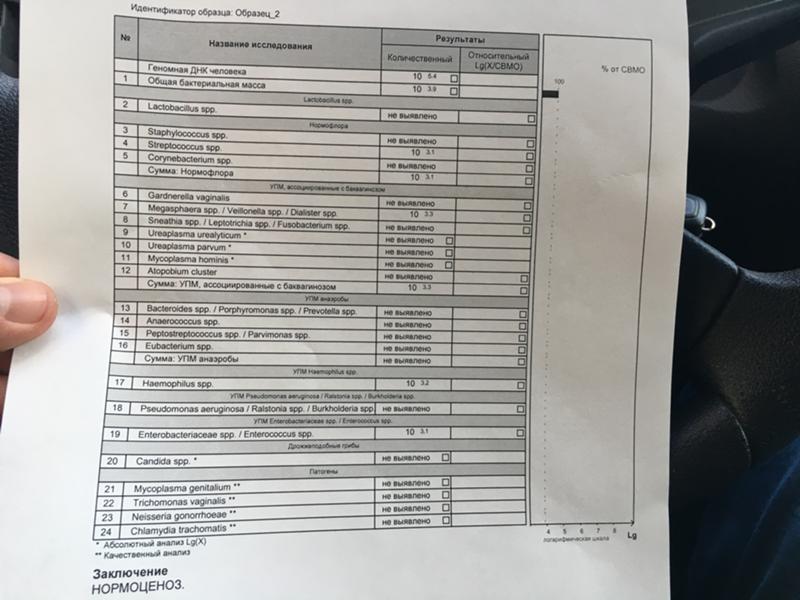
4. При выявлении относительного нормоценоза целесообразно определение профиля экспрессии генов цитокинов IL1B, IL8, IL10,IL18 в отделяемом влагалища и вычисление значения канонической линейной дискри-минантной функции (КЛДФ). Значение КЛДФ выше cut-off свидетельствует о наличии локальной воспалительной реакции слизистой влагалища и требует проведения своевременной профилактики осложнений родов и послеродового периода.
5. При наличии умеренного или выраженного дисбиоза влагалища беременных следует относить к группе высокого риска по развитию ослож-
нений родов и послеродового периода, что требует проведения необходимого комплекса лечебно-профилактических мероприятий.
6. Важным в диагностике воспалительных заболеваний половых органов является типирование лактобактерий. Преобладание в лактофлоре Lactobacillus crispatus можно расценивать как благоприятный прогностический признак при оценке состояния микробиоценоза влагалища. Повышение количества Lactobacillus iners предрасполагает к развитию воспалительных заболеваний половых органов и является неблагоприятным фактором в плане прогноза осложнений родов и послеродового периода.
7. Выявление в отделяемом влагалища Atopobium vaginae в количестве более 10 2,1 ГЭ/образец может рассматриваться как фактор риска по развитию осложнений родов и послеродового периода и требует проведения лечебно-профилактических мероприятий.
8. Наличие Candida spp. и Ureaplasma spp. более 104 ГЭ/образец перед родами вне зависимости от сохранности флоры влагалища может рассматриваться как фактор риска осложнений родов и послеродового периода только при наличии локальной воспалительной реакции. Бессимптомное кандидоносительство не требует лечения.
9. Сочетание дисбиотических состояний влагалища с локальной воспалительной реакцией у беременных перед родами требует тщательного контроля в послеродовом периоде с проведением полного комплекса лечебно-профилактических мероприятий.
Алгоритм обследования микробиоценоза и локального иммунитета влагалища у беременных перед родами
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Качественный и количественный состав микробиоценоза влагалища беременных женщин. / Донников А.Е., Тумбинская Л.В., Ворошилина Е.С., Муллабаева С.М., Меджидова М.К., Касабулатов Н.М. // Четвертый международный конгресс по репродуктивной медицине: Материалы конгресса,-Москва, 18-21 января, 2010,- С.67-68.
/ Донников А.Е., Тумбинская Л.В., Ворошилина Е.С., Муллабаева С.М., Меджидова М.К., Касабулатов Н.М. // Четвертый международный конгресс по репродуктивной медицине: Материалы конгресса,-Москва, 18-21 января, 2010,- С.67-68.
2. Оптимизация профилактики гнойно-воспалительных заболеваний послеродового периода. / Балушкина A.A., Меджидова М.К., Огай О.Ю., Тютюнник В.Л. // ХНЫИ Всероссийский научный форум «Мать и дитя»: Материалы форума.- Москва, 27-30 сентября, 2011.- С. 17.
3. Особенности локального иммунитета при дисбиотических состояниях влагалища перед родами. / Меджидова М.К., Трофимов Д.Ю., Донников А.Е., Бурменская О.В., Тютюнник В.Л. // ХНЫИ Всероссийский научный форум «Мать и дитя»: Материалы форума.- Москва, 27-30 сентября, 2011,- С.95-96.
4. Основные принципы терапии вульвовагинального кандидоза. / Ефимов Б.А., Тютюнник В.Л., Меджидова М.К. // Русский медицинский журнал.-2011.- Т. 19, № 20,- С. 1253-1256.
5. Неспецифический вагинит: этиология, патогенез, клиника, диагностика, современные принципы лечения. / Тютюнник В.Л., Михайлова О.И., Меджидова М.К. // Акушерство и гинекология.-2011.-№ 7-2.- С.92-96.
/ Тютюнник В.Л., Михайлова О.И., Меджидова М.К. // Акушерство и гинекология.-2011.-№ 7-2.- С.92-96.
6. Профиль экспрессии мРНК генов цитокинов при дисбиотических состояниях влагалища у беременных накануне родов. / Меджидова М.К., Бурменская О.В., Донников А.Е., Трофимов Д.Ю., Тютюнник В.Л. // Шестой международный конгресс по репродуктивной медицине: Материалы конгресса.- Москва, 18-21 января, 2012.- С.40-41.
7. Инфекция гениталий. Акушерские и перинатальные исходы. / Карапетян Т.Э., Тютюнник В.Л., Меджидова М.К. // Шестой
международный конгресс по репродуктивной медицине: Материалы конгресса,- Москва, 18-21 января, 2012.- С.66-67.
8. Современные представления и основные принципы лечения неспецифического вагинита. / Тютюнник B.JL, Михайлова О.И., Карапетян Т.Э., Меджидова М.К. // Русский медицинский журнал.-2012.- Т.20, № 1.-С.24-27.
9. Микробиоценоз влагалища и его особенности у беременных перед родами. / Меджидова М.К., Донников А.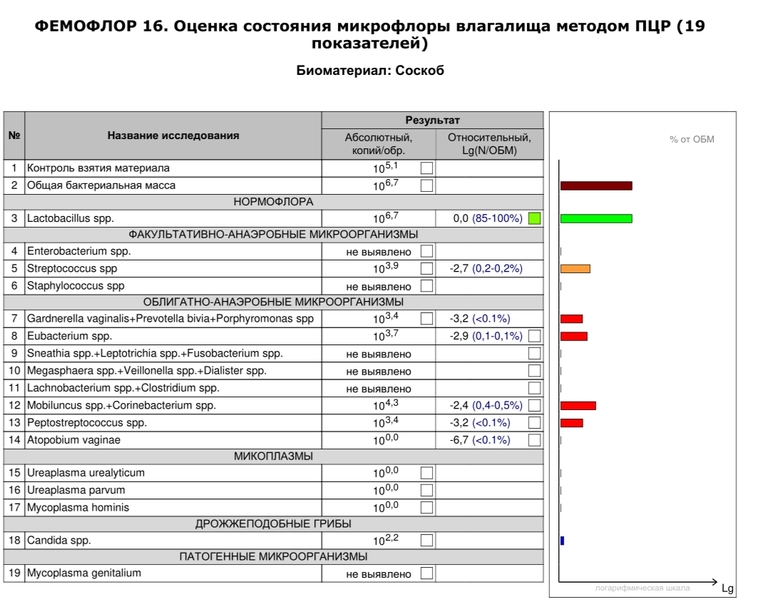 Е., Балушкина A.A., Тютюнник B.JI. // Вопросы гинекологии, акушерства и перинатологии.-2012,-Т.11, № 2,- С.38-46.
Е., Балушкина A.A., Тютюнник B.JI. // Вопросы гинекологии, акушерства и перинатологии.-2012,-Т.11, № 2,- С.38-46.
10. Оценка локальной воспалительной реакции во влагалище по профилю экспрессии мРНК генов цитокинов у беременных накануне родов. / Меджидова М.К., Бурменская О.В., Донников А.Е., Непша О.С., Трофимов Д.Ю., Тютюнник B.JI., Сухих Г.Т. // Акушерство и гинекология.-2012.-№ 3.-С.26-31.
Подписано в печать 15.05.2012 г. Формат 60х90Ш6. Тираж 120 экз., объем 1 п.л. Заказ № 15-01/05-12 Печать с готового оригинал-макета Центр полиграфических услуг «Радуга» Москва, ул. Автозаводская, 25
Criteria for diagnosis of bacterial vaginosis using the test Femoflor-16 | Nazarova
Введение
Бактериальный вагиноз (БВ) — основная причина патологических выделений из влагалища у женщин репродуктивного возраста. Исследования последних лет показывают, что БВ сопряжен с рядом воспалительных заболеваний органов мочеполового тракта и является одной из частых причин осложнений беременности [1–4].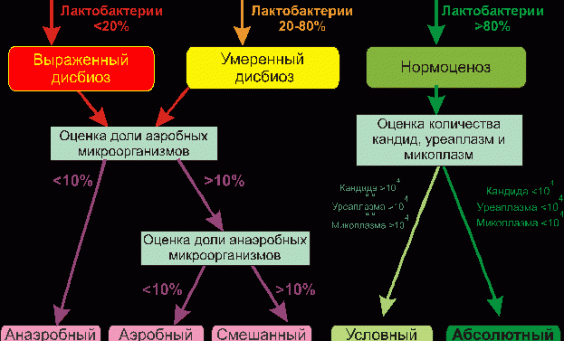 Распространенность заболевания широко варьирует (от 7 до 68 %) в зависимости от региона, этнической/расовой принадлежности, а также обследуемой популяции [5].
Распространенность заболевания широко варьирует (от 7 до 68 %) в зависимости от региона, этнической/расовой принадлежности, а также обследуемой популяции [5].
Основным методом клинической диагностики БВ является метод Амселя [6]. Для лабораторной диагностики используют главным образом метод Нуджента, основанный на определении бактериальных морфотипов при микроскопии окрашенных по Граму препаратов [7]. В нашей стране эти методы используются очень редко.
Бактериальный вагиноз представляет собой нарушение баланса между физиологической микрофлорой влагалища, представленной преимущественно лактобациллами, и условно патогенной микрофлорой, в норме обнаруживаемой во влагалище в небольшом количестве. Применительно к таким состояниям в отечественной литературе часто используется термин «дисбиоз влагалища». Другим известным дисбиозом влагалища является аэробный вагинит (АВ). Сходство БВ с АВ заключается в том, что при обоих состояниях наблюдается уменьшение количества лактобацилл, приводящее к снижению концентрации молочной кислоты и, соответственно, повышению рН среды влагалища, и их замещение условно патогенными микроорганизмами. Различия между этими заболеваниями существенны. Для БВ характерны отсутствие воспаления и присутствие большого количества анаэробной микрофлоры (типично выявляются Gardnerella vaginalis, Atopobium vaginae, представители родов Prevotella, Megasphaera, Leptotrichia, Sneatia, Mobiluncus и др.). Аэробный вагинит в его типичном проявлении характеризуется повышенным воспалительным ответом и/или выраженными признаками атрофии эпителия влагалища и наличием умеренного количества комменсальной кишечной микрофлоры [8]. Чаще всего при АВ выявляются стрептококки (до 59 % случаев), Staphylocuccus aureus (до 42 %), коагулазаотрицательные стафилококки (до 37 %), Escherichia coli (до 23 %) [9].
Различия между этими заболеваниями существенны. Для БВ характерны отсутствие воспаления и присутствие большого количества анаэробной микрофлоры (типично выявляются Gardnerella vaginalis, Atopobium vaginae, представители родов Prevotella, Megasphaera, Leptotrichia, Sneatia, Mobiluncus и др.). Аэробный вагинит в его типичном проявлении характеризуется повышенным воспалительным ответом и/или выраженными признаками атрофии эпителия влагалища и наличием умеренного количества комменсальной кишечной микрофлоры [8]. Чаще всего при АВ выявляются стрептококки (до 59 % случаев), Staphylocuccus aureus (до 42 %), коагулазаотрицательные стафилококки (до 37 %), Escherichia coli (до 23 %) [9].
В нашей стране в последние годы для выявления дисбиотических состояний влагалища широко используется тест отечественного производства Фемофлор-16 (ДНК-Технология, Москва). Тест основан на мультиплексной количественной ПЦР в реальном времени. С помощью теста определяют тотальную концентрацию бактериальной ДНК — общую бактериальную массу (ОБМ) и концентрацию (абсолютную и относительную) следующих видов/родов микроорганизмов: Lactobacillus, Enterobacteriaceae, Streptococcus, Staphylococcus, Gardnerella vaginalis/Prevotella bivia/Porphyromonas, Eubacterium, Sneathia/Leptotrichia/Fusobacterium, Megasphaera/Veillonella/Dialister, Lachnobacterium/Clostridium, Corynebacterium/Mobiluncus, Peptostreptococcus, Atopobium vaginae. По соотношению этих бактерий определяется состояние микробиоценоза влагалища — нормоценоз или дисбиоз. Дисбиоз, в свою очередь, оценивается по степени выраженности (умеренный или выраженный дисбиоз) и преобладанию аэробной или анаэробной условно патогенной микрофлоры (аэробный или анаэробный дисбиоз соответственно). Кроме того, оценивается абсолютная концентрация микроорганизмов Mycoplasma hominis, Ureaplasma и Candida, наличие ДНК которых в концентрации > 104 геном-эквивалентов в образце в отсутствие другой условно патогенной микрофлоры дает основание относить нормоценоз к категории условного.
По соотношению этих бактерий определяется состояние микробиоценоза влагалища — нормоценоз или дисбиоз. Дисбиоз, в свою очередь, оценивается по степени выраженности (умеренный или выраженный дисбиоз) и преобладанию аэробной или анаэробной условно патогенной микрофлоры (аэробный или анаэробный дисбиоз соответственно). Кроме того, оценивается абсолютная концентрация микроорганизмов Mycoplasma hominis, Ureaplasma и Candida, наличие ДНК которых в концентрации > 104 геном-эквивалентов в образце в отсутствие другой условно патогенной микрофлоры дает основание относить нормоценоз к категории условного.
Алгоритмы интерпретации результатов теста Фемофлор-16 не включают категорию БВ. Однако для ведения пациента, основанного на принципах доказательной медицины, лабораторное заключение должно давать информацию, позволяющую с высокой точностью установить или опровергнуть определенный общепринятый диагноз. Целью исследования явилась разработка диагностических критериев определения БВ при анализе отделяемого влагалища тестом Фемофлор-16.
Материалы и методы
В исследовании участвовали женщины репродуктивного возраста, обратившиеся к аку шеру-гинекологу с жалобами на дискомфорт и выделения из половых путей в поликлиническое отделение ФГБНУ «Научно-исследова тельский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта» и СПб ГБУЗ «Городская поликлиника № 34». Критериями исключения являлись беременность и применение антибактериальных препаратов в течение последних четырех недель.
Клиническим материалом для исследования служило отделяемое влагалища, которое получали с помощью двух дакроновых тампонов. Содержимое одного тампона наносили на предметное стекло для микроскопического исследования. Содержимое второго тампона использовали для анализа с применением теста Фемофлор-16.
Для клинической диагностики БВ использовали критерии Амселя [6] с небольшой модификацией, заключавшейся в том, что для определения ключевых клеток в отделяемом влагалища использовали не нативный, а окрашенный по Граму препарат. При выполнении как минимум трех из четырех критериев, а именно наличия специфических выделений из влагалища, повышенного pH влагалища (> 4,5), положительного аминного теста; наличия «ключевых» клеток при микроскопическом исследовании отделяемого влагалища, устанавливали диагноз БВ.
При выполнении как минимум трех из четырех критериев, а именно наличия специфических выделений из влагалища, повышенного pH влагалища (> 4,5), положительного аминного теста; наличия «ключевых» клеток при микроскопическом исследовании отделяемого влагалища, устанавливали диагноз БВ.
Лабораторный анализ на БВ производили путем исследования отделяемого влагалища с применением метода Нуджента [7]. В окрашенных по Граму препаратах определяли следующие бактериальные морфотипы: крупные грамположительные палочки (морфотип лактобациллы), небольшие грамотрицательные или грамвариабельные кокки и коккобациллы (морфотип Gardnerella и Bacteroides) и грамотрицательные или грамвариабельные изогнутые палочки (морфотип Mobiluncus). В зависимости от суммы баллов образцы расценивали как нормальную микрофлору (число баллов от 0 до 3), промежуточную микрофлору (число баллов от 4 до 6) и БВ (число баллов от 7 до 10).
Анализ образцов отделяемого влагалища с использованием теста Фемофлор-16 проводили в соответствии с инструкцией производителя. Интерпретацию результатов осуществляли с применением алгоритма производителя (см. рис. 1).
Интерпретацию результатов осуществляли с применением алгоритма производителя (см. рис. 1).
Рис. 1. Алгоритм интерпретации результатов теста Фемофлор-16
При разработке диагностических критериев БВ количество всех микроорганизмов, за исключением M. hominis, Ureaplasma и Candida, было представлено как соотношение концентрации их ДНК к ОБМ в долях единицы. Количество M. hominis, Ureaplasma и Candidaпредставляли в абсолютных значениях концентрации ДНК (геном-эквивалентов в образце). Для изучения ассоциации микроорганизмов/групп микроорганизмов, определяемых тестом Фемофлор-16, с БВ проводили анализ корреляции их количества с клиническими и микроскопическими показателями БВ: числом баллов по шкале Нуджента, суммой положительных критериев Амселя и со значениями рН влагалища. Для оценки способности потенциальных бактериальных маркеров, определяемых с применением теста Фемофлор-16, правильно классифицировать образцы с нормальной микрофлорой и БВ использовали ROC-анализ (ROC — receiver operating characteristic). Оптимальный порог содержания бактерий определяли по максимальной пропорции правильно классифицированных образцов. Статистический анализ результатов осуществляли с использованием статистических пакетов Statistica (StatSoft) и SPSS (IBM).
Оптимальный порог содержания бактерий определяли по максимальной пропорции правильно классифицированных образцов. Статистический анализ результатов осуществляли с использованием статистических пакетов Statistica (StatSoft) и SPSS (IBM).
Результаты
В исследование было включено 280 женщин в возрасте от 20 до 45 лет (29 ± 5,7 года). С использованием критериев Амселя БВ был выявлен у 86 женщин, 194 женщины не имели БВ. Согласно классификации вагинальных проб по методу Нуджента 172 образца были причислены к категории нормальной микрофлоры, 27 — промежуточной микрофлоры, 81 — БВ (табл. 1).
Таблица 1. Результаты исследования отделяемого влагалища с использованием методов Амселя и Нуджента
Table 1. Results of the analysis of vaginal samples using the Amsel criteria and Nugent score
Категория по Амселю | Категория по Нудженту | Всего | ||
нормальная микрофлора | промежуточная микрофлора | бактериальный вагиноз | ||
Норма | 172 | 21 | 1 | 194 |
Бактериальный вагиноз | 0 | 6 | 80 | 86 |
Всего | 172 | 27 | 81 | 280 |
Пробы от всех женщин были протестированы с использованием теста Фемофлор-16. Результаты 10 проб были признаны невалидными ввиду низкого значения контроля взятия материала и исключены из анализа. Таким образом, в анализ было включено 270 проб. Из них 164 пробы были из категории нормальной микрофлоры по Нудженту, 26 — промежуточной микрофлоры и 80 — БВ. В соответствии с алго ритмами интерпретации результатов теста Фемофлор-16 100 случаев были классифицированы как нормоценоз, 24 — условный нормоценоз, 45 — умеренный дисбиоз (44 — анаэробный, 1 — аэробный), 101 — выраженный дисбиоз (90 — анаэробный, 8 — аэробный, 3 — смешанный) (табл. 2).
Результаты 10 проб были признаны невалидными ввиду низкого значения контроля взятия материала и исключены из анализа. Таким образом, в анализ было включено 270 проб. Из них 164 пробы были из категории нормальной микрофлоры по Нудженту, 26 — промежуточной микрофлоры и 80 — БВ. В соответствии с алго ритмами интерпретации результатов теста Фемофлор-16 100 случаев были классифицированы как нормоценоз, 24 — условный нормоценоз, 45 — умеренный дисбиоз (44 — анаэробный, 1 — аэробный), 101 — выраженный дисбиоз (90 — анаэробный, 8 — аэробный, 3 — смешанный) (табл. 2).
Таблица 2. Результаты исследования отделяемого влагалища с использованием метода Нуджента и теста Фемофлор-16
Table 2. Results of the analysis of vaginal samples using the Nugent score and Femoflor-16 test
Результат теста Фемофлор-16 | Категория по Нудженту | Всего | ||
нормальная микрофлора | промежуточная микрофлора | бактериальный вагиноз | ||
Нормоценоз | 98 | 2 | 0 | 100 |
Условный нормоценоз | 23 | 1 | 0 | 24 |
Умеренный анаэробный дисбиоз | 37 | 6 | 1 | 44 |
Умеренный аэробный дисбиоз | 1 | 0 | 0 | 1 |
Выраженный анаэробный дисбиоз | 2 | 10 | 78 | 90 |
Выраженный аэробный дисбиоз | 2 | 5 | 1 | 8 |
Выраженный смешанный дисбиоз | 1 | 2 | 0 | 3 |
Всего | 164 | 26 | 80 | 270 |
Для изучения ассоциации микроорганизмов/групп микроорганизмов, определяемых тестом Фемофлор-16, с БВ был проведен анализ корреляции их количества с клиническими и микроскопическими показателями БВ, а именно числом баллов по шкале Нуджента, суммой положительных критериев Амселя и со значениями рН влагалища (рис. 2, 3).
2, 3).
Рис. 2. Коэффициенты корреляции (r) количества микроорганизмов/групп микроорганизмов, определяемых тестом Фемофлор-16, с количественными показателями бактериального вагиноза. ОБМ — общая бактериальная масса
Рис. 3. Статистическая значимость (р) корреляции количества микроорганизмов/групп микроорганизмов, определяемых тестом Фемофлор, с количественными показателями бактериального вагиноза. ОБМ — общая бактериальная масса
Отрицательная корреляция с БВ была установлена для соотношения Lactobacillus/ОБМ. Анаэробные бактерии/группы бактерий предсказуемо показали положительную корреляцию с БВ, при этом самые высокие коэффициенты корреляции наблюдались для групп Gardnerella vaginalis/Prevotella bivia/Porphyromonas, Sneathia/Leptotrichia/Fusobacterium и Megasphaera/Veillo nella/Dialister. Положительная корреляция с БВ также наблюдалась для M. hominis. Из бактерий, традиционно связываемых с БВ, Mobiluncus не показал значимой корреляции ни с одним из показателей БВ, что может быть связано с тем, что эти бактерии в тесте Фемофлор-16 выявляются в совокупности с филогенетически родственными, но не связанными с БВ бактериями рода Corynebacterium. Содержание ДНК аэробных бактерий кишечной группы (энтеробактерий, стрептококков и стафилококков), а также уреаплазм и дрожжеподобных грибов рода Candida ожидаемо не коррелировало с показателями БВ.
Содержание ДНК аэробных бактерий кишечной группы (энтеробактерий, стрептококков и стафилококков), а также уреаплазм и дрожжеподобных грибов рода Candida ожидаемо не коррелировало с показателями БВ.
Следующим этапом нашего анализа была оценка способности бактериальных маркеров, определяемых с применением теста Фемо флор-16, правильно классифицировать образцы с нормальной микрофлорой и БВ. Для этой цели был использован ROC-анализ. В качестве референтного стандарта применяли метод Нуд жента. Так как определение диагностических характеристик требует бинарной классификации случаев («есть болезнь» или «нет болезни»), случаи промежуточной микрофлоры по Нудженту были исключены из анализа. В анализ включили ОБМ и относительную концентрацию ДНК бактерий, показавших значительную корреляцию с БВ, а именно лактобацилл и всех групп анаэробных бактерий, за исключением Corynebacterium/Mobiluncus. Вычисляли значения площади под ROC-кривой, а также значения чувствительности и специфичности при оптимальном пороге относительной концентрации ДНК.
Самую высокую диагностическую точность (площадь под ROC-кривой превышает значение 0,9, что рассматривается как отличная диагностическая точность) продемонстрировали следующие маркеры: соотношение лактобацилл и ОБМ (площадь под ROC-кривой 0,996), Gardnerella vaginalis/Prevotella bivia/Porphyro monas/ОБМ (0,975), Eubacterium/ОБМ (0,942), Sneathia/Leptotrichia/Fusobacterium/ОБМ (0,907), Megasphaera/Veillonella/Dialister/ОБМ (0,934) и Atopobium vaginae/ОБМ (0,908) (рис. 4). Мар керы Lachnobacterium/Clostridium/ОБМ и Pepto streptococcus/ОБМ обладали удовлетворительной (площадь под ROC-кривой 0,775) и хорошей (0,850) диагностической точностью соответственно. Общая бактериальная масса и концентрация M. hominis показали низкую диагностическую точность (площадь под ROC-кривой ниже 0,7).
Рис. 4. ROC-анализ способности бактериальных маркеров, определяемых тестом Фемофлор-16, выявлять бактериальный вагиноз. Чем ближе ROC-кривая к верхнему левому углу (точка 100 % чувствительности и 100 % специфичности), тем выше точность классификатора
Для маркеров с площадью под ROC-кривой выше 0,7 был рассчитан оптимальный порог относительной концентрации и показатели чувствительности и специфичности при данном пороге (табл.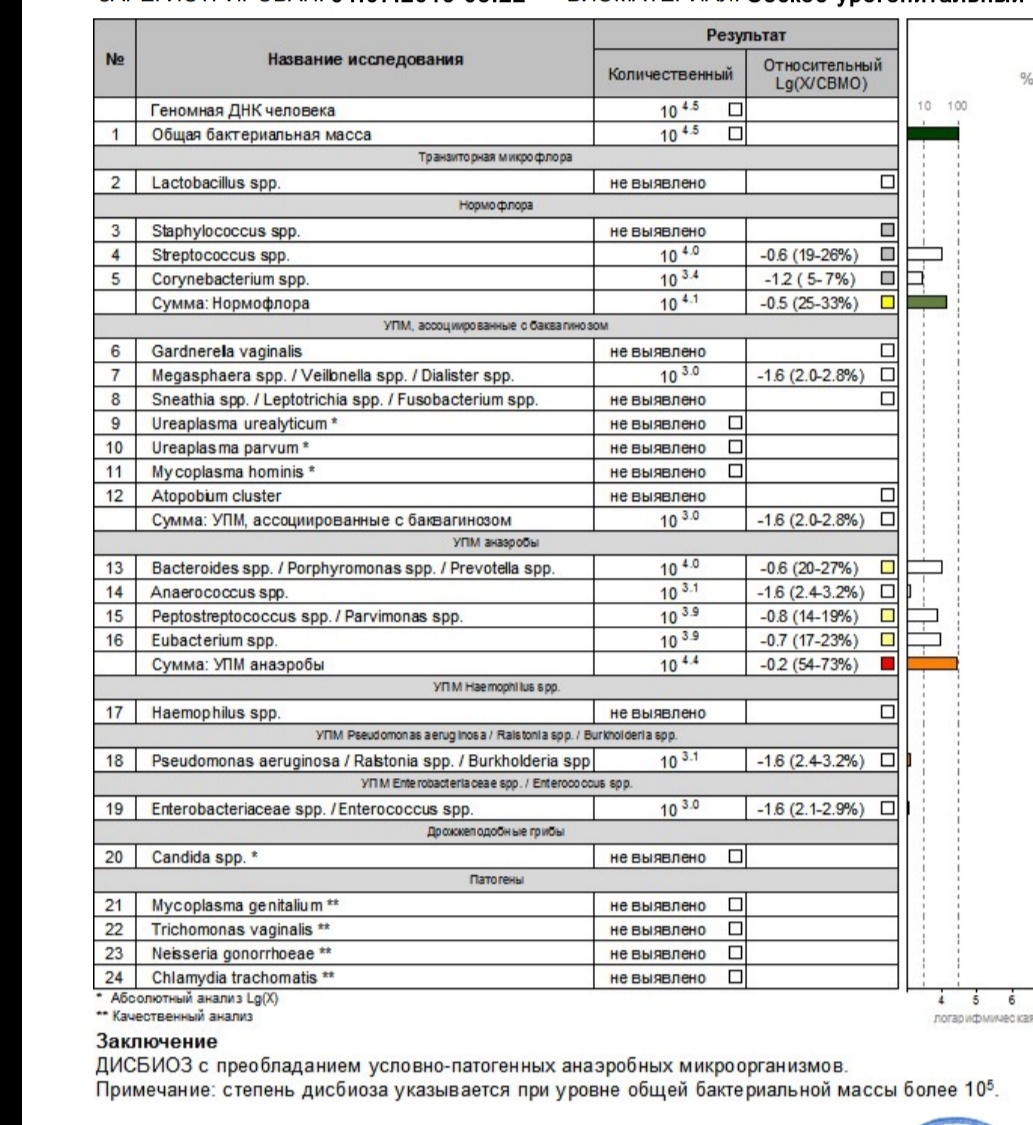 3). Самые высокие показатели чувствительности и специфичности были показаны для соотношения концентрации ДНК лактобацилл к ОБМ. При пороге < 0,1 (иными словами, если содержание лактобацилл в отделяемом влагалища ниже 10 %) данный показатель предсказывает БВ с чувствительностью и специфичностью, равными 99 %. Самыми высокими показателями чувствительности и спе цифичности обладал маркер Gardnerella vaginalis/Prevotella bivia/Porphyromonas/ОБМ — 95 и 94 % соответственно, при пороге > 0,01 (т. е. при содержании выше 1 %). Чувствительность остальных маркеров варьировала от 39 до 80 %, специфичность — от 93 до 99 %.
3). Самые высокие показатели чувствительности и специфичности были показаны для соотношения концентрации ДНК лактобацилл к ОБМ. При пороге < 0,1 (иными словами, если содержание лактобацилл в отделяемом влагалища ниже 10 %) данный показатель предсказывает БВ с чувствительностью и специфичностью, равными 99 %. Самыми высокими показателями чувствительности и спе цифичности обладал маркер Gardnerella vaginalis/Prevotella bivia/Porphyromonas/ОБМ — 95 и 94 % соответственно, при пороге > 0,01 (т. е. при содержании выше 1 %). Чувствительность остальных маркеров варьировала от 39 до 80 %, специфичность — от 93 до 99 %.
Таким образом, низкое содержание лактобацилл является самым чувствительным и специ фичным критерием БВ. Однако необходимо учитывать, что при расчете диагностических характеристик мы исключили промежуточную категорию по Нудженту, в которую входит большинство проб из категории «выраженный аэробный и смешанный дисбиоз с высоким содержанием аэробных бактерий», также характеризующихся низким содержанием лактобацилл.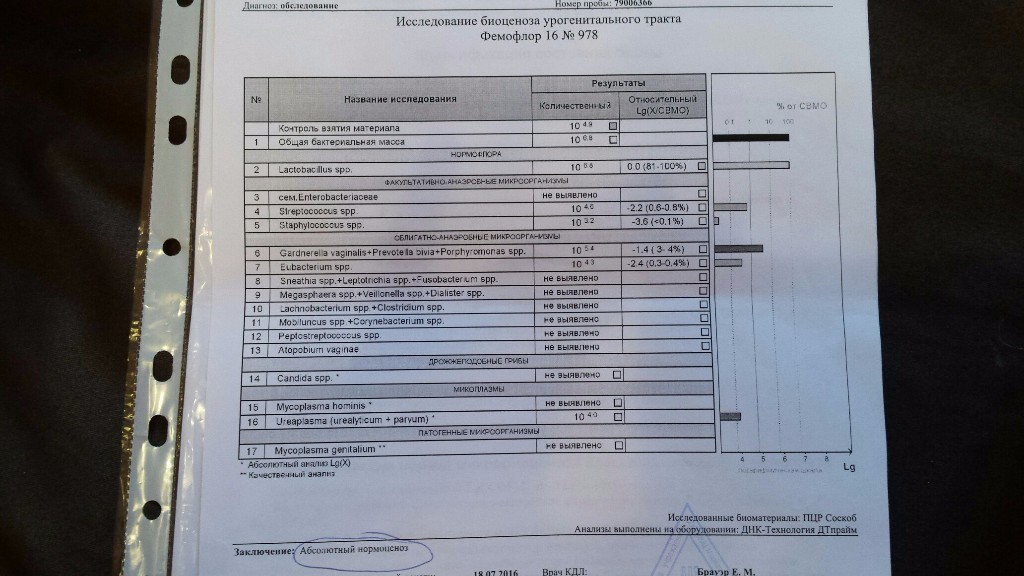 В связи с этим использование соотношения лактобацилл к ОБМ как единственного критерия может приводить к ложноположительным результатам, хотя и немногочисленным. Принимая во внимание этот факт, представляется целесообразным рассматривать микрофлору влагалища как соответствующую БВ, если выполняются два условия: низкое содержание лактобацилл и повышенное содержание (выше порога, обозначенного в табл. 3) как минимум одного из бактериальных маркеров БВ.
В связи с этим использование соотношения лактобацилл к ОБМ как единственного критерия может приводить к ложноположительным результатам, хотя и немногочисленным. Принимая во внимание этот факт, представляется целесообразным рассматривать микрофлору влагалища как соответствующую БВ, если выполняются два условия: низкое содержание лактобацилл и повышенное содержание (выше порога, обозначенного в табл. 3) как минимум одного из бактериальных маркеров БВ.
Таблица 3. Диагностическая точность бактериальных маркеров, выявляемых с применением теста Фемофлор-16, для определения бактериального вагиноза
Table 3. Diagnostic accuracy of the bacterial markers detected by Femoflor-16 test for bacterial vaginosis
Бактерии | Площадь под ROC-кривой | Оптимальный порог | Чувствитель ность, % | Специфич ность, % |
Лактобациллы/ОБМ | 0,996 | < 0,1 | 99 | 99 |
Gardnerella vaginalis/Prevotella bivia/Porphyromonas/ОБМ | 0,975 | > 0,01 | 95 | 94 |
Eubacterium/ОБМ | 0,942 | > 0,02 | 83 | 93 |
Sneathia/Leptotrichia/Fusobacterium/ОБМ | 0,907 | > 0,001 | 68 | 99 |
Megasphaera/Veillonella/Dialister/ОБМ | 0,934 | > 0,001 | 80 | 96 |
Lachnobacterium/Clostridium/ОБМ | 0,775 | > 0,001 | 39 | 97 |
Peptostreptococcus/ОБМ | 0,850 | > 0,001 | 61 | 94 |
Atopobium vaginae/ОБМ | 0,908 | > 0,002 | 76 | 99 |
Примечание: ОБМ — общая бактериальная масса | ||||
Для того чтобы оценить чувствительность и специфичность предлагаемого подхода к диагностике БВ, мы включили в анализ промежуточную микрофлору по Нудженту, объединив ее с нормальной микрофлорой. Иначе говоря, все случаи были разделены на БВ (n = 80) и отсутствие БВ (n = 190). Если в качестве критерия БВ использовали только низкое содержание лактобацилл, чувствительность и специфичность выявления БВ равнялись 99 и 89 % соответственно (табл. 4). Когда же в качестве критерия БВ использовали низкое содержание лактобацилл в совокупности с повышенным содержанием анаэробных бактерий, количество ложноположительных случаев ожидаемо уменьшилось (с 20 до 13), что привело к повышению специфичности до 93 %.
Иначе говоря, все случаи были разделены на БВ (n = 80) и отсутствие БВ (n = 190). Если в качестве критерия БВ использовали только низкое содержание лактобацилл, чувствительность и специфичность выявления БВ равнялись 99 и 89 % соответственно (табл. 4). Когда же в качестве критерия БВ использовали низкое содержание лактобацилл в совокупности с повышенным содержанием анаэробных бактерий, количество ложноположительных случаев ожидаемо уменьшилось (с 20 до 13), что привело к повышению специфичности до 93 %.
Таблица 4. Чувствительность и специфичность диагностических критериев бактериального вагиноза с использованием теста Фемофлор-16
Table 4. Sensitivity and specificity of the diagnostic criteria for bacterial vaginosis using Femoflor-16 test
Критерии | Категория по Нудженту | Чувстви тельность, % | Специфич ность, % | ||
отсутствие бактериального вагиноза (нормальная и промежуточная микрофлора) | бактериаль ный вагиноз | ||||
Низкое содержание лактобацилл | Нет | 170 | 1 | 99 | 89 |
Да | 20 | 79 | |||
Низкое содержание лактобацилл в совокупности с повышенным содержанием анаэробных бактерий | Нет | 177 | 1 | 99 | 93 |
Да | 13 | 79 | |||
Заключительным этапом нашей работы было сопоставление разработанных нами критериев выявления БВ с критериями производителя теста для выраженного анаэробного дисбиоза, который неформально приравнивается к БВ.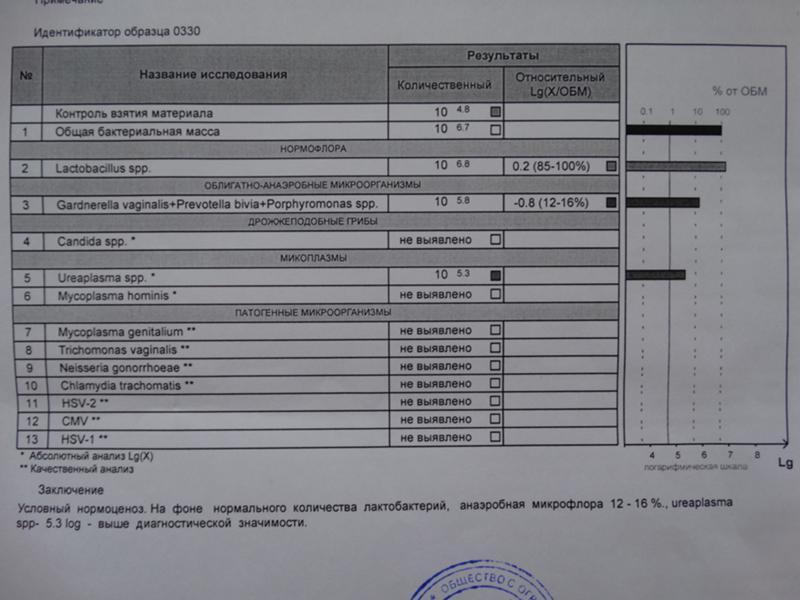 Из 92 проб, интерпретированных нами как БВ, 87 проб были отнесены к категории выраженного анаэробного дисбиоза, 2 — выраженного аэробного дисбиоза, 3 — выраженного смешанного дисбиоза. В то же время 3 из 90 проб из категории выраженного анаэробного дисбиоза были интерпретированы нами как отсутствие БВ (табл. 5). Таким образом, разработанные в данном исследовании диагностические критерии БВ и критерии, разработанные производителями теста Фемофлор, в значительной степени описывают одну и ту же категорию микробиоценоза влагалища.
Из 92 проб, интерпретированных нами как БВ, 87 проб были отнесены к категории выраженного анаэробного дисбиоза, 2 — выраженного аэробного дисбиоза, 3 — выраженного смешанного дисбиоза. В то же время 3 из 90 проб из категории выраженного анаэробного дисбиоза были интерпретированы нами как отсутствие БВ (табл. 5). Таким образом, разработанные в данном исследовании диагностические критерии БВ и критерии, разработанные производителями теста Фемофлор, в значительной степени описывают одну и ту же категорию микробиоценоза влагалища.
Таблица 5. Сопоставление категорий микробиоценоза влагалища, определенных с помощью критериев бактериального вагиноза, и результатов теста Фемофлор-16
Table 5. Comparison of the categories of the vaginal microbiocenosis determined using the criteria for bacterial vaginosis with the results of Femoflor-16 test
Результат теста Фемофлор-16 | Разработанные в данном исследовании критерии бактериального вагиноза | Всего | |
отсутствие бактериального вагиноза | бактериальный вагиноз | ||
Нормоценоз | 100 | 0 | 100 |
Условный нормоценоз | 24 | 0 | 24 |
Умеренный анаэробный дисбиоз | 44 | 0 | 44 |
Умеренный аэробный дисбиоз | 1 | 0 | 1 |
Выраженный анаэробный дисбиоз | 3 | 87 | 90 |
Выраженный аэробный дисбиоз | 6 | 2 | 8 |
Выраженный смешанный дисбиоз | 0 | 3 | 3 |
Всего | 178 | 92 | 270 |
Обсуждение результатов
В последние годы молекулярные методы активно внедряются в диагностику урогенитальных инфекций, в том числе ассоциированных с условно патогенными микроорганизмами.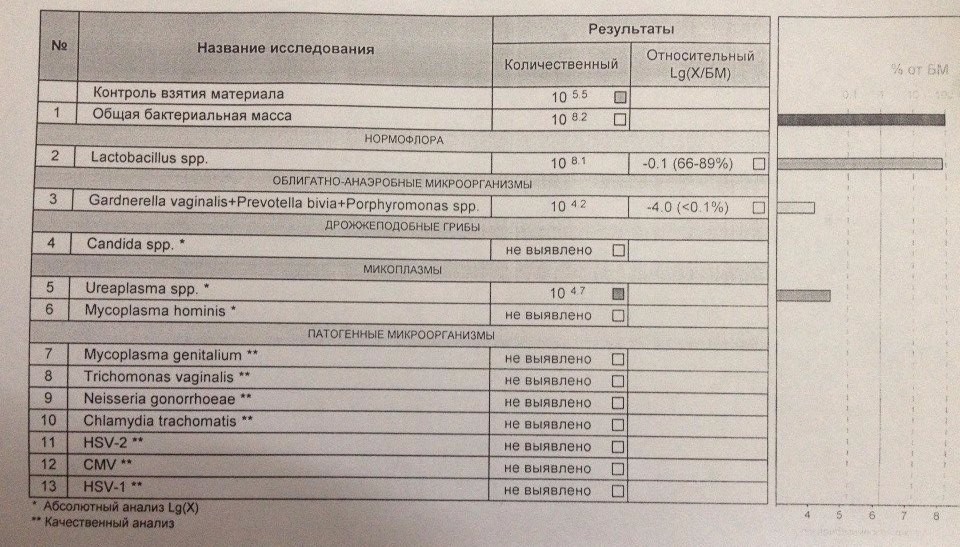 Условно патогенная микрофлора влагалища является частью эндогенной (нормальной) микрофлоры, поэтому при анализе связанных с ней дисбиотических состояний необходимо учитывать ее количественный состав. Тест Фемофлор-16, основанный на количественной ПЦР в реальном времени, был внедрен в клиническую лабораторную диагностику в 2009 г. и нашел достаточно широкое применение. Тест обладает рядом преимуществ перед традиционными методами выявления нарушений микробиоценоза влагалища — бактериологическим и микроскопическим. Его преимущества перед обоими методами заключаются в высоком уровне стандартизации анализа и интерпретации результатов, исключении фактора субъективности, точной количественной оценке. От бактериологического метода тест Фемофлор-16 отличается также быстротой анализа, возможностью выявлять некультивируемые и трудно культивируемые микроорганизмы. Далее, тест позволяет дифференцировать бактерии, имеющие сходные морфотипы и поэтому неразличимые при бактериоскопии. Суммируя вышесказанное, можно утверждать, что тест дает возможность быстрой, объективной, стандартизованной характеристики микробиоценоза влагалища.
Условно патогенная микрофлора влагалища является частью эндогенной (нормальной) микрофлоры, поэтому при анализе связанных с ней дисбиотических состояний необходимо учитывать ее количественный состав. Тест Фемофлор-16, основанный на количественной ПЦР в реальном времени, был внедрен в клиническую лабораторную диагностику в 2009 г. и нашел достаточно широкое применение. Тест обладает рядом преимуществ перед традиционными методами выявления нарушений микробиоценоза влагалища — бактериологическим и микроскопическим. Его преимущества перед обоими методами заключаются в высоком уровне стандартизации анализа и интерпретации результатов, исключении фактора субъективности, точной количественной оценке. От бактериологического метода тест Фемофлор-16 отличается также быстротой анализа, возможностью выявлять некультивируемые и трудно культивируемые микроорганизмы. Далее, тест позволяет дифференцировать бактерии, имеющие сходные морфотипы и поэтому неразличимые при бактериоскопии. Суммируя вышесказанное, можно утверждать, что тест дает возможность быстрой, объективной, стандартизованной характеристики микробиоценоза влагалища.
Лабораторное заключение исследования отделяемого влагалища тестом Фемофлор-16 включает следующие основные категории вагинальной микрофлоры: нормоценоз (включая условный нормоценоз), умеренный дисбиоз (анаэробный и аэробный) и выраженный дисбиоз (анаэробный и аэробный). Инициируя данное исследование, мы исходили из убеждения, что тест Фемофлор-16 обладает потенциалом достаточно точно выявлять два основных нарушения баланса вагинальной микрофлоры — БВ и АВ. Данную работу мы посвятили разработке критериев диагностики БВ. По нашему мнению, с помощью теста возможно, после разработки соответствующих критериев, с высокой долей определенности выявлять тип вагинальной микрофлоры, соответствующий аэробному вагиниту (для точной диагностики аэробного вагинита необходима также оценка воспалительной реакции).
Первым этапом нашего анализа была оценка ассоциации выявляемых микроорганизмов/групп микроорганизмов с БВ. Все группы анаэробных бактерий, за исключением группы Corynebacterium/Mobiluncus, коррелировали в той или иной степени с БВ.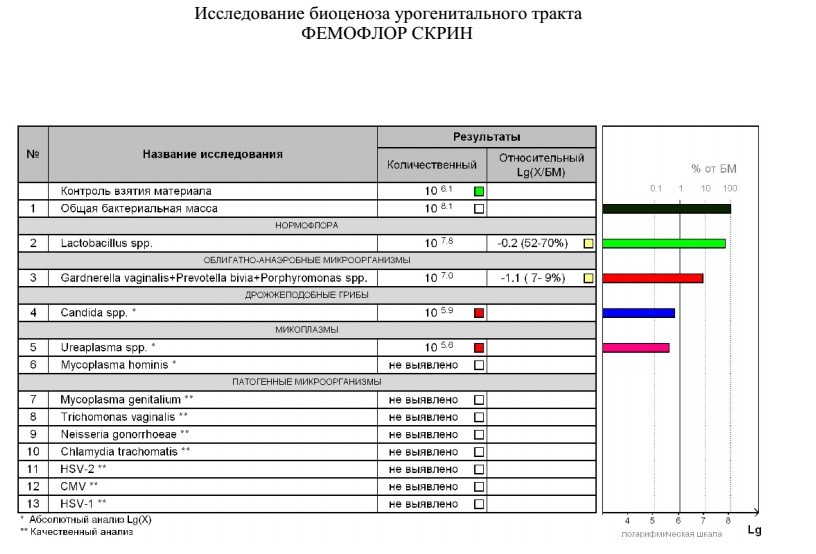 Оба рода бактерий принадлежат порядку Actinomycetales класса Actinobacteria, однако Mobiluncus spp. ассоциирован с БВ, а Corynebacterium spp. — нет. Результаты метагеномных исследований микрофлоры влагалища свидетельствуют, что содержание бактерий рода Corynebacterium в некоторых случаях, хоть и немногочисленных, может быть существенным, выше 10 % [10]. В связи с этим совокупное выявление Mobiluncus spp. и Corynebacterium spp. может приводить к необоснованному заключению о дисбиотическом состоянии влагалища.
Оба рода бактерий принадлежат порядку Actinomycetales класса Actinobacteria, однако Mobiluncus spp. ассоциирован с БВ, а Corynebacterium spp. — нет. Результаты метагеномных исследований микрофлоры влагалища свидетельствуют, что содержание бактерий рода Corynebacterium в некоторых случаях, хоть и немногочисленных, может быть существенным, выше 10 % [10]. В связи с этим совокупное выявление Mobiluncus spp. и Corynebacterium spp. может приводить к необоснованному заключению о дисбиотическом состоянии влагалища.
Далее, нами были разработаны критерии, которые позволяют с чувствительностью 99 % и специфичностью 93 % установить диагноз БВ или исключить его. Необходимо отметить, что при оценке разработанных критериев мы объединили категории нормальной и промежуточной микрофлоры по Нудженту, определив эту сборную категорию как отсутствие БВ. Известно, что категория промежуточной микрофлоры по Нудженту неоднородна по своему составу, и на сегодняшний день нет единого мнения относительно ведения пациенток с данной категорией вагинальной микрофлоры. Полагают, что эта категория содержит по большей части микрофлору, соответствующую аэробному вагиниту, а также действительно промежуточную микрофлору, т. е. переходную от нормы к БВ [8]. Наши результаты служат этому косвенным подтверждением: 5 из 8 случаев (63 %) выраженного аэробного дисбиоза, определенных тестом Фемофлор-16, вошли в категорию промежуточной микрофлоры по Нудженту. Важно отметить, что при сопоставлении результатов тестирования на БВ с использованием разработанных нами критериев и тестирования на выраженный анаэробный дисбиоз (неформально приравнивается к БВ) с использованием критериев производителя теста количество дискордантных результатов было относительно небольшим.
Полагают, что эта категория содержит по большей части микрофлору, соответствующую аэробному вагиниту, а также действительно промежуточную микрофлору, т. е. переходную от нормы к БВ [8]. Наши результаты служат этому косвенным подтверждением: 5 из 8 случаев (63 %) выраженного аэробного дисбиоза, определенных тестом Фемофлор-16, вошли в категорию промежуточной микрофлоры по Нудженту. Важно отметить, что при сопоставлении результатов тестирования на БВ с использованием разработанных нами критериев и тестирования на выраженный анаэробный дисбиоз (неформально приравнивается к БВ) с использованием критериев производителя теста количество дискордантных результатов было относительно небольшим.
Еще одним побудительным мотивом для данного исследования послужили трудности, испытываемые клиницистами при интерпретации категории умеренного дисбиоза, которая подразумевает промежуточное состояние между нормоценозом и выраженным дисбиозом. Особенно проблематичной является категория умеренного анаэробного дисбиоза, так как она выявляется довольно часто.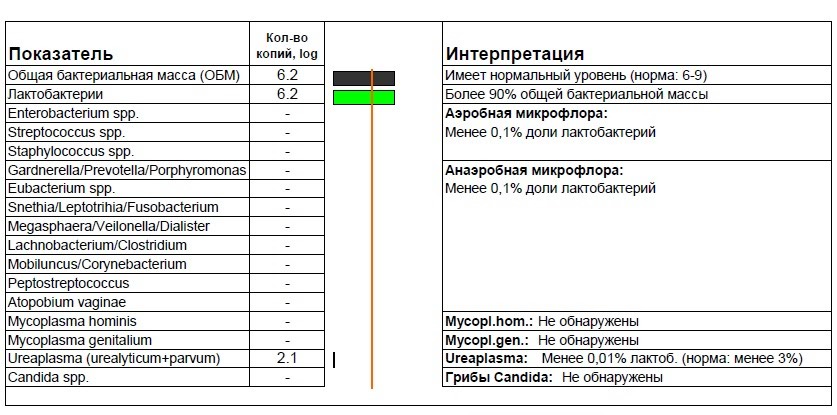 Так, в нашем исследовании 44 из 270 случаев (16 %) были отнесены к этой категории. Сравнение результатов теста Фемофлор-16 и метода Нуджента показало, что подавляющее большинство проб из категории умеренного анаэробного дисбиоза (37 из 44, 84 %) были классифицированы как нормальная микрофлора по шкале Нуджента и только 6 случаев (14 %) были отнесены к категории промежуточной микрофлоры, и один случай (2 %) — к категории БВ. На наш взгляд, категория промежуточного состояния, определяемая тестом Фемофлор-16 как умеренный дисбиоз, должна быть сужена и включать только пограничные, трудно интерпретируемые случаи.
Так, в нашем исследовании 44 из 270 случаев (16 %) были отнесены к этой категории. Сравнение результатов теста Фемофлор-16 и метода Нуджента показало, что подавляющее большинство проб из категории умеренного анаэробного дисбиоза (37 из 44, 84 %) были классифицированы как нормальная микрофлора по шкале Нуджента и только 6 случаев (14 %) были отнесены к категории промежуточной микрофлоры, и один случай (2 %) — к категории БВ. На наш взгляд, категория промежуточного состояния, определяемая тестом Фемофлор-16 как умеренный дисбиоз, должна быть сужена и включать только пограничные, трудно интерпретируемые случаи.
В порядке дискуссии хотелось бы отметить существенный потенциал теста Фемофлор-16 для анализа вагинальной микрофлоры в научных целях, который, на наш взгляд, несколько ограничен тем, что Gardnerella vaginalis — факультативный анаэроб, представитель поряд ка Bifidobacteriales класса Actinobacteria — выявляется в совокупности с Prevotella bivia и Porphyromonas spp. — облигатными анаэробными бактериями порядка Bacteroidales класса Bacteroidetes. К ограничениям подобного рода также можно отнести уже упомянутое совместное выявление бактерий рода Corynebacterium с бактериями рода Mobiluncus.
К ограничениям подобного рода также можно отнести уже упомянутое совместное выявление бактерий рода Corynebacterium с бактериями рода Mobiluncus.
Таким образом, нами разработаны критерии диагностики БВ с применением теста Фемофлор-16, предназначенного для характеристики микробиоценоза влагалища. Низкое содержание лактобацилл (< 10 % от общей бактериальной массы) в совокупности с повышенным содержанием Gardnerella vaginalis/Prevotella bivia/Porphyromonas (> 1 %), и/или Eubacterium (> 2 %), и/или Sneathia/Leptotrichia/Fusobacterium (> 0,1 %), и/или Megasphaera/Veillonella/Dialister (> 0,1 %), и/или Lachnobacterium/Clostridium (> 0,1 %), и/или Peptostreptococcus (> 0,1 %), и/или Atopobium vaginae (> 0,2 %) определяют БВ с чувствительностью 99 % и специфичностью 93 %. Данные критерии БВ и критерии, разработанные производителями теста Фемофлор-16 для категории выраженного анаэробного дисбиоза, в значительной степени описывают одну и ту же категорию микробиоценоза влагалища.
«Микробиом влагалища и вагинальные инфекции. Что важно клиницисту?». «Смешанные вагиниты. Практический подход»
«Микробиом влагалища и вагинальные инфекции. Что важно клиницисту?». «Смешанные вагиниты. Практический подход»Микробиом влагалища и вагинальные инфекции: что важно знать клиницисту?
Хамошина М.Б.
Противоинфекционный барьер
* Волосяной покров области лобка и промежности.
* Сомкнутая половая щель.
* Агрессивный уровень рН (4,0-4,5).
* Анатомическая целостность шейки матки.
* Высокая концентрация факторов местного иммунитета в цервикальной слизи.
* Ежемесячное отторжение функционального слоя эндометрия при условии отсутствия беременности.
Реалии современности
* Функциональная несостоятельность мышц влагалища, промежности и тазового дна у 75% рожавших женщин.
* Высокая сексуальная активность, практика незащищенных половых контактов, которая приводит к ощелачиванию среды влагалища (что нормально для зачатия, но, если пара не планирует беременность, это повышает риск вагинальной инфекции).
* Огромный выбор антибактериальных препаратов на фармацевтическом рынке и их бесконтрольное использование пациентками, самолечение.
* Назначение антимикробной терапии на основании лабораторных тестов, в том числе и качественных (а не количественных).
Норма
* Отсутствие жалоб и патологических белей.
* Наличие при микроскопии только лактобактерий и клеток плоского эпителия.
* Отсутствие или незначительное количество лейкоцитов.
* Кислая среда влагалища.
Свойством лактобактерий является способность к адгезии к эпителию влагалища и его колонизация, способность к лактообразованию, что возможно только при целостности эпителия и достаточном количестве гликогена. В этом случае будет сохраняться кислая среда влагалища и сдерживаться рост патогенной микрофлоры.
Гипотеза изменения иммунного ответа
Лактобациллы, присутствующие во влагалище здоровых женщин, поддерживают активацию TLR-рецепторов эпителиальных клеток на постоянном уровне, в результате чего продуцируется достаточно цитокинов для контроля за размножением патогенных микроорганизмов.
При преобладании анаэробов (пусть даже не лактобактерий), не возникает активации провоспалительного ответа, поэтому нет реализованной инфекции и речь идет о дисбиотических нарушениях.
В случае преобладания аэробных бактерий, реализуется воспалительный эффект с развитием смешанного аэробного вагинита.
Лактофлора и рН
Lactobacillus acidophilus – ферментирует сахара в молочную кислоту, тем самым контролирует болезнетворные микробы и грибки, обеспечивает оптимальный рН 4,4. Их гибель увеличивает риск инфекций.
Lactobacillus gasseri – ферментируют сахара в молочную кислоту, обеспечивают рН 4,5.
Иммунный ответ влагалища во многом зависит от способности различных видов лактобактерий к сосуществованию и активности – формированию биопленок. Оптимально низкая кислая среда, вырабатываемая лактобактериями, способствует их выживанию как вместе, так и по отдельности. Т.е. это взаимообусловленный процесс. При нарушении этого баланса, развивается дисбиотический процесс.
Оптимально низкая кислая среда, вырабатываемая лактобактериями, способствует их выживанию как вместе, так и по отдельности. Т.е. это взаимообусловленный процесс. При нарушении этого баланса, развивается дисбиотический процесс.
Алгоритм изучения биоценоза здоровых женщин
* Рн-метрия обязательно.
* Бактериоскопия влагалищных мазков (важна при любой степени чистоты влагалища).
* При уровне рН в диапазоне 4,0-4,4, количество лактобактерий составляет более 107, а КОЕ менее 105, что свидетельствует о норме. рН метрию не следует проводить: во время менструации, после полового акта или применения гигиенических и спермицидных средств.
* При щелочной среде, 3-4 степени чистоты влагалища, проводится количественное бактериологическое исследование, иммунологические тесты в динамике.
Носительство – это уже дисбиоз. Это незначительное увеличение числа УПМ и лейкоцитов, когда отсутствуют жалобы и бели, присутствует фактически только увеличение рН. И это состояние развивается очень часто у многих женщин из-за особенностей половой жизни, ношения тесной одежды, синтетического белья и т.д. Нормальная генетика лактофлоры влагалища помогает быстро восстановить этот дисбаланс, но при нарушении условий ее проживания, рН постепенно увеличивается, давая возможность размножаться патогенной микрофлоре, наиболее частая из которых – это gardnerella vaginalis (наблюдается ее рост уже при пограничных значениях рН.). Также наблюдается рост мико-уреаплазменной флоры, которая встречается в норме, но в очень небольшом количестве, поэтому ее обнаружение в очень низком титре не нуждается в лечении. Частая персистенция уреаплазмы, как правило, связана с каким-либо другим инфекционным агентом – более серьезным (ВПЧ, гепатит С и т.д.).
Структура вагинальных инфекций
* Бактериальный вагиноз (БВ) – 30-40%.
* Аэробный вагинит (АВ) – 20-30%.
* Вульвовагинальный кандидоз (ВВК) – 20-30%.
* Трихомониаз – 5-10%.
Вагиноз
БВ – это общий инфекционный невоспалительный синдром, связанный с дисбиозом влагалищного биотопа, который характеризуется чрезмерно высокой концентрацией облигатных и факультативно-анаэробных УПМ (с образованием биопленок) и резким снижением или отсутствием молочнокислых бактерий в отделяемом влагалища.
По МКБ-10
№89.9 Другие невоспалительные болезни влагалища.
БВ выделен в отдельную нозологическую форму.
Вагиноз – это типичное проявление дисбиоза с пограничным рН, отсутствием лейкоцитарной реакции, воспаления, жалоб, снижением количества лактобакетрий. И это состояние может стать основой для присоединения более агрессивной флоры с развитием вагинита.
Клинические проявления БВ
* Обильные белые или серые гомогенные выделения, часто с неприятным запахом, покрывающие всю слизистую влагалища и шейки матки, легко удаляемые тампоном.
* Усиление патологической секреции после полового акта или во время менструации.
* Зуд, повторное инфицирование кожных покровов.
* Дизурические расстройства.
* Диспареуния.
* Может протекать бессимптомно.
С нарастанием гипоэстрогении в постменопаузе принимает рецидивирующий характер или сменяется атрофическим вагинитом.
На сегодня четко выделяется эпизодический и рецидивирующий БВ. И рецидивирование всегда имеет под собой какую-либо причину: поведение женщины, неправильная гигиена, очаг хронической инфекции, изменение микробиома влагалища, дающее предпосылки для развития БВ.
Критерии БВ (Амсель)
* Характерные пленчатые выделения.
* Наличие ключевых клеток.
* Положительный аминный тест.
* рН вагинального отделяемого более 4,5.
Верификация диагноза обеспечивается наличием 3 или 4 критериев.
Микробиологические предпосылки к развитию БВ
Речь идет о состояниях, предшествующих развитию БВ, при наличии которых и дополнительных факторов риска, очень быстро развивается дисбаланс.
* Доминирование L. iners, которые обладают слабыми защитными свойствами (выявляется у 26,8% женщин). Они не способны адгезироваться и формировать биопленки с другими лактобактериями.
* Снижение доли штаммов лактобактерий, продуцирующих Н2О2.
* Наличие во влагалищном биотопе Atopobium vaginae, особенно если он существует в комбинации с G. Vaginalis. Atopobium vaginae способен выжить в кислой среде и способен формировать биопленки с другими патогенами, прежде всего с G. Vaginalis, обеспечивая им возможность также выжить в кислой среде (в 4-8 раз превышающие допустимые значения) и противостоять многим антимикробным препаратам.
Atopobium vaginae – строго анаэробный микроорганизм, чувствительный к клиндамицину.
Рецидивы БВ
Наличие биопленок – это причина рецидивов вагинальных инфекций даже после терапии метронидазолом. Также причина рецидивов – это отсутствие второго этапа лечения – заселения влагалища нормальной лактофлорой.
По данным проведенного исследования, частота рецидивов после лечения метронидазолом составляет 50-70%.
Биопленки
G. Vaginalis не способна выживать в кислой среде, а формируя пленку с Atopobium vaginae играет большую роль в развитии рецидивов. Она более патогенна, чем другие микроорганизмы, именно вследствие способности к образованию биопленок.
Обнаружение в мазке бактериальных пленок G. Vaginalis достоверно свидетельствует о наличии БВ.
Биопленки способны устоять перед действием большинства противомикробных средств в больших концентрациях и должны лечиться строго определенными препаратами (Клиндамицин в первую очередь).
При частом рецидивировании обязательно проведение ПЦР для идентификации этих микроорганизмов.
Надо ли лечить вагиноз?
Бытует мнение, что вагиноз лечить не нужно и микрофлора влагалища восстановится самостоятельно, что неверно.
* БВ встречается у 32% пациенток с трубным бесплодием.
* У 35% заболевших становится причиной сальпингита, оофорита.
* Служит кофактором развития ВПЧ.
* Способствует активации вирусной инфекции, колонизации возбудителей инфекции мочеполовых органов и ИППП.
* Способствует развитию цервикальной интраэпителиальной неоплазии.
* Является фактором высокого риска развития преждевременных родов, особенно у женщин с ПР в анамнезе.
* Увеличение риска послеродового метроэндометрита в 3 раза, внутриутробного инфицирования плода, хориамнионита.
* Обнаружение Atopobium vaginae у беременных сопряжено с более высокими перинатальными рисками и требует лечения клиндамицином, который может снизить частоту перинатальных рисков, в отличие от метронидазола, который доказано на них не влияет.
Поэтому лечение дисбиоза является целесообразным.
Вагинит
* Жалобы (зуд, дискомфорт, боли).
* Наличие патологических белей.
* Наличие при микроскопии патогенной и условнопатогенной (УП) бациллярной микрофлоры.
* Ощелачивание среды (рН более 5,0).
Выбор препарата
Важно лечить пациентку, а не анализы и в соответствии с наличием показаний для этого диагноза в инструкции (возможно дополняя ее, руководствуясь данными доказательной медицины).
Препарат должен иметь ожидаемую или доказанную эффективность в отношении предполагаемого или доказанного возбудителя (ассоциации) при вагините или анаэробов при БВ.
Препарат должен иметь минимальное влияние на микробиоту влагалища, быть доступным и минимизировать риск рецидивов.
Этапы лечения вагиноза или вагинита
1 этап – снижение количества анаэробных микроорганизмов – антимикробная терапия.
2 этап – восстановление микробиоценоза влагалища (колонизация влагалища лактобактериями, стимуляция роста собственных лактобактерий, восстановление и поддержание адекватной рН влагалищного секрета).
Эффективность такой этапности лечения подтверждена различными исследованиями. Результаты отечественных исследований БИОС 1 и 2 свидетельствуют о том, что 80% пациенток после противоинфекционной терапии нуждаются в восстановлении биоценоза и имеют высокий риск рецидива, особенно при наличии биопленки из патогенов до начала лечения. А применение препаратов, содержащих лактобактерии, напротив, повышает эффективность терапии до 91% и снижает частоту рецидивов в 2,3 раза.
Принципы коррекции нарушений биоценоза влагалища у женщин репродуктивного возраста (вагиноз)
* Верификация диагноза (наличие 3 или 4 критериев Амселя).
* Препараты с антианаэробным действием в соответствии с существующими рекомендациями (препарат выбора – клиндамицин (крем) местно или внутрь, также возможно применение метронидазола и орнидазола)
* Нормализация и поддержание нормальной рН среды влагалища.
* Восстановление концентрации лактобактерий не менее 107 КОЕ\мл.
Лечение рецидивов БВ также должно быть основано на использовании препаратов с доказанной эффективностью в отношении Atopobium vaginae, а это клиндамицин (Далацин) с дальнейшим восстановлением эубиоза и коррекцией возможного эстрогендефицита. Два отечественных исследования показали, что использование клиндамицина и аскорбиновой кислоты в лечении рецидивирующего БВ, снижает риск рецидивов более, чем в 3 раза.
Принципы коррекции нарушений биоценоза влагалища у женщин репродуктивного возраста (вагинит)
* Верификация диагноза (микробиологическое исследование).
* Антимикробные препараты с учетом чувствительности возбудителя или ассоциации микробов до устранения клинических и лабораторных проявлений воспаления.
* Нормализация и поддержание нормальной рН среды влагалища (аскорбиновая или молочная кислота интравагинально, молочная кислота + гликоген).
* Восстановление концентрации лактобактерий не менее 107 КОЕ\мл.
Основные принципы коррекции нарушений биоценоза влагалища, когда не исключена беременность раннего срока
* Верификация диагноза (микробиологическое исследование).
* Антимикробные препараты по показаниям (хлоргексидин, деквалиния хлорид, повидон-йодид интравагинально). Со 2-3 триместра при необходимости могут быть добавлены комбинированные препараты или клиндамицин местно.
* Нормализация и поддержание нормальной рН среды влагалища (аскорбиновая или молочная кислота интравагинально, молочная кислота + гликоген).
* Восстановление концентрации лактобактерий не менее 107 КОЕ\мл (аскорбиновая или молочная кислота интравагинально, молочная кислота + гликоген, препараты содержащие ацидофильные лактобактерии интравагинально или внутрь).
Постоянство кислой среды влагалища и адекватной эстрогенной насыщенности – это обязательное условие качественной прегравидарной подготовки.
Вопросы
Дозы флуомизина при БВ?
Определены инструкцией – по 1 вагинальной таб. 6 дней.
Следует ли лечить уреаплазму?
Нет, лечить нужно заболевание, если оно ассоциировано с уреаплазмой – вагиноз или вагинит.
Можно ли ставить диагноз «цитолитический вагиноз»?
Существует диагноз «цитолитический вагинит». Шифруется как и БВ по МКБ-10. Требует ощелачивания влагалищной среды и использования соответствующих лекарственных средств (Актифер).
Количественная норма лейкоцитов в цервикальном канале?
На сегодня 20-40, но этот вопрос сегодня пока является спорным.
Ваше отношение в эпиген-спрею?
Может использоваться по соответствующим показаниям у конкретных женщин. При БВ не является специфическим препаратом.
Можно ли использовать тантум розе для лечения БВ?
Если в инструкции к этому препарату, среди показаний указан БВ, его можно применять.
Смешанные вагиниты. Практический подход к тактике веденияШестакова И.Г.
Самая частая причина обращений к гинекологу – это вагинальные выделения, которые могут быть симптомом различной патологии. При этом эффективные диагностика и лечение выделений могут снизить последствия урогенитальных инфекций и БВ (преждевременные роды, постабортный эндометрит).
Жалобы на вагинальные выделения
* У 62% пациенток жалобы в течение более чем одного года. Это связано с частыми рецидивами и неадекватно подобранной терапией.
* У 18% женщин выставлено 2 и более диагноза.
При этом наиболее распространенные диагнозы при хронических вагинальных выделениях были следующими: рецидивирующий кандидозный вульвовагинит, вульвит и БВ – самые частые; а также контактный дерматит, атрофический вагинит, простой лишай вульвы или склерозирующий лишай, физиологические бели, десквамативный воспалительный вагинит.
Чтобы выставить правильный диагноз, нужно уметь правильно набирать мазки (микроскопия мазка – это стандарт во всем мире), читать микроскопию и ПЦР.
Правила взятия мазков
* Выделения: микроскопия ПЦР Trichomonas vaginalis – верхнебоковой свод влагалища. При заборе из других участков – вероятнее всего не будет получен достоверный результат.
* Клетки для определения ДНК возбудителей ИППП (ПЦР) забираются из эндоцервикса.
Вагинальный эпителий
Для нормального состояния покровного эпителия влагалища важна нормальная функция яичников – достаточные уровни эстрогена и прогестерона. В этом случае инфекций не бывает или встречаются они крайне редко. Это доказывает тот факт, что рецидивы БВ часто встречаются при хронической ановуляции и ожирении.
рН вагинальных выделений – это показатель вагинального здоровья, и рН выше нормы – это свидетельство не только БВ, но и атрофии. И если кроме высокого рН не отмечается обильных белей, отсутствуют ключевые клетки и т.д., начинать лечение следует с восстановления эпителия.
Частота встречаемости ВВК и БВ
ВВК
* Один острый эпизод – до 75% женщин.
* Рецидивирующий – у 10-15% (у беременных 30-35%).
БВ
* 1 эпизод хоть раз в жизни: в различных популяциях женщин – 16-65%.
* У 50% женщин какие-либо симптомы отсутствуют.
* У беременных 15-37%.
* При патологических белях – до 87%.
Отечественные данные: БВ и ВВК в общей популяции 15-50% и 16-30% соответственно; БВ и ВВК у беременных 10-40% и 30-40% соответственно. Частота смешанных вагинитов – 30%.
В лечении патологических белей следует опираться на федеральные клинические рекомендации «Диагностика и лечение заболеваний, сопровождающихся патологическими выделениями из половых путей женщин».
ВВК
Это инфекционное поражение вульвы и влагалища (не кольпит!), вызываемое дрожжеподобными грибами Candida.
Диагноз обязательно должен подтверждаться микроскопией и посевом (особенно при рецидивах), по которым можно заключить, что это не смешанный процесс, а изолированный ВВК.
Частота выделения candida albicans при ВВК достигает 60-90%.
Терапия неосложненного ВВК
Это пациентки без нарушения иммунной системы, с нормальной функцией кишечника и без сахарного диабета.
Эффективность терапии 80-90%, уровень доказательности А.
* Местные антимикотики: миконазол, изоконазол, клотримазол, натамицин и т.д. 10-14 дней.
* Системные средства: Флуканазол (Дифлюкан) 150 мг однократно или итраконазол 200 мг 2 р в сутки – 1 день.
И местные и системные средства одинаково эффективны, и выбор зависит от предпочтений пациентки.
Рецидивирующий ВВК
* Критерий: 4 и более симптомных эпизодов ВВК в год, вызванного Candida spp, чувствительными к азоловым антимикотикам.
2 этапа лечения
1. Купировать симптомы обострения и добиться микологической эрадикации.
Это флуканазол (Дифлюкан) 150 мг – 3 таб. с интервалом в 72 часа (АI) или 10-14 дней топические препараты (BII).
2. Продолжить курс терапии, предотвращающий избыточный рост Candida с целью профилактики рецидивов ВВК в течение 6 месяцев.
Поддерживающая супрессивная терапия – это флуканазол (Дифлюкан) 150 мг по 1 таб. в неделю в течение 6 месяцев (AI) (1 упаковка – 12 таблеток, на курс 2 упаковки).
Контроль излеченности ВВК и наблюдение
* При исчезновении клинических симптомов заболевания, проведение микроскопического или бактериологического исследования не требуется.
* Инфекция считается излеченной, если у пациентки отсутствуют клинические проявления.
* У пациенток с РВВК гинекологический осмотр через 1 месяц после окончания лечения.
* В случае неосложненного ВВК и РВВК, резистентных к стандартной терапии, обязательная видовая идентификация, определение чувствительности к антифунгальным препаратам, исключение сопутствующих состояний.
Бактериальный вагиноз
Упоминания этого заболевания стали появляться только с началом использования различных гигиенических средств, ношения тесной одежды, синтетического белья.
БВ – это полимикробное невоспалительное заболевание (отсутствует лейкоцитарная инфильтрация). Происходит замещение протективных лактобактерий различными строгими анаэробными микроорганизмами и не существует конкретного возбудителя БВ.
Код по МКБ-10 — №89 Другие невоспалительные заболевания влагалища.
Факторы риска, ассоциированные с БВ
* Частая смена половых партнеров.
* Перенесенные ИППП.
* Частые влагалищные души и спринцевания.
* Ятрогенные факторы: антибиотикотерапия, использование ВМС, спермимицидов и вагинальных колец.
Осложнения БВ
В гинекологии
* Инфекционные осложнения после гистерэктомии и абортов.
* Неоплазия шейки матки.
* Эндометрит и параметрит после ГСГ, биопсии эндометрия, введения ВМС, РДВ.
В акушерстве
* Внутриамниотическая инфекция.
* Преждевременное излитие вод.
* Преждевременные роды.
* Самопроизвольные аборты с 13 по 24 неделю гестации.
* Рождение маловесных детей.
* Эндометрит и сепсис после кесарева сечения.
БВ ассоциирован с повышенной восприимчивостью к ЗППП, особенно ВИЧ и генитальному герпесу!
Критерии диагноза БВ
Стандартной диагностикой БВ является сочетание трех из четырех признаков (критерии Амселя).
Показания к лечению БВ
1. Женщины с симптомами БВ при наличии лабораторно подтвержденного диагноза.
2. Женщины без симптомов в следующих случаях.
* Риск невынашивания беременности (анамнез ПР либо поздних выкидышей).
* Перед введением ВМС.
* Перед оперативным вмешательством на органах малого таза, в том числе медицинским абортом.
* Беременные, имеющие в анамнезе ПР или поздние выкидыши с положительным результатом микроскопии, независимо от наличия симптомов.
3. Лечение не показано мужчинам – половым партнерам женщин с БВ в отсутствии симптомов.
Лечение БВ
Проводится 2-х этапный курс лечения БВ, где 2-ой этап предусматривает вагинальное применение пробиотиков, содержащих не менее 106-7 живых лактобактерий. Целесообразность и эффективность такой терапии доказана.
Рекомендуемые схемы лечения БВ у небеременных женщин
* Клиндамицин крем 2%. Один аппликатор (5 г) интравагинально 1 раз в сутки (на ночь), 7 дней.
* Метронидазол 500 мг внутрь 2 раза в сутки, 7 дней. Необходимо избегать приема даже минимальных количеств алкоголя!
* Метронидазол гель 0,75%. Один аппликатор (5г) интравагинально 1 раз в сутки, 5 дней.
Альтернативные схемы лечения БВ у небеременных женщин
* Клиндамицин супп. ваг. 100 мг интравагинально 1 р в сутки на ночь, 3 дня.
* Клиндамицин 300 мг внутрь 1 р в сутки, 7 дней.
* Тинидазол 2 г внутрь 1 раз в сутки, 3 дня.
* Тинидазол 1 г внутрь 1 раз в сутки, 5 дней.
Высокоспецифичный маркер БВ – atopobium vaginae
С этим микробом связано развитие устойчивости, прежде всего к метронидазолу.
Клиническое излечение БВ, ассоциированного с a. vaginae (результаты исследования)
* При использовании клиндамицина 2% крема по 5 мг интравагинально в течение 6 дней – 83,3%.
* При использовании метронидазола 0,75% гель по 5 мг интравагинально в течение 5 дней – всего 33,3%.
Типы биоценоза влагалища
Нормоценоз – доминирование лактобактерий, отсутствие Гр- флоры, спор, псевдомицелия, лейкоцитов, единичные «чистые» эпителиальные клетки. Это нормальный биотоп влагалища.
Промежуточный тип – умеренное или сниженное количество лактобактерий, единичные Гр- и Гр+ бактерии, обнаруживаются лейкоциты, эпителиальные клетки. Часто наблюдается у здоровых женщин и является причиной их беспокойства. Однако, промежуточный тип может перейти и в нормоценоз и в дисбиоз, поэтому лечить в такой ситуации нужно только при повышении рН, его нормальные или пограничные значения, лечения не требуют. Также в этих ситуациях не нужны ПЦР на УПМ, поскольку они обнаруживаются у 70% здоровых женщин и не требуют лечения. У таких пациенток целесообразно предложить применение пробиотиков.
Дисбиоз – Незначительное количество или отсутствие лактобактерий, обильная Гр- и Гр+ анаэробная флора, наличие лейкоцитов, «ключевых» клеток. Бактериальный вагиноз.
Вагинит – большое количество лейкоцитов, эпителиальных клеток, при обнаружении трихомонад, псевдомицелия и т.д. Это трихомониаз, кандидоз и т.д.
Показания для использования пробиотиков
* Профилактика рецидивов БВ и неспецифических вагинитов.
* Профилактика у пациенток из группы высокого риска.
* При системной а\б терапии.
* Лечение вагинального дискомфорта.
Оценка влагалищного мазка при отсутствии жалоб – когда?
* Беременность.
* Кольпоскопия.
* Введение ВМК.
* Взятие цитологических мазков.
* Плановые инвазивные лечебные и диагностические процедуры.
* Хирургические вмешательства.
В этих ситуациях лечение женщин с промежуточным типом биоценоза влагалища проводится по стандартам лечения БВ.
Смешанный вагинит
* Менее 5% всех вагинитов.
* У 20-30% женщин с БВ выявляется ВВК.
* У 60-80% женщин с трихомонадным кольпитом выявляется БВ.
Терапия сочетанной инфекции (ВВК+БВ)
Клиндамицин (Далацин) по 1 свече интравагинально 3 дня + Дифлюкан 1 капсула (150 мг) однократно внутрь.
Сложные пациентки
Встречаются пациентки с длительными обильными выделениями и зудом, использование общепринятых схем у которых неэффективно. При этом микроскопия указывает на воспалительный процесс, но отсутствие дисбиоза. Посев также выявляет УМП в допустимых значениях. Но, известно, что микроскопия позволяет идентифицировать только 10 морфотипов и многие этиологически значимые облигатные и УП возбудители выявить невозможно. У этих женщин целесообразно проведение анализа Фемофлор. Это количественное обнаружение клинически значимых трудно- и некультивируемых УПМ – Гр+ бактерий. Такая мера позволяет выделить возбудитель и подобрать эффективную терапию.
Редкие причины вагинита
Вульвовагинит, вызванный Streptococcus А.
Характеризуется острым началом, гнойными выделениями, зудом, раздражением, эритемой и дизурией (клиническая картина похожа на трихомониаз).
В мазке по Грамму: Гр+ кокки в цепочках.
Встречается у девочек в препубертате или у матерей, чьи дети болеют инфекциями, вызванными Streptococcus А (носоглотка, кожа), при дефиците эстрогенов и при неправильной или недостаточной гигиене.
Лечение: крем с клиндамицином 2% вагинально в течение 7-10 дней.
Принципы ведения пациенток с вагинальными выделениями или дискомфортом, когда кандидозный вагинит, БВ и трихомониаз были исключены
* Избегать эмпирической терапии вслепую.
* При слабовыраженных симптомах, когда обследование не дает результата, повтор обследования при усилении симптомов.
* Оценить длительность симптомов, их локализацию (вульва или влагалище) и не было ли смены полового партнера.
* Оценить рН вагинальных выделений.
* При повышенном рН исключить инфекционные причины (атрофию, атрофический вагинит, крауроз вульвы, десквамативный воспалительный вагинит и аллергию).
* При нормальном рН флора влагалища в норме и важно исключить наружные причины симптомов (контактный дерматит, себорейный или экзематозный дерматит и псориаз).
* Вагинит, вызванный Streptococcus А с нормальной или несколько повышенной рН – редкое заболевание.
Десквамативный воспалительный вагинит
Критерий – один из симптомов
* Выделения из влагалища, диспареуния, зуд, жжение, раздражение.
* Воспаление во влагалище: пятнистые кровоизлияния, эритема, фокальные или линейные эрозии.
* рН больше 4,5.
* Микроскопия мазка: повышенное количество парабазальных клеток и лейкоцитов.
Все причины вагинита и вагиноза должны быть исключены. Трихомониаз необходимо исключить методом ПЦР.
Лечение обсуждается. Может предлагаться крем Далацин или мази с глюкокортикоидами, поскольку это своего рода иммунная агрессия.
Цитолитический кольпит (вагиноз)
* Зуд, диспареуния, усиление симптомов в лютеиновую фазу цикла.
* Белые обильные выделения.
* Повышенная кислотность влагалища – рН 3,-4,5.
* Микроскопия мазка по Грамму: много лактобактерий, цитолиз (голые ядра).
* Посев: избыточный рост лактобактерий.
Лечение: р-р соды (1 ч.л. на 600 мл воды) для орошения влагалища 1 раз в день в течение 7-14 дней.
Заключение: смешанные вагиниты (промежуточные мазки)
* Важно тщательно диагностировать заболевание, не забывая про редкие состояния.
* Не допускать эмпирического лечения и самолечения антимикробными препаратами.
* Профилактировать рецидивы (гигиена, поддержание кислой среды).
Вопросы
Следует ли лечить партнера женщины с РВВК?
Нет. В клинических рекомендациях это четко прописано. Лечение у мужчины проводится только при наличии заболевания, спровоцированного кандидой.
Тактика ведения при жалобах на вагинальный дискомфорт, если абсолютный нормоценоз по Фемофлор, при осмотре в зеркалах без изменений.
Необходимо выставить диагноз. Эти симптомы могут быть результатом таких заболеваний как: зуд вульвы и вульводиния, лечится назначением трициклических антидепрессантов, мазей с глюкокортикоидами.
Норма лейкоцитов в цервикальном канале?
Нормы не существует, вплоть до 100. При оценке мазка мы не ориентируемся на лейкоциты, они лишь помогают поставить диагноз. Если нет возбудителя, а флора в норме, повышенное количество лейкоцитов может быть ее уникальной лейкоцитарной реакцией (ответ на спермицид, презерватив и т.д.) и лечения не требует.
Если в мазке обнаружен лептотрикс, следует ли исключать трихомониаз (который сегодня встречается редко) или сразу назначить фунгицидные препараты?
При нормоценозе или даже промежуточном мазке, лептотрикс не нуждается в лечении, поскольку является УПМ. Трихомониаз можно исключить только при ПЦР или микроскопии нативного мазка.
Пациентки с жалобами на «молочницу», принявшие антимикотический местный препарат + метронидазол накануне (при осмотре скудные белые выделения). Как вести, когда приглашать на повторный прием для взятия мазка или сразу назначать пробитики?
Необходимо взять анализ на ИППП + оценить рН, если свеча была использована некоторое время назад, и пригласить пациентку на повторный осмотр с микроскопией через неделю. Возможно, принятое ею лечение оказало свое действие. Пробиотики сразу не нужны, в ряде случаев при ВВК они могут усилить симптоматику.
Допустимо ли применение комбинированных препаратов (например, Нео-Пенотран) при смешанных вагинитах?
Да, возможно. Общепринятых схем не существует и выбирать можно любой комбинированный препарат с учетом доминирующих симптомов и того какую флору необходимо перекрыть.
Необходимо ли применение системных антимикотиков у детей для профилактики кандидоза при лечении антибиотиками?
Нет, системные антимикотики используются только у детей с ВИЧ и пациентов онкогематологии.
В последнее время часто встречается развитие кандидоза на фоне второго этапа лечения БВ у женщин в постменопаузе Гинофлором Э. Следует ли в таком случае проводить профилактику Дифлюканом?
Если такое часто встречается в практике, можно проводить профилактику или уже назначать лечение после появления кандидоза. Но, чтобы избежать таких ситуаций, лучше назначать эстриол во время лечения БВ, а не вторым этапом.
Как назначать антимикотики для профилактики кандидоза на фоне антибиотиков – сразу или вторым этапом?
Сразу одновременно с антибиотиками.
Как объяснить женщине происхождение у нее во влагалище УПМ?
Как только девочка рождается (особенно через естественные родовые пути), она получает всю материнскую микрофлору. Все слизистые человека заселены нормальной и УП микрофлорой и это норма. Порекомендовать прочитать научно-популярную литературу.
Используете ли Вы в своей практике бактериофаги?
Нет, потому что отсутствует доказательная база и нет личного опыта. Если есть положительный опыт использования, их можно назначать.
В инструкции к клиндамицину в противопоказаниях указана беременность и лактация. Как быть?
При беременности используется метронидазол. При ГВ используются те же схемы, что и при беременности.
Можно ли использовать Лактацид Фемина для постоянной гигиены?
Если для женщины это комфортно, она применяет его по инструкции и не более 2-х раз в день, то можно.
У женщин в постменопаузе часто встречаются выраженные атрофические вагиниты, трудно поддающиеся лечению. Как правильно и эффективно лечить таких женщин?
Лечение начинается с эстриола. Пока не восстановится нормальный эпителий влагалища, использование пробиотиков является бесполезным. Если на фоне эстриола уходят все симптомы, мазок – норма, то женщина продолжает принимать эстриол пожизненно, в дополнительном лечении не нуждается. Если на фоне восстановившегося эпителия и нормальной рН остаются признаки БВ или ВВК, их лечение проводится по стандартной схеме.
Жалобы отсутствуют, анализы на инфекции отрицательные, но при получении результатов цитологии – признаки хронического эндоцервицита. Дальнейшая тактика?
Лечить не нужно. В цитологии самое главное обратить внимание на наличие атипичных клеток. Если это 1 тип мазка, атипических клеток нет, пациентка в лечении не нуждается и проходит скрининг по общепринятой схеме.
Необходимо ли добиваться полной эрадикации уреаплазмы, если пациентка готовится к ЭКО?
Полной эрадикации уреаплазмы добиться невозможно – это часть нормальной микрофлоры. На ЭКО женщина должна идти без ИППП, с нормальным мазком и рН без лейкоцитарной инфильтрации.
Как технически правильно провести рНметрию?
Если полоски с острыми краями, то опускать их следует в выделения, которые остались на ложке зеркала при осмотре (избегая попадания цервикальной слизи – она щелочная). Полоски с закругленным концом можно вводить во влагалище.
Как поставить диагноз при отсутствии ПЦР и Фемофлор?
ПЦР входит в стандарты и должна быть проведена. При невозможности, используется микроскопия нативного мазка, которая позволит диагностировать трихомониаз и гонорею.
42 года рецидивирующий ВВК, онкоцитология – атрофия. Менструации регулярные, вегетативных нарушений нет. Проведена супрессивная терапия РВВК успешно. Что делать с атрофией?
Если она предъявляет жалобы на сухость влагалища (использует лубриканты) вероятнее всего есть возрастные изменения и можно использовать эстриол. Также следует уточнить частоту гигиенических процедур – она может просто вымывать все выделения и пересушивать слизистую.
Пациентка обследуется по поводу бесплодия и невынашивания, предстоит биопсия эндометрия и другие малоинвазивные процедуры. ПЦР – отрицательно, лейкоциты – 30-40, флора смешанная. Как быть?
Возможно проведение Фемофлора, но если нет такой возможности, проводится лечение смешанного кольпита. Препаратов существует множество. Тот же клиндамицин в этой ситуации будет эффективным.
До какого возраста можно использовать эстриол. Можно ли назначить, например, пациентке 85 лет?
Эстриол можно принимать пожизненно – и в 85 и 95 лет.
Если не нужно лечить только лейкоциты при отсутствии воспаления, и у беременных в частности, как это объяснить страховым компаниям? Они ссылаются на нормы у беременных – до 15-20.
Ссылаться на мировые данные, указывать нормальный рН влагалища, посев с ростом только лактобактерий. Если конфликты со страховыми компаниями возникают, можно использовать подкисление влагалища, пробиотики и спринцевания тантум розе именно для устранения лейкоцитов. Но, возможно, необходимо проведение консилиума, после которого вопросов у страховой компании не будет.
Эстрогенный тип мазка по цитологии у женщины в постменопаузе. Как поступить при отсутствии жалоб?
Эстрогенный тип мазка – это по сути норма, которая в постменопаузе встречается редко. Лечения не требует, поскольку говорит о еще какой-то активности яичников или избыточном весе пациентке, в жировой ткани которой происходит синтез эстрогенов.
Почему в дерматовенерологии существует диагноз «цервицит, вызванный уреаплазмой уреалитикум, парвум и микоплазмой хоминис»?
Цервицит может быть вызван ассоциацией этих микробов и он вторичный на фоне БВ, который и лечим в данной ситуации. Отдельно какой-либо из этих микроорганизмов лечить не нужно.
Можно ли назначать эстриол местно женщинам, перенесшим операцию по поводу рака молочной железы?
Официально нельзя, у нас это запрещено. Но сейчас проводятся пилотные исследования в Италии. Таким женщинам назначаются негормональные лубриканты.
(PDF) Features of the vaginal microbiota and ways of correction of its disorders in case of full-term pregnancy
42 МЕДИЦИНСКИЙ СОВЕТ
Клиническое наблюдение
2020;(3):38–43
7. Antonio M.A. , Hawes S.E., Hillier S.L. The identification of vaginal
Lactobacillus species and the demographic and microbiologic characteris-
tics of women colonized by these species. J Infect Dis. 1999;180(6):1950–
1956. doi: 10.1086/315109.
8. Hillier S.L. The vaginal microbial ecosystem and resistance to HIV. AIDS
Res Hum Retroviruses. 1998;14(Suppl 1):17–21. Available at: https://www.
ncbi.nlm.nih.gov/pubmed/9581879.
9. Hill J.E., Goh S.H., Money D.M. et al. Characterization of vaginal microflora
of healthy, nonpregnant women by chaperonin-60 sequence-based meth-
ods. American Journal of Obstetrics and Gynecology. 2005;193(3):682–692.
doi: 10.1016/j.ajog.2005.02.094.
10. Hyman R.W., Fukushima M., Diamond L., Kumm J., Giudice L.C., Davis R.W.
Microbes on the human vaginal epithelium. Proc Natl Acad Sci U S A.
2005;102(22):7952–7957. doi: 10.1073/pnas.0503236102.
11. Reid G., Bruce A.W., Fraser N., Heinemann C., Owen J. , Henning B. Oral pro-
biotics can resolve urogenital infections. FEMS Immunol Med Microbiol.
2001;30(1):49–52. doi: 10.1111/j.1574-695X.2001.tb01549.x.
12. Wilks M., Tabaqchali S. Quantitative bacteriology of the vaginal flora dur-
ing the menstrual cycle. Journal of Medical Microbiology. 1987;24(3):241–
245. doi: 10.1099/00222615-24-3-241.
13. Burton J.P., Cadieux P.A., Reid G. Improved understanding of the bacterial
vaginal microbiota of women before and after probiotic instillation.
Applied and Environmental Microbiology. 2003;69(1):97–101. doi: 10.1128/
aem.69.1.97-101.2003.
14. Goplerud C.P., Ohm M.J., Galask R.P. Aerobic and anaerobic flora of the cer-
vix during pregnancy and puerperium. Am J Obstet Gynecol.
1976;126(7):858–868. doi: 10.1016/0002-9378(76)90674-8.
15. Tärnberg M., Jakobsson T., Jonasson J., Forsum U. Identification of randomly
selected colonies of lactobacilli from normal vaginal fluid by pyrose-
quencing of the 16S rDNA variable V1 and V3 regions. APMIS.
2002;110(11):802–810. doi: 10.1034/j.1600-0463.2002.1101106.x.
16. Verhelst R., Verstraelen H., Claeys G. et al. Cloning of 16S rRNA genes
amplified from normal and disturbed vaginal microflora suggests a
strong association between Atopobium vaginae, Gardnerella vaginalis
and bacterial vaginosis. BMC Microbiology. 2004;4:16. doi: 10.1186/1471-
2180-4-16.
17. Rogosa M., Sharpe M.E. Species differentiation of human vaginal lactoba-
cilli. Journal of General Microbiology. 1960;23(1):197–201. doi:
10.1099/00221287-23-1-197.
18. Marco J., Coolen M.J.L., Post E., Davis C.C., Forney L.J. Characterization of
microbial communities found in the human vagina by analysis of terminal
restriction fragment length polymorphisms of 16S rRNA genes. Applied
and Environmental Microbiology. 2005;71(12):8729–8737. doi: 10.1128/
AEM.71.12.8729-8737.2005.
19. Reid G., McGroarty J.A., Tomeczek L., Bruce A.W. Identification and plasmid pro-
files of Lactobacillus species from the vagina of 100 healthy women. FEMS
Immunol Med Microbiol. 1996;15(1):23–26. doi: 10.1111/j.1574-695X.1996.
tb00354.x.
20. Eschenbach D.A., Thwin S.S., Patton D.L. et al. Influence of the normal
menstrual cycle on vaginal tissue, discharge, and microflora. Clinical
Infectious Diseases. 2000;30(6):901–907. doi: 10.1086/313818.
21. Redondo-Lopez V., Cook R.L., Sobel J.D. Emerging role of lactobacilli in
the control and maintenance of the vaginal bacterial microflora. Reviews
of Infectious Diseases. 1990;12(5):856–872. doi: 10.1093/clinids/12.5.856.
22. Стрижаков А.Н., Давыдов А.И., Баев О.Р., Буданов П.В. Генитальные
инфекции. М.: Династия; 2003. 134 с. Режим доступа: https://search.rsl.ru/
ru/record/01002430403.
23. Levison M.E., Corman L.C., Carrington E.R., Kaye D. Quantitative microflora
of the vagina. American Journal of Obstetrics and Gynecology.
1977;127(1):80–85. doi: 10.1016/0002-9378(77)90318-0.
24. Reid G., Charbonneau D., Erb J., Kochanowski B., Beuerman D., Poehner R.,
Bruce A.W. Oral use of Lactobacillus rhamnosus GR-1 and Reuteri RC-14
significantly alters vaginal flora: randomized, placebo-controlled trial in
healthy women. FEMS Immunol Med Microbiol. 2003;35(2):131–134. doi:
10.1016/S0928-8244(02)00465-0.
25. Кира Е.Ф. Бактериальный вагиноз. СПб.: Нева-Люкс; 2001. 364 с.
26. Мартикайнен З.М., Деркач О.И., Головачева С.Н., Зациорская С.Л. и соавт.
Формирование вагинального микробиоценоза в послеродовом перио-
де при использовании различных эубиотических препаратов. Журнал
акушерства и женских болезней. 2001;(2):58–61. Режим доступа: http://
www.fesmu.ru/elib/Article.aspx?id=61710.
27. McDonald H.M., O’Loughlin J.A., Jolley P.T., Vigneswaran R., McDonald P.J.
Changes in vaginal flora during pregnancy and association with preterm
birth. J Infect Dis. 1994;170(3):724–728. doi: 10.1093/infdis/170.3.724.
28. Казесалу Р.Х. Об анаэробной микрофлоре влагалища беременных в I и
II триместрах беременности. Антибиотики и колонизационная
резистентность. 1990;(9):47–53.
29. Marrazzo J.M., Koutsky L.A., Eschenbach D.A., Agnew K., Stine K., Hillier S.L.
Characterization of vaginal flora and bacterial vaginosis in women who
have sex with women. Journal of Infectious Diseases. 2002;185(9):1307–
1313. doi: 10.1086/339884.
30. Yamamoto T., Zhou X., Williams C.J., Hochwalt A., Forney L.J. Bacterial pop-
ulations in the vaginas of healthy adolescent women. J Pediatr Adolesc
Gynecol. 2009;22(1):11–18. doi: 10.1016/j.jpag.2008.01.073.
1. Ankirskaya A.S., Prilepskaya V.N., Bayramova G.R., Murav’yeva V.V. Bacterial
vaginosis: features of the clinical course, diagnosis and treatment. RMZh =
RMJ. 1998;(5):276–282. (In Russ.) Available at: https://www.rmj.ru/articles/
ginekologiya/BAKTERIALYNYY_VAGINOZ_OSOBENNOSTI_
KLINIChESKOGO_TEChENIYa_DIAGNOSTIKA_I_LEChENIE.
2. Sidorova I.S. Microbiocenosis of reproductive tract of women of reproduc-
tive age. Akusherstvo i Ginekologiya = Obstetrics and Gynecology.
2005;(2):7–9. (In Russ.) Available at: http://www.fesmu.ru/elib/Article.
aspx?id=123624.
3. Zhou X., Bent S.J., Schneider M.G., Davis C.C., Islam M.R., Forney L.J.
Characterization of vaginal microbial communities in adult healthy
women using cultivation-independent methods. Microbiology.
2004;150(8):2565–2573. doi: 10.1099/mic.0.26905-0.
4. Bartlett J.G., Polk B.F. Bacterial Flora of the Vagina: Quantitative Study.
Reviews of Infectious Diseases.1984;6(Suppl. 1):567–572. doi: 10.1093/clin-
ids/6.Supplement_1.S67.
5. Larsen B., Monif G.R. Understanding the bacterial flora of the female genital
tract. Clinical Infectious Diseases. 2001;32(4):69–77. doi: 10.1086/318710.
6. Kudryavtseva L.V., Il’ina E.N., Govorun V.M., Minayev V.I., Zaytseva S.V.,
Lipova E.V., Batkayev E.A. Bacterial vaginosis: manual for doctors. M.: Litekh;
2003. 56 p. (In Russ.)
7. Antonio M.A. , Hawes S.E., Hillier S.L. The identification of vaginal
Lactobacillus species and the demographic and microbiologic characteris-
tics of women colonized by these species. J Infect Dis. 1999;180(6):1950–
1956. doi: 10.1086/315109.
8. Hillier S.L. The vaginal microbial ecosystem and resistance to HIV. AIDS
Res Hum Retroviruses. 1998;14(Suppl 1):S17-S21. Available at: https://www.
ncbi.nlm.nih.gov/pubmed/9581879.
9. Hill J.E., Goh S.H., Money D.M. et al. Characterization of vaginal microflora
of healthy, nonpregnant women by chaperonin-60 sequence-based meth-
ods. American Journal of Obstetrics and Gynecology. 2005;193(3):682–692.
doi: 10.1016/j.ajog.2005.02.094.
10. Hyman R.W., Fukushima M., Diamond L., Kumm J., Giudice L.C., Davis R.W.
Microbes on the human vaginal epithelium. Proc Natl Acad Sci U S A.
2005;102(22):7952–7957. doi: 10.1073/pnas.0503236102.
11. Reid G., Bruce A.W., Fraser N., Heinemann C., Owen J. , Henning B. Oral pro-
biotics can resolve urogenital infections. FEMS Immunol Med Microbiol.
2001;30(1):49–52. doi: 10.1111/j.1574-695X.2001.tb01549.x.
12. Wilks M., Tabaqchali S. Quantitative bacteriology of the vaginal flora dur-
ing the menstrual cycle. Journal of Medical Microbiology. 1987;24(3):241–
245. doi: 10.1099/00222615-24-3-241.
13. Burton J.P., Cadieux P.A., Reid G. Improved understanding of the bacterial
vaginal microbiota of women before and after probiotic instillation.
Applied and Environmental Microbiology. 2003;69(1):97–101. doi: 10.1128/
aem.69.1.97-101.2003.
14. Goplerud C.P., Ohm M.J., Galask R.P. Aerobic and anaerobic flora of the cer-
vix during pregnancy and puerperium. Am J Obstet Gynecol.
1976;126(7):858–868. doi: 10.1016/0002-9378(76)90674-8.
15. Tärnberg M., Jakobsson T., Jonasson J., Forsum U. Identification of randomly
selected colonies of lactobacilli from normal vaginal fluid by pyrose-
quencing of the 16S rDNA variable V1 and V3 regions. APMIS.
2002;110(11):802–810. doi: 10.1034/j.1600-0463.2002.1101106.x.
16. Verhelst R., Verstraelen H., Claeys G. et al. Cloning of 16S rRNA genes
amplified from normal and disturbed vaginal microflora suggests a
strong association between Atopobium vaginae, Gardnerella vaginalis
and bacterial vaginosis. BMC Microbiology. 2004;4:16. doi: 10.1186/1471-
2180-4-16.
17. Rogosa M., Sharpe M.E. Species differentiation of human vaginal lactoba-
cilli. Journal of General Microbiology. 1960;23(1):197–201. doi:
10.1099/00221287-23-1-197.
References
Нормальная микрофлора влагалища. Нормоценоз влагалища. Клипарты, векторы, и Набор Иллюстраций Без Оплаты Отчислений. Image 90878477.
Нормальная микрофлора влагалища. Нормоценоз влагалища. Клипарты, векторы, и Набор Иллюстраций Без Оплаты Отчислений. Изображение 90878477.Нормальная микрофлора влагалища.Нормоценоз влагалища. Соотношение лактобактерий, бифидобактерий и условно-патогенных бактерий. Инфографика. Векторная иллюстрация на изолированном фоне.
M L XL EPSТаблица размеров
| Размер изображения | Идеально подходит для |
| Ю | Интернет и блоги, социальные сети и мобильные приложения. |
| м | Брошюры и каталоги, журналы и открытки. |
| л | Плакаты и баннеры для дома и улицы. |
| XL | Фоны, рекламные щиты и цифровые экраны. |
Используете это изображение на предмете перепродажи или шаблоне?
Распечатать Электронный Всесторонний
5000 x 4920 пикселей | 42.3 см x 41,7 см | 300 точек на дюйм | JPG
Масштабирование до любого размера • EPS
5000 x 4920 пикселей | 42,3 см x 41,7 см | 300 точек на дюйм | JPG
Скачать
Купить одно изображение
6 кредитов
Самая низкая цена
с планом подписки
- Попробуйте 1 месяц на 2209 pyб
- Загрузите 10 фотографий или векторов.
- Нет дневного лимита загрузок, неиспользованные загрузки переносятся на следующий месяц
221 ру
за изображение любой размер
Цена денег
Ключевые слова
Похожие векторы
Нужна помощь? Свяжитесь с вашим персональным менеджером по работе с клиентами
@ +7 499 938-68-54
Мы используем файлы cookie, чтобы вам было удобнее работать.Используя наш веб-сайт, вы соглашаетесь на использование файлов cookie, как описано в нашей Политике использования файлов cookie
. Принимать| [1] | Тачеджян Г., Алдунат М., Брэдшоу К.С., Конус Р.А. Роль продукции молочной кислоты пробиотическими видами Lactobacillus для здоровья влагалища. Res Microbiol. 2017; 168: 782-792. DOI: 10.1016 / j.resmic.2017.04.001. |
| [2] | Ламонт Р.Ф., Собел Д.Д., Акинс Р.А., Хассан С.С., Чайворапонгса Т., Кусанович Дж.П. и др.Микробиом влагалища: новая информация о флоре половых путей с использованием молекулярных методов. BJOG. 2011; 118: 533-549. DOI: 10.1111 / j.1471-0528.2010.02840.x. |
| [3] | Mendes-Soares H, Suzuki H, Hickey RJ, Forney LJ. Сравнительная функциональная геномика Lactobacillus spp. Выявлены возможные механизмы специализации вагинальных лактобацилл в окружающей их среде. Бактериологический журнал. 2014; 196: 1458-1470. DOI: 10.1128 / JB.01439-13. |
| [4] | Ravel J, Gajer P, Abdo Z, Schneider GM, Koenig SS, McCulle SL, et al. Микробиом влагалища женщин репродуктивного возраста. Proc Natl Acad Sci USA. 2011; 108: 4680-4687. DOI: 10.1073 / pnas.1002611107. |
| [5] | Будиловская О.В., Шипицына Е.В., Герасимова Е.Н. и др. Видовое разнообразие вагинальных лактобацилл в норме и при дисбиотических состояниях. Журнал акушерства и женских болезней. 2017; 66 (2): 24-32.DOI: 10.17816 / JOWD66224-32. |
| [6] | Джесперс В., ван де Вейгерт Дж., Коулс П. и др. Значение Lactobacillus crispatus и Lactobacillus vaginalis для здоровья влагалища и отрицательный эффект недавнего секса: перекрестное описательное исследование среди групп африканских женщин. BMC Infect Dis. 2015; 15: 115. DOI: 10.1186 / s12879-015-0825-z. |
| [7] | Dols JA, Molenaar D, van der Helm JJ, et al. Молекулярная оценка бактериального вагиноза по численности и видовому разнообразию Lactobacillus. BMC Infect Dis. 2016; 16: 180. DOI: 10.1186 / s12879-016-1513-3. |
| [8] | Назарова В.В., Шипицына Е.В., Шалепо К.В., Савичева А.М. Бактериальные сообщества, образующие микроэкосистему влагалища в норме и при бактериальном вагинозе. Журнал акушерства и женских болезней. 2017; 66 (6): 30-43. DOI: 10.17816 / JOWD66630-43. |
| [9] | Мендлинг В., Палмейра-де-Оливейра А., Бибер С., Прасаускас В. Последняя информация о роли Atopobiumvaginae при бактериальном вагинозе: что следует учитывать при выборе лечения? Мини-обзор Архив гинекологии и акушерства. 2019; 300: 1–6. DOI: 10.1007 / s00404-019-05142-8. |
| [10] | Gajer P, Brotman RM, Bai G, Sakamoto J, Schütte UM, Zhong X и др. Временная динамика микробиоты влагалища человека. Sci Transl Med. 2012; 4 (132): 132-152. DOI: 10.1126 / scitranslmed.3003605. |
| [11] | Гладышева И.В., Черкасов С.В. Коринебактерии микробиома влагалища — потенциальные возбудители или перспективные пробиотки? Вестник Оренбургского научного центра Уральского отделения Российской академии наук. 2019; 3: 1-20. [на Руси]. DOI: 10.24411 / 2304-9081-2019-130225. |
| [12] | Torcia MG. Взаимодействие микробиома влагалища, иммунного ответа и вирусных инфекций, передаваемых половым путем. Int J Mol Sci. 2019; 20: E266. DOI: 10.3390 / ijms20020266. |
| [13] | Macklaim JM, Fernandes AD, Di Bella JM, Hammond J, Reid G, Gloor GB. Сравнительная последовательность мета-РНК влагалищной микробиоты и дифференциальная экспрессия Lactobacillus iners при здоровье и дисбактериозе. Микробиом. 2013; 1: 12. DOI: 10.1186 / 2049-2618-1-12. |
| [14] | Собель Д.Д., Каур Н., Возницкий Н.А., Бойков Д., Агуин Т., Гилл Г., Акинс Р.А. Прогностические показатели рецидива бактериального вагиноза. J Clin Microbiol. 2019; 57: e00227-19. DOI: 10.1128 / JCM.00227-19. |
| [15] | Кампишиано Г., Занотта Н., Ликастро Д., Де Сета Ф., Комар М. Микробиом in vivo и связанные с ним иммунные маркеры: новое понимание патогенеза дисбактериоза влагалища. Научный доклад 2018; 8: 2307. DOI: 10.1038 / s41598-018-20649-x. |
| [16] | Мелкумян А.Р., Припутневич Т.В., Анкирская А.С. и др. Видовой состав лактобацилл при различных состояниях микробиоты влагалища у беременных. Клиническая микробиология и антимикробная химиотерапия. 2013; 15 (1): 72–79 [inRuss]. |
| [17] | Шишкова Ю.С., Долгушина В.Ф., Графова Е.Д. и др. Образование биопленок у лактобацилл, выделенных из репродуктивного тракта женщин в первом триместре беременности. Вестник современной клинической медицины. 2016; 9 (5): 53-56. DOI: 10.20969 / VSKM.2016.9 (5) .53-56. |
| [18] | Бурменская О.В., Байрамова Г.Р., Непша О.С. и др. Видовой состав лактобацилл при неспецифическом вагините и бактериальном вагинозе и его влияние на местный иммунитет. Акушерство и гинекология. 2014; 1: 41–45. |
| [19] | O’Hanlon DE, Moench TR, Cone RA. PH влагалища и бактерицидная молочная кислота, когда лактобациллы доминируют в микробиоте. PLoS One. 2013: 8; e80074. doi.10.1371 / journal.pone.0080074. |
| [20] | Линьярес И.М., Саммерс П.Р., Ларсен Б. и др. Современные взгляды на pH влагалища и лактобациллы. Am J Obstet Gynecol. 2011; 204 (2): 120.e1-5. DOI: 10.1016 / j.ajog.2010.07.010. |
| [21] | Виткин С.С., Мендес-Соарес Х., Линьярес И.М. и др. Влияние вагинальных бактерий и изомеров D- и L-молочной кислоты на индуктор металлопротеиназы внеклеточного матрикса влагалища: значение для защиты от инфекций верхних отделов половых путей. мБио. 2013; 4 (4): e00460-13. DOI: 10.1128 / mBio.00460-13. |
| [22] | Rizzo A, Losacco A, Carratelli CR. Lactobacillus crispatus модулирует защиту эпителиальных клеток от Candida albicans через Toll-подобные рецепторы 2 и 4, интерлейкин 8 и человеческие бета-дефенсины 2 и 3. Immunol Lett. 2013; 156 (1-2): 102-109. DOI: 10.1016 / j.imlet.2013.08.013. |
| [23] | Ghartey JP, Smith BC, Chen Z, Buckley N, Lo Y, Ratner AJ, et al.Доминирующий вагинальный микробиом Lactobacillus crispatus связан с ингибирующей активностью секреции женских половых путей в отношении Escherichia coli. PLoS ONE. 2014; 9 (5): e96659.doi: 10.1371 / journal.pone.0096659. |
| [24] | Де Сета Ф, Кампишиано Дж., Занотта Н., Риччи Дж., Комар М. Типы состояния вагинального сообщества микробиомно-иммунная сеть как ключевой фактор бактериального вагиноза и аэробного вагинита. Front Microbiol. 2019; 10: 2451. DOI: 10.3389 / fmicb.2019.02451. |
| [25] | Stafford GP, Parker JL, Amabebe E, et al. Самопроизвольные преждевременные роды связаны с дифференциальной экспрессией вагинальных метаболитов микрофлорой с преобладанием лактобацилл. Front Physiol. 2017; 8: 615. DOI: 10.3389 / fphys.2017.00615. |
| [26] | Kalyoussef S, Nieves E, Dinerman E, et al. Белки Lactobacillus связаны с бактерицидной активностью в отношении кишечной палочки секрета женских половых путей. PLoS ONE. 2012; 7: e49506. DOI: 10.1371 / journal.pone.0049506. |
| [27] | Aldunate M, Srbinovski D, Hearps AC, et al. Противомикробные и иммуномодулирующие эффекты молочной кислоты и короткоцепочечных жирных кислот, продуцируемых вагинальной микробиотой, связанной с эубиозом и бактериальным вагинозом. Front Physiol. 2015; 6: 164. DOI: 10.3389 / fphys.2015.00164. |
| [28] | Харди Л., Церка Н., Джесперс В. и др. Бактериальные биопленки во влагалище. Res Microbiol. 2017; 168 (9-10): 865-874. DOI: 10.1016 / j.resmic.2017.02.001. |
| [29] | Лю М.Б., Сюй С.Р., Хе И, Дэн Г.Х., Шенг Х.Ф. и др. Разнообразный микробиом влагалища у женщин репродуктивного возраста с кандидозным вульвовагинитом. PLoS ONE. 2013; 8 (11): e79812. DOI: 10.1371 / journal.pone.0079812. |
| [30] | Кранн С.Е., Каннингем С., Альберт А. и др. Вагинальное здоровье и гигиена, а также использование продуктов в Канаде: национальное поперечное исследование. BMC Womens Health. 2018; 18: 52. doi: 10.1186 / s12905-018-0543-у. |
| [31] | Рахматуллаева М.М. Лечение бактериального вагиноза: проблемы и перспективы. Pharmateca. 2019; 26 (6): 79-83. DOI: 10.18565 / Pharmateca.2019.6.79-83. |
| [32] | Hilbert DW, Smith WL, Paulish-Miller TE, et al. Использование молекулярных методов для выявления прогностических маркеров рецидивирующего бактериального вагиноза. Diagnosis Microbiol Infect Dis. 2016; 86: 231-242. DOI: 10.1016 / j.diagmicrobio.2016.07.003. |
Количественная оценка бактериального микробиома влагалища у разных групп женщин с помощью тестов амплификации нуклеиновых кислот | BMC Microbiology
Myer L, Kuhn L, Stein ZA, Wright TC, Denny L: Интравагинальные методы, бактериальный вагиноз и подверженность женщин ВИЧ-инфекции: эпидемиологические данные и биологические механизмы. Lancet Infect Dis. 2005, 5: 786-794. 10.1016 / S1473-3099 (05) 70298-Х.
PubMed Статья Google Scholar
Taha TE, Hoover DR, Dallabetta GA, Kumwenda NI, Mtimavalye LA, Yang LP, Liomba GN, Broadhead RL, Chiphangwi JD, Miotti PG: Бактериальный вагиноз и нарушения микрофлоры влагалища: связь с увеличением заражения ВИЧ . СПИД. 1998, 12: 1699-1706. 10.1097 / 00002030-199813000-00019.
PubMed CAS Статья Google Scholar
van de Wijgert JH, Morrison CS, Brown J, Kwok C, Van Der PB, Chipato T, Byamugisha JK, Padian N, Salata RA: Выявление вклада инфекций репродуктивного тракта в заражение ВИЧ среди африканских женщин. Sex Transm Dis. 2009, 36: 357-364. 10.1097 / OLQ.0b013e3181a4f695.
PubMed Статья Google Scholar
Mirmonsef P, Gilbert D, Zariffard MR, Hamaker BR, Kaur A, Landay AL, Spear GT: Влияние комменсальных бактерий на врожденные иммунные реакции в женских половых путях.Am J Reprod Immunol. 2011, 65: 190-195. 10.1111 / j.1600-0897.2010.00943.x.
PubMed CAS PubMed Central Статья Google Scholar
Hillier SL, Krohn MA, Rabe LK, Klebanoff SJ, Eschenbach DA: Нормальная вагинальная флора, лактобациллы, продуцирующие h3O2, и бактериальный вагиноз у беременных. Clin Infect Dis. 1993, 16 (Дополнение 4): S273-S281.
PubMed Статья Google Scholar
Klebanoff SJ, Coombs RW: Вирицидный эффект Lactobacillus acidophilus на вирус иммунодефицита человека типа 1: возможная роль в передаче гетеросексуальным путем. J Exp Med. 1991, 174: 289-292. 10.1084 / jem.174.1.289.
PubMed CAS Статья Google Scholar
Cherpes TL, Hillier SL, Meyn LA, Busch JL, Krohn MA: тонкий баланс: факторы риска заражения бактериальным вагинозом включают половую активность, отсутствие продуцирующих перекись водорода лактобацилл, черную расу и положительный герпес. серология симплекс-вируса 2-го типа.Sex Transm Dis. 2008, 35: 78-83. 10.1097 / OLQ.0b013e318156a5d0.
PubMed Статья Google Scholar
Nugent R, Krohn M, Hillier S: Надежность диагностики бактериального вагиноза повышается с помощью стандартизированного метода интерпретации окраски по Граму. J Clin Microbiol. 1991, 29: 297-301.
PubMed CAS PubMed Central Google Scholar
Hugenholtz P, Goebel BM, Pace NR: Влияние культурно-независимых исследований на формирующееся филогенетическое представление о бактериальном разнообразии.J Bacteriol. 1998, 180: 4765-4774.
PubMed CAS PubMed Central Google Scholar
Sha BE, Chen HY, Wang QJ, Zariffard MR, Cohen MH, Spear GT: полезность критериев Амселя, оценка Ньюджента и количественная ПЦР для Gardnerella vaginalis, Mycoplasma hominis и Lactobacillus spp. для диагностики бактериального вагиноза у женщин, инфицированных вирусом иммунодефицита человека. J Clin Microbiol. 2005, 43: 4607-4612. 10.1128 / JCM.43.9.4607-4612.2005.
PubMed PubMed Central Статья Google Scholar
Verhelst R, Verstraelen H, Claeys G, Verschraegen G, Delanghe J, Van Simaey L, De Ganck C, Temmerman M, Vaneechoutte M: Клонирование генов 16 S рРНК, амплифицированных из нормальной и нарушенной микрофлоры влагалища, предполагает наличие сильная связь между Atopobium vaginae, Gardnerella vaginalis и бактериальным вагинозом. BMC Microbiol. 2004, 4: 16-10.1186 / 1471-2180-4-16.
PubMed PubMed Central Статья Google Scholar
Фредрикс Д.Н., Фидлер Т.Л., Томас К.К., Окли Б.Б., Марраццо Дж. М.: Целевая ПЦР для обнаружения вагинальных бактерий, связанных с бактериальным вагинозом. J Clin Microbiol. 2007, 45: 3270-3276. 10.1128 / JCM.01272-07.
PubMed CAS PubMed Central Статья Google Scholar
Хаммелен Р., Фернандес А.Д., Маклэйм Дж. М., Диксон Р. Дж., Чангалуха Дж., Глоор Б. Б., Рид Г.: Глубокое секвенирование микробиоты влагалища у женщин с ВИЧ.PLoS One. 2010, 5: e12078-10.1371 / journal.pone.0012078.
PubMed PubMed Central Статья Google Scholar
Равель Дж., Гайер П., Абдо З., Шнайдер Г.М., Кениг С.С., МакКулл С.Л., Карлебах С., Горле Р., Рассел Дж., Тэкет СО, Бротман Р.М., Дэвис С.К., Оулт К., Перальта Л. : Микробиом влагалища женщин репродуктивного возраста. Proc Natl Acad Sci USA. 2011, 108 (Приложение 1): 4680-4687.
PubMed CAS PubMed Central Статья Google Scholar
Spear GT, Gilbert D, Landay AL, Zariffard R, French AL, Patel P, Gillevet PM: Пиросеквенирование генитальных микробиот ВИЧ-серопозитивных и -серонегативных женщин показывает, что Lactobacillus iners являются преобладающими видами Lactobacillus. Appl Environ Microbiol. 2011, 77: 378-381. 10.1128 / AEM.00973-10.
PubMed CAS PubMed Central Статья Google Scholar
Чжоу X, Браун CJ, Абдо З., Дэвис CC, Hansmann MA, Joyce P, Foster JA, Forney LJ: Различия в составе вагинальных микробных сообществ, обнаруженные у здоровых белых и черных женщин.ISME J. 2007, 1: 121-133. 10.1038 / ismej.2007.12.
PubMed CAS Статья Google Scholar
Ламонт Р., Собел Дж., Акинс Р., Хассан С., Чайворапонгса Т., Кусанович Дж., Ромеро Р.: Микробиом влагалища: новая информация о флоре половых путей с использованием молекулярных методов. BJOG. 2011, 118: 533-549. 10.1111 / j.1471-0528.2010.02840.x.
PubMed CAS PubMed Central Статья Google Scholar
Сринивасан С., Лю С., Митчелл С.М., Фидлер Т.Л., Томас К.К., Агнью К.Дж., Марраццо Дж.М., Фредрикс Д.Н.: Временная изменчивость вагинальных бактерий человека и связь с бактериальным вагинозом. PLoS One. 2010, 5: e10197-10.1371 / journal.pone.0010197.
PubMed PubMed Central Статья Google Scholar
Verstraelen H, Verhelst R, Claeys G, De Backer E, Temmerman M, Vaneechoutte M: Продольный анализ микрофлоры влагалища во время беременности предполагает, что L.crispatus способствует стабильности нормальной микрофлоры влагалища, а L. gasseri и / или L. iners в большей степени способствуют возникновению аномальной микрофлоры влагалища. BMC Microbiol. 2009, 9: 116-10.1186 / 1471-2180-9-116.
PubMed PubMed Central Статья Google Scholar
Santiago GL, Cools P, Verstraelen H, Trog M, Missine G, El Aila N, Verhelst R, Tency I, Claeys G, Temmerman M, Vaneechoutte M: продольное исследование динамики микрофлоры влагалища в течение двух последовательные менструальные циклы.PLoS One. 2011, 6: e28180-10.1371 / journal.pone.0028180.
PubMed Статья Google Scholar
Джесперс В.А., Ван Рой Дж.М., Битс Г.И., Буве А.М.: Исследование фазы 1 с определением дозировки TMC120, многообещающего вагинального микробицида, на ВИЧ-отрицательных и ВИЧ-положительных женщинах-добровольцах. J Acquir Immune Defic Syndr. 2007, 44: 154-158. 10.1097 / QAI.0b013e31802bb35f.
PubMed CAS Статья Google Scholar
McCutcheon AL: Анализ скрытых классов. Количественные применения в серии социальных наук № 64. 1987, Sage Publication, Thousand Oaks, edition
Google Scholar
Larsson PG, Brandsborg E, Forsum U, Pendharkar S, Krogh-Andersen K, Nasic S, Hammarstrom L, Marcotte H: расширенное противомикробное лечение бактериального вагиноза в сочетании с лактобациллами человека, чтобы найти лучшее лечение и минимизировать риск заражения. риск рецидивов.BMC Infect Dis. 2011, 11: 223-10.1186 / 1471-2334-11-223.
PubMed PubMed Central Статья Google Scholar
Менард Дж. П., Феноллар Ф., Генри М., Бретель Ф., Рауль Д.: Молекулярная количественная оценка нагрузки Gardnerella vaginalis и Atopobium vaginae для прогнозирования бактериального вагиноза. Clin Infect Dis. 2008, 47: 33-43. 10.1086 / 588661.
PubMed CAS Статья Google Scholar
Уокер Дж., Хокинг Дж., Фэрли С., Тебризи С., Чен М., Боуден Ф, Ганн Дж., Донован Б., Калдор Дж., Брэдшоу С. Распространенность и частота бактериального вагиноза в когорте молодых австралийских женщин. Половая трансмиссия. 2011, Том 87: Дополнение 1-
Google Scholar
Чжоу X, Хансманн М.А., Дэвис С.К., Сузуки Х., Браун С.Дж., Шютте У., Пирсон Д.Д., Форни Л.Дж.: бактериальные сообщества влагалища японских женщин похожи на сообщества женщин других расовых групп.FEMS Immunol Med Microbiol. 2010, 58: 169-181. 10.1111 / j.1574-695X.2009.00618.x.
PubMed CAS PubMed Central Статья Google Scholar
Антонио М., Петрина М., Мейн Л., Хиллиер С. Колонизация Lactobacillus crispatus снижает риск заражения бактериальным вагинозом (БВ). Sex Transm Dis. 2011 г., Том 87 (Приложение 1): A304-A305.
Артикул Google Scholar
Zariffard MR, Saifuddin M, Sha BE, Spear GT: Обнаружение организмов, связанных с бактериальным вагинозом, с помощью ПЦР в реальном времени на Lactobacilli, Gardnerella vaginalis и Mycoplasma hominis. FEMS Immunol Med Microbiol. 2002, 34: 277-281. 10.1111 / j.1574-695X.2002.tb00634.x.
PubMed CAS Статья Google Scholar
Бюн Р., Надкарни М.А., Чхур К.Л., Мартин Ф.И., Жак Н.А., Хантер Н.: Количественный анализ различных видов Lactobacillus, присутствующих при распространенном кариесе зубов.J Clin Microbiol. 2004, 42: 3128-3136. 10.1128 / JCM.42.7.3128-3136.2004.
PubMed CAS PubMed Central Статья Google Scholar
Tamrakar R, Yamada T, Furuta I, Cho K, Morikawa M, Yamada H, Sakuragi N, Minakami H: Связь между видами Lactobacillus и бактериями, связанными с бактериальным вагинозом, и баллы по бактериальному вагинозу у беременных японских женщин. BMC Infect Dis. 2007, 7: 128-10.1186 / 1471-2334-7-128.
PubMed PubMed Central Статья Google Scholar
De Backer E, Verhelst R, Verstraelen H, Alqumber MA, Burton JP, Tagg JR, Temmerman M, Vaneechoutte M: Количественное определение четырех видов вагинальных Lactobacillus с помощью ПЦР в реальном времени. Gardnerella vaginalis и Atopobium vaginae указывают на обратную связь между L. gasseri и L. iners. BMC Microbiol. 2007, 7: 115-10.1186 / 1471-2180-7-115.
PubMed PubMed Central Статья Google Scholar
Микроорганизмы | Бесплатный полнотекстовый | Восстановление микробиоты влагалища после стандартного лечения инфекции бактериального вагиноза: обсервационное исследование
1.Введение
Влагалищные лактобациллы играют фундаментальную роль в здоровье женщин, взаимодействуя с физиологией хозяина и воздействуя на патогенные микроорганизмы, тем самым положительно влияя на репродуктивное здоровье и благополучие. Понимание сообществ вагинальной микробиоты и ее влияния на здоровье быстро возросло с появлением методологий, не зависящих от молекулярных культур. Влагалищная микробиота объединяется по крайней мере в пять основных типов состояния сообщества (CST). В четырех из них преобладают лактобациллы: CST I — Lactobacillus crispatus, CST II — Lactobacillus gasseri, CST III — Lactobacillus iners и CST V — Lactobacillus jensenii [1].L. crispatus, L. gasseri и L. jensenii наиболее тесно связаны со здоровой микробиотой [1]. На сегодняшний день L. iners считается наиболее распространенным видом как у здоровых женщин, так и у женщин с дисбактериозом и заболеваниями влагалища [2]. CST IV состоит из смеси строгих и факультативных анаэробов, включая представителей Gardnerella, Atopobium, Sneathia и Prevotella. Фактически, бактериальный состав бактериального вагиноза (BV), одной из наиболее частых причин вагинального дискомфорта у женщин, напоминает CST IV с точки зрения истощения лактобацилл и чрезмерного роста анаэробных бактерий, таких как Gardnerella, Atopobium и Prevotella.БВ часто сопровождается такими клиническими симптомами, как раздражение, аномальные выделения из влагалища и запах. Однако у некоторых женщин с БВ симптомы могут протекать полностью бессимптомно. Бактерии, ассоциированные с БВ, например Gardnerella vaginalis, образуют биопленки [3], что может быть одной из ключевых причин, по которым от 10% до 15% пациентов с БВ не реагируют на первоначальные противомикробные препараты терапия [4,5]. Кроме того, частота рецидивов среди респондентов остается значительной [6], что требует повторного приема антибиотиков. Повторное воздействие антибиотиков увеличивает риск появления устойчивых штаммов, нарушения микробиоты, связанной с хозяином, и возможного сохранения микробного дисбаланса, связанного с BV.Клинический диагноз BV обычно основывается на оценке Nugent в сочетании с критериями Amsel. Однако разнообразная морфология вагинальных бактерий, бессимптомный характер БВ и субъективность микроскопического исследования затрудняют точную и своевременную диагностику БВ. Особенно L. iners с сообщенной изменчивой морфологией могут быть упущены из виду при деформации по Граму [2]. Приложения на основе последовательностей обеспечивают более глубокое понимание сообщества вагинальной микробиоты, и изучение динамических изменений в этом сообществе при БВ во время и после антибиотикотерапии было бы более информативным при ранней оценке и лечении БВ, а также для прогнозирования риска рецидива [7].Тем не менее, информация о периоде восстановления, когда микробиота возвращается в здоровое состояние после лечения БВ антибиотиками, ограничена [8]. Эта информация поможет в принятии более точных решений в отношении схемы лечения. Таким образом, цель этого наблюдательного исследования — изучить время, необходимое как сообществу вагинальной микробиоты, так и шкале Ньюджента, чтобы вернуться к норме после стандартного лечения BV-инфекции метронидазолом, путем сравнения вагинальной микробиоты BV-положительных женщин со здоровыми женщинами.В анализе секвенирования микробиоты мы применили алгоритм шумоподавления для учета ошибок в секвенировании, что обеспечило большее разрешение видов Lactobacillus, присутствующих в микробиоте влагалища. Мы обнаружили, что микробиота влагалища у BV-положительных женщин восстанавливается и становится похожей на микробиоту здоровых женщин после прекращения приема метронидазола, но также обнаружили относительно высокое содержание L.iners как у здоровых, так и у женщин с BV во все временные точки.2. Материалы и методы
2.1. Дизайн исследования
Это неинтервенционное наблюдательное исследование, проведенное в Шотландии, Соединенное Королевство, с сентября по ноябрь 2017 г. (Clinicaltrials.идентификатор правительства: NCT03187457). Исследование было одобрено 12 июля 2017 г. Службой по этике исследований Восточной Шотландии, Региональным комитетом по этике 2 (номер ссылки 17 / ES / 0072). Исследование проводилось в соответствии с рекомендациями ICH GCP и этическими стандартами, установленными в Хельсинкской декларации 1964 года. Оценка размера выборки была основана на суждении главного исследователя и исследовании Mayer et al. [8]. Однако из-за характера исследования наблюдательного исследования не было подготовлено ни формального плана статистического анализа, ни расчета мощности.Письменное информированное согласие было получено от всех отдельных участников, включенных в исследование. Участники группы 1 состояли из здоровых женщин, у которых не было симптомов BV, тогда как участники группы 2 состояли из женщин с риском инфицирования BV, первоначально определяемым как продолжающиеся самооценочные симптомы BV (вагинальный зуд, выделения из влагалища (жидкие и водянистые, либо белые или бледно-серого цвета), раздражение, жжение, покраснение, отек, боль или сыпь). Симптомы были дополнительно изучены и подтверждены лечащим врачом.Критерии включения для всех участников следующие: подписанное информированное согласие, женский пол, возраст старше 18 лет, высокая вероятность соблюдения и завершения исследования. Вагинальный pH-тест Canestest (Bayer plc, Ньюбери, Великобритания) использовался в качестве инструмента скрининга для распределения участников по исследовательским группам для оценки применимости теста в будущих исследованиях. Для группы 1 дополнительным критерием включения был отрицательный результат Canestest, тогда как для группы 2 результат Canestest должен был быть положительным.Участницы были исключены, если у них была гиперчувствительность к метронидазолу (применялась только к группе 2), в постменопаузе (определялась как минимум 12 месяцев без менструации подряд), они получали лечение от БВ в течение последних 4 недель, имели клинически значимые нарушения менструального цикла, имели подозрение на наличие заболеваний, передающихся половым путем (ЗППП) (таких как хламидиоз или трихомониаз) или других вагинальных инфекций, по оценке лечащего врача, были беременны или кормили грудью, использовали методы контрацепции, содержащие спермицидные агенты, за исключением презервативов со спермицидными агентами, участвовали в других клинических исследованиях которые могли повлиять на микробиоту мочеполовых путей, не желали воздерживаться от использования каких-либо других пероральных или вагинальных пробиотиков во время исследования (применительно только к группе 2), злоупотребляли веществами, проводящий расследование врач подозревал, что участник имеет высокий риск ЗППП, или лечащий врач полагал, что участник может отказываться от сотрудничества и / или не соответствуют требованиям и поэтому не должны участвовать в исследовании.
Здоровые участники для Группы 1 были набраны во время обычных посещений терапевтов. Во время базового визита (обозначенного как День 1) были получены текущая и история вагинальной инфекции (в течение последних трех месяцев), а также взят мазок Canestest. Участникам с отрицательным результатом Canestest был проведен дополнительный вагинальный мазок для оценки Nugent и анализа микробиоты, который завершил их участие в исследовании. Участникам, у которых был положительный результат Canestest, была предложена возможность участвовать в группе 2 при условии, что также были применимы все другие критерии включения и исключения для группы 2.
Участники группы 2 были сначала проверены онлайн или по телефону. Те, кто соответствовал критериям отбора (определялись как продолжающиеся самооценка симптомов BV или положительный результат Canestest), были приглашены на базовый визит (называемый днем 1) в клинику исследования, где критерии включения и исключения были дополнительно рассмотрены. Во время этого визита была оценена информация о вагинальных инфекциях в течение последних трех месяцев и текущих вагинальных симптомах, и был взят мазок Canestest. Участникам с положительным результатом Canestest были сделаны мазки из влагалища для оценки Nugent и анализа микробиоты.Затем участникам прописали метронидазол перорально; 400 мг 3 раза в день в течение 5 дней. Участников попросили воздержаться от полового акта и использования интравагинальных спринцеваний и кремов в течение 24 часов до взятия мазка из влагалища при двух последующих визитах: в 8-й день (между 8-10 днями от исходного визита) и 15-й день (между 15. –17 дней с момента базового визита). Во время этих контрольных визитов проводились обследования симптомов и соответствие метронидазолу, а также собирались вагинальные мазки для оценки по шкале Ньюджента и для анализа микробиоты.
2.2. Результаты
Первичные результаты заключались в исследовании времени, необходимого для вагинальной микробиоты (особенно количества лактобацилл) и показателя Nugent, чтобы вернуться к норме после лечения БВ метронидазолом, и сравнение данных со здоровыми женщинами. Более того, корреляция между микробными таксонами и оценками Ньюджента была проанализирована в качестве исследовательского результата. Безопасность оценивалась путем опроса участников о нежелательных явлениях (НЯ) во время всех посещений. НЯ были классифицированы в соответствии с Медицинским словарем нормативной деятельности (MedDRA).
2.3. Сбор образцов
Образцы влагалища собирали со стенок влагалища, осторожно вращая в течение 10–15 с участниками исследования с помощью тампонов из полиэстера (Becton Dickinson, Sparks, MD, USA). Тампон помещали в пробирку для сбора (вагинальный транспорт образцов для анализа амплифицированной ДНК BD ProbeTec Qx; Becton Dickinson), тщательно избегая загрязнения кожи. Для анализа баллов по шкале Ньюджента образцы мазков были доставлены из исследовательского центра в больницу Наффилд, Глазго, Соединенное Королевство.Для анализа влагалищной микробиоты образцы мазков как таковые хранили сразу при -20 ° C после сбора, а затем переносили при -80 ° C для более длительного хранения в течение 1 месяца после сбора.
2.4. Оценка Nugent
Оценка Nugent была разделена на следующие категории: отсутствие BV (оценка 0–3), промежуточная (оценка 4-6) или BV (оценка 7-10) [9]. Различия между исследуемыми группами в абсолютных значениях баллов по шкале Ньюджента были проанализированы с помощью критериев суммы рангов Вилкоксона. Разница между 8-м и 15-м днями в группе 2 была проанализирована с помощью знакового рангового критерия Уилкоксона для согласованных пар.2,5. Обработка и анализ проб влагалищной микробиоты
2.5.1. Экстракция ДНК
ДНК из вагинальных мазков экстрагировали с использованием набора для выделения общей нуклеиновой кислоты Thermo Fisher Scientific (Уолтем, Массачусетс, США) MagMAX Express 96 и AM1840. Головки тампона нарезали в пробирки на 1,5 мл и добавляли 550 мкл концентрата, связывающего лизис. Затем образцы встряхивали на орбитальной сухой бане со скоростью 900 оборотов в минуту (об / мин) и 56 ° C в течение 3 часов. Затем 400 мкл образца взбивали шариками (3 × 30 с при 6800 об / мин) с помощью гомогенизатора Precellys 24 (Bertin Instruments, Montigny-le Bretonneux, Франция) и стеклянных пробирок Precellys VK01.Затем пробирки центрифугировали при 16000 об / мин в течение 6 минут, и 115 мкл супернатанта обрабатывали с помощью набора MagMAX ™ Pathogen RNA / DNA, сценарий 4462359_DW_HV (Thermo Fisher Scientific, Waltham, MA, USA).
