ошибка иммунитета: как она работает и от чего возникает
В первую очередь необходимо выявить аллерген и исключить или уменьшить контакт с ним. Для некоторых видов аллергий (обычно на пыльцу, на цветение растений) работает метод лечения под названием «специфическая гипосенсибилизация», когда пациенту вводят аллерген в возрастающей концентрации, переключая иммунный ответ на адекватный. Этот способ требует длинных курсов лечения (до трех лет), но зато может быть очень эффективным. Таким же образом работает «лечение домашними животными», когда взрослый аллергик заводит себе кошку или собаку, переживает 2−3 тяжелые недели, а потом обнаруживает, что аллергические проявления уменьшились или даже исчезли. Объясняется это тем, что огромное количество аллергенов, проникающих через кожу и слизистые, может переключить аллергическую реакцию на адекватную. Но этот способ ни в коем случае не рекомендуется тем, у кого есть тяжелые формы аллергии, особенно с затруднением дыхания (астма), и в любом случае требует консультации с врачом.
Болезнь от нервов
На самом деле почти половина проявлений аллергии психосоматические: нейродермит, психосоматическая бронхиальная астма и т. п. Настоящая аллергия проявляется вне зависимости от того, знает ли аллергик о том, что он съел именно опасный продукт. А психосоматическая — когда аллергик думает, что он съел именно опасный продукт (независимо от того, действительно ли он его съел). Последнее — как раз тот случай, когда «все болезни от нервов», и лечить его нужно у грамотного психотерапевта, или просто привести нервы в порядок — заняться физкультурой или любимым хобби, и аллергия пропадет сама. Если же нервы не лечить, результаты аллергических тестов будут все время положительные, причем на разные аллергены, а препараты не будут давать никакого эффекта. Таким образом, если аллергия чаще проявляется во время стресса, стоит задуматься, в какой степени она психосоматическая.
Автор текста — аллерголог-иммунолог, кандидат медицинских наук
Полезно знать об АЛЛЕРГИИ (allergi)
Что такое аллергия?
Слово «аллергия» заимствовано из греческого языка и означает «другое действие». Таким образом, аллергия – это изменения реакции организма на воздействие обычных веществ, имеющихся в окружающей среде, которые сами по себе являются безопасными. Такие вещества называются аллергенами, и самые обычные из них происходят от домовых клещей, плесневых грибков, шерстистых животных, продуктов питания, лекарств, металлов и пыльцы трав и деревьев.
При контакте больного с аллергеном в его организме начинают вырабатываться особые антитела (IgE). Эти антитела абсорбируются на поверхности различных воспалительных клеток, таких, как тучные клетки и базофильные гранулоциты. Такие клетки находятся, например, в слизистой оболочке дыхательных путей, крови и коже. При возобновлении контакта с тем же самым аллергеном может возникнуть реакция между антителом и аллергеном. В процессе такой реакции образуются химические субстанции, вызывающие такие расстройства, как зуд, заложение носа, кашель и одышка. Наиболее важной химической субстанцией, образующейся в этом процессе, является гистамин. Иногда аллергия на определённое вещество может развиться быстро, а иногда это происходит в течение продолжительного времени.
Кто может страдать аллергией?
Наследственный фактор играет большую роль в развитии аллергии. Если ни один из родителей не страдает сверхчувствительностью или аллергией, то вероятность того, что их ребенок заболеет аллергией, составляет 15%. Если один из родителей является аллергиком, то тогда этот показатель составит 40%. При наличии аллергии у обоих родителей, вероятность заболевания ребенка составит 60-80%. Часто пищевая аллергия у детей проходит с возрастом, но и у взрослых могут развиться новые виды аллергии, поражающие дыхательные пути. Аллергия дыхательных путей редко исчезает полностью, но её интенсивность и симптомы могут заметно варьироваться и, в некоторых случаях, почти не наблюдаться.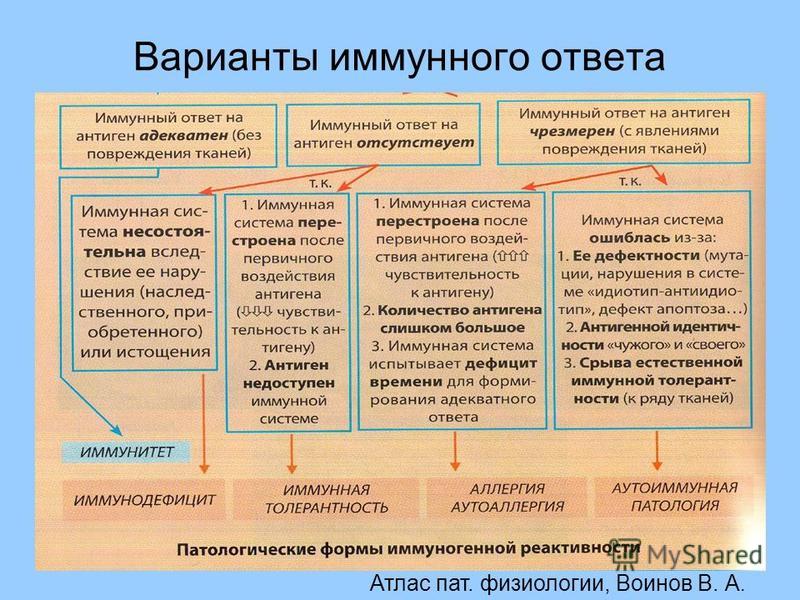
Каковы симптомы аллергии?
Пыльцевая аллергия, прежде всего, ведет к раздражению носа и глаз, но может также являться причиной головной боли, слабости, усталости и снижения концентрации внимания. Многие пыльцевые аллергики жалуются на неприятные ощущения во рту и гортани во время принятия в пищу сырых фруктов и овощей, особенно в пыльцевой сезон. Это происходит потому, что пыльцевые аллергены похожи на протеины, содержащиеся в пище, что ведёт к возникновению перекрёстной реакции.
При острой аллергической реакции может наступить анафилактический шок, то есть опасное для жизни резкое падение кровяного давления. Это может случиться при введении инъекции (вакцины или контрастной жидкости для рентгеноскопии), укусе насекомого (например, осы), принятии медикаментов или продуктов питания. См. также информационные листки об аллергии на металлы и контактной аллергии.
Распространённость
Более чем у 40% населения наблюдаются аллергические реакции в течение жизни. В большинстве случаев речь идёт о слабых симптомах. Более серьёзные аллергические реакции наблюдаются у 10-20% населения. Чаще всего аллергические симптомы появляются уже в детском возрасте, хотя кое-кто получает первые аллергические реакции уже будучи взрослым.
Специалисты на международном уровне сходятся во мнении о том, что в последние десятилетия наблюдался рост случаев заболевания аллергией. Многое говорит о том, что такие факторы стиля жизни, как изменённый рацион питания и нездоровый внутренний климат помещений, могут играть свою роль. В дополнение к этому, следует отметить ослабление микробиологической стимуляции (гигиеническая гипотеза) и изменение состава окружающей нас бактериальной флоры.
Лечение аллергии
Если Вам кажется, что у Вас аллергия, то, несмотря на достаточность профилактических мероприятий при слабых и умеренных симптомах, следует обратиться к врачу.
Важным является выбор подходящего метода лечения с правильным применением необходимых медикаментов. Первой помощью при аллергических симптомах в носу является применение так называемых местных стероидов, имеющихся в продаже в виде порошка или в ингаляторах. Антигистамины, имеющиеся в виде таблеток, глазных капель и назальных ингаляторов, также являются действенным лекарством с редкими и безопасными побочными эффектами. Как правило, при симптомах, возникающих в нижних дыхательных путях, необходимо применение ингаляционных лекарств. Здесь также центральное место отводится местным стероидам, часто в комбинации с одним или несколькими другими ингаляционными лекарствами. Следует как можно дольше воздерживаться от инъекций кортизона, которые, однако, могут быть актуальны в особых случаях (например, перед сдачей экзамена) или при недостаточной эффективности других видов лечения. Действие кортизоновой инъекции продолжается в течение нескольких недель.
Анафилактический шок может наступать постепенно или внезапно и представлять опасность для жизни. Те немногие больные с настолько ярко выраженной аллергией, что существует опасность анафилактического шока, должны всегда иметь при себе шприц с адреналином. При наступлении шока необходимо тут же произвести инъекцию адреналина и незамедлительно обратиться к врачу.
(Информацию о противоаллергической вакцинации Вы найдёте в отдельном информационном листке).
Как поставить диагноз?
При проведении обследования в период острых аллергических реакций, как, например, при аллергическом рините, результаты будут достаточно типичными для аллергии. Тем не менее, клиническое обследование обычно не даёт ответа на вопрос, является ли реакция результатом аллергии, гиперактивности дыхательных путей, повышенной чувствительности к химическим веществам или чего-то другого.
Ни один из анализов на аллергию является надёжным на 100%. Вполне возможно наличие аллергии при отрицательных результатах анализов и наоборот. Поэтому история болезни пациента имеет наиболее важное значение в диагностике аллергии. Не существует возрастных границ для проведения анализов на аллергию.
Как сдать анализ
При подозрении о наличии аллергии обращайтесь к лечащему врачу. Некоторые врачи сами проводят анализ. В противном случае, Вам будет дано направление к специалисту, в поликлинику или больницу. Принцип свободного выбора больницы в Норвегии даёт возможность выбора на основании полученной информации. На нижеуказанном сайте в Интернете и по бесплатному телефону 800 41 004 Вы можете получить информацию об имеющихся местах лечения аллергии. На сайте www.sykehusvalg.net Вы найдёте также информацию о Ваших правах относительно выбора больницы.
Профилактика аллергии
Предполагается, что можно предупредить аллергию, если давать ребенку грудное молоко в течение первых четырёх-шести месяцев жизни. В период беременности не следует курить, а также нельзя подвергать детей воздействию табачного дыма. Следует создать максимально благоприятный внутренний климат помещения.
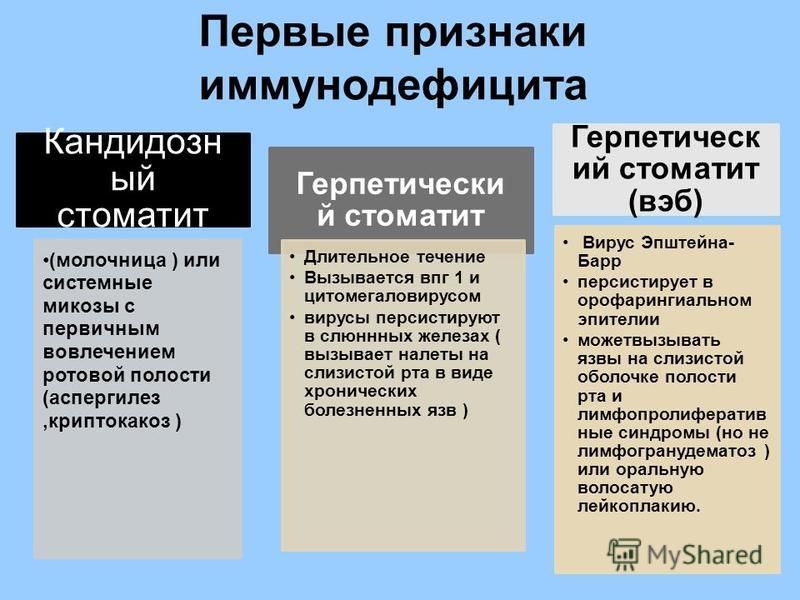
Аллергия как фактор иммунодефицита — презентация онлайн
1. МБОУ «Лицей №56»
2. Цель:
1. Ознакомиться с особенностямиаллергических заболеваний.
2. Типами аллергических реакций.
3. Выяснить причины аллергии.
4. Донести до учеников нашей школы
информацию о причинах и
профилактики аллергии.
3. Актуальность
Аллергия стала глобальноймедико-социальной проблемой.
Повсеместно регистрируется рост
заболеваемости (до 40% больных),
каждый третий житель планеты
страдает аллергическим ринитом и
астмой.

4. Что такое аллергия?
Аллергия- этоострая реакция
иммунной системы
организма на
обычно безобидные
вещества.
5. Основные аллергены
Пыльца растенийШерсть животных
Плесень
Постельные клещи
6. Аллергия на продукты питания
Симптомы:1.Кожные проявления;
2.Поражение желудочно –
кишечного тракта;
3.Приступы бронхиальной астмы;
4.Анафилактический шок;
Продукты: орехи, рыба, яйца,
цитрусовые.
7. Заболевания:
КрапивницаСимптомы:
1.Сыпь;
2. Основной элемент сыпи
красный волдырь ( чётко
ограниченный участок
отёка кожи), которые
могут сливаться друг с
8. Заболевания:
Атопический дерматитПроявления:
1.Астма
2. Ринит
3.Конъюктивит
4. Сыпь из волдырей
5.Кожа может быть сухой,
шелушиться.
6.Изменения на лбу, щеках, затем на
волосистой части головы и
подбородке.
9. Заболевания:
ЭкземаСимптомы:
1.Сыпь;
2.Жжения;
3. Зуд;
4.Возможны рецидивы.
10. Заболевания:
Бронхиальная астмаСимптомы:
1. Кашель, который усиливается на
холодном воздухе или после
физических нагрузок;
2.Сильная одышка, у многих
астматиков отмечаются
свистящие хрипы;
3.Вздутие легких, приступы удушья.
11. Заключение
В заключении нашей работы нам хотелось бы отметить, что забота оболее возрастающая с возрастом. Статистические исследования последних
лет показали, что во всех экономически развитых странах отмечается рост
аллергических заболеваний. Это во многом объясняется тем, что мы живем
в век загрязнения окружающей среды, химизации, искусственной
ароматизации, подцветки производимых продуктов и т.д.
12. Интернет ресурсы
1.http://health.mail.ru/disease/allergiya/
2.
http://medallergy.ru/vidy-allergii/
3.
http://ru.wikipedia.org/wiki/
4.
http://www.knigamedika.ru/bolezni-organovdyxaniya/drugieverhdih/allergiya-udetej.html#ixzz2rVc6dZd5
КОЖНЫЕ аллергические ЗАБОЛЕВАНИЯ | Центр АЛЛЕРГОЛОГИИ в Ставрополе
Кожная аллергия – вид ответной реакции человеческого организма на действие аллергена. Формы ее очень разнообразны и вызывают большой дискомфорт, и могут быть очень опасны для жизни.Под аллергией подразумевают иммунопатологический процесс, который протекает при воздействии возбудителя аллергии на организм. Симптомы аллергии крайне разнообразны, однако почти всегда сопровождаются каким-либо повреждением кожи – хотя бы крапивницей.
Что такое кожная аллергия?
Патогенез любого вида аллергии развивается по одинаковому сценарию. По сути, это иммунный ответ организма, но усиленный в несколько раз. Механизм аллергии состоит из 2 этапов:
— фаза раннего иммунного ответа – при появлении возбудителя аллергии вырабатываются IgE плазмоциды, и связываются с рецепторами мастоцитов и базофилов. При повторном появлении аллергена IgE реактивируется, что служит сигналом для синтеза гистамина и других медиаторов воспаления – интерлейкина, цитоксина. Вещества, попадая в окружающую ткань, вызывают сокращение гладкой мускулатуры стенок сосудов, раздражают нервные окончания, усиливают секрецию слизи и так далее. Внешне это проявляется как зуд, чихание, насморк, сыпь и отеки на коже;
— фаза позднего ответа обусловлена накоплением лейкоцитов, нейтрофилов, лимфоцитов в месте предполагаемого воспаления, а такую реакцию организм воспринимает, как сигнал о воспалении. Под их действием функциональная ткань постепенно заменяется соединительной, что весьма негативно сказывается на состоянии органов. Вторая фаза, как правило, появляется через 4–6 часов после первой, и действует 1–2 дня.
Кожная аллергия выступает составляющей этого процесса. Характерными для нее признаками являются: сухость и шелушение, порой очень сильное; зуд; покраснение и отечность кожи.

Основным проявлением крапивницы является кожная сыпь в виде волдырей, разного размера. Тяжёлыми проявлением крапивницы является ангионевротический отек (ранее его называли отек Квинке) или их сочетание.
Локализация высыпаний разная. При внешних раздражителях первыми страдают участки, контактирующие с аллергеном, при попадании возбудителя в организм дыхательным путем или через пищевой тракт, пораженной может оказаться любая часть тела.
Аллергодерматозы: характер и виды высыпаний (поражений)
Аллергодерматозы – это группа заболеваний аллергической природы, которые проявляются разнообразными поражениями кожи.
Атопический дерматит – вызывается пыльцой, шерстью животных, укусами, контактом с бытовой химией. Проявляется как зуд, сухость и раздражение кожных покровов. Как правило, локализован. Часто встречается у детей начиная с 2 месяцев.
Контактный дерматит – является ответной реакцией на непосредственное воздействие раздражителя: бытовой химии, косметики, промышленных реагентов. Для него характерны покраснение, отеки кожи, высыпания, сопровождающиеся сильным зудом. Возможно появление пузырьков и эрозия кожи.
Крапивница – за сходство с ожогом при контакте с крапивой эти высыпания получили свое название. Проявляется в виде красных пятен и плоских бледно-розовых волдырей диаметром до 5 мм. Высыпание сильно чешется, при этом волдыри лопаются, и крапивница захватывает новые участки кожи. Вызывается крапивница не только контактом с растениями, но и укусами насекомых, стрессами, действием солнечных лучей, действием холода или тепла, слишком тесной одежды на фоне потливости. Встречается также дермографическая, аквагенная,
Экзема – острая форма аллергии. Обильные высыпания сопровождаются появлением множества пузырьков. Последние легко лопаются, что ведет к эрозии коже, образованию корочек, узелков и рубцов.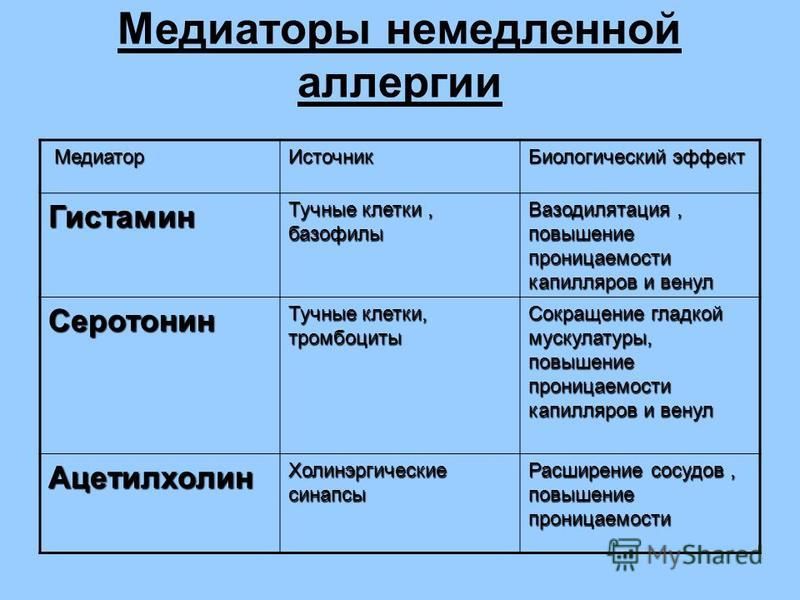 Экзема сопровождается сильнейшим зудом, что вызывает бессонницу, нервные расстройства, потерю аппетита. Экзему провоцируют как внешние факторы – стресс, бытовая пыль, так и внутренние – нарушения в работе эндокринной системы.
Экзема сопровождается сильнейшим зудом, что вызывает бессонницу, нервные расстройства, потерю аппетита. Экзему провоцируют как внешние факторы – стресс, бытовая пыль, так и внутренние – нарушения в работе эндокринной системы.
Токсикодермия – обычно вызывается острой инфекцией или неподходящим лекарственным средством. Выглядит токсикодермия как розовые или красные высыпания, в скором времени приводящее к образованию волдырей.
Нейродермит – может быть самостоятельным заболеванием, связанным с воспалениями кожи, но чаще является признаком аллергической реакции. Образует высыпания в виде красных пятен самого разного размера. Пятна могут превращаться в бляшки, сливающиеся между собой, часто сопровождаются отеком кожи. Обычно нейродермит вызывает зуд, усиливающийся ночью. Нейродермит – весьма специфическая ответная реакция. Очень часто она вызывается не объективными факторами, а является следствием сильного нервного переживания.
Отек Квинке – отек жировой и слизистой клетчатки. Обычно сопровождается крапивницей в острой форме. Симптом развивается крайне стремительно и очень опасен. Чаще всего отек локализуется на лице – веках, губе, щеке, однако отекать может и слизистая рта, и дыхательные пути.
Синдром Лайелла – крайняя, наиболее тяжелая лекарственная аллергия. При этом на коже образуются пузыри, и довольно быстро переходят в язвы, трещины и открытые раны. Недуг вызывает сильное обезвоживание, токсическое повреждение почек, печени, ЖКТ. При отсутствии срочной медицинской помощи приводит к летальному исходу.
Синдром Стивена-Джонсона – форма экссудативной эритемы, сопровождающаяся воспалением кожных покровов и слизистых. На коже она проявляется как ярко-красная сыпь, которой в скором времени начинает кровоточить. Наблюдается сильный зуд, отечность, чувство жжения. Синдром обычно возникает при аллергии на медикаменты или как следствие инфекционных заболеваний. У детей встречается крайне редко.
Общие симптомы и клинические признаки у взрослых
Для всех разновидностей болезни существуют общие признаки. Диагностировать по ним аллергию нельзя. Но, так как реакция возникает очень быстро при контакте с аллергеном, зачастую, близкие догадываются о настоящем источнике плохого самочувствия.
Диагностировать по ним аллергию нельзя. Но, так как реакция возникает очень быстро при контакте с аллергеном, зачастую, близкие догадываются о настоящем источнике плохого самочувствия.
Аллергия развивается очень быстро, поэтому знать о ее видах нужно не столько для того, чтобы сообщить их врачу, сколько для того чтобы оказать помощь больному. И в этом смысле нужно различать признаки легкой и тяжелой формы.
Симптомы легкой формы таковы:
сыпь, зуд, возможно волдыри в месте контакта с аллергеном;
слезоточивость глаз, покраснение;
обильные, но прозрачные выделения из носа;
чиханье – для аллергии характерно чиханье сериями.
В этих случаях достаточно промыть место контакта – след укуса, например, теплой водой, приложить холодный компресс и выпить какое-либо антигистаминное средство – супрастин, хлоропирамин.
Тяжелая форма имеет следующие признаки:
охриплость, затруднения с глотанием и произношением, несвязность речи;
одышка, спазмы горла, затрудненное дыхание;
сильная общая слабость, головокружение, возможна потеря сознания;
учащение пульса, давление низкое;
возможны тошнота и рвота, но не при всех видах аллергии;
как правило, больной испытывает острый страх, впадает в панику.
В этих случаях скорую медицинскую помощью нужно вызывать немедленно. До приезда скорой нужно снять тесную одежду, обеспечить приток воздуха, удалить аллерген, если известна его природа – пыльца растения, животное. Если наблюдается рвота, нужно следить за тем, чтобы пациент переворачивался набок и не заглотал язык. При остановке сердца нужен непрямой массаж сердца и искусственное дыхание.
Иммунитет и аллергия — как они связаны?
Каждый из нас наверняка слышал о том, что аллергические реакции напрямую зависят от состояния иммунной системы. Но каким образом нарушения иммунитета обуславливают появление аллергии?
Что такое иммунитет?
Иммунитет (от лат. immunitas, что значит «освобождение» или избавление от чего-либо) – это невосприимчивость и сопротивляемость организма инфекциям, а также воздействию чужеродных веществ, которые обладают токсичными свойствами.
immunitas, что значит «освобождение» или избавление от чего-либо) – это невосприимчивость и сопротивляемость организма инфекциям, а также воздействию чужеродных веществ, которые обладают токсичными свойствами.
Иммунитет делится на врожденный и приобретенный.
- Врожденный, или неспецифический, иммунитет обусловлен физиологическими и анатомическими особенностями организма, наследственно закрепленными на клеточном или молекулярном уровне. К этому виду иммунитета относятся такие свойства, как невосприимчивость всех людей к собачьей чумке или невосприимчивость некоторых к туберкулезу.
- Приобретенный иммунитет возникает после контакта с инфекцией или чужеродным белком. Он делится на активный и пассивный.
- Активный приобретенный иммунитет развивается после перенесенного заболевания или же после введения вакцины. То есть после контакта с возбудителем болезни.
- Пассивный приобретенный иммунитет связан с поступлением в организм готовых антител. Антитела, или иммуноглобулины – это специфические вещества, которые могут вырабатываться клетками иммунной системы и предназначены для нейтрализации инфекционных тел и токсичных продуктов их жизнедеятельности. Но антитела могут и поступать в организм извне в виде сыворотки, а также при передаче их с молоком матери или внутриутробным способом.
Что входит в нашу иммунную систему?
Иммунная система включает в себя два типа защиты: клеточную и гуморальную. Клеточный тип – это иммунокомпетентные клетки (например, Т-лимфоциты), отвечающие за уничтожение чужеродных инфекционных микроорганизмов, попадающих в наше тело. Гуморальный тип объединяет иммунокомпетентные клетки (например, В-лимфоциты), которые продуцируют специфические антитела для борьбы с инфекцией и токсичными чужеродными молекулами.
Органы иммунной системы
Органы иммунной системы делят на центральные и периферические.
- — Красный костный мозг является центральным органом кроветворения и производства клеток иммунной системы.
 Он располагается в плоских и трубчатых костях.
Он располагается в плоских и трубчатых костях. - Тимус, или вилочковая железа, – центральный орган иммунной системы, в котором происходит окончательное созревание Т-лимфоцитов из предшественников, которые поступают из красного костного мозга.
- Лимфатические узлы – это периферические органы иммунной системы, располагающиеся по ходу лимфатических сосудов. Они участвуют как в механизмах гуморального (В-типа), так и клеточного (Т-типа) иммунитета, в том числе и в развитии аллергических реакций.
- Селезенка – самый крупный орган иммунной системы. Он также участвует в Т- и в В-иммунитете, а также обеспечивает превращение моноцитов в макрофаги.
Как взаимосвязаны иммунитет и аллергия?
Аллергия – это сверхчувствительность иммунной системы, возникающая при повторных воздействиях аллергена на организм. На сегодняшний день описано 5 типов реакций такой гиперчувствительности. Но аллергией называется только одна из них, обусловленная выработкой и воздействием иммуноглобулина Е в ответ на попадание в организм чужеродных белков.
Аллергия характеризуется чрезмерной деятельностью тучных клеток, которая переходит в общий воспалительный ответ. Также он может приводить к различным доброкачественным симптомам:
- насморку;
- кожному зуду;
- рези в глазах;
- отекам;
- крапивнице;
- чиханию и кашлю.
Кроме того, при выраженных реакциях могут развиваться и опасные для жизни состояния, такие как анафилактический шок или отек Квинке.
Следует различать аллергию и аутоиммунные реакции. Аутоиммунный процесс возникает в случае, когда защитные механизмы начинают атаковать клетки собственных тканей организма. Аллергия всегда является реакцией на чужеродные соединения.
Почему развивается аллергия?
Многочисленные исследования свидетельствуют о наследственной предрасположенности к аллергиям. Ребенок, чьи родители страдают этой патологией, подвержен большему риску возникновения аллергии, чем дети от здоровых пар.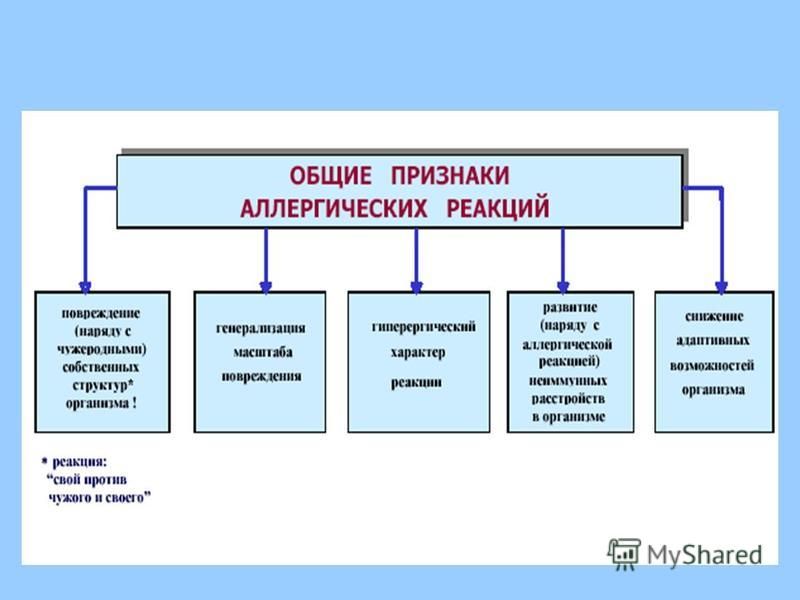
Теория влияния гигиены утверждает, что соблюдение гигиенических норм предотвращает контакты организма со многими патологическими микроорганизмами и токсичными веществами. Это приводит к недостаточной нагрузке на иммунную систему, особенно у детей. Наш организм сконструирован так, что он должен постоянно противостоять определенному уровню угроз и внешних проникновений. И если такой постоянной «тренировки» и поддержания тонуса иммунной системы не происходит, то она начинает все более выражено реагировать на вполне безобидные вещества.
Статистические данные свидетельствуют, что различные иммунологические заболевания в странах третьего мира встречаются гораздо реже, чем в развитых. Более того, чем больше времени проходит от момента иммиграции, тем чаще иммигранты из развивающихся стран страдают иммунными расстройствами. И по мере роста благосостояния, а, соответственно, чистоты и соблюдения гигиенических норм в стране у ее населения увеличивается количество случаев возникновения аллергии.
Теория увеличения потребления продуктов химической промышленности также подтверждается научными исследованиями. Многие химические продукты сами по себе могут являться довольно сильными аллергенами. Кроме того, они зачастую создают предпосылки для возникновения аллергических реакций, поскольку способны нарушать функции эндокринной и нервной системы.
Однако однозначного объяснения, почему одинаковые факторы действуют на одних людей и не действуют на других, пока не существует. С уверенностью можно сказать одно: здоровый образ жизни, правильное сбалансированное питание, отказ от вредных привычек и забота о собственном организме станут отличным подспорьем для недопущения развития аллергии.
Майорова Л.Н.
Презентация индивидуального проекта «Аллергия. Причины и профилактика»»
библиотека
материалов
Содержание слайдов
Номер слайда 1
Муниципальное казенное общеобразовательное учреждение»Гимназия №1″ Искитимского района. Новосибирской области. Проект по биологии«АЛЛЕРГИЯ. ПРИЧИНЫ И ПРОФИЛАКТИКА»Авторы проекта: Карпова Алина, учащаяся 9 класса. Руководитель проекта: Бондаренко Екатерина Алексеевна,учитель биологии. Линево — 2018 год
Новосибирской области. Проект по биологии«АЛЛЕРГИЯ. ПРИЧИНЫ И ПРОФИЛАКТИКА»Авторы проекта: Карпова Алина, учащаяся 9 класса. Руководитель проекта: Бондаренко Екатерина Алексеевна,учитель биологии. Линево — 2018 год
Номер слайда 2
Номер слайда 3
Целью данной работы является выявление причин возникновения аллергических заболеваний и возможных мер их профилактики. Задачи исследования:1.провести информационный поиск по вопросу исследования и выявить количество аллергиков в «Гимназии№1» Искитимского района2.рассмотреть типы аллергических заболеваний3.выяснить причины аллергии4.изучить профилактику аллергии. Гипотеза: если проследить и проанализировать причины распространения аллергии, можно выявить профилактику аллергии и остановить распространение аллергии.
Номер слайда 4
ЭТАПЫ РАБОТЫ: Постановка цели, определение задач. Подбора материала. Опрос среди учащихся и педагогического коллектива Подготовка презентации. Выводы.
Подбора материала. Опрос среди учащихся и педагогического коллектива Подготовка презентации. Выводы.
Номер слайда 5
Что такое аллергия?Аллергия – это унаследованная сверхчувствительность к некоторым веществам окружающей среды, действующим на человека через его иммунную систем.
Номер слайда 6
Классификация аллергических реакций Немедленного типа. Замедленного типа
Номер слайда 7
Основные аллергены Пыль. Пыльца растений. Лекарства. Бытовая химия Шерсть животных Продукты питания
Номер слайда 8
Заболевания. Атопический дерматит: Проявление:1. Сыпь из волдырей2. Кожа может быть сухой, шелушиться
Атопический дерматит: Проявление:1. Сыпь из волдырей2. Кожа может быть сухой, шелушиться
Номер слайда 9
Крапивница. Проявление:1. Сыпь
Номер слайда 10
Экзема. Проявление:1. Сыпь2. Жжения3. Зуд
Номер слайда 11
Отек Квинке Отека мягких тканей. Обычно поражаются лицо, шея, кисти и стопы, гениталии.
Номер слайда 12
Бронхиальная астма. Проявление:1. Сильная одышка, у многих астматиков отмечаются свистящие хрипы2. Вздутие легких, приступы удушья
Проявление:1. Сильная одышка, у многих астматиков отмечаются свистящие хрипы2. Вздутие легких, приступы удушья
Номер слайда 13
Анафилактический шок. Проявление:1. Бледность кожи;2. Липкий пот;3. Судороги;4. Боли в животе, рвота;5. Появление эритемы, крапивницы.
Номер слайда 14
Профилактикане употреблять продукты, являющиеся аллергенами;избегать запахов, вызывающих симптомы аллергических проблем; ограничить пребывание в помещениях с пылью; исключить общение с животными;профилактическое промывание пазух носа с целью вымывания аллергенов.
Номер слайда 15
Исследовательская часть. Анкета включила в себя пять вопросов:1. Есть ли у Вас аллергия?2. Если есть, то какая?3. Если есть, то, в каком виде она проявляется?4. Как Вы боритесь с ней?5. Укажите Ваш возраст?
Анкета включила в себя пять вопросов:1. Есть ли у Вас аллергия?2. Если есть, то какая?3. Если есть, то, в каком виде она проявляется?4. Как Вы боритесь с ней?5. Укажите Ваш возраст?
Номер слайда 16
Номер слайда 17
Номер слайда 18
Номер слайда 19
Номер слайда 20
Заключение. Аллергия – это унаследованная сверхчувствительность к некоторым веществам окружающей среды, действующим на человека через его иммунную систему. 52% опрошенных являются аллергиками. Больше всего аллергиков оказалось в возрастной категории 9-12 лет. Лидирует атопический дерматит и составил 35%. 44% с аллергией не борются. Чаще всего встречается пищевая аллергия 48%.
Аллергия – это унаследованная сверхчувствительность к некоторым веществам окружающей среды, действующим на человека через его иммунную систему. 52% опрошенных являются аллергиками. Больше всего аллергиков оказалось в возрастной категории 9-12 лет. Лидирует атопический дерматит и составил 35%. 44% с аллергией не борются. Чаще всего встречается пищевая аллергия 48%.
Номер слайда 21
Информационные ресурсы1. Всё об аллергии и иммунитете [Электронный курс]. URL: https://allergolife.ru/osnovnye-priznaki-i-simptomy-allergii/ 2. Лечим просто. Все о домашнем лечении. ( http://www.lechim-prosto.ru/lechenie-doma/neotlozhnye/allergiya)3. Studfiles.(https://studfiles.net/preview/5710901/page:3/)4. Лечим просто. Все о домашнем лечении. (http://www.lechim-prosto.ru/lechenie-doma/neotlozhnye/allergiya).5. Alergo. Live.ru. Все об аллергии и иммунитете.(https://allergolife.ru/osnovnye-priznaki-i-simptomy-allergii/).6. Я живу!Здорово!(http://ilive.com.ua/health/profilaktika-allergii_112281i16116.html)
Трудные вопросы диагностики и лечения аллергических заболеваний у детей. XVII Российский конгресс «Инновационные технологии в педиатрии и детской хирургии». Сателлитный симпозиум компании «Фармамед»
В рамках XVII Российского конгресса «Инновационные технологии в педиатрии и детской хирургии» (Москва, 25 октября 2018 г.) состоялся симпозиум, организованный компанией «Фармамед».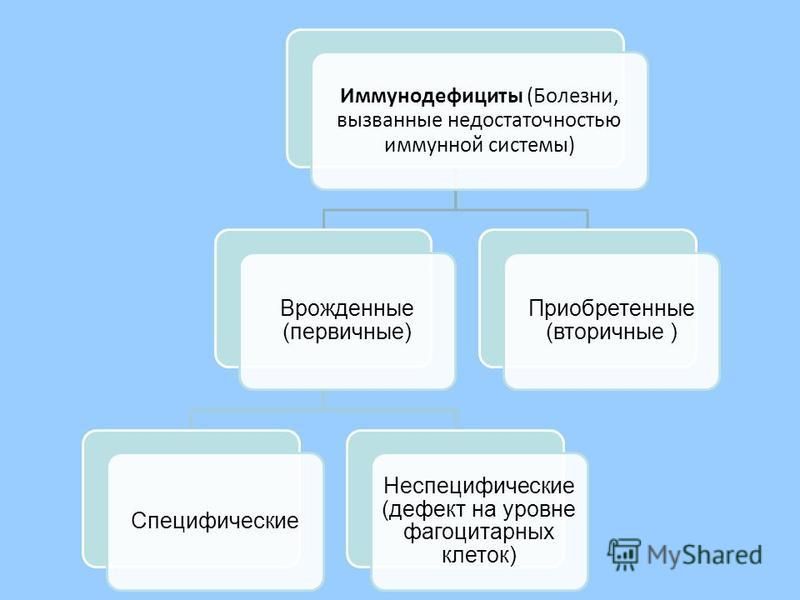 Эксперты обсудили наиболее значимые проблемы, касающиеся этиологии, патогенеза пищевой аллергии, диагностики и клинических проявлений аллергических заболеваний, особенно у детей раннего возраста.
Эксперты обсудили наиболее значимые проблемы, касающиеся этиологии, патогенеза пищевой аллергии, диагностики и клинических проявлений аллергических заболеваний, особенно у детей раннего возраста.
Профессор, д.м.н. В.А. Ревякина
Рис. 1. Средние показатели секреторного IgA у пациентов основной и контрольной групп
Рис. 2. Динамика микробиологических параметров (средние величины) в основной группе
Профессор, д.м.н. Д.Ш. Мачарадзе
К.м.н. Е.Д. Кувшинова
К.м.н. И.А. Ларькова
В.А. Мухортых
Новое в этиопатогенезе пищевой аллергии
Под пищевой аллергией понимают побочные реакции у сенсибилизированных лиц на пищевые продукты, обусловленные иммунологическими механизмами, преимущественно IgE-антителами. По словам заведующей отделением аллергологии ФИЦ питания и биотехнологии, д.м.н., профессора Веры Афанасьевны РЕВЯКИНОЙ, пищевая аллергия характеризуется полиморфизмом клинических симптомов. Не случайно с ней связано большинство кожных, респираторных и гастроинтестинальных проявлений.
Этиология и виды аллергенов
К этиологическим факторам пищевой аллергии относятся аллергены, содержащиеся в пищевых продуктах. Как правило, это белки с высокой молекулярной массой (10–70 кД). Чем выше молекулярный вес пептидов, тем выше аллергенность пищевого продукта1. Иммунная система распознает лишь небольшую часть молекулы белка (антигена), называемую эпитопом. Именно эпитоп связывается с соответствующими специфическими IgE-антителами.
В настоящее время в белковой молекуле выделяют конформационные и линейные эпитопы. Конформационные эпитопы нестабильны. При нагревании в процессе производства изменяется их пространственная конфигурация, что приводит к снижению аллергенности как эпитопов, так и собственно пищевых продуктов. Конформационные эпитопы, как правило, ответственны за транзиторную аллергию (коровье молоко, яйцо, соя, пшеница). Линейные эпитопы стабильны, их активность не снижается в процессе приготовления пищи. Они отвечают за длительную аллергию (рыба, арахис, лесные орехи).
При нагревании в процессе производства изменяется их пространственная конфигурация, что приводит к снижению аллергенности как эпитопов, так и собственно пищевых продуктов. Конформационные эпитопы, как правило, ответственны за транзиторную аллергию (коровье молоко, яйцо, соя, пшеница). Линейные эпитопы стабильны, их активность не снижается в процессе приготовления пищи. Они отвечают за длительную аллергию (рыба, арахис, лесные орехи).
Любой пищевой аллерген содержит несколько молекул (компонентов) с различными эпитопами. Одни эпитопы видоспецифичны, другие, несмотря на схожесть, относятся к разным семействам. Так, некоторые эпитопы пыльцы березы гомологичны эпитопам арахиса, лесных орехов и фруктов. Это проявляется таким феноменом, как перекрестная реактивность.
Результаты исследований, проведенных специалистами Центра питания и биотехнологии, показали, что ведущим пищевым аллергеном у детей является белок коровьего молока (БКМ). Второй по значимости пищевой аллерген – горох и томаты. БКМ подразделяются на сывороточные (альфа-лактоальбумин, бета-лактоглобулин, бычий сывороточный альбумин, иммуноглобулин), на долю которых приходится 20%, и казеины (αs1-, αs2-казеины, g1-, g2-, g3-казеины и др.) – 80%.
Конформационные эпитопы сывороточных белков обычно разрушаются при нагревании или ферментативном гидролизе (термолабильны). Линейные эпитопы казеинов более термостабильны, не расщепляются в желудке. Они ответственны за развитие системных реакций и длительной аллергии. При обычной промышленной переработке молока белки не удаляются, но их аллергенность частично снижается.
Как показали клинические исследования, 75% детей с IgЕ-опосредованной пищевой аллергией на коровье молоко хорошо переносят продукты, в состав которых оно входит (кексы, торты, хлеб, вафли). Следовательно, включение таких продуктов в рацион питания может ускорить развитие у детей толерантности к коровьему молоку. По данным S.A. Leonard и соавт.2, введение в рацион ребенка выпечки, содержащей молоко и куриное яйцо, ускоряет развитие толерантности к необработанному молоку и яйцу.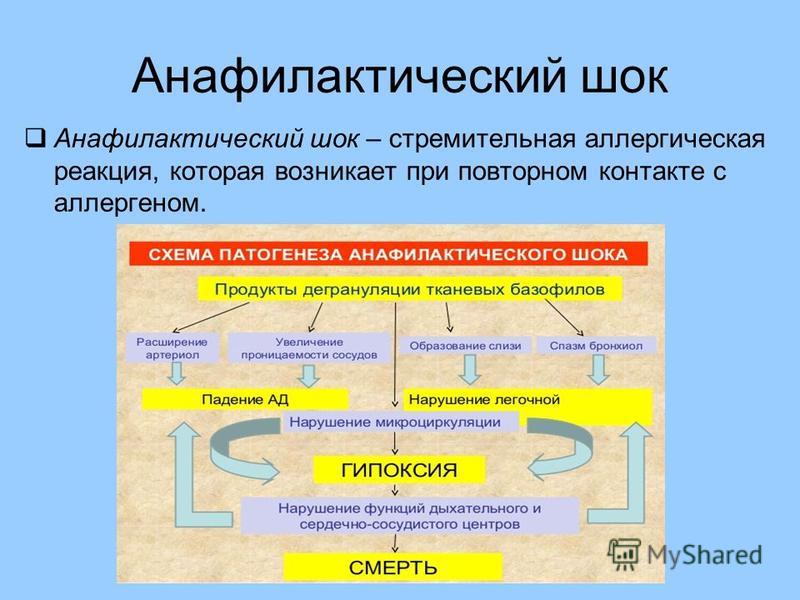 Меньше известно о кулинарной обработке молока при не-IgЕ-опосредованной аллергии на его протеины.
Меньше известно о кулинарной обработке молока при не-IgЕ-опосредованной аллергии на его протеины.
Развитие толерантности
Пищевая аллергия имеет вариабельное течение, с возрастом ее доминирующая роль снижается. В ряде исследований, посвященных оценке естественного течения аллергии к БКМ, за период наблюдения от шести месяцев до четырех лет развитие оральной толерантности отмечалось у 29% детей в возрасте 14–20 месяцев с IgE-опосредованной реакцией и у 74% – с не-IgE-опосредованной реакцией, за пятилетний период наблюдения – у 67% детей от года до восьми лет (98 месяцев) с IgE-опосредованной реакцией и у 86% – с не-IgE-опосредованной реакцией3.
Развитие клинических проявлений (начало и разрешение) при использовании молока у детей первого года жизни оценивали в ряде исследований, в том числе проведенных в США, Европе, Израиле, Португалии. Согласно полученным данным, ультрапастеризованное молоко может безопасно применяться перед введением сырого молока. Включение ультрапастеризованного молока в рацион питания способно ускорить развитие толерантности к сырому молоку.
Аналогичные исследования проводились и в отношении клинических симптомов (начало и разрешение) при употреблении яйца, сои, пшеницы, арахиса. Согласно полученным данным, употребление в пищу ультрапастеризованного яйца способствовало развитию толерантности к нему у 50% детей к шестилетнему возрасту. При включении в диету переработанной сои и пшеницы толерантность развивалась к шести-семи годам в 45–50% случаев при более высоких показателях IgE. И лишь у небольшого количества детей (10–22%) формировалась толерантность к арахису.
Какова хронология возникновения клинических симптомов пищевой аллергии? Реакция, возникающая менее чем через 15 минут, проявляется оральным аллергическим синдромом, в течение 15–60 минут – в виде крапивницы, астмы, анафилаксии, в течение 30–60 минут – болью в животе, тошнотой и рвотой.
Терапия пищевой аллергии
Современный алгоритм терапии пищевой аллергии включает элиминацию причинно-значимых пищевых аллергенов, неспецифических факторов, проведение противовоспалительной фармакотерапии, направленной на достижение контроля за течением пищевой аллергии. Что касается аллергенспецифической иммунотерапии, пока достаточной доказательной базы ее эффективности у пациентов с пищевой аллергией нет.
Что касается аллергенспецифической иммунотерапии, пока достаточной доказательной базы ее эффективности у пациентов с пищевой аллергией нет.
Диетотерапия – основа комплексного лечения детей. Она подразделяется на элиминационную (исключение причинно-значимых аллергенных продуктов), гипоаллергенную (исключение причинно-значимых и продуктов с высоким аллергенным потенциалом) и ротационную (чередование продуктов каждые два – четыре дня). При пищевой аллергии назначают антигистаминные препараты, пероральные формы кромогликата натрия, особенно при резистентных формах, кетотифен (у детей раннего возраста), пробиотики, энтеросорбенты, анти-IgE-препараты, препараты симптоматической терапии.
Как известно, частота дисбиотических нарушений у детей с пищевой аллергией достигает 94%. Не случайно в схему лечения для коррекции нарушений кишечной микробиоты вводят пробиотики с доказанной эффективностью: Bifidobacterium longum, Bifidobacterium lactis, Lactobacillus rhamnosus, Lactobacillus casei, Lactobacillus reuteri, а также Saccharomyces boulardii.
Мультиштаммовый пробиотик нового поколения Бак-Сет Беби (Великобритания), содержащий семь видов полезных бактерий и пребиотик, предназначен для детей с рождения (одно саше один раз в день). Мультипробиотик Бак-Сет Форте содержит 14 видов полезных бактерий и предназначен для детей с трех лет (одна капсула в день).
К слову сказать, препарат Бак-Сет, который используется у детей с высоким риском атопии в целях коррекции гастроинтестинальных проявлений пищевой аллергии, получил награду королевы Великобритании Елизаветы II.
В исследовании, проведенном в Центре питания и биотехнологии, у детей на фоне применения мультипробиотика Бак-Сет существенно снижалось содержание эозинофильного катионного протеина – маркера аллергии, а также уровень эозинофильного нейротоксина по сравнению с группой контроля. Кальпротектин у большинства детей оставался в норме.
Положительная динамика наблюдалась и в отношении показателей IgA: среднее значение секреторного IgA (sIgA) в основной группе на фоне терапии мультипробиотиком увеличилось более чем в два раза по сравнению с исходным и аналогичным показателем в группе контроля (рис. 1). Оценка динамики микробиологических показателей у больных основной группы продемонстрировала увеличение содержания лактобацилл и бифидобактерий (рис. 2).
1). Оценка динамики микробиологических показателей у больных основной группы продемонстрировала увеличение содержания лактобацилл и бифидобактерий (рис. 2).
Установлено, что пробиотики эффективны в предупреждении экземы. Кроме того, Lactobacillus reuteri оказывает профилактический эффект в отношении атопического дерматита (АтД): кумулятивная частота АтД к шестимесячному возрасту достоверно ниже у детей, матери которых во время беременности получали рекомендуемый рацион питания и пробиотик Lactobacillus reuteri.
Энтеросорбенты также используются в схемах лечения пищевой аллергии, особенно при кожных проявлениях. Они выводят из организма аллергены, продукты неполного ферментативного расщепления, биологически активные вещества, патогенные, условно патогенные микроорганизмы и вирусы.
Завершая выступление, профессор В.А. Ревякина констатировала, что при выборе терапии пищевой аллергии у детей необходимо учитывать этиологические факторы и особенности патогенетических механизмов. При этом первоочередными остаются элиминация причинно-значимых аллергенов с диетической коррекцией и медикаментозное лечение с использованием препаратов, влияющих на разные звенья патогенеза.
Маски аллергических заболеваний у детей. Аллергия или не аллергия?
Как отметила профессор кафедры аллергологии и клинической иммунологии Российского университета дружбы народов, д.м.н. Дали Шотаевна МАЧАРАДЗЕ, специалисту в условиях рутинной практики часто приходится консультировать пациентов с гиперэозинофилией.
Гиперэозинофилия бывает первичной и вторичной. Наиболее частыми причинами вторичной, или реактивной неопухолевой гиперэозинофилии могут быть аллергические заболевания (аллергический бронхолегочный аспергиллез, реакции на лекарственные средства, астма и др.), паразитарные (стронгилоидоз, токсокароз, шистосомоз, филариоз), метаболические нарушения (гипокортицизм), иммунодефицитные состояния, аутоиммунные заболевания (дерматит Дюринга, буллезный дерматит). О наличии у ребенка гиперэозинофилии могут свидетельствовать снижение веса, температурная реакция, увеличение размеров печени и селезенки (требует консультации гематолога).
О наличии у ребенка гиперэозинофилии могут свидетельствовать снижение веса, температурная реакция, увеличение размеров печени и селезенки (требует консультации гематолога).
Если причины вторичной гиперэозинофилии установить не удается, необходимо провести тщательное обследование. На первом этапе выполняют общий и биохимический анализы крови, а также определяют уровни тропонина, IgE, IgG, IgA, витамина В12, триптазы. Кроме того, проводят рентгенографию грудной клетки, ультразвуковое исследование (УЗИ) брюшной полости, эхокардиографию (ЭхоКГ), анализ крови методом полимеразной цепной реакции (ПЦР), иммунофенотипирование.
Наличие идиопатической гиперэозинофилии служит основанием для назначения глюкокортикостероидов 1 мг/кг/сут в течение двух недель.
По словам профессора Д.Ш. Мачарадзе, уровень сывороточного общего IgE имеет низкую диагностическую специфичность. Его определяют в трех случаях: для исключения гипер-IgE-синдрома, назначения омализумаба, выявления аллергического бронхолегочного аспергиллеза.
Экстремально высокие уровни IgE могут также наблюдаться при АтД. Атопический дерматит – хроническое заболевание кожи, которое сопровождается сухостью и зудом, нередко развивается у детей через три месяца после рождения и имеет наследственную отягощенность.
Важно дифференцировать АтД от неонатальной эритродермии, которая проявляется у детей с шестинедельного возраста. Заболевание, маскирующееся под АтД, относится к первичным иммунодефицитам. Неонатальная эритродермия может иметь место при врожденных инфекциях, лекарственной аллергии, метаболических нарушениях, мастоцитозе и даже псориазе новорожденных.
Первичный иммунодефицит всегда сопровождается гипер-IgE-синдромом, синдромом Вискотта – Олдрича и нередко сопряжен с аллергическими проявлениями. Триада Вискотта – Олдрича представлена экземой, которая проявляется в течение первых недель жизни, тромбоцитопенией и рецидивирующими инфекциями. Экзема напоминает классический АтД, но может быть тяжелой и сопровождаться формированием корок, петехий, пурпуры.
Селективный дефицит IgA в 50% случаев также сопровождается экземой, астмой, конъюнктивитом, пищевой аллергией или аллергическим ринитом. У ребенка может развиться тяжелая анафилаксия при переливании IgA-содержащих продуктов крови. Целесообразно определять уровень IgА после четырех лет, поскольку до этого возраста показатели варьируются.
Основное отличие пищевой аллергии от других неблагоприятных реакций на продукты питания заключается в IgE-опосредованных и не-IgE-опосредованных механизмах. Побочные реакции на пищевые продукты могут быть вызваны метаболическими, фармакологическими или токсическими факторами. Пищевая аллергия не может быть причиной хронической астмы или аллергического ринита.
Нередко тесты, позволяющие выявлять антитела IgE к пище, не являются диагностическими. Золотым стандартом для подтверждения аллергии считается оральный провокационный тест. Согласно 111 проведенным провокационным тестам (44 ребенка), в пищевом рационе детей отсутствовали определенные продукты из-за положительных результатов других тестов, только в 7% случаев имела место истинная пищевая аллергия. Следовательно, 93% детей не употребляли в пищу безопасные для их здоровья продукты из-за неадекватной трактовки результатов теста.
Самая тяжелая форма пищевой аллергии – анафилаксия. Существует идиопатическая форма анафилаксии на ранее неопознанный аллерген. Нередко анафилаксия развивается на анизакиды, попадающие в организм с рыбой. Важным симптомом анафилаксии является острая боль в животе.
Тяжелая анафилаксия при попадании в организм яда пчел также может проявляться абдоминальной болью, требующей госпитализации. Истинную аллергию важно дифференцировать от системного мастоцитоза. Кровь на специфические антитела следует брать через три-четыре недели после укуса насекомых. Если тест отрицательный, надо проверить уровень триптазы.
Анафилаксия может сопровождать все аллергические заболевания. Существует так называемое правило двойки: если в первые два часа вовлеченными в процесс оказались три органа, имеет место анафилаксия.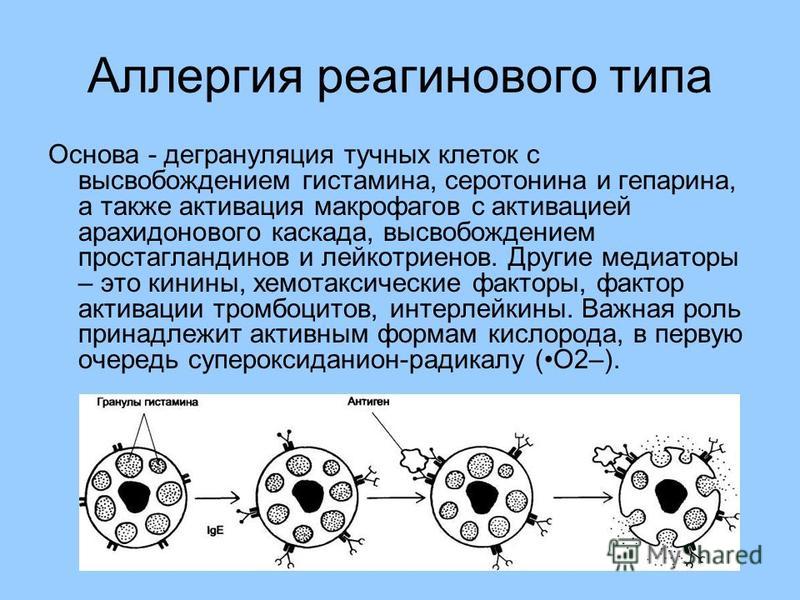 Пищевая анафилаксия через 20 минут после употребления креветок, сельдерея, хлеба может быть индуцирована физической нагрузкой.
Пищевая анафилаксия через 20 минут после употребления креветок, сельдерея, хлеба может быть индуцирована физической нагрузкой.
Не-IgE-опосредованная пищевая аллергия нередко маскируется под кишечные инфекции. Поэтому следует обращать внимание на подострые и хронические симптомы, которые могут свидетельствовать о пищевом происхождении, например синдром энтероколита, вызванный пищевым белком. Сильная рвота, летаргия, иногда гипотензия и ацидоз у детей часто наблюдаются через два часа после приема пищи.
Аллергический колит, проявляющийся слизисто-кровавым стулом, равно как и синдром энтероколита, требует определения пищевых аллергических триггеров.
При энтеропатическом акродерматите высыпания под глазами, вокруг рта и ануса сопровождаются диареей. В основе развития энтеропатического акродерматита лежит дефицит цинка. В случае когда определение содержания цинка затруднено, следует оценить уровень щелочной фосфатазы, поскольку цинк входит в состав этого фермента. Если уровень щелочной фосфатазы снижен, ребенку назначают препараты цинка.
Эозинофильный эзофагит широко диагностируется за рубежом у детей и взрослых и практически не диагностируется в нашей стране. Как правило, диагностика основана на клинических и патоморфологических данных. Клинические симптомы проявляются дисфагией, изжогой, рвотой, болью в животе. У новорожденных и детей до двух лет часто наблюдаются отказ от еды, рвота, срыгивания. Дети более старшего возраста жалуются на трудности глотания. Установлено, что эозинофильный эзофагит чаще встречается у лиц мужского пола с атопией.
Различают аллергическую и неаллергическую бронхиальную астму. Педиатров должно настораживать сообщение родителей о продолжительном кашле у ребенка в раннем возрасте в отсутствие симптомов простуды. Резюмируя сказанное, профессор Д.Ш. Мачарадзе подчеркнула, что в типичных случаях диагностика крапивницы не вызывает затруднений у клиницистов. Однако при атипичных проявлениях возникают сложности дифференциальной диагностики, обусловленные вариабельностью симптомов и недостаточной информированностью практикующих врачей о редких заболеваниях и синдромах, протекающих с классическими и атипичными уртикарными высыпаниями.
Больной с атопическим дерматитом и его питание
Атопический дерматит – хроническое аллергическое воспалительное заболевание, для которого характерны зуд, возрастная морфология высыпаний, стадийность. По словам старшего научного сотрудника отделения аллергологии ФИЦ питания и биотехнологии, к.м.н. Елены Дмитриевны КУВШИНОВОЙ, этому заболеванию свойственны возрастная эволюция клинической картины – от экссудативной до пруригинозной формы, а также цикличность и сезонность.
Выделяют три основных периода болезни.
Первый – младенческий (от ноля до двух лет) с экссудативной формой АтД. Как правило, на коже щек отмечается экссудация, возникают папулы, микровезикулы, которые вскрываются и образуют дерматозные колодцы, покрывающиеся серозными, а при присоединении вторичной гнойной инфекции – гнойно-геморрагическими корочками. В этом возрастном периоде иногда наблюдается эритематозно-сквамозная форма АтД без экссудации, но с очагами эритемы, эритематозными папулами, покрытыми корочками. В распространенной форме эти элементы воспроизводятся не только на коже лица, но также на шее и сгибательных поверхностях.
Второй период – детский (от двух до 13 лет). Характеризуется возникновением эритематозно-сквамозной формы с лихенизацией.
Третий период – подростковый и взрослый (старше 13 лет). Для него характерны наличие лихеноидной и пруригинозной форм АтД с признаками хронического аллергического воспаления.
Важно дифференцировать АтД от псориаза, чесотки, ихтиоза, микробной экземы, себорейного дерматита, пеленочного дерматита.
Пеленочный дерматит связан с недостаточным уходом за ребенком. Он проявляется в виде эритемы, отечности, уртикарной сыпи в области промежности, ягодиц и бедер. Зуд отсутствует.
Себорейный дерматит вызывается грибком Рityrosporum ovale. Для него характерны эритематозные очаги с фестончатыми краями, покрытые желтыми, жирными чешуйками. Локализация: волосистая часть головы, носогубные и паховые складки. Зуд слабый или отсутствует.
Зуд слабый или отсутствует.
Чесотка представляет собой паразитарное заболевание кожи, вызванное Sarcoptes scables. Заболевание проявляется зудящими папулами и везикулами, располагающимися линейно, попарно, с характерными чесоточными ходами и расчесами. Имеет место выраженный ночной зуд.
При микробной экземе часто наблюдается сенсибилизация к стрептококку и стафилококку. Характерны эритематозные очаги с четкими границами (1–3 см) насыщенного красного цвета. Локализация чаще асимметрична, на голени или носит распространенный характер. Зуд умеренный, начало заболевания в любом возрасте.
Ихтиоз – генодерматоз, который проявляется фолликулярным гиперкератозом, сухостью кожи, мелкопластинчатым и крупнопластинчатым шелушением, слабовыраженным зудом. Заболевание начинается в первые месяцы жизни ребенка.
Псориаз имеет аутоиммунную природу и может стартовать в любом возрасте. Он характеризуется наличием папул с быстрым образованием бляшек, покрытых серебристыми чешуйками, на волосистой части головы, в естественных складках кожи или местах трения.
Основным терапевтическим мероприятием при пищевой аллергии считается диетотерапия. Детям с пищевой аллергией назначается общая гипоаллергенная диета. Из пищевого рациона исключаются цельное коровье молоко, цитрусовые, манная крупа, оливки, рыба, шоколад, кофе, колбаса, клубника, малина, хрен, редька, баклажаны, уксус, горчица. Рекомендуется употреблять кисломолочные продукты без фруктовых добавок, из круп – гречку, рис, овсянку, овощи и фрукты светлой окраски, овощные супы.
Как известно, основными триггерами пищевой аллергии являются БКМ (казеин, бычий сывороточный альбумин альфа-лактальбумин, бета-лактоглобулин), яйцо (овальбумин, овомукоид, овотрансферрин, лизоцим), в злаках – глютен и белок сои. У детей первого года жизни с аллергией к БКМ, находящихся на смешанном и искусственном вскармливании, смеси на основе коровьего молока заменяются лечебными смесями на основе высокогидролизованных молочных белков.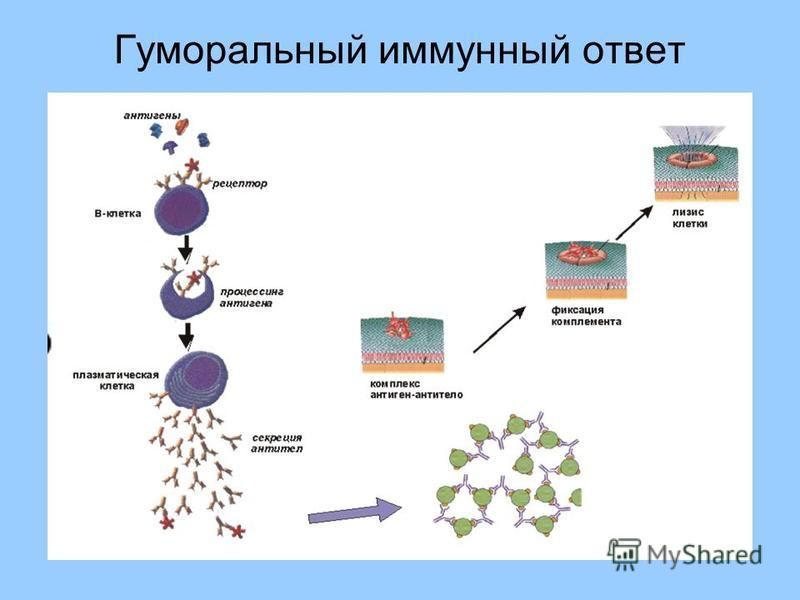 В зависимости от субстрата гидролиза они могут быть сывороточными и казеиновыми. Выбор по субстрату гидролиза определяется данными аллергологического обследования. При повышенной чувствительности к БКМ и сывороточным БКМ ребенку назначают казеиновые гидролизаты, при аллергии к казеину – сывороточные гидролизаты.
В зависимости от субстрата гидролиза они могут быть сывороточными и казеиновыми. Выбор по субстрату гидролиза определяется данными аллергологического обследования. При повышенной чувствительности к БКМ и сывороточным БКМ ребенку назначают казеиновые гидролизаты, при аллергии к казеину – сывороточные гидролизаты.
При неэффективности смеси на основе полного гидролиза применяются аминокислотные смеси. Абсолютным показанием к назначению аминокислотных смесей являются прежде всего тяжелый АтД с задержкой развития, гипоальбуминемия или железодефицитная анемия, желудочно-кишечные симптомы с хронической диареей, рвотой, отказом от еды, отставанием в физическом развитии, энтеропатией с потерей белка.
Кроме того, аминокислотные смеси назначаются детям с бронхиальной обструкцией или острым отеком гортани, обусловленными приемом молочных продуктов, а также при анафилаксии.
Лечебной диеты с исключением БКМ из пищевого рациона следует придерживаться в течение шести месяцев, а при наличии тяжелых реакций – не менее 12–18 месяцев. Максимальная продолжительность безмолочной диеты без повторного обследования не должна превышать 12 месяцев. Продукты, содержащие молочный белок, целесообразно вводить после контроля уровня специфических IgE-антител в крови, который обычно проводят спустя шесть месяцев от начала безмолочной диеты.
Смеси на основе изолята сои не являются продуктами первого выбора в остром периоде аллергии к БКМ. Они применяются у детей в возрасте старше шести месяцев при нетяжелых проявлениях аллергии к БКМ и отсутствии гастроинтестинальных нарушений и сенсибилизации к белку сои.
Современные представления об оптимальном формировании пищевой толерантности предполагают введение прикорма в возрасте от четырех до шести месяцев. Каждый новый продукт вводят постепенно, на его адаптацию отводится одна-две недели. Предпочтение отдается монокомпонентным продуктам. Новый продукт включается в пищевой рацион ребенка в минимальных количествах – не более 5 мл (г), предпочтительно в утреннее кормление, чтобы в течение дня можно было понаблюдать за реакцией. В отсутствие аллергической реакции объем продукта ежедневно увеличивается на 10–30 г в течение пяти – семи дней.
В зависимости от нутритивного статуса ребенка и характера стула первым прикормом обычно становится овощное пюре или безмолочная каша. При дефиците массы тела в качестве первого прикорма может быть введена безмолочная безглютеновая каша (гречневая, кукурузная, рисовая), затем вводятся овощи. С целью коррекции белковой части рациона меню ребенка расширяется за счет мясного пюре.
Безглютеновая диета, назначаемая детям с пищевой аллергией, подразумевает исключение из рациона овса, пшеницы, манной крупы, перловой крупы, ячменя, ржи, а также продуктов, содержащих глютен. Это мясопродукты (сосиски, сардельки), хлебобулочные продукты, конфеты, полуфабрикаты, кондитерские изделия, молочные продукты и глютенсодержащие добавки.
В основе современной диетотерапии лежит персонифицированный подход. Принципы современной диетотерапии заключаются в элиминации пищевого продукта только при строгой доказанности его аллергенности, с его полноценной заменой другим продуктом, не уступающим по питательной ценности и калорийности, и исключением из рациона продуктов с высоким аллергизирующим потенциалом (орехи, мед, морепродукты, цитрусовые, шоколад).
Диетотерапия должна обеспечивать все физиологические потребности организма в энергии, основных пищевых веществах, витаминах и минералах. При этом необходимо соблюдать квоту белка, количество жира не должно превышать 30% суточной калорийности рациона.
Гастроинтестинальные симптомы в практике аллерголога
По мнению старшего научного сотрудника отделения аллергологии ФИЦ питания и биотехнологии, к.м.н. Инны Анатольевны ЛАРЬКОВОЙ, сегодня в реальной клинической практике имеет место не только гипердиагностика клинически не значимых реакций на пищевые аллергены, но и гиподиагностика истинной пищевой аллергии. Гастроинтестинальные проявления долго не распознаются или оцениваются неадекватно.
Механизмы возникновения
В основе развития гастроинтестинальных проявлений пищевой аллергии лежат IgE-опосредованные и не-IgE-опосредованные аллергические реакции. К IgE-опосредованным гастроинтестинальным проявлениям пищевой аллергии относят оральный аллергический синдром, гастроинтестинальную анафилаксию, к клеточно-опосредованным – пищевой проктоколит, пищевой энтероколит, энтеропатию. Эозинофильный эзофагит, эозинофильный гастроэнтерит и колит развиваются вследствие сочетанных IgE-опосредованных и клеточных реакций.
Клинические варианты
Оральный аллергический синдром проявляется в любом возрасте зудом, першением, отеком в полости рта. Гастроинтестинальные симптомы стандартно характеризуются тошнотой, рвотой, болью в животе и диареей, вызванной приемом пищи. У детей раннего возраста имеют место беспокойство после еды, обильные срыгивания, отказ от еды.
При анафилаксии на фоне многосистемных реакций возникают гастроинтестинальные симптомы (тошнота, рвота, боль в животе, диарея).
Индуцированный пищей проктоколит манифестирует у детей первого года жизни и сопровождается наличием слизи и крови в стуле в отсутствие других симптомов.
Индуцированный пищевыми белками синдром энтероколита (БКМ, яйцо, соя, рис) чаще развивается у детей первого года жизни, с первого месяца. Синдром энтероколита сопровождается профузной или интермиттирующей рвотой, диареей, кровью и слизью в стуле, метеоризмом, метаболическим ацидозом, болью в животе, анемией, гипопротеинемией, отсутствием прибавки в весе, дегидратацией и гиповолемией. Может быть острым и хроническим.
Нередко при индуцированном пищевыми белками энтероколите в классическом варианте sIgЕ отсутствуют, в атипичном – выявляются. Дифференциальная диагностика затруднена, приходится исключать инфекционные заболевания желудочно-кишечного тракта (ЖКТ), паразитарные инфекции, иные проявления пищевой аллергии, дисахаридазную недостаточность, болезнь Гиршпрунга, инвагинации, гастроэзофагеальную рефлюксную болезнь (ГЭРБ), кишечную непроходимость, целиакию, воспалительные заболевания кишечника (ВЗК), наследственные нарушения обмена веществ.
Индуцированная пищевыми белками энтеропатия (БКМ, соя, яйцо, пшеница) зачастую манифестирует у детей младше девяти месяцев. Ее симптомы проявляются в виде рвоты, диареи, стеатореи, отсутствия прибавки в весе и росте, тошноты, метеоризма, крови в стуле, анемии. Отличительные особенности такой энтеропатии при морфологическом исследовании – поражение ворсинок, гиперплазия крипт. Индуцированную пищевыми белками энтеропатию необходимо дифференцировать от протеин-теряющей энтеропатии, аутоиммунной энтеропатии, дисахаридазной недостаточности, панкреатической недостаточности, первичного иммунодефицита, других проявлений пищевой аллергии, синдрома приобретенного иммунодефицита, лимфангиоэктазии кишечника, врожденной патологии эпителия, наследственных нарушений обмена веществ.
Эозинофильный эзофагит может встречаться во всех возрастных группах. Его клиническими признаками являются рвота, срыгивание, боль в животе, отказ от еды, дисфагия, ахалазия, снижение аппетита, чувство быстрого насыщения, стриктуры. Эозинофильный эзофагит дифференцируют от функциональных нарушений у детей раннего возраста, пороков развития, ГЭРБ.
Эозинофильный гастроэнтерит развивается в любом возрасте, чаще у взрослых. Его симптомы – боль в животе, рвота, тошнота, диарея, вздутие живота, асцит, потеря массы тела, анемия. Эозинофильный гастроэнтерит трудно дифференцировать от других проявлений пищевой аллергии (индуцированной пищевыми белками энтеропатии, энтероколита).
При проведении дифференциальной диагностики в ряде случаев приходится исключать инфекционный гастроэнтерит, паразитарные инфекции, другие проявления пищевой аллергии, ВЗК, системные заболевания, заболевания соединительной ткани, мастоцитоз, карциному, лимфому, аллергию на лекарственные препараты.
Считается, что эозинофильный колит чаще встречается у взрослых, однако множество работ свидетельствует о его наличии у детей раннего возраста. Он сопровождается болью в животе, диареей с кровью и слизью, потерей массы тела и анемией.
Эозинофильный колит может сочетаться с болезнью Крона, неспецифическим язвенным колитом и лимфоидным колитом. Его следует дифференцировать от инфекционного колита, паразитарных инфекций, ВЗК, других проявлений пищевой аллергии.
При эозинофильных заболеваниях в 50% случаев могут обнаруживаться специфические IgE к пищевым аллергенам. Тем не менее симптомы отсроченные. Пациенты наблюдаются как больные с гастропатологией. В течение нескольких дней могут возникать тошнота, рвота, боль в животе, но острые эпизоды тяжелой, повторяющейся рвоты или вялости не характерны.
Дифференциальная диагностика
Правильная трактовка характера диареи позволяет сузить круг дифференциально-диагностического поиска. Так, разжиженный пенистый стул с кислым запахом наблюдается при дисахаридазной недостаточности и глюкозно-галактозной мальабсорбции, водная диарея – при инфекциях и инвазиях, постинфекционном энтерите, дисахаридазной недостаточности, глюкозно-галактозной мальабсорбции, пищевой аллергии, дискинезии ЖКТ, при некоторых гормонпродуцирующих опухолях, мастоцитозе, хлоридной диарее, врожденной натриевой диарее.
Жирный стул имеет место при экзокринной недостаточности поджелудочной железы, патологии кишечника, в том числе целиакии, герпетиформном дерматите, постинфекционном энтерите, очень жирный стул с эпизодами выпадения слизистой оболочки прямой кишки с характерным запахом при выраженной экзокринной недостаточности поджелудочной железы – муковисцидозе и врожденной липазной недостаточности. Выраженная полифекалия, нередко проявляющаяся серым жирным стулом, характерна при целиакии, герпетиформном дерматите, энтеропатическом акродерматите, пищевой аллергии.
Дифференциальная диагностика гастроинтестинальной пищевой аллергии проводится с синдромом мальабсорбции при наследственной (10%) и приобретенной патологии.
Клинический случай
Больная Е., четыре года. Поступила в отделение аллергологии ФИЦ питания и биотехнологии с жалобами на постоянную ежедневную боль в животе, метеоризм, неустойчивый стул с примесью слизи (в том числе в большом количестве), реже с алой кровью, избирательный аппетит, умеренную заложенность носа. Из анамнеза: наследственность по аллергическим заболеваниям отягощена: у старшего родного брата – поллиноз, пищевая аллергия, с десяти лет – неспецифический язвенный колит, у дедушки по линии матери – аллергический ринит, у матери – синдром раздраженного кишечника.
Девочка от второй беременности (обе беременности разрешились оперативно). С рождения находилась на смешанном вскармливании молочной смесью (безлактозный НАН). Попытка ввести гидролизованную смесь не увенчалась успехом – ребенок от питания отказался, вследствие чего мать продолжила докорм молочной смесью. Прикорм был введен с восьми месяцев, поскольку при более раннем введении отмечались ухудшение стула и метеоризм. Прививки – БЦЖ в роддоме. Перенесенные заболевания – редко острые респираторные вирусные инфекции.
Первые проявления симптомов – с рождения в виде колик, снижения аппетита (отказ от еды), метеоризма, разжиженного стула со слизью, зеленью, затем – стула со склонностью к запорам. В полуторамесячном возрасте появилась кровь в стуле, что расценивалось как аллергия на БКМ. Кормящей матери назначили безмолочную диету, которую она соблюдала, но ребенку гидролизованную смесь ввести не удалось.
На первом году жизни кровь в стуле девочки отмечалась чаще, чем на втором. На третьем году жизни имел место всего один эпизод на фоне более редких симптомов метеоризма и боли в животе. В возрасте 3,6 года у ребенка вновь появились редкие эпизоды алой крови в стуле, метеоризм и боль в животе стали постоянными, запоры сменились неустойчивым стулом, эпизодически со слизью. Четкая связь между этими явлениями и использованием того или иного продукта не прослеживалась, но на фоне уменьшения приема молочной продукции после трех лет наблюдалось некоторое улучшение состояния.
У ребенка с рождения отмечались симптомы АтД. По словам матери, улучшение течения АтД наблюдалось на фоне применения антибиотиков. С ноября 2017 г. до момента госпитализации (в течение пяти месяцев) имела место ремиссия АтД. Кроме того, улучшение гастроинтестинальных симптомов (болевого синдрома, слизи, метеоризма) имело место на фоне антибактериальной терапии (Сумамед, Зиннат). Ухудшение было зафиксировано лишь на фоне применения Аугментина. Всего проведено 12 курсов антибактериальной терапии. Между тем у ребенка с одного года эпизодически отмечалась заложенность носа, в два месяца – повышенная сенсибилизация к молочному белку.
Пациентке Е. в возрасте 11 месяцев в ФИЦ питания и биотехнологии был поставлен диагноз «гастроинтестинальная форма пищевой аллергии». Рекомендаций специалистов о безмолочной диете мать придерживалась не всегда.
Поскольку симптомы сохранялись, в год два месяца девочке провели колоноскопию. Неспецифический язвенный колит исключен. Ребенок неоднократно проходил стационарное обследование (колоноскопия, эзофагогастродуоденоскопия (ЭГДС), определение уровня кальпротектина). Полученные данные не подтвердили наличие у ребенка ВЗК. При очередном обследовании в 3,6 месяца (колоноскопия) неспецифический язвенный колит и болезнь Крона исключены. Кроме того, анализ на наследственную аминоацидопатию, органическую ацидурию, нарушения митохондриального бета-окисления не дал положительного результата.
В отделении аллергологии Центра питания и биотехнологии проведено обследование. Общий анализ крови – без патологии, биохимический анализ крови – в пределах референсных значений, иммунологический анализ крови, в том числе уровень общего IgE, – в норме, сенсибилизация к БКМ, глютену, пшенице, мясу, яйцу, сое не обнаружена. УЗИ органов брюшной полости – дискинезия желчевыводящих путей, УЗИ почек – изменений не выявлено.
Анализ кала: стул неоформленный, умеренное количество крахмала, жирных кислот, слизи, дисбиоз, снижение количества бифидо- и лактобактерий, уровень кальпротектина и эластазы в норме. Анализ крови: антитела к сальмонеллам, шигеллам, псевдотуберкулезу, иерсиниозу, простейшим и гельминтам, сахаромицетам и аутоантитела pANCA не выявлены. Обеспеченность витамином D маргинальная. Учитывая анамнез пациентки, был проведен анализ кала на антигены токсина А и В Clostridium difficile. Результат положительный.
Диагноз: инфекция, вызванная C. difficile, пищевая аллергия, персистирующий аллергический ринит, АтД – стадия ремиссии, дисфункция билиарного тракта на фоне деформации желчного пузыря (перегиб тела).
Пациентке назначена безмолочная диета, по рекомендации инфекциониста проведены курсы терапии метронидазолом 30 мг/кг/сут в три приема, а также S. boulardii по одному порошку два раза в день в течение семи дней с последующим контролем на наличие токсинов. При наличии более двух рецидивов – длительное лечение ванкомицином. В дальнейшем – терапия мультипробиотиком Бак-Сет Форте.
C. difficile – грамположительная, спорообразующая, цитотоксинпродуцирующая бацилла, основным фактором риска развития которой является антибиотикотерапия и ВЗК. Инфекция способна мимикрировать и потенцировать симптомы пищевой аллергии. При появлении у пациента новых симптомов, повышении уровня кальпротектина, развитии анемии, гипопротеинемии, отставании в весе и росте, отсутствии эффекта от диетотерапии врачу следует пересмотреть диагноз и/или расширить диагностический поиск.
Трудный пациент в детской аллергологической практике. Клинические случаи
Как отметил сотрудник отделения аллергологии ФИЦ питания и биотехнологии Валерий Алексеевич МУХОРТЫХ, родители обычно обращаются с жалобами на метеоризм, срыгивание, колики, беспокойный сон, боль в животе, высыпания, отеки, неустойчивый характер стула у детей. Зачастую педиатры длительно не распознают гастроинтестинальные признаки пищевой аллергии, диагностируют функциональные нарушения ЖКТ, дисбактериоз кишечника, лактазную недостаточность. В связи с этим необоснованно отменяется грудное вскармливание, назначаются безлактозные, кисломолочные, соевые смеси, диета.
Клинический пример 1. Пациент Т., 12 месяцев. Срыгивание, метеоризм, неустойчивый стул (эпизодически разжиженный), высыпания на коже, сопровождающиеся зудом. Из анамнеза: наследственность по аллергическим заболеваниям отягощена – у отца реакция на пыль и лекарственная непереносимость, у сестры отца – АтД. Ребенок от первой беременности, протекавшей на фоне слабости родовой деятельности, родоразрешение путем кесарева сечения. Все при рождении – 4150 г, рост – 54 см, оценка по шкале Апгар – 8/9 баллов.
Исключительно на грудном вскармливании мальчик находился в течение первых двух недель, на смешанном – до 4,5 месяца, затем – на искусственном. Были перепробованы разные смеси, включая аминокислотные, которые ребенок получает по настоящее время. При введении прикорма с шести месяцев мать отмечала у ребенка удовлетворительную переносимость кабачков, при использовании остальных продуктов прикорма (даже в малых количествах) – высыпания. Высыпаниями проявилась и лекарственная аллергия. По профилактическим прививкам – медицинский отвод.
Первые проявления аллергии в виде частых срыгиваний, колик, метеоризма наблюдались с рождения и сохранялись до шести месяцев. С одномесячного возраста мать отмечала распространенные высыпания, без зуда, что расценивалось педиатром как аллергическая реакция на питание матери, которой была рекомендована строгая безмолочная диета. Однако мальчику назначали молочные смеси, которые из-за отсутствия положительной динамики как со стороны кожи, так и со стороны гастроинтестинальных проявлений постоянно менялись (одну молочную смесь заменяли другой). При переходе на гипоаллергенные смеси состояние ребенка ухудшалось.
В шесть месяцев ребенку назначили полный гидролизат, на фоне которого уменьшились и кожные, и гастроинтестинальные проявления. Через месяц отмечалось незначительное ухудшение состояния кожных покровов, в связи с чем педиатр рекомендовал заменить смесь на аминокислотную. Ее ребенок получает по настоящее время.
С одной стороны, на фоне приема данной смеси удалось полностью купировать кожные и гастроинтестинальные проявления, с другой – не представляется возможным расширить рацион питания, поскольку при попытках введения каш, мяса кожный процесс обостряется. В качестве прикорма ребенок получает только один продукт (кабачок).
В возрасте 7,5 месяца мальчика обследовали на дисбактериоз. Получал терапию бактериофагами, прошел курс ферментотерапии без положительного эффекта.
На момент поступления ребенка в отделение аллергологии ФИЦ питания и биотехнологии в его рационе присутствовали аминокислотная смесь и овощное пюре (кабачок). При осмотре: состояние средней степени тяжести, кожные покровы сухие, с распространенными эритематозными высыпаниями. Живот вздут, мягкий и безболезненный при пальпации. Стул регулярный, кашицеобразный, периодически со слизью.
Общий анализ крови – эозинофилия (11%), протеинограмма – снижение глобулиновой фракции (11,9 г/л при норме 20–25 г/л). В иммунологическом анализе крови снижены уровни иммуноглобулинов A, G, M, уровень IgЕ выше нормы (232 МЕ/мл, норма – 100 МЕ/мл). УЗИ органов брюшной полости – признаки вторичных изменений поджелудочной железы, S-образная деформация желчного пузыря. Специфические IgE-антитела к БКМ, глютенам, капусте белокочанной, баранине, кабачку, кролику, курице, гречке, рису – нулевой класс аллергии.
С учетом результатов анализа ребенка направили в НИИ иммунологии на консультацию врача-иммунолога. Подозрение на первичный иммунодефицит потребовало дообследования – контроль уровней иммуноглобулинов A, G, M через три месяца с последующим решением вопроса о дальнейшей тактике лечения.
В период госпитализации ребенка предпринимались попытки расширить рацион за счет мяса индейки, кролика, гречневой каши. Однако даже при использовании продуктов в малых дозах усиливались кожные и гастроинтестинальные проявления. Из-за подозрения на иммунодефицит ребенок должен наблюдаться в специализированном отделении. Расширение рациона возможно и на фоне проведения патогенетической терапии.
Клинический пример 2. Пациент Д., год четыре месяца. Поступил с жалобами на колики, вздутие живота, слабость, плохой сон, стул с непереваренными кусочками пищи и слизью, высыпания, не сопровождающиеся зудом. Из анамнеза: наследственность по аллергическим заболеваниям отягощена – у матери и ее родной сестры поллиноз. Ребенок от первой беременности, протекавшей физиологически, роды самостоятельные. Первый месяц жизни находился на грудном вскармливании, до года двух месяцев – на искусственном (Симилак). При введении прикорма в шесть месяцев реакций не отмечалось.
В год два месяца у ребенка появились жалобы на сильное вздутие живота. После обращения в больницу г. Ростова последовала госпитализация в инфекционное отделение с диагнозом «острый неуточненный энтероколит в тяжелой форме с токсико-эксикозом 1-й степени; дисферментоз». Со слов матери, на фоне лечения (три курса антибактериальных препаратов) состояние ухудшилось, вздутие живота усилилось, появился жидкий стул со слизью и непереваренными остатками пищи до 15 раз в сутки.
На фоне обезвоживания ребенок находился в отделении реанимации, где была продолжена антибиотикотерапия и проведена коррекция питания – смесь Симилак отменили. После отмены смеси стул нормализовался, вздутие живота уменьшилось, однако сохранялись примеси слизи и непереваренных остатков пищи. Была рекомендована коррекция питания. Тем не менее при использовании безмолочных каш и фруктов вздутие живота сохранялось.
ЭГДС показала умеренно выраженный дуоденит, при гистологическом исследовании фрагментов тощей кишки – хронический выраженный еюнит. Такая морфологическая картина характерна для синдрома мальабсорбции.
На фоне лечения (безмолочная диета с ограничением глютеновых продуктов, инфузионная терапия глюкозо-солевыми растворами с включением новокаина, Но-шпы, преднизолона и дексаметазона, Макмирора, Креона, Эспумизана, Мотилиума) отмечалась положительная динамика – вздутие живота уменьшилось, ребенок стал спокойнее, прибавил 500 г, стул кашицеобразный со слизью и небольшим количеством непереваренной пищи.
Ребенка госпитализировали в отделение аллергологии ФИЦ питания и биотехнологии. При обследовании показатели общего и биохимического анализов крови в норме, уровень общего IgA – 13 МЕ/мл. УЗИ органов брюшной полости выявило признаки дискинезии желчевыводящих путей, вторичных изменений поджелудочной железы. С помощью экспресс-теста (Celiac-test) обнаружены положительные антитела IgA к трансглутаминазе. При аллергообследовании уровня специфических IgE к пищевым аллергенам сенсибилизация к БКМ, глютену не выявлена.
ЭГДС с биопсией тонкой кишки: структура слизистой оболочки тощей кишки характерна для нелеченой целиакии – имела место полная атрофия кишечных ворсинок с гипертрофией крипт, несколько увеличено число межэпителиальных лимфоцитов, в собственной пластинке повышенное содержание лимфоцитов и плазматических клеток. Заключение: целиакия, острая стадия.
Ребенку назначена пожизненная безглютеновая диета с введением в рацион молочных продуктов. Через месяц при контрольном осмотре на фоне строгой аглютеновой диеты родители отмечали значительное улучшение состояния ребенка: колики не беспокоили, стул стал ежедневным, вздутие живота уменьшилось.
Клинический пример 3. Пациент С., семь лет. Поступил с жалобами на периодическую боль в животе, срыгивание, рвоту, метеоризм, неприятный запах изо рта, изменения в копрограмме (стеаторея). Из анамнеза: наследственность по аллергическим заболеваниям отягощена – у отца пищевая аллергия, лактазная недостаточность, у бабушки – бронхиальная астма. Мальчик от первой беременности, протекавшей с угрозой прерывания. Мать до 20 недель беременности получала гормонотерапию. Ребенок находился на грудном вскармливании в течение первых трех недель, затем – на искусственном. Прикорм вводился с пяти месяцев.
У ребенка с года отмечались жалобы на колики, неоформленный стул со слизью и непереваренными остатками пищи, выраженную стеаторею, метеоризм, что расценивалось педиатром как синдром мальабсорбции. Мальчику неоднократно заменяли одну молочную смесь другой. Ферментотерапия – без положительного эффекта. В двухмесячном возрасте ребенка перевели на вскармливание гидролизатами, проявления со стороны ЖКТ сохранялись. В девять месяцев на фоне сохранения гастроинтестинальных проявлений, стеатореи ребенка впервые обследовали на муковисцидоз. Потовая проба отрицательная. Был также исключен диагноз целиакии, синдром Швахмана – Даймонда.
Со слов матери, состояние улучшилось на фоне приема ферментов. Их отмена сопровождалась ухудшением состояния, проблемами со стулом (разжиженный, со слизью, пенистый). Ребенка неоднократно госпитализировали в разные стационары с синдромом мальабсорбции, где исключались неспецифический язвенный колит, болезнь Крона. Пищевая аллергия не диагностирована. Только в пять лет ребенок впервые попал к аллергологу. Проведено аллергологическое обследование: специфические IgE к различным продуктам (БКМ, гречиха, свинина, картофель, груша, желток, кролик, капуста) не выявлены. Однако аллерголог принял решение о назначении безмолочной диеты. На фоне ее применения жалобы разной интенсивности сохранялись.
Мальчика направили на консультацию в отделение аллергологии ФИЦ питания и биотехнологии. При обследовании выявлен повышенный уровень IgE – 303 МЕ/мл. УЗИ органов брюшной полости: признаки дискинезии желчевыводящих путей, вторичных изменений поджелудочной железы. При исследовании сыворотки крови на уровень специфических IgE-антител к пищевым аллергенам установлена высокая степень сенсибилизации к глютену. Сенсибилизация к коровьему молоку, гречке, рису, индейке, баранине, свинине, кролику не выявлена.
На основании результатов анализа ребенку назначили диагностическую безглютеновую диету в течение месяца с постепенным введением в рацион молочных продуктов. Через месяц при контрольном осмотре на фоне строгой безглютеновой диеты родители отмечали значительное улучшение: колики не беспокоили, стул стал ежедневным без патологических примесей. Было рекомендовано продолжить безглютеновую диету до полугода.
Следует отметить, что в этой семье у полуторагодовалого младшего брата с выраженными проявлениями АтД и небольшими гастроинтестинальными симптомами (неустойчивый стул) мать самостоятельно исключила из пищевого рациона глютен и наблюдала выраженный положительный эффект.
Клинический пример 4. Пациентка Е., три года. Периодические высыпания, сопровождающиеся кожным зудом. Ребенок от второй беременности, протекавшей физиологически. До четырех месяцев – грудное вскармливание, затем искусственное (молочные смеси). Прикорм вводился с пяти месяцев, переносимость удовлетворительная. Профилактические прививки проводились согласно национальному календарю. Наследственность по аллергическим заболеваниям отягощена: у родного брата эпизоды крапивницы, пищевая аллергия.
Первые проявления аллергии отмечались в возрасте одного месяца в виде мелкоточечных заболеваний, покраснений кожи на фоне гипоаллергенной диеты кормящей матери. В возрасте года четырех месяцев девочка перенесла острый энтероколит, вызванный Enterobacter aerogenes (подтвержденный бактериологически и клинически). Получала антибактериальную и симптоматическую терапию. Спустя две недели от начала терапии появилась пятнисто-папулезная сыпь.
В аллергологическом отделении диагностированы АтД, лямблиоз, синдром избыточного бактериального роста. Девочка получала антигистаминную наружную терапию (крем Унна, Циндол), антибактериальную (Хемомицин) и противогельминтную (Немозол) терапию. На фоне терапии постоянно менялся характер сыпи (появлялись герпетические высыпания, элементы вторичного инфицирования). При выписке домой на фоне отмены всех препаратов, за исключением антигистаминных, отмечалось улучшение. До лета 2017 г. выраженных обострений дерматита не наблюдалось. До марта 2018 г. находилась на строгой гипоаллергенной диете (безмолочной, безглютеновой) – без значимого эффекта.
При иммунологическом обследовании у ребенка выявлено снижение уровней Т-лимфоцитов, фагоцитоза, фагоцитарного числа, циркулирующих иммунных комплексов. В сентябре 2017 г. врач-иммунолог диагностировал врожденный иммунодефицит, снижение гуморального иммунитета. Девочка получала Имунофан, Полиоксидоний, Ликопид, Эриус с незначительной положительной динамикой. С января 2018 г. – постепенное расширение рациона за счет молочных продуктов, банана. Переносимость была удовлетворительной.
Состояние кожных покровов у ребенка ухудшается в весенне-летний период (с мая по сентябрь). Высыпания стадийны: в течение недели появляется гиперемия на коже, затем пузырь с жидким прозрачным содержимым, далее он лопается и наступает ремиссия. Локализация – на верхних и нижних конечностях. Кожный зуд, болезненность, высыпания горячие на ощупь.
В июне 2018 г. находилась на обследовании в отделении аллергологии клиники ФИЦ питания и биотехнологии. Выявлен 3-й класс аллергии к полыни. Через две недели после выписки из стационара и по настоящее время у ребенка имеют место полиморфные высыпания на коже, сопровождающиеся кожным зудом.
Последнее обострение наблюдалось в сентябре 2018 г. Девочка была госпитализирована в отделение аллергологии ФИЦ питания и биотехнологии. При комплексном обследовании у ребенка выявлен высокий уровень IgE – 776 МЕ/мл (норма до 100 МЕ/мл). УЗИ: признаки дискинезии желчевыводящих путей. Анализ на наличие вирусов методом ПЦР отрицательный. При исследовании уровня специфических IgE-антител к пищевым, бытовым, пыльцевым аллергенам выявлен 4-й класс аллергии к полыни. Точный диагноз не установлен, предположительный – атипичная реакция кожи на цветение полыни. Девочка находится под наблюдением специалистов.
Заключение
Многообразие клинических симптомов с широким спектром причинно-значимых аллергенов затрудняет диагностику и снижает эффективность терапии аллергических заболеваний у детей. Частота дисбиотических нарушений у детей с пищевой аллергией достигает 94%, поэтому оптимизация ведения таких пациентов предусматривает включение в схему терапии пробиотиков с доказанной эффективностью.
Мультиштаммовые пробиотики Бак-Сет Беби и Бак-Сет Форте зарекомендовали себя как эффективное и безопасное средство для коррекции нарушений кишечной микробиоты у детей разного возраста.
Бак-Сет Беби, содержащий семь видов бактерий и пребиотик, разрешен к применению у детей с рождения. Бак-Сет Форте, в состав которого входят 14 штаммов пробиотических бактерий, предназначен для коррекции нарушений стула и подавления атопических и воспалительных реакций у детей старше трех лет.
Пересекающийся синдром аллергии и иммунодефицита у детей
J Аллергия (Каир). 2012; 2012: 658279.
Александра Щавинска-Поплоник
Кафедра детской пневмонологии, аллергологии и клинической иммунологии, Познанский университет медицинских наук, ул. Шпитальна 27/33, 60-572 Познань, Польша
Кафедра педиатрической пневмонологии Иммунология, Познанский университет медицинских наук, улица Шпитальна 27/33, 60-572 Познань, Польша
Научный редактор: Мэри Бет Хоган
Поступила в редакцию 13 марта 2011 г .; Пересмотрено 15 мая 2011 г .; Принята в печать 10 июля 2011 г.
Copyright © 2012 Александра Щавинская-Поплоник.Это статья в открытом доступе, распространяемая по лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Эта статья цитируется в других статьях в PMC.Abstract
Рецидивирующие воспаления дыхательных путей у детей — важная клиническая проблема в педиатрической практике. Существенной проблемой является дифференциация между аллергическим фоном и иммунодефицитом, что является сложной задачей, учитывая индивидуальную предрасположенность к атопии, созревание иммунной системы в раннем детстве, а также экспозицию к аллергенам окружающей среды и микробным антигенам.В этой статье обсуждалась взаимосвязь между отдельными элементами врожденного и адаптивного иммунитета, такими как рецепторы распознавания образов, компоненты комплемента, дендритные клетки, а также иммуноглобулины и регуляторные Т-лимфатические клетки. Особое внимание было уделено этим механизмам иммунного ответа, которые, в зависимости от настроек и времени активации, предрасполагают к аллергии или способствуют толерогенному фенотипу. В контексте многофакторной обусловленности врожденного и адаптивного иммунитета, определяющего конечный ответ, и ассоциации между аллергией и иммунодефицитом, эти явления следует рассматривать как патогенетически не исключающие, а как синдром перекрытия.
1. Введение
Развитие иммунного ответа в детстве — это динамический процесс, который начинается во внутриутробном периоде и распространяется во времени на месяцы и даже годы жизни ребенка. Физиологический феномен созревания иммунной системы, тип и время активации аллергенов и микробных антигенов в сочетании с генетической предрасположенностью к аллергии имеют решающее значение для определения проаллергического или толерогенного фенотипа. Клинически эти соображения особенно применимы к диагностическим и терапевтическим дилеммам, касающимся рецидивирующих воспалений дыхательных путей у детей, в которых основные вопросы касаются дифференциации между аллергией и иммунодефицитом.Установление диагноза является важной задачей, включая общие клинические проявления, взаимное влияние различных клинических образований, перекрывающиеся патологические механизмы аллергического фона и дефекты врожденного и адаптивного иммунного ответа, а также недостаточность факторов, играющих до сих пор неожиданную иммунорегуляторную роль.
2. Созревание иммунной системы
Физиологический феномен созревания иммунной системы, инициируемый в период развития плода, носит динамичный характер и распространяется во времени в течение первых месяцев и даже лет жизни ребенка.Следовательно, в неонатальном периоде в младенчестве и раннем детстве наблюдается дисфункция многих компонентов иммунной системы.
В неонатальном периоде значительная незрелость характеризует систему моноциты-макрофаги. Он заключается в снижении экспрессии костимулирующих молекул и снижении способности к дифференцировке в дендритные клетки, а также в слабой продукции IL-12 моноцитами [1]. Макрофаги проявляют пониженный ответ на IFN γ , пониженную активность при фагоцитозе [1] и нарушение внутриклеточного киллинга [2].
У новорожденных незрелость связана с функцией дендритных клеток. Это заключается в подавлении экспрессии костимулирующих молекул миелоидными (mDC) и плазматическими (pDC) дендритными клетками, дефектном созревании и синтезе цитокинов — IFN , γ и IL-12 в качестве ответа на сигнальные пути ниже взаимодействия Toll-подобных рецепторов. , в частности, молекулы TLR4, TLR9 и CD40, а также нарушение способности стимулировать иммунный ответ с помощью pDC. Предлагаемые механизмы для объяснения дисфункции неонатальных ДК включают внутреннюю незрелость, дефектное взаимодействие между дендритными клетками и Т-лимфоцитами, а также модулирующий эффект естественных регуляторных Т-клеток (nTreg).Эти клетки, играющие важную роль во время беременности и поддерживающие материнскую толерантность к плоду, присутствуют в большом количестве у новорожденных и имеют решающее значение для поддержания гомеостаза, иммунологической толерантности и предотвращения аутоиммунитета. Неонатальные nTregs проявляют свою иммуносупрессивную функцию за счет механизма взаимодействия между молекулами CTLA-4 и CD80 / CD86 на антигенпрезентирующих клетках и за счет секреции L-10 и TGF β [1].
Функциональные изменения неонатальных антигенпрезентирующих клеток могут, в свою очередь, привести к вторичным дефектам адаптивного ответа Т-клеток.У новорожденных возникает функциональная недостаточность Т-клеток, проявляющаяся в подавлении экспрессии комплекса TCR / CD3, молекул адгезии и лиганда CD40 (CD40L, CD154), нарушении цитотоксической активности CD8 + Т-клеток, а также снижении синтеза цитокинов. Экспрессия ряда цитокинов, играющих важную роль в иммунном ответе, таких как IL-4, IL-5, IFN , γ , TNF α и IL-12, является динамичным процессом, и их продукция увеличивается с возрастом возраст [3]. Ходж и др. продемонстрировали уменьшенное количество неонатальных Т-лимфатических клеток и NK-клеток, демонстрирующих экспрессию β цепи рецептора IL-2.Более того, уровень продукции цитокинов, таких как IL-1 α , IL-1 β и TNF α , был ниже по сравнению со взрослыми, что указывает на снижение способности вызывать эффективный воспалительный ответ. Напротив, уровень и кинетика экспрессии других функциональных молекул — CD71, HLA-DR; и CD152 — были сопоставимы с таковыми у взрослых [4].
Преобладание Th3-зависимого иммунного ответа, преобладающего во внутриутробном периоде и расширяющегося в неонатальном периоде и младенчестве [5-7], может быть среди прочего результатом проявленной активности регуляторных Т-клеток, подавляющих провоспалительный Th2-опосредованный ответ. [8].Более того, механизмы врожденного иммунного ответа, определяющие развитие адаптивного ответа на благоприятный Th2- или Th3-опосредованный иммунитет, вносят вклад в предрасположенность или в защиту от астмы и аллергии. Доза, параметры и время воздействия антигенов имеют решающее значение для модуляции профиля иммунного ответа в раннем возрасте ребенка [9, 10].
Незрелость эффекторных механизмов и подавляющая активность материнских антител IgG, передаваемых через плаценту, способствуют последующему дефициту специфического гуморального ответа [5].У новорожденных быстрое увеличение иммуноглобулина М, активного в первичном иммунном ответе на антигены, относительно высокая концентрация IgG материнского происхождения и слабая продукция собственных иммуноглобулинов IgG и IgA ребенка проявляются как дисгаммаглобулинемия и отражают отчетливую динамику синтеза различных изотипов. У младенцев между вторым и шестым месяцами жизни гипогаммаглобулинемия продолжается в результате все еще слабой собственной продукции и распада материнского иммуноглобулина G. Задержка созревания гуморального ответа часто проявляется в виде транзиторной гипогаммаглобулинемии младенчества (THI), которая обычно ослабевает до конец второго года жизни [11], но может быть продлен даже до пятого или шестого года жизни [12] и до сих пор оценка, если иммунный дефект у ребенка временный или сигнализирует о постоянном первичном иммунном дефицит, может быть сложно.В недавнем исследовании Keles et al. [13], оценивая клинические и иммунологические особенности детей с THI, астма была ведущей проблемой со здоровьем, присутствующей у 52% пациентов.
3. Аллергические заболевания, сосуществующие с иммунодефицитом
3.1. Дефекты продукции антител
На клиническую проблему сопутствующего возникновения аллергических заболеваний и первичного иммунодефицита у детей обратил внимание Клемола, который сообщил о симптомах атопических заболеваний у 50% детей с селективным дефицитом IgA (sIgAD) [14].Интересно, что была отмечена лучшая корреляция между распространенностью и тяжестью клинического течения аллергических заболеваний у детей в течение первых двух лет жизни и более низкой нормальной концентрацией IgA в сыворотке, чем концентрация IgE, повышенная выше нормального значения для возраста [ 15]. В проспективном исследовании, оценивающем ту же группу детей в возрасте четырех лет, наблюдалась связь между возникновением аллергических заболеваний и астмой и снижением подкласса IgA и IgG4 в сыворотке, а также секреторного IgA слюны [16].Исследование Пападопулу выявило не только более высокую распространенность атопии в группе детей с селективным дефицитом IgA по сравнению с контрольной группой, но также указало на более частую сопутствующую гиперреактивность и гиперчувствительность бронхов к Dermatophagoides pteronyssinus у детей с sIgAD [17]. . Результаты исследования Kutukculer et al. [18] указали, что частичный дефицит IgA и дефицит подкласса IgG являются временными у 52% и 51% детей, соответственно, и что повышение сывороточных иммуноглобулинов до возрастных нормальных уровней происходит до шестого года жизни.Именно в этой группе детей атопические заболевания встречаются чаще, чем у детей с полным селективным дефицитом IgA (соответственно у 41% и 24% пациентов). Анализ корреляции между клиническими и иммунологическими фенотипами был проведен в недавнем отчете иранских авторов [19] о группе пациентов в возрасте 4–32 лет, в котором концентрация IgA ниже 62 мг / дл. Рецидивирующие воспаления дыхательных путей были наиболее частыми клиническими проблемами у 94% пациентов. Аллергические заболевания — астма, атопический дерматит, аллергический ринит и конъюнктивит были диагностированы у 84% пациентов, что свидетельствует о том, что не только предрасположенность к инфекциям, возникающим исключительно в результате иммунодефицита, но и аллергический фон существенно влияет на клинические проявления заболевания. .Интересно, что астматический фенотип присутствовал исключительно у пациентов с селективным дефицитом IgA, составляющих 62% исследуемой группы. Напротив, у 38% пациентов, которые страдали комплексным иммунодефицитом, состоящим из дефицита IgA, дефицита подкласса IgG, дефицита специфических антител к полисахаридным антигенам (sAbD) и инфекции дыхательных путей преобладали как клинические проявления и исключительно в этом В группе больных наблюдалась встречаемость бронхоэктазов.Moraes et al. [20] в исследовании группы из 41 ребенка с тяжелой астмой показали связь между степенью контроля астмы и рецидивирующими инфекциями дыхательных путей, а также недостатками иммунной системы. У детей с плохим контролем астмы чаще, чем у детей с достаточно контролируемой астмой (66% против 55% детей), диагностировали дефицит одного или нескольких подклассов IgG и дефицит IgG3 или IgG4, а также только в этой группе детей, a выявлен комбинированный дефицит подкласса IgA и IgG.
Отдельные сообщения в литературе, касающиеся селективного дефицита иммуноглобулина М (sIgMD) у детей и взрослых, указывают на рецидивирующие инфекции дыхательных путей как на преобладающую клиническую особенность. Аллергические заболевания и астма сосуществуют с этим иммунодефицитом у 7-8% пораженных детей [21] и до 33% взрослых пациентов [22].
Интересно, что связь между аллергическими заболеваниями и иммунодефицитом наблюдалась у пациентов с глубокими дефектами выработки антител.Шабестари и др. [23] сообщили о случае мальчика с агаммаглобулинемией Брутона, у которого концентрации основных классов иммуноглобулинов были снижены во всех изотипах, включая IgE (<0,1 МЕ / мл), B-лимфатические клетки, несущие антигены CD19 и CD20, составили менее 1%. нормального значения для возраста и заболевание подтверждено мутацией гена BTK . Рецидивирующие эпизоды респираторных инфекций с обструкцией нижних дыхательных путей были наиболее важными клиническими симптомами, и при дополнительных диагностических обследованиях были отмечены положительные кожные пробы с пищевыми и воздушными аллергенами, а также гиперреактивность бронхов при спирометрии.Смещение в сторону Th3-опосредованного иммунного ответа также было задокументировано у пациентов с общим вариабельным иммунодефицитом (CVID) посредством исследования уровней цитокинов и демонстрации увеличения продукции IL-4 и IL-10 [24]. Высокая частота астмы, обычно диагностируемая после первичного обращения, наблюдалась у 83% педиатрических пациентов с ОВИН, как сообщили Ogershok et al. [25].
3.2. Дефицит комплемента
Связь между аллергическим фоном респираторных симптомов и иммунными дефектами не ограничивается исключительно нарушением регуляции выработки иммуноглобулинов и нарушением баланса между компартментами лимфатических клеток Th2 и Th3.Эти явления также определяются активностью компонентов пути комплемента, устанавливая связи между врожденными и адаптивными иммунными ответами. Хотя каждый путь активируется различными рецепторами распознавания пути (PRR), все они завершаются активацией компонента C3, центрального шага в активации комплемента. Активация C3 приводит к образованию анафилатоксинов C3a и C5a, которые, связывая свои рецепторы с воспалительными клетками, вызывают патофизиологические признаки аллергического воспаления.В подтверждение этой проаллергической роли C3 его дефицит, как было показано на модели на животных, оказывает защитное действие против антиген-индуцированной гиперреактивности бронхов [26, 27]. C5a, в свою очередь, при аллергическом воспалении играет двойную роль, как стимулирующую, так и защитную, в зависимости от воспалительных клеток и цитокиновой среды после его активации. Иммунологическая роль компонента C5a состоит в основном в модуляции адаптивного иммунного ответа путем изменения фенотипа и функции антигенпрезентирующих дендритных клеток [28].Дефицит C5a приводит к сдвигу соотношения миелоидных дендритных клеток (mDC) к плазматическим дендритным клеткам (pDC) и последующему развитию Th3-зависимой эффекторной фазы. В этом состоянии недостатка C5a также происходит увеличение продукции Th3-специфических хемокинов, CCL17 и CCL22 легочными мДК, что усиливает самонаведение лимфатических клеток Th3 [29]. Нарушение иммунной толерантности является результатом дефектной стимуляции pDC и отсутствия индукции регуляторных Т-клеток, что подтверждает концепцию толерогенной роли C5a и защитного эффекта во время сенсибилизации аллергеном.Распознавание молекулярных паттернов, ассоциированных с паттерном (PAMP), приводит к активации пути комплемента лектиновыми белками. В группе детей-астматиков был обнаружен пониженный уровень маннозосвязывающего лектина (MBL), играющего важную роль в опсонизации [30]. Более того, была показана связь между аллельным вариантом гена MBL2 , приводящим к снижению концентрации MBL в сыворотке, и более высокому риску астмы у детей с рецидивирующей и хронической инфекцией Chlamydia pneumonia [31].У взрослых аллельный вариант MBL не только ассоциировался с предрасполагающим эффектом к астме, но также коррелировал со снижением функции легких [32].
Фиколины M, L и H (1, 2 и 3, соответственно), структурно сходные с коллектинами, MBL и поверхностно-активными белками A и D, инициируют лектиновый путь активации комплемента через сериновые протеазы MASP [33]. Cedzynski et al. сообщили о связи между относительной недостаточностью L-фиколина и рецидивирующими респираторными инфекциями, сосуществующими с астмой у детей [34].
Отображаются недостатки гуморальных врожденных и адаптивных иммунных ответов, связанные с проаллергическим эффектом.
Гуморальные дефекты врожденного и адаптивного иммунного ответа, связанные с проаллергическим эффектом.
3.3. Дефект фагоцитов
Fitzpatrick et al. [35] продемонстрировали нарушение фагоцитоза альвеолярных макрофагов у детей с плохо контролируемой астмой. Эти данные свидетельствуют о том, что функциональный дефицит врожденного иммунитета способствует нарушению антимикробного ответа и рецидивирующему воспалению дыхательных путей, приводящему к обострениям астмы.Этот феномен нарушенного фагоцитоза может быть объяснен альтернативным механизмом активации макрофагов, потенцируемой IL-4 в микроокружении Th3, где Varin et al. Наблюдали ингибирование фагоцитоза, связанное с дефектным образованием фагосом и сопутствующим повышенной секрецией провоспалительных цитокинов. [36].
4. Роль регуляторных Т-лимфоцитов
Природные Treg-клетки с фенотипом CD4 + CD25 + лучше всего характеризуются внутриклеточным маркером, фактором транскрипции Foxp3, играющим важную роль в развитии и активности этих клеток [37-40].Индуцируемые регуляторные Т-лимфатические клетки (iTreg, Tr1) возникают в результате активации зрелых Т-клеток в условиях отсутствия оптимального воздействия антигена или костимуляции, а также в среде ингибирующих цитокинов и характеризуются IL-10 и TGF . β производство. Наивные CD4 + Т-клетки могут также развиваться в клетки Tr1 в присутствии хронической стимуляции инфекционными аллергенами и опухолевыми антигенами. Однако подавляющая функция не является строго Treg-специфической, и все CD4 + Т-клетки проявляют подавляющую активность в разной степени.Показаны механизмы, определяющие типы иммунного ответа и их взаимосвязь в результате факторов транскрипции и активности цитокинов в отношении субпопуляций CD4 + Т-клеток.
Механизмы, определяющие типы иммунного ответа и их взаимосвязь в результате факторов транскрипции и активности цитокинов по отношению к субпопуляциям CD4 + Т-клеток.
Для Т-регуляторных лимфоцитов предлагаются следующие неисключительные функции: предотвращение аутоиммунитета путем установления и поддержания иммунологической толерантности к аутоантигенам, индукция материнской толерантности к плоду, индукция толерантности к пищевым антигенам и подавление патоген-индуцированной иммунопатологии. [38, 39].
При аллергических заболеваниях и астме активация CD4 + Т-клеток играет ключевую роль, а аллергическое воспаление в дыхательных путях опосредуется субпопуляциями эффекторных клеток Th3 и Th27. Регуляторные Т-клетки, как nTregs с фенотипом CD4 + CD25 +, так и антиген-индуцированные клетки Tr1, секретирующие IL-10, достигают своего регулирующего эффекта различными путями, подавляя активность дендритных клеток, подавляя эффекторные клетки Th3 и Th27, подавляя тучные клетки и базофилы, а также уменьшение миграции воспалительных клеток в ткани-мишени [41–44].Они также подавляют синтез IgE и стимулируют переключение класса на противовоспалительные изотипы — подкласс IgG4 и, в меньшей степени, на IgA. Индукция синтеза IgA определяется, прежде всего, активацией В-лимфоцитов через Toll-подобные рецепторы TLR9 и пути TLR7 [45]. Hartl et al. [46] сообщили о значительном снижении количества CD4 + CD25 + Т-клеток и более низкой концентрации цитокинов IL-10 и TGF β в жидкости бронхоальвеолярного лаважа астматиков по сравнению со здоровыми детьми.Аналогичным образом, у пациентов с симптомами атопических заболеваний Сайто [47] продемонстрировал меньшую долю клеток Foxp3 + CD4 +, чем у бессимптомных лиц в контрольной группе, имея аналогичные концентрации IFN , γ и IgE в сыворотке, а также количество эозинофилов в крови. . Эти вышеупомянутые данные свидетельствуют о том, что развитие симптомов аллергических заболеваний определяется взаимной взаимосвязью между подмножествами провоспалительных лимфатических клеток Th3 и Th27 и регуляторными Т-клетками. Недавно были продемонстрированы новые отдельные популяции эффекторных Т-хелперных клеток, вовлеченных в тканевое воспаление, а именно клетки Th9, характеризующиеся секрецией IL-9 и IL-10 [48], и клетки Th32 с секрецией IL-22 и низкими уровнями экспрессии IL. -17 [49, 50].
Дефицит регуляторных Т-клеток в результате мутации гена FOXP3 является важным фактором патогенеза синдрома IPEX (иммунная дисрегуляция, полиэндокринопатия, энтеропатия, Х-сцепленная) [51]. При ряде заболеваний, связанных с первичным иммунодефицитом, иммунологическая дисрегуляция может быть следствием функционального нарушения регуляторных Т-лимфоцитов и преобладающего Th3-зависимого иммунного ответа, как это было продемонстрировано у пациентов с общим вариабельным иммунодефицитом, заболеванием, предрасполагающим к аутоиммунитету [52, 53].Дефицит клеток Th27 является критическим иммунным нарушением при синдроме гипериммуноглобулина E (HIES), сложном иммунодефиците с множеством различных клинических проявлений, уникальной предрасположенностью к стафилококковым и микотическим инфекциям и гетерогенным генетическим происхождением. При аутосомно-доминантном синдроме гипер-IgE (AD-HIES) были продемонстрированы гипоморфные мутации в гене STAT3 (преобразователь сигналов и активатор транскрипции) [54], что приводит к нарушению дифференцировки клеток Th27 и нарушению передачи сигналов множественных цитокинов, что приводит к нарушению активации. антимикробных пептидов [55].Пациенты с аутосомно-рецессивным синдромом гипер-IgE (AR-HIES) из-за DOCK8 (выделитель цитокинеза 8) [56] или мутации гена Tyk2 (тирозинкиназа 2) [57] имеют общие черты HIES, такие как повышенное содержание сыворотки Концентрация IgE и эозинофилия, а также предрасположенность к стафилококковым и кандидозным инфекциям, однако, различный профиль инфекции и клинические особенности предполагают наличие отдельного заболевания.
Первичные иммунодефицитные состояния различного генетического фона, связанные с дисфункцией Т-клеток и аберрантной выработкой IgE, отображаются в.
Таблица 1
Первичные иммунодефициты и их генетический фон, связанные с дисфункцией Т-клеток и аберрантным продуцированием IgE.
| Первичный иммунодефицит с повышенным уровнем IgE | ||
|---|---|---|
| Дисфункция Т-клеток | Иммунодефицит | Генетический фон |
| Дефицит Treg-клеток, связанный с Treg-клетками | , иммунопатия (иммунопатия, X-лимфатическая регуляция) ) | Форкхед-бокс-белок 3 (Foxp3) преобразователь сигнала и активатор транскрипции 5b (STAT5b) CD25 |
| Дисфункция Treg-клеток | Синдром Вискотта-Олдрича (WAS) | Синдром Вискотта-Олдрича ( | белок синдрома Вискотта-Олдрича ()06 | Дефицит Treg-клеток Олигоклональность Т-клеток | Синдром Оменна (OS) | гены активации рекомбинации (RAG1, RAG2) Дзета-ассоциированный белок Artemis IL-7R, 70 кДа (ZAP-70,) ДНК-лигаза |
| Восстановленный NK клеточная цитотоксичность, искривленная фенотипом Th2 | Синдром Комеля-Нетертона (ЦНС) | Ингибитор сериновой протеазы Kazal type (SPINK) лимфоэп ингибитор ителиального типа Kazal (LEKTI) |
| Т-клеточная олигоклональность | Синдром ДиДжорджи (DGS) — атипичная полная форма | Микроделеция 22q11 |
| Уменьшение Th27-клеток Синдром Treg-клеточной дисфункции ) | Сигнальный преобразователь и активатор транскрипции 3 (STAT3), выделитель цитокинеза 8 (DOCK8), тирозинкиназа 2 (Tyk2) | |
5.Иммуномодулирующая роль рецепторов распознавания образов (PRR)
Toll-подобные рецепторы (TLR), а также рецепторы, индуцируемые ретиноидной кислотой, ген-I-подобные рецепторы (RLR) и рецепторы, подобные домену олигомеризации, связывающим нуклеотиды (NOD) (NLR), являются важнейшие элементы врожденного иммунитета, распознавание молекулярных паттернов, связанных с патогенами (PAMP), и молекулярных структур, специфичных для микробных патогенов. Они экспрессируются в различных клеточных компартментах, таких как клеточная поверхность, эндосома, лизосома или цитоплазма, и активируют специфические сигнальные пути, ведущие к экспрессии генов, которые адаптируют иммунные ответы к определенным микробам [58].Toll-подобные рецепторы TLR1, TLR2, TLR4, TLR6 и TLR10 обнаруживают сигнатуры, связанные с внеклеточными патогенами, в то время как TLR3, TLR7, TLR8 и TLR9 распознают лиганды, происходящие от внутриклеточных вирусных и бактериальных патогенов.
В лимфатических клетках B активация Toll-подобных рецепторов приводит к усилению регуляции маркеров активации, пролиферации, секреции цитокинов, терминальной дифференцировки и секреции иммуноглобулинов. Было продемонстрировано, что стимуляция TLR9 В-клеток с мотивами CpG индуцирует рекомбинацию переключения классов IgG (CSR).Этот эффект приводит к ингибированию IL-4 и CD40-зависимого переключения классов IgG1 / IgE и подавлению продукции IgE, а также одновременной стимуляции синтеза IgA [59].
Обширные взаимодействия и перекрестные помехи между TLR и другими поверхностными рецепторами являются характерной особенностью TLR [60]. И микробные антигены, и аллергены представляют собой важные триггерные факторы, влияющие на антигенпрезентирующие клетки и эффекторные клетки, участвующие в аллергических реакциях. Следовательно, вполне вероятно, что не отдельная, а сопутствующая стимуляция обоих типов рецепторов, а именно Toll-подобных рецепторов и высокоаффинного рецептора для IgE (Fc ε RI), может происходить в физиологических условиях и, в частности, в контексте аллергических и аллергических заболеваний. инфекционные заболевания.Потенциальная противорегуляция и взаимодействие TLR с иммунным ответом, опосредованным рецептором IgE, вместе с интегрированным сигналом от различных рецепторных сетей могут, следовательно, составлять механизмы, которые способствуют развитию аллергии [60].
Было продемонстрировано, что различные TLR, в частности TLR2 и TLR4, экспрессируются на тучных клетках, которые могут активироваться для секреции различных медиаторов и цитокинов с помощью IgE, а также специфических антигенов и продуктов, полученных либо от патогенов, либо от хозяина во время врожденного и адаптивного иммунные ответы [61, 62].В зависимости от типа лиганда TLR2 проявляет модулирующий эффект на Fc ε RI-опосредованную передачу сигналов и подавление Fc ε RI, а ослабление IgE-зависимой дегрануляции тучных клеток было продемонстрировано в контексте липотейхоевой кислоты [63]. Эти данные указывают на иммуномодулирующую функцию TLR2 тучных клеток в зависимости от стимулирующего бактериального продукта.
Интересно, что противорегуляция Fc , RI и TLR9 была продемонстрирована на плазматических дендритных клетках.Способность pDC высвобождать интерферон 1 типа (IFN- α и IFN- β ) после стимуляции TLR9 специфическими лигандами, неметилированными мотивами CpG существенно снижается после агрегации Fc ε RI и заражения аллергеном in vitro, что указывает на перекрестная связь также среди этих рецепторов, TLR9 и Fc ε RI [64]. Подводя итог, костимуляция эффекторных клеток на уровне TLR и Fc ε RI может привести к разнообразному конечному эффекту, будь то защитный или стимулирующий аллергический ответ, а также эффективные или нарушенные противомикробные иммунные ответы при определенных условиях.
6. Влияние витамина D на иммунные функции
Появляются новые доказательства роли витамина D не только в гомеостазе кальция и костей, но также в его плейотропном и иммуномодулирующем воздействии как на врожденный, так и на адаптивный иммунный ответ. Активная форма витамина D, 1,25 (OH) 2 D связывается с рецептором витамина D (VDR), ядерным рецептором и лиганд-активированным фактором транскрипции, экспрессируется во многих тканях и регулирует клеточную дифференцировку и функцию многих клеток. типы, включая иммунную систему.Экспрессия VDR обнаруживается, среди прочего, в макрофагах, дендритных клетках, NK-клетках, T-клетках и B-клетках. После активации VDR вызывает в этих клетках сильные антипролиферативные, продифференцирующие и иммуномодулирующие эффекты как на транскрипционно-зависимые, так и на независимые от транскрипции действия [65]. Витамин D подавляет функцию Т-лимфоцитов как напрямую, так и посредством воздействия на антигенпрезентирующие клетки, в частности, продуцирование Th2-ассоциированных цитокинов и выработку IL-17 лимфатическими клетками Th27, участвующими в аутоиммунных и аллергических процессах, включая астму.Эффект на Th3-опосредованный иммунный ответ более сложен, и отчеты указывают как на его ингибирование, так и на усиление [66]. Витамин D оказывает ингибирующее действие на дендритные клетки, подавляя экспрессию костимулирующих молекул CD40 и CD80 / 86, уменьшая секрецию иммуностимулирующего IL-12. Одновременно это приводит к увеличению выработки противовоспалительного IL-10 дендритными клетками и CD4 + CD25 + Treg-клетками.
Было обнаружено, что в дыхательных путях легких эпителиальные клетки экспрессируют высокие уровни 1альфа-гидроксилазы, фермента, активирующего витамин D.Также было показано, что кальцитриол ингибирует синтез и высвобождение определенных цитокинов, таких как RANTES (регулируется при активации, нормальные Т-клетки экспрессируются и секретируются), PDGF (тромбоцитарный фактор роста) и матриксные металлопротеиназы из гладкомышечных клеток бронхов, тем самым приводя к уменьшению воспаления и пролиферации гладкомышечных клеток [67]. Кроме того, на животной модели рецепторы витамина D были обнаружены в альвеолярных эпителиальных клетках плода II типа, которые, согласно последним данным, могут играть роль в индукции регуляторных Т-клеток [68].В нескольких клинических исследованиях изучалась связь витамина D с аллергией и астмой. В 2007 году два одновременно опубликованных отчета [69, 70] продемонстрировали более высокий риск рецидива хрипов у детей, рожденных от женщин с низким потреблением витамина D во время беременности. Brehm et al. [71] показали корреляцию между низким уровнем витамина D и маркерами тяжести астмы у детей, включая госпитализации, прием лекарств и гиперреактивность дыхательных путей.
Таким образом, было обнаружено, что витамин D действует как иммуномодулятор, влияющий на патологические механизмы противомикробного ответа и аллергии.В этом контексте дефицит витамина D можно рассматривать как состояние иммунодефицита, предрасполагающее к инфекциям дыхательных путей и снижению толерогенного фенотипа, влияющему на сложные взаимодействия между генетическими факторами и факторами окружающей среды, ведущими к развитию астмы.
7. Заключительные замечания
Многонаправленные взаимодействия и точный контроль элементов иммунного ответа определяют гомеостаз между эффекторными механизмами и толерантностью. Вышеупомянутые ассоциации между многочисленными элементами иммунной системы, врожденным, а также адаптивным иммунным ответом и механизмами, предрасполагающими к развитию аллергии, предполагают комплексное рассмотрение клинической проблемы рецидивирующих воспалений дыхательных путей у детей.Вышеупомянутые данные указывают на патогенетическую взаимосвязь между аллергией и иммунодефицитом, которая лучше, чем механизмы атопии, коррелирует с симптоматикой аллергических заболеваний у детей. Эти наблюдения, касающиеся в основном маленьких детей и младенцев, демонстрирующих преходящие нарушения иммунного ответа, указывают на задержку созревания иммунологических компонентов как на феномен решающей важности. Нарушение регуляции иммунного ответа, способствующее нарушению элиминации антигена в раннем детстве предрасположенного человека, может рассматриваться как критический фактор риска, предшествующий развитию аллергии.Иммунодефицит и аллергия имеют взаимное влияние и, таким образом, не исключают явления, но должны рассматриваться как специфический синдром перекрытия.
Ссылки
1. Велилья PA, Rugeles MT, Chougnet CA. Нарушение функции антигенпрезентирующих клеток у новорожденных. Клиническая иммунология . 2006. 121 (3): 251–259. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2. Сайто Ф., Кувата Х., Оики Э. и др. Неэффективное созревание фагосом в детских макрофагах. Сообщения о биохимических и биофизических исследованиях .2008. 375 (1): 113–118. [PubMed] [Google Scholar] 3. Härtel C, Adam N, Strunk T, Temming P, Müller-Steinhardt M, Schultz C. Ответы цитокинов по-разному коррелируют с возрастом в младенчестве и раннем детстве. Клиническая и экспериментальная иммунология . 2005. 142 (3): 446–453. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Ходж С., Ходж Г., Флауэр Р., Хан П. Экспрессия лейкоцитов пуповинной крови функционально значимых молекул, участвующих в регуляции клеточного иммунитета. Скандинавский журнал иммунологии .2001. 53 (1): 72–78. [PubMed] [Google Scholar] 5. Морейн Б., Бломквист Г., Ху К. Иммунная реакция в неонатальном периоде. Журнал сравнительной патологии . 2007; 137 (1): S27 – S31. [PubMed] [Google Scholar] 6. Гаспарони А., Чиарделли Л., Аванзини А. и др. Возрастные изменения внутриклеточной продукции цитокинов Th2 / Th3, иммунопролиферативного ответа Т-лимфоцитов и активности естественных клеток-киллеров у новорожденных, детей и взрослых. Биология новорожденных . 2003. 84 (4): 297–303. [PubMed] [Google Scholar] 7.Котиранта-Айнамо А., Раутонен Дж., Раутонен Н. Несбалансированная секреция цитокинов у новорожденных. Биология новорожденных . 2004. 85 (1): 55–60. [PubMed] [Google Scholar] 8. Адкинс Б. Неоднородность в компартменте Т-лимфоцитов CD4 и вариабельность неонатального иммунного ответа. Текущие обзоры иммунологии . 2007. 3 (3): 151–159. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Бельдербос М., Леви О., Бонт Л. Врожденный иммунитет новорожденных в развитии аллергии. Текущее мнение в педиатрии .2009. 21 (6): 762–769. [PubMed] [Google Scholar] 10. Schröder NWJ. Роль врожденного иммунитета в патогенезе астмы. Текущее мнение в области аллергии и клинической иммунологии . 2009. 9 (1): 38–43. [PubMed] [Google Scholar] 11. Moschese V, Graziani S, Avanzini MA и др. Проспективное исследование детей с первоначальным диагнозом преходящей гипогаммаглобулинемии младенчества: результаты Итальянской сети первичного иммунодефицита. Международный журнал иммунопатологии и фармакологии .2008. 21 (2): 343–352. [PubMed] [Google Scholar] 12. Кутуккулер Н., Гулез Н. Исход пациентов с неклассифицированной гипогаммаглобулинемией в раннем детстве. Детская аллергия и иммунология . 2009. 20 (7): 693–698. [PubMed] [Google Scholar] 13. Келес С., Артак Х., Кара Р., Гоктюрк Б., Озен А., Рейсли И. Преходящая гипогаммаглобулинемия и неклассифицированная гипогаммаглобулинемия: сходства и различия. Детская аллергия и иммунология . 2010. 21 (5): 843–851. [PubMed] [Google Scholar] 14.Клемола Т. Дефицит иммуноглобулина А. Анналы клинических исследований . 1987. 19 (4): 248–257. [PubMed] [Google Scholar] 15. Ludviksson BR, Eiriksson TH, Ardal B, Sigfusson A, Valdimarsson H. Корреляция между концентрацией сывороточного иммуноглобулина A и аллергическими проявлениями у младенцев. Педиатрический журнал . 1992. 121 (1): 23–27. [PubMed] [Google Scholar] 16. Луовикссон Б.Р., Арасон Г.Дж., Тораренсен О., Ардал Б., Вальдимарссон Х. Аллергические заболевания и астма в отношении сывороточных иммуноглобулинов и иммуноглобулина А слюны у детей дошкольного возраста: последующее исследование на уровне сообщества. Клиническая и экспериментальная аллергия . 2005. 35 (1): 64–69. [PubMed] [Google Scholar] 17. Пападопулу А., Мермири Д., Таусани С., Трига М., Николайду П., Прифтис К.Н. Бронхиальная гиперчувствительность при селективном дефиците IgA. Детская аллергия и иммунология . 2005. 16 (6): 495–500. [PubMed] [Google Scholar] 18. Kutukculer N, Karaca NE, Demircioglu O, Aksu G. Повышение сывороточных иммуноглобулинов до возрастных нормальных уровней у детей с дефицитом подкласса IgA и / или IgG. Детская аллергия и иммунология .2007. 18 (2): 167–173. [PubMed] [Google Scholar] 19. Агамохаммади А., Чераги Т., Гарагозлоу М. и др. Дефицит IgA: корреляция между клиническим и иммунологическим фенотипами. Журнал клинической иммунологии . 2009. 29 (1): 130–136. [PubMed] [Google Scholar] 20. Де Мораес Луи С., Оливейра Л.С., Диого С.Л., Киршфинк М., Грумах А.С. Концентрации подкласса иммуноглобулина G и инфекции у детей и подростков с тяжелой астмой. Детская аллергия и иммунология . 2002. 13 (3): 195–202.[PubMed] [Google Scholar] 21. Гольдштейн М.Ф., Гольдштейн А.Л., Дунский Э.Х., Дворин Д.Д., Белеканеч Г.А., Шамир К. Детский селективный иммунодефицит IgM. Клиническая иммунология и иммунология развития . 2008; 2008: 10 с. Идентификатор статьи 624850. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Йел Л., Рамануджа С., Гупта С. Клинические и иммунологические особенности дефицита игм. Международный архив аллергии и иммунологии . 2009. 150 (3): 291–298. [PubMed] [Google Scholar] 23. Шабестари М.С., Резаи Н.Астма и аллергический ринит у больного с дефицитом БТК. Журнал исследовательской аллергологии и клинической иммунологии . 2008. 18 (4): 300–304. [PubMed] [Google Scholar] 24. Rezaei N, Aghamohammadi A, Kardar GA, Nourizadeh M, Pourpak Z. Анализ цитокинов T-хелперов 1 и 2 у пациентов с общим вариабельным иммунодефицитом. Журнал исследовательской аллергологии и клинической иммунологии . 2008. 18 (6): 449–453. [PubMed] [Google Scholar] 25. Огершок П.Р., Хоган М.Б., Велч Дж. Э., Кордер В. Т., Уилсон Н. В..Спектр заболеваний у детей с общим вариабельным иммунодефицитом. Анналы аллергии, астмы и иммунологии . 2006. 97 (5): 653–656. [PubMed] [Google Scholar] 26. Друин С.М., Корри Д.Б., Кильдсгаард Дж., Ветсел Р.А. Передний край: отсутствие C3 демонстрирует роль комплемента в эффекторных функциях Th3 на мышиной модели легочной аллергии. Журнал иммунологии . 2001. 167 (8): 4141–4145. [PubMed] [Google Scholar] 27. Уолтерс Д.М., Брейсс П.Н., Скофилд Б., Уиллс-Карп М. Фактор комплемента 3 опосредует гиперреактивность дыхательных путей, вызванную твердыми частицами. Американский журнал респираторной клетки и молекулярной биологии . 2002. 27 (4): 413–418. [PubMed] [Google Scholar] 28. Köhl J, Baelder R, Lewkowich IP, et al. Регуляторная роль анафилатоксина C5a в иммунитете 2 типа при астме. Журнал клинических исследований . 2006. 116 (3): 783–796. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Köhl J, Wills-Karp M. Комплемент регулирует ингаляционную толерантность на границе дендритные клетки / Т-клетки. Молекулярная иммунология . 2007. 44 (1–3): 44–56.[PubMed] [Google Scholar] 30. Thórarinsdóttir HK, Lúdvíksson BR, Víkingsdóttir T, et al. Детские уровни иммуноглобулинов и маннан-связывающего лектина в отношении инфекций и аллергии. Скандинавский журнал иммунологии . 2005. 61 (5): 466–474. [PubMed] [Google Scholar] 31. Надь A, Kozma GT, Keszei M, Treszl A, Falus A, Szalai C. Развитие астмы у детей, инфицированных Chlamydia pneumoniae, зависит от модифицирующего действия лектина, связывающего маннозу. Журнал аллергии и клинической иммунологии .2003. 112 (4): 729–734. [PubMed] [Google Scholar] 32. Aittoniemi J, Soranummi H, Rovio AT и др. Полиморфизм гена связывающего маннозу лектина 2 (MBL2) при астме и атопии у взрослых. Клиническая и экспериментальная иммунология . 2005. 142 (1): 120–124. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Чжан XL, Али МАМ. Фиколины: структура, функции и сопутствующие заболевания. Успехи экспериментальной медицины и биологии . 2008; 632: 105–115. [PubMed] [Google Scholar] 34. Cedzynski M, Atkinson APM, Swierzko AS, et al.Недостаточность L-фиколина (фиколина-2) связана с сочетанием аллергических и инфекционных респираторных заболеваний у детей. Молекулярная иммунология . 2009. 47 (2-3): 415–419. [PubMed] [Google Scholar] 35. Фитцпатрик А.М., Ольгин Ф., Тиг В.Г., Браун ЛАС. Фагоцитоз альвеолярных макрофагов нарушается у детей с плохо контролируемой астмой. Журнал аллергии и клинической иммунологии . 2008; 121 (6): 1372–1378.e3. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Варин А., Мухопадхьяй С., Хербейн Г., Гордон С.Альтернативная активация макрофагов IL-4 ухудшает фагоцитоз патогенов, но усиливает индуцированную микробами передачу сигналов и секрецию цитокинов. Кровь . 2010. 115 (2): 353–362. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Лу Л.Ф., Руденский А. Молекулярная оркестровка дифференцировки и функции регуляторных Т-клеток. Гены и развитие . 2009. 23 (11): 1270–1282. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Cools N, Ponsaerts P, Van Tendeloo VFI, Berneman ZN. Регуляторные Т-клетки и болезни человека. Клиническая иммунология и иммунология развития . 2007; 2007: 10 с. Идентификатор статьи 89195. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Nandakumar S, Miller CWT, Kumaraguru U. T-регуляторные клетки: обзор и методы вмешательства для изменения исхода аллергии. Клиническая и молекулярная аллергия . 2009; 7, статья № 5 [Бесплатная статья PMC] [PubMed] [Google Scholar] 41. Финотто С. Регуляция Т-клеток при астматических заболеваниях. Химическая иммунология и аллергия . 2008; 94: 83–92. [PubMed] [Google Scholar] 42.Паломарес О., Яман Г., Азкур А. К., Аккоц Т., Акдис М., Акдис КА. Роль Treg в иммунной регуляции аллергических заболеваний. Европейский журнал иммунологии . 2010. 40 (5): 1232–1240. [PubMed] [Google Scholar] 43. Акдис К.А., Акдис М. Механизмы и лечение аллергических заболеваний в общей картине регуляторных Т-клеток. Журнал аллергии и клинической иммунологии . 2009. 123 (4): 735–746. [PubMed] [Google Scholar] 44. Akdis M, Blaser K, Akdis CA. Т-регуляторные клетки при аллергии. Химическая иммунология и аллергия .2006. 91: 159–173. [PubMed] [Google Scholar] 45. Meiler F, Klunker S, Zimmermann M, Akdis CA, Akdis M. Четкая регуляция IgE, IgG4 и IgA Т-регуляторными клетками и толл-подобными рецепторами. Аллергия . 2008. 63 (11): 1455–1463. [PubMed] [Google Scholar] 46. Хартл Д., Гриз М., Николай Т. и др. Легочные хемокины и их рецепторы различают детей с астмой и хроническим кашлем. Журнал аллергии и клинической иммунологии . 2005. 115 (4): 728–736. [PubMed] [Google Scholar] 47.Сайто Х. Основы для начала педиатрического клинического исследования (2): роль окружающей среды и иммунитета в развитии аллергических и иммунологических расстройств у детей. Журнал токсикологических наук . 2009; 34 (2): SP313 – SP319. [PubMed] [Google Scholar] 48. Адамсон А.С., Коллинз К., Лоуренс А., О’Ши Дж. Дж. Текущее состояние передачи сигналов лимфоцитами: новые роли для старых игроков. Текущее мнение в области иммунологии . 2009. 21 (2): 161–166. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Трифари С, Спиц Х.CD4 + Т-клетки, продуцирующие IL-22: посредники между иммунной системой и окружающей средой. Европейский журнал иммунологии . 2010. 40 (9): 2369–2371. [PubMed] [Google Scholar] 51. Ван дер Влит HJJ, Nieuwenhuis EE. IPEX в результате мутации в FOXP3. Клиническая иммунология и иммунология развития . 2007; 2007: 5 с. Идентификатор статьи 89017. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52. Жанр J, Errante PR, Kokron CM, Toledo-Barros M, Câmara NOS, Rizzo LV. Снижение частоты CD4 + CD25 HIGH FOXP3 + клеток и снижение экспрессии FOXP3 у пациентов с общим вариабельным иммунодефицитом: связь с аутоиммунитетом? Клиническая иммунология .2009. 132 (2): 215–221. [PubMed] [Google Scholar] 53. Мело К.М., Карвалью К.И., Бруно Ф.Р. и др. Снижение частоты регуляторных Т-клеток у пациентов с общим вариабельным иммунодефицитом. PLoS Один . 2009; 4 (7) Идентификатор статьи e6269. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Холланд С.М., ДеЛео Ф.Р., Эллуми Х.З. и др. Мутации STAT3 при синдроме гипер-IgE. Медицинский журнал Новой Англии . 2007. 357 (16): 1608–1619. [PubMed] [Google Scholar] 55. Милнер Дж. Д., Бренчли Дж. М., Лоуренс А. и др.Нарушение дифференцировки клеток Th27 у субъектов с аутосомно-доминантным синдромом гипер-IgE. Природа . 2008. 452 (7188): 773–776. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. Энгельхардт К.Р., МакГи С., Винклер С. и др. Крупные делеции и точечные мутации с участием выделителя цитокинеза 8 (DOCK8) при аутосомно-рецессивной форме синдрома гипер-IgE. Журнал аллергии и клинической иммунологии . 2009; 124 (6): 1289–1302.e4. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57.Минегиси Ю., Сайто М., Морио Т. и др. Дефицит тирозинкиназы 2 человека выявляет ее необходимые роли во множественных цитокиновых сигналах, участвующих в врожденном и приобретенном иммунитете. Иммунитет . 2006. 25 (5): 745–755. [PubMed] [Google Scholar] 60. Новак Н., Бибер Т., Пэн В.М. Сеть E-toll-подобных рецепторов иммуноглобулина. Международный архив аллергии и иммунологии . 2009. 151 (1): 1–7. [PubMed] [Google Scholar] 61. Галли С.Дж., Цай М. Тучные клетки при аллергии и инфекции: универсальные эффекторные и регуляторные клетки врожденного и адаптивного иммунитета. Европейский журнал иммунологии . 2010. 40 (7): 1843–1851. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62. Кумар В., Шарма А. Тучные клетки: новые сигнальные клетки врожденного иммунитета с разнообразной ролью в иммунитете. Молекулярная иммунология . 2010. 48 (1–3): 14–25. [PubMed] [Google Scholar] 63. Йошиока М., Фукуиси Н., Иригути С. и др. Липотейхоевая кислота подавляет экспрессию Fc и RI на тучных клетках человека через Toll-подобный рецептор 2. Journal of Allergy and Clinical Immunology .2007. 120 (2): 452–461. [PubMed] [Google Scholar] 64. Новак Н., Аллам Дж. П., Хагеманн Т. и др. Характеристика Fc ε RI-несущих CD123 + антиген-2 дендритных клеток крови + плазмацитоидных дендритных клеток при атопическом дерматите. Журнал аллергии и клинической иммунологии . 2004. 114 (2): 364–370. [PubMed] [Google Scholar] 65. Уокер В.П., Модлин Р.Л. Связь витамина D с детскими инфекциями и иммунной функцией. Педиатрические исследования . 2009; 65 (5): 106R – 113R.[Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Lange NE, Litonjua A, Hawrylowicz CM, Weiss S. Витамин D, иммунная система и астма. Экспертный обзор клинической иммунологии . 2009. 5 (6): 693–702. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Sandhu MS, Casale TB. Роль витамина D при астме. Анналы аллергии, астмы и иммунологии . 2010; 105 (3): 191–199. [PubMed] [Google Scholar] 68. Gereke M, Jung S, Buer J, Bruder D. Эпителиальные клетки альвеолярного типа II представляют антиген CD4 + T-клеткам и индуцируют Foxp3 + регуляторные T-клетки. Американский журнал респираторной медицины и реанимации . 2009. 179 (5): 344–355. [PubMed] [Google Scholar] 69. Камарго К.А., мл., Рифас-Шиман С.Л., Литонжуа А.А. и др. Потребление матери витамина D во время беременности и риск рецидивов хрипов у детей в возрасте 3 лет. Американский журнал клинического питания . 2007. 85 (3): 788–795. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70. Devereux G, Litonjua AA, Turner SW, et al. Потребление витамина D матерью во время беременности и при хрипах в раннем детстве. Американский журнал клинического питания . 2007. 85 (3): 853–859. [PubMed] [Google Scholar] 71. Брем Дж. М., Селедон Дж. К., Сото-Кирос М. Э. и др. Уровни витамина D в сыворотке и маркеры тяжести детской астмы в Коста-Рике. Американский журнал респираторной медицины и реанимации . 2009. 179 (9): 765–771. [Бесплатная статья PMC] [PubMed] [Google Scholar](PDF) АЛЛЕРГИЧЕСКИЕ ПРОЯВЛЕНИЯ ПЕРВИЧНЫХ ЗАБОЛЕВАНИЙ ИММУНОДЕФИЦИТА И ПОДХОДЫ К ЕГО ЛЕЧЕНИЮ
89
Asian J Pharm Clin Res, Vol 11, Issue 11, 2018, 83-90
Боярчук
29.Wu J, Chen J, Tian ZQ, Zhang H, Gong RL, Chen TX и др. Клинические проявления
и генетический анализ 17 пациентов с аутосомным синдромом
доминантного гипер-IgE в материковом Китае: новые отчеты и обзор литературы
. Дж. Клин Иммунол 2017; 37: 166-79.
30. Сигел А.М., Стоун К.Д., Круз Дж., Лоуренс М.Г., Оливера А., Юнг М.И.,
и другие. Уменьшение количества аллергических заболеваний у пациентов с мутациями STAT3
показывает роль передачи сигналов STAT3 в дегрануляции тучных клеток.J Allergy
Clin Immunol 2013; 132: 1388-96.
31. Hagl B, Heinz V, Schlesinger A, Spielberger BD, Sawalle-Belohradsky J,
Senn-Rauh M, et al. Основные результаты для ускорения диагностики синдромов гипер-
IgE у младенцев и детей раннего возраста. Pediatr Allergy Immunol
2016; 27: 177-84.
32. Минегиси Й., Сайто М., Морио Т., Ватанабе К., Агемацу К., Цучия С.,
и др. Дефицит тирозинкиназы 2 человека выявляет ее необходимые роли в
множественных сигналах цитокинов, участвующих в врожденном и приобретенном иммунитете.
Иммунитет 2006; 25: 745-55.
33. Килич С.С., Хаджимустафаоглу М., Буассон-Дюпюи С., Крейнс А.Ю., Грант А.В.,
Абель Л. и др. Пациент с дефицитом тирозинкиназы 2 без синдрома гипер-
IgE. Журнал Педиатр 2012; 160: 1055-7.
34. Крейнс А.Ю., Чианканелли М.Дж., Окада С., Конг XF, Рамирес-Алехо Н.,
Килич СС и др. Дефицит TYK2 человека:
микобактериальных и вирусных инфекций без гипер-IgE-синдрома. J Exp Med 2015; 212: 1641-62.
35. Битун Э., Чаванас С., Ирвин А.Д., Лони Л., Бодемер С., Парадизи М.
Синдром Нетертона: выражение заболевания и спектр мутаций SPINK5
в 21 семье. Дж. Инвест Дерматол 2002; 118: 352-61.
36. Столл С., Алембик Ю., Чомаков Д., Мессер Дж., Хейд Е., Бём Н.,
и др. Тяжелая гипернатремическая дегидратация у младенца с синдромом Нетертона
. Жене Коунс 2001; 12: 237-43.
37. Wang S, Olt S, Schoefmann N, Stuetz A, Winiski A, Wolff-Winiski B,
et al.Нокдаун SPINK5 в органотипической культуре кожи человека как модель
Системадля синдрома Нетертона: эффект генетического ингибирования серина
протеаз калликреина 5 и калликреина 7. Exp Dermatol 2014; 23: 524-6.
38. Komatsu N, Saijoh K, Jayakumar A, Clayman GL, Tohyama M,
Suga Y, et al. Корреляция между мутациями гена SPINK5 и клиническими проявлениями
у пациентов с синдромом Нетертона. Дж. Инвест Дерматол
2008; 128: 1148-59.
39.Овнанян А. Синдром Нетертона: воспаление кожи и аллергия из-за потери ингибирования протеазы
. Cell Tissue Res 2013; 351: 289-300.
40. Дефицит Hwa V. STAT5B: влияние на рост человека и иммунитет.
Growth Horm IGF Res 2016; 28: 16-20.
41. Hwa V, Nadeau K, Wit JM, Rosenfeld RG. Дефицит STAT5b: уроки
из мутаций гена STAT5b. Лучшая практика Res Clin Endocrinol Metab
2011; 25: 61-75.
42. Кламмт Дж., Нойманн Д., Геверс Э.Ф., Эндрю С.Ф., Шварц И.Д.,
Рокстрох Д. и др.Доминантно-отрицательные мутации STAT5B вызывают
нечувствительность к гормону роста, низкий рост и легкую иммунную дисрегуляцию
. Нац Коммуна 2018; 9: 2105.
43. Ел Л. Селективный дефицит igA. Дж. Клин Иммунол 2010; 30: 10-6.
44. Янзи М., Кулл И., Сьёберг Р., Ван Дж., Мелен Е., Баят Н. и др. Селективный
Дефицит IgA в раннем детстве: связь с инфекциями и аллергическими заболеваниями
в детстве. Clin Immunol 2009; 133: 78-85.
45.Эдвардс Э., Разви С., Каннингем-Рандлс С. Дефицит IgA: клинический
коррелирует и реагирует на пневмококковую вакцину. Clin Immunol
2004; 111: 93-7.
46. Aghamohammadi A, Cheraghi T., Gharagozlou M, Movahedi M,
Rezaei N, Yeganeh M, et al. Дефицит IgA: корреляция между
клинических и иммунологических фенотипов. J Clin Immunol 2009; 29: 130-6.
47. Balzar S, Strand M, Nakano T, Wenzel SE. Тонкий иммунодефицит
при тяжелой астме: IgA и IgG2 коррелируют с функцией легких и
симптомами.Int Arch Allergy Immunol 2006; 140: 96-102.
48. Ким В.Дж., Чой И.С., Ким С.С., Ли Дж.Х., Кан Х.В. Связь
между уровнем сывороточного IgA и аллергией / астмой. Korean J Intern Med
2017; 32: 137-45.
49. Бен Дхубан К., Пиччирилло, Калифорния. Иммунологические и генетические основы
иммунной дисрегуляции, полиэндокринопатии, энтеропатии, Х-сцепленного синдрома
. Curr Opin Allergy Clin Immunol 2015; 15: 525-32.
50. Barzaghi F, Hernandez LC, Neven B, Ricci S, Kucuk ZY, Bleesing JJ,
et al.Долгосрочное наблюдение за пациентами с синдромом IPEX после различных терапевтических стратегий
: международное многоцентровое ретроспективное исследование.
J Allergy Clin Immunol 2018; 141: 1036-49.
51. Гамбинери Э., Перрони Л., Пассерини Л., Бьянки Л., Доглиони С.,
Мески Ф. и др. Клинический и молекулярный профиль новой серии из
пациентов с иммунной дисрегуляцией, полиэндокринопатией, энтеропатией,
Х-сцепленный синдром: несогласованная корреляция между экспрессией белка 3 вилки
и тяжестью заболевания.J Allergy Clin Immunol
2008; 122: 1105-120.
52. Milner JD. PLAID: Синдром сложных паттернов болезни и
уникальных фенотипов. Дж. Клин Иммунол 2015; 35: 527-30.
53. Abajian M, Młynek A, Maurer M. Physical urticaria. Curr Allergy
Asthma Rep 2012; 12: 281-7.
54. Омбрелло MJ, Remmers EF, Sun G, Freeman AF, Datta S, Torabi-Parizi P,
et al. Холодовая крапивница, иммунодефицит и аутоиммунитет, связанные с делециями
PLCG2.N Engl J Med 2012; 366: 330-8.
55. Сасси А., Лазароски С., Ву Дж., Хаслам С.М., Флигауф М., Меллули Ф.,
et al. Гипоморфные гомозиготные мутации фосфоглюкомутазы 3
(PGM3) ослабляют иммунитет и повышают уровень IgE в сыворотке. J Allergy Clin
Immunol 2014; 133: 1410-9, 1419.e1-13.
56. Чжан И, Ю Х, Итикава М., Лайонс Дж. Дж., Датта С., Ламборн ИТ и др.
Аутосомно-рецессивные мутации фосфоглюкомутазы 3 (PGM3) связывают
дефекты гликозилирования с атопией, иммунодефицитом, аутоиммунитетом,
и нейрокогнитивными нарушениями.J Allergy Clin Immunol
2014; 133: 1400-9, 1409.e1-5.
57. Пичард, округ Колумбия, Фриман А.Ф., Коуэн Е.В. Первичный иммунодефицит
Обновление: Часть I. Синдромы, связанные с экзематозным дерматитом. J Am
Acad Dermatol 2015; 73: 355-64.
58. Абдоллахпур Х., Аппасвами Г., Котларц Д., Дистелхорст Дж., Байер Р.,
Шеффер А.А. и др. Фенотип дефицита STK4 человека. Кровь
2012; 119: 3450-7.
59. Nehme NT, Schmid JP, Debeurme F, André-Schmutz I., Lim A,
Nitschke P, et al.Мутации MST1 при аутосомно-рецессивном первичном иммунодефиците
, характеризующемся нарушением выживаемости наивных Т-клеток.
Кровь 2012; 119: 3458-68.
60. Гольдбах-Манский Р. Текущее состояние понимания патогенеза
и ведения пациентов с NOMID / CINCA. Curr Rheumatol
Rep 2011; 13: 123-31.
61. Хоффман Х.М., Мюллер Дж.Л., Бройде Д.Х., Странник А.А., Колоднер Р.Д.
Мутация нового гена, кодирующего предполагаемый пириноподобный белок, вызывает
семейный холодовой аутовоспалительный синдром и синдром Макл-Уэллса.
Нат Генет 2001; 29: 301-5.
62. Гольдбах-Мански Р., Дейли Н.Дж., Канна С.В., Гелаберт А.,
Джонс Дж., Рубин Б.И. и др. Мультисистемное воспалительное заболевание с неонатальным началом
Заболевание, реагирующее на ингибирование интерлейкина-1бета. N Engl J Med
2006; 355: 581-92.
63. Лахманн Х. Дж., Папа Р., Герхольд К., Обичи Л., Тоуиту И., Кантарини Л. и др.
Фенотип аутовоспалительного синдрома, ассоциированного с рецепторами TNF.
(TRAPS) при представлении: серия из 158 случаев из международного реестра евро лихорадки /
EUROTRAPS.Энн Рум Дис 2014; 73: 2160-7.
64. Уэда Н., Ида Х, Васио М., Мияхара Х, Токунага С., Танака Ф. и др.
Клинические и генетические особенности пациентов с вариантами TNFRSF1A
в Японии: результаты общенационального исследования. Arthritis Rheumatol
2016; 68: 2760-71.
65. Caso F, Galozzi P, Costa L, Sfriso P, Cantarini L, Punzi L, et al.
Аутовоспалительные гранулематозные заболевания: от синдрома Блау и
саркоидоза с ранним началом до болезни, опосредованной NOD2, и болезни Крона.
RMD Open 2015; 1: e000097.
66. Розэ С.Д., Пансес С., Кастилс И., Антон Дж., Бадер-Менье Б., Бриссо П.,
и другие. Синдром Блау: перекрестные данные многоцентрового исследования
клинических, радиологических и функциональных исходов. Ревматология (Оксфорд)
2015; 54: 1008-16.
67. Воутерс С.Х., Маес А., Фоли К.П., Бертен Дж., Роуз С.Д. Синдром Блау,
прототипное аутовоспалительное гранулематозное заболевание. Pediatr
Rheumatol Online J 2014; 12: 33.
68. Паппалардо Э., Чикарди М., Дюпончель С., Каругати А., Шоке С.,
Агостони А. и др. Частые мутации de novo и делеции экзонов в гене-ингибиторе
C1 у пациентов с ангионевротическим отеком. J Allergy Clin Immunol
2000; 106: 1147-54.
69. Чикарди М., Аберер В., Банержи А., Бас М., Бернштейн Дж. А., Борк К. и др.
Классификация, диагностика и подход к лечению ангионевротического отека:
Консенсусный отчет международной рабочей группы по наследственному ангионевротическому отеку
.Аллергия 2014; 69: 602-16.
70. Борк К., Франк Дж., Грундт Б., Шлаттманн П., Нуссбергер Дж., Кройц В.,
et al. Лечение приступов острого отека при наследственном ангионевротическом отеке
антагонистом рецептора 2 брадикинина (Икатибант). J Allergy Clin Immunol
2007; 119: 1497-503.
71. Боярчук О., Волянская Л., Дмитраш Л. Клиническая изменчивость синдрома делеции
хромосомы 22q11.2. Cent Eur J Immunol
2017; 42: 412-7.
72.Аппаласами Дж. Р., Сарифф А. Обзор проблем, связанных с наркотиками, среди
пациентов, проходящих лечение от симптомов аллергии в общественных аптеках в
Негери-Сембилан, Малайзия. Int J Pharm Pharm Sci 2014; 6: 313-6.
73. Бат-Хекстолл Ф.Дж., Бирни А.Дж., Равенскрофт Дж.С., Уильямс ХК. Вмешательства
для уменьшения Staphylococcus aureus при лечении атопической экземы:
Обновленный Кокрановский обзор. Br J Dermatol 2010; 163: 12-26.
74. Павлин М., Симинович К.А.Синдром Вискотта-Олдрича: новые молекулярные
Аллергии и иммунная система
Аллергическая болезнь — одно из самых распространенных хронических заболеваний в мире. Люди с семейным анамнезом аллергии имеют повышенный риск развития аллергического заболевания. Сенная лихорадка (аллергический ринит), экзема, крапивница, астма и пищевая аллергия — это некоторые типы аллергических заболеваний. Симптомы аллергии могут варьироваться от легкой до серьезной, опасной для жизни аллергической реакции (анафилаксии).
В вашей иммунной системе начинаются аллергические реакции.Когда человек, страдающий аллергией на это вещество, сталкивается с безвредным веществом, таким как пыль, плесень или пыльца, иммунная система может чрезмерно отреагировать, производя антитела, которые «атакуют» аллерген. Может вызвать хрипы, зуд, насморк, слезотечение или зуд в глазах и другие симптомы.
Что такое иммунная система?
Цель иммунной системы — защитить себя и не допустить попадания в организм микроорганизмов, таких как определенные бактерии, вирусы и грибки, а также уничтожить любые инфекционные микроорганизмы, которые действительно вторгаются в организм.Иммунная система состоит из сложной и жизненно важной сети клеток и органов, которые защищают организм от инфекции.
Органы, связанные с иммунной системой, называются лимфоидными органами. Они влияют на рост, развитие и высвобождение лимфоцитов (один из видов лейкоцитов). Кровеносные сосуды и лимфатические сосуды — важные части лимфоидных органов. Они переносят лимфоциты в разные части тела и из них. Каждый лимфоидный орган играет роль в производстве и активации лимфоцитов.
К лимфоидным органам относятся:
Аденоиды (две железы, расположенные в задней части носовых ходов)
Аппендикс (тонкая трубка, которая соединяется с толстой кишкой)
Кровеносные сосуды (артерии, вены и капилляры, по которым течет кровь)
Костный мозг (мягкая жировая ткань в костных полостях)
Лимфатические узлы (небольшие органы в форме бобов, которые расположены по всему телу и соединяются через лимфатические сосуды)
Лимфатические сосуды (сеть каналов по всему телу, по которым лимфоциты попадают в лимфоидные органы и кровоток)
Пейеровы бляшки (лимфоидная ткань тонкого кишечника)
Селезенка (орган размером с кулак, расположенный в брюшной полости)
Тимус (две доли, которые соединяются перед трахеей за грудиной)
Миндалины (две овальные образования в задней части горла)
Как у человека появляется аллергия?
Аллергены можно вдыхать, проглатывать или проникать через кожу.Общие аллергические реакции, такие как сенная лихорадка, определенные типы астмы и крапивница, связаны с вырабатываемым организмом антителом, называемым иммуноглобулином E (IgE). Каждое антитело IgE может быть очень специфичным, реагируя на определенные пыльцы и другие аллергены. Другими словами, у человека может быть аллергия на один тип пыльцы, но не на другой. Когда восприимчивый человек подвергается воздействию аллергена, организм начинает вырабатывать большое количество аналогичных антител IgE. Следующее воздействие того же аллергена может вызвать аллергическую реакцию.Симптомы аллергической реакции будут варьироваться в зависимости от типа и количества встречающегося аллергена, а также от того, как иммунная система организма реагирует на этот аллерген.
Аллергия может поразить любого, независимо от возраста, пола, расы или социально-экономического статуса. Как правило, аллергия чаще встречается у детей. Однако впервые это может произойти в любом возрасте или повториться после многолетней ремиссии. Гормоны, стресс, дым, духи или раздражители окружающей среды также могут играть роль в развитии или тяжести аллергии.
Что такое анафилактический шок?
Анафилактический шок, также называемый анафилаксией, — это тяжелая, опасная для жизни реакция на определенные аллергены. Ткани тела могут опухать, в том числе ткани в горле. Анафилактический шок также характеризуется резким падением артериального давления. Ниже приведены наиболее частые симптомы анафилактического шока. Однако каждый человек может испытывать симптомы по-разному. Другие симптомы могут включать:
Зуд и крапивница на большей части тела
В тепле
Отек горла и языка или стеснение в горле
Затрудненное дыхание или одышка
Головокружение
Головная боль
Боль или спазмы
Тошнота, рвота или диарея
Удар
Потеря сознания
Чувство головокружения
Беспокойство
Аномальная частота пульса (слишком высокая или слишком медленная)
Анафилактический шок может быть вызван аллергической реакцией на лекарство, пищу, сыворотку, яд насекомых, экстракт аллергена или химическое вещество.Некоторые люди, которые знают о своих аллергических реакциях или аллергенах, носят с собой набор для экстренной анафилаксии, который содержит инъекционный адреналин (препарат, который стимулирует надпочечники и увеличивает частоту и силу сердечного сокращения).
Для получения информации о пищевой аллергии посетите следующие страницы:
Подозрение на иммунодефицит | Всемирная организация по аллергии
Обновлено: март 2021 г.
Обновлено: июнь 2015
Сообщение: декабрь 2008 г.,
Обновил:
Антонио Кондино-Нето, MD, PhD
Профессор иммунологии и экспериментальной медицины
Отделение иммунологии Института биомедицинских наук
Университет Сан-Паулу,
Сан-Паулу, SP.Бразилия
Авторы оригинала:
Сасаван Чинратанаписит, доктор медицины
Отделение аллергии и иммунологии педиатрии
Больница Пхумипон Адульядет Бангкок, Таиланд
Панида Сриарун, доктор медицины
Отделение аллергии, иммунологии и ревматологии
Университет Южной Флориды, педиатрический факультет
Санкт-Петербург, Флорида, США
Джон В. Слизман, доктор медицины
Профессор и начальник
Отделение аллергии и иммунологии
Медицинский факультет Университета Дьюка,
Дарем, Северная Каролина, США
1.0 Определение болезни
Первичные и вторичные иммунодефицитные расстройства — это разнообразная группа заболеваний, возникающих в результате одного или нескольких нарушений иммунной системы. Клинические проявления включают повышенную восприимчивость к инфекции и повышенный риск аутоиммунных заболеваний, злокачественных новообразований, аллергии и аутовоспалительных заболеваний. Заболевания, связанные с первичным иммунодефицитом (ВЗОМТ), представляют собой группу серьезных нарушений, возникающих из-за внутреннего дефекта иммунной системы, как правило, в результате генетического заболевания, которое может быть напрямую связано с определенным иммунным путем, в настоящее время первичными дефектами являются более 400 генов.Напротив, вторичный иммунный дефицит возникает из-за нарушения иммунного ответа через другие механизмы, такие как инфекция, нарушение обмена веществ, злокачественные новообразования, токсины, иммунодепрессанты, при этом иммунный дефект является вторичным проявлением. Хотя возможность иммунодефицита следует учитывать у любого человека с рецидивирующими инфекциями, также важно рассматривать неиммунные состояния как причину. Такие расстройства включают нарушения кровообращения, приводящие к застою или клеточной ишемии, которые могут возникать при серповидно-клеточной анемии, диабете или сердечной недостаточности; обструктивные состояния легких, такие как хроническая обструктивная болезнь легких, цилиарная дискинезия и муковисцидоз; или стеноз мочеточника, приводящий к нарушению очищения от патогенов; и повреждения покровов и поверхностей слизистых оболочек, как это видно при множественной эритеме или ожогах, буллезном эпидермолизе, тяжелом воспалительном заболевании кишечника, позволяющем проникнуть в условно-патогенные микроорганизмы и инфекцию.Каждый из них связан с инфицированием конкретными патогенами и приводит к характерным клиническим проявлениям.
Вторичные иммунные дисфункции гораздо чаще встречаются у взрослых, чем ВЗОМТ. Общие причины включают недоедание, ВИЧ / СПИД, злокачественные новообразования, иммуносупрессивные препараты и воздействие токсинов. Злокачественные новообразования могут напрямую подавлять функцию В-клеток, как это наблюдается при хроническом лимфолейкозе и лимфомах. Злокачественные новообразования также могут напрямую вызывать недостаточность костного мозга, что приводит к нейтропении и нарушению функции Т-клеток.
Нарушения обмена веществ, такие как диабет, уремия и печеночная недостаточность, часто связаны с тяжелыми, опасными для жизни инфекциями из-за нарушения клеточных функций лимфоидных и миелоидных клеток. Энтеропатии с потерей белка, ожоги и нефроз приводят к потере растворимых факторов, таких как иммуноглобулин и комплемент, тем самым повышая риск сепсиса и перитонита. Аутоиммунные заболевания, особенно связанные с иммунными комплексами, такие как системная красная волчанка (СКВ), часто приводят к вторичному дефициту комплемента из-за хронического потребления, превышающего синтез в печени.В больших сериях случаев из Таиланда и Тайваня антицитокиновые аутоантитела против гамма-интерферона были связаны с множественными оппортунистическими инфекциями и были связаны с иммунодефицитом у взрослых. Аутоантитела к интерферонам I типа связаны с тяжелым исходом COVID19, а аутоантитела к области IL-17, связанной с хроническим кожно-слизистым кандидозом при дефиците AIRE, и аутоантитела к IL-6 связаны со стафилококковым сепсисом. Временная активация и истощение комплемента также может происходить при сепсисе, виремии, ожогах и травмах.При диагностическом подходе к взрослому с рецидивирующими инфекциями и подозрением на иммунную недостаточность необходимо учитывать эти неиммунные и вторичные причины. Характеристики и клинические признаки категорий первичных и вторичных иммунных расстройств у взрослых перечислены в таблице 1.
2.0 Классификация и клиническое представление
ВЗОМТ, хотя и реже, чем вторичные иммунные расстройства, может быть довольно распространенным явлением. Например, у некоторых этнических групп, таких как скандинавы, дефицит связывающего маннозу лектина имеет распространенность 5-7%.Селективный иммуноглобулин (Ig) А дефицит встречается у 1 из 300 человек. Эти общие ВЗОМТ обычно не имеют клинической значимости, тогда как другие ВЗОМТ могут привести к опасным для жизни инфекциям. Комитет экспертов по ВЗОМТ Международного союза иммунологических обществ (IUIS) недавно сообщил об обновленной классификации ВЗОМТ. Как и в недавних классификациях, восемь основных групп PID были включены
- Иммунодефициты, влияющие на клеточный и гуморальный иммунитет
- Комбинированные иммунодефициты с ассоциированными или синдромальными признаками
- Преимущественно дефицит антител
- Болезни иммунной дисрегуляции
- Врожденные дефекты количества, функции или того и другого фагоцитов
- Дефекты внутреннего и врожденного иммунитета
- Аутовоспалительные заболевания
- Недостатки дополнения
- Недостаточность костного мозга
- Фенокопии врожденных пороков иммунитета
ВЗОМТ — это группа из более чем 400 моногенных заболеваний, которые развиваются с рецидивирующими инфекциями, аутоиммунитетом, иммунной дисрегуляцией, ауто-воспалением, злокачественными новообразованиями и фенотипами аллергии.Это постоянно растущее число заболеваний, классифицируемых по фенотипам, генотипам или обоим сразу.
2.1. Дефицит антител является наиболее частой причиной ВЗОМТ, составляя более половины всех случаев. Клинические проявления — это, прежде всего, рецидивирующие бактериальные синусно-легочные инфекции, включая пневмонию и синусит, хотя часто сообщалось о бактериальном сепсисе и менингите. Чаще всего встречаются инфекции, вызванные Haemophilus influenzae , Streptococcus pneumoniae и другими инкапсулированными бактериальными организмами.Проявления не ограничиваются синопульмональными инфекциями, поскольку также встречаются хронический лямблиозный энтерит, лимфоидная гиперплазия желудочно-кишечного тракта, полимиозит, аутоиммунные цитопении и хронический артрит. Наиболее частым клинически значимым нарушением дефицита антител у взрослых является общий вариабельный иммунный дефицит (ОВИН). ОВИН часто ассоциируется с рецидивирующей бактериальной пневмонией, часто с бронхоэктазами; стойкие желудочно-кишечные симптомы, указывающие на воспалительное заболевание кишечника или целиакию; и аутоиммунитет.У 20% пациентов с CVID развиваются гранулемы в легких, печени и селезенке, которые можно спутать с саркоидозом. Хотя генетическая причина не может быть идентифицирована у большинства пациентов с клиническими признаками ОВИН, растет число идентифицируемых состояний, которые могут быть связаны с недавно выявленными генетическими нарушениями, которые имеют значение для долгосрочного прогноза и лечения ОВИН. Например, пациенты с дефицитом PIK3CD имеют профили Ig, соответствующие ОВИН, а также рецидивирующей синопульмональной инфекции, но также имеют снижение лимфопролиферативного заболевания, вызванного вирусом герпеса, низкие наивные Т-клетки CD4 и инвертированное соотношение Т-лимфоцитов CD4 / CD8.Другие признаки специфических генетических нарушений у пациентов с ОВИН включают амилоидоз кишечника (дефицит NLRP12), гранулемы ЦНС и энтеропатию (дефицит CTLA4). Всестороннее клиническое и лабораторное обследование вместе с подробным семейным анамнезом должно быть частью обследования всех пациентов с ОВИН. Другие дефициты антител, наблюдаемые у взрослых, которые имеют клинические проявления, сходные с CVID, включают дефицит подкласса IgG, избирательный дефицит IgA, функциональный дефицит антител, B-клеточный хронический лимфоцитарный лейкоз и энтеропатии с потерей белка.
2.2. Клеточный иммунодефицит. Клинические симптомы, возникающие в результате первичного дефекта клеточного иммунитета или комбинированного клеточного иммунитета и иммунитета антител, у взрослых встречаются реже, чем у детей; вместо этого преобладает вторичный иммунный дефицит, связанный с ВИЧ-инфекцией или лекарствами, нацеленными на функцию Т-клеток. Обычно встречающиеся инфекции включают хронический кожно-слизистый кандидоз, стойкие инфекции, вызванные цитомегаловирусом и другими вирусами герпеса, такими как симплекс или опоясывающий лишай, пневмония Pneumocystis jiroveci, и инфекции, вызываемые атипичными видами микобактерий.Дефектный клеточный иммунитет увеличивает риск злокачественных новообразований, особенно В-клеточных лимфом или лимфопролиферативных заболеваний, вызванных вирусом Эпштейна-Барра.
2.3. Дефицит фагоцитарных клеток. Нарушение функции фагоцитарных клеток и синдромы нейтропении обычно связаны с рецидивирующими инфекциями мягких тканей, включая целлюлит, лимфаденит и остеомиелит. Также проявляются абсцессы и гранулемы, вызванные грибковыми патогенами в печени, легких и селезенке. Часто клинические проявления будут состоять исключительно из лихорадки неизвестного происхождения из-за скрытой глубоко укоренившейся инфекции.Часто встречаются заболевания полости рта и пародонта, включая хронический некротический гингивит, язвы в полости рта и зубные абсцессы. Часто наблюдается плохое или замедленное заживление ран. Системные инфекции, вызванные каталазо-положительными организмами, такими как Staphylococcus aureus, Serratia, Aspergillus, Burkholderia cepacia и Nocardia , являются признаком хронической гранулематозной болезни, которая не обладает способностью к окислительному взрыву. Редкие поздние формы фагоцитарных нарушений включают синдром гипер-IgE, аутосомно-рецессивное (p47phox) хроническое гранулематозное заболевание, дефекты пути IL-12 и гамма-рецептора интерферона (IFNgR).Дефекты пути IL-12 и гамма-рецептора интерферона (IFNgR) приводят к хроническим инфекциям, вызываемым атипичными видами микобактерий. Синдром гипер-IgE возникает из-за мутации в STAT3, приводящей к тяжелой экземе, инфекциям мягких тканей и стафилококковой пневмонии. Вторичные причины нейтрофильных расстройств включают миелодиспластические синдромы, злокачественные новообразования, миелоаблативную химиотерапию и аутоиммунную нейтропению.
2.4. Дефицит комплемента. Наследственные дефекты в системе комплемента имеют очень разные клинические проявления в зависимости от конкретного компонента затронутого каскада комплемента.Нарушение регуляторных белков, задействованных в ингибиторе C1, вызывает клинические симптомы, которые включают эпизодический незудящий ангионевротический отек дыхательных путей, мягких тканей и желудочно-кишечного тракта. Лица с дефектами ранних или классических компонентов комплемента имеют повышенный риск бактериальной инфекции и обычно развивают аутоиммунные заболевания, такие как СКВ, ревматоидный артрит и гломерулонефрит. У пациентов с дефектами конечных компонентов каскада комплемента часто развиваются хронические или рецидивирующие инфекции, особенно менингит, вызываемый видами Neisseria , а также повышенный риск аутоиммунитета.Большинство расстройств комплемента наследуются по аутосомно-доминантному или ко-доминантному типу, поэтому семейный анамнез помогает в диагностике.
2,5. Тяжелая форма COVID 19. Недавнее исследование более 650 человек, у которых развился COVID-19 в тяжелой форме, показало, что примерно у 3,5% пациентов имелись варианты с потерей функции зародышевой линии в генах, ранее считавшихся важными для защиты хозяина от гриппа или других вирусных инфекций (bi -аллельные мутации потери функции IRF7 или IFNAR1 , гетерозиготные мутации TLR3 , TICAM1 , TBK1 или IRF3 ) из-за ключевой роли этих генов в пути передачи сигналов IFN 1 типа .Сопутствующее исследование показало, что примерно у 10% пациентов с тяжелой формой COVID-19 наблюдается высокий уровень нейтрализующих аутоантител (аутоАТ) против интерферонов 1 типа в сыворотке крови. Влияние этих аутоАТ было доказано неспособностью обнаруживать IFN типа 1 в сыворотке крови этих пациентов и их способностью предотвращать противовирусные иммунные ответы in vitro.
3.0 Оценка подозрения на иммунодефицит
Оценка подозрения на ВЗОМТ у взрослого пациента должна основываться на клинических данных, связанных с категориями болезней иммунодефицита.Диагноз должен быть направлен на первичную и вторичную этиологию, соответствующую клинической картине и структуре инфекций. Следовательно, природа заражающего организма, история болезни и клинические проявления, а также систематическое использование лабораторных и диагностических процедур могут использоваться для определения природы иммунного дефекта. Результаты помогут определить, каких пациентов необходимо направить в специализированные центры для окончательной диагностики и лечения, или каких пациентов можно лечить у основного практикующего аллерголога и иммунолога.
3.1 История — важный начальный шаг в процессе оценки. Необычные или тяжелые осложнения обычных инфекций часто наблюдаются у пациентов с иммунодефицитом. Например, эмпиема, связанная с бактериальной пневмонией, предполагает дефицит антител. Гранулема печени или селезенки, вызванная S. aureus , предполагает хроническое гранулематозное заболевание. У пациентов с иммунодефицитом часто возникает необходимость лечить инфекцию с помощью длительного или многократного приема антибиотиков. Медицинский анамнез должен включать полный семейный анамнез, чтобы определить, существует ли модель наследования, совместимая с известным PID, например аутосомно-доминантная, Х-сцепленная или аутосомно-рецессивная.Изучая семейный анамнез, врач должен узнать о кровном родстве, а также о повторяющихся или тяжелых инфекциях среди членов семьи. Следует исследовать сопутствующие неинфекционные признаки иммунодефицита, такие как преждевременная потеря зубов, плохое или замедленное заживление ран. Рецидивирующие инфекции опоясывающего лишая или стойкие кожные бородавки часто встречаются у пациентов с клеточным иммунодефицитом, тогда как история рецидивирующих афтозных язв может быть единственным признаком того, что функция фагоцитов нарушена.
3.2 Физикальное обследование также позволяет понять природу иммунодефицита. Например, истощение и необъяснимая потеря веса распространены как при недостаточности антител, так и при клеточном иммунодефиците, хотя любое хроническое воспалительное состояние может быть связано с аномальными катаболическими состояниями. Рубцы барабанной перепонки или хроническая перфорация из-за рецидивирующего среднего отита обычно наблюдаются у пациентов с недостаточностью антител. Грубые черты лица и тяжелая экзема предполагают синдром гипер-IgE, тогда как витилиго или очаговая алопеция связаны с кожно-слизистым кандидозом с аутоиммунным полигландулярным заболеванием.Гепатоспленомегалия и лимфаденопатия часто встречаются у пациентов с ОВИН и клеточным иммунодефицитом. Кожные грибковые инфекции предполагают дефекты клеточного иммунитета. Фурункулы и абсцессы мягких тканей видны при фагоцитарных нарушениях. Глазная телеангиэктазия в сочетании с мозжечковой атаксией является признаком атаксии телеангиэктазии, которая приводит к прогрессирующему комбинированному иммунодефициту. Хронический воспалительный артрит проявляется в дефиците антител и комплемента.
3.3 Диагностическое тестирование должно быть сосредоточено на различении неиммунных, вторичных и ВЗОМТ. Оценка рецидивирующих синусно-легочных инфекций должна включать, при необходимости, подробную рентгенографическую оценку носовых пазух и визуализацию легких с высоким разрешением для выявления скрытых бронхоэктазов, внутригрудной лимфаденопатии и гранулем. Интерпретация результатов должна проводиться в контексте других лабораторных и клинических данных. Например, гранулемы в легких, печени или селезенке могут быть замечены при хронической гранулематозной болезни, CVID или саркоидозе.У пациентов с рецидивирующей пневмонией следует рассмотреть возможность проведения цилиарной биопсии и анализа пота на муковисцидоз с поздними проявлениями. У пациентов с бактериальным сепсисом следует оценивать количество нейтрофилов и функцию селезенки. Все формы нейтропении следует дополнительно исследовать с помощью аспирата костного мозга для выявления скрытых злокачественных новообразований или миелодисплазии. Полный метаболический профиль всех пациентов с тяжелыми или рецидивирующими инфекциями должен быть оценен для оценки функции печени, почек и эндокринной системы; Также следует провести анализ мочи для выявления скрытой протеинурии.
3.4 Лабораторная оценка иммунитета состоит из пошагового анализа, который коррелирует клинические проявления с конкретным подозреваемым иммунным заболеванием.
Чтобы оптимизировать использование клинической лаборатории, тестирование должно в первую очередь сосредоточиться на количественных и качественных оценках скрининга, с более дорогостоящими и сложными исследованиями, используемыми для определения точной природы расстройства и подтверждения предполагаемого диагноза. Сводка скрининговых тестов и исследований для подтверждения диагноза представлена в таблице 2.Скрининговые тесты на дефекты продукции антител включают количественные сывороточные иммуноглобулины, в которых можно точно измерить общий IgG, IgA и IgM. Преобладающий иммунный глобулин в крови — это IgG, обычно в диапазоне от 800 до 1500 мг / дл с небольшим снижением после 60 лет. Селективный дефицит IgA определяется как сывороточные уровни <10 мг / дл. Типичные уровни IgM у взрослых колеблются от 70 до 130 мг / дл. Изолированный селективный дефицит IgM (<10 мг / дл) встречается крайне редко, тогда как повышенный IgM указывает на синдром гипер-IgM, инфекцию или аутоиммунитет.Повышение в нескольких изотипах может отражать активацию поликлональных В-клеток, как при ВИЧ или других вирусных инфекциях, таких как ВЭБ или ЦМВ, саркоидоз или СКВ. Повышение уровня одного изотипа следует оценивать с помощью электрофореза белков сыворотки, чтобы исключить множественную миелому, макроглобулинемию Вальденстрема или первичный системный амилоидоз. Доброкачественная моноклональная гаммопатия развивается у 1% здоровых взрослых людей в возрасте 50 лет. Титры специфических антител, измеренные до и через 30 дней после иммунизации, являются общепринятым средством измерения функционального иммунитета к Т-зависимым (столбняк и дифтерия) и Т-независимым (различные серотипы пневмококкового полисахарида) антигенам.У более чем 90% здоровых людей обычный постиммунизационный защитный ответ на Т-зависимые антигены, такие как столбняк и дифтерия, превышает 1,0 МЕ / мл. Ответ на Т-независимые антигены обычно измеряется с помощью до- и пост-титров различных серотипов в вакцине пневмококкового полисахарида. Защитный уровень антител после пневмококковой полисахаридной вакцины плохо определен, однако практические параметры ACAAI и AAAAI определяют нормальный ответ у взрослых как титры ³ 1.3 мкг / мл или четырехкратное повышение по крайней мере для 70% иммунизирующих серотипов.
Повышение уровня общего сывороточного IgE может быть полезно у пациентов с подозрением на IgE-опосредованный аллергический риносинусит, аллергическую астму и другие аллергические заболевания у пациентов с дефектами антител. У пациентов с низким общим уровнем IgG или дефектным функциональным иммунитетом измерение подклассов IgG помогает точно установить диагноз. Однако значение дефицита подкласса IgG при наличии нормальных ответов антител на белок и полисахаридный антиген неизвестно.Низкий уровень или отсутствие IgG4 присутствует примерно у 5% здоровых взрослых, и его дефицит не считается клинически значимым. Подсчет B-клеток с помощью проточной цитометрии может дифференцировать позднюю врожденную агаммаглобулинемию, когда CD20 + или CD19 + B-клетки низкие или отсутствуют в CVID, а общее количество B-клеток в целом нормальное.
Скрининговые лабораторные тесты для оценки клеточного иммунитета включают общее количество лимфоцитов, подсчет Т- и В-клеток с использованием проточной цитометрии и тестирование на антитела к ВИЧ.ВИЧ — наиболее распространенный вторичный иммунный дефицит среди взрослых. У здоровых людей CD3-положительные Т-клетки составляют 60-70% от общего количества лимфоцитов. Эти клетки подразделяются на Т-клетки CD4 или Т-клетки CD8 в типичном соотношении, превышающем 1,0. Инвертированные соотношения CD4 и CD8 T с низким общим числом Т-лимфоцитов CD4 наблюдаются при СПИДе, некоторых подтипах ОВИН и идиопатической Т-клеточной лимфопении CD4. Функциональная оценка клеточного иммунитета включает кожные тесты на гиперчувствительность замедленного типа (ГЗТ), чтобы вспомнить антигены и митогены и антиген-индуцированную пролиферацию лимфоцитов, которые представляют собой измерения функции лимфоцитов in vitro, рассчитываемые как индекс стимуляции.Например, антиген-специфический ответ пролиферации и ГЗТ Candida является низким при кандидозе кожно-слизистых оболочек. Генетически охарактеризованные комбинированные заболевания иммунодефицита, вызванные дефектами путей спасения пуринов или передачи сигналов Т-клеток, редко имеют свои первоначальные клинические проявления у подростков и взрослых. Клинические проявления этих расстройств обычно возникают в младенчестве и при отсутствии лечения приводят к летальному исходу.
Общий анализ крови для подсчета нейтрофилов, других гранулоцитов и моноцитов может быть использован в качестве начального теста на дефицит фагоцитов .Стойкий лейкоцитоз более 25000 клеток / мкл предполагает возможный дефицит адгезии лейкоцитов, который может быть подтвержден на основании низкой экспрессии молекул адгезии, таких как CD11b и CD18. Выявление редких вариантов хронической гранулематозной болезни у взрослых и подростков может быть выполнено с помощью анализа проточной цитометрии с использованием красителя дигидрородамина или окислительного респираторного взрыва, которые в значительной степени заменили анализ нитросинего тетразолия в качестве лучшей оценки функции фагоцитов. Различные генетические варианты хронической гранулематозной болезни, 91phox, p22 и p47, имеют узнаваемые образцы флуоресценции, которые могут помочь подтвердить диагноз.
Скрининговые тесты для системы комплемента включают общий C3, общий C4, общий гемолитический комплемент в сыворотке (CH50) и альтернативный путь (AH50). Вместе эти четыре теста могут использоваться для дифференциации дефектов в классических, альтернативных или терминальных компонентах комплемента. Уровни C3 и C4 помогают определить, продолжается ли потребление комплемента, как это наблюдается при иммунных комплексах или аутоиммунных заболеваниях. В этих условиях подавляются множественные компоненты комплемента, тогда как при изолированном наследственном дефиците отсутствие одного компонента приводит к нарушению функции всего пути.Низкий или полностью подавленный CH50 с нормальным AH50 характерен для дефектов классического пути (примерами являются дефицит C1, C2 и C4). Низкий или отсутствующий AH50 при нормальном CH50 типичен для дефекта альтернативного пути (такого как дефицит пропердина). Низкие или отсутствующие AH50 и CH50 (от C5 до C9) характерны для дефектов в компонентах терминального комплемента, которые составляют комплекс атаки на мембрану. За аномальными результатами следует следить с помощью фактор-специфичных анализов для выявления специфического дефицитного компонента.При дефиците лектина, связывающего маннозу, AH50, CH50, C3 и C4 в норме, но уровень лектина, связывающего маннозу, низкий. Диагноз может быть подтвержден и дополнительно охарактеризован генотипированием различных аллелей, связанных с этими расстройствами.
4.0 Менеджмент
Управление ВЗОМТ зависит от того, какой компонент иммунной системы нарушен и можно ли восстановить функцию. В случаях серьезных дефектов клеточного иммунитета трансплантация костного мозга может быть единственным доступным лечением для изменения состояния.У пожилых пациентов эта процедура обычно требует предварительной абляции с химиотерапией и подавлением иммунитета, что несет в себе риск неблагоприятного исхода. В ближайшем будущем генная терапия может стать альтернативой лечению дефектов одного гена. Напротив, пациенты с дефицитом антител IgG могут быть заменены ежемесячным внутривенным введением гаммаглобулина или еженедельными инфузиями подкожного IgG. Эта терапия эффективна при лечении синопульмональных инфекций и их осложнений. Заместительную терапию гаммаглобулином следует использовать только тем людям, у которых имеются лабораторные доказательства нарушения гуморального иммунитета, рецидивирующие инфекции, неэффективность консервативной терапии антибиотиками и отсутствие других причин рецидивов инфекции.
Клеточный иммунодефицит, особенно связанный с низким числом Т-лимфоцитов CD4, должен получать профилактику оппортунистических инфекций. Текущие рекомендации состоят в том, что пациенты с количеством Т-лимфоцитов CD4 менее 200 клеток / мкл должны проходить профилактику пневмонией Pneumocystis jiroveci с помощью триметоприма / сульфаметоксазола, а пациенты с количеством Т-лимфоцитов CD4 менее 50 клеток / мкл должны проходить профилактику атипичных заболеваний. микобактериальные инфекции. Пациенты с нарушенной функцией фагоцитарных клеток должны получать профилактику Aspergillus .Пациенты с хронической гранулематозной болезнью получают пользу от заместительной терапии гамма-интерфероном. Все ВЗОМТ являются хроническими и пожизненными состояниями, которые требуют тщательного клинического наблюдения и агрессивных вмешательств для улучшения здоровья и качества жизни.
Таблица 1: Характеристики иммунодефицитных заболеваний у взрослых
Таблица 2: Лабораторные значения для оценки Т-клеточного или В-клеточного иммунодефицита
Abs: отсутствует N1: нормальный, Ele: повышенный, CVID: общий вариабельный иммунный дефицит, BTK: тирозинкиназа Bruton, XLA: X-связанная агаммаглобулинемия, CLL; Хронический лимфоцитарный лейкоз, AID: цитидиндезаминаза, индуцированная активацией, ADA: аденозиндезаминаза, PNP: пуриннуклеозидфосфорилаза, IL-12: интерлейкин-12, IFNγR; Гамма-рецептор интерферона, общий анализ крови: общий анализ крови, DHR: дигидродаминовый краситель, SLE: системная красная волчанка, AR-Hyper-IgM: аутосомно-рецессивный гипер-IgM, STAT 3: датчик сигнала и активатор транскрипции 3, ANA: антинуклеарные антитела
Библиография
- Слизман Дж. У., Вирелла Г.Диагностика иммунодефицитных заболеваний. В: Вирелла Г. Медицинская иммунология . 6-е изд. Нью-Йорк, штат Нью-Йорк: Informa Healthcare; 2007: 397-407
- Orange JS, Hossny EM, et al. Использование внутривенного иммуноглобулина при заболеваниях человека: обзор данных, полученных членами Комитета по первичному иммунодефициту Американской академии аллергии, астмы и иммунологии: J Allergy Clin Immunol . 2006 апрель; 117 (4): 525-553
- Bonilla FA, Bernstein IL, Khan DA, et al.Практический параметр диагностики и лечения первичного иммунодефицита: Ann Allergy Asthma Immunol 2005; 94 (5 Приложение 1): S1-S63
- Баллоу М, О’Нил КМ. Подходите к пациенту с рецидивирующими инфекциями. В: Adkinson NF, Yunginger JW, Busse WW, Bochner BS, Holgate ST, Simons FE, ред. Принципы и практика Миддлтона в отношении аллергии . 6-е изд. Филадельфия, Пенсильвания: Мосби; 2003: 1043-1072
- Вен Л., Аткинсон Дж. П., Гиклас П.С. Клинико-лабораторная оценка дефицита комплемента: J Allergy Clin Immunol .2004 апрель; 113 (4): 585-593
- Розенцвейг SD, Голландия SM. Иммунодефицитные состояния фагоцитов и их инфекции: J Allergy Clin Immunol . 2004 апрель; 113 (4): 620-626,
- Танге С.Г., Аль-Херц В., Бусфиха А., Шатила Т., Каннингем-Рандлс С., Эциони А., Франко Дж. Л., Холланд С. М., Кляйн С., Морио Т., Охс HD, Оксенхендлер Е., Пикард С., Пак Дж., Торгерсон Т. Р., Казанова JL, Салливан KE. Врожденные ошибки иммунитета человека: обновление 2019 г. по классификации Комитета экспертов Международного союза иммунологических обществ. J Clin Immunol. Янв 2020; 40 (1): 24-64. DOI: 10.1007 / s10875-019-00737-x
- Танге С.Г., Аль-Херц В., Бусфиха А., Каннингем-Рандлс С., Франко Дж. Л., Холланд С. М., Кляйн С., Морио Т., Оксенхендлер Е., Пикард С., Пуэль А., Пак Дж., Сеппянен М. Дж., Сомеч Р., Су ХК, Салливан К.Е., Торгерсон Т.Р., Мейтс И. Постоянно увеличивающийся массив новых врожденных ошибок иммунитета: промежуточное обновление Комитета IUIS . J Clin Immunol. 2021 Апрель; 41 (3): 666-679. DOI: 10.1007 / s10875-021-00980-1.
- Bastard P, Rosen LB, Zhang Q, Michailidis E, Hoffmann HH, Zhang Y, et al.Аутоантитела к IFN типа I у пациентов с опасным для жизни COVID-19. Наука. 2020; 370 (6515): eabd4585. DOI: 10.1126 / science.abd4585
- Zhang Q, Bastard P, Liu Z, Le Pen J, Moncada-Velez M, Chen J, et al. Врожденные аномалии IFN-иммунитета I типа у пациентов с опасным для жизни COVID-19. Наука. 2020; 370 (6515): eabd4570. DOI: 10.1126 / science.abd4570.
Общие симптомы вариабельного иммунодефицита, диагностика и лечение
Обзор CVID
Общий вариабельный иммунодефицит (ОВИН) — это дефицит антител, из-за которого иммунная система не может защищаться от бактерий и вирусов, что приводит к повторяющимся и часто тяжелым инфекциям, в первую очередь поражающим уши, носовые пазухи и дыхательные пути (синусно-легочные инфекции).В большинстве случаев диагноз ставится только на третьем-четвертом десятилетии жизни. Необратимое повреждение дыхательных путей (бронхоэктатическая болезнь) может произойти из-за тяжелых и повторяющихся инфекций.
Хотя генетические мутации, приводящие к ОВИН, были идентифицированы, точная причина и характер генетического наследования ОВИН в большинстве случаев неизвестны. Поражаются как самцы, так и самки. Это одна из наиболее распространенных форм болезни первичного иммунодефицита (PIDD), и тяжесть симптомов варьируется от одного человека к другому.
ОВИН может быть связано с аутоиммунными заболеваниями, которые поражают другие клетки крови, вызывая низкое количество лейкоцитов или тромбоцитов, анемию, артрит и другие состояния, такие как эндокринные нарушения. Также могут присутствовать желудочно-кишечные проблемы, включая хроническую диарею, потерю веса, тошноту, рвоту и боль в животе. При некоторых формах ОВИН у пациентов развиваются гранулемы в легких, лимфатических узлах, печени, коже или других органах.
Люди с ОВИН также подвержены повышенному риску некоторых видов рака (в первую очередь лимфоидного и желудочно-кишечного рака).
Лечение ОВИН включает замену иммуноглобулинов, профилактические антибиотики и, если показано, лечение аутоиммунных и гранулематозных заболеваний.
Будьте в курсе последней информации и общайтесь с другими. Присоединиться к нам на Facebook.
Симптомы и диагностика CVID
Симптомы
ОВИН можно диагностировать в любое время, начиная с детства и заканчивая взрослой жизнью.
Как и в случае с дефицитом других антител, наиболее распространенными типами рецидивирующих инфекций являются уши, носовые пазухи, бронхи и легкие.К ним относятся:
• Пневмония
• Синусит
• Инфекции уха
• Желудочно-кишечные инфекции
Рецидивирующая пневмония и хронические инфекции легких могут привести к повреждению легких, называемому бронхоэктазами, что может осложнить лечение.
Диагностика
ОВИН можно заподозрить у детей или взрослых с историей рецидивирующих инфекций легких, бронхов, ушей или носовых пазух.
Точный диагноз можно поставить с помощью скрининговых тестов, измеряющих уровень иммуноглобулинов или количество В-клеток в крови.
Видео: Выбирать с умом »
Лечение и лечение CVID
ОВИН лечат заместительной иммуноглобулиновой терапией (ЗРТ), которая чаще всего облегчает симптомы. Лечение IRT должно проводиться регулярно и длиться всю жизнь.
Антибиотики используются для лечения большинства инфекций, вызванных ОВИН, хотя пациентам может потребоваться более длительное лечение, чем здоровому человеку.
Чтобы узнать больше о PIDD, посетите веб-сайт Фонда иммунодефицита.
Болезнь первичного иммунодефицита | AAAAI
Симптомы, диагностика, лечение и ведение
По мнению ведущих специалистов в области иммунологии, когда часть иммунной системы отсутствует или не функционирует должным образом, это может привести к болезни иммунодефицита. Когда причина этого дефицита наследственная или генетическая, это называется заболеванием первичного иммунодефицита (PIDD). Исследователи выявили более 300 * различных видов PIDD.
Иммунная система состоит из лейкоцитов. Эти клетки образуются в костном мозге и проходят через кровоток и лимфатические узлы. Они защищают и защищают от атак «чужих» захватчиков, таких как микробы, бактерии и грибки. Антитела — это белки, которые вырабатываются в ответ на инфекцию или иммунизацию и помогают бороться с инфекциями. Комплемент — это еще один белок крови, который играет защитную роль в иммунной системе.
В наиболее распространенных PIDD различные формы этих клеток или белков отсутствуют или не функционируют.Это создает картину повторяющихся инфекций, тяжелых инфекций и / или инфекций, которые необычно трудно вылечить. Эти инфекции могут поражать кожу, дыхательную систему, уши, головной или спинной мозг, мочевыводящие пути или желудочно-кишечный тракт.
В некоторых случаях PIDD поражает определенные и / или множественные органы, железы, клетки и ткани. Например, пороки сердца присутствуют при некоторых ПИДЗ. Другие PIDD изменяют черты лица, некоторые замедляют нормальный рост, а третьи связаны с аутоиммунными заболеваниями, такими как ревматоидный артрит.
Симптомы и диагностика первичного иммунодефицитного заболевания
Серьезные PIDD обычно проявляются в младенчестве. Например, тяжелая Т-клеточная или комбинированная иммунная недостаточность обычно присутствует в младенчестве. Однако у детей старшего возраста или взрослых может наблюдаться дефицит некоторых антител. В более легких формах перед подозрением на ПИДЗ часто возникает картина рецидивирующих инфекций.
Важные знаки, которые могут указывать на PIDD, включают:
• Рецидивирующие, необычные или трудно поддающиеся лечению инфекции
• Плохой рост или потеря веса
• Рецидивирующая пневмония, ушные инфекции или синусит
• Несколько курсов антибиотиков или внутривенных антибиотиков, необходимых для лечения инфекций
• Рецидивирующие глубокие абсцессы органов или кожи
• Семейный анамнез PIDD
• Увеличение лимфатических узлов или селезенки
• Аутоиммунное заболевание
Некоторые иммунодефицитные расстройства не являются первичными (наследственными или генетическими).Вторичная болезнь иммунодефицита возникает, когда иммунная система нарушена из-за фактора окружающей среды. Примеры этих внешних причин включают инфекцию (ВИЧ), лекарства (химиотерапию или системные стероиды), тяжелые ожоги или недоедание.
Лечение и лечение первичного иммунодефицитного заболевания
Исследования первичного иммунодефицита делают большие успехи, улучшая варианты лечения и повышая качество жизни большинства людей с этими сложными состояниями.Варианты лечения нацелены на конкретные иммунные дефекты и могут включать трансплантацию (костного мозга, стволовых клеток, тимуса), замену иммуноглобулинов (антител), профилактические антибиотики и стратегии лечения аутоиммунных заболеваний. Генная терапия оказалась успешной при определенных типах PIDD.
Если у вас или у вашего ребенка есть симптомы этих, иногда критических состояний, вам нужен лучший доступный уход. Аллерголог / иммунолог или клинический иммунолог имеет специальную подготовку и опыт, чтобы точно диагностировать и согласовать план лечения ПИДЗ.
Будьте в курсе последней информации и общайтесь с другими. Присоединяйтесь к нам в Facebook и Twitter.
Проверьте свои знания о PIDD. »
Введение в биологическую терапию »
Видео: Выбор с умом »
Фонд иммунодефицита объясняет здесь типы ВЗОМТ.
Первичный иммунодефицит | Аллергия, астма и клиническая иммунология
Пикард С., Аль-Херц В., Бусфиха А., Казанова Дж. Л., Шатила Т., Конли М. Е., Каннингем-Рандлс С., Этциони А., Холланд С. М., Кляйн С., Нонояма С., Охс HD, Оксенхендлер Е., Пак Дж. М., Салливан К. Э., Тан М.Л., Франко Дж.Л., Гаспар Н.Б. Заболевания, связанные с первичным иммунодефицитом: обновленная информация о классификации Комитета экспертов по первичному иммунодефициту Международного союза иммунологических обществ, 2015 г. J Clin Immunol. 2015; 35 (8): 696–726.
CAS Статья PubMed PubMed Central Google Scholar
Аль-Херц В., Бусфиха А., Казанова Дж. Л., Шатила Т., Конли М. Е., Каннингем-Рандлс С., Этциони А., Франко Дж. Л., Гаспар Х. Б., Холланд С. М., Кляйн С., Нонояма С., Охс HD, Оксенхендлер Е., Пикард С., Пак Дж. М., Салливан К., Тан М.Л. Заболевания, связанные с первичным иммунодефицитом: обновленная информация о классификации комитета экспертов международного союза иммунологических обществ по первичному иммунодефициту. Фронт Иммунол. 2014; 5: 162.
PubMed PubMed Central Google Scholar
Notarangelo LD. Первичные иммунодефициты. J Allergy Clin Immunol. 2010; 125 (2 приложение 2): S182–94.
Артикул PubMed Google Scholar
Chi CY, Lin CH, Ho MW, Ding JY, Huang WC, Shih HP, Yeh CF, Fung CP, Sun HY, Huang CT, Wu TS, Chang CY, Liu YM, Feng JY, Wu WK , Ван Л.С., Цай Чемпион, Хо СМ, Лин Х.С., Чен Х.Дж., Лин П.С., Ляо В.К., Чен В.Т., Ло С.К., Ван С.Ю., Го ЦЙ, Ли СН, Ку Ц. Клинические проявления, течение и исходы у пациентов с нейтрализующими аутоантителами к интерферону-γ и диссеминированными нетуберкулезными микобактериальными инфекциями.Медицина. 2016; 95 (25): e3927.
CAS Статья PubMed PubMed Central Google Scholar
Duraisingham SS, Buckland M, Dempster J, Lorenzo L, Grigoriadou S, Longhurst HJ. Первичная и вторичная недостаточность антител: клинические особенности и исходы инфекции при заместительной терапии иммуноглобулином. PLoS ONE. 2014; 9 (6): e100324.
Артикул CAS PubMed PubMed Central Google Scholar
Duraisingham SS, Бакленд MS, Grigoriadou S, Longhurst HJ. Вторичный дефицит антител. Эксперт Рев Клин Иммунол. 2014; 10 (5): 583–91.
CAS Статья PubMed Google Scholar
Шривастава С., Вуд П. Вторичный дефицит антител — причины и подход к диагностике. Clin Med. 2016; 16 (6): 571–6.
Артикул Google Scholar
Бойл Дж. М., Бакли Р. Х.Распространенность диагностированных первичных иммунодефицитных заболеваний среди населения в США. J Clin Immunol. 2007. 27 (5): 497–502.
CAS Статья PubMed Google Scholar
Bonilla FA, Khan DA, Ballas ZK, Chinen J, Frank MM, Hsu JT, Keller M, Kobrynski LJ, Komarow HD, Mazer B, Nelson RP Jr, Orange JS, Routes JM, Shearer WT, Sorensen RU, Вербски Дж. В., Бернштейн Д. И., Блессинг-Мур Дж., Ланг Д., Никлас Р. А., Оппенгеймер Дж., Портной Дж. М., Рэндольф С. Р., Шуллер Д., Спектор С. Л., Тиллес С., Уоллес Д.Совместная рабочая группа по параметрам практики, представляющая американскую академию аллергии, астмы и иммунологии; Американский колледж аллергии, астмы и иммунологии; и Объединенный совет по аллергии, астме и иммунологии. Параметр практики для диагностики и лечения первичного иммунодефицита. J Allergy Clin Immunol. 2015; 136 (5): 1186–205.
Артикул PubMed Google Scholar
Шехата Н., Палда В., Боуэн Т., Хаддад Е., Иссекутц ТБ, Мазер Б., Шелленберг Р., Уоррингтон Р., Истон Д., Андерсон Д., Хьюм Х.Использование иммуноглобулиновой терапии у пациентов с первичным иммунодефицитом: практическое руководство, основанное на фактических данных. Transfus Med Rev.2010; 24 (Приложение 1): S28–50.
Артикул PubMed Google Scholar
Seidel MG. Аутоиммунные и другие цитопении при первичных иммунодефицитах: патомеханизмы, новые дифференциальные диагнозы и лечение. Кровь. 2014. 124 (15): 2337–44.
CAS Статья PubMed PubMed Central Google Scholar
Мальфеттес М., Жерар Л., Кармагнат М., Муийо Г., Винс Н., Бутбул Д., Березне А., Нов-Жоссеран Р., Лемоинг В., Тету Л., Виаллар Д. Ф., Боннот Б., Павик М., Харош Д., Ларрош С., Бруэ Дж. , Ферманд Дж. П., Рабиан К., Фиески С., Оксенхендлер Э., Исследовательская группа DEFI. Комбинированный иммунодефицит с поздним началом: разновидность общего вариабельного иммунодефицита с тяжелым дефектом Т-лимфоцитов. Clin Infect Dis. 2009. 49 (9): 1329–38.
CAS Статья PubMed Google Scholar
Mogensen TH. Первичные иммунодефициты с повышенным уровнем IgE. Int Rev Immunol. 2016; 35 (1): 39–56.
CAS PubMed Google Scholar
Oliveira JB, Fleisher TA. Лабораторная оценка первичных иммунодефицитов. J Allergy Clin Immunol. 2010; 125 (2 приложение 2): S297–305.
Артикул PubMed Google Scholar
Конли М.Э., Доббс А.К., Фермер Д.М., Килич С., Пэрис К., Григориаду С., Кустан-Смит Е., Ховард В., Кампана Д.Первичные В-клеточные иммунодефициты: сравнения и контрасты. Анну Рев Иммунол. 2009. 27: 199–227.
CAS Статья PubMed Google Scholar
Фишер А., Прово Дж., Джейс Дж. П., Алькаис А., Махлауи Н., члены французской исследовательской группы CEREDIH PID. При первичных иммунодефицитах часто возникают аутоиммунные и воспалительные проявления. J Allergy Clin Immunol. 2017; 140 (5): 1388–93.
CAS Статья PubMed Google Scholar
Bonilla FA, Barlan I, Chapel H, Costa-Carvalho BT, Cunningham-Rundles C, de la Morena MT, Espinosa-Rosales FJ, Hammarström L, Nonoyama S, Quinti I, Routes JM, Tang ML, Warnatz K. International Consensus Документ (ЗНАЧОК): общие вариабельные иммунодефицитные расстройства. J Allergy Clin Immunol Pract. 2016; 4 (1): 38–59.
Артикул PubMed Google Scholar
Lehman HK. Аутоиммунитет и иммунная дисрегуляция при первичных иммунодефицитных расстройствах.Curr Allergy Asthma Rep.2015; 15 (9): 53.
Артикул CAS PubMed Google Scholar
Bousfiha A, Jeddane L, Al-Herz W., Ailal F, Casanova J-L, Chatila T., Conley ME, Cunningham-Rundles C, Tang MLK. Фенотипическая классификация первичных иммунодефицитов IUIS 2015 г. J Clin Immunol. 2015; 35 (8): 727–38.
Артикул PubMed PubMed Central Google Scholar
Фонд иммунодефицита. Заболевания первичного иммунодефицита в Америке: первое общенациональное обследование пациентов и специалистов. 1995. https://primaryimmune.org/wp-content/uploads/2011/04/Primary-Immune-Deficiency-Diseases-in-America-The-First-National-Survey-of-Patients-and-Specialists-1995. pdf По состоянию на 8 марта 2017 г.
Immune Deficiency Foundation. Заболевания первичного иммунодефицита в Америке: 2007 г. — третий национальный опрос пациентов. https: // primaryimmune.org / wp-content / uploads / 2011/04 / Primary-Immunodeficiency-Diseases-in-America-2007The-Third-National-Survey-of-Patients.pdf. По состоянию на 8 марта 2017 г.
Kwan A, Puck JM. Анамнез и текущий статус скрининга новорожденных на тяжелый комбинированный иммунодефицит. Семин Перинатол. 2015; 39 (3): 194–205.
Артикул PubMed PubMed Central Google Scholar
Фонд Джеффри Моделла. Ресурсный центр по первичному иммунодефициту.http://www.info4pi.org/library/educational-materials/10-warning-signs По состоянию на 7 марта 2017 г.
Fleisher TA, Madkaikar M, Rosenzweig SD. Применение проточной цитометрии для оценки первичных иммунодефицитов. Индийский J Pediatr. 2016; 83 (5): 444–9.
Артикул PubMed PubMed Central Google Scholar
Абрахам Р.С., Обер Г. Проточная цитометрия, универсальный инструмент для диагностики и мониторинга первичных иммунодефицитов.Clin Vaccine Immunol. 2016; 23 (4): 254–71.
CAS Статья PubMed PubMed Central Google Scholar
Orange JS, Ballow M, Stiehm ER, Ballas ZK, Chinen J, De La Morena M, Kumararatne D, Harville TO, Hesterberg P, Koleilat M, McGhee S, Perez EE, Raasch J, Scherzer R, Schroeder H, Seroogy C, Huissoon A, Sorensen RU, Katial R. Использование и интерпретация диагностической вакцинации при первичном иммунодефиците: отчет рабочей группы Секции интересов базовой и клинической иммунологии Американской академии аллергии, астмы и иммунологии.J Allergy Clin Immunol. 2012; 130 (3 доп.): S1–24.
Артикул PubMed Google Scholar
Аль-Муса Х, Абуэльода М, Мониес Д.М., Аль-Тассан Н., Аль-Гонаиум А, Аль-Сауд Б., Аль-Декри Х., Арнаут Р., Аль-Мухсен С., Адес Н., Эльшорбаги С. , Аль Газлан С., Шейх Ф., Дасуки М., Эль-Байк Л., Эламин Т., Джабер А., Хейр О, Эль-Калиоби М., Субхани С., Аль Идрисси Е., Аль-Захрани М., Альхелале М., Алнадер Н., Аль- Отайби А., Каттан Р., Аль Абдельрахман К., Аль Бреакан М. М., Бен Хумаид Ф. С., Вакил С. М., Альзайер Ф., Аль-Дусери Х., Факих Т., Аль-Хисси С., Мейер Б. Ф., Хаввари А.Беспристрастный целевой молекулярный подход к секвенированию следующего поколения для первичных иммунодефицитных заболеваний. J Allergy Clin Immunol. 2016; 137 (6): 1780–7.
CAS Статья PubMed Google Scholar
Meyts I, Bosch B, Bolze A, Boisson B, Itan Y, Belkadi A, Pedergnana V, Moens L, Picard C, Cobat A, Bossuyt X, Abel L, Casanova JL. Секвенирование экзома и генома при врожденных пороках иммунитета. J Allergy Clin Immunol. 2016. 138 (4): 957–69.
CAS Статья PubMed PubMed Central Google Scholar
Галло В, Дотта Л., Джардино Дж., Чирилло Э, Лугарис В., Д’Ассанте Р., Прандини А., Консолини Р., Фэрроу Е. Г., Тиффолт I, Сондерс С. Дж., Леонарди А., Плебани А., Бадолато Р., Пигната С. Диагностика первичных иммунодефицитов с помощью секвенирования следующего поколения. Фронт Иммунол. 2016; 7: 466.
Артикул CAS PubMed PubMed Central Google Scholar
Пай С.Ю., Логан Б.Р., Гриффит Л.М., Бакли Р.Х., Парротт Р.Э., Дворак С.К., Капур Н., Хансон И.С., Филипович А.Х., Йонучи С., Салливан К.Э., Смолл Т.Н., Берроуз Л., Шкода-Смит С., Хейт А. , Pulsipher MA, Chan KW, Fuleihan RL, Haddad E, Loechelt B, Aquino VM, Gillio A, Davis J, Knutsen A, Smith AR, Moore TB, Schroeder ML, Goldman FD, Connelly JA, Porteus MH, Xiang Q, Shearer В.Т., Флейшер Т.А., Кон Д.Б., Пак Дж.М., Нотаранджело Л.Д., Коуэн М.Дж., О’Рейли Р.Дж. Результаты трансплантации при тяжелом комбинированном иммунодефиците, 2000–2009 гг.N Engl J Med. 2014; 371 (5): 434–46.
CAS Статья PubMed PubMed Central Google Scholar
Стенд C, Gaspar HB, Thrasher AJ. Лечение иммунодефицита с помощью генной терапии HSC. Тенденции Мол Мед. 2016; 22 (4): 317–27.
CAS Статья PubMed Google Scholar
Kuo CY, Kohn DB. Генная терапия для лечения первичного иммунодефицита.Curr Allergy Asthma Rep.2016; 16 (5): 39.
Артикул CAS PubMed PubMed Central Google Scholar
Нахирняк С., Лазарус А. Глава 4: Продукты иммунного глоблина. В: Клиническое руководство по переливанию крови.

 Он располагается в плоских и трубчатых костях.
Он располагается в плоских и трубчатых костях.