Исследование уровня общего билирубина в крови, цены в Нижнем Новгороде
Билирубин – это продукт распада гемоглобина. Он имеет интенсивный желто-коричневый цвет. В связи с этим сам билирубин и продукты его метаболизма придают желчи, калу и моче соответствующую окраску. В результате расщепления гемоглобина образуется непрямой (несвязанный) билирубин, который затем выделяется в циркулирующую кровь. За сутки у человека распадается около 1 % циркулирующих эритроцитов с образованием 100-250 мг билирубина. Один из основных компонентов желчи, содержится также в сыворотке в виде двух фракций: прямого (связанного, или конъюгированного) и непрямого (свободного, или несвязанного) билирубина, вместе составляющих общий билирубин крови. При повышении концентрации билирубина в сыворотке свыше 27 — 34 мкмоль/л появляется желтуха (лёгкая форма — до 85 мкмоль/л, среднетяжёлая — 86 — 169 мкмоль/л, тяжёлая форма — свыше 170 мкмоль/л). У новорожденных наблюдается физиологическая желтуха в первую неделю жизни (с повышением общего билирубина крови за счёт фракции непрямого билирубина), т.
Выделяют три основных типа нарушений обмена билирубина в организме, приводящих к его накоплению в крови:
1.Усиление гемолиза эритроцитов. Это происходит при заболеваниях, когда разрушаются относительно молодые красные клетки крови, причем доля эритроцитов, подвергающихся гемолизу, возрастает.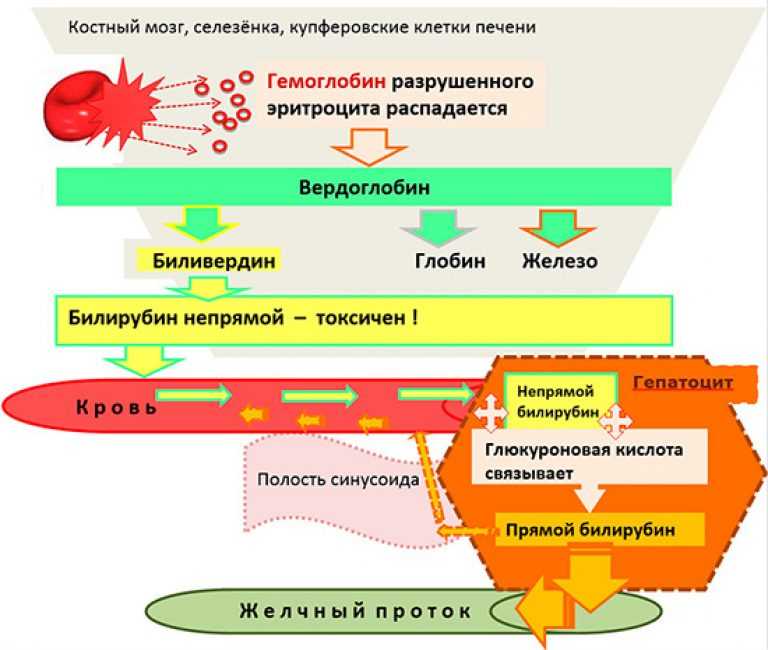 К таким отклонениям относятся некоторые заболевания крови, при которых происходит образование не вполне жизнеспособных эритроцитов (серповидно-клеточная анемия, сфероцитоз, сидеробластная анемия, пернициозная анемия), иммунная агрессия в отношении нормальных эритроцитов (гемолитическая болезнь новорожденных) и др. Кроме того, гемолиз эритроцитов может усиливаться в результате токсического действия на клетки крови некоторых химических веществ. Повышенный распад эритроцитов, в свою очередь, приводит к необходимости ферментативного расщепления большего количества гемоглобина в клетках ретикулоэндотелиальной системы. При этом образуется дополнительный объем непрямого билирубина, который впоследствии выделяется в кровоток. В итоге уровень билирубина повышен.
К таким отклонениям относятся некоторые заболевания крови, при которых происходит образование не вполне жизнеспособных эритроцитов (серповидно-клеточная анемия, сфероцитоз, сидеробластная анемия, пернициозная анемия), иммунная агрессия в отношении нормальных эритроцитов (гемолитическая болезнь новорожденных) и др. Кроме того, гемолиз эритроцитов может усиливаться в результате токсического действия на клетки крови некоторых химических веществ. Повышенный распад эритроцитов, в свою очередь, приводит к необходимости ферментативного расщепления большего количества гемоглобина в клетках ретикулоэндотелиальной системы. При этом образуется дополнительный объем непрямого билирубина, который впоследствии выделяется в кровоток. В итоге уровень билирубина повышен.
2.Нарушение функциональной и/или анатомической целостности печеночных клеток. К нему приводят заболевания, при которых поражаются клетки печени, наиболее распространены вирусные гепатиты. Кроме того, это может происходить при острых и хронических воздействиях токсических веществ: алкоголя, лекарственных средств, химикатов, применяемых в быту и промышленном производстве.
3.Кроме того, существует еще несколько других, не основных, причин повышенного содержания билирубина – это довольно редкие заболевания различного происхождения, но их клиническое значение невелико.
Таким образом, анализ на общий билирубин в сыворотке крови позволяет диагностировать различные заболевания, прямо или косвенно связанные с нарушением процессов кроветворения, функции печени и желчевыводящих путей.
Для чего используется исследование?
-Для диагностики различных заболеваний крови, при которых происходит усиленное разрушение эритроцитов: серповидно-клеточной анемии, сфероцитоза, сидеробластной/пернициозной анемии.
-Чтобы оценить состояние печени (целостность ее клеточных элементов).
-Чтобы выявить гепатит и степень его тяжести.
-Чтобы убедиться в нормальной проходимости желчных путей.
-Для диагностики физиологической и гемолитической желтухи новорожденных.
-Для диагностики некоторых заболеваний поджелудочной железы, а также других органов и тканей, связанных с желчевыводящими путями.
-Чтобы оценить тяжесть состояния больного при отравлении веществами, которые вызывают гемолиз эритроцитов.
Когда назначается исследование?
-При симптомах заболеваний крови.
-Когда необходимо оценить функциональное состояние печени.
-При желтухе, в частности у новорожденных.
-При диагностике заболеваний печени.
-При оценке функции желчных путей.
-При подозрении на вирусный гепатит.
-Когда проводится клиническое наблюдение за пациентом с заболеванием печени.
-При симптомах закупорки желчных путей.
-При наблюдении за состоянием пациента, отравившегося определенными химическими веществами.
Исследование уровня свободного и связанного билирубина в крови (+ общий)
Билирубин – это продукт распада гемоглобина. Он имеет интенсивный желто-коричневый цвет. В связи с этим сам билирубин и продукты его метаболизма придают желчи, калу и моче соответствующую окраску. В результате расщепления гемоглобина образуется непрямой (несвязанный) билирубин, который затем выделяется в циркулирующую кровь. За сутки у человека распадается около 1 % циркулирующих эритроцитов с образованием 100-250 мг билирубина. Один из основных компонентов желчи, содержится также в сыворотке в виде двух фракций: прямого (связанного, или конъюгированного) и непрямого (свободного, или несвязанного) билирубина, вместе составляющих общий билирубин крови.

Для чего используется исследование?
-Для дифференциальной диагностики состояний, сопровождающихся желтушностью кожных покровов и склер.
— Для оценки степени гипербилирубинемии.
— Для дифференциальной диагностики желтух новорожденных и выявления риска развития билирубиновой энцефалопатии.
— Для диагностики гемолитической анемии.
— Для исследования функционального состояния печени.
— Для диагностики нарушений оттока желчи.
— Для наблюдения за пациентом, принимающим препараты с гепатотоксическими и/или гемолитическими свойствами.
— Для динамического наблюдения за пациентами с гемолитической анемией или патологией печени и желчевыводящих путей.
Когда назначается анализ?
-При клинических признаках патологии печени и желчевыводящих путей (желтуха, потемнение мочи, обесцвечивание стула, зуд кожных покровов, тяжесть и боли в правом подреберье).
-При обследовании новорожденных с выраженной и затянувшейся желтухой.
-При подозрении на гемолитическую анемию.
-При обследовании пациентов, регулярно употребляющих алкоголь.
-При использовании лекарственных препаратов с вероятным гепатотоксическим и/или гемолитическим побочным действием.
-При инфицировании вирусами гепатитов.
-При наличии хронических заболеваний печени (цирроз, гепатит, холецистит,желчнокаменная болезнь).
-При комплексном профилактическом обследовании пациента
Желтухи у новорожденных | #10/06
Желтуха, или визуальное проявление гипербилирубинемии, включает синдромы различного происхождения, общей чертой которых является желтушное прокрашивание кожи и слизистых оболочек. Всего насчитывается около 50 заболеваний, которые сопровождаются появлением желтушности кожных покровов. У взрослых прокрашивание кожи происходит при повышении уровня билирубина более 34 мкмоль/л, у новорожденных — при уровне билирубина от 70 до 120 мкмоль/л.
Желтухи периода новорожденности, обусловленные накоплением в крови избыточного количества билирубина, встречаются часто и иногда требуют проведения неотложных лечебных мероприятий. Непрямой билирубин является нейротоксическим ядом и при определенных условиях (недоношенность, гипоксия, гипогликемия, длительная экспозиция и т. д.) вызывает специфическое поражение подкорковых ядер и коры головного мозга — так называемую билирубиновую энцефалопатию. По различным данным, на первой неделе жизни желтуха встречается у 25–50% доношенных и у 70–90% недоношенных новорожденных.
д.) вызывает специфическое поражение подкорковых ядер и коры головного мозга — так называемую билирубиновую энцефалопатию. По различным данным, на первой неделе жизни желтуха встречается у 25–50% доношенных и у 70–90% недоношенных новорожденных.
Билирубин является конечным продуктом катаболизма гема и образуется преимущественно вследствие распада гемоглобина (около 75%) с участием гемоксигеназы, биливердинредуктазы, а также неферментных восстанавливающих веществ в клетках ретикулоэндотелиальной системы (РЭС). Другими источниками билирубина являются миоглобин и гемсодержащие ферменты печени (около 25%).
Естественный изомер билирубина — непрямой свободный билирубин — хорошо растворим в липидах, но плохо растворим в воде. В крови он легко вступает в химическую связь с альбумином, образуя билирубин-альбуминовый комплекс, благодаря чему в ткани поступает только менее 1% образующегося билирубина. Теоретически одна молекула альбумина может связать две молекулы билирубина.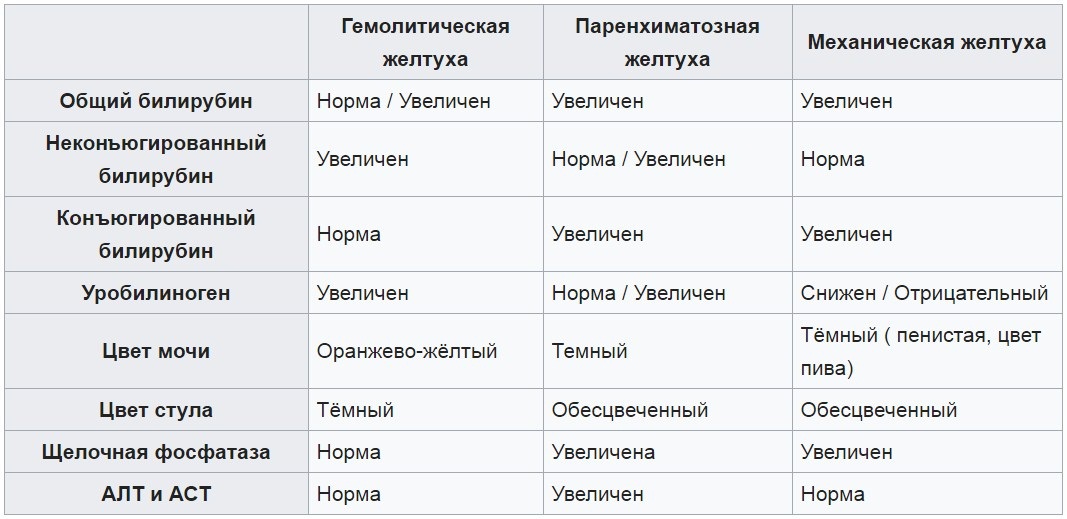 В комплексе с альбумином билирубин попадает в печень, где он путем активного транспорта проникает в цитоплазму, связывается с Y- и Z-протеинами и транспортируется в эндоплазматический ретикулум. Там под влиянием уридиндифосфатглюкуронилтрансферазы (УДФГТ) происходит соединение молекул билирубина с глюкуроновой кислотой и образуется моноглюкуронидбилирубин (МГБ). При транспортировке МГБ через цитоплазматическую мембрану в желчные капилляры происходит присоединение второй молекулы билирубина и образуется диглюкуронидбилирубин (ДГБ). Конъюгированный билирубин является водорастворимым, нетоксичным и выводится из организма с желчью и мочой. Далее билирубин в виде ДГБ экскретируется в желчные капилляры и выводится вместе с желчью в просвет кишечника. В кишечнике под влиянием кишечной микрофлоры происходит дальнейшая трансформация молекул билирубина, в результате которой образуется стеркобилин, выводящийся с калом.
В комплексе с альбумином билирубин попадает в печень, где он путем активного транспорта проникает в цитоплазму, связывается с Y- и Z-протеинами и транспортируется в эндоплазматический ретикулум. Там под влиянием уридиндифосфатглюкуронилтрансферазы (УДФГТ) происходит соединение молекул билирубина с глюкуроновой кислотой и образуется моноглюкуронидбилирубин (МГБ). При транспортировке МГБ через цитоплазматическую мембрану в желчные капилляры происходит присоединение второй молекулы билирубина и образуется диглюкуронидбилирубин (ДГБ). Конъюгированный билирубин является водорастворимым, нетоксичным и выводится из организма с желчью и мочой. Далее билирубин в виде ДГБ экскретируется в желчные капилляры и выводится вместе с желчью в просвет кишечника. В кишечнике под влиянием кишечной микрофлоры происходит дальнейшая трансформация молекул билирубина, в результате которой образуется стеркобилин, выводящийся с калом.
Практически все этапы билирубинового обмена у новорожденных характеризуются рядом особенностей: относительно большее количество гемоглобина на единицу массы тела, умеренный гемолиз эритроцитов даже в нормальных условиях, даже у здорового доношенного новорожденного ребенка содержание Y- и Z-протеинов, а также активность УДФГТ резко снижены в первые сутки жизни и составляют 5% от активности таковых систем у взрослых.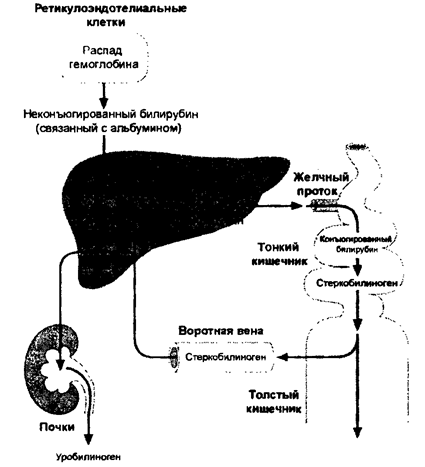 Повышение концентрации билирубина приводит к повышению активности ферментных систем печени в течение 3–4 дней жизни. Полное становление ферментных систем печени происходит к 1,5–3,5 мес жизни. Морфофункциональная незрелость, эндокринные расстройства (гипотиреоз, повышение в женском молоке прогестерона), нарушения углеводного обмена (гипогликемия), наличие сопутствующей инфекционной патологии существенно удлиняют сроки становления ферментных систем печени. Процессы выведения билирубина из организма также несовершенны, с чем связана повышенная кишечная реабсорбция билирубина. Заселение кишечника новорожденного нормальной кишечной микрофлорой резко сокращает количество билирубина, всасываемого из кишечника, и способствует нормализации процессов его выведения из организма.
Повышение концентрации билирубина приводит к повышению активности ферментных систем печени в течение 3–4 дней жизни. Полное становление ферментных систем печени происходит к 1,5–3,5 мес жизни. Морфофункциональная незрелость, эндокринные расстройства (гипотиреоз, повышение в женском молоке прогестерона), нарушения углеводного обмена (гипогликемия), наличие сопутствующей инфекционной патологии существенно удлиняют сроки становления ферментных систем печени. Процессы выведения билирубина из организма также несовершенны, с чем связана повышенная кишечная реабсорбция билирубина. Заселение кишечника новорожденного нормальной кишечной микрофлорой резко сокращает количество билирубина, всасываемого из кишечника, и способствует нормализации процессов его выведения из организма.
Все желтухи принято делить по уровню блока билирубинового обмена:
- на надпеченочные (гемолитические), связанные с повышенным распадом эритроцитов, когда клетки печени не способны утилизировать лавинообразно образующиеся большие количества билирубина;
- печеночные (паренхиматозные), связанные с наличием воспалительного процесса, нарушающего функции клеток печени;
- подпеченочные (механические), связанные с нарушением оттока желчи.

В практике неонатолога используется патогенетическая классификация желтух новорожденных (по Н. П. Шабалову, 1996), согласно которой выделяют:
- Желтухи, обусловленные повышенной продукцией билирубина (гемолитические): гемолитическая болезнь новорожденных, полицитемический синдром, синдром заглоченной крови, кровоизлияния, лекарственный гемолиз (передозировка витамина К, окситоцина, применение сульфаниламидов и др.), наследственные формы эритроцитарных мембрано- и ферментопатий, гемоглобинопатии.
- Желтухи, обусловленные пониженным клиренсом билирубина гепатоцитами (конъюгационные): наследственно обусловленные синдромы Жильбера, Криглера–Найяра I и II типов, Ариаса, нарушения обмена веществ (галактоземия, фруктоземия, тирозиноз, гиперметионинемия и др.), нарушение конъюгации билирубина при пилоростенозе, высокой кишечной непроходимости, применении некоторых лекарственных средств.
- Желтухи, обусловленные нарушением эвакуации конъюгированного билирубина с желчью по желчным путям и кишечнику (механические): аномалии развития желчевыводящих путей в сочетании с другими пороками развития (синдром Эдвардса, Аладжилля), семейные холестазы Байлера, Мак-Элфреша, синдромы Ротора и Дубина–Джонсона, муковисцидоз, α-1-антитрипсиновая недостаточность, синдром сгущения желчи, сдавление желчевыводящих путей опухолью, инфильтратами и др.

- Смешанного генеза: сепсис, внутриутробные инфекции.
На патологический характер желтухи всегда указывают следующие признаки: появление желтухи в первые сутки жизни, уровень билирубина более 220 мкмоль/л, почасовой прирост билирубина более 5 мкмоль/л в час (более 85 мкмоль/л в сутки), длительность ее более 14 дней, волнообразное течение заболевания, появление желтухи после 14-го дня жизни.
Наиболее частой причиной конъюгационных гипербилирубинемий у новорожденных является несоответствие между нормальной продукцией билирубина и несовершенной системой его выведения из организма вследствие незрелости ферментных систем печени. Для конъюгационной желтухи характерно появление ее на 3-и сутки жизни, отсутствие увеличения печени и селезенки, изменений в окраске стула и мочи, анемического симптомокомплекса.
Для транзиторной гипербилирубинемии новорожденных характерно появление желтухи в возрасте более 36 ч жизни. Почасовой прирост билирубина не должен превышать 3,4 мкмоль/л ч (85,5 мкмоль в сутки). Наибольшая интенсивность желтушного прокрашивания кожи приходится на 3–4-е сутки, при этом максимальный уровень билирубина не поднимается выше 204 мкмоль/л. Для транзиторной гипербилирубинемии характерно прогрессирующее снижение уровня билирубина и интенсивности желтухи после 4 сут и угасание ее к 8–10-м суткам. Общее состояние ребенка при этом не нарушается. Лечение не требуется.
Почасовой прирост билирубина не должен превышать 3,4 мкмоль/л ч (85,5 мкмоль в сутки). Наибольшая интенсивность желтушного прокрашивания кожи приходится на 3–4-е сутки, при этом максимальный уровень билирубина не поднимается выше 204 мкмоль/л. Для транзиторной гипербилирубинемии характерно прогрессирующее снижение уровня билирубина и интенсивности желтухи после 4 сут и угасание ее к 8–10-м суткам. Общее состояние ребенка при этом не нарушается. Лечение не требуется.
Для желтухи недоношенных новорожденных характерно более раннее начало (1–2-е сутки жизни), что создает трудности при дифференциации ее с гемолитической болезнью новорожденных. Однако данные анамнеза (группа крови матери и ребенка, отсутствие сенсибилизации) и лабораторных исследований (нормальный уровень гемоглобина, эритроцитов, отсутствие ретикулоцитоза) помогают поставить правильный диагноз. Длительность конъюгационной желтухи у недоношенных — до 3 нед.
В 1963 г. И. М. Ариасом была описана «желтуха от материнского молока» (прегнановая желтуха) у детей, находящихся на грудном вскармливании. Патогенез этого вида желтухи до конца не выяснен. Однако считается, что ее причиной является низкая конъюгация билирубина, являющаяся следствием тормозящего влияния прегнандиола, который содержится в избыточном количестве в крови некоторых женщин в послеродовом периоде, а также пониженная экскреция билирубина. Длительность желтухи составляет от 3 до 6 нед. Диагностическим тестом является отмена грудного вскармливания на 2–3-и сутки, на фоне чего желтуха начинает быстро разрешаться. При возобновлении вскармливания грудью уровень билирубина снова начинает расти.
Патогенез этого вида желтухи до конца не выяснен. Однако считается, что ее причиной является низкая конъюгация билирубина, являющаяся следствием тормозящего влияния прегнандиола, который содержится в избыточном количестве в крови некоторых женщин в послеродовом периоде, а также пониженная экскреция билирубина. Длительность желтухи составляет от 3 до 6 нед. Диагностическим тестом является отмена грудного вскармливания на 2–3-и сутки, на фоне чего желтуха начинает быстро разрешаться. При возобновлении вскармливания грудью уровень билирубина снова начинает расти.
Синдром Жильбера (конституциональная печеночная дисфункция) — наследственное заболевание, наследуемое по аутосомно-доминантному типу. Частота в популяции составляет 2–6%. Причиной является наследственное нарушение конъюгации непрямого билирубина вследствие нарушения захвата последнего печеночной клеткой. У новорожденных заболевание имеет сходство с транзиторной желтухой. Случаев ядерной желтухи не описано. Прогноз благоприятный. Диагноз ставится на основании семейного анамнеза, длительно сохраняющейся гипербилирубинемии при отсутствии других патологических изменений. Назначение фенобарбитала приводит к резкому уменьшению желтушности, что также свидетельствует о наличии данного заболевания.
Прогноз благоприятный. Диагноз ставится на основании семейного анамнеза, длительно сохраняющейся гипербилирубинемии при отсутствии других патологических изменений. Назначение фенобарбитала приводит к резкому уменьшению желтушности, что также свидетельствует о наличии данного заболевания.
Наследуемое нарушение пигментного обмена при синдроме Криглера–Найяра обусловлено отсутствием (I тип) или очень низкой активностью (II тип) глюкуронилтрансферазы в клетках печени.
При синдроме Криглера–Найяра I типа заболевание наследуется по аутосомно-рецессивному типу. Характерна интенсивная желтуха с первых дней жизни с повышением уровня непрямого билирубина сыворотки крови в 15–50 раз выше нормы, полным отсутствием прямой фракции билирубина. При естественном течении заболевания в большинстве случаев происходит прокрашивание ядер мозга, может отмечаться летальный исход. Назначение фенобарбитала неэффективно. Единственным способом лечения являются проведение фототерапии и трансплантация печени.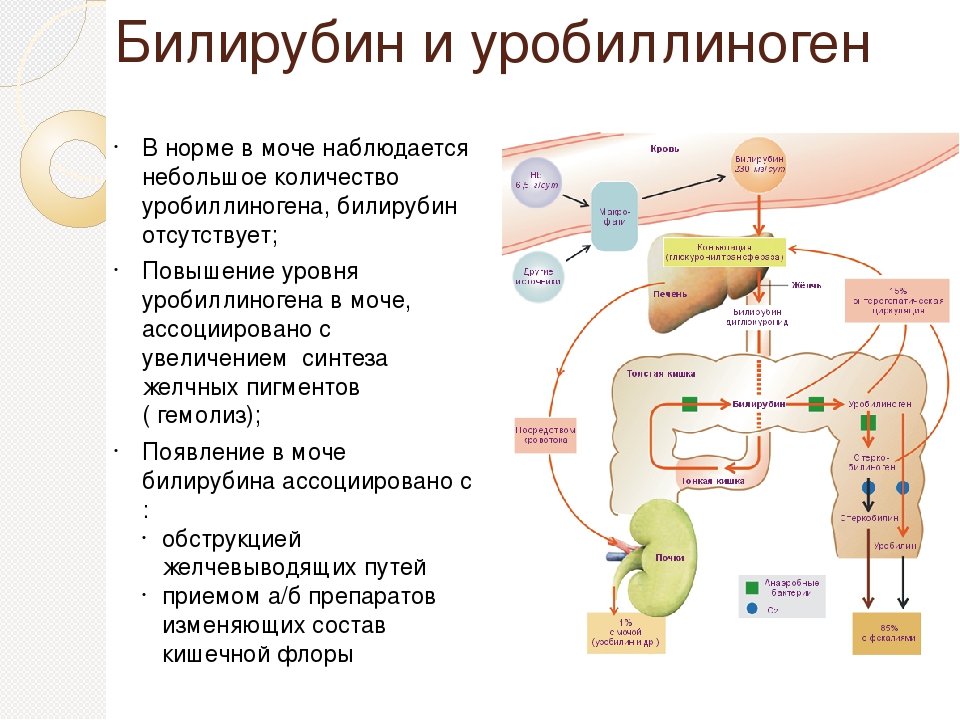
При II типе заболевания, которое наследуется по аутосомно-доминантному типу, наряду с менее интенсивной желтухой и уровнем непрямого билирубина в 15–20 раз больше нормы, в крови определяется прямая фракция билирубина. Отличительной чертой является положительный ответ на назначение фенобарбитала. Прогностически синдром Криглера–Найяра II типа более благоприятный. Развитие билирубиновой энцефалопатии наблюдается крайне редко.
Первым симптомом наследственно обусловленных нарушений обмена веществ, таких, как галактоземия, фруктоземия, тирозинемия и др., также может быть желтуха, имеющая конъюгационный характер. В первую очередь врача должно насторожить сочетание затяжной желтухи с такими симптомами, как рвота, диарея, гепатомегалия, прогрессирующая гипотрофия, тяжелая неврологическая симптоматика в виде судорог, мышечной гипотонии, парезов, параличей, атаксии, развитие катаракты, задержки нервно-психического развития. Диагноз подтверждается наличием галактозы в моче, позитивными пробами на сахар и другими специальными методами выявления нарушения обмена веществ в каждом отдельном случае.
Желтуха при гипотиреозе отмечается у новорожденных в зависимости от степени недостаточности функции щитовидной железы и сочетается с другими симптомами заболевания, такими, как крупный вес при рождении, выраженный отечный синдром, низкий тембр голоса новорожденного, ранние и упорные запоры и др. В биохимическом анализе крови наряду с непрямой гипербилирубинемией отмечается повышение холестерина. Скрининг-тест на гипотиреоз положительный, в крови повышен уровень тиреотропного гормона при снижении Т4. Длительная (от 3 до 12 нед) желтуха при гипотиреозе обусловлена замедлением всех метаболических процессов, в том числе и созревания глюкуронилтрансферазных систем печени. Своевременная постановка диагноза (в течение первого месяца жизни) и назначение заместительной терапии тиреоидином или L-тироксином приводят к нормализации билирубинового обмена.
Желтуха при полицитемии (диабетической фетопатии) обусловлена задержкой созревания ферментных систем печени на фоне гипогликемии при повышенном гемолизе. Контроль и коррекция гипогликемии, назначение индукторов микросомальных ферментов печени способствуют нормализации обмена билирубина.
Контроль и коррекция гипогликемии, назначение индукторов микросомальных ферментов печени способствуют нормализации обмена билирубина.
Желтуха при пилоростенозе и высокой кишечной непроходимости обусловлена как нарушением конъюгирующих систем печени вследствие обезвоживания и гипогликемии, так и повышенным обратным всасыванием билирубина из кишечника. В данной ситуации лишь устранение пилоростеноза и обструкции кишечника приводят к нормализации пигментного обмена.
Применение лекарственных средств (глюкокортикоиды, некоторые виды антибиотиков и др.) может приводить к резкому нарушению процессов конъюгации в печени вследствие конкурентного вида метаболизма вышеуказанных препаратов. В каждом конкретном случае необходим анализ терапевтических мероприятий, а также знание метаболических особенностей препаратов, назначаемых новорожденному.
Для всех гемолитических желтух характерно наличие симптомокомплекса, включающего желтуху на бледном фоне (лимонная желтуха), увеличение печени и селезенки, повышение в сыворотке крови уровня непрямого билирубина, разной степени тяжести нормохромную анемию с ретикулоцитозом. Тяжесть состояния ребенка всегда обусловлена не только билирубиновой интоксикацией, но и выраженностью анемии.
Тяжесть состояния ребенка всегда обусловлена не только билирубиновой интоксикацией, но и выраженностью анемии.
Гемолитическая болезнь новорожденных возникает в результате несовместимости крови матери и ребенка по резус-фактору, его подтипам или группам крови. Заболевание протекает в виде отечной, желтушной и анемической форм. Отечная форма наиболее тяжелая и проявляется врожденной анасаркой, выраженной анемией, гепатоспленомегалией. Как правило, такие дети нежизнеспособны. Желтушная и анемическая формы заболевания более благоприятны, но также могут представлять угрозу здоровью ребенка. При легком течении уровень гемоглобина в пуповинной крови составляет более 140 г/л, уровень непрямого билирубина в сыворотке крови менее 60 мкмоль/л. В этом случае достаточно проведения консервативной терапии. При гемолитической болезни новорожденных средней степени тяжести и тяжелом течении может потребоваться проведение операции заменного переливания крови. В клинической картине желтуха либо врожденная, либо появляется в течение первых суток жизни, имеет бледно-желтый (лимонный) оттенок, неуклонно прогрессирует, на фоне чего может появляться неврологическая симптоматика билирубиновой интоксикации. Всегда отмечается гепатоспленомегалия. Изменения цвета кала и мочи нехарактерно.
Всегда отмечается гепатоспленомегалия. Изменения цвета кала и мочи нехарактерно.
Поражение структур центральной нервной системы (ЦНС) происходит при повышении уровня непрямого билирубина в сыворотке крови у доношенных новорожденных выше 342 мкмоль/л.
Для недоношенных детей этот уровень колеблется от 220 до 270 мкмоль/л, для глубоконедоношенных — от 170 до 205 мкмоль/л. Однако необходимо помнить, что глубина поражения ЦНС зависит не только от уровня непрямого билирубина, но и от времени его экспозиции в тканях головного мозга и сопутствующей патологии, усугубляющей тяжелое состояние ребенка.
Профилактические мероприятия для предупреждения развития гемолитической болезни новорожденных, которые должны проводиться уже в женской консультации, заключаются в постановке на учет всех женщин с резус-отрицательной и с 0(I) группой крови, выяснении данных анамнеза в плане наличия фактора сенсибилизации, определении уровня резус-антител и при необходимости проведении досрочного родоразрешения. Всем женщинам с резус-отрицательной кровью в первый день после родов показано введение анти-D-глобулина.
Всем женщинам с резус-отрицательной кровью в первый день после родов показано введение анти-D-глобулина.
При развитии гемолитической болезни новорожденному проводится заменное переливание крови, в дооперационном периоде применяют фото- и инфузионную терапию.
Наследственные гемолитические анемии отличаются большим разнообразием. Самая распространенная из них — микросфероцитарная гемолитическая анемия Минковского–Шоффара. Дефектный ген локализован в 8-й паре хромосом. Результатом мутации является продукция аномальных эритроцитов, имеющих сферическую форму и меньшие (менее 7 нм) размеры, подвергающихся избыточному разрушению в криптах селезенки. Для анамнеза характерно наличие в семье родственников с аналогичным заболеванием. Диагноз подтверждается обнаружением микросфероцитарных эритроцитов, сдвигом кривой Прайс–Джонса влево, снижением осмотической стойкости эритроцитов, изменением индекса сферичности и средней концентрации гемоглобина в эритроцитах. Заболевание протекает волнообразно, гемолитические кризы сопровождаются повышением температуры тела, снижением аппетита и рвотами. Кризы провоцируются, как правило, острыми вирусными заболеваниями, переохлаждением, назначением сульфаниламидов и т. д. Основным методом лечения считается спленэктомия.
Заболевание протекает волнообразно, гемолитические кризы сопровождаются повышением температуры тела, снижением аппетита и рвотами. Кризы провоцируются, как правило, острыми вирусными заболеваниями, переохлаждением, назначением сульфаниламидов и т. д. Основным методом лечения считается спленэктомия.
В период новорожденности может выявляться еще один вид наследственной гемолитической анемии, характеризующийся изменением формы эритроцитов — так называемый инфантильный пикноцитоз. Первые признаки заболевания появляются на первой неделе жизни и чаще у недоношенных детей. Эритроциты в окрашенном мазке крови имеют шиповидные отростки. Помимо анемии выявляются также отеки и тромбоцитоз. Назначение витамина Е в дозе 10 мг/кг в сутки приводит в большинстве случаев к клинико-лабораторной ремиссии.
При исследовании мазка крови у новорожденных могут быть выявлены и мишеневидные эритроциты, что характерно для гемоглобинопатий (талассемия, серповидно-клеточная анемия). Серповидно-клеточная анемия встречается чаще у жителей Средней Азии, Азербайджана и Армении и проявляется в неонатальном периоде только у гомозиготных носителей s-гемоглобина.
Серповидно-клеточная анемия встречается чаще у жителей Средней Азии, Азербайджана и Армении и проявляется в неонатальном периоде только у гомозиготных носителей s-гемоглобина.
Диагноз наследственных энзимопенических анемий (дефицит глюкозо-6-фосфатдегидрогеназы, пируваткиназы, гексогеназы, 2,3-дифосфоглицеромутазы, фосфогексоизомеразы) новорожденным ставится крайне редко, так как требует проведения высокодифференцированных исследований. В клинической картине у новорожденных с этой патологией выявляются гемолитическая анемия с ретикулоцитозом, увеличение печени и селезенки. Характерен семейный анамнез.
Большие гематомы в периоде новорожденности также могут стать причиной выраженной непрямой гипербилирубинемии и анемии. Наличие у ребенка больших размеров кефалогематом, внутрижелудочковых кровоизлияний, субкапсулярных гематом паренхиматозных органов, массивных кровоизлияний в мягкие ткани сопровождается характерной клинической картиной.
Механические желтухи характеризуются накоплением в крови прямого (связанного) билирубина, что сопровождается желтухой, имеющей зеленоватый оттенок, увеличением размеров печени, изменением окраски стула (обесцвечивание) и мочи (нарастание интенсивности окраски).
Синдром сгущения желчи у новорожденных развивается как осложнение гемолитической болезни новорожденных, имеющих обширные кефалогематомы, а также перенесших асфиксию в родах. При этом нарастание интенсивности желтухи отмечается с конца первой недели жизни, сопровождается увеличением размеров печени, иногда значительным, и частичным обесцвечиванием стула. Лечение заключается в применении холеретиков и холекинетиков.
Кроме того, синдром сгущения желчи может являться одним из наиболее ранних клинических проявлений муковисцидоза, особенно если он сочетается с мекониальным илеусом или поражением бронхолегочной системы. Постановке правильного диагноза в данном случае способствуют определение содержания альбумина в меконии, ультразвуковое исследование (УЗИ) поджелудочной железы, проведение потовой пробы.
Причиной механической желтухи в периоде новорожденности могут быть пороки развития желчевыводящих путей: внутри- и внепеченочная атрезия желчных ходов, поликистоз, перекруты и перегибы желчного пузыря, артериопеченочная дисплазия, синдром Аладжилля, синдромальное уменьшение количества междольковых желчных протоков.
При атрезии желчевыводящих путей первым признаком порока развития служит желтуха, которая носит упорно нарастающий характер, сопровождается зудом кожных покровов, из-за чего дети бывают очень беспокойны и раздражительны. Постепенно нарастают размеры и плотность печени, изменяется характер стула: он становится частично или полностью обесцвеченным. Явления холестаза приводят к мальабсорбции жиров и жирорастворимых витаминов, нарастают гипотрофия и гиповитаминоз. В возрасте 4–6 мес появляются признаки портальной гипертензии, геморрагического синдрома. Без оперативного вмешательства такие пациенты погибают в возрасте до 1–2 лет жизни. Биохимический анализ крови выявляет наличие гипопротеинемии, гипоальбуминемии, повышение прямого билирубина, щелочной фосфатазы.
При синдроме канальцевой гипоплазии желчных путей (синдром Аладжилля), наследуемом по аутосомно-рецессивному типу, определяются и другие пороки развития: гипоплазия или стеноз легочной артерии, аномалии позвоночных дуг, почек.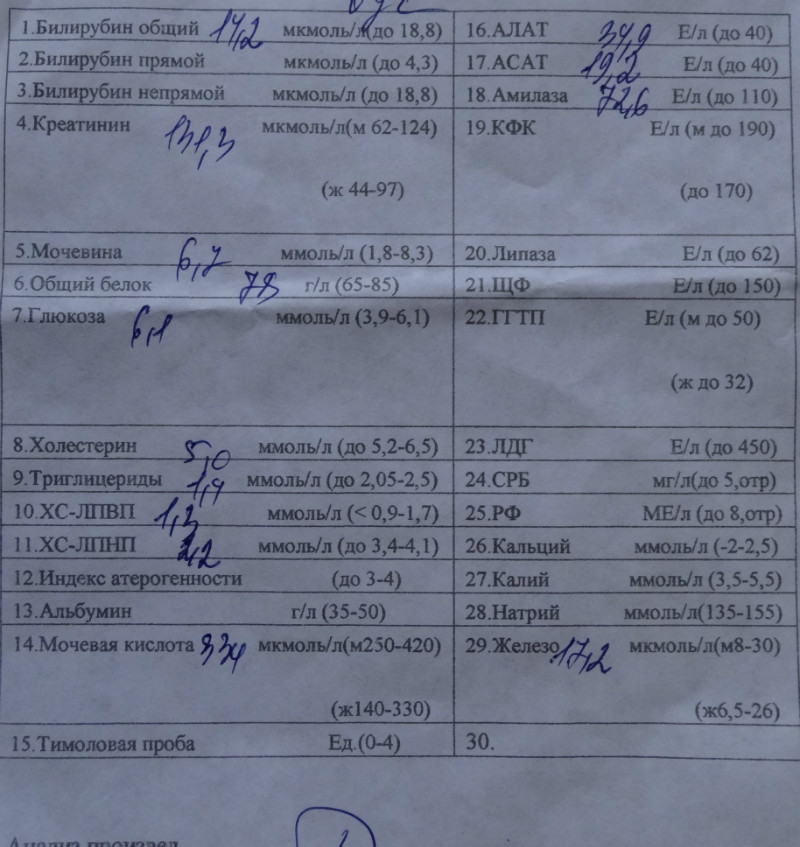 Характерны стигмы дизэмбриогенеза: гипертелоризм, выступающий лоб, глубоко посаженные глаза, микрогнатия.
Характерны стигмы дизэмбриогенеза: гипертелоризм, выступающий лоб, глубоко посаженные глаза, микрогнатия.
Известны семейные формы холестаза, проявляющиеся в периоде новорожденности. При синдроме Мак-Элфреша отмечается наличие обесцвеченного стула в течение длительного периода времени, вплоть до нескольких месяцев. В дальнейшем отклонений в состоянии ребенка не отмечается. При синдроме Байлера, напротив, после эпизода холестаза в первые месяцы жизни развивается билиарный цирроз печени.
Механические желтухи могут быть обусловлены сдавлением желчных протоков извне опухолью, инфильтратами и другими образованиями брюшной полости. Нередко отмечается обтурация общего желчного протока при врожденной желчнокаменной болезни.
Выделяют группу наследственно обусловленных дефектов экскреции связанного билирубина. К ним относятся синдром Дубина–Джонсона, обусловленный «поломкой» каналикулярной транспортной системы. Синдром наследуется по аутосомно-рецессивному типу, сопровождается умеренным повышением уровня прямого билирубина, небольшим увеличением размеров печени, массивным выделением с мочой копропорфиринов.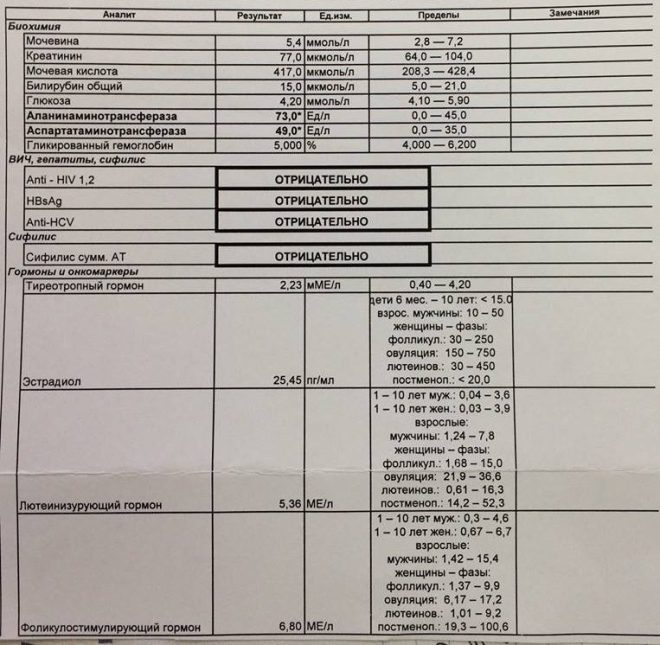 В биоптатах в клетках печени наблюдается отложение коричнево-черного пигмента, напоминающего меланин. Синдром Ротора также наследуется по аутосомно-рецессивному типу, но в основе этого синдрома лежит дефект захвата и накопления клетками печени органических анионов. Клиническая картина аналогична таковой при синдроме Дубина–Джонсона. Отложения пигмента в клетках печени нет.
В биоптатах в клетках печени наблюдается отложение коричнево-черного пигмента, напоминающего меланин. Синдром Ротора также наследуется по аутосомно-рецессивному типу, но в основе этого синдрома лежит дефект захвата и накопления клетками печени органических анионов. Клиническая картина аналогична таковой при синдроме Дубина–Джонсона. Отложения пигмента в клетках печени нет.
Постановке правильного диагноза при синдроме холестаза в период новорожденности помогают УЗИ печени, радиоизотопное сканирование, чрескожная биопсия печени, холангиография и т. д.
Паренхиматозные желтухи обусловлены поражением паренхимы печени воспалительного характера. Причиной поражения могут являться вирусы, бактерии и простейшие: вирус гепатита В и С, цитомегаловирус, Коксаки, краснухи, Эпстайна–Барр, вирус простого герпеса, бледная трепонема, токсоплазма и др. Септический процесс у новорожденного может сопровождаться прямым бактериальным поражением печени.
Клиническая картина паренхиматозной желтухи включает в себя ряд общих и строго специфических признаков: дети часто рождаются недоношенными или незрелыми, с задержкой внутриутробного развития, маловесными к сроку гестации, имеют признаки поражения нескольких органов и систем, вследствие чего состояние их при рождении расценивается как крайне тяжелое. Желтуха имеется уже при рождении и носит сероватый, «грязный» оттенок, на фоне выраженных нарушений микроциркуляции, часто с проявлениями кожного геморрагического синдрома. Характерна гепатоспленомегалия. При исследовании биохимического анализа сыворотки крови выявляются как прямая, так и непрямая фракции билирубина, повышенная активность (в 10-100 раз) трансаминаз печени, увеличение щелочной фосфатазы, глутаматдегидрогеназы. Метод Эберлейна свидетельствует о серьезных нарушениях в конъюгационных механизмах печеночной клетки — подавляющее количество прямого билирубина представлено фракцией моноглюкуронидбилирубина. Общий анализ крови нередко выявляет анемию, ретикулоцитоз, тромбоцитопению, лейкоцитоз или лейкопению. В коагулограмме — дефицит плазменного звена гемостаза, фибриногена. Для установления возбудителя инфекционного процесса проводятся его идентификация путем полимеразной цепной реакции (ПЦР), определение титров специфических иммуноглобулина М и иммуноглобулина G. Лечение заключается в назначении специфической антибактериальной, противовирусной и иммунокорригирующей терапии.
Желтуха имеется уже при рождении и носит сероватый, «грязный» оттенок, на фоне выраженных нарушений микроциркуляции, часто с проявлениями кожного геморрагического синдрома. Характерна гепатоспленомегалия. При исследовании биохимического анализа сыворотки крови выявляются как прямая, так и непрямая фракции билирубина, повышенная активность (в 10-100 раз) трансаминаз печени, увеличение щелочной фосфатазы, глутаматдегидрогеназы. Метод Эберлейна свидетельствует о серьезных нарушениях в конъюгационных механизмах печеночной клетки — подавляющее количество прямого билирубина представлено фракцией моноглюкуронидбилирубина. Общий анализ крови нередко выявляет анемию, ретикулоцитоз, тромбоцитопению, лейкоцитоз или лейкопению. В коагулограмме — дефицит плазменного звена гемостаза, фибриногена. Для установления возбудителя инфекционного процесса проводятся его идентификация путем полимеразной цепной реакции (ПЦР), определение титров специфических иммуноглобулина М и иммуноглобулина G. Лечение заключается в назначении специфической антибактериальной, противовирусной и иммунокорригирующей терапии.
Обобщая вышесказанное, отметим, что диагностические мероприятия при неонатальных желтухах должны учитывать ряд положений.
- При сборе анамнеза необходимо обратить внимание на возможный семейный характер заболевания: имеют значение случаи затяжной желтухи, анемии, спленэктомии у родителей или родственников.
- Анамнез со стороны матери должен обязательно содержать сведения о группе крови и резус-факторе у нее и отца ребенка, наличии предыдущих беременностей и родов, операций, травм, переливаний крови без учета резус-фактора. У женщины во время беременности могут быть выявлены нарушение толерантности к глюкозе, сахарный диабет, инфекционный процесс. Необходимо также выяснить, не принимала ли женщина препараты, оказывающие влияние на билирубиновый обмен.
- Анамнез новорожденного включает определение срока гестации, масса-ростовых показателей, оценки по шкале Апгар при рождении, выяснение характера вскармливания (искусственного или естественного), времени появления желтушного прокрашивания кожи.

- Физикальное обследование помогает определить оттенок желтухи, установить ориентировочный уровень билирубина при помощи иктерометра. Определяется наличие кефалогематом или обширных экхимозов, геморрагических проявлений, отечного синдрома, гепатоспленомегалии. Следует обращать внимание на характер окраски мочи и стула. Важным диагностическим моментом является правильная трактовка неврологического статуса ребенка.
- Лабораторные методы включают клинический анализ крови с определением гематокрита, мазок периферической крови (необходимы для диагностики нарушений формы и размеров эритроцитов), определение группы крови и резус-фактора у матери и ребенка (позволяет установить причину гемолитической болезни новорожденных).
Кроме того, проведение прямой и непрямой пробы Кумбса позволит предположить, имеет ли место несовместимость крови матери и ребенка по редким факторам.
Биохимический анализ крови (определение общего билирубина и его фракций, уровня трансаминаз печени, щелочной фосфатазы, концентрации общего белка, альбумина, глюкозы, мочевины и креатинина, холестерина и триглицеридов, С-реактивного белка, тимоловой пробы и т. д.) позволяет не только диагностировать вид желтухи, но и собрать данные о состоянии других органов и систем, имеющие большое значение при назначении радикальных способов лечения (например, об изначальной функции почек очень важно иметь представление до проведения заменного переливания крови, так как одним из осложнений этой операции является острая почечная недостаточность).
д.) позволяет не только диагностировать вид желтухи, но и собрать данные о состоянии других органов и систем, имеющие большое значение при назначении радикальных способов лечения (например, об изначальной функции почек очень важно иметь представление до проведения заменного переливания крови, так как одним из осложнений этой операции является острая почечная недостаточность).
Метод Эберлейна (определение фракций прямого билирубина — моно- и диглюкуронидбилирубина) имеет значение при дифференциальной диагностике механических и паренхиматозных желтух.
Необходимо также проведение тестов на выявление инфекционного агента в крови, стадии заболевания (ПЦР, иммуноферментный анализ, определение количества и вида иммуноглобулинов, определение авидности и аффинности антител, реакция Вассермана и др.).
Определение профиля гормонов щитовидной железы проводится при подозрении на гипотиреоз.
Осмотическая резистентность эритроцитов, электрофорез гемоглобина, скрининг-тесты на определение глюкозо-6-фосфатдегидрогеназы проводятся с целью уточнения причины наследственных гемолитических анемий.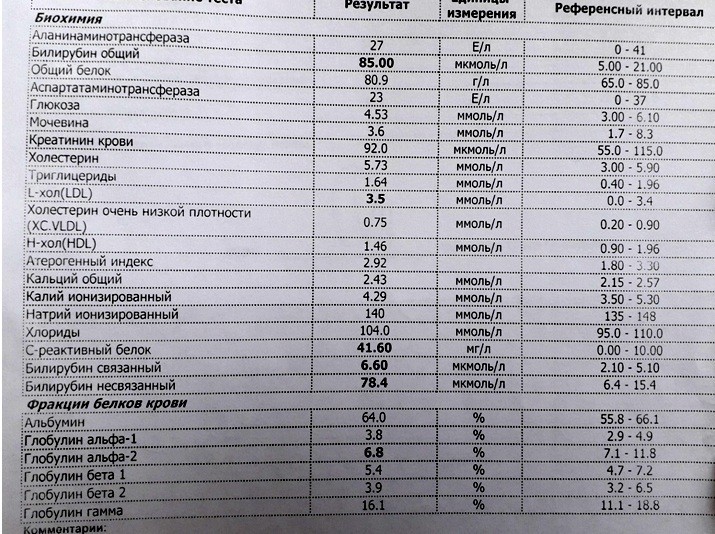
Потовая проба при подозрении на муковисцидоз проводится у детей старше 1 мес жизни; в раннем неонатальном периоде можно практиковать определение содержания альбумина в меконии.
Анализы включают также определение содержания a-1-антитрипсина в сыворотке крови, УЗИ головного мозга, внутренних органов брюшной полости.
Рентгенологический метод, компьютерная томография проводятся при подозрении на кишечную непроходимость, внутричерепные кровоизлияния, фиброэзофагогастродуоденоскопия — при подозрении на пилоростеноз. Чрескожная биопсия печени проводится в спорных случаях с целью верификации диагноза.
До начала проведения лечебных мероприятий необходимо определить способ кормления новорожденного: грудное вскармливание не допускается при гемолитической болезни новорожденных, галактоземии, тирозинемии.
Лечение гипербилирубинемий
Рассмотрим сновные методы лечения гипербилирубинемий.
- Фототерапия на современном этапе — самый эффективный метод лечения непрямой гипербилирубинемии.
 Суть действия фототерапии заключается в фотоизомеризации непрямого билирубина, т. е. превращении его в водорастворимую форму. В настоящее время существует несколько разновидностей ламп синего света, с длиной волны 410–460 нм, позволяющих выбрать необходимую схему лечения (непрерывную, прерывистую). Современные оптико-волоконные аппараты Biliblanket лишены практически всех побочных эффектов, компактны, не нарушают обычного режима ребенка и общения его с матерью. Фототерапию начинают проводить, когда есть угроза роста билирубина до токсического значения. Лампы располагают на расстоянии 20–40 см от уровня кожи ребенка, мощность излучения должна составлять не менее 5–9 нВТ/см2/нм. Фототерапия проводится непрерывно, прерывать ее можно только на время кормления и визитов матери. Глаза и наружные половые органы ребенка закрываются светонепроницаемой тканью. Если фототерапию применяют у новорожденного с прямой гипербилирубинемией, можно наблюдать изменение цвета кожных покровов — синдром «бронзового ребенка».
Суть действия фототерапии заключается в фотоизомеризации непрямого билирубина, т. е. превращении его в водорастворимую форму. В настоящее время существует несколько разновидностей ламп синего света, с длиной волны 410–460 нм, позволяющих выбрать необходимую схему лечения (непрерывную, прерывистую). Современные оптико-волоконные аппараты Biliblanket лишены практически всех побочных эффектов, компактны, не нарушают обычного режима ребенка и общения его с матерью. Фототерапию начинают проводить, когда есть угроза роста билирубина до токсического значения. Лампы располагают на расстоянии 20–40 см от уровня кожи ребенка, мощность излучения должна составлять не менее 5–9 нВТ/см2/нм. Фототерапия проводится непрерывно, прерывать ее можно только на время кормления и визитов матери. Глаза и наружные половые органы ребенка закрываются светонепроницаемой тканью. Если фототерапию применяют у новорожденного с прямой гипербилирубинемией, можно наблюдать изменение цвета кожных покровов — синдром «бронзового ребенка». К осложнениям фототерапии относятся ожоги кожи, непереносимость лактозы, гемолиз, дегидратация, гипертермия и загар. При проведении фототерапии обязательны мероприятия по поддержанию постоянного водного баланса новорожденного.
К осложнениям фототерапии относятся ожоги кожи, непереносимость лактозы, гемолиз, дегидратация, гипертермия и загар. При проведении фототерапии обязательны мероприятия по поддержанию постоянного водного баланса новорожденного. - Инфузионная терапия применяется для предотвращения нарушений водного баланса при проведении фототерапии с использованием ламп с недифференцированным светом; при этом физиологическая потребность в жидкости увеличивается на 0,5–1,0 мл/кг/ч. Основой инфузионной терапии являются растворы глюкозы, к которым добавляются мембраностабилизаторы (с целью уменьшения процессов перекисного окисления), электролиты, сода (при необходимости их коррекции), кардиотрофики и препараты, улучшающие микроциркуляцию. Для ускорения выведения билирубина из организма иногда применяют методику форсированного диуреза. Возможно введение в схему инфузионной терапии растворов альбумина в дозе 1 г/кг в сутки.
- Целесообразность применения индукторов микросомальных ферментов печени (фенобарбитал, зиксорин, бензонал) объясняется способностью последних повышать содержание лигандина в клетках печени и активность глюкуронилтрансферазы. Данные индукторы используются при нарушении процессов конъюгации. Фенобарбитал применяется в дозе 5 мг/кг в сутки, курс лечения не должен превышать 4–6 дней. Возможна схема применения фенобарбитала, при которой используются высокие нагрузочные дозы — 20–30 мг/кг в первые сутки, затем 5 мг/кг в последующие, однако высокие дозы фенобарбитала оказывают сильное седативное действие и могут вызвать нарушение дыхания, апноэ у новорожденного.
- Энтеросорбенты (смекта, полифепан, энтеросгель, холестирамин, агар-агар и др.) включаются в терапию с целью прервать печеночно-кишечную циркуляцию билирубина. Однако они не оказывают существенного влияния на уровень сывороточного билирубина. Тем не менее, учитывая отсутствие токсического влияния этих препаратов, их можно применять при лечении гипербилирубинемий, но только как вспомогательный метод.
- Синтетические металлопорфирины ранее широко использовались при лечении непрямых гипербилирубинемий. Механизм их действия основан на конкурентном ингибировании гемоксигеназы, приводящем к снижению продукции билирубина. В настоящее время эти препараты в лечении неонатальных желтух не используются, так как был отмечен фототоксический эффект олово-протопорфирина IX.
- Заменное переливание крови проводится при неэффективности консервативных методов терапии, прогрессирующем нарастании уровня билирубина, при наличии абсолютных показаний, т. е. когда есть угроза развития ядерной желтухи. Заменное переливание крови выполняется в объеме двух объемов циркулирующей крови, что позволяет заменить до 85% циркулирующих эритроцитов и снизить уровень билирубина в 2 раза. Показаниями к проведению данной процедуры в настоящее время являются: отечно-анемическая форма гемолитической болезни новорожденных, когда переливание проводится в первые 2 ч жизни; уровень непрямого билирубина пуповинной крови выше 60 мкмоль/л; уровень гемоглобина пуповинной крови ниже 140 г/л; почасовой прирост билирубина выше 6 мкмоль/л; почасовой прирост билирубина выше 8,5 мкмоль/л при падении гемоглобина ниже 130 г/л; наличие прогрессирующей анемии; превышение билирубина в последующие сутки выше 340 мкмоль/л.
- Из холеретиков и холекинетиков — при явлениях холестаза (за исключением атрезии внепеченочных желчных протоков и нарушения синтеза желчных кислот вследствие ферментопатии) могут использоваться магния сульфат, аллохол, однако в настоящее время предпочтение отдается препарату урсодезоксихолевой кислоты — урсофальк, который выпускается в виде суспензии, отличается легкостью дозирования для новорожденных, характеризуется быстрым и отчетливым терапевтическим эффектом. Начальная лечебная доза составляет 15–20 мг/кг в сутки. При недостаточной эффективности доза может быть увеличена до 30–40 мг/кг в сутки. При проведении длительного лечения используют поддерживающую дозу 10 мг/кг в сутки.
- Коррекция жирорастворимых витаминов проводится при гипоплазиях и атрезиях желчевыводящих путей и длительно существующих явлениях холестаза в дооперационном периоде. Витамин Д3 — 30 000 МЕ внутримышечно 1 раз в месяц или по 5000-8000 МЕ внутрь ежедневно. Витамин А — 25 000–50 000 МЕ внутримышечно 1 раз в месяц или 5000-20000 МЕ внутрь 1 раз в сутки. Витамин Е — 10 мг/кг внутримышечно; 25 МЕ/кг в сутки внутрь 1 раз в 2 нед. Витамин К — 1 мг/кг 1 раз в 1–2 нед.
- Коррекция микроэлементов: кальций — 50 мг/кг в сутки внутрь, фосфор — 25 мг/кг в сутки внутрь, цинка сульфат — 1 мг/кг внутрь в сутки.
- Увеличение белковой и калорийной нагрузки у таких детей необходимо для обеспечения нормального роста и развития, кроме того в питании должны присутствовать среднецепочечные триглицериды. Потребность у таких новорожденных в белках — 2,5–3 г/кг, жирах — 8 г/кг, углеводах — 15–20 г/кг, калориях — 150 ккал/кг (60% — углеводы, 40% — жиры).
- При синдроме Аладжилля, несиндромальной форме гипоплазии внутрипеченочных желчных протоков, перинатальном склерозирующем холангите методы этиопатогенетического лечения отсутствуют. Формирование цирроза печени при этих процессах служит показанием к трансплантации печени.
- Внепеченочные причины развития синдрома холестаза являются показанием к удалению причины холестаза или проведению операции по Касаи, с последующей профилактикой развития инфекционных процессов и склеротических изменений желчных протоков. Противовоспалительная терапия включает назначение высоких доз преднизолона внутривенно в течение первой недели после операции (10 > 2 мг/кг в сут), затем 2 мг/кг/сут внутрь в течение 1–3 мес.
- При гипербилирубинемии, вызванной метаболическими нарушениями, чаще всего прибегают к консервативным методам лечения. При галактоземии применяется диета, не содержащая галактозу и лактозу. На первом году жизни используются лечебные смеси: NAN безлактозный, Нутрамиген, Прегистимил и другие смеси, не содержащие лактозу. При тирозинемии назначается диета, не содержащая тирозин, метионин и фенилаланил (лофенолак, ХР Аналог, ХР Аналог LCP, Афенилак, Фенил-Фри, Тетрафен 40 и др.). в последние годы также используется ингибитор фермента 4-гидроксифенилпируват-диоксигеназы — нитисинон, который назначают из расчета 1 мг/кг/сут, перорально. При фруктоземии необходимо исключить из питания продукты, содержащие фруктозу, сукрозу и мальтозу. Назначаются препараты, компенсирующие недостаток желчных кислот — холевой и дезоксихолевой из расчета 10 мг/кг/сут.
- При заместительной энзимотерапии чаще всего используется креон 10 000, доза препарата подбирается соответственно недостаточности функции поджелудочной железы, панкреатин — по 1000 ЕД липазы/кг/сут.
Литература
- Абрамченко В. В., Шабалов Н. П. Клиническая перинатология. Петрозаводск: ООО «Издательство Интел Тех», 2004. 424 с.
- Болезни плода и новорожденного, врожденные нарушения обмена веществ/под ред. Р. Е. Бермана, В. К. Вогана. М.: Медицина, 1991. 527 с.
- Дегтярев Д. Н., Иванова А. В., Сигова Ю. А. Синдром Криглера-Найяра//Российский вестник перинатологии и педиатрии. 1998. № 4. С. 44–48.
- Комаров Ф. И., Коровкин Б. Ф., Меньшиков В. В. Биохимические исследования в клинике. М.: АПП «Джангар», 2001.
- Неонатология/под ред. Т. Л. Гомеллы, М. Д. Каннигам. М.: Медицина, 1998. 640 с.
- Папаян А. В., Жукова Л. Ю. Анемии у детей. СПб.: Питер, 2001.
- Руководство по фармакотерапии в педиатрии и детской хирургии. Неонатология/под ред. А. Д. Царегородцева, В. А. Таболина. М.: Медпрактика-М, 2003.
- Таболин В. А. Билирубиновый обмен у новорожденных. М.: Медицина, 1967.
- Шабалов Н. П. Неонатология: пособие для врачей. СПб., 1996. Т. 1, 2.
- Шерлок Ш., Дули Д. Заболевания печени и желчных путей: практическое руководство/под ред. З. Г. Апросиной, Н. А. Мухина: пер. с англ. М.: ГЭОТАР Медицина, 1999. 864 с.
- Подымова С. Д. Болезни печени. М., Медицина. 1993.
- Balistreri W. F. Nontransplant options for the treatment of metabolic liver disease: saving livers while saving lives//Hepatology. 1994; 9: 782–787.
- Bernard O. Early diagnosis of neonatal cholestatic jaundice//Arch. Pediatr. 1998; 5: 1031–1035.
- Nedim Hadzie, Giorgina Mieli-Vergani. Chronic liver disease in childhood. Int. Semin. Paediatr. Gastroenterol. Nutr. 1998; 7: 1–9.
Л. А. Анастасевич, кандидат медицинских наук
Л. В. Симонова, кандидат медицинских наук
РГМУ, Москва
Билирубин общий анализ в Ростове-на-Дону, сдать кровь на билирубин
Билирубин – один из компонентов желчи. Он образуется в организме, проходит ряд преобразований и выводится с калом и мочой.
Общим билирубином именуют 2 формы вещества:
- Непрямой билирубин (свободный) – продукт распада гемоглобина и некоторых других железосодержащих белков. Циркулирует в плазме крови, преимущественно в связи с альбумином; плохо растворим в воде, токсичен.
- Прямой (конъюгированный) билирубин – образуется из непрямого путем связи с глюкуроновой кислотой в печени. Не токсичен. С желчью переходит в кишечник, где, подвергаясь дальнейшей трансформации (в уробилиноген – стеркобилиноген — стеркобилин), выводится с калом, придавая ему специфическую окраску. Часть уробилиногена из кишечника всасывается в кровь, фильтруется почками и выводится в виде желтого пигмента уробилина с мочой.
Свое название «прямой» и «непрямой» билирубин получил по типам лабораторных исследований. Связанный прямой билирубин легко растворяется в воде и вступает во взаимодействие с реактивами, то есть дает «прямую» реакцию. Свободный непрямой, наоборот, для определения требует дополнительных этапов, «непрямой» реакции.
Оценивать уровень билирубина можно в составе биохимического анализа крови, либо отдельным исследованием. Отклонение от нормы общего билирубина для уточнения причины потребует определения его непрямой и прямой фракции.
При различных патологиях происходит, как правило, повышение уровня билирубина.
Основные причины повышенного билирубина
- Повышенный распад гемоглобина. Это возможно при массивном разрушении эритроцитов в случаях болезней системы крови (сфероцитоз, сидеробластная и пернициозная анемия), иммунной агрессии к эритроцитам (гемолитическая болезнь новорожденных), при отравлении химическими веществами, наличии крупных гематом после травм. В этом случае рост билирубина в крови происходит за счет непрямой (свободной) формы.
- Повреждение печеночных клеток и выход их содержимого в кровоток при вирусных гепатитах, интоксикации алкоголем, действии ряда лекарственных препаратов, различных бытовых и промышленных химических соединений, при циррозе печени, опухолях и метастазах в печень.
- Нарушение желчеоттока из печени и желчного пузыря из-за механического блока – препятствия внутри протока или сдавление протоков извне (камни, опухоли, рубцы, глистные инвазии), или при дискинезии желчных путей (снижение их сократительной активности). Рост давления желчи в протоках вызывает повышение их проницаемости и переход компонентов желчи в кровь.
- Генетические аномалии, приводящие к поломкам механизма внутриклеточного транспорта билирубина и, как следствие, дальнейшего его преобразования и выведения. Описаны синдромы Жильбера, Дубина-Джонсона, Ротора.
Показания к анализу на общий билирубин
- Наличие желтухи
- Оценка состояния гепатоцитов (целостность и функция)
- Оценка функции желчевыводящих путей
- Подозрение на заболевание крови с усиленным разрушением эритроцитов
Как сдать анализ на общий билирубин
Специальной подготовки не требуется. Кровь можно сдавать в течение всего дня после 3х-часового голода. Накануне рекомендовано исключить прием алкоголя.
Нормы билирубина: взрослые: 5-21 мкмоль/л
Подробно о билирубине можно почитать в СТАТЬЕ.Желтуха у новорожденных детей
Случается, что на вторые или третьи сутки после своего рождения ребенок желтеет. Это не патология, это естественный процесс, возникающий по причине адаптации младенца к условиям внешней среды. И называется он физиологическая желтуха. Давайте разберемся, что такое желтуха, и как она развивается.
Желтуха – это симптом, а не болезнь. И лечить нужно не его, а причину, вызвавшую состояние.
В крови человека имеются красные кровяные тельца – эритроциты, предназначенные для переноса кислорода и углекислого газа в организме. Период их существования составляет 120 дней, после чего они погибают. Таким образом, каждый день разрушается 1% от общего пула эритроцитов. В процессе разрушения в кровь выделяются продукты метаболизма. Одним из них является пигмент билирубин, именно он и придает коже желтый цвет. Билирубин токсичен для организма, поэтому он его обезвреживает и выводит с помощью печени. В ней печеночные ферменты производят нейтрализацию, и пигмент выводится наружу кишечником. Если этот процесс нарушается, уровень билирубина растет, что проявляется желтухой.
Физиологическая желтуха новорожденных
А теперь про конкретное состояние – желтуха у новорожденных. Она не является опасной. Сразу после рождения в организме младенца происходит распад большого количества фетального гемоглобина, вследствие чего выделяется много билирубина в кровь. А в печени еще не созрели печеночные ферменты, необходимые для нейтрализации билирубина. Поэтому у 50-60% новорожденных на 2-3 сутки после рождения развивается физиологическая желтуха. Необходимо время, чтобы печень научилась обезвреживанию и выведению билирубина. Вероятность развития выше у недоношенных детей и составляет 80-90%. И это нормально.
- Как понять, что у моего ребенка именно физиологическая желтуха? А не опасная желтуха?
Причину желтухи и степень опасности может точно установить только врач. Однако стоит знать, что при физиологической желтухе желтизна склер, кожи и слизистых оболочек не сопровождается другими симптомами. При желтухе, вызванной другими причинами, младенец себя плохо чувствует, плачет, плохо кушает и не набирает вес.
- Можно ли ставить прививку против гепатита В при физиологической желтухе?
Желтуха новорожденных не представляется противопоказанием для постановки вакцины от гепатита В и других прививок.
- Физиологическая желтуха в будущем сказывается на состоянии ребенка?
Нет, на здоровье ребенка желтуха новорожденных никак не отражается.
Особенности лечения желтухи новорожденных
В большинстве случае желтуха проходит через 2-3 недели. Осложнения у такой желтухи возникают крайне редко, однако чрезмерное повышение билирубина (особенно непрямого) опасно токсическим воздействием, и отсутствие соответствующего лечения может привести к неблагоприятным последствиям.
Врач берет во внимание все сопутствующие факторы, чтобы спланировать кратность осмотров и выяснить риск возникновения нарастания билирубина:
- содержание билирубина в настоящее время;
- наличие недоношенности;
- активность и аппетит ребенка;
- уровень лактации у матери;
- наследственная предрасположенность к тяжелой желтухе.
Лечение, снижающее уровень билирубина в крови, может быть следующим.
- Фототерапия. Ребенок помещается под специальные лампы со светом сине-зеленого спектра высокой интенсивности. Такой свет обладает способностью трансформировать структуру и форму непрямого гемоглобина, чтобы он становился водорастворимым, достаточной для его утилизации с мочой и калом. Это процедура является безвредной, так как ультрафиолетовый спектр блокируется специальным фильтром и не попадает на кожу малыша.
- Внутривенные инъекции иммуноглобулина. Если в качестве причины желтухи выступает несовместимость крови матери и ребенка, можно использовать введение иммуноглобулина внутривенно. Такой способ поможет снизить уровень антител. Этого может быть достаточно.
- Переливание крови. Применяется для быстрого снижения билирубина и проводится в отделении интенсивной терапии. Отбирается определенный объем крови у ребенка с высоким уровнем билирубина, и одновременно вводится донорская кровь с нормальными показателями. Таким образом уменьшается билирубинемия и нормализуется гемоглобин.
- Плазмаферез. Этот метод применим в сложных медицинских случаях. Производят многократный забор небольших объемов крови у ребенка, очищают их от плазмы с высоким уровнем билирубина и антител, разводят физиологическим раствором или плазмой донора и вводят обратно внутривенно. Как и переливание, плазмаферез очень эффективен. Однако оба метода проводятся в крайних случаях, к примеру, когда присутствует гемолитическая болезнь.
- Если желтуха не выраженная, можно обойтись некоторыми изменениями в питании. Более частые кормления стимулируют активность дефекации, благодаря чему билирубин выводится активнее.
Помните, что установить, является ли желтуха у новорожденного патологией или нормой, сможет только врач. В любых подозрительных случаях записывайтесь на консультацию к педиатру!
Желтушка | Детский медицинский центр «ЧудоДети»
Желтушка – частое явление у новорожденных детей. Она проявляется желтушным окрашиванием кожи и склер младенца в первые 3-4 дня после рождения. Ее появление связано с повышением концентрации билирубина в крови новорожденного ребенка из-за повышенного разрушения эритроцитов плода. В норме к концу второй недели жизни младенца желтушка уходит самостоятельно. Но нередко бывает так, что она затягивается.
Билирубин – желчный пигмент, он образуется из гемоглобина. Попадая в печень, билирубин входит в состав желчи и в дальнейшем попадает в кишечник. Из кишечника билирубин выводится естественным путем. Билирубин в организме бывает двух видов – жирорастворимый (непрямой) и водорастворимый (прямой). Непрямой билирубин токсичен для организма, так как он может легко проникать в клетки и нарушать их жизнедеятельность. В норме такой билирубин связывается в печени с белком, становится водорастворимым (прямым) и выводится из организма.Есть ряд причин, по которым процесс выведения непрямого билирубина у новорожденного ребенка затягивается. К ним можно отнести незрелость печеночных ферментов, повышенную скорость распада эритроцитов, различные заболевания печени и системы крови, и другие причины, для выяснения которых надо обратиться к педиатру.А обратиться к педиатру надо как можно скорее, так как непрямой билирубин в повышенной концентрации оказывает токсическое действие на клетки мозга, и вызывает так называемую билирубиновую энцефалопатию. Проявляется она вялостью ребенка, апатией, ребенок начинает хуже сосать, больше срыгивать, взгляд становится «блуждающим». Если вовремя не начать лечение, поражение нервной системы может привести к таким необратимым последствиям, как ДЦП, параличи, парезы, глухота, задержка психического развития и т.д. При тяжелой форме гипербилирубинемии лечением является общее переливание крови.В норме уровень билирубина у новорожденных составляет 20,5 мкмоль/л, а видимое глазом желтушное прокрашивание кожи у доношенного младенца возникает примерно при уровне 85 мкмоль/л.У недоношенного младенца жировой слой меньше, поэтому видимая желтушка у него появляется при уже достаточно высоком уровне билирубина – более 120 мкмоль/лПри появлении желтушки у новорожденного младенца надо обратиться к педиатру и выяснить причины ее появления, чтобы правильно определить тактику лечения. Запоры, недостаточное допаивание ребенка задерживают естественное выведение билирубина. Важно, чтобы у новорожденного ребенка кишечник опорожнялся ежедневно и младенец получал достаточное количество жидкости. Кормить ребенка грудью в этот период рекомендовано 8-12 раз в сутки, без ночного перерыва.Основным методом лечения непрямой гипербилирубинемии является фототерапия (светолечение) — лечение светом синего спектра излучения. Билирубин разрушается под воздействием света и выводится естественным путем.Для фототерапии новорожденных используются специальные лампы синего света (фотооблучатели). Лечение занимает несколько дней, продолжительность терапии определяет врач-педиатр. Фотоизомеризация билирубина происходит в коже, поэтому, чем большая площадь тела используется для фототерапии, тем эффективнее процесс лечения. Лампа представляет собой ванночку из безвредного пластика, в основание которой вмонтированы лампы синего света. Младенец на протяжении процедуры размещается в съемном гамаке. Необходимо регулярно менять положение ребенка по отношению к источнику света, переворачивая его поочередно вверх животом или спиной. Общий сеанс длится не менее 14 часов в присутствии родителей. Нельзя оставлять ребенка в аппарате без присмотра.
Показания для фототерапии:- непрямая гипербилирубинемия новорожденных (в том числе при незрелости ферментов печени, конъюгационной гипербилирубинемии, гемолитической болезни новорожденных, резус-конфликтах)
- наличие диагноза «Порфирия» в семейном анамнезе или у ребенка
- при значительном повышении концентрации прямого билирубина
- использование фотосенсибилизирующих медикаментов.
В последние годы доказана одинаковая эффективность непрерывной и прерывистой схем фототерапии, при этом:
- максимальный перерыв между сеансами фототерапии, составляет не более 2–4 ч;
- сеансы фототерапии должны повторяться регулярно;
- оптимальной схемой фототерапии для большинства новорожденных детей с конъюгационной гипербилирубинемией является последовательное чередование сеансов фототерапии с перерывами на кормление;
- Температура в помещении должна быть не менее 26 градусов.
- глаза ребенка и половые органы (у мальчиков) должны быть защищены светонепроницаемым материалом.
- каждые 2 ч необходимо измерять температуру тела ребенка,
- суточный объем вводимой ребенку жидкости необходимо увеличить на 10–20%
- фототерапия может быть прекращена, если отсутствуют признаки патологического
- прироста билирубина, а концентрация общего билирубина в сыворотке крови стала ниже
- значений, послуживших основанием для начала фототерапии;
- спустя 12 ч после окончания фототерапии необходимо контрольное исследование билирубина крови.
👆 Повышен билирубин в крови
В комплекс биохимического анализа крови входит определение пигментного обмена в человеческом организме. Его оценивают по показателям билирубина, но большинству людей не известно, что это за вещество, за что оно отвечает и чем опасно его повышенная концентрация. Когда его количество становится очень высоким, это свидетельствует об определенных болезнях и нарушениях в работе организма.
Типы билирубина
Билирубином называют продукт вещественного обмена. Вещество формируется из гемоглобина, который расщепляется внутри печени и выводится в составе мочи, кала и желчи. При этом билирубин бывает трех видов:
- прямой – он является водорастворимым и называется также конъюгированным. Формируется в печени в результате соединения с глюкуроновой кислотой;
- непрямой в воде не растворяется. Он токсичен и является продуктом распада гемовых веществ;
- общий – это суммарное количество обеих форм вещества в плазме человеческой крови.
Медики при диагностическом обследовании пациентов по количеству разных видов билирубина определяют заболевания внутренних органов, среди которых патологии печени и даже бесплодие.
В непрямой форме вещество токсично, а для нейтрализации печень переводит его в растворимую форму. Повышенное содержание общего билирубина сопровождается желтизной на коже, токсикозом и зудом кожных покровов.
Какой уровень означает, что билирубин не повышен?
Что собой представляют разные виды билирубина мы разобрались, но какие показатели считаются нормальными? Когда его концентрация повышена, это может свидетельствовать о разных заболеваниях. Итак, нормы согласно современным медицинским таблицам следующие:
- в непрямой форме – не более 16,2 мкмоль/л;
- в прямой – не выше 5,1 мкмоль/л;
- количество общего билирубина варьируется от 0,5 до 20,5 мкмоль/л.
Даже показатели в 21-21,7 единиц считаются завышенными, но это еще не повод для беспокойства. Преобладание определенной формы вещества может быть обусловлено разными причинами. Когда концентрация вещества достигает 35-36 единиц, у пациента могут проявиться первые симптомы желтухи, а более подробно о них читайте далее.
Симптомы повышенного билирубина
Когда при анализе выявляются высокие цифры билирубина, у человека может слегка пожелтеть кожа, а моча обретет темный оттенок (в среднем при показателе более 34 единиц).
В результате увеличения концентрации человек после физических нагрузок может ощущать ряд симптомов:
- повышение температуры;
- дискомфорт в левой подреберной зоне;
- вялость;
- общая слабость.
Врач определяет, с чем связано нарушение, и назначает соответствующее лечение. Когда уровень билирубина увеличен значительно (60, 71.3, 96, 120 единиц), в организме определенно развивается какое-либо заболевание, требующее квалифицированного лечения.
В редких случаях концентрация вещества достигает критических отметок в 220-300 мкмоль/л, и это очень опасно. У взрослых такое встречается редко, но бывает у детей и подростков до 15 лет.
Из-за чего же возрастает количество билирубина и каковы последствия подобного нарушения будем сейчас разбираться.
Чем опасно повышение показателей?
Как было сказано, билирубин токсичен, поэтому способствует интоксикации организма и нарушению работы органов. Наиболее чувствительны ткани головного мозга, а печень, почки и сердце имеют более высокую устойчивость. В любом случае все зависит от точной концентрации, определенной по результатам анализов.
При незначительном превышении нормы, когда концентрация вещества достигает 29-30 или более высоких значений в 46-80 единиц, это не опасно для здоровья пациента. Это еще не тяжелая интоксикация и органы не получают токсического поражения, а некоторые люди живут с такими показателями, хоть это и ненормально.
Читайте также
При выраженном повышении билирубина, когда он достигает 150-180 единиц, все достаточно опасно, но еще некритично. Долгое сохранение такого состояния сопровождается интоксикацией, с которой нужно поскорее справиться.
При тяжелых формах, когда содержание вещества достигает 300 мкмоль/л, врачи говорят об угрозе жизни пациента. В этой ситуации имеет место сильнейшая интоксикация и нарушение функций многих органов. Для подростков такая концентрация билирубина опаснее, чем для взрослых.
Существует еще крайне тяжелая форма, когда билирубин зашкаливает за 300 единиц. Подобные показатели в случае со взрослыми пациентами несовместимы с жизнью. Если за несколько дней не начать лечение и не снизить концентрацию в крови, последствия будут самыми печальными – возможен летальный исход.
Иногда женщины интересуются, можно ли делать ЭКО при повышенном билирубине, так как это встречается довольно часто. Также на форумах часто встречаются вопросы, связанные с концентрацией этого вещества и бесплодием. В действительности опытные врачи опровергают связь между содержанием билирубина и бесплодием, а вот направлять на ЭКО при его завышенных цифрах или нет, зависит от показателей и других индивидуальных факторов.
Видео
Почему подскакивает билирубин?
Медикам известны разные причины повышенного билирубина, среди которых:
- высокоинтенсивный гемолиз эритроцитов;
- поражение печени;
- проблемы с оттоком желчи;
- нарушения выработки ферментов.
При болезнях печени может нарушиться секреция прямого билирубина в желчь и повыситься интенсивность гемолиза. Когда содержание вещества в крови достигает высоких отметок, а кожа обретает желтый оттенок, и моча темнеет, а также возникает слабость и утомляемость, причина может быть в анемии, патологиях желчного пузыря, глистной инвазии или остром дефиците витамина В12.
Анемия врожденного типа или приобретенная может поспособствовать заметному ускорению разрушения эритроцитов в человеческой крови, а это приведет к незначительному или заметному росту билирубина. Остальные функции организма могут работать нормально, а анализ покажет только высокий непрямой билирубин.
Привести к высокой концентрации вещества и неприятным последствиям могут разные виды онкологических заболеваний, цирроз и гепатит. Все они нарушают образование прямого билирубина. Среди провоцирующих факторов выделяют наследственные болезни и синдром Жильбера (отклонения в выделении ферментов). В отдельных ситуациях даже прием медикаментозных средств вызывать увеличение содержания вещества примерно в двое – все дело в побочных эффектах, отражающихся на работе желчного пузыря. При этом может быть повышен только билирубин, а остальные показатели останутся в норме.
Как понизить высокий билирубин?
Мы выясняли, признаком какой болезни может являться повышенный билирубин в крови, а теперь осталось разобраться в способах его снижения. Сначала любой лечащий врач ставит диагноз и определяет, с чем связано увеличение концентрации вещества. После этого подбирается оптимальный комплекс терапии.
Зачастую в основе лечения подростков и взрослых после 30 лет с высоким билирубином лежит инфузионная терапия. Пациенту внутривенно вливаются особые препараты и глюкоза, благодаря которым вещество и его продукты распада более интенсивно выводятся из тела. Обычно эту методику врачи применяют в критических ситуациях, а когда билирубин составляет 39-46 единиц или около того, используются другие способы. Также к инфузионной терапии могут прибегнуть, когда незначительное превышение нормы долго не снижается.
Еще одним методом является фототерапия – облучение особыми лампами. Токсичная непрямая форма вещества под их лучами разрушается и превращается в простую прямую форму, после чего свободно выводится наружу. Методика востребована, когда нужно быстро уменьшить уровень билирубина, а особенно она эффективна для детей и подростков.
Когда причина отклонения связана с нарушенным выводом желчи, врачи прописывают пациентам аптечные препараты для нормализации данного физиологического процесса. Среди желчегонных препаратов особенно востребованы Карсил, Аллохол, Хофитол и Холензим. Дополнительно требуется подходящая повседневная диета. Кроме сложных очищающих препаратов помогает обычный активированный уголь и разные гели для выведения токсинов. Важно уменьшить нагрузку на печень, убрав из рациона острую, сладкую и жареную жирную пищу.
Иногда при повышенном билирубине болит печень, а врачи ставят диагноз гепатит. В такой ситуации обязателен прием препаратов для защиты этого внутреннего органа и борьбы с основным заболеванием, в результате чего концентрация вещества постепенно начнет понижаться. Среди лекарственных средств для восстановления печени выделяют Эссенсиале, Урсосан и Гепатрин.
Какой максимальный уровень общего билирубина в сыворотке крови указывает на физиологическую желтуху при неконъюгированной гипербилирубинемии?
Автор
Хишам Назер, MBBCh, FRCP, DTM & H Профессор педиатрии, консультант по детской гастроэнтерологии, гепатологии и клиническому питанию, Медицинский факультет Университета Иордании, Иордания
Хишам Назер, MBBCh, FRCP, DTM & H является членом следующих медицинских общества: Американская ассоциация врачей-лидеров, Королевский колледж педиатрии и здоровья детей, Королевский колледж хирургов в Ирландии, Королевское общество тропической медицины и гигиены, Королевский колледж врачей и хирургов Соединенного Королевства
Раскрытие информации: раскрывать нечего.
Соавтор (ы)
Правин К. Рой, доктор медицины, AGAF Клинический доцент медицины, Медицинский факультет Университета Нью-Мексико
Правин К. Рой, доктор медицины, AGAF является членом следующих медицинских обществ: Американской гастроэнтерологической ассоциации, Американского общества гастроэнтерологической эндоскопии
Раскрытие информации: раскрывать нечего.
Специальная редакционная коллегия
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Получил зарплату от Medscape за работу.для: Medscape.
Главный редактор
BS Ананд, доктор медицины Профессор кафедры внутренней медицины, отделение гастроэнтерологии, Медицинский колледж Бейлора
BS Ананд, доктор медицинских наук, является членом следующих медицинских обществ: Американской ассоциации по изучению заболеваний печени, Американского колледжа гастроэнтерологии , Американская гастроэнтерологическая ассоциация, Американское общество эндоскопии желудочно-кишечного тракта
Раскрытие: Ничего не говорится.
Благодарности
BS Ананд, доктор медицины Профессор кафедры внутренней медицины, отделение гастроэнтерологии, Медицинский колледж Бейлора
BS Ананд, доктор медицинских наук, является членом следующих медицинских обществ: Американской ассоциации по изучению заболеваний печени, Американского колледжа гастроэнтерологии, Американской гастроэнтерологической ассоциации и Американского общества гастроэнтерологической эндоскопии
.Раскрытие: Ничего не нужно раскрывать.
Шоукат Башир, доктор медицины Доцент, кафедра медицины, отделение гастроэнтерологии, Университет Джорджа Вашингтона, Вашингтон, округ Колумбия
Шоукат Башир, доктор медицины, является членом следующих медицинских обществ: Американского колледжа гастроэнтерологии, Американского колледжа врачей, Американской гастроэнтерологической ассоциации и Американской медицинской ассоциации
.Раскрытие: Ничего не нужно раскрывать.
Дэвид Эрик Бернштейн, доктор медицины Директор отделения гепатологии, Университетская больница Норт-Шор; Профессор клинической медицины, Медицинский колледж Альберта Эйнштейна
Дэвид Эрик Бернштейн, доктор медицинских наук, является членом следующих медицинских обществ: Американской ассоциации по изучению заболеваний печени, Американского колледжа гастроэнтерологии, Американского колледжа врачей, Американской гастроэнтерологической ассоциации и Американского общества гастроэнтерологической эндоскопии
Раскрытие: Ничего не нужно раскрывать.
Мануп С. Бутани, доктор медицины Профессор, содиректор Центра эндоскопических исследований, обучения и инноваций (CERTAIN), директор Центра эндоскопического ультразвука, Департамент медицины, Отделение гастроэнтерологии, Медицинское отделение Техасского университета; Директор отдела эндоскопических исследований и разработок, Онкологический центр Андерсона Техасского университета
Мануп С. Бутани, доктор медицинских наук, является членом следующих медицинских обществ: Американской ассоциации развития науки, Американского колледжа гастроэнтерологии, Американского колледжа врачей, Американской гастроэнтерологической ассоциации, Американского института ультразвука в медицине и Американского общества гастроэнтерологической эндоскопии.
Раскрытие: Ничего не нужно раскрывать.
Джек Брэгг, DO Доцент кафедры клинической медицины Медицинского факультета Университета Миссури
Джек Брэгг, DO, является членом следующих медицинских обществ: Американского колледжа остеопатических терапевтов и Американской остеопатической ассоциации
Раскрытие: Ничего не нужно раскрывать.
Энни Т. Чемманур, MD Лечащий врач, Медицинский центр Метровест и Мемориальная больница Массачусетского университета, кампус Мальборо
Энни Т. Чемманур, доктор медицины, является членом следующих медицинских обществ: Американского колледжа врачей — Американского общества внутренней медицины, Американской гастроэнтерологической ассоциации, Американской медицинской ассоциации и Массачусетского медицинского общества
.Раскрытие: Ничего не нужно раскрывать.
Кармен Каффари, доктор медицины Доцент кафедры педиатрии, отделение гастроэнтерологии / питания, Медицинский факультет Университета Джона Хопкинса
Кармен Каффари, доктор медицины, является членом следующих медицинских обществ: Американского колледжа гастроэнтерологии, Американской гастроэнтерологической ассоциации, Североамериканского общества детской гастроэнтерологии, гепатологии и питания и Королевского колледжа врачей и хирургов Канады
Раскрытие: Ничего не нужно раскрывать.
Гаутам Дехадрай, доктор медицины Заведующий отделением, начальник отделения отделения интервенционной радиологии, Норманская региональная больница
Гаутам Дехадрай, доктор медицины, является членом следующих медицинских обществ: Американского колледжа радиологии, Медицинского совета Индии и Радиологического общества Северной Америки
Раскрытие: Ничего не нужно раскрывать.
Джаянт Деодхар, доктор медицины Адъюнкт-профессор педиатрии, Медицинский колледж Би Джей, Индия; Почетный консультант отделения педиатрии и неонатологии, Мемориальный госпиталь короля Эдуарда, Индия
Раскрытие: Ничего не нужно раскрывать.
Ширли Донельсон, директор программы MD , доцент, кафедра внутренней медицины, отделение болезней органов пищеварения, Медицинская школа Университета Миссисипи
Ширли Донельсон, доктор медицины, является членом следующих медицинских обществ: Американского колледжа гастроэнтерологии, Американского колледжа врачей, Американской гастроэнтерологической ассоциации, Американской медицинской ассоциации и Медицинской ассоциации штата Миссисипи
Раскрытие: Ничего не нужно раскрывать.
Сандип Мукерджи, MB, BCh, MPH, FRCPC Доцент, Отделение внутренней медицины, Отделение гастроэнтерологии и гепатологии, Медицинский центр Университета Небраски; Консультанты отделения гастроэнтерологии и гепатологии Медицинского центра по делам ветеранов
Раскрытие информации: Merck Honoraria Выступление и обучение; Членство в Правлении гонорара Ikaria Pharmaceuticals
Дена Назер, доктор медицины Медицинский директор Центра защиты детей Детской больницы Мичигана; Доцент, Государственный университет Уэйна
Дена Назер, доктор медицины, является членом следующих медицинских обществ: Амбулаторная педиатрическая ассоциация, Американская академия педиатрии, Американское профессиональное общество по борьбе с жестоким обращением с детьми и Helfer Society
.Раскрытие: Ничего не нужно раскрывать.
Mohamed Othman, MD Врач-резидент, Отделение внутренней медицины, Медицинский факультет Университета Нью-Мексико
Раскрытие: Ничего не нужно раскрывать.
Нури Озден, доктор медицины Доцент кафедры внутренней медицины Медицинского колледжа Мехарри
Нури Озден, доктор медицины, является членом следующих медицинских обществ: Американского колледжа гастроэнтерологии, Американского колледжа врачей, Американской гастроэнтерологической ассоциации и Американского общества гастроэнтерологической эндоскопии
Раскрытие: Ничего не нужно раскрывать.
Тушар Патель, MB, ChB Профессор медицины, Медицинский центр Университета штата Огайо
Tushar Patel, MB, ChB является членом следующих медицинских обществ: Американской ассоциации по изучению заболеваний печени и Американской гастроэнтерологической ассоциации
Раскрытие: Ничего не нужно раскрывать.
Дэвид А. Пикколи, доктор медицины Заведующий отделением детской гастроэнтерологии, гепатологии и питания Детской больницы Филадельфии; Профессор Медицинского факультета Пенсильванского университета
Дэвид А. Пикколи, доктор медицины, является членом следующих медицинских обществ: Американской ассоциации по изучению заболеваний печени, Американской гастроэнтерологической ассоциации и Североамериканского общества детской гастроэнтерологии и питания
Раскрытие: Ничего не нужно раскрывать.
Алессио Пигацци, доктор медицинских наук , доктор медицинских наук, руководитель программы минимально инвазивной хирургии, отделение хирургии, отделение общей онкологической хирургии, Национальный медицинский центр «Город надежды»
Раскрытие: Ничего не нужно раскрывать.
Правин К. Рой, доктор медицины, AGAF Гастроэнтеролог, Фонд клиники Окснера; Младший научный сотрудник Института респираторных исследований Лавлейс; Главный редактор Интернет-журнала гастероэнтерологии; Редакционный совет, Signal Transduction Insights; Редакционная коллегия Интернет-журнала эпидемиологии; Редакционная коллегия, Письмо с обзором эндоскопии желудочно-кишечного тракта
Правин К. Рой, доктор медицины, AGAF является членом следующих медицинских обществ: Американского колледжа гастроэнтерологии, Американской гастроэнтерологической ассоциации и Американского общества гастроэнтерологической эндоскопии
Раскрытие: Ничего не нужно раскрывать.
Жанетт Дж. Смит, доктор медицинских наук , научный сотрудник отделения гастроэнтерологии и гепатологии, Медицинский факультет Университета Коннектикута
Джанетт Дж. Смит, доктор медицины, является членом следующих медицинских обществ: Американского колледжа врачей, Американской гастроэнтерологической ассоциации и Американской ассоциации общественного здравоохранения
Раскрытие: Ничего не нужно раскрывать.
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Medscape Salary Employment
Мэри Л. Виндл, PharmD Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие: Ничего не нужно раскрывать.
Джордж И Ву, доктор медицины, доктор философии Профессор, кафедра медицины, директор секции гепатологии, кафедра исследований гепатита Германа Лопата, медицинский факультет Университета Коннектикута
Джордж И Ву, доктор медицинских наук, является членом следующих медицинских обществ: Американской ассоциации по изучению заболеваний печени, Американской гастроэнтерологической ассоциации, Американской медицинской ассоциации, Американского общества клинических исследований и Ассоциации американских врачей
Раскрытие информации: Гонорар Springer за консультационные услуги Консультации; Гонорар Gilead Consulting Членство в экспертной комиссии; Vertex Honoraria Выступление и обучение; Bristol-Myers Squibb Honoraria Выступление и преподавание; Членство в комиссии Springer Royalty Review; Merck Honoraria Выступление и обучение
9.Желтуха, анемия и полицитемия
,00Пройдите тест по главе до и после прочтения этой главы.
Викторина по открытию главы
Закрыть викторинуЗакрыть викторинуПервый раз? Бесплатная регистрация. Просто введите свой адрес электронной почты или номер мобильного телефона и придумайте пароль.
Содержание
Цели
Когда вы завершите это задание, вы сможете:
- Определите желтуху и гипербилирубинемию.
- Опишите выведение билирубина.
- Перечислите причины желтухи.
- Перечислите опасности гипербилирубинемии.
- Разберитесь с гемолитической болезнью новорожденного.
- Лечить желтуху.
- Перечислите общие причины и методы лечения анемии.
- Перечислите частые причины полицитемии и методы лечения.
Желтуха
9-1 Что такое желтуха?
Желтуха — это желтый цвет кожи и склер, вызванный отложениями билирубина. У новорожденных склеры (белок глаза) плохо различимы, поэтому цвет кожи используется для определения желтухи.Желтуха — это клинический признак, а не лабораторное измерение.
Желтуха новорожденных — это желтый цвет кожи, вызванный билирубином.
9-2 Что такое билирубин?
Красные кровяные тельца содержат красный пигмент гемоглобин, переносящий кислород. Эритроциты у плода и новорожденного живут всего 3 месяца. Таким образом, организм постоянно формирует новые эритроциты в костном мозге, чтобы заменить старые эритроциты, разрушенные в печени и селезенке.
Когда эритроциты умирают, их гемоглобин превращается в желтый пигмент, называемый билирубином. Этот неконъюгированный билирубин переносится с альбумином с током крови в печень, где сначала конъюгируется (соединяется с другим веществом), а затем выводится с желчью. Если концентрация билирубина в сыворотке (крови) повышается, он становится видимым на коже, вызывая желтуху. Новорожденные дети обычно имеют высокую концентрацию гемоглобина и, следовательно, вырабатывают много билирубина.
Нормальные новорожденные вырабатывают много билирубина.
9-3 Что такое гипербилирубинемия?
Гипербилирубинемия определяется как концентрация (уровень) общего билирубина в сыворотке (TSB), превышающая нормальный диапазон. Обычно концентрация билирубина в сыворотке крови при рождении низкая, менее 35 мкмоль / л. Затем он неуклонно растет в течение первых нескольких дней, прежде чем снова вернуться к взрослому уровню менее 35 мкмоль / л через 2 недели. Общая концентрация билирубина в сыворотке крови доношенных новорожденных обычно не превышает 200 мкмоль / л (12 мг / дл).
Верхний предел концентрации общего билирубина в сыворотке (TSB) у большинства здоровых доношенных детей составляет приблизительно:
| Дни после рождения | 0 | 0,5 | 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|---|---|---|
| TSB (мкмоль / л) | 35 | 75 | 125 | 150 | 175 | 200 | 200 |
- Примечание
- Верхний предел нормальной концентрации общего билирубина в сыворотке очень спорен.У здоровых доношенных детей, находящихся на грудном вскармливании, верхний предел может достигать 275 мкмоль / л.
9-4 Как измеряется билирубин?
Трудно и неточно оценить концентрацию билирубина в сыворотке крови путем клинического исследования степени желтухи, особенно у грудных детей с темной кожей. Поэтому важно измерить концентрацию билирубина в сыворотке крови, если у младенца желтуха. Обычно образец крови собирают в капиллярную трубку и центрифугируют, чтобы отделить сыворотку от эритроцитов.Затем общий билирубин сыворотки (TSB) измеряется билирубинометром и выражается в мкмоль / л. TSB включает как неконъюгированный, так и конъюгированный билирубин. Однако у новорожденных TSB обычно состоит в основном из неконъюгированного билирубина.
Общий билирубин сыворотки (TSB) не может быть точно определен путем клинической оценки степени желтухи кожи.
- Примечание
- Степень желтухи можно измерить с помощью чрескожного билирубинометра.Однако мониторы дороги, легко повреждаются и имеют ограниченную точность после начала фототерапии. Они полезны при обследовании младенцев на фототерапию.
9-5 Как выводится билирубин у взрослых?
Неконъюгированный билирубин, образующийся при расщеплении эритроцитов, переносится альбумином с током крови в печень. В клетках печени ферменты объединяют неконъюгированный билирубин с глюкуроновой кислотой с образованием конъюгированного билирубина. Этот химический процесс, называемый конъюгацией, делает билирубин водорастворимым.Только когда билирубин растворяется в воде, клетки печени могут выводить его в мелкие желчные протоки. Отсюда конъюгированный билирубин переносится с желчью в кишечник, где бактериями превращается в коричневый пигмент стеркобилин. У взрослых билирубин не всасывается из кишечника. Таким образом, продукты окончательного распада билирубина выводятся с калом.
Конъюгация билирубина в печени необходима, прежде чем он может быть выведен с желчью.
9-6 Как билирубин выводится из организма плода?
Плод не может выводить конъюгированный билирубин со стулом, поскольку он обычно не выводит меконий, а также в кишечнике отсутствуют бактерии, превращающие билирубин в стеркобилин. Вместо этого билирубин плода выводится через плаценту в кровь матери. Однако плацента может удалять только жирорастворимый неконъюгированный билирубин и не водорастворимый конъюгированный билирубин. Чтобы гарантировать, что большая часть билирубина плода остается неконъюгированной, ферментная система, контролирующая конъюгацию билирубина в печени, функционирует очень медленно.Небольшое количество конъюгированного билирубина, которое выделяется с желчью, переносится в кишечник плода. Здесь специальный фермент плода деконъюгирует билирубин, который затем реабсорбируется обратно в кровоток плода в виде неконъюгированного билирубина. Таким образом, плод обеспечивает вывод всего билирубина через плаценту.
Билирубин у плода выводится через плаценту, а не печень.
9-7 Как билирубин выводится из организма новорожденного?
В течение первой недели жизни ферментная система, которая связывает билирубин с глюкуроновой кислотой в печени, функционирует медленно, как у плода.Следовательно, неконъюгированный билирубин накапливается в сыворотке крови, поскольку плацента больше не существует для его удаления. В результате у новорожденных обычно возникает желтуха из-за повышенной концентрации неконъюгированного билирубина в сыворотке крови. Через несколько дней скорость конъюгации печени увеличивается, и концентрация билирубина в сыворотке медленно возвращается к нормальному диапазону для взрослых, составляющему менее 35 мкмоль / л. Однако желтуха при рождении или в первые 24 часа является необычным явлением, поскольку билирубин адекватно выводится через плаценту до момента родов.
Часть билирубина, который конъюгируется и выводится печенью в первую неделю жизни, расщепляется ферментом плода в кишечнике, который продолжает функционировать в течение нескольких недель после рождения. Этот неконъюгированный билирубин реабсорбируется в кишечнике, увеличивая уровень TSB.
Желтуха в течение первых 24 часов всегда ненормально.
- Примечание
- Реабсорбция билирубина из кишечника обратно в кровоток новорожденных (энтерогепатическая циркуляция билирубина) происходит за счет фермента β-глюкуронидазы в стенке кишечника.Этот фермент также присутствует в грудном молоке, что приводит к более высокому TSB у младенцев, находящихся на грудном вскармливании. В результате у некоторых нормальных младенцев, находящихся на грудном вскармливании, желтуха сохраняется более двух недель (желтуха грудного молока).
9-8 Каковы причины желтухи?
Основными причинами желтухи у новорожденных являются:
- Повышенная выработка билирубина
- Медленная конъюгация билирубина в печени
- Пониженное выведение желчи
9-9 Каковы причины повышенной выработки билирубина?
Есть много причин повышенного производства билирубина:
- Нормальные новорожденные вырабатывают много билирубина из-за высокой концентрации гемоглобина.
- Цефалгематома или синяк . Гемоглобин, вышедший из поврежденных кровеносных сосудов, быстро распадается на билирубин, который снова всасывается в кровоток.
- Полицитемия . Младенцы с очень большим объемом упакованных клеток или концентрацией гемоглобина имеют избыток гемоглобина и, следовательно, вырабатывают намного больше билирубина, чем обычно.
- Инфекция . Общие инфекции, такие как сепсис и сифилис, вызывают гемолиз (разрушение эритроцитов).Высвободившийся гемоглобин превращается в билирубин.
- Гемолитическая болезнь новорожденных . Избыточный гемолиз вызывает повышенный уровень неконъюгированного билирубина.
- Примечание
- Чрезмерный гемолиз в редких случаях может быть вызван недостаточностью фермента эритроцитов (например, дефицитом глюкозо-6-фосфатдегидрогеназы), аномальной мембраной эритроцитов (например, сфероцитоз) или аномальным гемоглобином (например, альфа-талассемия).
9-10 Каковы причины медленной конъюгации билирубина?
- Нормальные, здоровые доношенные дети имеют медленную конъюгацию билирубина в течение первой недели после родов.Таким образом, печень новорожденного в течение первых нескольких дней жизни функционирует так же, как и у плода.
- Около 10% клинически здоровых доношенных детей имеют TSB, превышающий нормальный диапазон. У них большая, чем обычно, задержка созревания ферментов печени, ответственных за конъюгацию.
- У недоношенных младенцев также обычно уровень TSB выше нормы из-за незрелости их ферментов печени. Это известно как желтуха незрелости .Желтуха чаще встречается у недоношенных детей, чем у доношенных.
- Врожденный гипотиреоз из-за отсутствия щитовидной железы у младенца может вызвать длительную желтуху из-за медленного созревания ферментов печени. Хотя это случается редко, это важно, поскольку эти дети становятся умственно отсталыми, если не диагностировать и не лечить их вскоре после рождения. Им необходимо пожизненное лечение тироксином.
Во всех этих условиях, при повышенной выработке или медленной конъюгации билирубина, билирубин в сыворотке не конъюгирован.
Длительная желтуха может быть вызвана гипотиреозом.
- Примечание
- В некоторых странах все новорожденные проходят скрининг на гипотиреоз. Тиреотропный гормон (ТТГ) и тироксин (Т4) измеряются в крови младенца, взятой при рождении или в течение нескольких дней после родов. Высокий ТТГ и низкий Т4 предполагают гипотиреоз.
9-11 Что вызывает снижение выведения билирубина?
- У здоровых младенцев на грудном вскармливании снижается выведение билирубина в течение нескольких недель после рождения, так как они реабсорбируют некоторую часть неконъюгированного билирубина из кишечника обратно в кровоток.В результате у детей, находящихся на грудном вскармливании, часто возникает желтуха с повышенным уровнем неконъюгированного билирубина.
- Гепатит , вызванный сепсисом, вирусной инфекцией или сифилисом. Набухание клеток печени препятствует оттоку желчи в мелких желчных протоках.
- Атрезия желчных путей — разрушение желчных протоков, вызванное вирусной инфекцией в течение первых недель жизни.
Заболевания печени (гепатит и атрезия желчных путей) препятствуют выведению конъюгированного билирубина с желчью.Следовательно, конъюгированный билирубин реабсорбируется в кровоток, что приводит к желтухе. Это называется механической желтухой, и ее можно диагностировать, обнаружив высокую концентрацию конъюгированного билирубина в сыворотке крови. Если билирубин не выводится с желчью, стул становится бледным. Часть излишка конъюгированного билирубина выводится почками с темной мочой. Желтуха из-за пониженной экскреции билирубина у новорожденных встречается гораздо реже, чем желтуха из-за чрезмерного производства или снижения конъюгации билирубина.
Бледный стул и темная моча предполагают, что желтуха вызвана заболеванием печени.
9-12 Что такое физиологическая желтуха?
У всех здоровых новорожденных общая концентрация билирубина в сыворотке (TSB) выше, чем у взрослых. Это связано с нормальным увеличением продукции, медленной конъюгацией и снижением выведения билирубина. В результате у 50% здоровых доношенных детей наблюдается легкая желтуха в течение первых 2 недель жизни. Однако они клинически здоровы, их желтуха исчезает в течение 14 дней, а уровень TSB не превышает 200 мкмоль / л (12 мг / дл).Это известно как физиологическая желтуха . Поэтому легкая желтуха очень часто встречается у здоровых младенцев.
Легкая желтуха у здоровых младенцев очень часто встречается в первые две недели жизни.
- Примечание
- Некоторые исследования показывают, что при физиологической желтухе TSB может повышаться до 275 мкмоль / л.
Гемолитическая болезнь
9-13 Что такое гемолитическая болезнь новорожденного?
Гемолитическая болезнь новорожденного — это состояние, при котором антитела (иммуноглобулины) матери проникают через плаценту в кровоток плода.Здесь эти антитела разрушают эритроциты плода (гемолиз), вызывая анемию и повышенное производство билирубина у плода и новорожденного.
Две наиболее важные причины гемолитической болезни новорожденных:
- Гемолитическая болезнь ABO
- Резус-гемолитическая болезнь
Существуют также другие необычные формы гемолитической болезни у новорожденных.
9-14 Какие группы крови?
Красные клетки имеют на своей поверхности белки, называемые антигенами, которые определяют группу крови человека.Антигены эритроцитов плода наследуются от обоих родителей и, следовательно, могут отличаться от антигенов матери. Наиболее важными антигенами эритроцитов являются антигены ABO и антиген D (резус). Если антиген A присутствует в эритроцитах человека, группа крови будет A. Точно так же присутствие антигена B делает группу крови B. Если присутствуют оба антигена, группа крови будет AB, а если оба антигена отсутствуют, группа крови будет О. Большинство людей группы крови О.
Антиген D наследуется отдельно от антигенов ABO.Присутствие антигена D в красных кровяных тельцах делает человека резус-положительным. Если антиген D отсутствует, значит, у человека резус-отрицательный.
Следовательно, человек с антигенами A и D будет иметь положительную группу крови A, в то время как другой человек без антигенов A, B или D будет иметь отрицательную группу крови.
9-15 Что такое гемолитическая болезнь ABO?
Гемолитическая болезнь ABO возникает, когда мать принадлежит к группе крови O, а ее плод — к группе крови A или B, причем плод унаследовал эти группы крови от отца.По неизвестным причинам некоторые матери группы O начинают вырабатывать антитела против A или B, которые проникают через плаценту и вызывают гемолиз плода, поражая эритроциты плода. Гемолиз недостаточно серьезен, чтобы повредить плод, но может вызвать тяжелую желтуху у новорожденного. Гемолитическая болезнь ABO может возникнуть при первой или любой более поздней беременности.
Материнские антитела, которые прилипают к эритроцитам плода, дают положительный результат теста Кумба у новорожденного, в то время как гемолиз приводит к низкому объему упакованных клеток и гемоглобину, а также к повышению TSB.Младенец с гемолитической болезнью ABO обычно выглядит нормальным при родах, поскольку плацента смогла удалить избыток билирубина, вырабатываемого во время беременности. Однако у младенца появляется желтуха в течение первых 24 часов после рождения. TSB может быстро увеличиваться и достигать опасного уровня. Из-за гемолиза у младенца развивается анемия. К сожалению, гемолитическая болезнь АВО не поддается профилактике и не может быть точно диагностирована до родов. Гемолитическая болезнь ABO является наиболее частой причиной тяжелой желтухи у доношенных детей.
Гемолитическая болезнь ABO — самая частая причина тяжелой желтухи у доношенных детей.
- Примечание
- При гемолитической болезни ABO мать вырабатывает антитела IgG к A или B. Эти небольшие антитела могут проникать через плаценту и, следовательно, отличаются от больших антител IgM к A и B, которые присутствуют в сыворотке всех взрослых группы O. Непонятно, почему некоторые женщины вырабатывают антитела IGg к антигенам A и B. В отличие от резус-гемолитической желтухи, кровотечение из матери и плода не является причиной сенсибилизации по системе АВО.
9-16 Как диагностировать гемолитическую болезнь ABO при рождении?
- Мать группы крови О.
- Отец группы крови A, B или AB.
- Младенец относится к группе крови A или B.
- Тест Кумба у младенца положительный.
- TSB часто бывает высоким (выше 35 мкмоль / л), в то время как гемоглобин и объем упакованных клеток в пуповинной крови часто низкие (ниже 45%).
- Желтуха у младенца обычно развивается в течение 24 часов после родов.Желтуха обычно быстро нарастает, и TSB может достигать опасного уровня в течение первой недели.
- TSB через 6 часов после родов часто превышает 80 мкмоль / л.
Желтуха в первый день свидетельствует о гемолитической болезни.
9-17 Что такое резус-гемолитическая болезнь?
Гемолитическая болезнь резус — гемолитическая болезнь новорожденных, вызываемая материнскими антителами к антигену D. При резус-гемолитической болезни у матери всегда резус-отрицательный (резус-отрицательный или Rh – ve), в то время как у плода и младенца (и отца) всегда резус-положительный (резус-положительный или Rh + ve).
Обычно эритроциты плода не попадают в кровоток матери во время беременности или родов. Однако, если капилляры плода в плаценте повреждены, эритроциты плода могут попасть в кровь матери. Если эритроциты плода имеют антиген D (резус-положительный), а у матери нет (резус-отрицательный), то эмбриональные клетки могут распознаваться иммунной системой матери как чужеродные. В результате резус-отрицательная мать ответит выработкой антител (анти-D) против этих чужеродных эритроцитов.Этот процесс известен как сенсибилизация . В редких случаях резус-отрицательная женщина также может быть сенсибилизирована к антигену D, если она получает несовместимое переливание крови с резус-положительными эритроцитами.
Гемолитическая болезнь-резус более тяжелая, чем гемолитическая болезнь АВО. Резус-гемолитическая болезнь редко встречается при первой беременности, поскольку она возникает только в том случае, если кровь плода пересекает плаценту (кровотечение из матери и матери), чтобы достичь крови матери и, таким образом, вызывает у нее повышенную чувствительность к выработке анти-D-антител.Гемолитическая болезнь резус прогрессивно ухудшается с каждой последующей беременностью. В отличие от гемолитической болезни АВО, при гемолитической болезни резус степень гемолиза плода является тяжелой, и у плода может развиться сердечная недостаточность, что приведет к генерализованному отеку (так называемому водянке) из-за анемии и смерти. К счастью, резус-гемолитическая болезнь встречается нечасто, потому что у большинства людей резус-положительный. Гемолитическую болезнь резус можно предотвратить.
- Примечание
- Группа крови резус названа в честь макаки резус, использованной в ранних экспериментах с антигенами эритроцитов.Резус-гемолитическая болезнь также может быть вызвана другими антигенами резуса (C, c, E и e). Эти формы менее тяжелы, чем резус-гемолитическая болезнь из-за антигена D (гемолитическая болезнь Rh D).
Эритроциты плода могут проникать через плаценту в кровь матери:
- При поставке (самый обычный)
- Во время выкидыша
- С отслойкой плаценты
- Во время амниоцентеза
- Во время наружной головной версии
Плод может умереть от гемолитической болезни резус.
9-18 Как предотвратить резус-гемолитическую болезнь?
Rh-положительные эритроциты плода, пересекающие плаценту, могут быть уничтожены до того, как они вызовут сенсибилизацию матери, путем внутримышечной инъекции 100 мкг (4 мл) анти-D иммуноглобулина в течение 72 часов. Обычно это делается после родов у матери с отрицательным резус-фактором. Однако анти-D иммуноглобулин также необходимо назначать после любого из вышеперечисленных осложнений беременности. К сожалению, бесполезно давать матери анти-D иммуноглобулин, если она уже сенсибилизирована и у нее выработались собственные анти-D антитела.
Вводите всем резус-отрицательным матерям анти-D иммуноглобулин после родов.
9-19 Как диагностировать резус-гемолитическую болезнь во время беременности?
- Группа крови матери резус-отрицательная.
- Группа крови отца резус-положительная.
- В крови матери обнаружены антитела к D.
- У матери в прошлом могла быть желтуха или акушерский анамнез, свидетельствующий о кровотечении у плода. Обычно мать не получала анти-D иммуноглобулин после предыдущих родов.
Группа крови всех беременных должна быть определена в начале дородовой помощи. Если вы подозреваете, что беременность осложняется резус-гемолитической болезнью (т. Е. Резус-отрицательная пациентка с антителами к D), мать должна быть срочно направлена в больницу, где доступна специализированная помощь.
У всех женщин должна быть определена группа крови во время беременности.
Гемолитическая болезнь, вызванная резус-фактором, следует рассматривать, если у ребенка желтуха, бледность и отек в первые 24 часа жизни.Тяжелая резус-гемолитическая болезнь плода может быть диагностирована во время беременности, если дородовое ультразвуковое исследование выявляет признаки отека плода и сердечной недостаточности (водянка плода).
Гемолитическая болезнь-резус следует диагностировать во время беременности.
- Примечание
- Антенатальный допплеровский ультразвук можно использовать для идентификации анемичных плодов, в то время как новая технология может определять группу крови плода по образцу материнской крови.
9-20 Опасна ли желтуха?
Желтуха может стать опасной, когда концентрация неконъюгированного билирубина в крови становится очень высокой.Неконъюгированный билирубин может затем попасть в мозг новорожденного и вызвать билирубиновую энцефалопатию () (ядерная желтуха). Конъюгированный билирубин не токсичен для мозга. В клинической практике TSB используется для оценки того, достигает ли билирубин опасной концентрации, поскольку TSB у новорожденных обычно почти полностью состоит из неконъюгированного билирубина.
Риск билирубиновой энцефалопатии зависит от:
- Общая концентрация билирубина в сыворотке крови .Чем выше TSB, тем больше вероятность того, что неконъюгированный билирубин проникнет через гематоэнцефалический барьер в клетки мозга.
- Срок беременности . Чем больше недоношенный ребенок, тем выше риск из-за незрелого гематоэнцефалического барьера.
- Послеродовой возраст . У высокого TSB в первые несколько дней больше шансов подняться до опасного уровня, чем у того же TSB в недельном возрасте.
- Факторы, которые могут сделать гематоэнцефалический барьер более проницаемым для билирубина , такие как гипоксия, гипотермия, гипогликемия и инфекция.
- Примечание
- Гематоэнцефалический барьер — это сложный механизм, который предотвращает проникновение токсичных веществ, таких как билирубин, из крови в клетки мозга.
У доношенных детей TSB становится опасным при концентрации выше 350 мкмоль / л (20 мг / дл), в то время как у недоношенных детей TSB становится опасным выше 250 мкмоль / л (15 мг / дл). Опасный уровень ниже, если присутствуют факторы, которые делают гематоэнцефалический барьер более проницаемым для билирубина.
Высокая концентрация неконъюгированного билирубина в сыворотке крови может повредить мозг.
9-21 Как распознать билирубиновую энцефалопатию?
- У младенца выраженная желтуха.
- TSB очень высок.
- Сначала младенец вялый, гипотонический, у него слабый крик, плохой рефлекс Моро и он плохо ест из-за рвоты из-за подавленной функции мозга.
- Позже младенец становится раздражительным из-за пронзительного крика, нервозности, опистотонуса и судорог из-за раздражения мозга.
Многие младенцы с билирубиновой энцефалопатией умирают, а оставшиеся в живых подвергаются высокому риску глухоты и церебрального паралича.Поэтому необходимо приложить все усилия для предотвращения билирубиновой энцефалопатии.
- Примечание
- Kernicterus описывает патологический признак окрашивания головного мозга билирубином и больше не используется для описания клинических признаков билирубиновой энцефалопатии. Церебральный паралич, вызванный билирубиновой энцефалопатией, обычно является атетоидным.
9-22 Как предотвратить билирубиновую энцефалопатию?
Не позволяя TSB достигать опасных уровней. Для уменьшения TSB можно использовать ряд методов:
- Давайте раннее кормление молоком, чтобы уменьшить количество билирубина, реабсорбируемого из кишечника.
- Предотвратить преждевременные роды.
- Вводите анти-D иммуноглобулин всем резус-отрицательным матерям после родов, выкидыша, амниоцентеза, отслойки плаценты или наружной головной версии.
- Проводите фототерапию, когда TSB приближается к опасному уровню.
- Сделайте обменное переливание крови, когда фототерапия не может удержать TSB ниже опасного уровня или когда опасный уровень уже достигнут.
- Иммуноглуобулин 0,5 г на кг внутривенно в течение 2 часов может снизить потребность в обменном переливании крови у младенцев с тяжелой гемолитической желтухой ABO или резусом.
Раннее кормление молоком помогает снизить общий уровень билирубина в сыворотке крови.
Фототерапия
9-23 Что такое фототерапия?
Фототерапия использует белый или синий свет (то есть видимый свет) для преобразования неконъюгированного билирубина в коже в водорастворимую форму билирубина. Затем водорастворимый билирубин переносится с альбумином с кровью в печень, откуда он может легко выводиться из организма без предварительного конъюгирования. Таким образом, фототерапия может быстро снизить TSB.Яркий свет может изменить форму, но не химический состав молекулы билирубина. Ультрафиолетовый свет, вызывающий солнечные ожоги и серьезное повреждение тканей, может убить младенца и не используется для фототерапии.
- Примечание
- При фототерапии неконъюгированный билирубин в процессе фотоизомеризации превращается в фотобилирубин и люмирубин, которые водорастворимы и, следовательно, легко выводятся с калом и мочой. Фототерапия не связывает билирубин.Синий свет (с длиной волны) 455 нм является наиболее эффективным.
9-24 Что используется для фототерапии?
Фототерапия обычно проводится с помощью установки для фототерапии, состоящей из ряда люминесцентных ламп. Используются трубки дневного света (SABS № 5) или белые трубки (SABS № 2). Их следует менять через 1000 часов использования, поскольку, несмотря на то, что они все еще выглядят яркими, их эффективность со временем снижается, и они излучают ультрафиолетовый свет, который опасен. Лист плексигласа (прозрачного пластика) должен быть размещен под трубками, чтобы уменьшить нагрев.Лист из плексигласа также защищает младенца, если люминесцентная лампа сломается или выйдет из строя. Иногда для проведения фототерапии также используются специальные белые галогенные прожекторы или синие светодиодные (светоизлучающие диоды) прожекторы.
Хотя воздействие солнечного света также снижает TSB, ребенок, помещенный на солнце, может быстро получить гипертермию. Следовательно, эту форму фототерапии следует использовать с большой осторожностью, если вообще использовать.
- Примечание
- Количество света, испускаемого аппаратом фототерапии, можно измерить с помощью фотометра.Измеряется только свет в синей части спектра, а выходная энергия указывается в мкВт / см2 / нм. Для эффективной фототерапии требуется выходная мощность более 7 мкВт. Одеяло для фототерапии может добавить к количеству фототерапии, обеспечиваемой светом для фототерапии. Однако он может обеспечить только ограниченное количество фототерапии, если используется отдельно. Преимущество светодиодных точечных светильников в том, что они не излучают ультрафиолетовый свет или тепло.
9-25 Когда следует проводить фототерапию?
Фототерапия может использоваться как терапевтически, так и профилактически.
Терапевтическая фототерапия должна проводиться всякий раз, когда TSB превышает нормальный диапазон и приближается к опасным уровням. На практике используется простая таблица, чтобы решить, когда проводить терапевтическую фототерапию. Если TSB для возраста младенца достигает линии фототерапии , лечение следует начинать. У недоношенных или больных детей фототерапию обычно начинают раньше. Фототерапию нельзя назначать здоровым доношенным детям с желтухой, у которых TSB находится ниже линии фототерапии.
У всех младенцев, рожденных от женщин с группой крови O, необходимо измерить TSB через 6 часов после рождения. Если TSB выше 80 мкг / дл, следует начать фототерапию.
Фототерапия позволяет избежать почти всех обменных переливаний.
Профилактическая фототерапия назначается, когда TSB все еще ниже линии фототерапии, но ожидается, что TSB быстро возрастет, или у ребенка повышенный риск билирубиновой энцефалопатии. Поэтому профилактическую фототерапию начинают сразу после рождения, если есть подозрение или диагноз гемолитической болезни новорожденного.Профилактическая фототерапия недоношенных новорожденных обычно начинается, когда TSB достигает 125 мкмоль / л у детей с массой тела менее 1250 г, 150 мкмоль / л у детей с массой тела менее 1500 г и 200 мкмоль / л у детей с массой тела менее 2000 г.
Рис. 9-1: Простое руководство по фототерапии для доношенных детей с указанием линии фототерапии.
Рисунок 9-2: Подробная таблица фототерапии для младенцев с разной массой тела при рождении и категориями гестационного возраста (например,грамм. От 34 до 34 недель и 6 дней или от 34 до менее 35 недель). (Источник: A R Horn: Неонатальная медицина, Университет Кейптауна.) Начните интенсивную фототерапию, когда TSB находится выше линии, соответствующей сроку беременности или весу.
9-26 Как проводить фототерапию?
- Включите аппарат для фототерапии и убедитесь, что все трубки работают. Проверьте возраст трубок и убедитесь, что лист плексигласа находится на месте.
- Поместите младенца обнаженным в инкубатор или люльку так, чтобы матрас находился примерно в 40 см от трубок для фототерапии.Младенец не должен носить подгузник. Вместо этого под младенца можно подложить подгузник.
- Накройте глаза младенца подушечками, так как яркий свет беспокоит младенца и может повредить сетчатку. Снимите наглазники во время кормления, чтобы можно было проверить глаза на наличие инфекции и позволить ребенку и матери видеть друг друга.
- Переворачивание младенца каждый час не делает фототерапию более эффективной.
- Кормите грудное молоко, по крайней мере, каждые 3-4 часа.Если возможно, кормите грудью. Добавьте еще 25 мл / кг / день, если ребенок нуждается в питании смесью. Свет может быть выключен во время кормления, или младенец может быть удален из аппарата фототерапии во время кормления.
- Следите за температурой младенца ежечасно, взвешивайте дважды в день и измеряйте TSB ежедневно или чаще, если она приближается к опасным уровням.
- Разрешить матери неограниченное свидание. По возможности, младенцу следует проводить фототерапию рядом с матерью в послеродовом отделении.
9-27 Как долго нужно проводить фототерапию?
Продолжайте фототерапию до тех пор, пока TSB не будет находиться под линией фототерапии в течение 24 часов. Иногда TSB снова поднимается над линией после того, как фототерапия была остановлена и лечение необходимо возобновить. Однако, как только TSB падает, он обычно остается в нерабочем состоянии. Большую часть фототерапии можно прекратить через 3 дня.
9-28 В чем опасность фототерапии?
- Младенцу может стать слишком жарко или слишком холодно .Во время фототерапии важно очень внимательно следить за температурой кожи.
- У ребенка может быть жидкий зеленый стул из-за большого количества билирубина, выделяемого в кишечник. Младенец также может потеть больше, чем обычно. Это может привести к чрезмерной потере веса из-за обезвоживания. При фототерапии младенцам, находящимся на грудном вскармливании, следует разрешать кормить по крайней мере каждые 4 часа, в то время как младенцы, находящиеся на искусственном вскармливании, должны получать дополнительно 25 мл / кг / день в виде молока. Нет необходимости давать особо чистые корма.Всем младенцам, проходящим фототерапию, следует контролировать их вес.
- Глаза младенца должны быть прикрыты подушечками для предотвращения чрезмерного воздействия яркого света. Прокладки мешают матери и ребенку видеть друг друга, и это может мешать склеиванию . Конъюнктивит также может быть скрыт подушечками. Поэтому рекомендуется снимать наглазники каждый раз перед кормлением ребенка. Замените подушечки после кормления.
- Видимая желтуха быстро исчезает при фототерапии, даже если TSB остается высоким или продолжает увеличиваться.TSB необходимо контролировать у всех младенцев, получающих фототерапию.
- Могут произойти другие изменения цвета кожи . Через несколько дней младенец может загореть. Эритема (розовая сыпь) может возникнуть в результате чрезмерного нагрева, если под трубками не положить плексигласовый лист. Большинство кожных высыпаний усугубляются фототерапией, а фототерапия, проведенная по ошибке младенцу с конъюгированной гипербилирубинемией, придает коже серый / зеленый цвет, известный как бронзовый.
- Фототерапия отделяет младенца от матери , поэтому ее не следует проводить без уважительной причины.Разделение, вызванное фототерапией, вызывает у матери тревогу, а также может помешать установлению грудного вскармливания.
Общий билирубин в сыворотке крови следует измерять у всех младенцев, получающих фототерапию.
9-29 Можно ли использовать фенобарбитон для лечения желтухи?
Существует мало доказательств того, что пероральное или внутримышечное введение фенобарбитона увеличивает эффективность фототерапии. Это также может вызвать вялость и плохое питание. Поэтому фенобарбитон не рекомендуется для лечения желтухи новорожденных.Его не следует использовать вместо фототерапии.
- Примечание
- Фенобарбитон 5 мг / кг внутривенно может помочь снизить TSB у младенцев с тяжелой желтухой. Также может помочь очистка толстой кишки от мекония с помощью глицериновых суппозиториев. У младенцев с гемолитической желтухой Rh или ABO внутривенное введение иммуноглобулина останавливает гемолиз.
Регулярное использование фенобарбитона для уменьшения желтухи не рекомендуется.
9-30 Когда необходимо обменное переливание крови?
За исключением младенцев с тяжелой гемолитической болезнью, вызванной резус-фактором, обменное переливание крови сегодня редко требуется, если фототерапия используется правильно и по показаниям.Тем не менее, обменное переливание крови все же может потребоваться, если есть задержка с началом фототерапии и постепенное увеличение TSB невозможно контролировать.
Показания к обменному переливанию крови:
- TSB выше 400 мкмоль / л (20 мг / дл) у доношенных новорожденных, несмотря на фототерапию.
- TSB выше 250–350 мкмоль / л (15 мг / дл) у недоношенных детей в зависимости от веса ребенка. Чем меньше младенец, тем ниже TSB, при котором показано обменное переливание крови.
- Более низкий TSB, если младенец является или был гипоксическим, гипотермическим, гипогликемическим или инфицированным.
- Быстро увеличивающийся TSB и падающий объем упакованных клеток на 1-й день у младенца с гемолитической болезнью резус.
- Примечание
- Следующие весовые категории могут быть полезны при необходимости обменного переливания крови:
| Менее 1500 г | 1500–1999 г | 2000–2499 г | 2500 г | |
|---|---|---|---|---|
| Well baby | 250 мкмоль / л | 300 мкмоль / л | 350 мкмоль / л | 400 мкмоль / л |
| Больной младенец или младенец с гемолизом | 200 мкмоль / л | 250 мкмоль / л | 300 мкмоль / л | 350 мкмоль / л |
Всех младенцев, которым может потребоваться обменное переливание крови, необходимо срочно перевести в больницу с необходимым персоналом и оборудованием.Отправьте согласие родителей и пробирку со свернувшейся материнской кровью младенцу для перекрестного сопоставления. Тем временем проведите фототерапию. Помните, что обменное переливание крови имеет свои опасности и побочные эффекты.
- Примечание
- При обменном переливании двойной объем крови младенца заменяется свежей совместимой донорской кровью отрицательной группы O (160 мл / кг). Обычно обмен осуществляется через катетер, помещенный в пупочную вену, при этом за один раз обменивается 10–20 мл крови. Необходимо следить за тем, чтобы младенцу было тепло, и следить за показателями жизнедеятельности во время процедуры.
Анемия
9-31 Что такое анемия?
Чтобы определить, есть ли у младенца анемия, можно измерить одно из следующих значений:
- Объем упакованных клеток (PCV), выраженный в процентах.
- Концентрация гемоглобина (Hb), которая выражается в г / дл.
Анемия определяется как PCV или Hb, уровень которого ниже нормы для постнатального возраста младенца.
Нормальный уровень PCV при рождении составляет 45–65%, а Hb — 15–25 г / дл.После родов уровни PCV и Hb у доношенных детей неуклонно снижаются примерно до 8-недельного возраста, а затем медленно повышаются. PCV не должен опускаться ниже 35%, а Hb — ниже 12 г / дл у доношенного ребенка. Продолжительность жизни красных кровяных телец у младенца составляет всего 90 дней (3 месяца) по сравнению со 120 днями у взрослого.
Важно, чтобы PCV или Hb измерялись в образце венозной или артериальной крови или крови, взятой из теплой пятки. Капиллярная кровь, взятая из холодной пятки, дает ложно завышенные показания.
- Примечание
- Анемия (технически диагностированная) — это не то же самое, что бледность (клинический признак бледности кожи, ногтевого ложа и слизистых оболочек). Хотя младенцы с анемией бледны, существует множество других причин бледности (например, холод или шок).
9-32 Каковы общие причины анемии у младенцев?
- Анемия недоношенных
- Повторный забор небольших объемов крови для специальных исследований (например, газов крови)
- Гемолитическая болезнь новорожденных
- Кровотечение перед родами (кровотечение у плода и матери)
- Кровоизлияние во время или после родов (e.грамм. кровотечение из пуповины)
- Инфекция (например, сепсис и сифилис).
Дефицит железа — очень редкая причина анемии у новорожденных. Однако железодефицитная анемия часто встречается в возрасте старше 3 месяцев, особенно у недоношенных детей, у которых пуповина пережата сразу после родов и которые не получают регулярных добавок железа.
9-33 Что такое анемия недоношенных?
PCV и Hb у недоношенного ребенка нормальные при рождении, но падают быстрее и до более низкого уровня, чем у доношенного ребенка.Чем больше недоношенный ребенок, тем быстрее и ниже будет падение PCV и Hb. У большинства недоношенных детей PCV падает до 30%, а Hb — до 10 г / дл. Уровень гемоглобина или PCV ниже этих уровней является обычным явлением, особенно у очень недоношенных детей, и называется «анемией недоношенных». Анемия недоношенных часто усугубляется повторным забором крови. Пероральные добавки железа не предотвращают и не корректируют анемию недоношенных.
- Примечание
- Причиной анемии недоношенных является неспособность незрелой почки секретировать эритропоэтин, когда PCV и Hb падают ниже нормального диапазона.В результате костный мозг не стимулируется и не выделяет эритроциты в кровоток.
9-34 Когда следует лечить анемию у новорожденного?
Младенцу следует переливать упакованные клетки, если PCV ниже 45% или Hb ниже 15 г / дл при рождении или в течение первых 24 часов. После этого доношенных детей обычно рассматривают для переливания при PCV ниже 30% или Hb ниже 10 г / дл.
Упакованные клетки следует давать ребенку с анемией недоношенных, если PCV падает ниже 25% или Hb ниже 8.5 г / дл. Более раннее переливание показано, если PCV ниже 30% или Hb ниже 10 г / дл и у ребенка развиваются респираторные расстройства, признаки сердечной недостаточности или открытый артериальный проток, не развивается или имеется тяжелая инфекция.
Упакованные клетки должны полностью соответствовать младенцу. Обычно 10 мл / кг вводят в течение 4 часов. Очень маленьким младенцам может потребоваться несколько переливаний крови в течение первых нескольких месяцев жизни, прежде чем их PCV и гемоглобин спонтанно вернутся в норму. PCV следует проверить через неделю после переливания.
Полицитемия
9-35 Что такое полицитемия?
Полицитемия (слишком много эритроцитов) определяется как объем упакованных клеток выше 65% или концентрация гемоглобина выше 25 г / дл. Важно, чтобы кровь была венозной, артериальной или капиллярной из теплой стопы.
Младенцы с полицитемией выглядят очень красными (полнокровными). Обычно полицитемия не вызывает серьезных проблем, хотя у младенца может развиться желтуха. Однако, если PCV и Hb очень высоки, кровь становится густой и липкой, что вызывает неврологические симптомы, респираторный дистресс, гипогликемию и сердечную недостаточность.
9-36 Каковы причины полицитемии у младенцев?
- Хроническая гипоксия плода, которая часто встречается у:
- Недостаточная масса тела для младенцев гестационного возраста
- Младенцы с истощением
- Сахарный диабет у матери
- Переливание:
- Переливание крови от одного однояйцевого близнеца другому перед родами через монохориальную плаценту (переливание крови от одного близнеца к другому)
- Случайное переливание крови после родов.Это может произойти, если младенец находится на уровне намного ниже матери (плаценты) до пережатия пуповины.
9-37 Как лечится полицитемия?
Если полицитемия не вызывает клинических проблем, лечение не требуется. В течение первых нескольких недель ПКВ и гемоглобин постепенно приходят в норму. Однако, если у младенца есть неврологические признаки (сильная нервозность, судороги или плохое питание), респираторный дистресс, гипогликемия или сердечная недостаточность из-за полицитемии, то его необходимо лечить путем частичного переливания плазмообменной крови.Метод аналогичен обменному переливанию крови при желтухе, за исключением того, что младенцу вводят физиологический раствор, свежезамороженную плазму или стабилизированную сыворотку крови человека. Обмен ограничен 20 мл / кг.
Пример из практики 1
У доношенного ребенка, находящегося на грудном вскармливании, на 3-й день развивается желтуха, и уровень общего билирубина в сыворотке крови составляет 120 мкмоль / л. И мать, и младенец относятся к группе крови 0 + ve. Объем упакованных клеток младенца составляет 60% (гемоглобин 20 г / дл), а тест Кумба отрицательный.
1.Какова вероятная причина желтухи у этого младенца?
У этого младенца, вероятно, физиологическая желтуха, вызванная обычно высоким уровнем производства билирубина, медленной конъюгацией билирубина в печени и повышенной реабсорбцией билирубина в кишечнике.
2. Почему у младенца не желтуха, вызванная гемолитической болезнью АВО или резусом?
Поскольку и мать, и младенец имеют одинаковые группы крови по системе ABO и оба имеют резус-положительный результат, тест Кумба у младенца отрицательный, а PCV (Hb) в норме.При гемолитической болезни TSB, вероятно, будет намного выше, а PCV — низким.
3. Есть ли у этого младенца гипербилирубинемия? Обоснуйте свой ответ.
Нет, у этого младенца нет гипербилирубинемии, потому что TSB находится в пределах нормы для 3-дневного ребенка.
4. Как правильно вести себя с этим младенцем?
С младенцем следует обращаться так же, как со здоровым нормальным младенцем, за исключением того, что TSB следует повторять ежедневно, пока он не начнет падать.
5. Следует ли этому младенцу пройти фототерапию?
Нет. Для фототерапии нет оснований.
6. Следует ли матери прекратить грудное вскармливание?
Нет. Она должна продолжать кормить грудью. Хотя грудное вскармливание может привести к несколько более высокому TSB, нет необходимости прекращать грудное вскармливание.
Пример 2
Младенец набирает 32 недели и весит при рождении 1600 г. У младенца двусторонние цефалгематомы, и на 2-й день у него появляется желтуха с TSB 190 мкмоль / л.Лечение не проводится. На 5-й день ребенок становится вялым и гипотоническим из-за слабого плача. TSB сейчас составляет 370 мкмоль / л.
1. Как вы думаете, почему у этого младенца появилась желтуха?
Потому что ребенок родился недоношенным и имеет незрелую печень с медленной конъюгацией билирубина. Кроме того, в цефалгематомах повышается продукция билирубина за счет распада гемоглобина.
2. Как следует лечить этого младенца на второй день?
Фототерапию следовало начать, как только TSB окажется выше линии фототерапии.
3. Зачем вам беспокоиться, если ребенок с желтухой становится вялым и гипотоническим из-за слабого крика?
Потому что это ранние признаки билирубиновой энцефалопатии. Помните, что они также могут быть ранними признаками других проблем, таких как сепсис.
4. Как бы вы лечили гипербилирубинемию этого младенца?
TSB настолько высок, что младенцу необходимо как можно скорее сделать обменное переливание крови. А пока надо начинать фототерапию. Не дренируйте цефалгематомы.
Пример 3
У доношенного ребенка появляется желтуха в 12 часов. Группа крови матери — O + ve, а младенец — группа крови B +. Начинается фототерапия, и через 24 часа желтуха у ребенка больше не появляется.
1. Какова вероятная причина желтухи у этого младенца?
Гемолитическая болезнь в виде желтухи была замечена в течение первых 24 часов. Группы крови предполагают гемолитическую болезнь ABO (т. Е. Материнская группа O и младенческая группа крови B). Положительный результат теста Кумба подтвердит диагноз гемолитической болезни.
2. Какое расследование необходимо?
Необходимо измерить TSB младенца.
3. Как вы думаете, можно ли безопасно прекратить фототерапию на 2-й день, когда желтуха исчезла? Поясните свой ответ.
Нет. Фототерапия может устранить желтуху, хотя TSB остается высоким.
4. Когда следует прекратить фототерапию?
Когда TSB находится ниже линии фототерапии в течение 24 часов. После этого TSB все еще следует контролировать в течение нескольких дней, поскольку TSB может снова увеличиться из-за продолжающегося гемолиза.
Пример использования 4
Недоношенному ребенку, весившему при рождении 1200 г, исполнился месяц. За последнюю неделю младенец не прибавил в весе, но в остальном чувствует себя хорошо. PCV составляет 22%. Младенец лечится препаратами железа. Поскольку сейчас ребенок весит 1800 г, мать хочет забрать его домой.
1. Есть ли у этого младенца анемия?
Да, потому что PCV ниже 30%.
2. Какой у вас диагноз?
Анемия недоношенных.Многие недоношенные дети не вырабатывают эритроциты в течение нескольких недель после рождения.
3. Как следует лечить этого младенца?
Младенцу необходимо переливание упакованных клеток. Обычно за 4 часа сдается 10 мл / кг крови.
4. Почему этого младенца еще не забрать домой?
Потому что PCV (и Hb) все еще может продолжать падать. После переливания крови младенца можно выписать. Его следует вернуть в клинику или больницу для проверки PCV через неделю.
5. Следует ли этому младенцу получать добавки железа?
Да. Добавки железа помогут предотвратить дефицит железа в течение нескольких месяцев. Однако добавки железа не предотвратят или не исправят анемию недоношенных.
Пример 5
Доношенный ребенок рождается дома, а затем доставляется в ближайшую больницу. При осмотре ребенок выглядит здоровым, но очень полнокровным. Берут капиллярный образец крови. PCV составляет 70%.
1. Какой диагноз?
У младенца полицитемия.Клинически на это указывает красный цвет и подтверждают высокие показатели ПВХ.
2. Что такое нормальная ПКВ при рождении?
При рождении нормальная ПКВ составляет от 45 до 65%. В течение первых нескольких недель ПКВ постепенно снижается.
3. Какие меры предосторожности следует предпринять, если образец капиллярной крови взят на ПКВ?
Пятка должна быть теплой и не сдавливаться. В противном случае результат PCV будет ложно высоким.
4. Как вести себя с этим младенцем?
Поскольку ребенок выглядит здоровым, специального лечения не требуется.Однако у грудничка следует наблюдать желтуху.
Видео
Желтуха
Видео проекта Global Health Media, доступное по лицензии Creative Commons Attribution-NonCommercial-NoDerivatives License
Конъюгированная гипербилирубинемия | Американская академия педиатрии
Цели
После прочтения этой статьи читатели должны иметь возможность:
Описывать метаболизм билирубина.
Обследуйте ребенка любого возраста, у которого была конъюгированная гипербилирубинемия.
Распознайте признаки и симптомы болезни Вильсона.
Введение
Желтуха — это изменение цвета кожи, склеры, слизистых оболочек и биологических жидкостей на желтый цвет. Это обычная проблема, которая может быть признаком многих заболеваний. Задача врача — выявить пациентов, нуждающихся в дополнительном обследовании. Дифференциальный диагноз желтухи зависит от возраста; в этом обзоре рассматриваются причинные состояния у младенцев после новорожденного, у детей старшего возраста и подростков.
Желтуха вызывается повышенными концентрациями билирубина в сыворотке крови. Это очевидно у младенцев, когда уровень билирубина в сыворотке превышает 4–5 мг / дл (от 68,4 до 85,5 мкмоль / л), а у детей более старшего возраста — от 2 до 3 мг / дл (от 34,2 до 51,3 ммоль / л). Общий билирубин сыворотки измеряется в лаборатории как сумма двух компонентов: неконъюгированной («непрямой») и конъюгированной («прямой») фракций. Термины «прямая» и конъюгированная гипербилирубинемия часто используются как синонимы. Однако это использование не всегда верно, поскольку прямой билирубин может включать как конъюгированную фракцию, так и билирубин, связанный с альбумином (дельта-билирубин).Дельта-билирубин образуется ковалентной связью между конъюгированным билирубином в сыворотке и альбумином; он метаболизируется с альбумином и имеет аналогичный период полувыведения 21 день. Присутствие дельта-билирубина часто продлевает прямую гипербилирубинемию, в то время как результаты других тестов печени нормализуются. Многие больницы продолжают измерять прямой билирубин методом, который включает как прямой, так и дельта-билирубин. Клиницистам следует подумать о том, чтобы попросить разбить фракцию прямого билирубина, если желтуха является длительной или нетипичной.
Конъюгированная гипербилирубинемия определяется как концентрация конъюгированного билирубина более 2 мг / дл (34,2 ммоль / л) или более 20% от общего билирубина. Это…
Желтуха в первичной медико-санитарной помощи: когортное исследование взрослых в возрасте> 45 лет с использованием электронных медицинских карт | Семейная практика
Аннотация
Справочная информация. Желтуха — редкий, но важный симптом злокачественных и доброкачественных заболеваний. Когда пациенты обращаются за первичной медико-санитарной помощью, понимание относительной вероятности различных процессов заболевания может помочь врачам общей практики обследовать пациентов и надлежащим образом направлять их.
Цель. Для выявления и количественной оценки различных причин желтухи у взрослых, обращающихся за первичной медико-санитарной помощью.
Дизайн. Историческое когортное исследование с использованием электронных записей первичной медико-санитарной помощи.
Настройка. База данных исследований общей практики Великобритании.
Методы. участников (186 814 мужчин и женщин) в возрасте> 45 лет с клиническими событиями, зарегистрированными в картах первичной медико-санитарной помощи в период с 1 января 2005 г. по 31 декабря 2007 г. Поиск данных проводился на предмет эпизодов желтухи и пояснительных диагнозов, установленных в течение последующих 12 месяцев.Если диагноз не был установлен, в предыдущей медицинской карте пациента производился поиск соответствующих хронических заболеваний.
Результаты. Из полной когорты 277 пациентов имели по крайней мере один отчет о желтухе в период с 1 января 2005 г. по 31 декабря 2006 г. Было обнаружено, что 92 (33%) имели камни желчных протоков; 74 (27%) имели объяснительный рак [рак поджелудочной железы 34 (12%), холангиокарцинома 13 (5%) и другие диагностированные первичные злокачественные опухоли 27 (10%)]. Заболевание печени, связанное с чрезмерным употреблением алкоголя, объяснили 26 (9%), а другие диагнозы были установлены у 24 (9%).У 61 (22%) не было зарегистрировано никаких диагнозов, связанных с желтухой.
Заключение. Хотя наиболее частой причиной желтухи являются камни желчных протоков, в этом исследовании рак присутствует более чем у четверти пациентов с желтухой, что демонстрирует важность безотлагательного расследования основной причины.
Введение
Желтуха, или желтуха, описывает желтый цвет кожи и глаз в результате повышенного билирубина плазмы, продукта разложения гемоглобина.Симптом (или признак) желтухи может быть следствием нескольких заболеваний, в том числе доброкачественных и злокачественных.1 Он возникает либо из-за повышенной выработки, либо из-за пониженного выведения билирубина. Билирубин может быть конъюгированным или неконъюгированным, в зависимости от процесса заболевания. Предпеченочная желтуха может быть результатом перепроизводства билирубина (как при гемолизе) или снижения конъюгации (как при синдроме Жильбера). Паренхиматозное заболевание печени приводит к повышению уровня конъюгированного или неконъюгированного билирубина. Печеночные причины повышенного билирубина включают цирроз, вирусный, аутоиммунный или лекарственный гепатит или обширное замещение печени метастазами.Внепеченочный холестаз может быть следствием закупорки желчных протоков камнями или первичным злокачественным новообразованием (панкреатическая или холангиокарцинома) и обычно связан с повышенным уровнем конъюгированного билирубина.
Клинически желтуха становится очевидной, когда уровень билирубина составляет ~ 40 мкмоль / л, что в два-три раза превышает нормальное значение, в зависимости от выбранного в лаборатории референсного диапазона.1 Частота клинически очевидной желтухи в учреждениях первичной медико-санитарной помощи не описана. хотя опыт показывает, что это относительно редко.В одном исследовании сообщалось об эффективности клиники быстрого доступа при желтухе с точки зрения диагностики и лечения2. Из 107 пациентов, направленных на лечение, злокачественные новообразования желчных путей имели место в 30 случаях, камни в общих желчных протоках — у 26 и связанное с алкоголем заболевание печени — у 9 пациентов. Вирусный или лекарственный гепатит и аутоиммунное заболевание печени присутствовали у 15 пациентов, синдром Гилберта — у 2, а застойная сердечная недостаточность — у одного человека. Три других британских исследования были посвящены этому вопросу, хотя все участники идентифицировали участников с помощью обычных лабораторных тестов.В валлийском исследовании были исследованы 3 121 участника с билирубином ≥120 мкмоль / л: вероятные причины желтухи были определены из больничных записей, при необходимости дополненных общением с терапевтами. Только 4% когорты полностью обслуживались в рамках первичной медико-санитарной помощи. Наиболее частыми причинами были злокачественные новообразования 35%, сепсис / шок 22% (у большинства из которых желтуха развилась в больнице), камни общего желчного протока 13% и цирроз 8%. Неправильный диагноз или его отсутствие установлен у 19% пациентов. В исследовании на английском языке 4 критерием включения было нарушение функции печени (не обязательно желтуха), и аналогичные методы использовались для выявления соответствующих исследований.Сто пятьдесят семь (18%) пациентов не находились под наблюдением в больнице и имели неполное обследование. Этим пациентам было предложено повторное обследование, и были зарегистрированы диагнозы только в этой подгруппе. Из 157 повторно протестированных пациентов у 97 (62%) были диагностированы состояния, требующие стационарного вмешательства или последующего наблюдения, включая алкогольную болезнь печени, наследственное хроническое заболевание печени и гепатит (как вирусный, так и аутоиммунный). В шотландском исследовании5 ретроспективно изучались результаты пациентов после тестирования функции печени в первичной медико-санитарной помощи, и было обнаружено только одно.15% с серьезным заболеванием печени. Однако пациенты с уровнем билирубина> 35 мкмоль / л (т.е. пациенты с клинической желтухой) были специально исключены из исследования. Другие исследования проводились в рамках вторичной медицинской помощи, основными причинами которых были острые и хронические паренхиматозные заболевания, злокачественная механическая желтуха и камни в желчном пузыре6. часто с последующим циррозом и метастазами в печень.3
Хотя пациенты с желтухой могут обращаться непосредственно в больницу, они часто обращаются в службу первичной медико-санитарной помощи, и врачи общей практики будут вести и направлять этих пациентов. В настоящее время, в частности, «механическая» желтуха включена в Руководство NICE при подозрении на рак .7 Это поможет врачам общей практики сформулировать план расследования, если будут выявлены различные основные причины желтухи в учреждениях первичной медико-санитарной помощи и их родственники. важность установлена. Это исследование было направлено на то, чтобы сделать это с использованием данных первичной медико-санитарной помощи.
Методы
Идентификация исследуемой популяции
Исследование было включено в большую программу исследований рака, DISCOVERY Program (http://www.discovery-programme.org). Соответствующая часть этой исследовательской программы использует базу данных исследований общей практики (GPRD). В этой базе данных хранятся анонимные данные первичной медико-санитарной помощи для 4,8 миллионов пациентов по всей Великобритании, включая подробности каждой консультации, направления, рецепта и основного результата.Для программы были идентифицированы все пациенты в возрасте ≥40 лет на 1 января 2000 г. с 1 из 13 специфических видов рака (перечисленных в таблице 1), диагностированных в период с 2000 по 2009 гг. Если было обнаружено> 5000 пациентов с определенным раком, 5000 были отобраны с использованием компьютеризированных случайных чисел. Для каждого случая рака было случайным образом выбрано до пяти контролей, сопоставленных по полу, году рождения и зарегистрированных в одной и той же врачебной практике. Контрольные группы были исключены, если у них когда-либо была запись о том же раке, что и в их случае.Однако у них могли быть диагностированы любые другие виды рака. В представленном здесь исследовании использовалась только «контрольная» популяция в качестве разумной выборки «здорового» населения, хотя и той, чей возрастной состав соответствовал возрастному распределению рака в Великобритании. Чтобы избежать возможной путаницы, эти элементы управления теперь называются «участниками».
Таблица 1Происхождение участников (разбито по локализации рака в программе DISCOVERY)
| Раковое место совпадающего случая | Количество потенциальных участников до применения критериев отбора | Количество подходящих участников (%, проконсультировавшихся в 2005–07 гг. ) | Участники по полу [мужчины, женщины (в процентах)] | ||
| Мочевой пузырь | 24 098 | 20 102 (83.4) | 14 435 (71,8), 5667 (28,2) | ||
| Грудь | 23028 | 20 356 (88,4) | 255 (1,3), 20101 (98,7) | ||
| Cervixa | 4653 (86,0) | 9 (0,2), 4644 (99,8) | |||
| Голова и шея | 8455 | 7045 (83,3) | 5092 (72,3), 1953 (27,7) | ||
| 15 716 | 13 624 (86,7) | 8274 (60.7), 5350 (39,3) | |||
| Лейкемия | 22 946 | 19 378 (84,5) | 11048 (57,0), 8330 (43,0) | ||
| Лимфома | 23703 207 | 23703 208 | 9 )10 588 (52,5), 9597 (47,5) | ||
| Миелома | 13503 | 11 263 (83,4) | 5936 (52,7), 5327 (47,3) | ||
| 19 592 (80,8) | 12 756 (65.1), 6836 (34,9) | ||||
| Поджелудочная железа | 17919 | 15172 (84,7) | 7103 (46,8), 8069 (53,2) | ||
| Желудок | 1929024 116 | 1 | 1 | 12 364 (64,4), 6828 (35,6) | |
| Testisa | 1489 | 1258 (84,5) | 1248 (99,2), 10 (0,8) | ||
| Uterusa | 992900 9116 7893 (89,3)514 (3,4), 14 480 (96.6) |
| Рак совпадающий случай | Количество потенциальных участников до применения критериев отбора | Количество подходящих участников (%, которые консультировались в 2005–07) | Участники по полу [мужчина, женщина (в процентах)] | ||||||||||||
| Мочевой пузырь | 24098 | 20102 (83,4) | 14 435 (71,8), 5667 (28,2) | ||||||||||||
| Грудь | 23028 | (889,193 2093)4)255 (1,3), 20101 (98,7) | |||||||||||||
| Cervixa | 5409 | 4653 (86,0) | 9 (0,2), 4644 (99,8) | ||||||||||||
| Головка и шея | |||||||||||||||
| 7045 (83,3) | 5092 (72,3), 1953 (27,7) | ||||||||||||||
| Почка | 15 716 | 13 624 (86,7) | 8274 (60,7), 5350 (39,3) | ||||||||||||
| 19 378 (84,5) | 11 048 (57.0), 8330 (43,0) | ||||||||||||||
| Лимфома | 23703 | 20185 (85,2) | 10 588 (52,5), 9597 (47,5) | ||||||||||||
| Миелома | 13503 26390 911,493 ) | 5936 (52,7), 5327 (47,3) | |||||||||||||
| Пищевод | 24248 | 19592 (80,8) | 12756 (65,1), 6836 (34,9) | ||||||||||||
| поджелудочная железа | 15 172 (84,7) | 7103 (46.8), 8069 (53,2) | |||||||||||||
| Желудок | 24116 | 19192 (79,6) | 12 364 (64,4), 6828 (35,6) | ||||||||||||
| Testisa | 1489 | 125890 (84,5 | 1248 (99,2), 10 (0,8) | ||||||||||||
| Uterusa | 16 786 | 14 994 (89,3) | 514 (3,4), 14 480 (96,6) |
Происхождение участников (разделенное по месту рака в программе DISCOVERY)
| Место рака совпадающего случая | Количество потенциальных участников до применения критериев отбора | Количество подходящих участников (%, проконсультировавшихся в 2005–07) | Участники по полу [мужчины , женский (в процентах)] | ||
| Мочевой пузырь | 24 098 | 20 102 (83.4) | 14 435 (71,8), 5667 (28,2) | ||
| Грудь | 23028 | 20 356 (88,4) | 255 (1,3), 20101 (98,7) | ||
| Cervixa | 4653 (86,0) | 9 (0,2), 4644 (99,8) | |||
| Голова и шея | 8455 | 7045 (83,3) | 5092 (72,3), 1953 (27,7) | ||
| 15 716 | 13 624 (86,7) | 8274 (60.7), 5350 (39,3) | |||
| Лейкемия | 22 946 | 19 378 (84,5) | 11048 (57,0), 8330 (43,0) | ||
| Лимфома | 23703 207 | 23703 208 | 9 )10 588 (52,5), 9597 (47,5) | ||
| Миелома | 13503 | 11 263 (83,4) | 5936 (52,7), 5327 (47,3) | ||
| 19 592 (80,8) | 12 756 (65.1), 6836 (34,9) | ||||
| Поджелудочная железа | 17919 | 15172 (84,7) | 7103 (46,8), 8069 (53,2) | ||
| Желудок | 1929024 116 | 1 | 1 | 12 364 (64,4), 6828 (35,6) | |
| Testisa | 1489 | 1258 (84,5) | 1248 (99,2), 10 (0,8) | ||
| Uterusa | 992900 9116 7893 (89,3)514 (3,4), 14 480 (96.6) |
| Рак совпадающий случай | Количество потенциальных участников до применения критериев отбора | Количество подходящих участников (%, которые консультировались в 2005–07) | Участники по полу [мужчина, женщина (в процентах)] | ||||||||||||
| Мочевой пузырь | 24098 | 20102 (83,4) | 14 435 (71,8), 5667 (28,2) | ||||||||||||
| Грудь | 23028 | (889,193 2093)4)255 (1,3), 20101 (98,7) | |||||||||||||
| Cervixa | 5409 | 4653 (86,0) | 9 (0,2), 4644 (99,8) | ||||||||||||
| Головка и шея | |||||||||||||||
| 7045 (83,3) | 5092 (72,3), 1953 (27,7) | ||||||||||||||
| Почка | 15 716 | 13 624 (86,7) | 8274 (60,7), 5350 (39,3) | ||||||||||||
| 19 378 (84,5) | 11 048 (57.0), 8330 (43,0) | ||||||||||||||
| Лимфома | 23703 | 20185 (85,2) | 10 588 (52,5), 9597 (47,5) | ||||||||||||
| Миелома | 13503 26390 911,493 ) | 5936 (52,7), 5327 (47,3) | |||||||||||||
| Пищевод | 24248 | 19592 (80,8) | 12756 (65,1), 6836 (34,9) | ||||||||||||
| поджелудочная железа | 15 172 (84,7) | 7103 (46.8), 8069 (53,2) | |||||||||||||
| Желудок | 24116 | 19192 (79,6) | 12 364 (64,4), 6828 (35,6) | ||||||||||||
| Testisa | 1489 | 125890 (84,5 | 1248 (99,2), 10 (0,8) | ||||||||||||
| Uterusa | 16 786 | 14 994 (89,3) | 514 (3,4), 14 480 (96,6) |
Участники были включены, если у них были клиническое событие, зарегистрированное в их записях в период с 2005 по 2007 год.Их исключали, если они когда-либо отказывались загружать данные в национальную электронную базу данных.
Выявление желтухи и возможных причин
Набор данных подходящих участников был подвергнут поиску для выявления пациентов с желтухой с 1 января 2005 года по 31 декабря 2006 года. Пациенты с желтухой были идентифицированы путем поиска клинических событий, которые содержали коды, относящиеся к желтухе (результаты см. В Приложении 1). GPRD имеет собственную систему кодирования, которая соответствует кодам чтения.Каждый код GPRD имеет описание, которое является элементом, видимым GP при вводе записи. Список кодов желтухи был извлечен из 100 035 доступных кодов в рамках всей системы GPRD и согласован на основе консенсуса между AT и WH. В картах пациентов проводился поиск кодов, связанных с причинами желтухи. Диагнозы считались актуальными, если они были зарегистрированы в течение 12 месяцев после регистрации желтухи. Для любого пациента без соответствующего диагностического кода проводился поиск в его предыдущей медицинской карте, чтобы определить хроническое или злокачественное заболевание, которое могло бы дать объяснение.
Смертность была рассчитана путем поиска кодов, относящихся к смерти за 12-месячный период, вместо использования даты отмены регистрации, содержащейся в данных GPRD, которая может возникнуть либо в результате смерти пациента, либо в результате его ухода из практики.
Результаты
После применения критериев отбора 186 814 участников были доступны для изучения. Их происхождение показано в таблице 1, а демографические данные — в таблице 2.
Таблица 2Возраст и пол участников
| Возраст | Мужской (возрастной группы) | Женский | Всего (% когорты) | ||||
| ≤59 | 16 198 | ||||||
| 37 641 (20.1) | |||||||
| 60–69 | 2505 | 24 758 | 49 763 (26,6) | ||||
| 70–79 | 29 833 | 26 880 | 56 713 | 2290 80–89 | 16 971 | 19 711 | 36 682 (19,6) |
| ≥90 | 1615 | 4400 | 6015 (3,2) | ||||
| Всего | |||||||
| 186 814 (100) |
| Возраст | Мужской (возрастной группы) | Женский | Всего (% когорты) | ||||
| ≤59 | 1 19893 903 | 37 641 (20.1) | |||||
| 60–69 | 25 005 | 24 758 | 49 763 (26,6) | ||||
| 70–79 | 29 833 | 26 880 | 56 713 | 2290 80–89 | 16 971 | 19 711 | 36 682 (19,6) |
| ≥90 | 1615 | 4400 | 6015 (3,2) | ||||
| Всего | |||||||
| 186 814 (100) |
Возраст и пол участников
| Возраст | Мужской (возрастной группы) | Женский | Всего (% от когорты) | ||||
| 16198 | 21 443 | 37 641 (20.1) | |||||
| 60–69 | 2505 | 24 758 | 49 763 (26,6) | ||||
| 70–79 | 29 833 | 26 880 | 56 713 | 2290 80–89 | 16 971 | 19 711 | 36 682 (19,6) |
| ≥90 | 1615 | 4400 | 6015 (3,2) | ||||
| Всего | |||||||
| 186 814 (100) |
| Возраст | Мужской (возрастной группы) | Женский | Всего (% когорты) | ||||
| ≤59 | 1 19893 903 | 37 641 (20.1) | |||||
| 60–69 | 2505 | 24 758 | 49 763 (26,6) | ||||
| 70–79 | 29 833 | 26 880 | 56 713 | 2290 80–89 | 16 971 | 19 711 | 36 682 (19,6) |
| ≥90 | 1615 | 4400 | 6015 (3,2) | ||||
| Всего | |||||||
| 186 814 (100) |
Двести семьдесят семь пациентов (0.15% участников или годовая заболеваемость 0,74 на 1000 пациентов> 45 лет) имели один или несколько кодов, относящихся к желтухе, в течение 2 лет, всего было зарегистрировано 412 кодов желтухи. В большинстве кодов используется термин «желтуха» как таковой, без дополнительного дескриптора, хотя в 139 (33%) указана механическая желтуха.
Сто шестьдесят один (58%) из 277 пациентов с желтухой были мужчинами и 116 (42%) женщинами. Тридцать семь (23%) мужчин и 26 (22%) женщин умерли в течение 1 года от начала желтухи.
Мы составили список возможных диагнозов, лежащих в основе желтухи, первоначально от болезней, перечисленных в нашем поиске литературы. Мы дополнили список возможных диагнозов, изучив медицинские карты наших пациентов с желтухой, чтобы выявить возможные причины, не включенные в наш первоначальный список. Полный список доступен у авторов. У восьми пациентов было более одного пояснительного кода: им был назначен наиболее вероятный диагноз на основе консенсуса; например, пациент с камнями в желчном пузыре и более поздней холангиокарциномой был отнесен к последней категории.Разбивка диагнозов представлена на Рисунке 1.
РИСУНОК 1
Причины желтухи. «Другая» категория включала неуточненные гепато-билиарные состояния (девять), гемолитическую анемию (шесть), гепатит (четыре), лекарственный гепатит (три), синдром Жильбера (один) и панкреатит (один). В категорию камней желчных протоков вошли пять пациентов с восходящим холангитом.
РИСУНОК 1
Причины желтухи. «Другая» категория включала неуточненные гепато-билиарные состояния (девять), гемолитическую анемию (шесть), гепатит (четыре), лекарственный гепатит (три), синдром Жильбера (один) и панкреатит (один).В категорию камней желчных протоков вошли пять пациентов с восходящим холангитом
Обсуждение
Краткое изложение основных выводов
Исследование показало, что камни желчных протоков являются наиболее частой причиной желтухи у пациентов в возрасте> 45 лет, обращающихся за первичной медико-санитарной помощью. Злокачественные новообразования (поджелудочная железа, холангиокарцинома и метастазы) составляют более четверти пациентов. Цирроз или гепатит, связанные с алкоголем, были третьей по величине категорией.Мы не могли определить причину почти за квартал, основываясь на проверке медицинских карт каждого пациента на предмет наличия уместных закодированных диагнозов.
Сильные стороны и ограничения
Это исследование имеет несколько ограничений. Это полностью зависит от точной записи данных врачами общей практики. В нескольких исследованиях изучались симптомы в GPRD, часто с использованием методов «случай – контроль». В большинстве предыдущих исследований сравнивали регистрацию симптомов в случаях и в контрольной группе, что делало систематическое занижение диагнозов менее важным.Мы не можем знать, сколько пациентов с желтухой не зарегистрировали симптом, возможно, потому, что терапевт предпочитал записывать конкретный диагноз. Как правило, врачи общей практики предпочитают документировать диагнозы, а не симптомы, хотя в случае желтухи было бы редко, чтобы основной диагноз мог быть очевиден на первоначальной консультации, что позволяет им это сделать. Еще одним ограничением является то, что наш набор данных был сопоставлен по возрасту и полу с пациентами, больными раком. Это означает, что они не являются случайной выборкой из всех взрослых старше 45 лет, но имеют более высокую представленность возрастной группы, страдающей раком.Таким образом, в наших исследованиях, вероятно, слишком много раковых заболеваний. Однако контрольные группы в программе DISCOVERY были отобраны так, чтобы не иметь того же рака, что и соответствующий случай. Это относится к контрольным образцам рака поджелудочной железы, у которых, как мы знали, не было обнаружено никаких данных о раке поджелудочной железы, что потенциально недооценивает рак поджелудочной железы как причину желтухи в исследовании. Наконец, регистрация чрезмерного употребления алкоголя в GPRD не завершена, поэтому некоторые пациенты с неуточненным гепатитом, вероятно, страдали алкогольным гепатитом.
Наши оценки смертности могут быть низкими, поскольку не всем случаям смерти пациентов присвоен конкретный код смертности. Тем не менее, уровень смертности был очень высоким, что согласуется с предыдущими исследованиями вторичной помощи3,6
Сравнение с существующей литературой
Наши результаты аналогичны результатам отчета Горячей линии по желтухам2. Злокачественные новообразования, камни желчных протоков и алкоголь были тремя наиболее частыми причинами, хотя камни желчных протоков обнаруживались несколько чаще, чем в исследовании Горячей линии.Аутоиммунный или вирусный гепатит был редкой причиной. Камни желчных протоков представляли только 16 (13%) пациентов в другом предыдущем исследовании. 3 Однако это исследование включало только пациентов с билирубином> 120 мкмоль / л. Интересно, что в этом исследовании пациенты, у которых при окончательном обследовании обнаружились камни желчных протоков, часто имели более низкий уровень билирубина; действительно, большинство из них не соответствовало критериям включения в исследование, основанным на значении билирубина. Это говорит о том, что желчные камни связаны с более умеренным повышением билирубина, чем, скажем, злокачественная обструкция желчных путей.Это исследование также определило сепсис и шок как частые причины желтухи, с провоцирующими факторами, включая послеоперационные осложнения и полиорганную недостаточность — сценарии, с меньшей вероятностью встречающиеся в первичной медико-санитарной помощи. Более согласованным с нашими выводами было то, что злокачественные новообразования (чаще всего рак поджелудочной железы или холангиокарцинома) вызывали значительную долю выраженной желтухи (35% пациентов). Опять же, их открытие 19% пациентов, у которых нет диагноза или неверного, было похоже на наше. Возможно, причина того, что у нас было больше недиагностированных случаев, заключалась в том, что в первичной медико-санитарной помощи не проводилось тщательное кодирование диагнозов.
Значение для клинической практики
Наши результаты должны помочь врачам общей практики с пациентами с желтухой. Наше исследование подчеркивает значительную долю пациентов, у которых причина желтухи не установлена. У некоторых пациентов диагноз и лечение ясны. Существует несколько исследований, связывающих желтуху с сепсисом, который обычно возникает у пациентов в критическом состоянии: единственными пациентами с острой инфекцией в нашей когорте были пациенты с восходящим холангитом.Эти пациенты обычно считаются остро нездоровыми и обычно достаточно больны, чтобы им требовалась срочная стационарная помощь. Такие пациенты были описаны в исследованиях вторичной медико-санитарной помощи при желтухе. То же самое касается людей с декомпенсированным заболеванием печени или нездоровым с запущенной злокачественной опухолью. Остальные, однако, обычно были бы достаточно здоровы, чтобы провести плановое обследование, возможно, следуя предложенному пути направления, предложенному в предыдущем исследовании.2
Высокий процент пациентов с основным злокачественным новообразованием, проявляющимся желтухой, предполагает, что терапевтам следует срочно инициировать причина — с помощью немедленных анализов крови (которые могут выявить печеночные причины, такие как вирусный гепатит или аутоиммунное заболевание печени) и срочного направления на трансабдоминальное ультразвуковое исследование для выявления не только рака, но и многих других диагнозов в нашем исследовании.Мы также рекомендуем одновременное срочное направление в специализированные центры, когда клиническая картина предполагает злокачественную причину, например, необъяснимую потерю веса, сильную усталость или симптомы, указывающие на первичное злокачественное новообразование вне гепатобилиарной зоны. Это потребует расширения текущего руководства NICE7, чтобы включить все новые виды желтухи, независимо от того, является ли она обструктивной или нет.
Выводы
Хотя наиболее частой причиной желтухи у взрослых в возрасте> 45 лет, получающих первичную медико-санитарную помощь, являются доброкачественные камни желчных протоков, рак присутствует более чем у четверти пациентов с желтухой.Это требует исследования с помощью срочных анализов крови и визуализации пациентов с желтухой, поскольку это позволяет выявить не только злокачественные новообразования, но и многие другие причины желтухи. Одновременное срочное направление в специализированные службы также рекомендуется для взрослых в возрасте> 45 лет, которые обращаются с желтухой в первичном звене медико-санитарной помощи, учитывая, что значительная часть пациентов может иметь злокачественные опухоли.
Декларация
Финансирование: AT является академическим доктором F2, работающим в университетских больницах Бристоля и Бристольском университете.
Утверждение этических норм: Независимый научный консультативный комитет по исследованиям базы данных MHRA; ссылка 09_110.
Конфликт интересов: отсутствует.
Приложение 1. Коды симптомов желтухи
| Medcode | Код считывания | Описание | ||||
| 25418 | 1675 | Желтый / желтоватый цвет | ||||
| 45632 | AA00.11 | Спирохетальная желтуха | ||||
| 5996 | 2274.11 | О / Е — желтуха | ||||
| 38877 | R024z00 | [D] Желтуха 6428 | 2 90282 9028 | Уведомление об инфекционной желтухе | ||
| 3121 | J66y600 | Механическая желтуха БДУ | ||||
| 39682 | D100.11 | Ахолурическая 6000 | 0 | 0 | 0 семейная желтуха11 | Желтуха — симптом |
| 355 | R024.00 | [D] Желтуха (не новорожденная) | ||||
| 29488 | 2274 | O / E — желтый цвет R024111 | [D] Желтуха | |||
| 18574 | R024100 | [D] Иктерус NOS | ||||
| 57309 | AA00.00 | Лептоспироз | 12 | Желтый — симптом |
| Medcode | Код считывания | Описание | |||||
| 25418 | 1675 | Желтый / | AAA | Желтый / | желтый00 | Уведомление об инфекционной желтухе | |
| 3121 | J66y600 | Механическая желтуха БДУ | |||||
| 39682 | D100.11 | Ахолурическая | желтуха | ||||
| 355 | R024.00 | [D] Желтуха (не новорожденная) | |||||
| 29488 | 2274 | O / E — цвет желтухи | |||||
| 2612 | R0024|||||||
| 18574 | R024100 | [D] Icterus NOS | |||||
| 57309 | AA00.00 | Лептоспироз icterohaemorrhagica | |||||
| 18019 | 1675.12 | Желтый — симптом |
| Medcode | Желтый код | Желтый код | Цвет | ||||
| 45632 | AA00.11 | Спирохетальная желтуха | |||||
| 5996 | 2274.11 | O / E — с желтухой | |||||
| 38877 | D902 новорожденных | ||||||
| 6419 | 65V3.00 | Уведомление об инфекционной желтухе | |||||
| 3121 | J66y600 | Механическая желтуха БДУ | |||||
| 39682 | D100.11 | Ахолурическая | желтуха | ||||
| 355 | R024.00 | [D] Желтуха (не новорожденная) | |||||
| 29488 | 2274 | O / E — цвет желтухи | |||||
| 2612 | R0024|||||||
| 18574 | R024100 | [D] Icterus NOS | |||||
| 57309 | AA00.00 | Лептоспироз icterohaemorrhagica | |||||
| 18019 | 1675.12 | Желтый — симптом |
| Medcode | Желтый код | Желтый код | Цвет | ||||
| 45632 | AA00.11 | Спирохетальная желтуха | |||||
| 5996 | 2274.11 | O / E — с желтухой | |||||
| 38877 | D902 новорожденных | ||||||
| 6419 | 65V3.00 | Уведомление об инфекционной желтухе | |||||
| 3121 | J66y600 | Механическая желтуха БДУ | |||||
| 39682 | D100.11 | Ахолурическая | желтуха | ||||
| 355 | R024.00 | [D] Желтуха (не новорожденная) | |||||
| 29488 | 2274 | O / E — цвет желтухи | |||||
| 2612 | R0024|||||||
| 18574 | R024100 | [D] Icterus NOS | |||||
| 57309 | AA00.00 | Лептоспироз icterohaemorrhagica | |||||
| 18019 | 1675.12 | Желтый — симптом |
Ссылки
1Азбука болезней печени, поджелудочной железы и желчевыводящей системы: исследование печени и желчевыводящих путей
BMJ
2001
322
33
6
2и другие.
«Горячая линия по желтухам» для быстрого обследования пациентов с желтухой
BMJ
2002
325
213
5
3Причины явной желтухи в Юго-Западном Уэльсе: восприятие против реальности
Кишечник
2001
48
409
13
4и другие.
Как поступают в первичной медико-санитарной помощи с отклонениями от нормы результатов функциональных тестов печени? Аудит доходности и воздействия
BMJ
2001
322
276
8
5и другие.
Результаты для здоровья после тестирования функции печени в первичной медико-санитарной помощи: ретроспективное когортное исследование
Fam Pract
2009
26
251
9
6и другие.
Причины и характеристика 500 последовательных случаев желтухи
Сканд Дж Гастроэнтерол
1981
16
1
6
7Национальный институт здоровья и передовой клинической практики.
Рекомендации при подозрении на рак. 2005 CG27.
8Клинические особенности первичных опухолей головного мозга: исследование случай-контроль с использованием электронных карт первичной медико-санитарной помощи
Br J Gen Pract
2007
57
695
9
© Автор 2012.Опубликовано Oxford University Press. Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected].
билируб
билирубли-11-1 БИЛИРУБИН МЕТАБОЛИЗМ Автор Д-р Э. Орфей
Физиология и патология
1-билирубин производство.
2-Транспортный в кровь.
3-гепатоцеллюлярный поглощение.
4-внутриклеточный транспорт в гепатоцитах.
5-конъюгация с глюкуроновая кислота.
6-секреция в желчные протоки.
7- Кишечный метаболизм.
8- Почечная экскреция билирубина
9- Почечная экскреция о уробилиноген
1-БИЛИРУБИН ПРОИЗВОДСТВО
Билирубин — это конечный продукт метаболизма гема.Гем присутствует в гемоглобине и других окислительные соединения, такие как митохондриальные и микросомальные цитохромы печени (П-450). Таким образом, билирубин плазмы является частично эритропоэтическим и частично неэритропоэтическим. Примерно 85% эритропоэтических и 15% неэритропоэтических.
Эритропоэтический фракция происходит из двух источников: циркулирующих нормальных стареющих эритроцитов и незрелые дефектные эритроциты костного мозга. Ежедневное производство билирубин составляет от 250 до 350 мг.
Шунтирующий билирубин называется той частью, которая не происходит из стареющих циркулирующих эритроцитов но происходит из незрелых и дефектных эритроцитов (7%) и из негемоглобиновых соединения гема, особенно из цитохромов печени и миоглобина. Эти две фракции были обнаружены путем мечения гемоглобина радиоактивным глицином, и наблюдая, что одна фракция (78%) билирубина выводится с калом в 120 дней, а другая фракция выводится за 10 дней или меньше.Первый был назывался поздно помечен билирубином , второй назывался рано меченый билирубин или шунтирующий билирубин . Шунтирование билирубина может быть заметно повышен при определенных патологических состояниях: сидеробластной анемии, мегалобластной анемии. анемия, эритролейкоз, отравление свинцом и врожденное заболевание, называемое «идиопатическим» дизэритропоэтическая желтуха ». Пациенты, страдающие этим заболеванием, нет гемолиза. У них гипербилирубинемия и желтуха.В гипрбилирубинемия обусловлена шунтирующим билирубином .
Билирубин из эритропоэтический гем продуцируют моноцитарные макрофаги, ретикулоэндотелий, в каждом органе, но особенно в селезенке, печени и костном мозге в порядке важность .. Билирубин из неэритропоэтического гема печени вырабатывается в гепатоциты.
Тетрапирролик кольцо гема разорвано оксигеназой на альфа-мостике, связь между двумя атомами углерода напротив гамма-моста, который находится между двумя атомы углерода, несущие две пропионовые кислоты.Тетрапирроловая молекула из кольца превращается в тетрапиррольную цепь без железа.
HEME
+ Heme оксигеназа = OXY-HEME ( замкнутое тетрапиррольное кольцо с железом)OXY-HEME
+ гем редуктаза = БИЛИВЕРДИН ( открытое тетрапиррольное кольцо без железа)БИЛИВЕРДИН
+ биливердинредуктаза = БИЛИРУБИН (неконъюгированный)Патология производства билирубина
Гипрбилирубинимия
при желтухе происходит повышенного разрушения красных кровяных телец , а именно: гемолиз . Встречается при 1) врожденных нарушениях эритроцитов (серповидноклеточные клетки, талассемия, сфероцитоз), 2) иммунный гемолиз (эритробластоз плода, 3) приобретенный заболевания эритроцитов (дизеритропоэз) и др.У взрослого, даже заметный гемолиз не вызывает значительного повышения уровня билирубина в сыворотке если клиренс печеночного билирубина в норме. Однако у новорожденного выраженный гемолиз будет катастрофическим.На уровне 20 мг / дл сыворотки билирубина у младенца будет глубокая желтуха, и у него разовьется ядерная желтуха (ядерная желтуха: тяжелая форма желтого окрашивания и дегенерация внутричерепного серого вещества, особенно чечевицеобразного ядра, рога аммония и субталамической области).
Фототерапия используется для лечения гипербилирубинемии у новорожденных.
Билирубин — фоторецептор . Синий свет превращает билирубин в бесцветные продукты окисления, которые выводятся с мочой.
синтетический порфирины, содержащие олово или цинк вместо железа, вызывают снижение образование билирубина за счет конкуренции за гемоксигеназную активность макрофагов. Эти соединения использовались для лечения гипербилирубинемии у животных. и люди (например, синдром Гилбертса) с ограниченным успехом.
2-БИЛИРУБИН ТРАНСПОРТ В КРОВИ
Билирубин токсичен к тканям, поэтому он транспортируется в крови в связке с альбумином.Только в крови присутствует незначительное количество свободной формы.
Патология транспорта билирубина в крови.
Если бесплатно фракция увеличивается, билирубин проникает в ткани и повреждает их. Это пересечет гематоэнцефалический барьер и вызывают ядерную желтушку у новорожденных. Бесплатно билирубин плазмы может повышаться при следующих патологических состояниях:
-1- перепроизводство.
-2- нарушение конъюгации в гепатоците.
-3- наличие вещества, препятствующие связыванию билирубина с альбумином: сульфаниламиды, длинноцепочечные жирные кислоты из грудного молока, салицилаты, контрастные вещества и т. д. Эти агенты конкурируют за сайты связывания альбумина.
3-ГЕПАТОКЛЕТОЧНЫЙ ПОНИЖЕНИЕ БИЛИРУБИНА.
Билирубин принимается вверх гепатоцитами на их синусоидальной поверхности. Связь альбумин-билирубин нарушена. Альбумин остается в плазме.Свободная молекула билирубина входит Это происходит очень быстро.
Патология поглощения билирубина гепатоцитами.
Обесценение поглощение приведет к неконъюгированной гипербилирубинемии.
. Прохождение:
.1) Мужской папоротниковая масляная желтуха. Это масло использовалось для лечения ленточного червя. (Аспидиум).
3) Jegzichte овец.
4-ВНУТРИКЛЕТОЧНЫЙ ТРАНСПОРТИРОВКА БИЛИРУБИНА В ГЕПАТОЦИТАХ.
В гепатоце билирубин связан с цитоплазматическими белками : лигандинами и Z белок. Лигандины представляют собой группу ферментов, которые составляют 2% цитозольного белки. Z-белки связывают жирные кислоты. Основная функция этих белков: то, чтобы избежать заброса свободного билирубина в кровь.Судя по всему, Промежуток времени между поглощением билирубина и коюгацией относительно велик.
Патология внутриклеточного транспорта.
Нет Известно, что гипербилирубинемия и желтуха связаны с дефицитом лигандинов.
5-СОПРЯЖЕНИЕ С ГЛЮКУРОНОВОЙ КИСЛОТОЙ
Один способ нейтрализации нежелательных соединений клетками — конъюгирование их с модифицированный сахар, гликозил.Сахара, используемые для этой реакции, представляют собой ксилозу, глюкоза или глюкуроновая кислота. Глюкоза обычно присутствует в клеточном соке, ксилозе. и глюкуроновая кислота образуются из глюкозы UDP-глюкозодегидрогеназой . Ксилозидация преобладает у растений, глюкозидация у бактерий и глюкуронирование у млекопитающих. Неконъюгированный билирубинин является липофильным. Его конъюгация с глюкуроновой кислотой делает его гидрофильным, поэтому его можно выводится с желчью.Многие другие агенты удаляются конъюгацией с глюкуроновая кислота: стероиды, гормон щитовидной железы, катехоламины, эстрадиол, тестостерон, желчные кислоты, фенолы, морфин, которые могут быть связаны с другими клетки помимо гепатоцитов.Глюкуронизация желчи проходит в два этапа: первая глюкуроновая добавка (GA) — это синтезируется из цитозольной глюкозы, которая образует комплекс с уридиндифосфатом (UDP) ad образует удпглюкуроновую кислоту (UDPGA ).Из этого соединения глюкуроновая кислота кислота переходит в блирубин. Первая реакция катализируется UP- глюкоза дегидрогенат , вторая реакция катализируется билирубином- ДУГАН- трансфер , который синтезируется микросомами. Любой дефицит эти два фермента приведут к нарушению конъюгации и устранению билирубин. С другой стороны, введение индукторов микросомальных ферментов, таких как фенобарбитал, глютетимид и антипирин способствуют конъюгации билирубина и устранение за счет повышения активности трансферазы блирубина.Конъюгация происходит в эндоплазматической сети и состоит из образования сложного эфира между глюкуроновой кислота и одна или обе пропионовые боковые цепи билирубина. Результат будет образование моно- и диглюкуронидов билирубина . В целом около 80% образуются ди и менее 20% моно. Котины желчи человека также малы количества неконъюгированного билирубина. Итого:
ГЛЮКОЗА + UDP-глюкозодегидрогеназа = UDP — ГЛЮКУРОННАЯ КИСЛОТА (UDPGA)
UDPGA + БИЛИРУБИН + Глюкуронилтрансфераза = БИЛИРУБИН MONO &
DI- ГЛЮКУРОНИДЫ.
Патология конъюгации билирубина
ГИЛЬБЕРТСИНДРОМ
Из-за очень легкий дефицит глюкуронилтрансферазы — очень частое заболевание. Это затрагивает от 5 до 7% населения в целом. Чаще встречается у мужчин. Это состоит из легкая флуктуирующая желтуха из-за негемолитической неконъюгированной гипербилирубинемии в диапазоне от 5 до 7 мг / дл или редко выше. Печень морфологически обычный.Самочувствие и продолжительность жизни в норме. Гемолиз, низкокалорийная диета, никотиновая кислота усиливает желтуху. Липидная диета снизит желтуха. Фенобарбитал и другие агенты, индуцирующие ферменты, являются полезными. Некоторые люди с этим синдромом у дефекта билирубина
КРИГЛЕР-НАДЖАР СИНДРОМ, ТИП I
Из-за тяжелого дефицит глюкуронилтранферазы. При родах развивается глубокая желтуха. неконъюгированная гипербилирубинемия сыворотки крови> 20 мг / дл., не отвечая на фенобарбитал. Отсутствие образования диглюкуронидов. Смерть обычно в первую год или два с ядерной желтушкой. Фототерапия, плазмоферезис и альбуминовый обмен полезны. Трансплантация печени может спасти жизнь. Печень гистологически нормальный. Подобное состояние существует у крысы Ганна. К счастью, этот синдром редко. Описано всего 100 и более случаев. По-видимому, это наследственный аутосомно-рецессивный признак.
КРИГЛЕР- НАДЖАРСКИЙ СИНДРОМ II ТИПА
Из-за умеренный дефицит глюкуронилтрансферазы.Более мягкий неконъюгированный гипербилирубинемия в ответ на препараты, индуцирующие ферменты: фенобарбитал, глтетимид, феназон, хлорпромазин. И моно, и диглюкурониды являются сформирован. Пациенты развиваются нормально, но у некоторых может наблюдаться билирубиновая энцефалопатия. ядерная желтуха. У них на всю жизнь будет неослабевающая желтуха. Это семейное расстройство. Способ генетической передачи не ясен. может иметь ассоциированный дефект захвата билирубина гепатоцитами.
ПИСИЛОЛОГИЧЕСКИЙ ЖЕЛТЫЙ НОВОРОЖДЕННЫЙ.
Это связано с очень преходящая недостаточность глюкуронилтрансферазы. В течение первых нескольких дней жизни наблюдается перепроизводство билирубина и недоразвитость механизм печени избавляться от билирубина.
Вместе с недостаточная конъюгация, выработка билирубина, транспорт крови, печеночный захват и секреция все недостаточна. Иногда существуют внепеченочные факторы, которые усугубляют ситуация: инфекции, препараты, конкурирующие за сайты связывания билирубина и прежде всего грудное вскармливание.Длинные цепочки жирных кислот грудного молока мешают сайтам связывания билирубина и альбумина.
6- СЕКРЕЦИЯ ЖЕЛЧИ ОТ ГЕПАТОЦИТОВ
Печень — это эндокринная и внешнесекреторная железа. Он выделяет синтезированные продукты внутри в кровь через синусоидальную поверхность, такую как белки крови, коагуляция факторы и т. д. и выделяет наружу в желчевыводящие пути и кишечник желчь и многие другие вещества, конечные продукты детоксикации.Механизм этой внешней секреции наименее ясен в физиологии печень. Похоже, что в этом процессе задействованы многие клеточные органеллы: везикулы, комплексы Гольджи, лизосомы, плазматические мембраны, митохондрии, цитоскелет, плазматические мембраны, канальцевые ворсинки. Однако ясны последствия неисправности этого аппарата особенно в секреции желчи, что приведет к конъюгированной гипербилирубинемии.
Патология желчи
ДУБЕН-ДЖОНСОН СИНДРОМ.
Синдром состоит из хронических доброкачественных желтуха из-за конъюгированной гипербилирубинемии без зуда
или повышение уровня щелочной фосфатазы в сыворотке крови и отсутствие гистологических признаков холестаза. Гепатоциты содержат большое количество грубых темно-коричневый пигмент, похожий на меланин. В печень черная, но в норме. Билирубин в сыворотке крови колеблется от 2 до 20 мг / дл, 60% конъюгировано. Желтуха появляется в первые 3 десятилетия жизни и прерывистый.Иногда начало острое, имитирующее гепатит. Прогноз отлично. Заболевание передается по аутосомному рецессивный признак. Диагноз ставится игольчатая биопсия. Овцы породы Корридейл страдают аналогичным заболеванием черной печени.Нажмите на картинках для увеличения
| Рис. 11-1-1
Синдром Дубина-Джонсона. печень буро-черная из-за большого количества буровато-крупной пигмент хранится в гепатоцитах.Обычно внутрипеченочного холестаз в этом состоянии. Пигмент преобладает в центролобулярная зона. |
Рис. 11-1-2 Синдром Дубина-Джонсона. Там у пожилых пациентов может быть умеренный портальный фиброз. Пигмент сохраняется в лизосомах, таких как липофусцин. Каналы желчи не содержат желчи. В соответствии Согласно исследованиям, проведенным на овцах Корридейл, пигмент содержит меланин-подобный компонент, и его образование связано с нарушение выведения метаболитов адреналина. |
РОТОР СИНДРОМ.
Это условие похож на Дубина-Джонсона. Возникает перемежающаяся желтуха с сопряженными гипербилирубинемия, аналогичное клиническое течение, отличный прогноз, но нет пигмент в ткани печени.
ДОБРО ПОЖАЛОВАТЬ РЕАКТИВНЫЙ ИНТРАГЕПАТИЧЕСКИЙ ХОЛЕСТАЗ.
Синдром характеризуется повторяющимися приступами довольно тяжелой желтухи.Атаки начинаются обычно до полового созревания, но они могут начаться позже. Им предшествуют 2-4 недели. зуда, недомогания, анорексии с последующим
увеличение желтуха без боли и лихорадки, продолжающаяся в среднем 2-3 месяца в течение каждого атака. Это может длиться от двух недель до двух лет.
Тошнота, рвота, В некоторых случаях возникают боли в животе и кожная сыпь. Пострадавший может иметь до 30 приступов в течение жизни. Биохимически у этих пациентов повышен билирубин в сыворотке от 10 до 20 мг / дл, в основном конъюгированный, повышенный щелочной фосфатаза и желчные кислоты.Альпа-глутамилтрансфераза (GGT) повышена. Сыворотка желчные кислоты повышены в 2-30 раз. Трансаминазы иногда заметно повышаются. Эти аномалии и клинические симптомы полностью исчезают в безболезненные интервалы. В холестатической фазе имеется ацинарная зона 3. холестаз с желчными пробками и инфильтрацией мононуклеарных клеток в холестатическом область. В некоторых случаях может наблюдаться легкое поражение гепатоцитов и портальные мононуклеары. проникнуть. Эти изменения не вызывают фиброза или цирроза печени.Печень биопсии, взятые в определенные промежутки времени, были нормальными. Заболевание встречается довольно редко. и, по-видимому, имеет семейный аутосомно-рецессивный характер.
СЕМЕЙНЫЙ РЕАКЦИОННЫЙ ВНУТРИГЕПАТИЧЕСКИЙ ХОЛЕСТАЗ БЕРЕМЕННОСТИ.
Это нарушение клинически и биохимически сходен с доброкачественным внутрипеченочным холестазом. Это возникает в третьем триместре беременности, когда уровень эстрогена самый высокий и исчезает в послеродовом периоде.Пострадавшие субъекты принадлежат к семьям. с доброкачественным признаком внутрипеченочного холестаза. Гонадный стероид, по-видимому, оказывает определяющее роль в причине этого синдрома. Гистология печени показывает центролобулярный холестаз похож на доброкачественный внутрипеченочный холестаз. Это самое часто встречается в Скандинавии (1/100), Боливии и Чили (1/10). Заболевание безопасно для матери, но не для плода, который перенесет преждевременные роды и мертворождения из-за инфарктов плаценты.У матерей чаще встречается камни в желчном пузыре. Иногда нарушение проявляется только при наличии кожный зуд без желтухи. (Pruritus gravidarum) . Пациенты не тяжело болеет ожирением печени при беременности, гепатитом, механической желтухой.
ЛЕКАРСТВО- ИНДУЦИРОВАННЫЙ ИНТРАГЕПАТИЧЕСКИЙ ХОЛЕСТАЗ.
Многие лекарства производят холестаз. Первые зарегистрированные случаи были связаны с хлопромазином и синтетическими препаратами. стероиды сейчас не продаются (Nilavar).Синтетические оральные контрацептивы с высоким содержанием список. Оказалось, что они действуют на основе чувствительности и воздействуют только на чувствительные частные лица. Многие из них нарушают секреторную функцию гепатоцитов. А также список увеличивается с появлением новых лекарств. Печень в этих случаях может показать
отмечен и фатален некроз.
ПОСЛЕОПЕРАЦИОННЫЙ ИНТРАГЕПАТИЧЕСКИЙ ХОЛЕСТАЗ
Приписывается на комбинированный эффект перегрузки билирубином, вызванной переливаниями крови и нарушению секреторной функции гепатоцитов.Обычно желтуха появляется в 1-2 дня после операции и исчезает через одну-две недели, гипербилирубинемия преимущественно конъюгирован с нормальным щелочным
фосфатаза и трансаминазы.
БАКТЕРИАЛЬНЫЙ ИНФЕКЦИИ
Это форма внутрипеченочный холестаз. Гипербилирубинемия сопряжена во всех случаях. В некоторых случаях повышение уровня щелочной фосфатазы в сыворотке. Гистология печени без сильное гепатоцеллюлярное повреждение.
Три типа морфологических изменений описано:
1- канальцевый холестаз , наиболее частый, в основном перицентральный, без гепатоцеллюлярный повреждать.
2-канальный холестаз, характеризующийся наличием в желчи больших желчных тромбов протоки и каналы Геринга на периферии портальных полей. Нет желчных пробок в междольковых желчных протоках.
Синдром 3-токсического шока из-за заражения золотистым стафилококком, вызывающим токсичные Токсин-1 шокового синдрома (ЦСТ-1).Этот токсин был произведен этим организмом растет в полиакрилатных тампонах у менструирующих женщин. Страдает печень воспаление внутрипеченочных желчных протоков и канальцев.
с разрывом желчные протоки и микровезикулярный стеатоз. Воспалительная реакция поля портала с
нейтрофилов, эозинофилы, лимфоциты и моноциты. В 50% случаев центролобулярный холестаз. случаев.
7- КИШЕЧНЫЙ ОБМЕН БИЛИРУБИНА
Билирубин в кишечник восстанавливается до уробилинов по следующему каскаду:
БИЛИРУБИН ГЛЮКУРОНИД
+ бактериальный или кишечная бета-глюкуронидаза = СВОБОДНЫЙ БИЛИРУБИНБИЛИРУБИН СВОБОДНЫЙ + бактериальная дегидрогеназа = УРОБИЛИНОГЕН (бесцветный)
УРОБИЛИНОГЕН + дегидрогеназа = УРОБИЛИН (оранжево-желтый).
Основная часть билирубин, уробилиноген и уробилин выводится с калом. Небольшие количества билирубин и уробилиноген реабсорбируются кишечником и возвращаются в печень. Билирубин повторно выводится в печени и снова выводится с калом. Реабсорбированный уробилиноген выводится с мочой, примерно 4 мг / день и 0,1 мг / сут. 1 мг в произвольной выборке мочи.
Патология желчевыводящих путей в кишечник
ЗАВЕРШИТЬ БИЛИАРНАЯ ОБСТРУКЦИЯ.
Желчь не достигают кишечника, поэтому кал ахолический. Имеется конъюгированных гипербилирубинемия и билирубинурия. Уробилиноген не образуется в кишечник и в моче нет уробилиногена. потому что желчь делает не попадают в кишечник, уролиноген не образуется.
ЧАСТИЧНЫЙ БИЛИАРНАЯ ОБСТРУКЦИЯ.
Меньше достигает желчи кишечник. Уробилиноген образуется, но в меньших количествах.Меньше конъюгированная гипербилирубинемия, отсутствие билирубинурии и небольшое количество уробилиноген в моче.
ГЕМОЛИЗ.
Гемолиз вызывает неконъюгированных гипербилирубинемия. Нет билирубинурии из-за неконъюгированного билирубина не является гидрофильным и не выводится с мочой. В моче повышен уровень уробилиногена, потому что больше билрубина достигает кишечника и больше уробилиноген образует реабсорбированный.
8- ПОЧЕЧНАЯ ЭКСКРЕЦИЯ БИЛИРУБИНА
Только конъюгированный билирубин (прямая фракция) выводится с мочой при его уровень в плазме повышен выше нормы. Его нет в моче нормальных субъектов и не выводится с мочой в случаях неконъюгированная (непрямая фракция) гипербилирубинемия, например, в случаях гемолиз.
Тольконебольшая часть небелкового билирубина в плазме переходит в моча.Некоторые препараты и соли желчных кислот, которые конкурируют за связывание с белками (салицилаты, софосоксазол) увеличивают Срок выведения зависит от степени связывание белков, которое варьируется, и его количество в моче не имеет клинических проявлений актуальность.
Конъюгированные билирубин может быть обнаружен в проксимальных почечных канальцах.
9-ПОЧЕЧНАЯ ВЫДЕЛЕНИЕ УРОБИЛИНОГЕНА
Уробилиноген образуется бактериями в тонком кишечнике и в двоеточие.
Это затем реабсорбируется тонкой и толстой кишкой и повторно выделяется печень почти полностью попадает в кишечник. Поэтому очень небольшая сумма выводится с мочой: 0-4 мг / сут. Эта сумма увеличится, когда будет больше уробилиноген образуется или когда печень больна и не может его повторно выводить. Это количество будет уменьшаться, когда его образование в кишечнике уменьшится, например, как в случае полной непроходимости желчных протоков, когда желчь не может поступать в кишечник, где уробилиноген вырабатывается определенными бактериями.В уробилиноген, образованный бактериями в тонком кишечнике, повторно всасывается лучше, чем образуется в толстой кишке.
СОДЕРЖАНИЕ / К ДВОЙНОЙ СИСТЕМЕ
Оценка аномальных функциональных тестов печени
Обычно доступные тесты включают аланинтрансаминазу (ALT) и аспартаттрансаминазу (AST), щелочную фосфатазу (ALP), гаммаглутамилтрансферазу, билирубин сыворотки, протромбиновое время или международное нормализованное соотношение и сывороточный альбумин (вставка 1 ).Они отражают различные функции печени, а именно: выведение анионов (билирубин), целостность гепатоцеллюлярной системы (трансаминазы), образование и последующий свободный отток желчи (билирубин и ЩФ) и синтез белка (альбумин).
Вставка 1:
Нормальные значенияАланинтрансаминаза: 0–45 МЕ / л.
Аспартаттрансаминаза: 0–35 МЕ / л.
Щелочная фосфатаза: 30–120 МЕ / л.
Гаммаглутамилтрансфераза: 0–30 МЕ / л.
Билирубин: 2–17 мкмоль / л.
Протромбиновое время: 10,9–12,5 сек.
Альбумин: 40–60 г / л.
Другие тесты часто выполняются специалистом и включают серологию на гепатит, исследования железа и меди, определение уровня α 1 -антитрипсина и аутоантител.Они связаны с возможной этиологией аномалии.
Тестируемые ферменты чаще всего вырабатываются при заболеваниях печени, но некоторые ферменты также присутствуют в других тканях и, следовательно, могут быть повышены в других условиях.
При столкновении с патологией у бессимптомного пациента обязательно установить наличие патологии, в первую очередь, статистически значимой (нормальное значение — это среднее значение в группе здоровых людей ± 2SD). Испытания следует повторить и после подтверждения предпринять соответствующие шаги.
КЛИНИЧЕСКАЯ ОЦЕНКА
Необходимо собрать подробный анамнез и провести полное физическое обследование с особым акцентом на потребление алкоголя, факторы риска вирусного гепатита (внутривенное употребление наркотиков, сексуальная распущенность, гомосексуальные отношения, татуировки, нестерильный пирсинг уха или тела, кровь или продукты крови. переливания), лекарства, которые использовались в настоящее время или ранее, травяные или альтернативные средства правовой защиты, а также профессиональное воздействие токсинов (вставка 2).
Вставка 2:
Клиническая оценкаУпотребление алкоголя.
Факторы риска вирусного гепатита:
Внутривенное употребление наркотиков.
Сексуальная распущенность.
Гомосексуальные отношения.
Татуировки.
Нестерильный пирсинг уха или тела.
Переливания крови или продуктов крови.
Проживание в развивающихся странах.
Лекарства.
Воздействие токсинов на рабочем месте.
Другие факторы, такие как диабет, ожирение и гиперлипидемия при неалкогольной жировой болезни печени, и семейный анамнез (болезнь Вильсона, гемохроматоз, аутоиммунное заболевание) могут иметь значение.
БИЛИРУБИН
Билирубин образуется в результате лизиса эритроцитов (компонента гема) в ретикулоэндотелиальной системе. Неконъюгированный билирубин транспортируется в печень, слабо связанный с альбумином. Он нерастворим в воде и, следовательно, не выводится с мочой. Конъюгированный билирубин растворим в воде и появляется в моче.
В печени он конъюгирован с глюкуронидом билирубина и впоследствии секретируется в желчь и кишечник соответственно.Кишечная флора расщепляет его на уробилиноген, часть которого реабсорбируется и выводится через почки с мочой или выводится печенью в желудочно-кишечный тракт. Остальная часть выделяется с калом в виде стеркобилиногена, придающего стулу коричневый цвет.
Сывороточный билирубин обычно находится в неконъюгированной форме, что отражает баланс между производством и экскрецией гепатобилиарной системы. Продукция билирубина увеличивается при гемолизе, неэффективном эритропоэзе, рассасывании гематомы и редко при травмах мышц.Во всех этих случаях билирубин находится в основном в неконъюгированной форме. Конъюгированная гипербилирубинемия характерна для паренхиматозных заболеваний печени и непроходимости желчевыводящих путей.
НЕСОПРЯЖЕННАЯ ГИПЕРБИЛИРУБИНЕМИЯ
Неконъюгированная гипербилирубинемия (фракция непрямого билирубина> 85% от общего билирубина) возникает при повышенном производстве билирубина или при дефектах печеночного поглощения или конъюгации, которые, в свою очередь, могут передаваться по наследству или приобретаться (вставка 3).
Вставка 3:
Причины изолированной гипербилирубинемииНесопряженный
Повышенное производство билирубина.
Пониженное печеночное поглощение.
Снижение спряжения.
Конъюгированные
Синдром Дубина-Джонсона.
Синдром Ротора.
Синдром Гилберта заслуживает особого упоминания. Это распространенное доброкачественное заболевание, характеризующееся неконъюгированной гипербилирубинемией, которая усугубляется голоданием. Это не требует какого-либо специального лечения, и пациента следует успокоить.
Непропорциональная изолированная неконъюгированная гипербилирубинемия также может наблюдаться при молниеносной болезни Вильсона. Интересно, что ALP в таких ситуациях невысокая.Считается, что гемолиз является результатом высвобождения меди в кровоток, что приводит к лизису эритроцитов.
Здесь стоит упомянуть, что уровни билирубина более 85 мкмоль / л при нормальной функции печени не могут быть объяснены одним лишь хроническим гемолизом. 1, 2
СОЕДИНЕННАЯ ГИПЕРБИЛИРУБИНАЕМИЯ (ПРЯМОЙ БИЛИРУБИН> 50% ОБЩЕГО БИЛИРУБИНА)
Это происходит при наследственных или приобретенных дефектах печеночной экскреции.Уровни билирубина имеют прогностическое значение при алкогольном гепатите, первичном билиарном циррозе и острой печеночной недостаточности. Однако непропорциональное повышение конъюгированного билирубина имеет ограниченную диагностическую ценность. Поскольку конъюгированный билирубин выводится с мочой, уровень билирубина редко превышает 510 мкмоль / л при отсутствии почечной недостаточности или гемолиза. 3
АМИНОТРАНСФЕРАЗЫ
К ним относятся АСТ и АЛТ. Они являются отличным маркером гепатоцеллюлярного повреждения.Они участвуют в глюконеогенезе, катализируя перенос аминогрупп от аспарагиновой кислоты или аланина к кетоглутаровой кислоте с образованием щавелевоуксусной кислоты и пировиноградной кислоты соответственно.
AST присутствует в цитозольных и митохондриальных изоферментах и обнаруживается в печени, скелетных мышцах сердечной мышцы, почках, головном мозге, поджелудочной железе, легких, лейкоцитах и эритроцитах. 4 Менее чувствителен и специфичен для печени.
ALT, цитозольный фермент, обнаруживается в самых высоких концентрациях в печени и более специфичен для печени. 4
Гепатоцеллюлярное повреждение и не обязательно гибель клеток является спусковым механизмом для высвобождения этих ферментов в кровоток.
Столкнувшись с отклонением от нормы, первым делом следует оценить степень отклонения. Если отклонение от нормы незначительное, анализы, вероятно, следует повторить. Если повторные тесты подтверждают отклонение от нормы, необходимы дальнейшие исследования. Очень высокие уровни должны незамедлительно вызвать дальнейшую оценку.
Распространенными причинами являются неалкогольная жировая болезнь печени, алкогольная болезнь печени, хронические гепатиты B и C, аутоиммунные заболевания печени, гемохроматоз, болезнь Вильсона, α 1 — дефицит антитрипсина и целиакия.
ПРИЧИНЫ ПОВЫШЕННЫХ АМИНОТРАНСФЕРАЗ
Спирт
Надежная история полезна; на самом деле это может быть сложно. Биохимическим признаком является соотношение АСТ к АЛТ (как минимум 2: 1), отражающее низкий уровень активности АЛТ у людей с алкогольной болезнью печени.
Уровень гаммаглутамилтрансферазы, вдвое превышающий норму, при соотношении АСТ / АЛТ 2: 1 или более с большой вероятностью указывает на злоупотребление алкоголем. 5 Гаммаглутамилтрансфераза неспецифична для алкоголя и, следовательно, не может использоваться в качестве изолированного теста. 4
Примечательно, что уровни АСТ, превышающие норму более чем в восемь раз, и уровни АЛТ более чем в пять раз встречаются при алкогольной болезни печени исключительно редко. 5 И наоборот, уровень АЛТ может быть нормальным даже при тяжелой алкогольной болезни печени. Обычно уровни аминотрансферазы составляют менее 300 Ед / л при поражении печени, вызванном алкоголем, если, конечно, другие инсульты, такие как вирусное поражение печени или поражение печени, вызванное парацетамолом, не накладываются на алкогольное заболевание печени, когда уровни аминотрансферазы в сыворотке могут превышать 1000 ед / л.Очень высокие уровни аминотрансфераз характерны для ишемического поражения печени, острого вирусного гепатита и повреждения печени, вызванного лекарствами или токсинами, а иногда и при остром обструктивном холедохолитиазе.
Лекарства
Некоторые лекарства могут вызывать повышение ферментов печени, обычно это нестероидные противовоспалительные препараты, антибиотики, статины, противоэпилептические и противотуберкулезные препараты (вставка 4). Следует сделать специальный запрос о лечебных травах, альтернативных лекарствах и злоупотреблении психоактивными веществами.Наиболее частой причиной резкого повышения уровня аминотрансферазы, вызванной приемом лекарств, является передозировка парацетамола, обычно в дозах 10 г или более, но также и в более низких дозах, особенно в контексте других оскорблений, таких как алкоголь.
Вставка 4:
Распространенные причины повышения уровня трансаминазАлкоголь.
Лекарства: нестероидные противовоспалительные препараты, антибиотики, ингибиторы HMG Co-A-редуктазы, противоэпилептические препараты, противотуберкулезные препараты, лекарственные травы, незаконное употребление наркотиков.
Неалкогольный стеатогепатоз.
Хронический гепатит B и C.
Аутоиммунные болезни.
Гемохроматоз.
Болезнь Вильсона.
Застойная сердечная недостаточность и ишемический гепатит.
α 1 -Дефицит антитрипсина.
Целиакия.
Эндокринная болезнь: гипотиреоз, болезнь Аддисона.
Болезни поперечно-полосатой мышцы.
Болезни накопления гликогена.
Повышение уровня ферментов печени, вызванное лекарственными средствами, может проявляться в виде повышения уровня ферментов вскоре после начала приема препарата.Логичный шаг — прекратить прием препарата и посмотреть, нормализуются ли результаты. Если препарат необходим пациенту, потребуется оценка риска и пользы. Биопсия печени может потребоваться для оценки тяжести травмы или подтверждения реакции, вызванной лекарством.
Вирусный гепатит
Гепатит B и / или C являются частыми причинами, поэтому необходимо запросить серологическое исследование гепатита. Рассмотрим по очереди особенности диагностической лаборатории.
Если поверхностный антиген гепатита B (HbsAg) положительный, то результаты на антитела к HBeAg и HBe обычно доступны автоматически.Положительный HbsAg может указывать на острую или хроническую инфекцию. HbsAg становится положительным за 2–8 недель до биохимических признаков желтухи или повреждения печени. Как только появится HbsAg, появятся и другие маркеры вирусной репликации, а именно ДНК вируса гепатита B и HbeAg. IgM anti-HBc, лучший серологический тест на острый гепатит B, выявляется в течение 2–4 недель после появления поверхностного антигена. Если результат положительный, это указывает на острую инфекцию гепатита B и HbsAg и анти-HBs должны быть получены через шесть месяцев.
Инфекция могла исчезнуть (HbsAg-отрицательный, анти-HBs-положительный) или перейти в хроническую форму (HbsAg-положительный, анти-HBs-отрицательный). Если IgM anti-HBc отрицательный, что указывает на хроническую инфекцию вируса гепатита B, HbeAg и anti-HBe помогут определить, активно ли реплицируется инфекция в носителе или находится в состоянии покоя. 6 Пациенты с положительным HBe Ag и ДНК вируса гепатита B могут быть рассмотрены для биопсии печени. 4 Члены семей и близкие контакты лиц с положительным результатом HbsAg должны быть проверены на заражение гепатитом B путем проверки HbsAg и анти-HBc.Если анти-HBc отрицательный, члены семьи / близкие могут быть кандидатами на иммунопрофилактику, если не были ранее вакцинированы. 6
Положительные антитела к гепатиту С у пациента с факторами риска отражают предыдущий контакт с вирусом. Антитела к вирусу гепатита С не обладают защитным действием. Наличие антигепатита С у пациента с аномальным уровнем АЛТ и факторов риска заражения гепатитом С убедительно указывает на текущую инфекцию гепатита С. Первоначальный тест на антигепатит С — это иммуноферментный анализ (ИФА).Тест очень чувствителен, но ложноположительные тесты нередки даже при ИФА третьего поколения, как это наблюдается при гипергаммаглобулинемии аутоиммунного гепатита. Если антигепатит C отрицательный, маловероятно, что у пациента гепатит C. Специфичность теста ELISA может быть улучшена путем добавления рекомбинантного иммуноблоттинга на антигепатит C. 3 Нет доступных методов культивирования вируса. Следовательно, обнаружение вируса в сыворотке используется в качестве маркера самого вируса.РНК гепатита С, обнаруженная с помощью полимеразной цепной реакции, в настоящее время является золотым стандартом. 7 Положительный тест свидетельствует об активной вирусной инфекции и репликации. Полимеразная цепная реакция может быть проведена количественными или качественными методами. Чувствительность количественного тестирования колеблется в пределах 2000–200 000 вирусных копий / мл, тогда как качественные тесты обнаруживают всего 100 вирусных копий / мл обычно в течение одной недели после воздействия. 3 Поэтому не следует использовать количественные тесты для диагностики, так как они могут пропустить пациентов с низким уровнем виремии.Специалист должен уделить должное внимание противовирусной терапии. Если полимеразная цепная реакция отрицательная, несмотря на положительный тест на антитела, ее следует повторить через три месяца, чтобы убедиться, что она не была ложноотрицательной.
АУТОИММУННЫЙ ГЕПАТИТ
Аутоиммунный гепатит — это неизлечимое воспаление печени неизвестной причины, связанное с интерфейсным гепатитом при гистологическом исследовании, гипергаммаглобулинемией и аутоантителами.Типичный клинический случай — это случай у женщины молодого и среднего возраста (соотношение женщин и мужчин 4: 1) с повышенными трансаминазами при отсутствии какой-либо другой очевидной причины. При электрофорезе белков сыворотки крови около 80% или более пациентов демонстрируют гипергаммаглобулинемию. 8 Поликлональные иммуноглобулины, превышающие норму более чем в два раза, весьма наводят на размышления. 4
Соответствующие тесты будут включать иммуноглобулины, антинуклеарные антитела, антитела к гладкой мускулатуре, микросомальные антитела против печени и почек и антитела к растворимому антигену печени, которые типичны для аутоиммунных заболеваний печени 1, 2 и 3 типов.Регулярное использование всех трех тестов не требуется. Биопсия печени полезна.
Аутоиммунный гепатит 1 типа характеризуется наличием антинуклеарных антител и / или антител к гладкой мускулатуре (актину). Это самая распространенная форма болезни во всем мире. Семьдесят процентов составляют женщины моложе 40 лет и более 30% страдают сопутствующими иммунными заболеваниями, особенно аутоиммунным тиреоидитом, синовитом или язвенным колитом.
Аутоиммунный гепатит 2 типа характеризуется наличием анти-LKM1 и преимущественно поражает детей в возрасте 2–14 лет.Пациенты с этой формой гепатита обычно имеют другие сопутствующие аутоиммунные заболевания, такие как диабет 1 типа, витилиго и аутоиммунный тиреоидит. Могут быть обнаружены и другие органоспецифические аутоиммунные антитела, такие как антитела к париетальным клеткам, островкам Лангерганса и щитовидной железе. У этих пациентов может быть низкий уровень иммуноглобулина А. В сыворотке крови аутоиммунный гепатит 1 и 2 обычно хорошо реагирует на стероиды.
Аутоиммунный гепатит 3 типа является наименее установленной формой заболевания и характеризуется наличием антител к растворимому антигену печени / поджелудочной железе.Пациенты с этими антителами неотличимы от пациентов с классическим аутоиммунным гепатитом 1 типа по возрасту, гендерному распределению, частоте и природе других аутоантител и чувствительности к стероидам.
ГЕПАТИЧЕСКИЙ СТЕАТОЗ И НЕАЛКОГОЛЬНЫЙ СТЕАТОГЕПАТИТ
Неалкогольный стеатогепатит (НАСГ) в последние годы возник как хроническое заболевание печени, имеющее клиническое значение. На самом деле НАСГ представляет собой стадию в спектре гистологического заболевания, известного как неалкогольная жировая болезнь печени.Диагноз НАСГ обычно подозревают у лиц с бессимптомным повышением биохимических показателей печени в сыворотке крови; наличие повышенного индекса массы тела, сахарного диабета 2 типа или гиперлипидемии; и никаких доказательств клинически значимого употребления алкоголя. Незначительное повышение уровня трансаминаз (менее чем в четыре раза выше нормы) может быть единственным клиническим признаком, и на самом деле будет справедливо сказать, что неалкогольная жировая болезнь печени, вероятно, является наиболее частой причиной умеренного повышения аминотрансферазы. 9, 10 Отношение AST к ALT обычно меньше 1: 1. 10, 11 Общий билирубин и альбумин обычно в норме. Лейкопения и тромбоцитопения должны вызывать опасения по поводу наличия цирроза и скрытой портальной гипертензии. Ультрасонография, которая должна быть частью оценки хронически повышенных трансаминаз, может показать жировую инфильтрацию. НАСГ может быть подтвержден биопсией печени 4 , если это необходимо в клиническом контексте.
Стеатоз имеет тенденцию протекать доброкачественно, тогда как НАСГ может прогрессировать до цирроза, 12 , хотя печеночная недостаточность встречается редко.Запрограммированная потеря веса и устранение основных факторов составляют основу лечения. 13
ГЕМОХРОМАТОЗ
Это распространенное аутосомно-рецессивное заболевание среди белых людей, связанное с повышенным кишечным всасыванием железа и отложением чрезмерного количества железа в печени, поджелудочной железе и других органах. Многие пациенты на момент постановки диагноза не имеют симптомов, но клинические проявления включают кожную гиперпигментацию, сахарный диабет и хронические заболевания печени, которые могут проявляться в виде усталости, боли в животе, гепатомегалии, аномальных тестов печени, цирроза и гепатоцеллюлярной карциномы.Другие клинические признаки включают кардиомиопатию, нарушения сердечной проводимости, гипотиреоз, гипогонадизм, импотенцию и артропатию.
Диагноз гемохроматоза основывается на сочетании клинических, лабораторных и патологических критериев. Повышенный уровень ферритина в сыворотке крови вызывает подозрение на основной гемохроматоз, но более надежным тестом является насыщение трансферрина. Измерение сывороточного железа и общей связывающей способности железа дает индекс насыщения трансферрина. Значение более 45% наводит на размышления. 14 Сывороточный ферритин, являющийся реагентом острой фазы, может также повышаться при ряде других воспалительных состояний и как таковой не является полезным скрининговым тестом.
Перегрузка железом может быть подтверждена биопсией печени для оценки индекса железа в печени (уровень железа в печени в мкмоль / г сухого веса, деленный на возраст пациента). Соотношение более 1,9 соответствует гомозиготному наследственному гемохроматозу. 14
Открытие гена гемохроматоза (HFE) в 1996 году произвело революцию в диагностике гемохроматоза.Мутация HFE, расположенная на коротком плече хромосомы 6, отвечающая за большинство случаев, теперь доступна с помощью генетического тестирования. Две точечные мутации были обозначены как C282Y и H63D. Наибольший риск перегрузки железом существует у гомозигот по мутации C282Y. Перегрузка железом также встречается у меньшинства людей с другими мутациями HFE, особенно у сложных гетерозигот, у которых есть одна копия C282Y и одна копия H63D, а иногда и гомозиготы H63D. Следует помнить, что клинически значимая перегрузка железом может происходить при отсутствии мутаций HFE.Следовательно, отрицательный генный тест не исключает гемохроматоз. Тест HFE — это полимеразная цепная реакция, которую обычно проводят на образце цельной крови. Генный тест наиболее полезен при скрининге взрослых членов семьи идентифицированного пробанда. Это часто также полезно для разрешения неоднозначных случаев, таких как перегрузка железом, связанная с гепатитом С, алкогольная болезнь печени или другие причины терминальной стадии заболевания печени. Перед прохождением теста HFE квалифицированный специалист должен проконсультировать человека о рисках, преимуществах и альтернативах генетического тестирования.Есть опасения по поводу возможности получения страховки или трудоустройства на основании результатов этих тестов. По этой причине генное тестирование обычно не рекомендуется лицам моложе 18 лет.
Потребность в биопсии печени снизилась с появлением возможности генетического тестирования. Биопсия печени по-прежнему остается золотым стандартом для оценки степени фиброза. Важно исключить цирроз из-за повышенного риска развития гепатоцеллюлярной карциномы. Таким пациентам может быть целесообразным обследование с помощью УЗИ и определения α-фетопротеина каждые шесть месяцев.Недавнее исследование 15 подтвердило, что некоторые неинвазивные предикторы были точными при исключении цирроза у гомозигот C282Y. В этом исследовании не было случаев цирроза у 96 гомозигот по C282Y с уровнем ферритина в сыворотке ниже 1000 мкг / л, нормальными значениями AST и отсутствием признаков гепатомегалии. Эти результаты были подтверждены в других исследованиях. Следовательно, сывороточный ферритин <1000 мкг / л кажется лучшим предиктором отсутствия цирроза у гомозигот по C282Y. Однако положительная прогностическая ценность сывороточного ферритина> 1000 мкг / л является низкой, поскольку только около 50% пациентов со значениями> 1000 мкг / л имеют цирроз.В этой группе пациентов рекомендуется провести биопсию печени, чтобы точно определить наличие цирроза. Подобная информация недоступна для гомозигот, не являющихся гомозиготами по C282Y.
Биопсия печени не обязательна для пациентов с наследственным гемохроматозом до 40 лет с нормальной функцией печени. 4
БОЛЕЗНЬ ВИЛЬСОНА
Это генетическое нарушение выведения меди с желчью. Обычно выявляется в возрасте от 5 до 25 лет, его также следует учитывать у пациентов в возрасте до 40 лет.
Сыворотка церулоплазмина, при обычном скрининговом тесте снижается примерно в 85% случаев. 4 Кольца Кайзера-Флейшера могут быть полезной клинической подсказкой. Церулоплазмин может быть нормальным, а кольца Кайзера-Флейшера отсутствовать, и в этом случае необходимо проверить 24-часовую экскрецию меди с мочой. Выведение более 100 мкг свидетельствует о болезни Вильсона.
Биопсия печени подтверждает диагноз, если концентрация меди в печени превышает 250 мкг / г сухой массы печени.Генетический дефект был идентифицирован, но из-за большого количества мутаций молекулярная диагностика пока невозможна.
АЛЬФА
1 ДЕФИЦИТ АНТРИПСИНАЭто редкая причина хронического заболевания печени у взрослых. Низкие уровни α- 1 -антитрипсина могут быть обнаружены путем прямого измерения уровней α-глобулина в сыворотке крови или по отсутствию роста полос α-глобулина при электрофорезе сывороточного белка. 4
НЕГЕПАТИЧЕСКИЕ ПРИЧИНЫ АНОМАЛЬНОСТИ
Инфильтрация печени, такая как метастатическая или даже первичная гепатоцеллюлярная карцинома, туберкулез, саркоидоз и амилоидоз, может вызывать умеренное (до трех раз) повышение аминотрансфераз и до 20-кратное повышение ЩФ в зависимости от степени поражения.Уровень билирубина обычно в норме, но распознается его пятикратное повышение. 3
Скрытая глютеновая спру признана причиной повышения уровня трансаминаз. 16 Антиэндомизарные антитела и антиглиадиновые антитела являются полезными подтверждающими тестами. Во вставке 4 перечислены общие и редкие, но признанные причины аномалий трансаминаз, не связанные с печенью.
Если, несмотря на всестороннее обследование, причина не очевидна, может потребоваться биопсия печени. На рисунке 1 представлен алгоритм исследования аномальных трансаминаз.
Рисунок 1Предлагаемый алгоритм для оценки повышенных трансаминаз (АЛТ, аланинтрансаминаза; ВГА, вирус гепатита А; ВГС, вирус гепатита С; ПВ, протромбиновое время).
ПРИЧИНЫ ПОВЫШЕННОЙ ЩЕЛОЧНОЙ ФОСФАТАЗЫ
ЩФ происходит в основном из двух источников: печени и кости. 2 Ферменты могут присутствовать во множестве других тканей, а именно в кишечнике, почках, плаценте и лейкоцитах.Возвышение может быть физиологическим или патологическим. Физиологическая роль этих ферментов не совсем ясна, но их продукция увеличивается в тканях, подвергающихся метаболической стимуляции. Повышение наблюдается в третьем триместре беременности в результате притока плацентарной ЩФ. У подростков может наблюдаться увеличение, вдвое превышающее норму для взрослых, в результате попадания в кровь ЩФ из костей, что соответствует росту.
Очевидно, что первым шагом в определении причины является определение источника повышенного ALP.Наиболее чувствительным и действительно специфическим методом является электрофоретическое разделение, но он недоступен в свободном доступе. Хороший дискриминатор — это тестирование на 5′-нуклеотидазу или гаммаглутамилтрансферазу, которые повышаются в печени, но не при заболеваниях костей. Если ALP имеет печеночное происхождение, необходимо провести ультразвуковое исследование.
Во вставке 5 перечислены распространенные причины повышенного уровня ЩФ. Внепеченочная обструкция желчевыводящих путей, инфильтративные заболевания и метастазы могут вызывать незначительное или поразительное повышение уровня ЩФ
.Вставка 5:
Распространенные причины повышенного АЛПФизиологический
Женщины в третьем триместре беременности.
Подростки.
Доброкачественный, семейный (из-за повышенного уровня ЩФ в кишечнике).
Патологический
Обструкция желчного протока.
Первичный билиарный цирроз.
Первичный склерозирующий холангит.
Холестаз, вызванный лекарствами, например анаболическими стероидами.
Желчные протоки у взрослых.
Метастатическая болезнь печени.
Болезнь костей.
Печеночная ЩФ присутствует в канальцевом и просветном доменах эпителия желчных протоков, и уровни повышаются в результате усиленного синтеза и последующего высвобождения в кровоток. В результате уровень может повыситься только через один-два дня после непроходимости желчных путей. Кроме того, период полураспада фермента составляет неделю, поэтому даже после разрешения обструкции желчных путей для нормализации уровней может потребоваться несколько дней.
Также стоит отметить, что уровень ЩФ может повышаться при злокачественных новообразованиях без поражения печени или костей. Этот изофермент называется «изоферментом Регана» и встречается при различных новообразованиях, например, при раке легких. 3
На рис. 2 предложен алгоритм оценки пациентов с повышенным уровнем ЩФ.
Рисунок 2Предлагаемый алгоритм для оценки повышенного уровня ЩФ (ЩФ, щелочная фосфатаза; ЭРХП, эндоскопическая ретроградная холангиопанкреатография; ГГТ, гаммаглутамилтрансфераза; ПВ, протромбиновое время; МРХП, магнитно-резонансная холангиопанкреатография).
ГАММАГЛУТАМИЛ ТРАНСФЕРАЗА
Этот фермент обнаружен в гепатоцитах и клетках желчного эпителия. Хотя это чувствительный тест на гепатобилиарную болезнь, его полезность ограничена из-за отсутствия специфичности. Повышенные уровни могут наблюдаться при заболеваниях поджелудочной железы, инфаркте миокарда, почечной недостаточности, хронической обструктивной болезни легких, диабете и алкоголизме. 17
Лекарства, такие как фенитоин, карбамазепин и барбитураты, также могут вызывать умеренное повышение уровня гаммаглутамилтрансферазы (вставка 6). 18
Вставка 6:
Причины повышенной гаммаглутамилтрансферазыЗаболевание гепатобилиарной системы (часто с другими нарушениями ферментов печени).
Болезнь поджелудочной железы.
Алкоголизм.
Хроническая обструктивная болезнь легких.
Почечная недостаточность.
Диабет.
Инфаркт миокарда.
Наркотики, например карбамазепин, фенитоин и барбитураты.
При других аномалиях ферментов повышенный уровень гаммаглутамилтрансферазы может поддерживать гепатобилиарный источник.Например, это подтвердит печеночный источник повышенного уровня ЩФ. Повышенный уровень гаммаглутамилтрансферазы с повышенным уровнем трансаминаз и соотношением АСТ к АЛТ 2: 1 или более может указывать на заболевание печени, связанное с алкоголем.
Разумным подходом является наблюдение за пациентами с изолированным повышением уровня гаммаглутамилтрансферазы через несколько интервалов в месяц. Если другие ферменты становятся ненормальными или уровень гаммаглутамилтрансферазы увеличивается, следует запросить УЗИ брюшной полости, компьютерную томографию или и то, и другое, чтобы исключить поражение, занимающее пространство, и рассмотреть возможность проведения биопсии печени. 19
АЛЬБУМИН
Синтез альбумина — важная функция печени. Примерно 10 г синтезируется и секретируется ежедневно. При прогрессирующем заболевании печени уровень сывороточного альбумина падает, что отражает снижение синтеза. Уровни альбумина зависят от ряда других факторов, таких как статус питания, катаболизм, гормональные факторы, а также потери с мочой и желудочно-кишечным трактом. Это следует учитывать при интерпретации низких уровней альбумина.При этом концентрация альбумина коррелирует с прогнозом при хроническом заболевании печени.
ПРОТРОМБИН ВРЕМЯ
Синтез факторов свертывания (кроме фактора VIII) — важная функция печени. Протромбиновое время измеряет скорость превращения протромбина в тромбин (требуя факторов II, V, VII и X) и, таким образом, отражает жизненно важную синтетическую функцию печени. Витамин К необходим для гамма-карбоксилирования вышеуказанных факторов.
Следовательно, протромбиновое время может быть продлено при дефиците витамина К, терапии варфарином, заболеваниях печени и чахоточной коагулопатии.
Важно отличать пролонгированное протромбиновое время из-за гепатоцеллюлярной болезни от хронического холестаза с нарушением всасывания жира. На практике полезным способом их дифференциации является введение витамина К, который сокращает пролонгированное протромбиновое время из-за мальабсорбции жира, но не из-за внутреннего заболевания печени.
МЕЖДУНАРОДНОЕ НОРМАЛИЗИРОВАННОЕ СООТНОШЕНИЕ
Сейчас это чаще тестируется вместо или вместе с протромбиновым временем, чтобы стандартизировать отчетность о результатах протромбинового времени (ПВ). Он рассчитывается по следующей формуле:
Международное нормализованное отношение = [PT пациента / среднее значение в контрольной группе] ISI
(ISI = международный индекс чувствительности).
Это полезно, поскольку позволяет избежать межлабораторной изменчивости протромбинового времени.В остальном его интерпретация аналогична протромбиновому времени.
КОЛИЧЕСТВЕННЫЕ ИСПЫТАНИЯ ФУНКЦИИ ПЕЧЕНИ
Ограничения различных биохимических тестов побудили к поиску более чувствительных и количественных тестов функции печени. Хотя эти тесты в настоящее время ограничены исследовательскими центрами, они заслуживают упоминания и включают 3 :
.Индоцианин зеленый клиренс.
14 Дыхательный тест с С-аминопирином.
Клиренс антипирин.
Способность к удалению галактозы.
13 Дыхательный тест с кофеином.
Тесты дорогие и трудоемкие. Прежде чем они получат более широкое признание, необходимы хорошо спланированные клинические испытания, сравнивающие их с биохимическими тестами.
КОГДА ОБРАЩАТЬСЯ К МНЕНИЮ СПЕЦИАЛИСТА?
Обычно сюда входят 6 пациентов с:
(1) Необъяснимые аномалии печени более 1.В 5 раз больше нормы в двух случаях с интервалом минимум шесть месяцев.
(2) Необъяснимое заболевание печени с признаками печеночной дисфункции (гипоальбуминемия, гипербилирубинемия, пролонгированное протромбиновое время или международное нормализованное соотношение)
(3) Известное заболевание печени, при котором требуется лечение, выходящее за рамки отмены возбудителя.
КАКИЕ ИСПЫТАНИЯ ПЕРЕД НАПРАВЛЕНИЕМ
6Рассмотрим следующее:
(1) Скрининг на вирусный гепатит: IgM к вирусу гепатита А, HbsAg, вирусу гепатита С.
(2) Антинуклеарные антитела.
(3) Церулоплазмин у пациентов моложе 40 лет.
(4) Исследования железа (железо, общая железосвязывающая способность и ферритин).
(5) УЗИ печени, особенно при подозрении на жировую инфильтрацию (люди с ожирением, диабетики и / или пациенты с гиперлипидемией).
Ключевые точкиУ бессимптомного пациента могут быть аномальные пробы печени.
Хороший анамнез и медицинский осмотр часто полезны.
Печеночные пробы часто становятся ненормальными при заболеваниях, не связанных с печенью.
Если применяется систематический подход, причина часто очевидна.
При необходимости следует запрашивать мнение специалиста.
Ультразвук также следует выполнять пациентам с симптомами с аномалиями ферментов печени или пациентам с признаками печеночной дисфункции (повышенное билирубиновое или протромбиновое время или снижение альбумина), а также пациентам с биохимическими признаками холестаза.
ССЫЛКИ
- ↵
Friedman LS , Martin P, Munroz SJ. Функциональные пробы печени и объективная оценка пациента с заболеванием печени. В: Заким Д., Бойер Т.Д., изд. Гепатология: учебник болезней печени. Том 1. Филадельфия, У. Б. Сондерс, 1996: 791–833.
- ↵
Pratt DS , Каплан MM. Лабораторные тесты. В: Schiff ER, Sorrell MF, Maddrey WC, eds. Болезни печени Шиффа. 8-е изд. Том 1. Филадельфия: Липпенкотт-Рэйвен, 1999: 205–44.
- ↵
Feldman M , Friedman LS, Sleisenger MH. Заболевания желудочно-кишечного тракта и печени Слейзенгера и Фордтрана. 7-е изд. 2002: 1227–39, 1310–11.
- ↵
Pratt DS , Каплан MM. Оценка аномального фермента печени приводит к бессимптомным пациентам.N Engl J Med2000; 342: 1266–71.
- ↵
Cohen JA , Kaplan MM. Соотношение SGOT / SGPT — показатель алкогольной болезни печени. Dig Dis Sci1979; 24: 835–8.
- ↵
Минук Г . Практические рекомендации Канадской ассоциации гастроэнтерологов: оценка аномальных тестов ферментов печени. Can J Gastroenterol1998; 12 (6): 417–21.
- ↵
Schiff ER , de Medina M, Kahn RS.Новые перспективы в диагностике гепатита С. Semin Liver Dis 1999; Suppl 1: 3–15.
- ↵
Czaja AJ . Естественное течение, клинические особенности и лечение аутоиммунного гепатита. Semin Liver Dis 1984; 4: 1–12.
- ↵
Diehl AM , Goodman Z, Ishak KG. Алкогольная болезнь печени у неалкоголиков: клиническое и гистологическое сравнение с поражением печени, вызванным алкоголем.Гастроэнтерология 1988; 95: 1056–62.
- ↵
Бекон BR , Фарахваш М.Дж., Дженни К.Г., и др. . Неалкогольный стеатогепатит: развернутая клиническая картина. Гастроэнтерология, 1994; 107: 1103–9.
- ↵
Sorbi D , Boynton J, Lindor KD. Отношение аспартатаминотрансферазы к аланинтрансферазе: потенциальное значение для дифференциации неалкогольного стеатогепатита от алкогольной болезни печени.Am J Gastroenterol1999; 94: 1018–22.
- ↵
Matteoni CA , Younossi ZM, Gramlich T, и др. . Неалкогольная жировая болезнь печени: спектр клинической и патологической степени тяжести. Гастроэнтерология, 1999; 116: 1413–9.
- ↵
Eriksson S , Eriksson KF, Bondesson L. Неалкогольный стеатогепатит при ожирении: обратимое состояние. Acta Med Scand 1986; 220: 83–8.
- ↵
Пауэлл LW , Джордж Д.К., МакДоннелл С.М., и др. Диагностика гемохроматоза. Ann Intern Med, 1998; 129: 925–31.
- ↵
Guyader D , Jacquelinet C, Moirand R, et al. Неинвазивное прогнозирование фиброза при гомозиготном гемохроматозе по C282Y. Гастроэнтерология 1998; 115: 929–36.
- ↵
Bardella MT , Vecchi M, Conte D, и др. Хроническая необъяснимая гипертрансаминаземия может быть вызвана скрытой целиакией. Гепатология 1999; 29: 654–7.
- ↵
Голдберг DM , Мартин СП. Роль активности гамма-глутамилтранспептидазы в диагностике гепатобилиарной болезни. Пищеварение, 1975; 12: 232–46.
- ↵
Rosalki SB , Tarlow D, Rau D. Повышение уровня гамма-глутамилтранспептидазы в плазме у пациентов, получающих препараты, индуцирующие ферменты.Lancet1971; II: 376–7.
- ↵
Bloom S , изд. Нарушение функции печени у бессимптомного пациента. Практическая гастроэнтерология. 1-е изд. Великобритания: Мартин Дуниц, 2002: 503–6.
Желтуха новорожденных — Центр здоровья новорожденных Торонто
Эндрю Джеймс Бакалавр, МБЧБ, МБИ, FRACP, FRCP
Представленный здесь материал был впервые опубликован в «Справочнике резидентов по неонатологии», 3-е издание, и воспроизводится здесь с разрешения PMPH USA, Ltd.Нью-Хейвен, Коннектикут и Кэри, Северная Каролина.Желтуха новорожденных, которая обычно проявляется как неконъюгированная гипербилирубинемия, является одним из наиболее частых физических признаков, наблюдаемых у новорожденных. Приблизительно 60% доношенных новорожденных и 80% недоношенных младенцев будут иметь видимую желтуху в течение первой недели жизни. Желтуха, которая является почти универсальной, получила название физиологической желтухи. Для большинства новорожденных это преходящее физиологическое явление, которое можно рассматривать как проявление их продолжающейся адаптации к внематочной среде.
Желтуха может быть признаком патологии и требует соответствующей оценки и рационального лечения. Важно понимать, что симптомы у новорожденного с желтухой могут быть связаны с желтухой, хотя на самом деле они вызваны другой патологией. Доказательств в отношении лечения желтухи мало, особенно у нездоровых новорожденных и недоношенных детей. Полный спектр неблагоприятных исходов гипербилирубинемии и безопасность многих вмешательств неизвестны.
Клиническая задача
Несмотря на улучшение ухода за новорожденными и фактическое отсутствие классической ядерной желтухи, безопасные уровни билирубина в сыворотке не были установлены с абсолютной уверенностью.Данные многочисленных исследований токсичности билирубина настолько сложны, что было трудно разработать рациональный подход к ведению новорожденных с желтухой. Были опубликованы многочисленные руководства по ведению новорожденных с желтухой, но их эффективность не была подтверждена надлежащим образом разработанными клиническими испытаниями [Подкомитет Американской академии педиатрии по гипербилирубинемии, 2004; Комитет по плодам и новорожденным Канадского педиатрического общества, 2007].
Острая билирубиновая энцефалопатия и ядерная желтуха, хотя и реже, чем раньше, все еще встречаются [Sgro et al, 2012].Основные основные причины, которые, по-видимому, вносят значительный вклад в зарегистрированные случаи ядерной желтухи, включают:
- Неспособность распознать важные факторы риска, включая гестационный возраст <38 недель и грудное вскармливание
- Неспособность оценить желтуху в первые 24 часа жизни
- занижение степени тяжести желтухи при визуальной оценке
- Неспособность отреагировать на опасения родителей по поводу желтухи, плохого кормления и изменений в поведении новорожденных
- Несвоевременное наблюдение
Крайняя гипербилирубинемия не редкость: в 2002–2004 годах примерно у 1 ребенка из 2000 в Канаде пиковая концентрация билирубина в сыворотке крови превышала 425 микромоль / л [Sgro et al, 2006].
Метаболизм билирубина
Несколько биофизических процессов вовлечены в производство, транспорт, метаболизм и клиренс билирубина. К ним относятся следующие:
- деградация эритроцитов
- связывание билирубина с альбумином
- Транспорт билирубина в печень
- поглощается печенью
- конъюгация в печени
- Экскреция через печень и перенос в желчь
- кишечный транспорт
Все биофизические процессы, участвующие в синтезе, распределении, метаболизме и выведении билирубина, показаны на Рисунке 1.
Рисунок 1. Синтез, распределение, метаболизм и выведение билирубина
Аномальное функционирование любого из этих биофизических процессов может вызвать желтуху новорожденных, которая прогрессирует до тяжелой гипербилирубинемии, острой билирубиновой энцефалопатии и ядерной желтухи. Существует несколько генетически обусловленных недостаточностей ферментов, которые мешают синтезу, метаболизму и выведению билирубина [Kaplan M, Hammerman C, Maisels MJ., 2003]. Дефицит глюкозо-6-дегидрогеназы (G6PD) является наиболее частым из этих состояний.
Нейротоксичность билирубина
Повреждение головного мозга, вызванное билирубином, протекает с целым рядом клинических проявлений, от обратимых нейрофизиологических и поведенческих изменений до постоянных структурных изменений.
Возможные механизмы, которые способствуют проникновению билирубина в мозг и его связыванию с мембранами нейрональных клеток, включают ацидоз, снижение связывания билирубина с сывороточным альбумином и нарушение гематоэнцефалического барьера [Таблица I].
Таблица 1.Механизмы, облегчающие поступление билирубина в мозг
Следующие ниже препараты, которые конкурируют с билирубином за сайты связывания с альбумином, следует избегать у новорожденных со значительной желтухой.
- Анальгетики, включая салицилаты и ибупрофен
- Противомикробные средства, включая цефалоспорин и сульфаниламиды, но не триметоприм / сульфаметоксазол (ко-тримоксазол)
- Среда для контраста для рентгенографии
Билирубин вызывает общее клеточное повреждение, ингибируя митохондриальные ферменты, вмешиваясь в синтез ДНК, вызывая разрыв цепи ДНК и ингибируя синтез и фосфорилирование белка [Chuniaud et al, 1996].Модель, описывающая патофизиологию нейротоксичности билирубина, представлена в таблице 2.
Таблица 2. Модель нейротоксичности билирубина
Симптомы и признаки могут быть незаметными и неспецифическими. Клинические признаки билирубиновой энцефалопатии различаются в зависимости от возраста младенца и степени гипербилирубинемии. Для описания нейротоксичности билирубина обычно используются три термина.
- Острая билирубиновая энцефалопатия
Острые признаки билирубиновой энцефалопатии включают летаргию, плохое питание, нестабильность температуры и гипотонию, приводящую к выгибанию головы, шеи и спины [opisthotonos], спастичности и судорогам.Может последовать смерть. Многие из выживших получат необратимые черепно-мозговые травмы.
МРТ головного мозга показывает высокий сигнал бледного шара, а МРТ-спектроскопия имеет характерную метаболическую сигнатуру [Oakden et al, 2005]. Эти изменения могут быть преходящими, и поэтому их не следует интерпретировать как явное свидетельство стойкого повреждения головного мозга.
- Хроническая билирубиновая энцефалопатия / клиническая ядерная желтуха
Классические признаки ядерной желтухи представляют собой тетраду, состоящую из экстрапирамидных нарушений, слуховых аномалий, параличей взгляда и дисплазии зубной эмали [Perlman, 1960].Также может наблюдаться нарушение нейрокогнитивного функционирования.
- Патологическая ядерная желтуха
Этот термин относится к результатам вскрытия младенцев, умерших от острой болезни. Он характеризуется отложением билирубина, вызывающим изменение цвета на желтый и гибель нейронов в базальных ганглиях, мозжечке и глубоких ядерных структурах, включая субталамические структуры, гиппокамп и ствол мозга. Результаты у субъектов с хронической билирубиновой энцефалопатией показывают хроническую патологию головного мозга в тех же местах без желтого окрашивания.
Причины желтухи:Общие причины желтухи новорожденных в течение первой недели жизни включают те физиологические механизмы, которые уникальны для новорожденного, незрелость печеночных ферментов и грудное вскармливание.
Физиологическая желтуха впервые наблюдается на лице, когда уровень билирубина в сыворотке (SBR) составляет не менее 80–120 мкмоль / л. Происходит медленное цефалокаудальное прогрессирование — от лица к туловищу и конечностям, которые обычно сохраняются. Скорость повышения билирубина менее 8.5 мкмоль / л / ч. Измерение уровня билирубина в сыворотке необходимо для определения степени желтухи и разработки соответствующего плана лечения просто потому, что визуальная оценка тяжести желтухи человеческим глазом часто неточна.
Биологические механизмы физиологической желтухи, связанные с процессами синтеза, передачи, конъюгации и экскреции билирубина в печени, перечислены в таблице 3.
Таблица 3. Механизмы физиологической желтухи
УровниSBR, превышающие 95-й процентиль для постнатального возраста, которые показаны на рисунке 2, не следует рассматривать как физиологические без дальнейшего исследования и исключения патологических причин.Большинство зрелых новорожденных выписываются из больницы до того, как физиологическая желтуха достигает своего пика через 3-5 дней.
Рис. 2. Номограмма для определения риска гипербилирубинемии у здоровых новорожденных (GA> 36 недель и масса тела при рождении> 2000 г или GA> 35 и масса тела при рождении> 2500 г) на основе часовых значений билирубина в сыворотке. Билирубин в сыворотке измерялся перед выпиской, и зона, в которой его значение упало, предсказывала вероятность того, что последующее значение билирубина превысит 95-й перцентиль.[Bhutani et al, 1999; Подкомитет Американской академии педиатрии по гипербилирубинемии, 2004 г.].
Хотя в большинстве случаев желтуха имеет умеренную форму и физиологическое происхождение, нельзя с уверенностью предполагать, что это так и есть. Атипичная желтуха — желтуха с ранним началом, быстро повышающийся билирубин, длительная желтуха, желтуха с поздним началом или конъюгированная гипербилирубинемия — скорее всего, отражает патологию. Психологическая и патологическая желтуха частично совпадают, и, кроме того, обе могут возникать одновременно.
Желтуха, возникающая в течение первых 24 часов жизни, должна считаться патологической, пока не будет доказано обратное.
К состояниям, вызывающим раннее начало желтухи новорожденных, относятся:- повышенная деградация эритроцитов как прямое следствие ферментативных или структурных дефектов эритроцитов
- Нарушение рецепторов мембран печени и / или печеночных ферментов
- Нарушение гепатобилиарной экскреции
- усиление энтерогепатической циркуляции билирубина
- Желтуха грудного вскармливания
- желтуха грудного молока
- врожденный гипотиреоз
- врожденная инфекция
- нарушения обмена веществ
- структурные аномалии печени и гепатобилиарного тракта
- Клиническая оценка
Обследование новорожденного с желтухой должно включать в себя тщательный сбор анамнеза и физикальное обследование, измерение чрескожного и / или сывороточного билирубина (SBR) и другие исследования, как указано.Всегда следует учитывать возможность острого гемолитического процесса, особенно если желтуха заметна в течение первых 24 часов жизни.
Желтуха может быть оценена, когда SBR превышает 75-80 микромоль / л. Новорожденного с желтухой легко распознать при наблюдении врачей и медсестер. Клиническая оценка желтухи должна проводиться у всех новорожденных при оценке жизненно важных функций ребенка, но не реже, чем каждые 8–12 часов.
Клиническое обследование не может точно предсказать SBR: визуальная оценка степени желтухи человеческим глазом часто неточна.Любые сомнения относительно уровня желтухи следует разрешить путем чрескожного и / или сывороточного измерения.
Чрескожная оценка SBR может использоваться для скрининга. Оценка зависит от расы и послеродового возраста. Если он> 200 мкмоль / л, следует измерить билирубин в сыворотке крови. Нормальные значения для чрескожных измерений показаны на рисунке 3. При чрескожных измерениях существует тенденция занижать SBR всякий раз, когда оно высокое.
Рисунок 3.Уровни чрескожного билирубина у здоровых белых младенцев старше 35 недель в течение первых 96 часов жизни [Maisels and Kring, 2006].
Во всех отделениях интенсивной терапии и интенсивной терапии должны быть установлены протоколы визуальной оценки желтухи. Эти протоколы должны включать обстоятельства, при которых медперсонал может получить чрескожные измерения, если они доступны, и / или измерения SBR без предписания врача.
Лабораторные исследования
Следующие лабораторные исследования рекомендуются для оценки новорожденного с желтухой.
- концентрации общего, неконъюгированного и конъюгированного билирубина [концентрации конъюгированного SBR <20% общих концентраций SBR считаются нормальными в соответствии с текущими согласованными рекомендациями] [Подкомитет Американской академии педиатрии по гипербилирубинемии, 2004]
- Определение групп крови матери и определение антител к эритроцитам
- Группа крови младенцев и прямой тест на антитела (DAT или тест Кумбса)
- гемоглобин, количество белых кровяных телец и дифференциал, количество тромбоцитов и ретикулоцитов
- Мазок крови для доказательства гемолиза и оценки морфологии эритроцитов
Дополнительные лабораторные исследования и визуализация органов рекомендуются для оценки желтухи с поздним началом, длительной желтухи и конъюгированной гипербилирубинемии.
- обследование на сепсис, включая инфекцию мочевыводящих путей
- обследование на врожденные инфекции
- исследование дефицита G6PD, галактоземии и врожденного гипотиреоза
- исследование редких метаболических нарушений
- исследование структуры и функции печени и желчевыводящих путей [УЗИ брюшной полости, сканирование HIDA]
Необходимость активного лечения новорожденного с желтухой определяется расчетным риском нейротоксичности билирубина, который определяется исходя из постнатального возраста SBR и / или скорости повышения SBR, а также других биофизических или патофизиологических факторов.
Интерпретируйте все уровни SBR в соответствии с послеродовым возрастом младенца в часах. Используйте общий SBR для принятия клинических решений.
Младенцев <38 недель гестационного возраста не следует лечить так, как если бы они были зрелыми доношенными детьми. Эти младенцы, особенно те, которые находятся на грудном вскармливании, подвергаются гораздо более высокому риску развития тяжелой гипербилирубинемии и требуют более тщательного наблюдения и наблюдения.
Традиционными, хорошо зарекомендовавшими себя методами лечения желтухи новорожденных являются фототерапия и обменное переливание крови.
Фототерапия, являющаяся основным методом лечения желтухи новорожденных, оказалась в целом безопасной процедурой, хотя могут возникнуть редкие осложнения. Цель фототерапии — предотвратить необходимость обменного переливания крови.
Пороговые значения для обменного переливания устанавливаются таким образом, чтобы поддерживать SBR ниже уровней, при которых сообщалось о ядерной желтухе. В большинстве случаев обменное переливание рекомендуется только после того, как фототерапия не смогла предотвратить повышение SBR до обменных порогов.
Фототерапия
Цель фототерапии — предотвратить необходимость обменного переливания крови. Фототерапию следует начинать на 75–100 мкмоль / л ниже рекомендуемого уровня для обменного переливания. При интенсивной фототерапии общий SBR должен снизиться на 17-34 мкмоль / л в течение 4-6 часов.
Фототерапия вызывает фотоокисление неконъюгированного билирубина в коже до водорастворимых фотоизомеров, которые выводятся с желчью и мочой без конъюгации.
Оптимальная фототерапия требует использования высоких уровней излучения в диапазоне 425–475 нм, доставляемых на как можно большую площадь поверхности ребенка с расстояния
15–20 см от ребенка [Ip et al, 2002]. Интенсивная фототерапия вдвое эффективнее стандартной фототерапии.
Фототерапия оказалась в целом безопасной процедурой. Возможные осложнения включают нестабильность температуры; умеренная потеря жидкости как следствие трансэпидермальной потери и увеличения стула; кожная сыпь и загар кожи; повреждение сетчатки и ожоги.Единственными противопоказаниями к использованию фототерапии являются конъюгированная гипербилирубинемия, врожденная эритропоэтическая порфирия или семейный анамнез этого состояния, а также сопутствующие лекарства, которые, как известно, вызывают светочувствительность.
Гидратация — это лечение только желтухи, вызванной обезвоживанием. Было показано, что он эффективен при лечении обезвоженных недоношенных и доношенных детей с желтухой в возрасте нескольких дней [Mehta et al, 2005].
У младенцев с холестатической желтухой, подвергшихся фототерапии, может развиться синдром бронзового младенца — темное, серо-коричневое изменение цвета кожи, сыворотки и мочи.
Уровни SBR, при которых рекомендуется фототерапия для зрелых или почти созревших новорожденных (GA ≥ 35 недель), задокументированы в Таблице 4 и на Рисунке 4.
Таблица 4. Рекомендуемые уровни SBR для начала фототерапии для младенцев GA ≥ 35 недель
Рис. 4. Рекомендуемые уровни SBR для начала фототерапии для младенцев GA ≥ 35 недель
Уровни SBR, при которых рекомендуется фототерапия для недоношенных новорожденных, задокументированы в таблице 5.
Таблица 5. Рекомендуемые уровни SBR для начала фототерапии недоношенных новорожденных
Не существует установленного стандарта для прекращения фототерапии. Уровень SBR, при котором прекращается фототерапия, должен зависеть от его расстояния от порога обменного переливания крови, причины гипербилирубинемии, реакции на фототерапию и возраста, в котором фототерапия была начата. SBR, который обычно ниже, чем уровень, на котором была начата фототерапия, часто увеличивается после прекращения фототерапии.Это явление известно как «рикошетная» желтуха и обычно возникает в течение 12 часов после прекращения фототерапии. Может быть показана дальнейшая фототерапия.
Обменное переливание крови
Пороговое значение SBR для обменного переливания крови должно быть индивидуализировано и должно учитывать факторы, которые изменяют возможность развития токсичности билирубина. К ним относятся наличие метаболического ацидоза, гипоальбуминемии, активной гемолитической болезни и клинических неврологических признаков, характерных для острой билирубиновой энцефалопатии.
Уровни SBR, при которых рекомендуется обменное переливание крови для зрелых или близких к созреванию новорожденных [GA ≥ 35 недель], задокументированы в Таблице 6 и показаны на Рисунке 5.
Таблица 6. Рекомендуемые уровни обменного переливания крови для младенцев GA ≥ 35 недель
Рис. 5. Рекомендуемые уровни обменного переливания крови для младенцев GA ≥ 35 недель
Уровни SBR, при которых рекомендуется обменное переливание крови для недоношенных новорожденных, задокументированы в таблице 7.
Таблица 7. Рекомендуемые уровни SBR для начала фототерапии недоношенных новорожденных
Важные дополнительные критерии для начала обменного переливания крови, особенно для пациентов с подозрением или доказанной гемолитической болезнью, включают следующее:
- пуповинный билирубин> 85 мкмоль / л
- гемоглобин пуповины <120 г / л
- быстро повышающийся билирубин: скорость повышения билирубина> 17 мкмоль / л / ч
Обменное переливание крови часто выполняется методом «пуш-пул» через единственный пупочный венозный катетер, пересекающий артериальный проток с кончиком в нижней полой вене.Процедура с двумя сосудами с использованием пупочного артериального катетера для забора крови и пупочного венозного катетера для переливания крови облегчает непрерывный изоволюметрический метод обменного переливания крови [Martin, 1973].
Значительная заболеваемость наблюдается при обменных переливаниях крови в 5% случаев. Осложнения включают дисбаланс между перелитым и забранным объемом крови в результате ошибок в технике и / или гипотонии с аликвотами для забора большого объема крови при однократном обмене катетера; гипокальциемия, тромбоцитопения и метаболический ацидоз; некротизирующий энтероколит; воздух и тромбоэмболия, вызывающая инфаркт миокарда или инсульт; и риски инфекций, связанных с переливанием крови.Смертность, связанная с обменным переливанием крови, составляет примерно 3 на 1000 процедур [Kennan et al, 1995].
Обменные переливания крови следует проводить в отделении интенсивной терапии новорожденных (ОИТН) III уровня под наблюдением неонатолога, знающего об осложнениях обменного переливания крови и имеющего опыт проведения процедуры. Это может потребовать упреждающего перевода новорожденного с желтухой в соответствующее отделение интенсивной терапии III уровня до того, как будет достигнут уровень обменного переливания крови.Актуальность начала обменного переливания зависит не только от уровня SBR, но и от наличия и тяжести неврологических симптомов. Подтверждение уровня SBR желательно до начала обмена, но может быть отказано в экстренных случаях — младенцы с определенными признаками нейротоксичности. В экстренных случаях, если наиболее подходящая кровь недоступна, рассмотрите возможность использования резус-отрицательной крови группы O.
Инновационные методы лечения
Гаммаглобулин внутривенный
Внутривенный иммуноглобулин (ВВИГ) действует как конкурентный ингибитор антител, вызывающих гемолиз.Применение ВВИГ у новорожденных с изоиммунной гемолитической желтухой снижает потребность в обменном переливании крови [Alcock, Liley 2002; Gottstein, Cooke 2003].
Эффективность была показана для новорожденных с резусом и другой изоиммунной гемолитической желтухой следующими препаратами:
- Высокий пуповинный билирубин и / или низкий гемоглобин
- Быстрое послеродовое повышение SBR, несмотря на фототерапию
- Приближение к порогу обменного переливания
Ожидаемая польза должна быть сбалансирована с риском использования продуктов крови от нескольких / объединенных доноров.
Рекомендуемая доза составляет 0,5-1,0 г / кг при введении в течение 2 часов. Вторую дозу можно ввести через 12 часов.
МеталлопорфиринИнгибирование продукции гемоксигеназы и билирубина Sn-мезопорфирином представляет собой новое фармакологическое вмешательство для профилактики и лечения желтухи новорожденных [Martinez et al, 1999]. Ингибиторы оксигеназы Haeme подавляют выработку билирубина, как показано на рисунке 1. Предварительные данные указывают на эффективность, но данные о безопасности отсутствуют.Роль этой недавно разработанной терапии в лечении желтухи новорожденных еще четко не установлена [Dennery PA, Seidman DS, Stevenson DK., 2001; Деннери PA, 2002].
Основные рекомендации- Клиническую оценку желтухи следует проводить у всех новорожденных при оценке жизненно важных функций ребенка, но не реже, чем каждые 8–12 часов.
- Во всех отделениях интенсивной терапии и интенсивной терапии должны быть установлены протоколы визуальной оценки желтухи.Эти протоколы должны включать обстоятельства, при которых медперсонал может получить чрескожные измерения и / или измерения SBR крови без указания врача.
- Если есть какие-либо сомнения относительно уровня желтухи, следует измерить SBR крови.
- Измерьте SBR в крови у каждого ребенка с желтухой в первые 24 часа жизни.
- Интерпретируйте все уровни SBR в соответствии с послеродовым возрастом младенца в часах.
- Младенцев <38 недель гестационного возраста не следует лечить так, как если бы они были зрелыми доношенными детьми.Эти младенцы, особенно те, которые находятся на грудном вскармливании, подвергаются гораздо более высокому риску развития тяжелой гипербилирубинемии и требуют более тщательного наблюдения и наблюдения.
- Следуйте признанным рекомендациям по использованию фототерапии и обменного переливания крови.
- Цель фототерапии — предотвратить необходимость обменного переливания крови.
- Любого ребенка, у которого SBR превышает 425 микромоль / л, следует немедленно лечить.
- Выполните систематическую оценку всех младенцев перед выпиской на предмет последующего риска гипербилирубинемии.Если надлежащее последующее наблюдение не может быть гарантировано, оцените риск тяжелой гипербилирубинемии и получите SBR крови.
Список литературы
- Кирпалани, Х., Мур, А.М. и Перлман, М., 2007. Справочник неонатологов для резидентов . PMPH-USA
- Alcock GS, Liley H. Инфузия иммуноглобулина для новорожденных с изоиммунной гемолитической желтухой. Кокрановская база данных Sys Rev 2002; (3): CD003313.
- Подкомитет Американской академии педиатрии по гипербилирубинемии.Лечение гипербилирубинемии у новорожденного на сроке 35 недель и более. Педиатрия 2004; 114: 297-316.
- Бутани В.К., Джонсон Л., Сивьери Э.М. Прогностическая способность специфического для каждого часа сывороточного билирубина перед выпиской в отношении последующей значительной гипербилирубинемии у здоровых доношенных и недоношенных новорожденных. Педиатрия 1999; 103: 6-14.
- Комитет по плодам и новорожденным Канадского педиатрического общества. Рекомендации по выявлению, лечению и профилактике гипербилирубинемии у доношенных и поздних недоношенных новорожденных (срок беременности 35 и более недель).Pediatr Child Health 2007; 12 (Приложение B): 1B-11B. (Подтверждено 28 февраля 2018 г.).
- Доступно по адресу https://www.cps.ca/en/documents/position/hyperbilirubinemia-newborn Последний доступ 25 мая 2019 г.
- Chuniaud L, Dessante M, Chantoux F, Blondeau JP, Francon J, Trivin F. Цитотоксичность билирубина для человеческих фибробластов и астроцитов крысы в культуре: влияние соотношения билирубина и сывороточного альбумина. Clin Chim Acta 1996; 256: 103-14.
- Dennery PA, Seidman DS, Stevenson DK.Неонатальная гипербилирубинемия. N Engl J Med 2001; 344: 581-90.
- Dennery PA. Фармакологические вмешательства для лечения желтухи новорожденных. Semin Neonatol 2002; 7: 111-9.
- Gottstein R, Cooke RI. Систематический обзор внутривенного иммуноглобулина при гемолитической болезни новорожденных. Arch Dis Child Fetal Neonatal Ed. 2003; 88: F6-10.
- Ip S, Glicken S, Kulig J, O’Brien R, Sege R. Управление неонатальной гипербилирубинемией. Резюме. Отчет о доказательствах / Оценка технологий: номер 65.Публикация AHRQ № 03-E005, март 2002 г. Агентство медицинских исследований и качества, Роквилл, Мэриленд.
- Каплан М., Хаммерман С. и Майзелс М.Дж. Генетика билирубина для негенетиков: наследственные дефекты конъюгации неонатального билирубина. Педиатрия 2003; 111: 886-893.
- Kennan WJ, Noval KK, Sutherland JM, Bryla DA, Fetterly KL. Заболеваемость и смертность, связанные с обменным переливанием крови. Педиатрия 1985; 75 (Дополнение 2, Часть 2): 417-21.
- Лауэр Б.Дж., Спектор Н.Д. Гипербилирубинемия у новорожденного.Педиатрия в обзоре 2011; 32 (8): 341-49.
- Maisels MJ, Kring E. Уровни чрескожного билирубина в первые 96 часов у здоровых новорожденных на сроке беременности> 35 недель. Педиатрия 2006; 117: 1169-73.
- Мартин Младший. Метод двойного катетера для обменного переливания крови новорожденному. N. Z. Med J. 1973; 77: 167-9.
- Martinez JC, Garcia HO, Otheguy LE, Drummond GS, Kappas A. Контроль тяжелой гипербилирубинемии у доношенных новорожденных с помощью ингибитора производства билирубина Sn-мезопорфирина.Педиатрия 1999; 103: 1-5.
- Mehta S, Kumar P, Narang A. Рандомизированное контролируемое испытание жидких добавок у доношенных новорожденных с тяжелой гипербилирубинемией. J Pediatr 2005; 147: 781-8.
- Oakden WK, Мур AM, Blaser S, Носуорти MD. 1H МР-спектроскопические характеристики ядерной желтухи: возможный метаболический признак. AJNR Amer J Neuroradiol 2005; 26: 1571-4.
- Pan DH, Rivas Y. Желтуха: новорожденный в возрасте до 2 месяцев. Педиатрия в обзоре 2017; 38 (12): 499-577.
- Perlman MA.Поздний клинический синдром постиктерической энцефалопатии. Pediatr Clin Nth Amer 1960; 7: 665-87.
- Sgro M, Campbell D, Shah V.

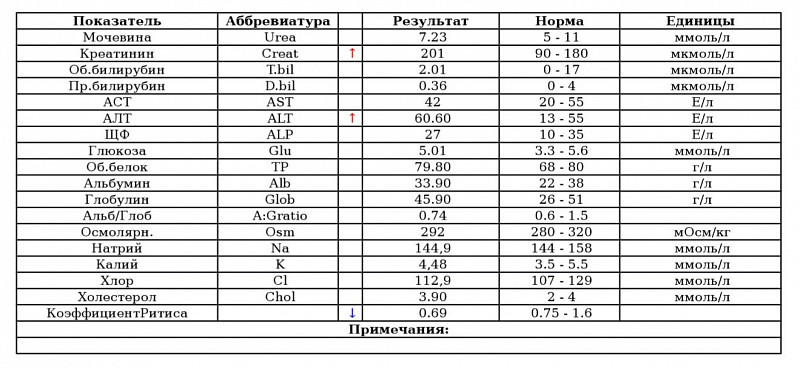

 Суть действия фототерапии заключается в фотоизомеризации непрямого билирубина, т. е. превращении его в водорастворимую форму. В настоящее время существует несколько разновидностей ламп синего света, с длиной волны 410–460 нм, позволяющих выбрать необходимую схему лечения (непрерывную, прерывистую). Современные оптико-волоконные аппараты Biliblanket лишены практически всех побочных эффектов, компактны, не нарушают обычного режима ребенка и общения его с матерью. Фототерапию начинают проводить, когда есть угроза роста билирубина до токсического значения. Лампы располагают на расстоянии 20–40 см от уровня кожи ребенка, мощность излучения должна составлять не менее 5–9 нВТ/см2/нм. Фототерапия проводится непрерывно, прерывать ее можно только на время кормления и визитов матери. Глаза и наружные половые органы ребенка закрываются светонепроницаемой тканью. Если фототерапию применяют у новорожденного с прямой гипербилирубинемией, можно наблюдать изменение цвета кожных покровов — синдром «бронзового ребенка».
Суть действия фототерапии заключается в фотоизомеризации непрямого билирубина, т. е. превращении его в водорастворимую форму. В настоящее время существует несколько разновидностей ламп синего света, с длиной волны 410–460 нм, позволяющих выбрать необходимую схему лечения (непрерывную, прерывистую). Современные оптико-волоконные аппараты Biliblanket лишены практически всех побочных эффектов, компактны, не нарушают обычного режима ребенка и общения его с матерью. Фототерапию начинают проводить, когда есть угроза роста билирубина до токсического значения. Лампы располагают на расстоянии 20–40 см от уровня кожи ребенка, мощность излучения должна составлять не менее 5–9 нВТ/см2/нм. Фототерапия проводится непрерывно, прерывать ее можно только на время кормления и визитов матери. Глаза и наружные половые органы ребенка закрываются светонепроницаемой тканью. Если фототерапию применяют у новорожденного с прямой гипербилирубинемией, можно наблюдать изменение цвета кожных покровов — синдром «бронзового ребенка».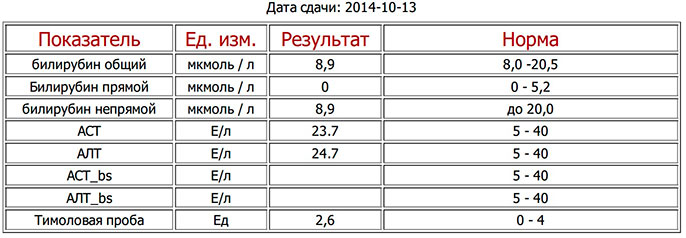 К осложнениям фототерапии относятся ожоги кожи, непереносимость лактозы, гемолиз, дегидратация, гипертермия и загар. При проведении фототерапии обязательны мероприятия по поддержанию постоянного водного баланса новорожденного.
К осложнениям фототерапии относятся ожоги кожи, непереносимость лактозы, гемолиз, дегидратация, гипертермия и загар. При проведении фототерапии обязательны мероприятия по поддержанию постоянного водного баланса новорожденного.