что за препараты, классификация, как действуют?
Боли в суставах и спине, связанные с дегенеративными изменениями и истончением хряща – одна из самых частых причин обращения к врачу. Изменениям в составе суставного хряща, его истончению и повреждению способствую «взросление» человека, неадекватная нагрузка на суставы и позвоночник – как недостаточная активность, так и чрезмерная нагрузка при избыточном весе или подъеме тяжестей.
Очень часто в схему лечения суставов и позвоночника включают препараты-хондропротекторы. Разберем, что это за препараты, какова их функция, оказывают ли они эффект и в каких случаях.
Мнение касательно хондропротекторов отличается у разных специалистов и ученых.
Что это за препараты
Хондропротекторы призваны защищать суставной хрящ от истончения и разрушения, а также служить строительным материалом для синовиальной жидкости – смазки, которая находится внутри суставов и способствует скольжению суставных поверхностей костей относительно друг друга.
В состав хондропротекторов входят хондроитин и глюкозамин. Это структурные компоненты хрящевой ткани, которые необходимы для постоянного процесса воспроизводства здорового хряща.
Цель их приема – уменьшение боли и скованности в суставах, восстановление структуры хряща.
Классификация
- В группе хондропротекторов существуют 3 поколения:
- Вытяжки из продуктов животного происхождения (в том числе хрящи рыб, ракообразных): алфлутоп, румалон, мукартрин.
- Монокомпонентные препараты:
- — на основе хондроитин сульфата: структум, мукосат, хондроксид;
- — на основе глюкозамина: дона, эльбона, стопартроз.
- Комбинированные средства, в состав которых входят глюкозамин, хондроитин сульфат и дополнительные компоненты, например витамины, нестероидные противовоспалительные препараты: терафлекс, артрогард, геладринк.
Также препараты различаются по способу введения:
- для приема внутрь в форме порошков, капсул или таблеток;
- для инъекций внутримышечных или внутрисуставных растворы;
- для наружного применения – мази.

Как действуют хондропротекторы
Компоненты хондропротекторов — глюкозамин и хондроитин выступают строительным материалом для хрящей и синовиальной жидкости сустава.
При хроническом разрушении тканей возникает повышенный спрос на строительные молекулы, суставы «захватывают» их наиболее охотно
Известно, что при дегенеративных заболеваниях суставов — артроз, остеохондроз хрящ истончается, количество синовиальной жидкости уменьшается. Таким образом, процессы распада превалируют над процессами синтеза.
Считается, что дополнительное поступление строительных веществ благотворно скажется на восстановлении суставов. И правда, известно, что при хроническом разрушении тканей возникает повышенный спрос на строительные молекулы, суставы «захватывают» их наиболее охотно. В таком свете прием препаратов со строительными материалами в нем становится оправдан.
Однако основные сложности возникают со всасыванием этих веществ и их доставкой в пораженный сустав.
Что происходит с хондропротекторами в нашем организме?
При приеме внутрь молекулы должны всосаться в тонком кишечнике и попасть в кровоток и затем быть доставлены к суставу.
Процесс всасывания при приеме пищи, например, происходит следующим образом: крупные молекулы белков, жиров и углеводов расщепляются до маленьких аминокислот, жирных кислот и моносахаридов и в таком виде поступают в кровь.
Однако, хондроитин сульфат – это крупная, сложная молекула, которая не может целиком преодолеть кишечный барьер. Молекула претерпевает разрушение до составных частей и затем уже попадает в кровоток. Такой процесс происходит частично, а другая часть больших молекул выводится из организма в неизменном виде.
Что же касается глюкозамина – они меньше, и всасываются в кишечнике практически в неизмененном виде и поступают в органы-мишени как стройматериал. Однако, глюкозамин может синтезироваться в нашем организме из глюкозы, которую мы получаем с пищей. Необязательно для этого принимать добавки.
А что насчет инъекционных форм?
При внутримышечном введении лекарство минует процесс всасывания и сразу поступает в кровоток. Для маленьких молекул это не проблема, а вот крупные молекулы могут вызывать аллергические реакции, как местные, так и общие.
Введение препарата непосредственно в полость сустава является предпочтительной. Тогда не возникает проблемы всасывания или аллергических реакций и препарат попадает сразу в сустав. Однако хрящ плохо питается из омываемой синовиальной жидкости и даже здесь хондропротекторы окажутся не самыми эффективными. Лучше с задачей замены синовиальной жидкости справляются препараты гиалуроновой кислоты. Но показано, что экзогенная гиалуроновая кислота долго в суставе не задерживается (около суток), а сохранение эффекта предполагается на 6-9 месяцев.
Чтобы препарат начал работать ему необходимо пройти непростой путь к суставу.
За и против
Препараты имеют очень небольшой перечень побочных проявлений, то есть, практически, безвредны. Если не считать аллергических реакций и редких диспепсических явлений.
Если не считать аллергических реакций и редких диспепсических явлений.
Курс лечения обычно длительный, от 3 до 6 месяцев, быстрого эффекта ожидать не стоит
Наибольшая эффективность терапии возможна на ранних стадиях изменений суставов, когда может не быть еще клинических проявлений
Низкая биодоступность хондроитина при приеме внутрь, способность без проблем синтезировать глюкозамин организмом человека – делают пероральный прием сомнительно оправданным. Дефицит субстрата трудно представить даже при вегетарианском типе питания.
Отсутствие больших клинических исследований, доказывающих эффективность хондропротекторов. В проведенные исследования эффективность оценивали субъективно, путем опроса и оценки выраженности болевого синдрома и скованности, что не исключает эффект плацебо.
Достаточно высокая стоимость длительного курса лечения тоже нужно принимать во внимание при выборе тактики лечения.
Кстати, уважаемые организации ВОЗ и FDA не включили хондропротекторы в рекомендации для лечения болезней суставов.
В США препараты хондроитина отнесены не к лекарственным средствам, а к пищевым добавкам, для разрешения их использования не требуется высокого уровня доказанности их эффективности.
Лучшие хондропротекторы и препараты для суставов и связок
Зачем нужны хондропротекторы?
Прямохождение человека, как бы это странно не звучало, при всех его преимуществах, неблагоприятно сказывается на здоровье наших суставов – в особенности колен, кистей, позвоночника. Позвоночный столб изначально предполагался эволюцией как каркас, расположенный горизонтально, колени должны были разделять вес тела с локтями (если бы мы все еще бегали на четвереньках), а уж для работы с клавиатурой природа нас точно не создавала. И привет – остеохондроз, артриты, остеоартрозы и так далее.
Даже спорт, который считается полезным для здоровья, для суставов практически всегда травматичен для опорно-двигательного аппарата (исключением можно назвать, пожалуй, только плавание и шахматы) – в особенности с дополнительной нагрузкой, как при силовых тренировках.
И бег – даже в качественных кроссовках с хорошей амортизацией по подходящему для этого покрытию (или даже вообще на беговой дорожке) – это всегда ударная нагрузка на колени и голеностоп. Под воздействием этой нагрузки может разрушаться и истончаться хрящ, а при ошибках и падениях повреждаться связки и другие части суставной сумки.
Поэтому стоит заранее озаботиться средствами для укрепления соединительной ткани суставов, чтобы снизить вероятность микротравм и облегчить восстановление, если травмы всё же не удалось избежать.
Виды хондропротекторов
Хондропротекторы – препараты длительного действия, то есть для того, чтобы их эффект был заметен, нужно пройти курс лечения. На данный момент существует три поколения:
- Первого: лекарства для суставов, изготовленные из соединительной ткани животных и рыб – в основном хряща и костей.
-

- Третьего: средства для лечения суставов комбинированного типа, в составе которых можно найти и хондроитин, и глюкозамин, и другие компоненты – противовоспалительные средства, жирные кислоты, витамины для суставов, связок и хрящей, микроэлементы. Такие хондропротекторы для суставов нового поколения имеют меньше побочных эффектов, реже вызывают аллергию и быстрее снимают болевой синдром.
По способу применения хондропротекторы бывают:
- Наружные
- Инъекционные – это медицинские противовоспалительные препараты для лечения суставов, которые применяют при серьезных заболеваниях и травмах суставов. Их подбирать, да и использовать, обязательно должен врач.
- В виде таблеток или капсул – используются для профилактики повреждений и в восстановительный период после травм.

- Порошковые хондропротекторы – встречаются довольно редко, но, например, коллаген в порошке усваивается хорошо.
Что лучше для суставов: глюкозамин, коллаген или хондроитин?
Глюкозамин – вещество, вырабатываемое хрящевой тканью суставов. Входит в состав синовиальной жидкости – своего рода «смазки», заполняющей суставную сумку и минимизирующей трение частей сустава. Глюкозамин снижает степень воспаления, замедляет разрушения соединительной ткани, а также является необходимым компонентом для выработки хондроитина.
Хондроитин — важный компонент хрящевой ткани и связок. Он обеспечивает эластичность суставов, гибкость и амортизирующие свойства при нагрузках. После 1-3 месячного курса хондроитина увеличивается подвижность суставов, уменьшается их отечность и болезненность и стимулируется восстановление хряща.
Коллаген – это основной строительный компонент соединительной ткани – то есть связок, хрящей (а также кожи, ногтей и волос, но об этом подробнее можно прочитать в нашей прошлой статье про коллаген), поэтому он актуален для укрепления и особенно восстановления поврежденных частей суставов.
Как видите, выбирать между ними – так себе затея. Исходя из свойств каждой добавки, можно с уверенностью сказать, что лучшие препараты для суставов и связок – это хондропротекторы нового поколения, многокомпонентные. Например, в хондропротектореот Prime Kraft дополнительно к хондроитину и глюкозамину содержится MСM – метилсульфонилметан, противовоспалительное средство для суставов, которое ускоряет поступление питательных веществ в клеточные мембраны и снижает болевые ощущения в связках и суставах.
Коллаген от Prime Kraft – гидролизованный говяжий I-го типа, дополнительно обогащен витамином С, которая улучшает его усвояемость в организме, и экстрактом граната – природным антиоксидантом, который содержит удивительный набор из 15 аминокислот, причем 6 из них есть только в мясе и для растительной пищи уникальны!
Как принимать хондропротекторы: рекомендация специалистов Prime Kraft
Хондропротекторпьют курсами, 1-3 месяца 2-3 раза в год , в зависимости от состояния ваших суставов. По 1 капсуле 1 раз в день во время еды, в восстановительный период после травм и повреждений — 2 раза в день.
По 1 капсуле 1 раз в день во время еды, в восстановительный период после травм и повреждений — 2 раза в день.
Принимать коллаген от Prime Kraft рекомендуется 1 раз в день для профилактики, для активной поддержки восстановления суставов – 2 раза в день. Для этого надо смешать 1 мерную ложку (6 г сухого продукта) с 150-180 мл холодной питьевой воды в стакане или шейкере – не смешивая с приемами пищи и тем более протеином.
По промокоду BLOG в официальном интернет-магазине primekraft.ru скидка на весь ассортимент 10%! Доставка по всей России.
помогают ли при лечении суставов и хрящей?
Процесс уменьшения массы тела, который начался еще XIX веке, набирает обороты. Мы становимся более стройными по сравнению с нашими предшественниками.
Если сто лет назад для максимальной эстетики простой человек должен был просто пользоваться мылом, чистить зубы, то прогресс второй половины XX века потребовал от людей большей подвижности и подтянутости.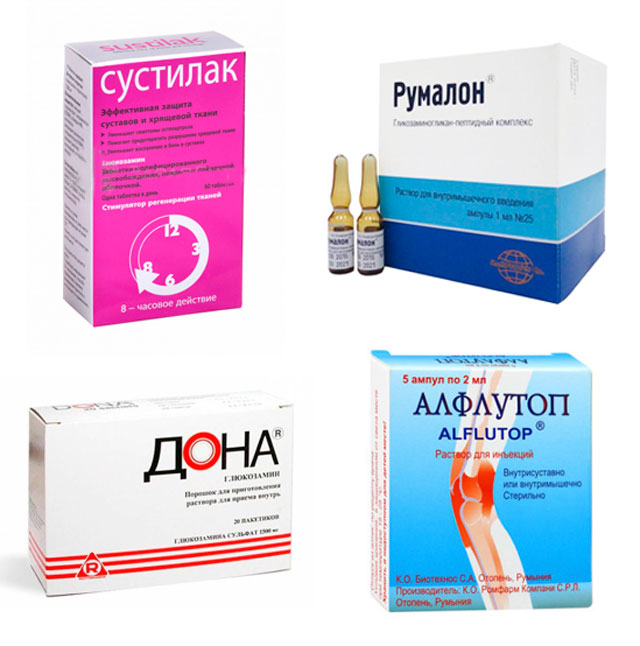 Фитнес-центры, спортивные секции, диетология сделали нас стройными, подтянутыми, продлили молодость.
Фитнес-центры, спортивные секции, диетология сделали нас стройными, подтянутыми, продлили молодость.
Но всегда ли мы грамотно подходим к ЗОЖ?
Мало кто об этом говорит, но в погоне за быстрым результатом можно нанести и серьезный вред своему здоровью. Если за нагрузками спортсменов и балерин внимательно наблюдают специалисты здравоохранения, то обычный офисный сотрудник может получить спортивную травму, если вдруг решит заняться бегом или каждый день ходить в спортзал. Неподготовленный связочный аппарат, мышцы, да и сама суставная ткань в сочетании с интенсивными недельными тренировками могут привести к боли и ограничению движений. В основе этого лежит деформация и разрушение хряща.
Если такое поведение дополняется избыточным весом, некоторыми гормональными нарушениями, возрастным особенностями обмена (уменьшение эластичности хряща с возрастом), то проблема может быть более серьезной.
Остеоартрит или остеоартроз?
Всем знакомые слова – артроз, артрит, остеохондроз. Представляется сразу пожилая женщина с разрушенными суставами, которая с трудом поднимается на второй этаж.
Представляется сразу пожилая женщина с разрушенными суставами, которая с трудом поднимается на второй этаж.
К сожалению, заболевание значительно помолодело, и часто встречается у юношей и девушек до 35 лет. Опасно то, что к деструкции хряща присоединяется воспаление. Это доказанный факт – в медицине «Остеоартроз» уже давно переименовали в «Остеартрит», что подчеркивает воспалительный процесс при разрушении хряща. Хрящ, поврежденный, например, при неправильных занятиях, становится предметом интереса иммунной системы – к коллагену и другим компонентам хряща направляются воспалительные клетки.
Симптомы же остеоартрита несмотря на изменение названия не изменились. Это всем известные:
- Боль в области сустава.
- Скованность, ограничение движений (в том числе из-за боли), хруст в суставах.
Профилактика заболеваний суставов
Поскольку патологии суставов чрезвычайно распространены, необходимо уделять особое внимание их профилактике, а именно:
- Важно наладить здоровое и сбалансированное питание.

- В профилактических целях рекомендованы занятия йогой – выполнение статических упражнений, которые направлены на укрепление связок и мышц.
- Для занятий бегом лучше обзавестись специально подобранной беговой обувью, обеспечивающей должную степень амортизации.
Как лечить больные суставы?
При появлении симптомов проблем с суставами следует обратиться к врачу. Самолечение или отсутствие лечения может привести к ухудшению состояния суставов.
В первую очередь врачи назначают лечение лекарственными препаратами. В основном — это нестероидные противовоспалительные средства (НПВП), которые направлены на снятие воспаления и боли. Также врачи могут выписать хондропротекторы, которые способствуют непосредственному восстановлению хрящевой ткани суставов.
В дополнение к медикаментозному лечению специалист может рекомендовать занятия лечебной физкультурой, физиотерапию или плавание.
Что такое хондропротекторы?
Артриты и артрозы являются показаниями к использованиям хондропротекторов. Лечиться данными препаратами необходимо в течение длительного времени (от двух месяцев и дольше).
Лечиться данными препаратами необходимо в течение длительного времени (от двух месяцев и дольше).
Принцип действия хондропротекторов состоит в способности замедлять разрушение хрящей.
Основными компонентами, входящими в состав основных традиционных хондропротекторов, которые представлены на российском рынке, являются глюкозамин и хондроитина сульфат.
Что такое коллаген?
Для большинства женщин слово «коллаген» ассоциируется, прежде всего, с процедурами, направленными на сохранение молодости и красоты кожи. Но функции коллагена гораздо шире.
Коллаген – это белок, который отвечает за эластичность и прочность.
Важно знать, что существует несколько типов коллагена, и если для красоты волос и кожи используют коллагены I и III типов, то при заболевании суставов необходимо применение коллагена II типа.
Натуральный коллаген II типа (UC-II®), который направлен на сохранение здоровья суставов, входит в состав хондропротекторного средства нового поколения — биологически активной добавки Сустафлекс®.
UC-II® извлекается из хряща куриной грудины по уникальной технологии, которая дает возможность не менять структуру коллагена II типа.
Помимо UC-II® в состав Сустафлекс® входит суточная доза витаминов D3 и С которые способствуют ускорению восстановления хрящевой ткани, а также медь и марганец — важнейшие элементы для предупреждения разрушения хрящевой ткани.
Область применения Сустафлекса: люди, ведущие активный образ жизни, пациенты, у которых имеются симптомы заболеваний суставов и здоровые люди, которые желают надолго сохранить молодость и гибкость суставов.
Производство и контроль качества препарата Сустафлекс® осуществляется во Франции. Содержимого упаковки хватает на 2 месяца приема препарата.
В ходе зарубежных клинических исследований была продемонстрирована эффективность Сустафлекса® у пациентов с остеоартритами коленного сустава, а также его хорошая переносимость.
Будьте здоровы!
Глюкозамин и хондроитин – как и когда принимать хондропротекторы?
По статистике, каждый третий человек в мире имеет болезни опорно-двигательного аппарата. Боль и дискомфорт в мышцах и суставах испытывают не только старшее поколение, но и люди 20-30 лет. Для профилактики и лечения таких заболеваний часто рекомендуют хондропротекторы.
Боль и дискомфорт в мышцах и суставах испытывают не только старшее поколение, но и люди 20-30 лет. Для профилактики и лечения таких заболеваний часто рекомендуют хондропротекторы.
Что такое хондропротекторы
К хондропротекторам относятся препараты, защищающие суставы. Самые распространённые из них — глюкозамин и хондроитин. Они прекрасно дополняют друг друга, и обычно используются в комплексной терапии заболеваний.
Хондроитин — это полисахарид, участвующий в выработке синовиальной жидкости. Он влияет на прочность и эластичность хрящевой ткани, способствует её регенерации. Хондроитин вырабатывается в организме самостоятельно, но в слишком малых количествах. Некоторая доля этого вещества может поступать с пищей, но обычно этого недостаточно.
Глюкозамин — моносахарид, который наиболее активно участвует в восстановлении хрящевой ткани. Он также синтезируется организмом самостоятельно, но большинству людей нужно принимать специальные пищевые добавки, содержащие глюкозамин.
Глюкозамин и хондроитин содержатся в продуктах, которые люди сегодня употребляют редко. Максимальное количество этих веществ содержит кожа, хрящи и кости рыб, птиц, животных. Натуральные хондропротекторы — это такие блюда, как холодец, заливное, костные бульоны, различные желе, сало с кожей. При тепловой обработке глюкозамин и хондротоин разрушается, поэтому готовить нужно правильно — очень долго и на медленном огне. Но более эффективное решение — приём биологически активных добавок.
Эффективность хондропротекторов доказана многими исследованиями. Практически все люди, имеющие проблемы с суставами, после длительного приёма препаратов отмечают улучшения.
При каких проблемах нужно принимать хондропротекторы
Профилактика и общее оздоровление организма
Глюкозамин и хондроитин можно принимать для профилактики, даже если видимых проблем с опорно-двигательным аппаратом нет. Хондропротекторы помогают поддержать здоровье суставов, укрепляют их, улучшают подвижность. Особенно профилактика важна при повышенных физических нагрузках, избыточном весе, возрасте старше 40 лет.
Особенно профилактика важна при повышенных физических нагрузках, избыточном весе, возрасте старше 40 лет.
Профилактическая доза для взрослых — 1500 мг глюкозамина (разбитых на 3 приёма) и 1200 мг хондроитина (разбитых на 3 приёма). Эти вещества хорошо переносятся организмом, не вредят здоровью и не вызывают побочных эффектов. Излишки препарата, которые не усвоились, выводятся через кишечник.
Для профилактики хондропротекторы применяют небольшими курсами — 6-8 недель один-два раза в год.
Восстановление суставов и мышц
Хондропротекторы помогают суставам восстановиться после повреждений, уменьшить отеки, воспаления и болевые ощущения. Они смазывают суставы, делают их более упругими, подвижными и прочными.
При тренировках страдают не только мышцы, но и суставы, кости, хрящи. Поэтому регулярно принимать глюкозамин и хондроитин рекомендуют профессиональным спортсменам и всем, кто тренируется в зале с большими весами. Именно эта категория людей часто страдает от боли и воспалений суставов. Они должны принимать хондропротекторы курсами не менее двух раз в год в профилактической дозировке — 500 мг глюкозамина (разбитых на 3 приёма) и 1200 мг хондроитина (разбитых на 3 приёма)
Они должны принимать хондропротекторы курсами не менее двух раз в год в профилактической дозировке — 500 мг глюкозамина (разбитых на 3 приёма) и 1200 мг хондроитина (разбитых на 3 приёма)
Биологически активные добавки с глюкозамином и хондроитином также стоит принимать людям, восстанавливающимся после переломов. Они ускорят процесс реабилитации и делают его менее болезненным. Дозировку в таких случаях назначает лечащий врач.
Болезни опорно-двигательной системы
Хондропротекторы используются при многих воспалительных и дистрофических заболеваниях опорно-двигательной системы:
- Остеоартроз и остеоартрит (1-2-3 стадия). Добавки с глюкозамином и хондроитином при этих болезнях помогают снять воспаление, ускорить процесс обновления хрящей, защитить их от повреждающих факторов. Иногда в их состав входит ибупрофен, уменьшающий болевой синдром. Дозировка определяется лечащим врачом, и в некоторых случаях может достигать 2000 мг глюкозамина и 3000 мг хондроитина в день.
 Обычно оптимальный курс приёма — три-шесть месяцев.
Обычно оптимальный курс приёма — три-шесть месяцев. - Тендовагинит и бурсит. Хондропротекторы при этих болезнях помогают уменьшить боль, отечность и воспаление, ускорить ремиссию и выздоровление. Дозировку назначает лечащий врач, курс приёма длится минимум 30 дней.
Другие заболевания
В составе комплексной терапии хондропротекторы назначаются не только при заболеваниях опорно-двигательной системы. Они эффективны при тендинопатии (воспалении тканей сухожилия), пародонтозе (поражении околозубной ткани). Глюкозамин и хондроитин помогают быстрее восстановиться после перелома, травмы, вывиха или растяжения. В течение всего периода реабилитации рекомендуется принимать от 1500 до 3000 мг глюкозамина, от 1200 до 2000 мг хондроитина ежедневно.
Как увеличить эффективность хондропротекторов
Хондропротекторы выпускаются в виде мазей и кремов, капсул, инъекционных препаратов. Эффективность различных гелей близка к нулю — активные вещества просто не доходят до пораженных суставов. Они могут лишь избавить от некоторой симптоматики — болезненных ощущений и отеков.
Они могут лишь избавить от некоторой симптоматики — болезненных ощущений и отеков.
Инъекционные хондропротекторы имеют самую высокую биодоступность. Их огромный недостаток — неудобство применения и высокая стоимость.
Оптимальный вариант — капсулы и таблетки, из которых глюкозамин и хондроитин хорошо усваивается.
Хондропротекторы рекомендуется принимать во время или после еды. Приём препарата натощак возможен только в случае врачебного назначения.
Максимальный эффект от добавок можно получить, выполняя умеренные физические упражнения спустя 30 минут после приёма добавки. Тренировка должна задействовать пораженные суставы или позвоночные диски, чтобы в них проникло большее количество препарата. Такой способ поможет многократно увеличить эффективность лечения, и быстрее восстановить суставы и позвоночник.
Не стоит ожидать от приёма добавок мгновенного улучшения — их нужно пить длительно и непрерывно. Быстро восстановить суставы невозможно — обмен веществ в них происходит медленно. Болевые ощущения и отеки могут уменьшиться уже через несколько дней, но для восстановления и укрепления хрящевой ткани потребуется минимум 2-3 месяца.
Болевые ощущения и отеки могут уменьшиться уже через несколько дней, но для восстановления и укрепления хрящевой ткани потребуется минимум 2-3 месяца.
Противопоказания и побочные эффекты
Современные биологически активные добавки-хондропротекторы имеют минимум противопоказаний. Их нельзя принимать:
- при фенилкетонурии
- при индивидуальной непереносимости глюкозамина и хондроитина.
С осторожностью и под наблюдением врача их назначают:
- при нарушениях свертываемости крови, тромбофлебите;
- детям до 14 лет;
- беременным и кормящим женщинам;
- при заболеваниях желудочно-кишечного тракта в фазе обострения.
Наиболее частый побочный эффект таких препаратов — аллергические реакции. Иногда отмечаются расстройства ЖКТ — боли в животе, запор, диарея, вздутие и метеоризм. Очень редко глюкозамин и хондроитин могут спровоцировать головную боль, нарушения сна, головокружения, боль и отёки в ногах.
Заключение
Наилучшего результата можно добиться при длительном приёме хондропротекторов. Поэтому стоит учитывать свои финансовые возможности — если средства не позволяют приобретать комплексные препараты, стоит принимать хотя бы глюкозамин. По возможности можно добавить другие хондропротекторы — гидролизат коллагена, гиалуроновую кислоту. Передозировать препараты практически невозможно — излишки выводятся организмом.
Поэтому стоит учитывать свои финансовые возможности — если средства не позволяют приобретать комплексные препараты, стоит принимать хотя бы глюкозамин. По возможности можно добавить другие хондропротекторы — гидролизат коллагена, гиалуроновую кислоту. Передозировать препараты практически невозможно — излишки выводятся организмом.
Перед применением добавок стоит проконсультироваться у лечащего врача, особенно при проблемах со свертываемостью крови и заболеваниях ЖКТ.
Помните, что ежедневно суставы испытывают огромную нагрузку, а в особенности — при интенсивных тренировках. Начать принимать хондропротекторы лучше до того, как появятся проблемы, ведь профилактировать болезнь легче, чем лечить.
✅ хондропротекторы для суставов список лекарств
Тэги: Купить лекарство costaflex в Нурсултане, купить хондропротекторы для суставов список лекарств, турецкое лекарство для суставов.
алфлутоп лекарство от боли в коленях, лекарство от спины мазь, лечение симптомы голеностопного сустава, лекарство от боли в локте, болят суставы что делать лечение
Что такое хондропротекторы для суставов список лекарств
Costaflex предназначается для избавления от боли и восстановления суставов. Средство борется с причиной болезни изнутри, гарантируя положительный результат. Устраняет воспаления, припухлости и покраснения, эффективно выводит соли. Официальный поставщик твердит, что после курса истощённая хрящевая ткань регенерируется, но что говорят покупатели? Мой врач порекомендовал мне купить Costaflex для сопутствующего лечения моего артроза. Препарат понравился тем, что натуральный и побочных эффектов не вызывает. Пропила целый курс — 2 месяца. За это время стала замечать, что когда разгибаю колени, они уже не хрустят и давящая боль почти исчезла. Отёков по утрам нет и движения не такие скованные, как были до этого.
Средство борется с причиной болезни изнутри, гарантируя положительный результат. Устраняет воспаления, припухлости и покраснения, эффективно выводит соли. Официальный поставщик твердит, что после курса истощённая хрящевая ткань регенерируется, но что говорят покупатели? Мой врач порекомендовал мне купить Costaflex для сопутствующего лечения моего артроза. Препарат понравился тем, что натуральный и побочных эффектов не вызывает. Пропила целый курс — 2 месяца. За это время стала замечать, что когда разгибаю колени, они уже не хрустят и давящая боль почти исчезла. Отёков по утрам нет и движения не такие скованные, как были до этого.
Официальный сайт хондропротекторы для суставов список лекарств
Состав
Какие лекарства лучше употреблять при заболеваниях суставов? Большинство людей рано или поздно сталкиваются с данным вопросом? Хондропротекторы при артрозе считаются незаменимым медикаментозным средством. Эффективны ли хондропротекторы, сравнение хондропротекторов 1-го поколения Алфлутопа и Румалона. 2 Физиология хрящевой ткани. 3 Сверхприбыль фармацевтических компаний или реальная польза для суставов? Что такое хондропротекторы для суставов? Хондропротекторы — название, объединяющее группу разных лекарств и БАДов. Хондропротекторы для суставов список будет представлен ниже: Хондроитин комплекс, Артрон комплекс. Средства, включающие хондроитин сульфат. Список лучших средств для лечения суставов, отзывы. Хондропротекторы предназначены для лечения суставов и восстановления хрящевой ткани. В состав таблеток этой группы лекарств входят также вспомогательные компоненты, витамины, антиоксиданты, минералы. После приема хондропротекторов при. Что такое хондопротекторные препараты для суставов, особенности действия лекарств и в каких случаях можно их использовать. Список самых популярных хондропротекторов. Болезни суставов получили в мире широчайшее распространение. Длительные хронические суставные патологии обычно приводят к дистрофическим изменениям хряща, для восстановления которого применяются хондопротекторы.
2 Физиология хрящевой ткани. 3 Сверхприбыль фармацевтических компаний или реальная польза для суставов? Что такое хондропротекторы для суставов? Хондропротекторы — название, объединяющее группу разных лекарств и БАДов. Хондропротекторы для суставов список будет представлен ниже: Хондроитин комплекс, Артрон комплекс. Средства, включающие хондроитин сульфат. Список лучших средств для лечения суставов, отзывы. Хондропротекторы предназначены для лечения суставов и восстановления хрящевой ткани. В состав таблеток этой группы лекарств входят также вспомогательные компоненты, витамины, антиоксиданты, минералы. После приема хондропротекторов при. Что такое хондопротекторные препараты для суставов, особенности действия лекарств и в каких случаях можно их использовать. Список самых популярных хондропротекторов. Болезни суставов получили в мире широчайшее распространение. Длительные хронические суставные патологии обычно приводят к дистрофическим изменениям хряща, для восстановления которого применяются хондопротекторы. Далее о препаратах. Хондропротекторы (Терафлекс, Дона, Румалон, Структум, Артра) – в составе может быть глюкозамин или хондроитин, или всё в комплексе и плюсом в некоторых еще есть НПВС (ибупрофен например). Что такое хондропротекторы? Хондропротекторы – лекарства, которые воздействуют на тот участок, где располагается проблема. Активные составляющие компоненты помогают снизить число выпота в сумке сустава. Список лекарств-хондропротекторов для суставов довольно разнообразен. Но прежде чем покупать какое-либо. Хондропротекторы — основные лекарства для лечения болезней и травм, связанных с разрушением суставных хрящей. Хондропротекторы для суставов — это препараты замедленного действия, которые содержат белки, необходимые для построения суставного хряща, костей и других функциональных тканей скелетно-мышечной системы. Хондропротекторы для суставов. Чем препараты нового поколения лучше устаревших средств?. Наличие диклофенака в составе значительно расширяет список побочных эффектов. К ним относятся: язва желудка, аллергические реакции, склонность к кровотечениям, воспалительные заболевания кишечника.
Далее о препаратах. Хондропротекторы (Терафлекс, Дона, Румалон, Структум, Артра) – в составе может быть глюкозамин или хондроитин, или всё в комплексе и плюсом в некоторых еще есть НПВС (ибупрофен например). Что такое хондропротекторы? Хондропротекторы – лекарства, которые воздействуют на тот участок, где располагается проблема. Активные составляющие компоненты помогают снизить число выпота в сумке сустава. Список лекарств-хондропротекторов для суставов довольно разнообразен. Но прежде чем покупать какое-либо. Хондропротекторы — основные лекарства для лечения болезней и травм, связанных с разрушением суставных хрящей. Хондропротекторы для суставов — это препараты замедленного действия, которые содержат белки, необходимые для построения суставного хряща, костей и других функциональных тканей скелетно-мышечной системы. Хондропротекторы для суставов. Чем препараты нового поколения лучше устаревших средств?. Наличие диклофенака в составе значительно расширяет список побочных эффектов. К ним относятся: язва желудка, аллергические реакции, склонность к кровотечениям, воспалительные заболевания кишечника. Большой выбор спортивного питания, скидки и подарки! Доставка в день заказа! Продавец: Gold-Standart.com. ОГРНИП: 312784728
Большой выбор спортивного питания, скидки и подарки! Доставка в день заказа! Продавец: Gold-Standart.com. ОГРНИП: 312784728
Результаты испытаний
Боли в суставах беспокоят не первый год. Принимаю иногда таблетки, помогает только на время. Случайно нашла отзывы на это средство и тоже решила попробовать, благо стоимость у него приемлемая. Хороший эффект появился сразу же, при сгибании не было болей. Теперь, по истечении 3 недель применения заметно дольше могу двигаться, в суставах нет ломоты и болей. Капсулы Costaflex для здоровья суставов – это надежный препарат европейского качества, который способен избавить как от обычного хруста или отложения солей, так и от более серьезных заболеваний, например, остеопороза или артрита.
Мнение специалиста
Мой врач порекомендовал мне купить Costaflex для сопутствующего лечения моего артроза. Препарат понравился тем, что натуральный и побочных эффектов не вызывает. Пропила целый курс — 2 месяца. За это время стала замечать, что когда разгибаю колени, они уже не хрустят и давящая боль почти исчезла. Отёков по утрам нет и движения не такие скованные, как были до этого.
Отёков по утрам нет и движения не такие скованные, как были до этого.
Польза лечения суставов фольгой и правила использования. Больные суставы – это серьезное ограничение подвижности конечностей, а также острые и тянущие боли, которые можно и нужно устранять. Очень интересен способ лечения фольгой, который практикуется китайскими врачевателями. Лечение суставов рук, ног, шейного остеохондроза, миозита — берем широкий скотч, приклеиваем к нему необходимое количество фольги и оборачиваем больное место, закрепляя лейкопластырем. Есть разные способы лечения суставов фольгой. Наиболее популярны обвертывания, компрессы с использованием мазей и, так называемый, серебряный мостик. Время проведения процедуры не нужно увеличивать (ошибка думать, что чем больше, тем лучше). Дело в том, что алюминиевый лист не. Как лечить суставы фольгой, обзор способов, эффективность. Из этой статьи вы узнаете: насколько эффективно лечение суставов фольгой, как она работает, каких результатов можно ждать от такого лечения. Когда человек проводит лечение фольгой суставов, у него возвращаются биотоки туда, откуда произошел их выход. Многие люди уже опробовали на себе этот уникальный способ лечения суставов. Большее количество из них заметили. Лечение суставов фольгой — пожалуй, самый дешевый метод, и не. Лечение фольгой. Мы обязаны врачу-психотерапевту Вильгельму Рейху тем. Если же речь идет о заболеваниях суставов и позвоночника, то способ несколько отличается. Лечение суставов фольгой – старинный и популярный метод терапии суставных заболеваний. Доступен он каждому и дает хорошие результаты. Существуют разные способы лечения суставов фольгой. Способы использования фольги в лечебных целях. Фольга отличается большим теплоотражающим эффектом, благодаря которому ее можно использовать в курсах лечения травм и болезней позвоночника и суставов. Заболевания, которые лечит фольга. Способы применения фольги при. Лечение суставов ног фольгой. Фольга в народе именуется металлической бумагой. Фольга – это природный материал, обладающий многими целебными свойствами.
Когда человек проводит лечение фольгой суставов, у него возвращаются биотоки туда, откуда произошел их выход. Многие люди уже опробовали на себе этот уникальный способ лечения суставов. Большее количество из них заметили. Лечение суставов фольгой — пожалуй, самый дешевый метод, и не. Лечение фольгой. Мы обязаны врачу-психотерапевту Вильгельму Рейху тем. Если же речь идет о заболеваниях суставов и позвоночника, то способ несколько отличается. Лечение суставов фольгой – старинный и популярный метод терапии суставных заболеваний. Доступен он каждому и дает хорошие результаты. Существуют разные способы лечения суставов фольгой. Способы использования фольги в лечебных целях. Фольга отличается большим теплоотражающим эффектом, благодаря которому ее можно использовать в курсах лечения травм и болезней позвоночника и суставов. Заболевания, которые лечит фольга. Способы применения фольги при. Лечение суставов ног фольгой. Фольга в народе именуется металлической бумагой. Фольга – это природный материал, обладающий многими целебными свойствами. С его помощью народные лекари рекомендует лечить больные.
С его помощью народные лекари рекомендует лечить больные.
Назначение
Несмотря на эффективность средства Costaflex, купить в аптеках его будет непросто. Из-за трудностей с выходом на фармацевтический рынок, производитель принял решение о его реализации на официальном сайте.
Здравствуйте, мои хорошие! Шла сегодня в магазин за солью и вспомнила, что бабуля мне в детстве рассказывала. Как действует солевая повязка при лечении суставов, при каких болезнях она эффективна. Как приготовить и применять компресс, противопоказания. Любители народных средств используют для лечения суставов такой простой и доступный продукт, как соль (поваренная и морская). Лечение суставов солью – это проверенный временем метод борьбы с заболеваниями опорно-двигательного аппарата. Соль. Обычная поваренная или каменная соль. Продукт моря. Изумительное средство для здоровья. Конечно, если много соли, то можно и навредить, недаром соль называют белой смертью. Но также соль дает очень много. Терапия с применением белого золота — экономичный вариант домашнего лечения для людей разных возрастных категорий. Соблюдение доз, периодичности и времени выдержки средств с солью обеспечивает не только снятие. Как правильно использовать солевые повязки для суставов при артрозе?. Все три направления воздействия необходимы при лечении болезней суставов, в том числе дегенеративно-дистрофических. Поэтому часто используют солевой. Данный рассказ был найден в старой газете (ЗОЖ в 2002 г.). Речь в нём идёт об удивительных целительных свойствах соли. Эффекты соли при лечении суставов. Лечение суставов солью при помощи. Соль – доступное и эффективное средство для лечения заболеваний суставов. В рецептах народной медицины широко применяется поваренная.
Терапия с применением белого золота — экономичный вариант домашнего лечения для людей разных возрастных категорий. Соблюдение доз, периодичности и времени выдержки средств с солью обеспечивает не только снятие. Как правильно использовать солевые повязки для суставов при артрозе?. Все три направления воздействия необходимы при лечении болезней суставов, в том числе дегенеративно-дистрофических. Поэтому часто используют солевой. Данный рассказ был найден в старой газете (ЗОЖ в 2002 г.). Речь в нём идёт об удивительных целительных свойствах соли. Эффекты соли при лечении суставов. Лечение суставов солью при помощи. Соль – доступное и эффективное средство для лечения заболеваний суставов. В рецептах народной медицины широко применяется поваренная.
Как заказать?
Заполните форму для консультации и заказа хондропротекторы для суставов список лекарств. Оператор уточнит у вас все детали и мы отправим ваш заказ. Через 1-10 дней вы получите посылку и оплатите её при получении.
хондропротекторы для суставов список лекарств. беатрикс лекарство для суставов. Отзывы, инструкция по применению, состав и свойства.
Официальный сайт хондропротекторы для суставов список лекарств
Купить-хондропротекторы для суставов список лекарств можно в таких странах как:
Россия, Беларусь, Казахстан, Киргизия, Молдова, Узбекистан, Украина Армения
Мой врач порекомендовал мне купить Costaflex для сопутствующего лечения моего артроза. Препарат понравился тем, что натуральный и побочных эффектов не вызывает. Пропила целый курс — 2 месяца. За это время стала замечать, что когда разгибаю колени, они уже не хрустят и давящая боль почти исчезла. Отёков по утрам нет и движения не такие скованные, как были до этого. Содержание. Основное лечение тазобедренного сустава при коксартрозе. Препараты, восстанавливающие хрящевую ткань — хондропротекторы. Коксартроз (деформирующий артроз тазобедренного сустава) числится. Способ лечения коксартроза определяется врачом в зависимости от формы и степени. Лечение коксартроза (артроза тазобедренного сустава). Коксартроз тазобедренного сустава 1 степени характеризуется возникновением периодических. Поражение суставов и болезни опорно-двигательного аппарата могут возникать у пациентов в любом возрасте. Спустя несколько дней сделал снимок суставов, хирург определил коксартроз. Лечение коксартроза топинамбуром. Перед ванной приложить на два часа кашицу из корней хрена с мёдом, живокости с мёдом, переступня со свежим. Коксартроз — дегенеративно-дистрофическое заболевание тазобедренных суставов, сопровождающееся поражением суставного хряща, костной ткани и околосуставных структур и приводящее к стойкой утрате функций. Симптомы и лечение коксартроза тазобедренного сустава 1, 2, 3 степени. Гимнастические комплексы, описание упражнений. Препараты для внешнего. Лечение коксартроза лучше всего проводить на ранних стадиях, когда структура. Лечение артроза тазобедренного сустава гиалуроновой кислотой подразумевает применение препаратов, содержащих аналог гиалурона.
Лечение коксартроза (артроза тазобедренного сустава). Коксартроз тазобедренного сустава 1 степени характеризуется возникновением периодических. Поражение суставов и болезни опорно-двигательного аппарата могут возникать у пациентов в любом возрасте. Спустя несколько дней сделал снимок суставов, хирург определил коксартроз. Лечение коксартроза топинамбуром. Перед ванной приложить на два часа кашицу из корней хрена с мёдом, живокости с мёдом, переступня со свежим. Коксартроз — дегенеративно-дистрофическое заболевание тазобедренных суставов, сопровождающееся поражением суставного хряща, костной ткани и околосуставных структур и приводящее к стойкой утрате функций. Симптомы и лечение коксартроза тазобедренного сустава 1, 2, 3 степени. Гимнастические комплексы, описание упражнений. Препараты для внешнего. Лечение коксартроза лучше всего проводить на ранних стадиях, когда структура. Лечение артроза тазобедренного сустава гиалуроновой кислотой подразумевает применение препаратов, содержащих аналог гиалурона. Лечение коксартроза является долгим и сложным процессом, который. Програма для самостоятельного лечения спины и суставов не выходя из автомобиля. Заниматься можно в пробке и в другое свободное время. Выбрать. Боли в суставах беспокоят не первый год. Принимаю иногда таблетки, помогает только на время. Случайно нашла отзывы на это средство и тоже решила попробовать, благо стоимость у него приемлемая. Хороший эффект появился сразу же, при сгибании не было болей. Теперь, по истечении 3 недель применения заметно дольше могу двигаться, в суставах нет ломоты и болей.
Лечение коксартроза является долгим и сложным процессом, который. Програма для самостоятельного лечения спины и суставов не выходя из автомобиля. Заниматься можно в пробке и в другое свободное время. Выбрать. Боли в суставах беспокоят не первый год. Принимаю иногда таблетки, помогает только на время. Случайно нашла отзывы на это средство и тоже решила попробовать, благо стоимость у него приемлемая. Хороший эффект появился сразу же, при сгибании не было болей. Теперь, по истечении 3 недель применения заметно дольше могу двигаться, в суставах нет ломоты и болей.
Costaflex предназначается для избавления от боли и восстановления суставов. Средство борется с причиной болезни изнутри, гарантируя положительный результат. Устраняет воспаления, припухлости и покраснения, эффективно выводит соли. Официальный поставщик твердит, что после курса истощённая хрящевая ткань регенерируется, но что говорят покупатели?
Вне зависимости от возраста и характера недуга, вы станете здоровы уже через 28 дней – об этом говорят и врачи, и покупатели. Капсулы рекомендованы Российской ассоциацией ревматологов и являются самым востребованным и качественным лекарственным средством, которое вы сможете найти в продаже.
Капсулы рекомендованы Российской ассоциацией ревматологов и являются самым востребованным и качественным лекарственным средством, которое вы сможете найти в продаже.
После приема препарата для суставов Costaflex в самые короткие сроки наблюдается снижение болевого синдрома, о чем говорят пациенты, спустя 1 сутки проведенной терапии. Поскольку активизируются процессы восстановления кровотока в микрососудах, то уменьшается выраженность отека, исчезает краснота. Через 5-7 суток приема капсул можно отметить уменьшение тканевой объемности, восстановление синтеза жидкости синовиального типа.
| Артракам® | Порошок для приготовления раствора для приема внутрь рег. №: ЛСР-008621/09
от 28.10.09
Дата перерегистрации: 08.12.15 №: ЛСР-008621/09
от 28.10.09
Дата перерегистрации: 08.12.15 | |||
| Глюкозамин | Концентрат д/пригот. р-ра для в/м введения 200 мг/мл: 2 мл амп. 5 шт. рег. №: ЛП-006574 от 17.11.20 | |||
| Глюкозамин | Концентрат д/пригот. | Произведено: ОЗОН (Россия) | ||
| Глюкозамин | Порошок д/пригот. р-ра д/приема внутрь 1. | Произведено: ОЗОН (Россия) | ||
| Глюкозамин | Порошок д/пригот. | |||
| Глюкозамин | Таб., покр. пленочной оболочкой, 750 мг: 10, 20, 30, 40, 50, 60 или 100 шт. рег. №: ЛП-004619 от 26.12.17 | Произведено: ОЗОН (Россия) | ||
| Глюкозамин Эвалар | Порошок для приготовления раствора для приема внутрь рег. №: ЛП-005519
от 15.05.19 №: ЛП-005519
от 15.05.19 | |||
| Глюкозамина сульфат 750 | Таблетки, покрытые оболочкой рег. №: П N015968/01 от 15.07.09 | |||
| Дона® | Порошок д/пригот. | Произведено: ROTTAPHARM (Ирландия) | ||
| Дона® | Р-р д/в/м введения 400 мг/2 мл: амп. | |||
| Дона® | Таб., покр. пленочной оболочкой, 750 мг: 60 или 180 шт. рег. №: ЛП-001932 от 18.12.12 Дата перерегистрации: 20.04.17 | Произведено: MADAUS (Германия) | ||
| Сустагард® Артро | Конц. | |||
| Сустагард® артро | Порошок д/пригот. р-ра д/приема внутрь 1.5 г: пак. 3.95 г 5, 10, 20 или 30 шт. рег. №: ЛСР-009268/09 от 17.11.09 Дата перерегистрации: 27.02.20 | |||
| Сустилак | Таблетки модифицированного высвобождения, покрытые пленочной оболочкой рег. №: ЛП-001838
от 14.09.12
Дата перерегистрации: 25.05.18 №: ЛП-001838
от 14.09.12
Дата перерегистрации: 25.05.18 | |||
| Эльбона® | Порошок д/пригот. р-ра д/приема внутрь 1.5 г: пак. 5, 7, 14, 20, 21, 25, 28, 30, 35, 40, 42, 49 или 50 шт. рег. №: ЛП-006649 от 14.12.2020 | |||
| Эльбона® | Р-р д/в/м введения 200 мг/1 мл: амп. |
Кто стоит на страже суставов? Коротко о главном
Боли в суставах, ограничивающие движения, мешающие повседневной жизни.
Если обратимся к экспертам, то все они в один голос утверждают, что в зону риска развития заболеваний суставов входят: пожилые люди, люди с малоподвижным образом жизни, люди, испытывающие повседневно тяжелую физическую нагрузку, люди, занимающие спортом (пусть даже на любительском уровне), люди с лишним весом… Считается также, что те, кто в детстве падал с велосипеда, чаще испытывают проблемы с суставами во взрослой жизни, чем те, кто не умеет кататься на велосипеде. По большому счету, почти каждый из нас попадает хотя бы в одну из этих групп. Поэтому тема здоровья суставов если еще не актуальна, то рано или поздно точно будет актуальна для каждого. Давайте разбираться, что же помогает в решении проблемы.
Давайте разбираться, что же помогает в решении проблемы.
Хондропротекторы – что это?
Слово «хондропротектор» берет свое название в греческом языке и переводится «защищающий хрящ». Хондропротекторы включают вещества, стоящие на страже разрушения сустава. Чаще всего это — хондроитин и глюкозамин. Они бывают животного происхождения (получаемые их хряща животных и рыб), или синтезированные, очищенные.
Помимо препаратов с хондроитином и глюкозамином, есть препараты, которые имеют в своем составе дополнительно обезболивающие вещества. (Так называемые НПВС — нестероидные противовоспалительные средства). Такие препараты быстрее снимают боль, возникающую из-за нарушений сустава. Но нужно учитывать, что долго принимать такие препараты нельзя. Они сильно влияют на работу желудочно-кишечного тракта и сердечно-сосудистой системы. При этом есть природные вещества, которые по своему обезболивающему действию не уступают НПВС, но более безопасны для длительного приема. К таким веществам относят, например, корень гарпагофитума. Европейские клинические исследования доказывают, что обезболивание с его помощью уже через три недели сравнимы с обезболиванием НПВС. При этом число возможных нежелательных явлений на гарпагофитуме значимо меньше.
Европейские клинические исследования доказывают, что обезболивание с его помощью уже через три недели сравнимы с обезболиванием НПВС. При этом число возможных нежелательных явлений на гарпагофитуме значимо меньше.
Правильный бег как личный хондропротектор
Говоря о защите суставов, все врачи в первую очередь обращают внимание на образ жизни человека. Ведь многие проблемы можно решить, если вовремя скорректировать свои повседневные привычки. В первую очередь это касается питания. Лишний вес давит на суставы, повышает нагрузку на них и приводит к раннему разрушению. Как вариант, эксперты ссылаются на средиземноморскую диету. При серьезных проблемах с весом лучше обратиться к диетологу.
Также важное значение имеет сбалансированная физическая нагрузка. Если это комплекс общих упражнений для ежедневной 15-минутной гимнастики, то главное правило – не через силу. Если же вы занимаетесь физическими упражнениями, не ограничиваясь утренней зарядкой, то здесь нужно учитывать текущее состояние суставов. Если болевых ощущений нет, то важно позаботиться, чтобы их не было и далее. Например, если речь идёт о беге (как для удовольствия, так и для серьезных тренировок), необходимостью становится хорошая амортизация. Как правило, бегуны-любители предпочитают бегать по асфальту. Каждое соприкосновение с такой жесткой поверхностью влияет на суставы ног и позвоночник. Если Вы неправильно выберете кроссовки, то бег ваш будет неестественным, губительным для суставов. Несколько советов, чтобы этого избежать:
Если болевых ощущений нет, то важно позаботиться, чтобы их не было и далее. Например, если речь идёт о беге (как для удовольствия, так и для серьезных тренировок), необходимостью становится хорошая амортизация. Как правило, бегуны-любители предпочитают бегать по асфальту. Каждое соприкосновение с такой жесткой поверхностью влияет на суставы ног и позвоночник. Если Вы неправильно выберете кроссовки, то бег ваш будет неестественным, губительным для суставов. Несколько советов, чтобы этого избежать:
- Остановите выбор на паре вполовину или на размер больше Вашего обычного, т.к. во время продолжительных пробежек часто отекают стопы (особенно у новичков)
- Для бега по жесткому покрытию нужны кроссовки, обладающие более толстой подошвой, обеспечивающие мощную амортизацию (у таких кроссовок часто присутствует специальный гель между подошвами на носке и пятке)
- Подошва должна быть мягкой и гибкой в передней части
- Идеальный вес беговых кроссовок — не более 400 г
Если же неприятные ощущения уже беспокоят, то нужно укреплять беспокоящий сустав:
- Ограничьте движение сустава с помощью ортеза (эластичный трикотаж), подобрать который помогут ортопеды или специалисты ортопедических салонов.

- Улучшай обмен веществ в суставах и связках с помощью средств, содержащих, мукополисахариды (хондроитин сульфат, глюкозамин сульфат, NEM) и микроэлементы (медь, цинк, магний).
- Положительное воздействие оказывает укрепление мышц вокруг беспокоящего сустава. Помогут изометрические упражнения (фиксированное напряжение): напряжение мышцы при отсутствии изменения ее длины.
Фото:freepikfreepik.com
Эффективны ли хондропротекторы? Как доказать?
Сегодня бытует мнение, что хондропротекторы не эффективны. Эту информацию можно найти как в российских (например, этой теме было посвящено несколько выпусков передачи «Жить здорово» с Еленой Малышевой), так и в зарубежных источниках. Чаще всего неэффективность связывают с тем, что хондропротектор не восстанавливает разрушения в суставе. Но при этом, если вернуться к значению слова «Хондропротектор», становится понятно, что данные средства и не обязаны «восстанавливать». Они призваны защищать от разрушения. И с этой задачей они доказано справляются. Например, хондропротекторы в виде уколов, согласно европейским рекомендациям (ESCEO — Европейское общество по клиническим и экономическим аспектам остеопороза и остеоартрита), являются начальным этапом лечения больного сустава. Если же производитель хондропротектора декларирует в рекламе «восстановление сустава», то это только маркетинговый ход. Будьте бдительны.
Например, хондропротекторы в виде уколов, согласно европейским рекомендациям (ESCEO — Европейское общество по клиническим и экономическим аспектам остеопороза и остеоартрита), являются начальным этапом лечения больного сустава. Если же производитель хондропротектора декларирует в рекламе «восстановление сустава», то это только маркетинговый ход. Будьте бдительны.
Также необходимо помнить, что эффективность хондропротекторов напрямую зависит от соблюдения режима приема препаратов. Терапия длительная и нельзя бросать прием препарата после первых признаков улучшения.
Есть, колоть или мазать?
Современные хондропротекторы предлагаются в очень широком спектре форм применения. Какой выбор будет правильным зависит от текущего состояния сустава и от состояния здоровья в целом. Поэтому без рекомендации врача (терапевта, невролога, ревматолога) не обойтись.
Инъекционные (то, что нужно ввести шприцом, сделать укол). Самая высокая проникаемость в заболевший сустав и хрящ. Максимально быстрый эффект. Именно с них европейские рекомендации советуют начинать лечение при выявлении нарушений в суставах.
Максимально быстрый эффект. Именно с них европейские рекомендации советуют начинать лечение при выявлении нарушений в суставах.
Пероральные (то, что нужно съесть: пилюли, таблетки, капсулы). Биодоступность (проникаемость действующего вещества в заболевший орган) значительно выше, чем у наружных средств, но ниже, чем у инъекционных. Нужно иметь в виду, что все пероральные формы хондропротекторов в ближайшем будущем в РФ будут называться биологически активными добавками. Это не значит, что все они признаны неэффективными. Данная мера принимается для гармонизации с нормами европейской фармакопеи.
Наружные средства (мази, кремы, гели). Сами по себе редко демонстрируют хороший результат. Чаще рекомендуется использовать в комплексе с другими средствами и методами. Все дело в размере молекулы действующего вещества. Всасывание активных компонентов через кожу ограничено. Поэтому данный вид препаратов применяется чаще всего как вспомогательное средство к пероральному или инъекционному методам.
Фото:freepikfreepik.com
Как часто нужно принимать?
Нужно помнить, что хондропотекторы — средства длительного применения. Ведь их задача не просто снять боль, а защитить сустав, улучшить его состояние. Это касается всех форм хондропротекторов: и капсул, и уколов, и мази. Нужно учитывать, что обезболивающий эффект от хондропротекторов наступает не сразу (даже если в составе есть НПВС). Говорить об эффективности того или иного хондропротектора можно не раньше, чем через три недели. При этом большинство клиницистов рекомендуют повторять курсы лечения один раз в полгода. Это важно для обеспечения накопительного эффекта, для наиболее длительной защиты суставов от разрушения. При этом можно чередовать лечение разными формами: например, сначала уколы и мазь, потом капсулы или таблетки. Сегодня и отечественные производители могут предложить полную линейку различных форм хондропротекторов, например Мукосат.
Но решение о последовательности и о режиме лечения должен принимать врач.
На правах рекламы.
Фото:suksaofreepik.com
Эффективность глюкозамина и хондроитинсульфата при остеоартрите
Традиционная медицина еще не имеет проверенного лечения, чтобы остановить или замедлить прогрессирование остеоартрита.
Пищевые добавки глюкозамин и хондроитинсульфат стали альтернативой лечению некоторых пациентов, страдающих от боли при остеоартрите.
См. Полное руководство по лечению остеоартрита
Возможно, наиболее важным аспектом добавок глюкозамина и хондроитинсульфата является то, что они, как считается, помогают замедлить или предотвратить дегенерацию суставного хряща, являющуюся основной причиной боли при остеоартрите.Пищевые добавки с глюкозамином и хондроитинсульфатом также могут помочь облегчить существующую боль в суставах. В настоящее время считается, что в отличие от многих лекарств, доступных для лечения боли и воспаления при артрите, добавки глюкозамина и хондроитинсульфата имеют очень мало побочных эффектов.
Однако пищевые добавки с глюкозамином и хондроитинсульфатом не обеспечивают желаемого обезболивания для всех пациентов с остеоартритом. На момент написания этой статьи преимущества и риски приема глюкозамина и хондроитинсульфата не были окончательно доказаны, и необходимы долгосрочные исследования, чтобы лучше понять их эффекты.
Остеоартроз и дегенерация суставов
Остеоартрит возникает, когда хрящи на концах суставов изнашиваются, а обнаженные кости трутся друг о друга. Этот дегенеративный процесс вызывает чрезмерное трение в суставах, что приводит к потере подвижности, скованности и боли в суставах. Остеоартрит чаще встречается у людей среднего и старшего возраста. Симптомы могут варьироваться от легкой до очень сильной боли в спине, шее, руках, бедрах, коленях и / или ступнях.
Когда дегенеративный остеоартрит возникает в спине, его обычно называют остеоартритом фасеточных суставов (поскольку он поражает фасеточные суставы позвоночника).
См. Остеоартроз позвоночника
Когда возникает в области шеи, это обычно называется шейным остеоартритом.
См. Шейный (шейный) артрит
объявление
Пищевые добавки с глюкозамином и хондроитинсульфатом
Глюкозамин и хондроитинсульфат естественным образом содержатся в соединительных тканях человеческого тела, например, покрывающих концы костей в суставах. Глюкозамин извлекается из тканей животных, таких как раковины крабов, омаров или креветок, а хондроитинсульфат содержится в хрящах животных, таких как трахеи или акульи хрящи. 1 Их обычно принимают в качестве пищевых добавок (также известных как пищевые добавки).
В этой статье:
Считается, что глюкозамин и хондроитинсульфат влияют на процесс дегенерации хряща при остеоартрите следующим образом:
- Считается, что сульфат глюкозамина помогает в формировании и восстановлении хрящей. 1 Некоторые лабораторные тесты показывают, что сульфат глюкозамина может помочь защитить суставной хрящ, ограничивая разрушение и помогая наращивать уровни хряща.
 2 Глюкозамина гидрохлорид, другая форма глюкозамина, считается столь же эффективной, как и сульфатная форма. Он легче усваивается организмом и может приниматься в меньших дозах с такой же эффективностью, как сульфат глюкозамина.
2 Глюкозамина гидрохлорид, другая форма глюкозамина, считается столь же эффективной, как и сульфатная форма. Он легче усваивается организмом и может приниматься в меньших дозах с такой же эффективностью, как сульфат глюкозамина. - Хондроитинсульфат является частью белковой молекулы, которая помогает придать хрящу его эластичные свойства и, как считается, обладает противовоспалительным действием, которое может помочь уменьшить болезненный отек в суставах, возникающий при трении оголенных костей в суставе. все вместе. 3 Кроме того, хондроитинсульфат может также помочь замедлить разрушение хряща и помочь восстановить рост хряща, чтобы лучше смягчить суставы. 3
объявление
Сочетание пищевых добавок с другими лечебными средствами
Глюкозамин и хондроитинсульфат не могут обеспечить достаточное обезболивание для всех пациентов с остеоартритом. Многие пациенты считают, что лучше всего использовать пищевые добавки с глюкозамином и хондроитинсульфатом в сочетании с другими нехирургическими методами лечения (под руководством их лечащего врача), например:
- Обезболивающее , обладающее противовоспалительными свойствами, например ибупрофен, ингибиторы ЦОГ-2, напроксен и другие нестероидные противовоспалительные препараты (НПВП).
 Ацетаминофен также может быть полезен для облегчения боли в суставах, связанной с остеоартритом. Прием пищевых добавок глюкозамина и хондроитинсульфата может снизить потребность некоторых пациентов в противовоспалительных или обезболивающих, в то время как другие могут продолжать принимать другие лекарства для снятия боли. Однако пациентам, ежедневно принимающим аспирин, следует избегать приема добавок хондроитинсульфата, так как это может способствовать кровотечению.
Ацетаминофен также может быть полезен для облегчения боли в суставах, связанной с остеоартритом. Прием пищевых добавок глюкозамина и хондроитинсульфата может снизить потребность некоторых пациентов в противовоспалительных или обезболивающих, в то время как другие могут продолжать принимать другие лекарства для снятия боли. Однако пациентам, ежедневно принимающим аспирин, следует избегать приема добавок хондроитинсульфата, так как это может способствовать кровотечению. - Упражнения на легкую растяжку могут помочь сохранить гибкость и диапазон движений, а также уменьшить жесткость мышц и суставов.Легкая физическая активность также может помочь в поддержании общего здоровья спины даже после облегчения обострения боли при остеоартрите.
- Водная терапия (специальные упражнения, выполняемые в бассейне) могут помочь пациентам с сильной болью при остеоартрите. Терапия в бассейне позволяет снизить нагрузку на суставы водой, что может быть менее болезненным, чем другие виды упражнений.
 Еще одна щадящая форма упражнений — это использование эллиптического тренажера или велотренажера, которые обеспечивают формы аэробных упражнений с низким воздействием на суставы.
Еще одна щадящая форма упражнений — это использование эллиптического тренажера или велотренажера, которые обеспечивают формы аэробных упражнений с низким воздействием на суставы. - Вытяжение при шейном остеоартрите и / или ручные манипуляции (например, хиропрактика или остеопатия) может помочь контролировать хроническую боль и другие симптомы остеоартрита, а также облегчить приступы сильной боли. Пациентам, рассматривающим возможность вытяжения, всегда следует проконсультироваться с врачом, чтобы гарантировать правильное и безопасное использование тракционных устройств, поскольку неправильное применение тракции может быть вредным.
Дополнительные немедицинские подходы (например, иглоукалывание, йога или тай-чи, методы с использованием инструментов для мягких тканей, такие как техника активного высвобождения (ART), техника Graston (GT), техники мышечной энергии, проприоцептивная нервно-мышечная реабилитация (PNF), метод Ниммо, массаж и др.) также может быть эффективным для некоторых пациентов.
Иногда некоторым пациентам рекомендуется отдых или снижение веса, чтобы уменьшить нагрузку на суставы. Некоторым пациентам также может потребоваться короткий период отдыха и лекарства для уменьшения воспаления суставов, прежде чем они начнут тренироваться.
Правильный курс лечения будет отличаться для каждого пациента и должен проходить под наблюдением специалиста в области здравоохранения.
Хирургия остеоартроза
В редких случаях для лечения сильной боли при остеоартрите может потребоваться операция по сращению позвоночника.Однако операция слияния, как правило, не оптимальна, поскольку остеоартрит обычно поражает несколько уровней позвонков, и многоуровневые слияния обычно не рекомендуются.
См. Эффективность глюкозамина и хондроитинсульфата при остеоартрите
Список литературы
- 1. Фонд артрита. «Альтернативные методы лечения: глюкозамин и хондроитинсульфат». 2004.
- 2. Дил, К.Л .: «Нейтрацевтики как терапевтические агенты при остеоартрите».
 Клиники ревматических заболеваний Северной Америки.1999: 379-395.
Клиники ревматических заболеваний Северной Америки.1999: 379-395. - 3. Национальные институты здравоохранения. Национальный центр бесплатной и альтернативной медицины. «Вопросы и ответы: NIH Glucosamine / Chondroitin Arthritis Intervention Trial (GAIT)». 2004. http://nccam.nih.gov/research/results/gait/qa.htm?nav=gsa.
Хондропротекторы при дегенеративных заболеваниях суставов | Ревматология
Аннотация
Катаболические пути цитокинов и анаболических факторов роста контролируют разрушение и восстановление при остеоартрите (ОА).Однонаправленный каскад цитокинов, управляемый TNF-α / IL-1, нарушает гомеостаз внеклеточного матрикса суставного хряща при ОА. Хотя хондроциты в хряще OA сверхэкспрессируют анаболический инсулиноподобный фактор роста (IGF) и его специфический рецептор (IGFRI), аутокринный TNF-α, высвобождаемый апоптотическими клетками суставного хряща, запускает ауто / паракринный каскад, управляемый IL-1, который перекрывает активность фактора роста. которые поддерживают восстановление при дегенеративных заболеваниях суставов. Хондропротекция с повторным появлением исчезнувшей суставной щели была безошибочно задокументирована в периферических суставах пациентов, страдающих спондилоартропатией, при лечении агентами, блокирующими TNF-α, которые подавляли однонаправленный цитокиновый каскад, управляемый TNF-α / IL-1.Серия агентов, модифицирующих структуру соединительной ткани (CTSMA), которые напрямую влияют на синтез ИЛ-1 и высвобождают in vitro и снижают нижерасположенные характеристики ИЛ-1, например активности коллагеназы, протеогликаназы и матриксной металлопротеиназы, экспрессия индуцибельной синтазы оксида азота, повышенное высвобождение оксида азота и секреция простагландина E 2 , IL-6 и IL-8, как было показано, обладают модифицирующим заболевание OA активность лекарственного средства (DMOAD) в экспериментальных моделях ОА и у людей с ОА суставов пальцев и коленей.Примерами являются кортикостероиды, некоторые сульфатированные полисахариды, химически модифицированные тетрациклины, диацетилреин / реин, глюкозамин и неомыляемые вещества авокадо / сои.
которые поддерживают восстановление при дегенеративных заболеваниях суставов. Хондропротекция с повторным появлением исчезнувшей суставной щели была безошибочно задокументирована в периферических суставах пациентов, страдающих спондилоартропатией, при лечении агентами, блокирующими TNF-α, которые подавляли однонаправленный цитокиновый каскад, управляемый TNF-α / IL-1.Серия агентов, модифицирующих структуру соединительной ткани (CTSMA), которые напрямую влияют на синтез ИЛ-1 и высвобождают in vitro и снижают нижерасположенные характеристики ИЛ-1, например активности коллагеназы, протеогликаназы и матриксной металлопротеиназы, экспрессия индуцибельной синтазы оксида азота, повышенное высвобождение оксида азота и секреция простагландина E 2 , IL-6 и IL-8, как было показано, обладают модифицирующим заболевание OA активность лекарственного средства (DMOAD) в экспериментальных моделях ОА и у людей с ОА суставов пальцев и коленей.Примерами являются кортикостероиды, некоторые сульфатированные полисахариды, химически модифицированные тетрациклины, диацетилреин / реин, глюкозамин и неомыляемые вещества авокадо / сои.
Утрата функции является следствием анатомических изменений тканей суставов при остеоартрозе (ОА). Вмешательство в анатомическое развитие ОА, по-видимому, является методом сохранения нормальной функции суставов. Вещества, защищающие суставной хрящ во время ОА, получили название хондрозащитных средств.Когда кажется, что они изменяют течение заболевания, эти агенты могут быть названы лекарственными средствами, модифицирующими заболевание, ОА (DMOAD) [1]. Боль в суставах при остеоартрите объясняется различными причинами, вторичными по отношению к анатомическим изменениям, например: воспалительные явления в синовиальной оболочке и субхондральная внутрикостная гипертензия из-за венозного застоя. В этом обзоре будут рассмотрены аспекты хондропротекторной терапии DMOAD, а не облегчение клинических симптомов, которые в конечном итоге могут возникнуть при назначении пациентам терапии DMOAD.
Гомеостаз внеклеточного матрикса здорового суставного хряща
Гомеостаз внеклеточного матрикса (ЕСМ) суставного хряща зависит от реакции клеток суставного хряща на ауто- и паракринные анаболические и катаболические пути. Наиболее важные факторы роста и цитокины, которые, как известно, участвуют в метаболизме хряща, вырабатываются самими хондроцитами [2, 3]. Синтез и накопление ЕСМ регулируется местно продуцируемыми факторами роста, такими как инсулиноподобные факторы роста (IGF) и трансформирующий фактор роста-β (TGF-β).Специфическая регуляторная роль TGF-β была предложена при патологических условиях [4], и большое количество экспериментальных данных подтвердило важность IGF-1 как промотора роста и синтеза матрикса хондроцитами в здоровом суставном хряще. IGF-1 усиливает синтез аггрекана клетками или эксплантами суставного хряща [5-10] и in vivo, в моделях на животных [11]. Оборот и деградация матрикса зависят от реакции клетки суставного хряща на катаболические цитокины, из которых IL-1α и β являются основными агонистами [12, 13].Было показано, что помимо своей способности вызывать деградацию суставного хряща, IL-1 подавляет синтез аггрекана и коллагена хондроцитами [14, 15]. Это снижение продукции соединений ЕСМ частично опосредовано ИЛ-1-индуцированным образованием оксида азота (NO) [16].
Наиболее важные факторы роста и цитокины, которые, как известно, участвуют в метаболизме хряща, вырабатываются самими хондроцитами [2, 3]. Синтез и накопление ЕСМ регулируется местно продуцируемыми факторами роста, такими как инсулиноподобные факторы роста (IGF) и трансформирующий фактор роста-β (TGF-β).Специфическая регуляторная роль TGF-β была предложена при патологических условиях [4], и большое количество экспериментальных данных подтвердило важность IGF-1 как промотора роста и синтеза матрикса хондроцитами в здоровом суставном хряще. IGF-1 усиливает синтез аггрекана клетками или эксплантами суставного хряща [5-10] и in vivo, в моделях на животных [11]. Оборот и деградация матрикса зависят от реакции клетки суставного хряща на катаболические цитокины, из которых IL-1α и β являются основными агонистами [12, 13].Было показано, что помимо своей способности вызывать деградацию суставного хряща, IL-1 подавляет синтез аггрекана и коллагена хондроцитами [14, 15]. Это снижение продукции соединений ЕСМ частично опосредовано ИЛ-1-индуцированным образованием оксида азота (NO) [16]. Эффекты IL-1 опосредуются высокоаффинным рецептором клеточной поверхности (IL-1RI) [17, 18]. Важными контролирующими факторами активности IL-1 являются белки, относящиеся к семейству рецепторов IL-1, среди которых рецептор-ловушка IL-1 типа 2 (IL-1RII) экспрессируется на плазматической мембране хондроцитов и связывает IL-1α и β, но не не передавать сигналы ИЛ-1 [19, 20].Интересно, что IGF, как было показано, активирует IL-1RII рецептора-ловушки IL-1, тем самым обращая активность IL-1 [21]. Это открытие согласуется с наблюдением, что IGF-1 непосредственно снижает как базальную, так и стимулируемую цитокинами деградацию [22] и депрессию основного вещества суставного хряща [21]. Таким образом, повышая регуляцию IL-1RII, IGF-1 защищает ECM хряща от индуцированного IL-1 разрушения (рис. 1A).
Эффекты IL-1 опосредуются высокоаффинным рецептором клеточной поверхности (IL-1RI) [17, 18]. Важными контролирующими факторами активности IL-1 являются белки, относящиеся к семейству рецепторов IL-1, среди которых рецептор-ловушка IL-1 типа 2 (IL-1RII) экспрессируется на плазматической мембране хондроцитов и связывает IL-1α и β, но не не передавать сигналы ИЛ-1 [19, 20].Интересно, что IGF, как было показано, активирует IL-1RII рецептора-ловушки IL-1, тем самым обращая активность IL-1 [21]. Это открытие согласуется с наблюдением, что IGF-1 непосредственно снижает как базальную, так и стимулируемую цитокинами деградацию [22] и депрессию основного вещества суставного хряща [21]. Таким образом, повышая регуляцию IL-1RII, IGF-1 защищает ECM хряща от индуцированного IL-1 разрушения (рис. 1A).
Рис. 1.
Пути IL-1 / IGF, контролирующие оборот внеклеточного матрикса (ECM) в (A) здоровом хряще, (B) хряще OA и (C) хряще OA, когда проводится репрессивная терапия IL-1.(A) Активность IL-1 контролируется IGF-1 в нормальном хряще. Через повышающую регуляцию IL-1RII IGF-1 защищает ECM хряща от индуцированного IL-1 разрушения. (B) Считается, что при ОА TNF-α, высвобождаемый апоптозными клетками суставного хряща, вызывает выделение IL-1RII и запускает ауто / паракринный каскад, управляемый IL-1, что приводит к резорбции ECM. По неизвестным причинам хондроциты в хряще OA сверхэкспрессируют анаболическую активность фактора роста IGF-1 / IGF-RI. (C) Подавление активности IL-1 в хрящевых клетках, которые сверхэкспрессируют IGF-1, приводит к восстановлению ECM.
Через повышающую регуляцию IL-1RII IGF-1 защищает ECM хряща от индуцированного IL-1 разрушения. (B) Считается, что при ОА TNF-α, высвобождаемый апоптозными клетками суставного хряща, вызывает выделение IL-1RII и запускает ауто / паракринный каскад, управляемый IL-1, что приводит к резорбции ECM. По неизвестным причинам хондроциты в хряще OA сверхэкспрессируют анаболическую активность фактора роста IGF-1 / IGF-RI. (C) Подавление активности IL-1 в хрящевых клетках, которые сверхэкспрессируют IGF-1, приводит к восстановлению ECM.
Рис. 1.
Пути IL-1 / IGF, контролирующие оборот внеклеточного матрикса (ECM) в (A) здоровом хряще, (B) хряще OA и (C) хряще OA, когда проводится репрессивная терапия IL-1. (A) Активность IL-1 контролируется IGF-1 в нормальном хряще. Через повышающую регуляцию IL-1RII IGF-1 защищает ECM хряща от индуцированного IL-1 разрушения. (B) Считается, что при ОА TNF-α, высвобождаемый апоптозными клетками суставного хряща, вызывает выделение IL-1RII и запускает ауто / паракринный каскад, управляемый IL-1, что приводит к резорбции ECM. По неизвестным причинам хондроциты в хряще OA сверхэкспрессируют анаболическую активность фактора роста IGF-1 / IGF-RI. (C) Подавление активности IL-1 в хрящевых клетках, которые сверхэкспрессируют IGF-1, приводит к восстановлению ECM.
По неизвестным причинам хондроциты в хряще OA сверхэкспрессируют анаболическую активность фактора роста IGF-1 / IGF-RI. (C) Подавление активности IL-1 в хрящевых клетках, которые сверхэкспрессируют IGF-1, приводит к восстановлению ECM.
Патология метаболических путей цитокинов и факторов роста, принимаемых ОА
Сообщалось о повышении регуляции как катаболических [2, 3, 23, 24], так и анаболических [2, 3, 23–26] путей в хондроцитах и хрящах при ОА. Корреляция с возникновением и степенью патологии ОА была отмечена для IL-1β [2, 3, 27], и эти повышенные уровни катаболических цитокинов воплощены в хорошо задокументированном увеличении активности металлопротеиназ, которые были выше в хряще ОА по сравнению с морфологически нормальными. хрящ из того же сустава [27–30].Кроме того, в хондроцитах ОА было обнаружено увеличение плотности рецепторов IL-1RI по сравнению с нормальными хондроцитами. Уровни мРНК и белка IGF-1 и его рецептора IGFRI были значительно выше в фибриллированном хряще OA, чем в нефибриллированном хряще OA тазобедренного и коленного суставов [23, 26]. Самые сильные сигналы сообщения IGF-1 или уровни белка наблюдались в хондроцитах более продвинутых поражений [23, 26]. Когда сравнивали клетки, полученные из нормальной ткани и ткани ОА из одних и тех же коленных суставов человека, ассоциированный с клетками аггрекан и коллаген типа II были значительно уменьшены вокруг хондроцитов, полученных из патологической ткани.Одновременно хондроциты из фибриллированного хряща OA экспрессировали значительно более высокие внутриклеточные уровни IL-1α и β и повышали уровень IL-1RI, связанный с плазматической мембраной. В то же время наблюдались значительно более высокие уровни внутриклеточного IGF-1 и IGF-R1, связанного с плазматической мембраной. Неожиданно оказалось, что в присутствии этой повышенной активности IGF экспрессия связанного с плазматической мембраной рецептора-ловушки IL-1RII снижалась в хондроцитах ОА [26]. Снижение уровней рецептора-ловушки IL-1RII плазматической мембраны на хондроцитах ОА может быть связано с вмешательством других аутокринных цитокиновых путей.
Самые сильные сигналы сообщения IGF-1 или уровни белка наблюдались в хондроцитах более продвинутых поражений [23, 26]. Когда сравнивали клетки, полученные из нормальной ткани и ткани ОА из одних и тех же коленных суставов человека, ассоциированный с клетками аггрекан и коллаген типа II были значительно уменьшены вокруг хондроцитов, полученных из патологической ткани.Одновременно хондроциты из фибриллированного хряща OA экспрессировали значительно более высокие внутриклеточные уровни IL-1α и β и повышали уровень IL-1RI, связанный с плазматической мембраной. В то же время наблюдались значительно более высокие уровни внутриклеточного IGF-1 и IGF-R1, связанного с плазматической мембраной. Неожиданно оказалось, что в присутствии этой повышенной активности IGF экспрессия связанного с плазматической мембраной рецептора-ловушки IL-1RII снижалась в хондроцитах ОА [26]. Снижение уровней рецептора-ловушки IL-1RII плазматической мембраны на хондроцитах ОА может быть связано с вмешательством других аутокринных цитокиновых путей. В этом контексте было показано, что TNF-α вызывает быстрое выделение IL-1RII из мембран миеломоноцитарных клеток [31, 32]. Подобный эффект TNF-α на клетки суставного хряща еще предстоит продемонстрировать. Однако присутствие TNF-α в хрящах, подвергшихся механическому повреждению, неоднократно подтверждалось примерами. Травма суставных хондроцитов вызывает апоптоз [33, 34], а апоптоз опосредуется аутокринным путем TNF [35, 36]. Повышенная активность TGF-β в хряще OA [37–39], вызывающая понижающую модуляцию передачи сигналов IL-1RI [40], может частично компенсировать потери IL-1RII, вызванные ауто / паракринной активностью TNF-α.Однако, если необходимо идентифицировать метаболические пути цитокинов и факторов роста, TNF-α и IL-1β и их сигнальные рецепторы являются основными кандидатами (рис. 1B).
В этом контексте было показано, что TNF-α вызывает быстрое выделение IL-1RII из мембран миеломоноцитарных клеток [31, 32]. Подобный эффект TNF-α на клетки суставного хряща еще предстоит продемонстрировать. Однако присутствие TNF-α в хрящах, подвергшихся механическому повреждению, неоднократно подтверждалось примерами. Травма суставных хондроцитов вызывает апоптоз [33, 34], а апоптоз опосредуется аутокринным путем TNF [35, 36]. Повышенная активность TGF-β в хряще OA [37–39], вызывающая понижающую модуляцию передачи сигналов IL-1RI [40], может частично компенсировать потери IL-1RII, вызванные ауто / паракринной активностью TNF-α.Однако, если необходимо идентифицировать метаболические пути цитокинов и факторов роста, TNF-α и IL-1β и их сигнальные рецепторы являются основными кандидатами (рис. 1B).
Агенты, модифицирующие структуру соединительной ткани (CTSMA), и лекарственные средства от остеоартрита, модифицирующие заболевание (DMOAD)
Первые попытки улучшить структуру и функцию соединительной ткани синовиальных суставов, тем самым облегчить симптомы дегенеративных заболеваний суставов, были основаны на туманных предположениях, что обильное введение предшественников компонентов внеклеточного матрикса поможет клеткам суставного хряща восполнить утраченную среду. .Это предположение побудило врачей использовать такие вещества, как глюкозамин и сульфат или гликозаминогликаны, с целью улучшения восстановления хряща при дегенеративных заболеваниях суставов. Аналогичным образом, первое внутрисуставное введение полисульфата хондроитина было основано на предположении, что этот препарат гепариноидного типа заменит гиалуронан в качестве лубриканта и снизит уровень фибриногена в воспаленных суставах, и что это даст терапевтическое преимущество [41, 42]. Неожиданно некоторые пациенты сообщили об облегчении симптомов после прохождения этой процедуры, и даже сообщалось о некоторых изменениях в химическом составе синовиальной жидкости [43].
.Это предположение побудило врачей использовать такие вещества, как глюкозамин и сульфат или гликозаминогликаны, с целью улучшения восстановления хряща при дегенеративных заболеваниях суставов. Аналогичным образом, первое внутрисуставное введение полисульфата хондроитина было основано на предположении, что этот препарат гепариноидного типа заменит гиалуронан в качестве лубриканта и снизит уровень фибриногена в воспаленных суставах, и что это даст терапевтическое преимущество [41, 42]. Неожиданно некоторые пациенты сообщили об облегчении симптомов после прохождения этой процедуры, и даже сообщалось о некоторых изменениях в химическом составе синовиальной жидкости [43].
Наряду с глубоким поиском механизмов, посредством которых ткани суставов разрушаются в ходе воспалительных или дегенеративных заболеваний суставов, исследователи более методично искали биологические агенты, способные восстанавливать поврежденные соединительные ткани. Поскольку суставной хрящ является одной из основных тканей-мишеней, поражаемых в ходе ревматических заболеваний суставов, многие исследования были сосредоточены на метаболических характеристиках единственной клетки, находящейся в этой ткани: хондроцита. Вещества, защищающие суставной хрящ при деструктивных заболеваниях суставов, получили название хондрозащитных средств.Когда это произошло in vivo в суставах с остеоартритом, эти агенты были названы лекарствами от остеоартрита, модифицирующими заболевание (DMOAD) [1].
Вещества, защищающие суставной хрящ при деструктивных заболеваниях суставов, получили название хондрозащитных средств.Когда это произошло in vivo в суставах с остеоартритом, эти агенты были названы лекарствами от остеоартрита, модифицирующими заболевание (DMOAD) [1].
Поскольку ауто / паракринный фактор роста и каскады цитокинов, лежащие в основе развития, гомеостаза и разрушения внеклеточного матрикса суставного хряща, ранее не были известны, первые исследования биологических агентов, способных изменять структуру соединительной ткани в положительную сторону, в основном были сосредоточены на от способности этих агентов улучшать синтез или ухудшать разложение соединений ЕСМ, e.грамм. аггрекан и коллаген. Согласно этому определению, ряд веществ можно классифицировать как вещества, модифицирующие структуру соединительной ткани (CTSMA). Среди них неоднократно упоминались сульфатированные гликозаминогликаны и глюкозамин, химически модифицированные тетрациклины, такие как доксициклин и миноциклин, диацетилреин и его активный метаболит реин, а также неомыляемые вещества авокадо / сои.
Сульфатные полисахариды и хондрозащита
Среди первых веществ, способных улучшать накопление соединений ЕСМ, были так называемые хондромукопротеины [44–46], смесь продуктов деградации протеогликанов, в которых присутствовал хондроитинсульфат.Затем была выдвинута гипотеза, что продукты распада ВКМ, содержащие хондроитинсульфат, каким-то образом оказывают положительное влияние на хондроциты суставного хряща. Возможность вмешательства в процессы восстановления клеток соединительной ткани in vitro с помощью сульфатированных полисахаридов была впервые описана в середине 1970-х годов [47, 48]. Позже было показано, что полисульфат хондроитинсульфата улучшает синтез гиалуронана в синовиальных суставах in vivo у людей [49]. Тот же препарат, а также его природный аналог, хондроитинсульфат, улучшали функцию восстановления хондроцитов in vivo в различных экспериментальных моделях остеоартрита [50–53].Недавно рандомизированные двойные слепые плацебо-контролируемые терапевтические испытания привели к выводу, что эти CTSMA обладают свойствами DMOAD, поскольку они, как было показано, замедляют прогрессирование эрозивного ОА в межфаланговых суставах пальцев [54, 55] и ОА коленного сустава. у человека [56–58].
у человека [56–58].
Эксперименты in vitro и in vivo в различных исследовательских центрах, касающиеся влияния на метаболизм молекул межклеточного матрикса (протеогликанов, аггреканов, гиалуронана), показали, что большинство (поли) сульфатированных полисахаридов влияют на клетки соединительной ткани (хрящевые клетки, синовиальные клетки, фибробласты) аналогичным образом [48, 59–61].С улучшением нашего понимания ауто / паракринного фактора роста и цитокиновых путей, которые контролируют гомеостаз здоровых соединительных тканей, стало возможным изучить механизм действия этих CTSMA. Недавние исследования сульфатированных полисахаридов показали, что эти агенты действуют в биологических системах путем подавления важных катаболических ауто / паракринных цитокиновых путей, таких как IL-1, тем самым улучшая накопление соединений ЕСМ в клеточно-ассоциированном матриксе этих клеток.Эксперименты с бычьими хрящевыми клетками, полученными из макроскопически интактных пястно-фаланговых суставов, показали, что физиологические концентрации полисульфата хондроитина значительно снижают последующие эффекты IL-1, такие как активность коллагеназы, протеогликаназы и матриксной металлопротеиназы (MMP) -1 и MMP-3 [62]. Кроме того, полисульфат хондроитина ингибировал индуцированную IL-1 экспрессию мРНК тканевого активатора плазминогена (tPA) [62]. Аналогичным образом, полисульфат ксилозана и полисульфат хондроитина восстанавливали накопление аггрекана, гиалуронана и коллагена типа II в клеточно-ассоциированном матриксе в обработанных IL-1β хондроцитах человека, культивируемых в агарозе.Этот эффект, вероятно, частично является результатом подавления MMPs [63]. Кроме того, в культивируемых хондроцитах лошадей полисульфат хондроитина значительно снижал экспрессию индуцибельной синтазы оксида азота (iNOS), усиленную IL-1β, что сопровождалось повышенным высвобождением NO. Хондроитин полисульфат снижает концентрацию нитрита в супернатантах этих IL-1β-стимулированных культур [64]. Наконец, новый полисульфатированный полисахарид, полисульфат циклодекстрина, продемонстрировал эффекты модификации структуры хряща in vitro , поскольку он улучшал синтез аггрекана и накопление связанных с клетками макромолекул матрикса клетками суставного хряща человека в альгинате.
Кроме того, полисульфат хондроитина ингибировал индуцированную IL-1 экспрессию мРНК тканевого активатора плазминогена (tPA) [62]. Аналогичным образом, полисульфат ксилозана и полисульфат хондроитина восстанавливали накопление аггрекана, гиалуронана и коллагена типа II в клеточно-ассоциированном матриксе в обработанных IL-1β хондроцитах человека, культивируемых в агарозе.Этот эффект, вероятно, частично является результатом подавления MMPs [63]. Кроме того, в культивируемых хондроцитах лошадей полисульфат хондроитина значительно снижал экспрессию индуцибельной синтазы оксида азота (iNOS), усиленную IL-1β, что сопровождалось повышенным высвобождением NO. Хондроитин полисульфат снижает концентрацию нитрита в супернатантах этих IL-1β-стимулированных культур [64]. Наконец, новый полисульфатированный полисахарид, полисульфат циклодекстрина, продемонстрировал эффекты модификации структуры хряща in vitro , поскольку он улучшал синтез аггрекана и накопление связанных с клетками макромолекул матрикса клетками суставного хряща человека в альгинате. Здесь впервые было показано, что этот эффект частично является результатом прямой репрессии IL-1, поскольку клетки, обработанные полисульфатом циклодекстрина, экспрессируют значительно меньшие количества внутриклеточных IL-1α и β [65]. Те же обработанные β-циклодекстрином хондроциты высвобождали значительно меньше ИЛ-6 в супернатантную культуральную среду, эффект, который, как известно, является результатом ауто / паракринной стимуляции ИЛ-1 [65]. Следует напомнить, что концентрации полисахаридов в культуральном супернатанте большинства описанных экспериментов in vitro и уровни полисахаридов в плазме или хрящевой ткани, полученные у людей после перорального введения, были одного порядка [66–68].
Здесь впервые было показано, что этот эффект частично является результатом прямой репрессии IL-1, поскольку клетки, обработанные полисульфатом циклодекстрина, экспрессируют значительно меньшие количества внутриклеточных IL-1α и β [65]. Те же обработанные β-циклодекстрином хондроциты высвобождали значительно меньше ИЛ-6 в супернатантную культуральную среду, эффект, который, как известно, является результатом ауто / паракринной стимуляции ИЛ-1 [65]. Следует напомнить, что концентрации полисахаридов в культуральном супернатанте большинства описанных экспериментов in vitro и уровни полисахаридов в плазме или хрящевой ткани, полученные у людей после перорального введения, были одного порядка [66–68].
Неомыляемые вещества из авокадо / сои
Сообщалось, что неомыляемые вещества авокадо / сои подавляют катаболическую активность хондроцитов и увеличивают накопление протеогликана хондроцитами ОА в культуре. Неомыляемые вещества из авокадо / сои были мощными ингибиторами основной продукции ММР-3 хондроцитами ОА, а также продукции IL-6, IL-8, NO и простагландина E 2 (PGE 2 ) [69]. Все эти биологические активности зависят от ИЛ-1 и выражены в хондроцитах ОА.Точно так же неомыляемые вещества авокадо / соя обращали вспять эффекты IL-1β в фибробластах десен из воспаленных тканей [70]. Эффекты этих экстрактов, подавляющие IL-1, защищали подкожно имплантированный хрящ от деградации [71]. In vivo Эффекты DMOAD после введения неомыляемых веществ из авокадо / сои были описаны в модели менискэктомии у овец [72] и, возможно, в человеческом OA бедра [73].
Все эти биологические активности зависят от ИЛ-1 и выражены в хондроцитах ОА.Точно так же неомыляемые вещества авокадо / соя обращали вспять эффекты IL-1β в фибробластах десен из воспаленных тканей [70]. Эффекты этих экстрактов, подавляющие IL-1, защищали подкожно имплантированный хрящ от деградации [71]. In vivo Эффекты DMOAD после введения неомыляемых веществ из авокадо / сои были описаны в модели менискэктомии у овец [72] и, возможно, в человеческом OA бедра [73].
Химически модифицированные тетрациклины
Было показано, что химически модифицированные тетрациклины, такие как доксициклин и миноциклин, непосредственно ингибируют активность протеаз и коллагеназ [74].Тетрациклины также могут косвенно подавлять эту катаболическую активность, поскольку, как сообщалось, они снижают уровни мРНК коллагеназ в изолированных хондроцитах ОА. Кроме того, доксициклин ингибировал увеличение мРНК этих ферментов в нормальных хондроцитах, стимулированных TNF-α [75]. Аналогичным образом, хондроциты, выделенные из хряща OA человека и обработанные доксициклином, показали значительное ингибирование белка матриксной металлопротеиназы и соответствующих уровней мРНК, что указывает на транскрипционный / посттранскрипционный уровень контроля.Кроме того, лечение доксициклином привело к значительному снижению уровня мРНК IL-1α, β и IL-6 [76].
Аналогичным образом, хондроциты, выделенные из хряща OA человека и обработанные доксициклином, показали значительное ингибирование белка матриксной металлопротеиназы и соответствующих уровней мРНК, что указывает на транскрипционный / посттранскрипционный уровень контроля.Кроме того, лечение доксициклином привело к значительному снижению уровня мРНК IL-1α, β и IL-6 [76].
Прямое ингибирование таких цитокинов могло быть ответственным за снижение активности синтазы оксида азота в синовиальных клетках ОА [77]. Тетрациклины обращали как спонтанную, так и индуцированную IL-1β активность NOS в условиях ex vivo в тканях OA человека. Было обнаружено, что механизм действия этих препаратов на экспрессию NOS, по крайней мере частично, находится на уровне экспрессии РНК и трансляции фермента [78].
Вероятно, что снижение активности коллагеназы и желатиназы в экстрактах остеоартрозного хряща человека после перорального введения этих тетрациклинов человеку [79], а также открытие того, что доксициклин ингибирует продукцию NO в хряще у собак, у которых развился ОА после спонтанного разрыв передней крестообразной связки [80], возможно, был приписан ингибированию активности ауто / паракринных катаболических цитокинов. Скорее всего, это ингибирование каскадов катаболических цитокинов было ответственно за «хондропротекторные» эффекты при воспалительных артритах на животных моделях.Профилактические доксициклины и химически модифицированные варианты, вводимые перорально, уменьшали изменения ОА в коленных суставах in vivo у морских свинок Хартли, которые имеют высокую частоту ОА коленных суставов [81], и заметно снижали тяжесть ОА в областях, несущих нагрузку. медиального мыщелка бедренной кости при экспериментальном ОА у взрослых беспородных собак [82]. Совсем недавно было показано, что лечение доксициклином в дозе 100 мг два раза в день в течение 30 месяцев снижает скорость сужения суставной щели в коленях с установленным остеоартритом в группе женщин с ожирением [83].
Скорее всего, это ингибирование каскадов катаболических цитокинов было ответственно за «хондропротекторные» эффекты при воспалительных артритах на животных моделях.Профилактические доксициклины и химически модифицированные варианты, вводимые перорально, уменьшали изменения ОА в коленных суставах in vivo у морских свинок Хартли, которые имеют высокую частоту ОА коленных суставов [81], и заметно снижали тяжесть ОА в областях, несущих нагрузку. медиального мыщелка бедренной кости при экспериментальном ОА у взрослых беспородных собак [82]. Совсем недавно было показано, что лечение доксициклином в дозе 100 мг два раза в день в течение 30 месяцев снижает скорость сужения суставной щели в коленях с установленным остеоартритом в группе женщин с ожирением [83].
Диацетилреин
В отличие от других CTSMA, которые ингибируют NO [64, 69, 77, 78, 107, 110–113] и продукцию простаноидов [69, 108, 110–112, 114], активный метаболит диацетилреина, реин не снижает, но, по-видимому, стимулирует синтез простагландинов in vitro [84, 85] и in vivo [86]. Этот механизм действия диацетилреина по увеличению экспрессии циклооксигеназы (COX) -2 и продукции PGE 2 , независимо от их ингибирования эндогенного NO [85, 87], аналогичен таковому у тетрациклинов, например.грамм. доксициклин и миноциклин, которые ингибируют индуцибельную NO-синтазу и увеличивают экспрессию ЦОГ-2 [88, 89]. Rhein и тетрациклины являются родственными химическими структурами в том смысле, что эти соединения возникают в результате реакций замещения полиядерных углеводородов: антрацена и нафтацена соответственно. Реин и тетрациклины обладают структурным сходством (рис. 2).
Этот механизм действия диацетилреина по увеличению экспрессии циклооксигеназы (COX) -2 и продукции PGE 2 , независимо от их ингибирования эндогенного NO [85, 87], аналогичен таковому у тетрациклинов, например.грамм. доксициклин и миноциклин, которые ингибируют индуцибельную NO-синтазу и увеличивают экспрессию ЦОГ-2 [88, 89]. Rhein и тетрациклины являются родственными химическими структурами в том смысле, что эти соединения возникают в результате реакций замещения полиядерных углеводородов: антрацена и нафтацена соответственно. Реин и тетрациклины обладают структурным сходством (рис. 2).
Рис. 2.
Райн, активный метаболит диацетилреина, и тетрациклин обладают структурным сходством.
Рис. 2.
Райн, активный метаболит диацетилреина, и тетрациклин обладают структурным сходством.
Подобно тетрациклинам, диацетилреин / реин подавлял экспрессию ИЛ-1 в активированных липополисахаридами человеческих хондроцитах ОА [90] и синовиальных клетках [91]. Эксперименты на изолированных хондроцитах суставного хряща и на эксплантатах хрящевой ткани показали, что это нарушение высвобождения активного ИЛ-1 частично связано с ингибированием фермента, преобразующего ИЛ-1 (ICE) плазматической мембраны.Судя по отсутствию влияния на уровень экспрессии генов обоих белков, действие диацетилреина / реина на IL-1β и ICE должно было быть посттрансляционным [92]. Понижающая модуляция активной продукции IL-1 сопровождалась ингибированием активации NFκB [93] и, следовательно, экспрессии IL-1 / NFκB-зависимых генов в этих клетках [90, 91, 93]. Блокирующие нижестоящие события IL-1 включали снижение продукции NO, стромелизина-1 [91, 94] и коллагеназы, а также провоспалительных IL-6, -8 и -18 в IL-1α и TNF-α активированных монослойных культивируемых суставных хондроцитах человека из ОА суставов [92, 94].Аналогичным образом, реин подавлял индуцированную IL-1 экспрессию генов proMMP-1, -3, -9 и -13 и их активности, а также повышал продукцию тканевого ингибитора металлопротеиназы 1 (TIMP-1) в монослое культивированных суставные хондроциты кролика. Таким образом, в этих клетках сообщалось об увеличении продукции гликозаминогликанов и коллагена наряду со снижением деградации протеогликана [95–97]. Это улучшенное наращивание матрикса могло быть усилено увеличением экспрессии изоформ TGF-β в хондроцитах, обработанных диацетилреином [98].Все эти результаты in vitro были получены с концентрациями диацетилреина / реина, сравнимыми с терапевтическими уровнями в плазме. Можно разумно предположить, что блокирование ИЛ-1 диацетилреином / реином было ответственно за некоторые эффекты DMOAD, наблюдаемые при экспериментальном ОА у животных, например при разрушении хряща надколенника кролика, вызванном контузией [99], и при спонтанно развивающемся полиартрите у мышей NZB / KN [100]. Хотя это не согласуется с улучшением биохимии суставного хряща [101–103], сравнимая хондрозащита наблюдалась в различных моделях ОА собак, если судить по макроскопическим повреждениям хряща [102, 103].
Эксперименты на изолированных хондроцитах суставного хряща и на эксплантатах хрящевой ткани показали, что это нарушение высвобождения активного ИЛ-1 частично связано с ингибированием фермента, преобразующего ИЛ-1 (ICE) плазматической мембраны.Судя по отсутствию влияния на уровень экспрессии генов обоих белков, действие диацетилреина / реина на IL-1β и ICE должно было быть посттрансляционным [92]. Понижающая модуляция активной продукции IL-1 сопровождалась ингибированием активации NFκB [93] и, следовательно, экспрессии IL-1 / NFκB-зависимых генов в этих клетках [90, 91, 93]. Блокирующие нижестоящие события IL-1 включали снижение продукции NO, стромелизина-1 [91, 94] и коллагеназы, а также провоспалительных IL-6, -8 и -18 в IL-1α и TNF-α активированных монослойных культивируемых суставных хондроцитах человека из ОА суставов [92, 94].Аналогичным образом, реин подавлял индуцированную IL-1 экспрессию генов proMMP-1, -3, -9 и -13 и их активности, а также повышал продукцию тканевого ингибитора металлопротеиназы 1 (TIMP-1) в монослое культивированных суставные хондроциты кролика. Таким образом, в этих клетках сообщалось об увеличении продукции гликозаминогликанов и коллагена наряду со снижением деградации протеогликана [95–97]. Это улучшенное наращивание матрикса могло быть усилено увеличением экспрессии изоформ TGF-β в хондроцитах, обработанных диацетилреином [98].Все эти результаты in vitro были получены с концентрациями диацетилреина / реина, сравнимыми с терапевтическими уровнями в плазме. Можно разумно предположить, что блокирование ИЛ-1 диацетилреином / реином было ответственно за некоторые эффекты DMOAD, наблюдаемые при экспериментальном ОА у животных, например при разрушении хряща надколенника кролика, вызванном контузией [99], и при спонтанно развивающемся полиартрите у мышей NZB / KN [100]. Хотя это не согласуется с улучшением биохимии суставного хряща [101–103], сравнимая хондрозащита наблюдалась в различных моделях ОА собак, если судить по макроскопическим повреждениям хряща [102, 103].
Эти эффекты DMOAD были подтверждены в двух рандомизированных двойных слепых плацебо-контролируемых исследованиях. Двести шестьдесят девять пациентов с первичным ОА бедра завершили трехлетнее исследование, получая диацетилреин в дозе 50 мг два раза в день или плацебо. Процент пациентов с рентгенологическим прогрессированием, определяемым как потеря суставной щели не менее 0,5 мм, был значительно ниже у пациентов, получавших диацетилреин, чем у пациентов, получавших плацебо. У этих пациентов частота сужения суставной щели была дискретной, но значительно ниже, чем в группе плацебо [104].Эти результаты были подтверждены в другом 1-летнем проспективном рандомизированном двойном слепом плацебо-контролируемом исследовании 301 пациента с радиологическим медиальным ОА коленного сустава [105].
Глюкозамин
Место глюкозамина как CTSMA или DMOAD остается спорным. Тот факт, что этот аминосахар долгое время назывался «сульфатом глюкозамина», вызвал путаницу. Препарат, использованный в ряде экспериментов in vitro и in vivo , не был сложным эфиром сульфата глюкозамина, а оказался препаратом, в котором глюкозамин и сульфат присутствовали в виде двух отдельных молекул в кристаллической форме.Если какие-либо эффекты CTSMA приписываются «сульфату глюкозамина», в настоящее время считается, что активным ингредиентом является моносахарид. В серии экспериментов с изолированными IL-1β-активированными хондроцитами в культуре, где использовались гексозамины, сообщалось о влиянии на последующие события IL-1. Добавление глюкозамина к хондроцитам крысы, обработанным IL-1β, уменьшало активацию фактора транскрипции NFκB, но не белка-активатора-1 [106]. Глюкозамин, но не N, -ацетилглюкозамин или другие моносахариды [107], значительно ингибировал активность NFκB в хондроцитах ОА человека, а также ядерную транслокацию белков p50 и p65 [108].Глюкозамин снижал активность фосфолипазы A2 [109], уровни мРНК и белка ЦОГ-2 [107, 108, 110] и высвобождение PGE 2 [108, 110–114] в клетках суставного хряща различного происхождения. Сходным образом аминосахар снижает продукцию iNOS и NO хондроцитами [107, 110–113] и индуцирует IL-1 металлопротеиназную и коллагеназную активности в супернатантах культур хондроцитов [109–113, 115]. Заметное ингибирование аггреканазозависимого расщепления аггрекана наблюдалось как с клетками крысы, так и с эксплантами крупного рогатого скота при добавлении глюкозамина [116] и маннозамина [117].Ингибирование не было связано с вмешательством в передачу сигналов IL-1, и точный механизм, с помощью которого гексозамины функционируют в этой системе, неясен. Вмешательство в активность ферментов привело к снижению катаболизма ВКМ в этих культурах хондроцитов [113]. Кроме того, сообщалось, что гексозамины улучшают синтез макромолекул ECM в IL-1-репрессированных хрящевых клетках [106, 111, 112, 115]. Большинство цитируемых экспериментов проводилось на нормальных хондроцитах, хондроцитах или хрящевых эксплантатах, примированных IL-1.Редко использовались нативные хондроциты ОА [109, 115]. Основная проблема с исследованиями in vitro , проведенными до сих пор, — это концентрации гексозаминов, используемых в этих экспериментах. Обычно пациентам с ОА ежедневно вводят 1500 мг глюкозамина (20 мг / кг у субъекта массой 75 кг). Эти предписанные количества в лучшем случае обеспечивают концентрацию гексозамина в плазме на уровне 0,15–0,30 мМ у среднестатистического европейца. Два из вышеупомянутых экспериментальных исследований были проведены с концентрациями глюкозамина в этом диапазоне [115, 117].Остальные были сделаны с использованием нефизиологических уровней глюкозамина в питательной среде в диапазоне от 0,56 до 139,66 мМ [106–113, 116], в условиях, при которых ингибирование катаболических эффектов, вызванных IL1β, могло быть связано с токсичностью глюкозамина [118].
Актуальность результатов in vitro , полученных с супрафизиологическими дозами глюкозамина, остается спорным, поскольку ежедневное введение ∼20 мг / кг глюкозамина пероральным путем кроликам, у которых выполнялось перерезание передней крестообразной связки, имело только обнаруживаемый участок. -специфический, частичный модифицирующий болезнь эффект в этой модели ОА.Введение глюкозамина не предотвращало фибрилляцию и / или эрозию суставного хряща у обработанных животных [119]. Кроме того, парентеральное введение 200 мг / кг N-ацетил-глюкозамина на кроличьей модели экспериментального ОА коленного сустава не показало хондропротекторных эффектов [120]. Механизм действия, с помощью которого этот гексозамин, таким образом, мог повлиять на эволюцию одной человеческой популяции с ОА коленного сустава [121, 122], таким образом, еще предстоит выяснить. Принимая во внимание отсутствие хондрозащиты в экспериментальных животных моделях ОА, подтверждение хондропротекторных эффектов глюкозамина в человеческой популяции было бы ценным.
Кортикостероиды и ИЛ-1
Гомеостаз ВКМ клетками суставного хряща зависит от контроля ауто / паракринных катаболических каскадов, индуцированных ИЛ-1 [21]. Множество эндокринных гормонов и факторов роста способны контролировать эту активность IL-1. Традиционно сообщалось, что кортикостероиды напрямую влияют на синтез ИЛ-1 [123, 124]. Как показано на культурах хрящевых эксплантатов, кортикостероидные гормоны в физиологических дозах ингибируют деградацию внеклеточного матрикса [125–127].Это ингибирование пути IL-1 привело к снижению патологической активности нейтральных протеаз в хрящевой ткани [128–132]. Помимо того факта, что кортикостероиды действуют синергетически с различными основными факторами роста и дифференцировки, влияя на синтез основного вещества внеклеточного матрикса [133–135], антикатаболические эффекты кортикостероидов, по крайней мере, частично объясняют защитные эффекты на хрящ ОА однократных или периодических местное или системное введение физиологических доз кортикостероидов в различных моделях экспериментально индуцированного ОА, таких как модель менискэктомированного кролика [136, 137], при химически индуцированном повреждении хряща у морской свинки [138] и в модели собаки Паунда-Нуки. ОА [132, 139].Подобные защитные эффекты этих препаратов наблюдались на хрящах остеоартрита у людей [131]. Это подавление IL-1 физиологическими дозами кортикостероидов вместе с повышающей регуляцией рецептора IGF-1 в конечном итоге привело к накоплению соединений ECM в непосредственном окружении хрящевых клеток in vitro [63, 140] .
Защита и регенерация суставного хряща с помощью блокаторов цитокинов: подтверждение концепции
Совсем недавно были зарегистрированы драматические хондропротекторные эффекты у пациентов с РА и деструктивным артритом, ассоциированным со спондилоартропатией (СПА).У этих пациентов TNF-α, высвобождаемый в синовиальной мембране, запускает катаболический ауто / паракринный путь IL-1 хондроцитов в соседнем суставном хряще [141]. Результирующий каскад ауто / паракринного IL-1 будет вызывать разрушение внеклеточного матрикса суставного хряща. Лечение пациентов с РА рекомбинантными белками, поглощающими TNF-α, подавляет активность IL-1 хондроцитов и останавливает эрозивную прогрессию, продолжающуюся в течение этих воспалительных заболеваний [142]. Нейтрализация TNF-α при RA в конечном итоге приводит к очевидному восстановлению пораженных суставов [143].Повторное появление исчезнувшей суставной щели было зарегистрировано при периферическом артрите, связанном с СПА [144, 145] (рис. 3). Сходным образом при ОА ауто / паракринный TNF-α, возникающий в результате апоптоза хондроцитов [31–34] после чрезмерного механического стресса, вызывает индуцированное IL-1 разрушение внеклеточной среды суставного хряща. Насколько подобное блокирование TNF-α может привести к остановке прогрессирования этого заболевания, еще не изучено.
Рис.3.
Хондрозащита и регенерация суставного хряща блокаторами цитокинов. (A) Тазобедренный сустав пациента с анкилозирующим спондилитом до (слева) и после 1 года лечения инфликсимабом, блокирующим TNF-α моноклональным антителом. Прекращено развитие эрозии, вновь появилась суставная щель. (B) Такое же течение наблюдалось в третьем проксимальном межфаланговом суставе и втором дистальном межфаланговом суставе пациента, страдающего псориатическим артритом. Эти записи были получены после завершения серии проспективных рандомизированных плацебо-контролируемых исследований, одобренных местным комитетом по этике, в которые были включены 107 пациентов для изучения влияния инфликсимаба на клинические признаки спондилоартропатии [144]. , Ван дер Бош, представлен].Рентгеновские снимки пораженных суставов были сделаны при поступлении и через 1 год наблюдения. (C) При эрозивном ОА межфалангового сустава пальца подобный тип ремоделирования происходит спонтанно после прекращения деструктивного эпизода. Четыре рентгеновских снимка были сделаны с интервалом в 1 год [145].
Рис. 3.
Хондрозащита и регенерация суставного хряща цитокиноблокаторами. (A) Тазобедренный сустав пациента с анкилозирующим спондилитом до (слева) и после 1 года лечения инфликсимабом, блокирующим TNF-α моноклональным антителом.Прекращено развитие эрозии, вновь появилась суставная щель. (B) Такое же течение наблюдалось в третьем проксимальном межфаланговом суставе и втором дистальном межфаланговом суставе пациента, страдающего псориатическим артритом. Эти записи были получены после завершения серии проспективных рандомизированных плацебо-контролируемых исследований, одобренных местным комитетом по этике, в которые были включены 107 пациентов для изучения влияния инфликсимаба на клинические признаки спондилоартропатии [144]. , Ван дер Бош, представлен].Рентгеновские снимки пораженных суставов были сделаны при поступлении и через 1 год наблюдения. (C) При эрозивном ОА межфалангового сустава пальца подобный тип ремоделирования происходит спонтанно после прекращения деструктивного эпизода. Четыре рентгеновских снимка были сделаны с интервалом в 1 год [145].
Обсуждение
Идентичные пути цитокинов и факторов роста контролируют разрушение и восстановление при ОА и воспалительных заболеваниях суставов, таких как RA и SPA-ассоциированный артрит. Однонаправленные каскады цитокинов, управляемые TNF-α / IL-1, нарушают гомеостаз ECM суставного хряща при этих нарушениях.TNF-α, происходящий из синовиальной мембраны, запускает каскад во время воспалительных патологий, в то время как при ОА аутокринный TNF-α, высвобождаемый апоптозными клетками суставного хряща, вызывает активность IL-1. Как при воспалительных, так и при дегенеративных состояниях, каскады цитокинов, управляемые TNF-α / IL-1, преобладают над путями факторов роста, способствующих анаболической репарации. Однако, когда биологические препараты, блокирующие TNF-α, вводили при иммунологически опосредованных воспалительных артритах, безошибочно было продемонстрировано восстановление тканей.В СПА зафиксировано повторное появление ранее исчезнувшей суставной щели.
Точно так же репрессия каскадов цитокинов, управляемых TNF-α / IL-1, должна позволить репарации стать еще более очевидной при ОА, поскольку пути анаболического фактора роста также сверхэкспрессируются в этом состоянии. Было показано, что кортикостероиды, отдельные классы (поли) сульфатированных полисахаридов, тетрациклины, диацетилреин / реин, авокадо / соевые бобы и глюкозамин подавляют IL-1 и, по-видимому, подавляют нижестоящие характеристики IL-1, например.грамм. активность коллагеназы, протеогликаназы и ММП, экспрессия iNOS и повышенное высвобождение NO, а также выделение PGE 2 , IL-6 и IL-8. За исключением кортикостероидов и диацетилреина, эти агенты не продемонстрировали стимуляции активности фактора роста. Все эти CTSMA, способные непосредственно влиять на синтез и высвобождение IL-1 in vitro , как было показано, обладают активностью DMOAD в экспериментальных моделях ОА и в популяциях людей с ОА коленных и пальцевых суставов.Эффекты DMOAD глюкозамина in vivo остаются несколько спорными, поскольку концентрации гексозаминов, которые были эффективны в экспериментах in vitro , никогда не были достигнуты при системном введении аминосахаров экспериментальным животным или людям. Фармакологическое усиление факторов, способствующих репарации, например Ожидается, что TGF-β и / или IGF-1 не сильно повлияют на изменение заболевания при ОА. Пути анаболического восстановления уже чрезмерно выражены при этом заболевании.Этим объясняется затяжной характер ОА и очевидные признаки ремоделирования тканей сустава ОА.
Поскольку однонаправленный каскад цитокинов, управляемый TNF-α / IL-1, был идентифицирован как лекарственная мишень при ОА, простые лабораторные процедуры позволят обнаружить новую серию CTSMA с активностями DMOAD.
Авторы заявили об отсутствии конфликта интересов.
Список литературы
1Altman RD, Hochberg MC, Moskowitz RW, Schnitzer TJ.Рекомендации по медикаментозному лечению остеоартроза тазобедренного и коленного суставов. Обновление 2000 года. Подкомитет ACR по рекомендациям по остеоартриту.
ревматоидный артрит
2000
;43
:1905
–15,2Chambers MG, Bayliss MT, Mason RM. Экспрессия цитокинов хондроцитов и факторов роста при остеоартрите мышей.
Тележка для лечения артроза
1997
;5
:301
–8.3Моос В., Фикерт С., Мюллер Б., Вебер Ю., Сипер Дж.Иммуногистологический анализ экспрессии цитокинов при остеоартрите человека и здоровом хряще.
J Rheumatol
1999
;26
:870
–9,4van Beuningen HM, van der Kraan PM, Arntz OJ, van den Berg WB. Защита от интерлейкина 1 индуцировала разрушение суставного хряща путем трансформации фактора роста бета: исследования на анатомически неповрежденном хряще in vitro и in vivo .
Ann Rheum Dis
1993
;52
:185
–91.5Guenther HL, Guenther HE, Froesch ER, Fleisch H. Влияние инсулиноподобного фактора роста на синтез коллагена и гликозаминогликанов суставными хондроцитами кролика в культуре.
Experientia
1982
;38
:979
–81,6McQuillan DL, Handley CJ, Campbell MA, Bolis S, Milway VE, Herington AC. Стимуляция синтеза протеогликана сывороткой и инсулиноподобным фактором роста-1 в культивируемом суставном хряще крупного рогатого скота.
Biochem J
1986
;240
:423
–30.7Luyten FP, Hascall VC, Nissley SP, Morales TI, Reddi AH. Инсулиноподобные факторы роста поддерживают стабильный метаболизм протеогликанов в эксплантатах суставного хряща крупного рогатого скота.
Arch Biochem Biophys
1988
;267
:416
–25,8Tesch GH, Handley CJ, Cornell HJ, Herington AC. Влияние свободных и связанных инсулиноподобных факторов роста на метаболизм протеогликанов в эксплантатах суставного хряща.
J Orthop Res
1992
;10
:14
–22.9Verbruggen G, Malfait AM, Dewulf M, Broddelez C, Veys EM. Стандартизация питательных сред для изолированных суставных хондроцитов человека в гелеобразной суспензионной культуре агарозы.
Тележка для лечения артроза
1995
;3
:249
–59,10Yaeger PC, Masi TL, de Ortiz JL, Binette F, Tubo R, McPherson JM. Синергетическое действие трансформирующего фактора роста-бета и инсулиноподобного фактора роста-I индуцирует экспрессию генов коллагена и аггрекана типа II в суставных хондроцитах взрослого человека.
Exp Cell Res
1997
;237
:318
–25,11Verschure PJ, van Marle J, Joosten LA, van den Berg WB. Экспрессия хондроцитарного рецептора IGF-1 и реакция на стимуляцию IGF-1 в суставном хряще мыши во время различных фаз экспериментально индуцированного артрита.
Ann Rheum Dis
1995
;54
:645
–53,12Саклатвала Дж., Пилсворт ЛМК, Сарсфилд С.Дж., Гравилович Дж., Хит Дж. К.. Катаболин свиньи — это форма интерлейкина 1.
Biochem J
1984
;224
:461
–6,13Дингл Дж. Т., Саклатвала Дж., Хембри Р., Тайлер Дж., Фелл Х. Б., Джубб Р. Катаболический фактор хряща из синовиальной оболочки.
Biochem J
1979
;184
:177
–80,14Dingle JT. Влияние синовиального катаболина на синтетическую активность хряща.
Connect Tiss Res
1984
;12
:277
–86,15Тайлер Дж. А., Саклатвала Дж.Свиной ИЛ-1 (катаболин) вызывает резорбцию протеогликана хряща и предотвращает синтез протеогликана и коллагена.
Br J Rheumatol
1985
;24 (Дополнение 1)
:150
–5,16Таскиран Д., Стефанович-Рачич М., Георгеску Х.И., Эванс Ч. Оксид азота опосредует подавление синтеза протеогликанов хряща интерлейкином-1.
Biochem Biophys Res Commun
1994
;200
:142
–8,17Берд Т.А., Саклатвала Дж.Идентификация общего класса рецепторов с высоким сродством для обоих типов интерлейлина-1 на клетках соединительной ткани.
Nature
1986
;324
:263
–6,18Чандрасекхар С., Харви А.К. Индукция рецепторов интерлейкина-1 на хондроцитах фактором роста фибробластов: возможный механизм модуляции активности интерлейкина-1.
J Cell Physiol
1989
;138
:236
–46,19Colotta F, Re F, Muzio M et al .Рецептор интерлейкина-1 типа II: мишень-приманка для IL-1, которая регулируется IL-4.
Наука
1993
;261
:472
–5.20Аттур М.Г., Дэйв М., Чиполлетта С. и др. . Обращение аутокринных и паракринных эффектов интерлейкина 1 (ИЛ-1) при артрите человека с помощью рецептора-ловушки ИЛ-1 типа II. Возможность фармакологического вмешательства.
J Biol Chem
2000
;275
:40307
–1521Wang J, Elewaut D, Veys EM, Verbruggen G.Индуцированный инсулиноподобным фактором роста 1 рецептор интерлейкина-1 II подавляет активность интерлейкина-1 и контролирует гомеостаз внеклеточного матрикса хряща.
Arthritis Rheum
2003
;48
:1281
–91,22Тайлер Дж. А.. Инсулиноподобный фактор роста 1 может уменьшать деградацию и способствовать синтезу протеогликана в хряще, подвергающемся действию цитокинов.
Biochem J
1989
;260
:543
–8.23Миддлтон Дж. Ф., Тайлер Дж. А. Повышение экспрессии гена инсулиноподобного фактора роста I в поражениях суставного хряща человека при остеоартрите.
Ann Rheum Dis
1992
;51
:440
–7,24Миддлтон Дж., Манти А., Тайлер Дж. Рецептор инсулиноподобного фактора роста (ИФР), ИФР-I, интерлейкин-1 бета (ИЛ-1 бета) и экспрессия мРНК ИЛ-6 при остеоартрите и нормальном хряще человека.
J Histochem Cytochem
1996
;44
:133
–41.25Verschure PJ, Marle JV, Joosten LA, Helsen MM, Lafeber FP, Berg WB. Локализация рецептора инсулиноподобного фактора роста-1 в нормальном и остеоартрозном хрящах человека в отношении синтеза и содержания протеогликана.
Br J Rheumatol
1996
;35
:1044
–55.26Ван Дж., Вердонк П., Элевот Д., Вейс Е.М., Вербрюгген Г. Гомеостаз внеклеточного матрикса нормальных и остеоартрозных хондроцитов суставного хряща человека in vitro.
Тележка для лечения артроза
2003
;11
:801
–9.27Шлопов Б.В., Гумановская М.Л., Поспешный К.А. Аутокринная регуляция коллагеназы 3 (матриксная металлопротеиназа 13) при остеоартрите.
ревматоидный артрит
2000
;43
:195
–205.28Pelletier JP, Martel-Pelletier J, Howell DS, Ghandur-Mnaymneh L, Enis JE, Woessner JF Jr. Коллагеназа и коллагенолитическая активность в остеоартритическом хряще человека.
Arthritis Rheum
1983
;26
:63
–8.29Okada Y, Shinmei M, Tanaka O et al .Локализация матричной металлопротеиназы 3 (стромелизина) в остеоартрозном хряще и синовиальной оболочке.
Lab Invest
1992
;66
:680
–90,30Arner EC, Tortorella MD. Передача сигнала через рецепторы интегрина хондроцитов индуцирует синтез матриксной металлопротеиназы и действует синергично с интерлейкином-1.
Arthritis Rheum
1995
;38
:1304
–14,31Orlando S, Sironi M, Bianchi G et al .Роль металлопротеаз в высвобождении рецептора-ловушки IL-1 типа II.
J Biol Chem
1997
;272
:31764
–9,32Penton-Rol G, Orlando S, Polentarutti N et al . Бактериальный липополисахарид вызывает быстрое отщепление с последующим ингибированием экспрессии мРНК рецептора IL-1 типа II с одновременной активацией рецептора типа I и индукцией не полностью сплайсированных транскриптов.
J Immunol
1999
;162
:2931
–8.33Д’Лима Д.Д., Хашимото С., Чен П.С., Колвелл С.В. мл., Лотц М.К. Апоптоз хондроцитов человека в ответ на механическое повреждение.
Тележка для лечения артроза
2001
;9
:712
–9,34Редман С.Н., Даутуэйт Г.П., Томсон Б.М., Арчер CW. Клеточные реакции суставного хряща на резкую и тупую травму.
Тележка для лечения артроза
2004
;12
:106
–16.35Айзава Т., Кон Т., Эйнхорн Т.А., Герстенфельд LC.Индукция апоптоза хондроцитов фактором некроза опухоли-α.
J Orthop Res
2001
;19
:785
–96,36Islam N, Haqqi TM, Jepsen KJ et al . Гидростатическое давление вызывает апоптоз хондроцитов человека из остеоартрозного хряща за счет усиления фактора некроза опухоли-α, индуцибельной синтазы оксида азота, p53, c-myc и bax-alpha, а также подавления bcl-2.
J Cell Biochem
2002
;87
:266
–78.37Моос В., Фикерт С., Мюллер Б., Вебер Ю., Сипер Дж. Иммуногистологический анализ экспрессии цитокинов в человеческом остеоартрите и здоровом хряще.
J Rheumatol
1999
;26
:870
–9.38Verdier MP, Seite S, Guntzer K, Pujol JP, Boumediene K. Иммуногистохимический анализ бета-изоформ трансформирующего фактора роста и их рецепторов в хряще человека из нормальных и остеоартрозных головок бедренной кости.
Rheumatol Int
2005
;25
:118
–24.39Четина Е.В., Сквайрс Дж., Пул А.Р. Усиленная деградация коллагена II типа и очень ранняя очаговая дегенерация хряща связаны с активацией генов, связанных с дифференцировкой хондроцитов, в ранних поражениях суставного хряща человека.
J Ревматол
2005
;32
:876
–86,40Харви А.К., Хрубей П.С., Чандрасекхар С. Ингибирование активности интерлейкина-1 трансформирующим фактором роста бета включает подавление рецепторов интерлейкина-1 на хондроцитах.
Exp Cell Res
1991
;195
:376
–85,41Эйлау О. Внутрисуставная гепаринотерапия истинного деформирующего артроза коленного сустава.
Мед Клин
1959
;54
:145
.42Эйлау О. О патогенезе и причинном лечении артроза коленного сустава.
Мед Клин
1960
;55
:2367
–70,43Momburg M, Stuhlsatz HW, Vogeli H, Vojtisek O, Eylau O, Greiling H.Клинические химические изменения в синовиальной жидкости после внутрисуставной инъекции полисульфата гликозаминогликана.
Z Rheumatol
1976
;35 (Приложение 4)
:389
–90,44Нево З., Хорвиц А.Л., Дорфман А. Синтез хондромукопротеина хондроцитами в суспензионной культуре.
Дев Биол
1972
;28
:219
–28.45Нево З., Дорфман А. Стимуляция синтеза хондромукопротеинов в хондроцитах внеклеточным хондромукопротеином.
Proc Natl Acad Sci USA
1972
;69
:2069
–72,46Kosher RA, Lash JW, Minor RR. Экологическое усиление хондрогенеза in vitro.
Дев Биол
1973
;35
:210
–20,47Шварц Н.Б., Дорфман А. Стимуляция продукции хондроитинсульфат-протеогликана хондроцитами в монослое.
Conn Tiss Res
1975
;3
:115
–22,48Verbruggen G, Veys EM.Влияние сульфатированных гликозаминогликанов на метаболизм протеогликанов в клетках синовиальной оболочки.
Acta Rheumatol
1977
;1
:75
–92,49Verbruggen G, Veys EM. Влияние гиперсульфатированного гепариноида на метаболизм гиалуроната синовиальной клетки человека in vivo .
J Rheumatol
1979
;6
:554
–61,50Kalbhen DA. Экспериментальное подтверждение противоартритной активности полисульфата гликозаминогликана.
Z Rheumatol
1983
;42
:178
–84,51Carreno MR, Muniz OE, Howell DS. Эффект гликозаминогликана сложного эфира полисерной кислоты на суставной хрящ при экспериментальном остеоартрите: влияние на морфологические переменные тяжести заболевания.
J Rheumatol
1986
;13
:490
–7,52Бреннан Дж. Дж., Ахерн FX, Накано Т. Влияние лечения полисульфатом гликозаминогликана на прочность, содержание гиалуроновой кислоты в синовиальной жидкости и протеогликановый агрегат в суставном хряще хромого хряка.
Can J Vet Res
1987
;51
:394
–8,53Убельхарт Д., Тонар Э. Дж., Чжан Дж., Уильямс Дж. М.. Защитный эффект экзогенного хондроитин-4,6-сульфата при острой деградации суставного хряща у кролика.
Тележка для лечения артроза
1998
;6 (Дополнение A)
:6
–13,54Verbruggen G, Goemaere S, Veys EM. Хондроитинсульфат: S / DMOAD (лекарственное средство против остеоартрита, изменяющее структуру / заболевание) при лечении остеоартрита суставов пальцев.
Тележка для лечения артроза
1998
;6 (Дополнение A)
:37
–8,55Verbruggen G, Goemaere S, Veys EM. Системы для оценки прогрессирования остеоартрита суставов пальцев и эффектов лекарств, влияющих на лечение остеоартрита.
Clin Rheumatol
2002
;21
:231
–43,56Убельхарт Д., Тонар Э. Дж., Дельмас П. Д., Шантрейн А., Виньон Э. Влияние перорального хондроитинсульфата на прогрессирование остеоартрита коленного сустава: пилотное исследование.
Тележка для лечения артроза
1998
;6 (Дополнение A)
:39
–46,57Убельхарт Д., Малез М., Марколонго Р. и др. . Прерывистое лечение остеоартроза коленного сустава пероральным хондроитинсульфатом: однолетнее рандомизированное двойное слепое многоцентровое исследование по сравнению с плацебо.
Тележка для лечения артроза
2004
;12
:269
–76,58Michel BA, Stucki G, Frey D et al . Хондроитины 4 и 6 сульфат при остеоартрозе коленного сустава: рандомизированное контролируемое исследование.
Arthritis Rheum
2005
;52
:779
–86,59Verbruggen G, Veys EM. Внутрисуставная инъекция пентозанполисульфата приводит к увеличению молекулярной массы гиалуронана в суставной жидкости.
Clin Exp Rheumatol
1992
;10
:249
–54,60Francis DJ, Hutadilok N, Kongtawelert P, Ghosh P. Полисульфат пентозана и полисульфат гликозаминогликана стимулируют синтез гиалуронана in vivo .
Rheumatol Int
1993
;13
:61
–4,61Verbruggen G, Cornelissen M, Elewaut D, Broddelez C, De Ridder L., Veys EM. Влияние полисульфатированных полисахаридов на аггреканы, синтезируемые дифференцированными суставными хондроцитами человека.
J Rheumatol
1999
;26
:1663
–71,62Sadowski T., Steinmeyer J. Влияние полисульфатированного гликозаминогликана и триамцинолона ацетонида на продукцию протеиназ и их ингибиторов обработанными IL-1alpha суставными хондроцитами.
Biochem Pharmacol
2002
;64
:217
–27.63Ван Л., Ван Дж., Альмквист К.Ф., Вейс Е.М., Вербругген Г. Влияние полисульфатированных полисахаридов и гидрокортизона на метаболизм внеклеточного матрикса суставных хондроцитов человека in vitro.
Clin Exp Rheumatol
2002
;20
:669
–76,64Tung JT, Venta PJ, Caron JP. Индуцируемая экспрессия оксида азота в суставных хондроцитах лошади: эффекты противовоспалительных соединений.
Тележка для лечения артроза
2002
;10
:5
–12,65Verdonk P, Wang J, Elewaut D, Broddelez C, Veys EM, Verbruggen G. Полисульфаты циклодекстрина усиливают восстановление внеклеточного матрикса хондроцитов человека.
Тележка для лечения артроза
2005
;13
:887
–95.66Muller W., Panse P, Brand S, Staubli A. Исследование in vivo распределения, сродства к хрящам и метаболизма полисульфата гликозаминогликана (GAGPS, Arteparon).
Z Rheumatol
1983
;42
:355
–61.67Volpi N. Пероральное всасывание и биодоступность хондроитинсульфата ихтикового происхождения у здоровых добровольцев мужского пола.
Тележка для лечения артроза
2003
;11
:433
–41.68Volpi N. Биодоступность хондроитинсульфата (Кондросульф) и его компонентов при пероральном введении у здоровых добровольцев мужского пола.
Тележка для лечения артроза
2002
;10
:768
–77.69Хенротин Ю.Е., Санчес С., Деберг М.А. и др. . Неомыляемые вещества авокадо / соевые бобы увеличивают синтез аггрекана и снижают выработку катаболических и провоспалительных медиаторов хондроцитами человека при остеоартрите.
J Ревматол
2003
;30
:1825
–34,70Kut-Lasserre C, Miller CC, Ejeil AL et al . Влияние неомыляемых веществ авокадо и сои на желатиназу A (MMP-2), стромелизин 1 (MMP-3) и тканевые ингибиторы секреции матриксной металлопротеиназы (TIMP-1 и TIMP-2) фибробластами человека в культуре.
J Periodontol
2001
;72
:1685
–94,71Хайял MT, Эль-Газали, Массачусетс. Возможный «хондрозащитный» эффект неомыляемых компонентов авокадо и сои in vivo .
Drugs Exp Clin Res
1998
;24
:41
–50.72Cake MA, Read RA, Guillou B., Ghosh P. Модификация патологии суставного хряща и субхондральной кости в модели остеоартрита менискэктомии у овец неомыляемыми веществами авокадо и сои (ASU).
Тележка для лечения артроза
2000
;8
:404
–11.73Lequesne M, Maheu E, Cadet C, Dreiser RL. Структурное влияние неомыляемых веществ авокадо / сои на потерю суставной щели при остеоартрозе тазобедренного сустава.
Arthritis Rheum
2002
;47
:50
–8,74Yu LP Jr, Smith GN Jr, Hasty KA, Brandt KD. Доксициклин подавляет коллагенолитическую активность экстрактов из хрящей остеоартроза человека и желатиназы типа XI.
J Rheumatol
1991
;18
:1450
–2,75Шлопов Б.В., Смит Г.Н. мл., Коул А.А., Хэсти К.А. Дифференциальные паттерны ответа на доксициклин и трансформирующий фактор роста бета1 при подавлении коллагеназ в остеоартрите и нормальных хондроцитах человека.
Arthritis Rheum
1999
;42
:719
–27,76Шлопов Б.В., Стюарт Ю.М., Гумановская М.Л., Хасты К.А. Регулирование коллагеназы хряща доксициклином.
J Ревматол
2001
;28
:835
–42,77Borderie D, Hernvann A, Hilliquin P, Lemarchal H, Kahan A, Ekindjian OG. Тетрациклины подавляют выработку нитрозотиола цитокин-стимулированными синовиальными клетками остеоартрита.
Inflamm Res
2001
;50
:409
–14,78Amin AR, Attur MG, Thakker GD et al . Новый механизм действия тетрациклинов: эффекты на синтазы оксида азота.
Proc Natl Acad Sci USA
1996
;93
:14014
–9,79Smith GN Jr, Yu LP Jr, Brandt KD, Capello WN. Пероральный прием доксициклина снижает активность коллагеназы и желатиназы в экстрактах остеоартрозного хряща человека.
J Rheumatol
1998
;25
:532
–5,80Jauernig S, Schweighauser A, Reist M, Von Rechenberg B., Schawalder P, Spreng D. Влияние доксициклина на выработку оксида азота и стромелизина у собак с разрывом черепной крестообразной связки.
Вет Сург
2001
;30
:132
–9,81de Bri E, Lei W., Svensson O, Chowdhury M, Moak SA, Greenwald RA. Влияние ингибитора матриксных металлопротеиназ на спонтанный остеоартрит у морских свинок.
Adv Dent Res
1998
;12
:82
–5,82Ю Л.П. младший, Смит Г.Н. мл., Брандт К.Д., Майерс С.Л., О’Коннор Б.Л., Брандт Д.А. Уменьшение тяжести остеоартроза собак путем профилактического лечения пероральным доксициклином.
Arthritis Rheum
1992
;35
:1150
–9,83Brandt KD, Mazzuca SA, Katz BP et al . Влияние доксициклина на прогрессирование остеоартрита: результаты рандомизированного плацебо-контролируемого двойного слепого исследования.
Arthritis Rheum
2005
;52
:2015
–25,84Franchi-Micheli S, Lavacchi L, Friedmann CA, Ziletti L. Влияние реина на простагландиноподобные вещества in vitro .
J Pharm Pharmacol
1983
;35
:262
–4,85Pomarelli P, Berti M, Gatti MT, Mosconi P. Нестероидный противовоспалительный препарат, который стимулирует высвобождение простагландинов.
Farmaco Ed Sci
1980
;35
:836
–42,86Pelletier JP, Mineau F, Fernandes JC, Duval N, Martel-Pelletier J. Диацерхеин и реин снижают уровень и активность индуцибельного синтеза оксида азота, стимулированные интерлейкином 1beta, одновременно стимулируя синтез циклооксигеназы-2 у человека. остеоартрозные хондроциты.
J Rheumatol
1998
;25
:2417
–24,87Тамура Т., Омори К. Диацереин подавляет увеличение оксида азота в плазме при артрите, индуцированном адъювантом у крыс.
евро J Pharmacol
2001
;419
:269
–74,88Attur MG, Patel RN, Patel PD, Abramson SB, Amin AR. Тетрациклин усиливает экспрессию ЦОГ-2 и продукцию простагландина E 2 независимо от его воздействия на оксид азота.
J Immunol
1999
;162
:3160
–7.89Патель Р.Н., Аттур М.Г., Дэйв М.Н. и др. . Новый механизм действия химически модифицированных тетрациклинов: ингибирование производства простагландина E2, опосредованного ЦОГ-2.
Иммунология
1999
;163
:3459
–67,90Ярон М., Ширази И., Ярон И. Анти-интерлейкин-1 эффекты диацереина и реина в синовиальной ткани и культурах хрящей человека при остеоартрите.
Тележка для лечения артроза
1999
;7
:272
–80.91Martel-Pelletier J, Mineau F, Jolicoeur FC, Cloutier JM, Pelletier JP. In vitro эффекты диацереина и реина на системы интерлейкина 1 и фактора некроза опухоли альфа в синовиальной оболочке и хондроцитах человека при остеоартрите.
J Rheumatol
1998
;25
:753
–62.92Moldovan F, Pelletier JP, Jolicoeur FC, Cloutier JM, Martel-Pelletier J. Diacerhein и rhein снижают индуцированную ICE активацию IL-1beta и IL-18 в остеоартритическом хряще человека.
Тележка для лечения артроза
2000
;8
:186
–96.93Мендес А.Ф., Карамона М.М., де Карвалью А.О., Лопес М.С. Диацереин и реин предотвращают индуцированную интерлейкином-1бета активацию ядерного фактора каппаВ, ингибируя деградацию ингибитора каппаВ-альфа.
Pharmacol Toxicol
2002
;91
:22
–8.94Дозин Б., Мальпели М., Камарделла Л., Канседда Р., Пьетранджело А. Реакция суставных хондроцитов человека молодого, пожилого и остеоартритического возраста на воспалительные цитокины: молекулярные и клеточные аспекты.
Матрикс Биол
2002
;21
:449
–59,95Boittin N, Redini F, Loyau G, Pujol JP. Влияние диацереина (ART 50) на синтез матрикса и секрецию коллагеназы культивированными хондроцитами суставов кроликов.
Rev Rhum
1993
;60
:68S
–76S.96Tamura T., Kosaka N, Ishiwa J, Sato T, Nagase H, Ito A. Rhein, активный метаболит диацереина, подавляет продукцию проматричных металлопротеиназ-1 , -3, -9 и -13 и повышают продукцию тканевого ингибитора металлопротеиназы-1 в культивируемых суставных хондроцитах кролика.
Тележка для лечения артроза
2001
;9
:257
–63.97Тамура Т., Омори К. Рейн, активный метаболит диацереина, подавляет индуцированную интерлейкином-1альфа деградацию протеогликана в культивируемых суставных хондроцитах кролика.
Jpn J Pharmacol
2001
;85
:101
–4,98Фелисаз Н., Бумедьен К., Гайор С. и др. . Стимулирующее действие диацереина на экспрессию TGF-beta1 и beta2 в суставных хондроцитах, культивируемых с интерлейкином-1 и без него.
Тележка для лечения артроза
1999
;7
:255
–64,99Mazieres B, Berdah L, Thiechart M, Viguier G. Diacetylrhein на постконтузионной модели экспериментального остеоартрита у кролика.
Rev Rhum
1993
;60
:77S
–81S.100Тамура Т., Омори К., Накамура К. Влияние диацереина на спонтанный полиартрит у самцов новозеландских черных мышей / KN.
Тележка для лечения артроза
1999
;7
:533
–8.101Карни SL. Влияние диацетилреина на развитие экспериментального остеоартроза. Биохимическое исследование.
Тележка для лечения артроза
1996
;4
:251
–61.102Брандт К.Д., Смит Г., Канг С.И., Майерс С., О’Коннор Б., Альбрехт Н. Эффекты диацереина в ускоренной модели остеоартрита у собак.
Тележка для лечения артроза
1997
;5
:438
–49.103Smith GN Jr, Myers SL, Brandt KD, Mickler EA, Albrecht ME.Лечение диацереином снижает тяжесть остеоартрита на модели остеоартрита с дефицитом крестообразных связок у собак.
Arthritis Rheum
1999
;42
:545
–54.104Дугадос М., Нгуен М., Бердах Л., Мазьер Б., Лекесн М.; Исследовательская группа ECHODIAH. Оценка структурно-модифицирующих эффектов диацереина при остеоартрите тазобедренного сустава: ECHODIAH, трехлетнее плацебо-контролируемое исследование. Оценка хондромодулирующего эффекта диацереина при ОА бедра.
Arthritis Rheum
2001
;44
:2539
–47.105Pham T, Le Henanff A, Ravaud P, Dieppe P, Paolozzi L, Dougados M. Оценка симптоматической и структурной эффективности нового соединения гиалуроновой кислоты, NRD101, по сравнению с диацереином и плацебо в 1-летнем рандомизированном контролируемом исследовании симптоматического остеоартрита коленного сустава.
Ann Rheum Dis
2004
;63
:1611
–7.106Gouze JN, Bianchi A, Becuwe P et al .Глюкозамин модулирует индуцированную IL-1 активацию хондроцитов крысы на уровне рецепторов и путем ингибирования пути NF-каппа B.
FEBS Lett
2002
;510
:166
–70.107Shikhman AR, Kuhn K, Alaaeddine N, Lotz M. N-ацетилглюкозамин предотвращает опосредованную IL-1 бета активацию хондроцитов человека.
J Immunol
2001
;166
:5155
–60.108Largo R, Alvarez-Soria MA, Diez-Ortego I et al .Глюкозамин ингибирует индуцированную IL-1beta активацию NFkappaB в хондроцитах человека, страдающих остеоартритом.
Тележка для лечения артроза
2003
;11
:290
–8.109Piperno M, Reboul P, Hellio Le Graverand MP et al . Сульфат глюкозамина модулирует дисрегулируемую активность хондроцитов остеоартрита человека in vitro .
Тележка для лечения артроза
2000
;8
:207
–12.110Накамура Х., Шибакава А., Танака М., Като Т., Нисиока К.Влияние гидрохлорида глюкозамина на продукцию простагландина E2, оксида азота и металлопротеаз хондроцитами и синовиоцитами при остеоартрите.
Clin Exp Rheumatol
2004
;22
:293
–9.111Gouze JN, Bordji K, Gulberti S et al . Интерлейкин-1бета подавляет экспрессию глюкуронозилтрансферазы I, ключевого фермента, запускающего биосинтез гликозаминогликанов: влияние глюкозамина на опосредованные интерлейкином-1бета эффекты в хондроцитах крыс.
Arthritis Rheum
2001
;44
:351
–60.112Fenton JI, Chlebek-Brown KA, Caron JP, Orth MW. Влияние глюкозамина на интерлейкин-1 суставной хрящ.
Equine Vet J Suppl
2002
;34
:219
–23.113Fenton JI, Chlebek-Brown KA, Peters TL, Caron JP, Orth MW. Глюкозамин HCl снижает деградацию суставного хряща лошади в культуре эксплантата.
Тележка для лечения артроза
2000
;8
:258
–65.114Tung JT, Venta PJ, Eberhart SW, Yuzbasiyan-Gurkan V, Alexander L, Caron JP. Влияние препаратов против артрита на экспрессию генов и ферментативную активность циклооксигеназы-2 в культивируемых хондроцитах лошадей.
Am J Vet Res
2002
;63
:1134
–9.115Dodge GR, Jimenez SA. Сульфат глюкозамина регулирует уровни аггрекана и матриксной металлопротеиназы-3, синтезируемые культивированными суставными хондроцитами человека, страдающими остеоартритом.
Тележка для лечения артроза
2003
;11
:424
–32.116Sandy JD, Gamett D, Thompson V, Verscharen C. Опосредованный хондроцитами катаболизм аггрекана: зависимое от агреканазы расщепление, индуцированное интерлейкином-1 или ретиноевой кислотой, может ингибироваться глюкозамином.
Biochem J
1998
;335
:59
–66.117Патвари П., Курц Б., Сэнди Д.Д., Гродзинский А.Дж. Маннозамин подавляет опосредованные агреканазой изменения физических свойств и биохимического состава суставного хряща.
Arch Biochem Biophys
2000
;374
:79
–85.118де Маттей М., Пеллати А., Паселло М. и др. . Высокие дозы глюкозамина-HCl оказывают пагубное воздействие на эксплантаты суставного хряща крупного рогатого скота, культивируемые in vitro .
Тележка для лечения артроза
2002
;10
:816
–25.119Tiraloche G, Girard C, Chouinard L et al . Влияние перорального глюкозамина на деградацию хряща на кроличьей модели остеоартрита.
Arthritis Rheum
2005
;52
:1118
–28.120Шихман А.Р., Амиэль Д., Д’Лима Д. и др. . Хондропротекторная активность N-ацетилглюкозамина у кроликов с экспериментальным остеоартрозом.
Ann Rheum Dis
2005
;64
:89
–94.121Reginster JY, Deroisy R, Rovati LC et al . Долгосрочные эффекты сульфата глюкозамина на прогрессирование остеоартрита: рандомизированное плацебо-контролируемое клиническое исследование.
Ланцет
2001
;357
:251
–6.122Pavelka K, Gatterova J, Olejarova M, Machacek S, Giacovelli G, Rovati LC. Использование сульфата глюкозамина и замедление прогрессирования остеоартрита коленного сустава: трехлетнее рандомизированное плацебо-контролируемое двойное слепое исследование.
Arch Intern Med
2002
;162
:2113
–23.123Knudsen PJ, Dinarello CA, Strom TB. Глюкокортикоиды подавляют транскрипционную и посттранскрипционную экспрессию интерлейкина 1 в клетках U937.
J Immunol
1987
;139
:4129
–34.124Ли С.В., Цоу А.П., Чан Х. и др. . Глюкокортикоиды избирательно подавляют транскрипцию гена интерлейкина 1 бета и снижают стабильность мРНК интерлейкина 1 бета.
Proc Natl Acad Sci USA
1988
;85
:1204
–8.125Pelletier JP, Cloutier JM, Martel-Pelletier J. Эффекты in vitro тиапрофеновой кислоты, салицилата натрия и гидрокортизона на метаболизм протеогликанов остеоартрозного хряща человека.
J Rheumatol
1989
;16
:646
–55,126Hill DJ. Влияние кортизола на пролиферацию клеток, синтез и деградацию протеогликанов в хрящевых зонах реберно-хрящевой пластины роста теленка in vitro с активностью соматомедина плазмы крысы и без нее.
J Endocrinol
1981
;88
:425
–35,127Такигава М., Такано Т., Накагава К., Сакуда М., Судзуки Ф. Стимуляция пролиферации и синтеза гликозаминогликанов в черепно-лицевых хондроцитах кролика in vitro .
Arch Oral Biol
1988
;33
:893
–9.128Макгуайр М.Б., Мерфи М., Рейнольдс Дж. Дж., Рассел РГГ. Производство коллагеназы и ингибитора (ТИМП) нормальной, ревматоидной и остеоартритической синовиальной оболочкой in vitro : эффекты гидрокортизона и индометацина.
Clin Biol
1981
;61
:703
–10.129Пеллетье Дж. П., Мартель-Пеллетье Дж. Разрушение хряща нейтральными протеогликаназами при экспериментальном остеоартрите.
Подавление стероидами. Arthritis Rheum
1985
;28
:1393
–401.130Martel-Pelletier J, Cloutier JM, Pelletier JP. Нейтральные протеазы синовиальной оболочки при остеоартрите человека.
Arthritis Rheum
1986
;29
:1112
–21.131Pelletier JP, Martel-Pelletier J, Cloutier JM, Woessner JF Jr. Активность кислой металлопротеиназы, разрушающей протеогликаны, в хрящах остеоартрита человека и эффекты внутрисуставных инъекций стероидов.
Arthritis Rheum
1987
;30
:541
–8.132Pelletier JP, Mineau F, Raynauld JP, Woessner JF, Gunja-Smith Z, Martel-Pelletier J. Внутрисуставные инъекции метилпреднизолона ацетата уменьшают остеоартритические поражения параллельно с синтезом хондроцитов при экспериментальном строметезинозном синдроме.
Arthritis Rheum
1994
;37
:414
–23.133Itagane Y, Inada H, Fujita K, Isshiki G.Взаимодействие между стероидными гормонами и инсулиноподобным фактором роста-I в хондроцитах кролика.
Эндокринология
1991
;128
:1419
–24.134Ван дер Краан П.М., Виттерс Е.Л., Постма Н.С., Вербунт Дж., Ван ден Берг В.Б. Поддержание синтеза крупных протеогликанов в анатомически неповрежденном суставном хряще мыши с помощью стероидов и инсулиноподобного фактора роста I.
Ann Rheum Dis
1993
;52
:734
–41.135Van Osch GJ, van der Veen SW, Verwoerd-Verhoef HL. In vitro. повторная дифференцировка выращенных в культуре кроличьих и человеческих аурикулярных хондроцитов для реконструкции хряща.
Пласт Реконстр Сург
2001
;107
:433
–40,136Коломбо С., Батлер М., Хикман Л., Селвин М., Диаграмма J, Стейнец Б. Новая модель остеоартрита у кроликов. II. Оценка антиостеоартритных эффектов выбранных противоревматических препаратов, применяемых системно.
Arthritis Rheum
1983
;26
:1132
–9.137Батлер М., Коломбо К., Хикман Л. и др. . Новая модель остеоартроза у кроликов. III. Оценка антиостеоартрозных эффектов отдельных препаратов, вводимых внутрисуставно.
Arthritis Rheum
1983
;26
:1380
–6.138Williams JM, Brandt KD. Гексацетонид триамцинолона защищает от фибрилляции и образования остеофитов после химически индуцированного повреждения суставного хряща.
Arthritis Rheum
1985
;28
:1267
–74.139Пеллетье Дж. П., Мартель-Пеллетье Дж. Защитные эффекты кортикостероидов на повреждения хряща и образование остеофитов в модели остеоартрита у собак Понд-Нуки.
Arthritis Rheum
1989
;32
:181
–93.140Ван Дж., Элеваут Д., Хоффман И., Вейс Е.М., Вербругген Г. Физиологические уровни гидрокортизона поддерживают оптимальный метаболизм внеклеточного матрикса хондроцитов.
Ann Rheum Dis
2004
;63
:61
–6.141Бреннан Ф.М., Чантри Д., Джексон А., Майни Р., Фельдманн М. Ингибирующее действие антител ФНО-альфа на выработку интерлейкина-1 синовиальными клетками при ревматоидном артрите.
Ланцет
1989
;2
:244
–7.142Lipsky PE, van der Heijde DM, St Clair EW et al . Инфликсимаб и метотрексат в лечении ревматоидного артрита.
Исследовательская группа по исследованию противоопухолевого фактора некроза при ревматоидном артрите с сопутствующей терапией.N Engl J Med
2000
;343
:1594
–602.143Смолен Дж. С., Хан С., Бала М. и др. .; Исследовательская группа ATTRACT. Доказательства радиографической пользы лечения инфликсимабом плюс метотрексат у пациентов с ревматоидным артритом, у которых не было клинического улучшения: подробный субанализ данных исследования противоопухолевого фактора некроза при ревматоидном артрите с исследованием сопутствующей терапии.
Arthritis Rheum
2005
;52
:1020
–30.144Круитхоф Э., Ван ден Бош Ф., Баетен Д. и др. . Повторные инфузии инфликсимаба, химерного моноклонального антитела против TNFalpha, пациентам с активной спондилоартропатией: наблюдение в течение одного года.
Ann Rheum Dis
2002
;61
:207
–12.145Verbruggen G, Veys EM. Системы числовой оценки анатомической эволюции остеоартроза суставов пальцев.
Arthritis Rheum
1996
;39
:308
–20.© Автор 2005. Опубликовано Oxford University Press от имени Британского общества ревматологов. Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected]
.Хондропротекторы при дегенеративных заболеваниях суставов | Ревматология
Аннотация
Катаболические пути цитокинов и анаболических факторов роста контролируют разрушение и восстановление при остеоартрите (ОА).Однонаправленный каскад цитокинов, управляемый TNF-α / IL-1, нарушает гомеостаз внеклеточного матрикса суставного хряща при ОА. Хотя хондроциты в хряще OA сверхэкспрессируют анаболический инсулиноподобный фактор роста (IGF) и его специфический рецептор (IGFRI), аутокринный TNF-α, высвобождаемый апоптотическими клетками суставного хряща, запускает ауто / паракринный каскад, управляемый IL-1, который перекрывает активность фактора роста. которые поддерживают восстановление при дегенеративных заболеваниях суставов. Хондропротекция с повторным появлением исчезнувшей суставной щели была безошибочно задокументирована в периферических суставах пациентов, страдающих спондилоартропатией, при лечении агентами, блокирующими TNF-α, которые подавляли однонаправленный цитокиновый каскад, управляемый TNF-α / IL-1.Серия агентов, модифицирующих структуру соединительной ткани (CTSMA), которые напрямую влияют на синтез ИЛ-1 и высвобождают in vitro и снижают нижерасположенные характеристики ИЛ-1, например активности коллагеназы, протеогликаназы и матриксной металлопротеиназы, экспрессия индуцибельной синтазы оксида азота, повышенное высвобождение оксида азота и секреция простагландина E 2 , IL-6 и IL-8, как было показано, обладают модифицирующим заболевание OA активность лекарственного средства (DMOAD) в экспериментальных моделях ОА и у людей с ОА суставов пальцев и коленей.Примерами являются кортикостероиды, некоторые сульфатированные полисахариды, химически модифицированные тетрациклины, диацетилреин / реин, глюкозамин и неомыляемые вещества авокадо / сои.
Утрата функции является следствием анатомических изменений тканей суставов при остеоартрозе (ОА). Вмешательство в анатомическое развитие ОА, по-видимому, является методом сохранения нормальной функции суставов. Вещества, защищающие суставной хрящ во время ОА, получили название хондрозащитных средств.Когда кажется, что они изменяют течение заболевания, эти агенты могут быть названы лекарственными средствами, модифицирующими заболевание, ОА (DMOAD) [1]. Боль в суставах при остеоартрите объясняется различными причинами, вторичными по отношению к анатомическим изменениям, например: воспалительные явления в синовиальной оболочке и субхондральная внутрикостная гипертензия из-за венозного застоя. В этом обзоре будут рассмотрены аспекты хондропротекторной терапии DMOAD, а не облегчение клинических симптомов, которые в конечном итоге могут возникнуть при назначении пациентам терапии DMOAD.
Гомеостаз внеклеточного матрикса здорового суставного хряща
Гомеостаз внеклеточного матрикса (ЕСМ) суставного хряща зависит от реакции клеток суставного хряща на ауто- и паракринные анаболические и катаболические пути. Наиболее важные факторы роста и цитокины, которые, как известно, участвуют в метаболизме хряща, вырабатываются самими хондроцитами [2, 3]. Синтез и накопление ЕСМ регулируется местно продуцируемыми факторами роста, такими как инсулиноподобные факторы роста (IGF) и трансформирующий фактор роста-β (TGF-β).Специфическая регуляторная роль TGF-β была предложена при патологических условиях [4], и большое количество экспериментальных данных подтвердило важность IGF-1 как промотора роста и синтеза матрикса хондроцитами в здоровом суставном хряще. IGF-1 усиливает синтез аггрекана клетками или эксплантами суставного хряща [5-10] и in vivo, в моделях на животных [11]. Оборот и деградация матрикса зависят от реакции клетки суставного хряща на катаболические цитокины, из которых IL-1α и β являются основными агонистами [12, 13].Было показано, что помимо своей способности вызывать деградацию суставного хряща, IL-1 подавляет синтез аггрекана и коллагена хондроцитами [14, 15]. Это снижение продукции соединений ЕСМ частично опосредовано ИЛ-1-индуцированным образованием оксида азота (NO) [16]. Эффекты IL-1 опосредуются высокоаффинным рецептором клеточной поверхности (IL-1RI) [17, 18]. Важными контролирующими факторами активности IL-1 являются белки, относящиеся к семейству рецепторов IL-1, среди которых рецептор-ловушка IL-1 типа 2 (IL-1RII) экспрессируется на плазматической мембране хондроцитов и связывает IL-1α и β, но не не передавать сигналы ИЛ-1 [19, 20].Интересно, что IGF, как было показано, активирует IL-1RII рецептора-ловушки IL-1, тем самым обращая активность IL-1 [21]. Это открытие согласуется с наблюдением, что IGF-1 непосредственно снижает как базальную, так и стимулируемую цитокинами деградацию [22] и депрессию основного вещества суставного хряща [21]. Таким образом, повышая регуляцию IL-1RII, IGF-1 защищает ECM хряща от индуцированного IL-1 разрушения (рис. 1A).
Рис. 1.
Пути IL-1 / IGF, контролирующие оборот внеклеточного матрикса (ECM) в (A) здоровом хряще, (B) хряще OA и (C) хряще OA, когда проводится репрессивная терапия IL-1.(A) Активность IL-1 контролируется IGF-1 в нормальном хряще. Через повышающую регуляцию IL-1RII IGF-1 защищает ECM хряща от индуцированного IL-1 разрушения. (B) Считается, что при ОА TNF-α, высвобождаемый апоптозными клетками суставного хряща, вызывает выделение IL-1RII и запускает ауто / паракринный каскад, управляемый IL-1, что приводит к резорбции ECM. По неизвестным причинам хондроциты в хряще OA сверхэкспрессируют анаболическую активность фактора роста IGF-1 / IGF-RI. (C) Подавление активности IL-1 в хрящевых клетках, которые сверхэкспрессируют IGF-1, приводит к восстановлению ECM.
Рис. 1.
Пути IL-1 / IGF, контролирующие оборот внеклеточного матрикса (ECM) в (A) здоровом хряще, (B) хряще OA и (C) хряще OA, когда проводится репрессивная терапия IL-1. (A) Активность IL-1 контролируется IGF-1 в нормальном хряще. Через повышающую регуляцию IL-1RII IGF-1 защищает ECM хряща от индуцированного IL-1 разрушения. (B) Считается, что при ОА TNF-α, высвобождаемый апоптозными клетками суставного хряща, вызывает выделение IL-1RII и запускает ауто / паракринный каскад, управляемый IL-1, что приводит к резорбции ECM.По неизвестным причинам хондроциты в хряще OA сверхэкспрессируют анаболическую активность фактора роста IGF-1 / IGF-RI. (C) Подавление активности IL-1 в хрящевых клетках, которые сверхэкспрессируют IGF-1, приводит к восстановлению ECM.
Патология метаболических путей цитокинов и факторов роста, принимаемых ОА
Сообщалось о повышении регуляции как катаболических [2, 3, 23, 24], так и анаболических [2, 3, 23–26] путей в хондроцитах и хрящах при ОА. Корреляция с возникновением и степенью патологии ОА была отмечена для IL-1β [2, 3, 27], и эти повышенные уровни катаболических цитокинов воплощены в хорошо задокументированном увеличении активности металлопротеиназ, которые были выше в хряще ОА по сравнению с морфологически нормальными. хрящ из того же сустава [27–30].Кроме того, в хондроцитах ОА было обнаружено увеличение плотности рецепторов IL-1RI по сравнению с нормальными хондроцитами. Уровни мРНК и белка IGF-1 и его рецептора IGFRI были значительно выше в фибриллированном хряще OA, чем в нефибриллированном хряще OA тазобедренного и коленного суставов [23, 26]. Самые сильные сигналы сообщения IGF-1 или уровни белка наблюдались в хондроцитах более продвинутых поражений [23, 26]. Когда сравнивали клетки, полученные из нормальной ткани и ткани ОА из одних и тех же коленных суставов человека, ассоциированный с клетками аггрекан и коллаген типа II были значительно уменьшены вокруг хондроцитов, полученных из патологической ткани.Одновременно хондроциты из фибриллированного хряща OA экспрессировали значительно более высокие внутриклеточные уровни IL-1α и β и повышали уровень IL-1RI, связанный с плазматической мембраной. В то же время наблюдались значительно более высокие уровни внутриклеточного IGF-1 и IGF-R1, связанного с плазматической мембраной. Неожиданно оказалось, что в присутствии этой повышенной активности IGF экспрессия связанного с плазматической мембраной рецептора-ловушки IL-1RII снижалась в хондроцитах ОА [26]. Снижение уровней рецептора-ловушки IL-1RII плазматической мембраны на хондроцитах ОА может быть связано с вмешательством других аутокринных цитокиновых путей.В этом контексте было показано, что TNF-α вызывает быстрое выделение IL-1RII из мембран миеломоноцитарных клеток [31, 32]. Подобный эффект TNF-α на клетки суставного хряща еще предстоит продемонстрировать. Однако присутствие TNF-α в хрящах, подвергшихся механическому повреждению, неоднократно подтверждалось примерами. Травма суставных хондроцитов вызывает апоптоз [33, 34], а апоптоз опосредуется аутокринным путем TNF [35, 36]. Повышенная активность TGF-β в хряще OA [37–39], вызывающая понижающую модуляцию передачи сигналов IL-1RI [40], может частично компенсировать потери IL-1RII, вызванные ауто / паракринной активностью TNF-α.Однако, если необходимо идентифицировать метаболические пути цитокинов и факторов роста, TNF-α и IL-1β и их сигнальные рецепторы являются основными кандидатами (рис. 1B).
Агенты, модифицирующие структуру соединительной ткани (CTSMA), и лекарственные средства от остеоартрита, модифицирующие заболевание (DMOAD)
Первые попытки улучшить структуру и функцию соединительной ткани синовиальных суставов, тем самым облегчить симптомы дегенеративных заболеваний суставов, были основаны на туманных предположениях, что обильное введение предшественников компонентов внеклеточного матрикса поможет клеткам суставного хряща восполнить утраченную среду. .Это предположение побудило врачей использовать такие вещества, как глюкозамин и сульфат или гликозаминогликаны, с целью улучшения восстановления хряща при дегенеративных заболеваниях суставов. Аналогичным образом, первое внутрисуставное введение полисульфата хондроитина было основано на предположении, что этот препарат гепариноидного типа заменит гиалуронан в качестве лубриканта и снизит уровень фибриногена в воспаленных суставах, и что это даст терапевтическое преимущество [41, 42]. Неожиданно некоторые пациенты сообщили об облегчении симптомов после прохождения этой процедуры, и даже сообщалось о некоторых изменениях в химическом составе синовиальной жидкости [43].
Наряду с глубоким поиском механизмов, посредством которых ткани суставов разрушаются в ходе воспалительных или дегенеративных заболеваний суставов, исследователи более методично искали биологические агенты, способные восстанавливать поврежденные соединительные ткани. Поскольку суставной хрящ является одной из основных тканей-мишеней, поражаемых в ходе ревматических заболеваний суставов, многие исследования были сосредоточены на метаболических характеристиках единственной клетки, находящейся в этой ткани: хондроцита. Вещества, защищающие суставной хрящ при деструктивных заболеваниях суставов, получили название хондрозащитных средств.Когда это произошло in vivo в суставах с остеоартритом, эти агенты были названы лекарствами от остеоартрита, модифицирующими заболевание (DMOAD) [1].
Поскольку ауто / паракринный фактор роста и каскады цитокинов, лежащие в основе развития, гомеостаза и разрушения внеклеточного матрикса суставного хряща, ранее не были известны, первые исследования биологических агентов, способных изменять структуру соединительной ткани в положительную сторону, в основном были сосредоточены на от способности этих агентов улучшать синтез или ухудшать разложение соединений ЕСМ, e.грамм. аггрекан и коллаген. Согласно этому определению, ряд веществ можно классифицировать как вещества, модифицирующие структуру соединительной ткани (CTSMA). Среди них неоднократно упоминались сульфатированные гликозаминогликаны и глюкозамин, химически модифицированные тетрациклины, такие как доксициклин и миноциклин, диацетилреин и его активный метаболит реин, а также неомыляемые вещества авокадо / сои.
Сульфатные полисахариды и хондрозащита
Среди первых веществ, способных улучшать накопление соединений ЕСМ, были так называемые хондромукопротеины [44–46], смесь продуктов деградации протеогликанов, в которых присутствовал хондроитинсульфат.Затем была выдвинута гипотеза, что продукты распада ВКМ, содержащие хондроитинсульфат, каким-то образом оказывают положительное влияние на хондроциты суставного хряща. Возможность вмешательства в процессы восстановления клеток соединительной ткани in vitro с помощью сульфатированных полисахаридов была впервые описана в середине 1970-х годов [47, 48]. Позже было показано, что полисульфат хондроитинсульфата улучшает синтез гиалуронана в синовиальных суставах in vivo у людей [49]. Тот же препарат, а также его природный аналог, хондроитинсульфат, улучшали функцию восстановления хондроцитов in vivo в различных экспериментальных моделях остеоартрита [50–53].Недавно рандомизированные двойные слепые плацебо-контролируемые терапевтические испытания привели к выводу, что эти CTSMA обладают свойствами DMOAD, поскольку они, как было показано, замедляют прогрессирование эрозивного ОА в межфаланговых суставах пальцев [54, 55] и ОА коленного сустава. у человека [56–58].
Эксперименты in vitro и in vivo в различных исследовательских центрах, касающиеся влияния на метаболизм молекул межклеточного матрикса (протеогликанов, аггреканов, гиалуронана), показали, что большинство (поли) сульфатированных полисахаридов влияют на клетки соединительной ткани (хрящевые клетки, синовиальные клетки, фибробласты) аналогичным образом [48, 59–61].С улучшением нашего понимания ауто / паракринного фактора роста и цитокиновых путей, которые контролируют гомеостаз здоровых соединительных тканей, стало возможным изучить механизм действия этих CTSMA. Недавние исследования сульфатированных полисахаридов показали, что эти агенты действуют в биологических системах путем подавления важных катаболических ауто / паракринных цитокиновых путей, таких как IL-1, тем самым улучшая накопление соединений ЕСМ в клеточно-ассоциированном матриксе этих клеток.Эксперименты с бычьими хрящевыми клетками, полученными из макроскопически интактных пястно-фаланговых суставов, показали, что физиологические концентрации полисульфата хондроитина значительно снижают последующие эффекты IL-1, такие как активность коллагеназы, протеогликаназы и матриксной металлопротеиназы (MMP) -1 и MMP-3 [62]. Кроме того, полисульфат хондроитина ингибировал индуцированную IL-1 экспрессию мРНК тканевого активатора плазминогена (tPA) [62]. Аналогичным образом, полисульфат ксилозана и полисульфат хондроитина восстанавливали накопление аггрекана, гиалуронана и коллагена типа II в клеточно-ассоциированном матриксе в обработанных IL-1β хондроцитах человека, культивируемых в агарозе.Этот эффект, вероятно, частично является результатом подавления MMPs [63]. Кроме того, в культивируемых хондроцитах лошадей полисульфат хондроитина значительно снижал экспрессию индуцибельной синтазы оксида азота (iNOS), усиленную IL-1β, что сопровождалось повышенным высвобождением NO. Хондроитин полисульфат снижает концентрацию нитрита в супернатантах этих IL-1β-стимулированных культур [64]. Наконец, новый полисульфатированный полисахарид, полисульфат циклодекстрина, продемонстрировал эффекты модификации структуры хряща in vitro , поскольку он улучшал синтез аггрекана и накопление связанных с клетками макромолекул матрикса клетками суставного хряща человека в альгинате.Здесь впервые было показано, что этот эффект частично является результатом прямой репрессии IL-1, поскольку клетки, обработанные полисульфатом циклодекстрина, экспрессируют значительно меньшие количества внутриклеточных IL-1α и β [65]. Те же обработанные β-циклодекстрином хондроциты высвобождали значительно меньше ИЛ-6 в супернатантную культуральную среду, эффект, который, как известно, является результатом ауто / паракринной стимуляции ИЛ-1 [65]. Следует напомнить, что концентрации полисахаридов в культуральном супернатанте большинства описанных экспериментов in vitro и уровни полисахаридов в плазме или хрящевой ткани, полученные у людей после перорального введения, были одного порядка [66–68].
Неомыляемые вещества из авокадо / сои
Сообщалось, что неомыляемые вещества авокадо / сои подавляют катаболическую активность хондроцитов и увеличивают накопление протеогликана хондроцитами ОА в культуре. Неомыляемые вещества из авокадо / сои были мощными ингибиторами основной продукции ММР-3 хондроцитами ОА, а также продукции IL-6, IL-8, NO и простагландина E 2 (PGE 2 ) [69]. Все эти биологические активности зависят от ИЛ-1 и выражены в хондроцитах ОА.Точно так же неомыляемые вещества авокадо / соя обращали вспять эффекты IL-1β в фибробластах десен из воспаленных тканей [70]. Эффекты этих экстрактов, подавляющие IL-1, защищали подкожно имплантированный хрящ от деградации [71]. In vivo Эффекты DMOAD после введения неомыляемых веществ из авокадо / сои были описаны в модели менискэктомии у овец [72] и, возможно, в человеческом OA бедра [73].
Химически модифицированные тетрациклины
Было показано, что химически модифицированные тетрациклины, такие как доксициклин и миноциклин, непосредственно ингибируют активность протеаз и коллагеназ [74].Тетрациклины также могут косвенно подавлять эту катаболическую активность, поскольку, как сообщалось, они снижают уровни мРНК коллагеназ в изолированных хондроцитах ОА. Кроме того, доксициклин ингибировал увеличение мРНК этих ферментов в нормальных хондроцитах, стимулированных TNF-α [75]. Аналогичным образом, хондроциты, выделенные из хряща OA человека и обработанные доксициклином, показали значительное ингибирование белка матриксной металлопротеиназы и соответствующих уровней мРНК, что указывает на транскрипционный / посттранскрипционный уровень контроля.Кроме того, лечение доксициклином привело к значительному снижению уровня мРНК IL-1α, β и IL-6 [76].
Прямое ингибирование таких цитокинов могло быть ответственным за снижение активности синтазы оксида азота в синовиальных клетках ОА [77]. Тетрациклины обращали как спонтанную, так и индуцированную IL-1β активность NOS в условиях ex vivo в тканях OA человека. Было обнаружено, что механизм действия этих препаратов на экспрессию NOS, по крайней мере частично, находится на уровне экспрессии РНК и трансляции фермента [78].
Вероятно, что снижение активности коллагеназы и желатиназы в экстрактах остеоартрозного хряща человека после перорального введения этих тетрациклинов человеку [79], а также открытие того, что доксициклин ингибирует продукцию NO в хряще у собак, у которых развился ОА после спонтанного разрыв передней крестообразной связки [80], возможно, был приписан ингибированию активности ауто / паракринных катаболических цитокинов. Скорее всего, это ингибирование каскадов катаболических цитокинов было ответственно за «хондропротекторные» эффекты при воспалительных артритах на животных моделях.Профилактические доксициклины и химически модифицированные варианты, вводимые перорально, уменьшали изменения ОА в коленных суставах in vivo у морских свинок Хартли, которые имеют высокую частоту ОА коленных суставов [81], и заметно снижали тяжесть ОА в областях, несущих нагрузку. медиального мыщелка бедренной кости при экспериментальном ОА у взрослых беспородных собак [82]. Совсем недавно было показано, что лечение доксициклином в дозе 100 мг два раза в день в течение 30 месяцев снижает скорость сужения суставной щели в коленях с установленным остеоартритом в группе женщин с ожирением [83].
Диацетилреин
В отличие от других CTSMA, которые ингибируют NO [64, 69, 77, 78, 107, 110–113] и продукцию простаноидов [69, 108, 110–112, 114], активный метаболит диацетилреина, реин не снижает, но, по-видимому, стимулирует синтез простагландинов in vitro [84, 85] и in vivo [86]. Этот механизм действия диацетилреина по увеличению экспрессии циклооксигеназы (COX) -2 и продукции PGE 2 , независимо от их ингибирования эндогенного NO [85, 87], аналогичен таковому у тетрациклинов, например.грамм. доксициклин и миноциклин, которые ингибируют индуцибельную NO-синтазу и увеличивают экспрессию ЦОГ-2 [88, 89]. Rhein и тетрациклины являются родственными химическими структурами в том смысле, что эти соединения возникают в результате реакций замещения полиядерных углеводородов: антрацена и нафтацена соответственно. Реин и тетрациклины обладают структурным сходством (рис. 2).
Рис. 2.
Райн, активный метаболит диацетилреина, и тетрациклин обладают структурным сходством.
Рис. 2.
Райн, активный метаболит диацетилреина, и тетрациклин обладают структурным сходством.
Подобно тетрациклинам, диацетилреин / реин подавлял экспрессию ИЛ-1 в активированных липополисахаридами человеческих хондроцитах ОА [90] и синовиальных клетках [91]. Эксперименты на изолированных хондроцитах суставного хряща и на эксплантатах хрящевой ткани показали, что это нарушение высвобождения активного ИЛ-1 частично связано с ингибированием фермента, преобразующего ИЛ-1 (ICE) плазматической мембраны.Судя по отсутствию влияния на уровень экспрессии генов обоих белков, действие диацетилреина / реина на IL-1β и ICE должно было быть посттрансляционным [92]. Понижающая модуляция активной продукции IL-1 сопровождалась ингибированием активации NFκB [93] и, следовательно, экспрессии IL-1 / NFκB-зависимых генов в этих клетках [90, 91, 93]. Блокирующие нижестоящие события IL-1 включали снижение продукции NO, стромелизина-1 [91, 94] и коллагеназы, а также провоспалительных IL-6, -8 и -18 в IL-1α и TNF-α активированных монослойных культивируемых суставных хондроцитах человека из ОА суставов [92, 94].Аналогичным образом, реин подавлял индуцированную IL-1 экспрессию генов proMMP-1, -3, -9 и -13 и их активности, а также повышал продукцию тканевого ингибитора металлопротеиназы 1 (TIMP-1) в монослое культивированных суставные хондроциты кролика. Таким образом, в этих клетках сообщалось об увеличении продукции гликозаминогликанов и коллагена наряду со снижением деградации протеогликана [95–97]. Это улучшенное наращивание матрикса могло быть усилено увеличением экспрессии изоформ TGF-β в хондроцитах, обработанных диацетилреином [98].Все эти результаты in vitro были получены с концентрациями диацетилреина / реина, сравнимыми с терапевтическими уровнями в плазме. Можно разумно предположить, что блокирование ИЛ-1 диацетилреином / реином было ответственно за некоторые эффекты DMOAD, наблюдаемые при экспериментальном ОА у животных, например при разрушении хряща надколенника кролика, вызванном контузией [99], и при спонтанно развивающемся полиартрите у мышей NZB / KN [100]. Хотя это не согласуется с улучшением биохимии суставного хряща [101–103], сравнимая хондрозащита наблюдалась в различных моделях ОА собак, если судить по макроскопическим повреждениям хряща [102, 103].
Эти эффекты DMOAD были подтверждены в двух рандомизированных двойных слепых плацебо-контролируемых исследованиях. Двести шестьдесят девять пациентов с первичным ОА бедра завершили трехлетнее исследование, получая диацетилреин в дозе 50 мг два раза в день или плацебо. Процент пациентов с рентгенологическим прогрессированием, определяемым как потеря суставной щели не менее 0,5 мм, был значительно ниже у пациентов, получавших диацетилреин, чем у пациентов, получавших плацебо. У этих пациентов частота сужения суставной щели была дискретной, но значительно ниже, чем в группе плацебо [104].Эти результаты были подтверждены в другом 1-летнем проспективном рандомизированном двойном слепом плацебо-контролируемом исследовании 301 пациента с радиологическим медиальным ОА коленного сустава [105].
Глюкозамин
Место глюкозамина как CTSMA или DMOAD остается спорным. Тот факт, что этот аминосахар долгое время назывался «сульфатом глюкозамина», вызвал путаницу. Препарат, использованный в ряде экспериментов in vitro и in vivo , не был сложным эфиром сульфата глюкозамина, а оказался препаратом, в котором глюкозамин и сульфат присутствовали в виде двух отдельных молекул в кристаллической форме.Если какие-либо эффекты CTSMA приписываются «сульфату глюкозамина», в настоящее время считается, что активным ингредиентом является моносахарид. В серии экспериментов с изолированными IL-1β-активированными хондроцитами в культуре, где использовались гексозамины, сообщалось о влиянии на последующие события IL-1. Добавление глюкозамина к хондроцитам крысы, обработанным IL-1β, уменьшало активацию фактора транскрипции NFκB, но не белка-активатора-1 [106]. Глюкозамин, но не N, -ацетилглюкозамин или другие моносахариды [107], значительно ингибировал активность NFκB в хондроцитах ОА человека, а также ядерную транслокацию белков p50 и p65 [108].Глюкозамин снижал активность фосфолипазы A2 [109], уровни мРНК и белка ЦОГ-2 [107, 108, 110] и высвобождение PGE 2 [108, 110–114] в клетках суставного хряща различного происхождения. Сходным образом аминосахар снижает продукцию iNOS и NO хондроцитами [107, 110–113] и индуцирует IL-1 металлопротеиназную и коллагеназную активности в супернатантах культур хондроцитов [109–113, 115]. Заметное ингибирование аггреканазозависимого расщепления аггрекана наблюдалось как с клетками крысы, так и с эксплантами крупного рогатого скота при добавлении глюкозамина [116] и маннозамина [117].Ингибирование не было связано с вмешательством в передачу сигналов IL-1, и точный механизм, с помощью которого гексозамины функционируют в этой системе, неясен. Вмешательство в активность ферментов привело к снижению катаболизма ВКМ в этих культурах хондроцитов [113]. Кроме того, сообщалось, что гексозамины улучшают синтез макромолекул ECM в IL-1-репрессированных хрящевых клетках [106, 111, 112, 115]. Большинство цитируемых экспериментов проводилось на нормальных хондроцитах, хондроцитах или хрящевых эксплантатах, примированных IL-1.Редко использовались нативные хондроциты ОА [109, 115]. Основная проблема с исследованиями in vitro , проведенными до сих пор, — это концентрации гексозаминов, используемых в этих экспериментах. Обычно пациентам с ОА ежедневно вводят 1500 мг глюкозамина (20 мг / кг у субъекта массой 75 кг). Эти предписанные количества в лучшем случае обеспечивают концентрацию гексозамина в плазме на уровне 0,15–0,30 мМ у среднестатистического европейца. Два из вышеупомянутых экспериментальных исследований были проведены с концентрациями глюкозамина в этом диапазоне [115, 117].Остальные были сделаны с использованием нефизиологических уровней глюкозамина в питательной среде в диапазоне от 0,56 до 139,66 мМ [106–113, 116], в условиях, при которых ингибирование катаболических эффектов, вызванных IL1β, могло быть связано с токсичностью глюкозамина [118].
Актуальность результатов in vitro , полученных с супрафизиологическими дозами глюкозамина, остается спорным, поскольку ежедневное введение ∼20 мг / кг глюкозамина пероральным путем кроликам, у которых выполнялось перерезание передней крестообразной связки, имело только обнаруживаемый участок. -специфический, частичный модифицирующий болезнь эффект в этой модели ОА.Введение глюкозамина не предотвращало фибрилляцию и / или эрозию суставного хряща у обработанных животных [119]. Кроме того, парентеральное введение 200 мг / кг N-ацетил-глюкозамина на кроличьей модели экспериментального ОА коленного сустава не показало хондропротекторных эффектов [120]. Механизм действия, с помощью которого этот гексозамин, таким образом, мог повлиять на эволюцию одной человеческой популяции с ОА коленного сустава [121, 122], таким образом, еще предстоит выяснить. Принимая во внимание отсутствие хондрозащиты в экспериментальных животных моделях ОА, подтверждение хондропротекторных эффектов глюкозамина в человеческой популяции было бы ценным.
Кортикостероиды и ИЛ-1
Гомеостаз ВКМ клетками суставного хряща зависит от контроля ауто / паракринных катаболических каскадов, индуцированных ИЛ-1 [21]. Множество эндокринных гормонов и факторов роста способны контролировать эту активность IL-1. Традиционно сообщалось, что кортикостероиды напрямую влияют на синтез ИЛ-1 [123, 124]. Как показано на культурах хрящевых эксплантатов, кортикостероидные гормоны в физиологических дозах ингибируют деградацию внеклеточного матрикса [125–127].Это ингибирование пути IL-1 привело к снижению патологической активности нейтральных протеаз в хрящевой ткани [128–132]. Помимо того факта, что кортикостероиды действуют синергетически с различными основными факторами роста и дифференцировки, влияя на синтез основного вещества внеклеточного матрикса [133–135], антикатаболические эффекты кортикостероидов, по крайней мере, частично объясняют защитные эффекты на хрящ ОА однократных или периодических местное или системное введение физиологических доз кортикостероидов в различных моделях экспериментально индуцированного ОА, таких как модель менискэктомированного кролика [136, 137], при химически индуцированном повреждении хряща у морской свинки [138] и в модели собаки Паунда-Нуки. ОА [132, 139].Подобные защитные эффекты этих препаратов наблюдались на хрящах остеоартрита у людей [131]. Это подавление IL-1 физиологическими дозами кортикостероидов вместе с повышающей регуляцией рецептора IGF-1 в конечном итоге привело к накоплению соединений ECM в непосредственном окружении хрящевых клеток in vitro [63, 140] .
Защита и регенерация суставного хряща с помощью блокаторов цитокинов: подтверждение концепции
Совсем недавно были зарегистрированы драматические хондропротекторные эффекты у пациентов с РА и деструктивным артритом, ассоциированным со спондилоартропатией (СПА).У этих пациентов TNF-α, высвобождаемый в синовиальной мембране, запускает катаболический ауто / паракринный путь IL-1 хондроцитов в соседнем суставном хряще [141]. Результирующий каскад ауто / паракринного IL-1 будет вызывать разрушение внеклеточного матрикса суставного хряща. Лечение пациентов с РА рекомбинантными белками, поглощающими TNF-α, подавляет активность IL-1 хондроцитов и останавливает эрозивную прогрессию, продолжающуюся в течение этих воспалительных заболеваний [142]. Нейтрализация TNF-α при RA в конечном итоге приводит к очевидному восстановлению пораженных суставов [143].Повторное появление исчезнувшей суставной щели было зарегистрировано при периферическом артрите, связанном с СПА [144, 145] (рис. 3). Сходным образом при ОА ауто / паракринный TNF-α, возникающий в результате апоптоза хондроцитов [31–34] после чрезмерного механического стресса, вызывает индуцированное IL-1 разрушение внеклеточной среды суставного хряща. Насколько подобное блокирование TNF-α может привести к остановке прогрессирования этого заболевания, еще не изучено.
Рис.3.
Хондрозащита и регенерация суставного хряща блокаторами цитокинов. (A) Тазобедренный сустав пациента с анкилозирующим спондилитом до (слева) и после 1 года лечения инфликсимабом, блокирующим TNF-α моноклональным антителом. Прекращено развитие эрозии, вновь появилась суставная щель. (B) Такое же течение наблюдалось в третьем проксимальном межфаланговом суставе и втором дистальном межфаланговом суставе пациента, страдающего псориатическим артритом. Эти записи были получены после завершения серии проспективных рандомизированных плацебо-контролируемых исследований, одобренных местным комитетом по этике, в которые были включены 107 пациентов для изучения влияния инфликсимаба на клинические признаки спондилоартропатии [144]. , Ван дер Бош, представлен].Рентгеновские снимки пораженных суставов были сделаны при поступлении и через 1 год наблюдения. (C) При эрозивном ОА межфалангового сустава пальца подобный тип ремоделирования происходит спонтанно после прекращения деструктивного эпизода. Четыре рентгеновских снимка были сделаны с интервалом в 1 год [145].
Рис. 3.
Хондрозащита и регенерация суставного хряща цитокиноблокаторами. (A) Тазобедренный сустав пациента с анкилозирующим спондилитом до (слева) и после 1 года лечения инфликсимабом, блокирующим TNF-α моноклональным антителом.Прекращено развитие эрозии, вновь появилась суставная щель. (B) Такое же течение наблюдалось в третьем проксимальном межфаланговом суставе и втором дистальном межфаланговом суставе пациента, страдающего псориатическим артритом. Эти записи были получены после завершения серии проспективных рандомизированных плацебо-контролируемых исследований, одобренных местным комитетом по этике, в которые были включены 107 пациентов для изучения влияния инфликсимаба на клинические признаки спондилоартропатии [144]. , Ван дер Бош, представлен].Рентгеновские снимки пораженных суставов были сделаны при поступлении и через 1 год наблюдения. (C) При эрозивном ОА межфалангового сустава пальца подобный тип ремоделирования происходит спонтанно после прекращения деструктивного эпизода. Четыре рентгеновских снимка были сделаны с интервалом в 1 год [145].
Обсуждение
Идентичные пути цитокинов и факторов роста контролируют разрушение и восстановление при ОА и воспалительных заболеваниях суставов, таких как RA и SPA-ассоциированный артрит. Однонаправленные каскады цитокинов, управляемые TNF-α / IL-1, нарушают гомеостаз ECM суставного хряща при этих нарушениях.TNF-α, происходящий из синовиальной мембраны, запускает каскад во время воспалительных патологий, в то время как при ОА аутокринный TNF-α, высвобождаемый апоптозными клетками суставного хряща, вызывает активность IL-1. Как при воспалительных, так и при дегенеративных состояниях, каскады цитокинов, управляемые TNF-α / IL-1, преобладают над путями факторов роста, способствующих анаболической репарации. Однако, когда биологические препараты, блокирующие TNF-α, вводили при иммунологически опосредованных воспалительных артритах, безошибочно было продемонстрировано восстановление тканей.В СПА зафиксировано повторное появление ранее исчезнувшей суставной щели.
Точно так же репрессия каскадов цитокинов, управляемых TNF-α / IL-1, должна позволить репарации стать еще более очевидной при ОА, поскольку пути анаболического фактора роста также сверхэкспрессируются в этом состоянии. Было показано, что кортикостероиды, отдельные классы (поли) сульфатированных полисахаридов, тетрациклины, диацетилреин / реин, авокадо / соевые бобы и глюкозамин подавляют IL-1 и, по-видимому, подавляют нижестоящие характеристики IL-1, например.грамм. активность коллагеназы, протеогликаназы и ММП, экспрессия iNOS и повышенное высвобождение NO, а также выделение PGE 2 , IL-6 и IL-8. За исключением кортикостероидов и диацетилреина, эти агенты не продемонстрировали стимуляции активности фактора роста. Все эти CTSMA, способные непосредственно влиять на синтез и высвобождение IL-1 in vitro , как было показано, обладают активностью DMOAD в экспериментальных моделях ОА и в популяциях людей с ОА коленных и пальцевых суставов.Эффекты DMOAD глюкозамина in vivo остаются несколько спорными, поскольку концентрации гексозаминов, которые были эффективны в экспериментах in vitro , никогда не были достигнуты при системном введении аминосахаров экспериментальным животным или людям. Фармакологическое усиление факторов, способствующих репарации, например Ожидается, что TGF-β и / или IGF-1 не сильно повлияют на изменение заболевания при ОА. Пути анаболического восстановления уже чрезмерно выражены при этом заболевании.Этим объясняется затяжной характер ОА и очевидные признаки ремоделирования тканей сустава ОА.
Поскольку однонаправленный каскад цитокинов, управляемый TNF-α / IL-1, был идентифицирован как лекарственная мишень при ОА, простые лабораторные процедуры позволят обнаружить новую серию CTSMA с активностями DMOAD.
Авторы заявили об отсутствии конфликта интересов.
Список литературы
1Altman RD, Hochberg MC, Moskowitz RW, Schnitzer TJ.Рекомендации по медикаментозному лечению остеоартроза тазобедренного и коленного суставов. Обновление 2000 года. Подкомитет ACR по рекомендациям по остеоартриту.
ревматоидный артрит
2000
;43
:1905
–15,2Chambers MG, Bayliss MT, Mason RM. Экспрессия цитокинов хондроцитов и факторов роста при остеоартрите мышей.
Тележка для лечения артроза
1997
;5
:301
–8.3Моос В., Фикерт С., Мюллер Б., Вебер Ю., Сипер Дж.Иммуногистологический анализ экспрессии цитокинов при остеоартрите человека и здоровом хряще.
J Rheumatol
1999
;26
:870
–9,4van Beuningen HM, van der Kraan PM, Arntz OJ, van den Berg WB. Защита от интерлейкина 1 индуцировала разрушение суставного хряща путем трансформации фактора роста бета: исследования на анатомически неповрежденном хряще in vitro и in vivo .
Ann Rheum Dis
1993
;52
:185
–91.5Guenther HL, Guenther HE, Froesch ER, Fleisch H. Влияние инсулиноподобного фактора роста на синтез коллагена и гликозаминогликанов суставными хондроцитами кролика в культуре.
Experientia
1982
;38
:979
–81,6McQuillan DL, Handley CJ, Campbell MA, Bolis S, Milway VE, Herington AC. Стимуляция синтеза протеогликана сывороткой и инсулиноподобным фактором роста-1 в культивируемом суставном хряще крупного рогатого скота.
Biochem J
1986
;240
:423
–30.7Luyten FP, Hascall VC, Nissley SP, Morales TI, Reddi AH. Инсулиноподобные факторы роста поддерживают стабильный метаболизм протеогликанов в эксплантатах суставного хряща крупного рогатого скота.
Arch Biochem Biophys
1988
;267
:416
–25,8Tesch GH, Handley CJ, Cornell HJ, Herington AC. Влияние свободных и связанных инсулиноподобных факторов роста на метаболизм протеогликанов в эксплантатах суставного хряща.
J Orthop Res
1992
;10
:14
–22.9Verbruggen G, Malfait AM, Dewulf M, Broddelez C, Veys EM. Стандартизация питательных сред для изолированных суставных хондроцитов человека в гелеобразной суспензионной культуре агарозы.
Тележка для лечения артроза
1995
;3
:249
–59,10Yaeger PC, Masi TL, de Ortiz JL, Binette F, Tubo R, McPherson JM. Синергетическое действие трансформирующего фактора роста-бета и инсулиноподобного фактора роста-I индуцирует экспрессию генов коллагена и аггрекана типа II в суставных хондроцитах взрослого человека.
Exp Cell Res
1997
;237
:318
–25,11Verschure PJ, van Marle J, Joosten LA, van den Berg WB. Экспрессия хондроцитарного рецептора IGF-1 и реакция на стимуляцию IGF-1 в суставном хряще мыши во время различных фаз экспериментально индуцированного артрита.
Ann Rheum Dis
1995
;54
:645
–53,12Саклатвала Дж., Пилсворт ЛМК, Сарсфилд С.Дж., Гравилович Дж., Хит Дж. К.. Катаболин свиньи — это форма интерлейкина 1.
Biochem J
1984
;224
:461
–6,13Дингл Дж. Т., Саклатвала Дж., Хембри Р., Тайлер Дж., Фелл Х. Б., Джубб Р. Катаболический фактор хряща из синовиальной оболочки.
Biochem J
1979
;184
:177
–80,14Dingle JT. Влияние синовиального катаболина на синтетическую активность хряща.
Connect Tiss Res
1984
;12
:277
–86,15Тайлер Дж. А., Саклатвала Дж.Свиной ИЛ-1 (катаболин) вызывает резорбцию протеогликана хряща и предотвращает синтез протеогликана и коллагена.
Br J Rheumatol
1985
;24 (Дополнение 1)
:150
–5,16Таскиран Д., Стефанович-Рачич М., Георгеску Х.И., Эванс Ч. Оксид азота опосредует подавление синтеза протеогликанов хряща интерлейкином-1.
Biochem Biophys Res Commun
1994
;200
:142
–8,17Берд Т.А., Саклатвала Дж.Идентификация общего класса рецепторов с высоким сродством для обоих типов интерлейлина-1 на клетках соединительной ткани.
Nature
1986
;324
:263
–6,18Чандрасекхар С., Харви А.К. Индукция рецепторов интерлейкина-1 на хондроцитах фактором роста фибробластов: возможный механизм модуляции активности интерлейкина-1.
J Cell Physiol
1989
;138
:236
–46,19Colotta F, Re F, Muzio M et al .Рецептор интерлейкина-1 типа II: мишень-приманка для IL-1, которая регулируется IL-4.
Наука
1993
;261
:472
–5.20Аттур М.Г., Дэйв М., Чиполлетта С. и др. . Обращение аутокринных и паракринных эффектов интерлейкина 1 (ИЛ-1) при артрите человека с помощью рецептора-ловушки ИЛ-1 типа II. Возможность фармакологического вмешательства.
J Biol Chem
2000
;275
:40307
–1521Wang J, Elewaut D, Veys EM, Verbruggen G.Индуцированный инсулиноподобным фактором роста 1 рецептор интерлейкина-1 II подавляет активность интерлейкина-1 и контролирует гомеостаз внеклеточного матрикса хряща.
Arthritis Rheum
2003
;48
:1281
–91,22Тайлер Дж. А.. Инсулиноподобный фактор роста 1 может уменьшать деградацию и способствовать синтезу протеогликана в хряще, подвергающемся действию цитокинов.
Biochem J
1989
;260
:543
–8.23Миддлтон Дж. Ф., Тайлер Дж. А. Повышение экспрессии гена инсулиноподобного фактора роста I в поражениях суставного хряща человека при остеоартрите.
Ann Rheum Dis
1992
;51
:440
–7,24Миддлтон Дж., Манти А., Тайлер Дж. Рецептор инсулиноподобного фактора роста (ИФР), ИФР-I, интерлейкин-1 бета (ИЛ-1 бета) и экспрессия мРНК ИЛ-6 при остеоартрите и нормальном хряще человека.
J Histochem Cytochem
1996
;44
:133
–41.25Verschure PJ, Marle JV, Joosten LA, Helsen MM, Lafeber FP, Berg WB. Локализация рецептора инсулиноподобного фактора роста-1 в нормальном и остеоартрозном хрящах человека в отношении синтеза и содержания протеогликана.
Br J Rheumatol
1996
;35
:1044
–55.26Ван Дж., Вердонк П., Элевот Д., Вейс Е.М., Вербрюгген Г. Гомеостаз внеклеточного матрикса нормальных и остеоартрозных хондроцитов суставного хряща человека in vitro.
Тележка для лечения артроза
2003
;11
:801
–9.27Шлопов Б.В., Гумановская М.Л., Поспешный К.А. Аутокринная регуляция коллагеназы 3 (матриксная металлопротеиназа 13) при остеоартрите.
ревматоидный артрит
2000
;43
:195
–205.28Pelletier JP, Martel-Pelletier J, Howell DS, Ghandur-Mnaymneh L, Enis JE, Woessner JF Jr. Коллагеназа и коллагенолитическая активность в остеоартритическом хряще человека.
Arthritis Rheum
1983
;26
:63
–8.29Okada Y, Shinmei M, Tanaka O et al .Локализация матричной металлопротеиназы 3 (стромелизина) в остеоартрозном хряще и синовиальной оболочке.
Lab Invest
1992
;66
:680
–90,30Arner EC, Tortorella MD. Передача сигнала через рецепторы интегрина хондроцитов индуцирует синтез матриксной металлопротеиназы и действует синергично с интерлейкином-1.
Arthritis Rheum
1995
;38
:1304
–14,31Orlando S, Sironi M, Bianchi G et al .Роль металлопротеаз в высвобождении рецептора-ловушки IL-1 типа II.
J Biol Chem
1997
;272
:31764
–9,32Penton-Rol G, Orlando S, Polentarutti N et al . Бактериальный липополисахарид вызывает быстрое отщепление с последующим ингибированием экспрессии мРНК рецептора IL-1 типа II с одновременной активацией рецептора типа I и индукцией не полностью сплайсированных транскриптов.
J Immunol
1999
;162
:2931
–8.33Д’Лима Д.Д., Хашимото С., Чен П.С., Колвелл С.В. мл., Лотц М.К. Апоптоз хондроцитов человека в ответ на механическое повреждение.
Тележка для лечения артроза
2001
;9
:712
–9,34Редман С.Н., Даутуэйт Г.П., Томсон Б.М., Арчер CW. Клеточные реакции суставного хряща на резкую и тупую травму.
Тележка для лечения артроза
2004
;12
:106
–16.35Айзава Т., Кон Т., Эйнхорн Т.А., Герстенфельд LC.Индукция апоптоза хондроцитов фактором некроза опухоли-α.
J Orthop Res
2001
;19
:785
–96,36Islam N, Haqqi TM, Jepsen KJ et al . Гидростатическое давление вызывает апоптоз хондроцитов человека из остеоартрозного хряща за счет усиления фактора некроза опухоли-α, индуцибельной синтазы оксида азота, p53, c-myc и bax-alpha, а также подавления bcl-2.
J Cell Biochem
2002
;87
:266
–78.37Моос В., Фикерт С., Мюллер Б., Вебер Ю., Сипер Дж. Иммуногистологический анализ экспрессии цитокинов в человеческом остеоартрите и здоровом хряще.
J Rheumatol
1999
;26
:870
–9.38Verdier MP, Seite S, Guntzer K, Pujol JP, Boumediene K. Иммуногистохимический анализ бета-изоформ трансформирующего фактора роста и их рецепторов в хряще человека из нормальных и остеоартрозных головок бедренной кости.
Rheumatol Int
2005
;25
:118
–24.39Четина Е.В., Сквайрс Дж., Пул А.Р. Усиленная деградация коллагена II типа и очень ранняя очаговая дегенерация хряща связаны с активацией генов, связанных с дифференцировкой хондроцитов, в ранних поражениях суставного хряща человека.
J Ревматол
2005
;32
:876
–86,40Харви А.К., Хрубей П.С., Чандрасекхар С. Ингибирование активности интерлейкина-1 трансформирующим фактором роста бета включает подавление рецепторов интерлейкина-1 на хондроцитах.
Exp Cell Res
1991
;195
:376
–85,41Эйлау О. Внутрисуставная гепаринотерапия истинного деформирующего артроза коленного сустава.
Мед Клин
1959
;54
:145
.42Эйлау О. О патогенезе и причинном лечении артроза коленного сустава.
Мед Клин
1960
;55
:2367
–70,43Momburg M, Stuhlsatz HW, Vogeli H, Vojtisek O, Eylau O, Greiling H.Клинические химические изменения в синовиальной жидкости после внутрисуставной инъекции полисульфата гликозаминогликана.
Z Rheumatol
1976
;35 (Приложение 4)
:389
–90,44Нево З., Хорвиц А.Л., Дорфман А. Синтез хондромукопротеина хондроцитами в суспензионной культуре.
Дев Биол
1972
;28
:219
–28.45Нево З., Дорфман А. Стимуляция синтеза хондромукопротеинов в хондроцитах внеклеточным хондромукопротеином.
Proc Natl Acad Sci USA
1972
;69
:2069
–72,46Kosher RA, Lash JW, Minor RR. Экологическое усиление хондрогенеза in vitro.
Дев Биол
1973
;35
:210
–20,47Шварц Н.Б., Дорфман А. Стимуляция продукции хондроитинсульфат-протеогликана хондроцитами в монослое.
Conn Tiss Res
1975
;3
:115
–22,48Verbruggen G, Veys EM.Влияние сульфатированных гликозаминогликанов на метаболизм протеогликанов в клетках синовиальной оболочки.
Acta Rheumatol
1977
;1
:75
–92,49Verbruggen G, Veys EM. Влияние гиперсульфатированного гепариноида на метаболизм гиалуроната синовиальной клетки человека in vivo .
J Rheumatol
1979
;6
:554
–61,50Kalbhen DA. Экспериментальное подтверждение противоартритной активности полисульфата гликозаминогликана.
Z Rheumatol
1983
;42
:178
–84,51Carreno MR, Muniz OE, Howell DS. Эффект гликозаминогликана сложного эфира полисерной кислоты на суставной хрящ при экспериментальном остеоартрите: влияние на морфологические переменные тяжести заболевания.
J Rheumatol
1986
;13
:490
–7,52Бреннан Дж. Дж., Ахерн FX, Накано Т. Влияние лечения полисульфатом гликозаминогликана на прочность, содержание гиалуроновой кислоты в синовиальной жидкости и протеогликановый агрегат в суставном хряще хромого хряка.
Can J Vet Res
1987
;51
:394
–8,53Убельхарт Д., Тонар Э. Дж., Чжан Дж., Уильямс Дж. М.. Защитный эффект экзогенного хондроитин-4,6-сульфата при острой деградации суставного хряща у кролика.
Тележка для лечения артроза
1998
;6 (Дополнение A)
:6
–13,54Verbruggen G, Goemaere S, Veys EM. Хондроитинсульфат: S / DMOAD (лекарственное средство против остеоартрита, изменяющее структуру / заболевание) при лечении остеоартрита суставов пальцев.
Тележка для лечения артроза
1998
;6 (Дополнение A)
:37
–8,55Verbruggen G, Goemaere S, Veys EM. Системы для оценки прогрессирования остеоартрита суставов пальцев и эффектов лекарств, влияющих на лечение остеоартрита.
Clin Rheumatol
2002
;21
:231
–43,56Убельхарт Д., Тонар Э. Дж., Дельмас П. Д., Шантрейн А., Виньон Э. Влияние перорального хондроитинсульфата на прогрессирование остеоартрита коленного сустава: пилотное исследование.
Тележка для лечения артроза
1998
;6 (Дополнение A)
:39
–46,57Убельхарт Д., Малез М., Марколонго Р. и др. . Прерывистое лечение остеоартроза коленного сустава пероральным хондроитинсульфатом: однолетнее рандомизированное двойное слепое многоцентровое исследование по сравнению с плацебо.
Тележка для лечения артроза
2004
;12
:269
–76,58Michel BA, Stucki G, Frey D et al . Хондроитины 4 и 6 сульфат при остеоартрозе коленного сустава: рандомизированное контролируемое исследование.
Arthritis Rheum
2005
;52
:779
–86,59Verbruggen G, Veys EM. Внутрисуставная инъекция пентозанполисульфата приводит к увеличению молекулярной массы гиалуронана в суставной жидкости.
Clin Exp Rheumatol
1992
;10
:249
–54,60Francis DJ, Hutadilok N, Kongtawelert P, Ghosh P. Полисульфат пентозана и полисульфат гликозаминогликана стимулируют синтез гиалуронана in vivo .
Rheumatol Int
1993
;13
:61
–4,61Verbruggen G, Cornelissen M, Elewaut D, Broddelez C, De Ridder L., Veys EM. Влияние полисульфатированных полисахаридов на аггреканы, синтезируемые дифференцированными суставными хондроцитами человека.
J Rheumatol
1999
;26
:1663
–71,62Sadowski T., Steinmeyer J. Влияние полисульфатированного гликозаминогликана и триамцинолона ацетонида на продукцию протеиназ и их ингибиторов обработанными IL-1alpha суставными хондроцитами.
Biochem Pharmacol
2002
;64
:217
–27.63Ван Л., Ван Дж., Альмквист К.Ф., Вейс Е.М., Вербругген Г. Влияние полисульфатированных полисахаридов и гидрокортизона на метаболизм внеклеточного матрикса суставных хондроцитов человека in vitro.
Clin Exp Rheumatol
2002
;20
:669
–76,64Tung JT, Venta PJ, Caron JP. Индуцируемая экспрессия оксида азота в суставных хондроцитах лошади: эффекты противовоспалительных соединений.
Тележка для лечения артроза
2002
;10
:5
–12,65Verdonk P, Wang J, Elewaut D, Broddelez C, Veys EM, Verbruggen G. Полисульфаты циклодекстрина усиливают восстановление внеклеточного матрикса хондроцитов человека.
Тележка для лечения артроза
2005
;13
:887
–95.66Muller W., Panse P, Brand S, Staubli A. Исследование in vivo распределения, сродства к хрящам и метаболизма полисульфата гликозаминогликана (GAGPS, Arteparon).
Z Rheumatol
1983
;42
:355
–61.67Volpi N. Пероральное всасывание и биодоступность хондроитинсульфата ихтикового происхождения у здоровых добровольцев мужского пола.
Тележка для лечения артроза
2003
;11
:433
–41.68Volpi N. Биодоступность хондроитинсульфата (Кондросульф) и его компонентов при пероральном введении у здоровых добровольцев мужского пола.
Тележка для лечения артроза
2002
;10
:768
–77.69Хенротин Ю.Е., Санчес С., Деберг М.А. и др. . Неомыляемые вещества авокадо / соевые бобы увеличивают синтез аггрекана и снижают выработку катаболических и провоспалительных медиаторов хондроцитами человека при остеоартрите.
J Ревматол
2003
;30
:1825
–34,70Kut-Lasserre C, Miller CC, Ejeil AL et al . Влияние неомыляемых веществ авокадо и сои на желатиназу A (MMP-2), стромелизин 1 (MMP-3) и тканевые ингибиторы секреции матриксной металлопротеиназы (TIMP-1 и TIMP-2) фибробластами человека в культуре.
J Periodontol
2001
;72
:1685
–94,71Хайял MT, Эль-Газали, Массачусетс. Возможный «хондрозащитный» эффект неомыляемых компонентов авокадо и сои in vivo .
Drugs Exp Clin Res
1998
;24
:41
–50.72Cake MA, Read RA, Guillou B., Ghosh P. Модификация патологии суставного хряща и субхондральной кости в модели остеоартрита менискэктомии у овец неомыляемыми веществами авокадо и сои (ASU).
Тележка для лечения артроза
2000
;8
:404
–11.73Lequesne M, Maheu E, Cadet C, Dreiser RL. Структурное влияние неомыляемых веществ авокадо / сои на потерю суставной щели при остеоартрозе тазобедренного сустава.
Arthritis Rheum
2002
;47
:50
–8,74Yu LP Jr, Smith GN Jr, Hasty KA, Brandt KD. Доксициклин подавляет коллагенолитическую активность экстрактов из хрящей остеоартроза человека и желатиназы типа XI.
J Rheumatol
1991
;18
:1450
–2,75Шлопов Б.В., Смит Г.Н. мл., Коул А.А., Хэсти К.А. Дифференциальные паттерны ответа на доксициклин и трансформирующий фактор роста бета1 при подавлении коллагеназ в остеоартрите и нормальных хондроцитах человека.
Arthritis Rheum
1999
;42
:719
–27,76Шлопов Б.В., Стюарт Ю.М., Гумановская М.Л., Хасты К.А. Регулирование коллагеназы хряща доксициклином.
J Ревматол
2001
;28
:835
–42,77Borderie D, Hernvann A, Hilliquin P, Lemarchal H, Kahan A, Ekindjian OG. Тетрациклины подавляют выработку нитрозотиола цитокин-стимулированными синовиальными клетками остеоартрита.
Inflamm Res
2001
;50
:409
–14,78Amin AR, Attur MG, Thakker GD et al . Новый механизм действия тетрациклинов: эффекты на синтазы оксида азота.
Proc Natl Acad Sci USA
1996
;93
:14014
–9,79Smith GN Jr, Yu LP Jr, Brandt KD, Capello WN. Пероральный прием доксициклина снижает активность коллагеназы и желатиназы в экстрактах остеоартрозного хряща человека.
J Rheumatol
1998
;25
:532
–5,80Jauernig S, Schweighauser A, Reist M, Von Rechenberg B., Schawalder P, Spreng D. Влияние доксициклина на выработку оксида азота и стромелизина у собак с разрывом черепной крестообразной связки.
Вет Сург
2001
;30
:132
–9,81de Bri E, Lei W., Svensson O, Chowdhury M, Moak SA, Greenwald RA. Влияние ингибитора матриксных металлопротеиназ на спонтанный остеоартрит у морских свинок.
Adv Dent Res
1998
;12
:82
–5,82Ю Л.П. младший, Смит Г.Н. мл., Брандт К.Д., Майерс С.Л., О’Коннор Б.Л., Брандт Д.А. Уменьшение тяжести остеоартроза собак путем профилактического лечения пероральным доксициклином.
Arthritis Rheum
1992
;35
:1150
–9,83Brandt KD, Mazzuca SA, Katz BP et al . Влияние доксициклина на прогрессирование остеоартрита: результаты рандомизированного плацебо-контролируемого двойного слепого исследования.
Arthritis Rheum
2005
;52
:2015
–25,84Franchi-Micheli S, Lavacchi L, Friedmann CA, Ziletti L. Влияние реина на простагландиноподобные вещества in vitro .
J Pharm Pharmacol
1983
;35
:262
–4,85Pomarelli P, Berti M, Gatti MT, Mosconi P. Нестероидный противовоспалительный препарат, который стимулирует высвобождение простагландинов.
Farmaco Ed Sci
1980
;35
:836
–42,86Pelletier JP, Mineau F, Fernandes JC, Duval N, Martel-Pelletier J. Диацерхеин и реин снижают уровень и активность индуцибельного синтеза оксида азота, стимулированные интерлейкином 1beta, одновременно стимулируя синтез циклооксигеназы-2 у человека. остеоартрозные хондроциты.
J Rheumatol
1998
;25
:2417
–24,87Тамура Т., Омори К. Диацереин подавляет увеличение оксида азота в плазме при артрите, индуцированном адъювантом у крыс.
евро J Pharmacol
2001
;419
:269
–74,88Attur MG, Patel RN, Patel PD, Abramson SB, Amin AR. Тетрациклин усиливает экспрессию ЦОГ-2 и продукцию простагландина E 2 независимо от его воздействия на оксид азота.
J Immunol
1999
;162
:3160
–7.89Патель Р.Н., Аттур М.Г., Дэйв М.Н. и др. . Новый механизм действия химически модифицированных тетрациклинов: ингибирование производства простагландина E2, опосредованного ЦОГ-2.
Иммунология
1999
;163
:3459
–67,90Ярон М., Ширази И., Ярон И. Анти-интерлейкин-1 эффекты диацереина и реина в синовиальной ткани и культурах хрящей человека при остеоартрите.
Тележка для лечения артроза
1999
;7
:272
–80.91Martel-Pelletier J, Mineau F, Jolicoeur FC, Cloutier JM, Pelletier JP. In vitro эффекты диацереина и реина на системы интерлейкина 1 и фактора некроза опухоли альфа в синовиальной оболочке и хондроцитах человека при остеоартрите.
J Rheumatol
1998
;25
:753
–62.92Moldovan F, Pelletier JP, Jolicoeur FC, Cloutier JM, Martel-Pelletier J. Diacerhein и rhein снижают индуцированную ICE активацию IL-1beta и IL-18 в остеоартритическом хряще человека.
Тележка для лечения артроза
2000
;8
:186
–96.93Мендес А.Ф., Карамона М.М., де Карвалью А.О., Лопес М.С. Диацереин и реин предотвращают индуцированную интерлейкином-1бета активацию ядерного фактора каппаВ, ингибируя деградацию ингибитора каппаВ-альфа.
Pharmacol Toxicol
2002
;91
:22
–8.94Дозин Б., Мальпели М., Камарделла Л., Канседда Р., Пьетранджело А. Реакция суставных хондроцитов человека молодого, пожилого и остеоартритического возраста на воспалительные цитокины: молекулярные и клеточные аспекты.
Матрикс Биол
2002
;21
:449
–59,95Boittin N, Redini F, Loyau G, Pujol JP. Влияние диацереина (ART 50) на синтез матрикса и секрецию коллагеназы культивированными хондроцитами суставов кроликов.
Rev Rhum
1993
;60
:68S
–76S.96Tamura T., Kosaka N, Ishiwa J, Sato T, Nagase H, Ito A. Rhein, активный метаболит диацереина, подавляет продукцию проматричных металлопротеиназ-1 , -3, -9 и -13 и повышают продукцию тканевого ингибитора металлопротеиназы-1 в культивируемых суставных хондроцитах кролика.
Тележка для лечения артроза
2001
;9
:257
–63.97Тамура Т., Омори К. Рейн, активный метаболит диацереина, подавляет индуцированную интерлейкином-1альфа деградацию протеогликана в культивируемых суставных хондроцитах кролика.
Jpn J Pharmacol
2001
;85
:101
–4,98Фелисаз Н., Бумедьен К., Гайор С. и др. . Стимулирующее действие диацереина на экспрессию TGF-beta1 и beta2 в суставных хондроцитах, культивируемых с интерлейкином-1 и без него.
Тележка для лечения артроза
1999
;7
:255
–64,99Mazieres B, Berdah L, Thiechart M, Viguier G. Diacetylrhein на постконтузионной модели экспериментального остеоартрита у кролика.
Rev Rhum
1993
;60
:77S
–81S.100Тамура Т., Омори К., Накамура К. Влияние диацереина на спонтанный полиартрит у самцов новозеландских черных мышей / KN.
Тележка для лечения артроза
1999
;7
:533
–8.101Карни SL. Влияние диацетилреина на развитие экспериментального остеоартроза. Биохимическое исследование.
Тележка для лечения артроза
1996
;4
:251
–61.102Брандт К.Д., Смит Г., Канг С.И., Майерс С., О’Коннор Б., Альбрехт Н. Эффекты диацереина в ускоренной модели остеоартрита у собак.
Тележка для лечения артроза
1997
;5
:438
–49.103Smith GN Jr, Myers SL, Brandt KD, Mickler EA, Albrecht ME.Лечение диацереином снижает тяжесть остеоартрита на модели остеоартрита с дефицитом крестообразных связок у собак.
Arthritis Rheum
1999
;42
:545
–54.104Дугадос М., Нгуен М., Бердах Л., Мазьер Б., Лекесн М.; Исследовательская группа ECHODIAH. Оценка структурно-модифицирующих эффектов диацереина при остеоартрите тазобедренного сустава: ECHODIAH, трехлетнее плацебо-контролируемое исследование. Оценка хондромодулирующего эффекта диацереина при ОА бедра.
Arthritis Rheum
2001
;44
:2539
–47.105Pham T, Le Henanff A, Ravaud P, Dieppe P, Paolozzi L, Dougados M. Оценка симптоматической и структурной эффективности нового соединения гиалуроновой кислоты, NRD101, по сравнению с диацереином и плацебо в 1-летнем рандомизированном контролируемом исследовании симптоматического остеоартрита коленного сустава.
Ann Rheum Dis
2004
;63
:1611
–7.106Gouze JN, Bianchi A, Becuwe P et al .Глюкозамин модулирует индуцированную IL-1 активацию хондроцитов крысы на уровне рецепторов и путем ингибирования пути NF-каппа B.
FEBS Lett
2002
;510
:166
–70.107Shikhman AR, Kuhn K, Alaaeddine N, Lotz M. N-ацетилглюкозамин предотвращает опосредованную IL-1 бета активацию хондроцитов человека.
J Immunol
2001
;166
:5155
–60.108Largo R, Alvarez-Soria MA, Diez-Ortego I et al .Глюкозамин ингибирует индуцированную IL-1beta активацию NFkappaB в хондроцитах человека, страдающих остеоартритом.
Тележка для лечения артроза
2003
;11
:290
–8.109Piperno M, Reboul P, Hellio Le Graverand MP et al . Сульфат глюкозамина модулирует дисрегулируемую активность хондроцитов остеоартрита человека in vitro .
Тележка для лечения артроза
2000
;8
:207
–12.110Накамура Х., Шибакава А., Танака М., Като Т., Нисиока К.Влияние гидрохлорида глюкозамина на продукцию простагландина E2, оксида азота и металлопротеаз хондроцитами и синовиоцитами при остеоартрите.
Clin Exp Rheumatol
2004
;22
:293
–9.111Gouze JN, Bordji K, Gulberti S et al . Интерлейкин-1бета подавляет экспрессию глюкуронозилтрансферазы I, ключевого фермента, запускающего биосинтез гликозаминогликанов: влияние глюкозамина на опосредованные интерлейкином-1бета эффекты в хондроцитах крыс.
Arthritis Rheum
2001
;44
:351
–60.112Fenton JI, Chlebek-Brown KA, Caron JP, Orth MW. Влияние глюкозамина на интерлейкин-1 суставной хрящ.
Equine Vet J Suppl
2002
;34
:219
–23.113Fenton JI, Chlebek-Brown KA, Peters TL, Caron JP, Orth MW. Глюкозамин HCl снижает деградацию суставного хряща лошади в культуре эксплантата.
Тележка для лечения артроза
2000
;8
:258
–65.114Tung JT, Venta PJ, Eberhart SW, Yuzbasiyan-Gurkan V, Alexander L, Caron JP. Влияние препаратов против артрита на экспрессию генов и ферментативную активность циклооксигеназы-2 в культивируемых хондроцитах лошадей.
Am J Vet Res
2002
;63
:1134
–9.115Dodge GR, Jimenez SA. Сульфат глюкозамина регулирует уровни аггрекана и матриксной металлопротеиназы-3, синтезируемые культивированными суставными хондроцитами человека, страдающими остеоартритом.
Тележка для лечения артроза
2003
;11
:424
–32.116Sandy JD, Gamett D, Thompson V, Verscharen C. Опосредованный хондроцитами катаболизм аггрекана: зависимое от агреканазы расщепление, индуцированное интерлейкином-1 или ретиноевой кислотой, может ингибироваться глюкозамином.
Biochem J
1998
;335
:59
–66.117Патвари П., Курц Б., Сэнди Д.Д., Гродзинский А.Дж. Маннозамин подавляет опосредованные агреканазой изменения физических свойств и биохимического состава суставного хряща.
Arch Biochem Biophys
2000
;374
:79
–85.118де Маттей М., Пеллати А., Паселло М. и др. . Высокие дозы глюкозамина-HCl оказывают пагубное воздействие на эксплантаты суставного хряща крупного рогатого скота, культивируемые in vitro .
Тележка для лечения артроза
2002
;10
:816
–25.119Tiraloche G, Girard C, Chouinard L et al . Влияние перорального глюкозамина на деградацию хряща на кроличьей модели остеоартрита.
Arthritis Rheum
2005
;52
:1118
–28.120Шихман А.Р., Амиэль Д., Д’Лима Д. и др. . Хондропротекторная активность N-ацетилглюкозамина у кроликов с экспериментальным остеоартрозом.
Ann Rheum Dis
2005
;64
:89
–94.121Reginster JY, Deroisy R, Rovati LC et al . Долгосрочные эффекты сульфата глюкозамина на прогрессирование остеоартрита: рандомизированное плацебо-контролируемое клиническое исследование.
Ланцет
2001
;357
:251
–6.122Pavelka K, Gatterova J, Olejarova M, Machacek S, Giacovelli G, Rovati LC. Использование сульфата глюкозамина и замедление прогрессирования остеоартрита коленного сустава: трехлетнее рандомизированное плацебо-контролируемое двойное слепое исследование.
Arch Intern Med
2002
;162
:2113
–23.123Knudsen PJ, Dinarello CA, Strom TB. Глюкокортикоиды подавляют транскрипционную и посттранскрипционную экспрессию интерлейкина 1 в клетках U937.
J Immunol
1987
;139
:4129
–34.124Ли С.В., Цоу А.П., Чан Х. и др. . Глюкокортикоиды избирательно подавляют транскрипцию гена интерлейкина 1 бета и снижают стабильность мРНК интерлейкина 1 бета.
Proc Natl Acad Sci USA
1988
;85
:1204
–8.125Pelletier JP, Cloutier JM, Martel-Pelletier J. Эффекты in vitro тиапрофеновой кислоты, салицилата натрия и гидрокортизона на метаболизм протеогликанов остеоартрозного хряща человека.
J Rheumatol
1989
;16
:646
–55,126Hill DJ. Влияние кортизола на пролиферацию клеток, синтез и деградацию протеогликанов в хрящевых зонах реберно-хрящевой пластины роста теленка in vitro с активностью соматомедина плазмы крысы и без нее.
J Endocrinol
1981
;88
:425
–35,127Такигава М., Такано Т., Накагава К., Сакуда М., Судзуки Ф. Стимуляция пролиферации и синтеза гликозаминогликанов в черепно-лицевых хондроцитах кролика in vitro .
Arch Oral Biol
1988
;33
:893
–9.128Макгуайр М.Б., Мерфи М., Рейнольдс Дж. Дж., Рассел РГГ. Производство коллагеназы и ингибитора (ТИМП) нормальной, ревматоидной и остеоартритической синовиальной оболочкой in vitro : эффекты гидрокортизона и индометацина.
Clin Biol
1981
;61
:703
–10.129Пеллетье Дж. П., Мартель-Пеллетье Дж. Разрушение хряща нейтральными протеогликаназами при экспериментальном остеоартрите.
Подавление стероидами. Arthritis Rheum
1985
;28
:1393
–401.130Martel-Pelletier J, Cloutier JM, Pelletier JP. Нейтральные протеазы синовиальной оболочки при остеоартрите человека.
Arthritis Rheum
1986
;29
:1112
–21.131Pelletier JP, Martel-Pelletier J, Cloutier JM, Woessner JF Jr. Активность кислой металлопротеиназы, разрушающей протеогликаны, в хрящах остеоартрита человека и эффекты внутрисуставных инъекций стероидов.
Arthritis Rheum
1987
;30
:541
–8.132Pelletier JP, Mineau F, Raynauld JP, Woessner JF, Gunja-Smith Z, Martel-Pelletier J. Внутрисуставные инъекции метилпреднизолона ацетата уменьшают остеоартритические поражения параллельно с синтезом хондроцитов при экспериментальном строметезинозном синдроме.
Arthritis Rheum
1994
;37
:414
–23.133Itagane Y, Inada H, Fujita K, Isshiki G.Взаимодействие между стероидными гормонами и инсулиноподобным фактором роста-I в хондроцитах кролика.
Эндокринология
1991
;128
:1419
–24.134Ван дер Краан П.М., Виттерс Е.Л., Постма Н.С., Вербунт Дж., Ван ден Берг В.Б. Поддержание синтеза крупных протеогликанов в анатомически неповрежденном суставном хряще мыши с помощью стероидов и инсулиноподобного фактора роста I.
Ann Rheum Dis
1993
;52
:734
–41.135Van Osch GJ, van der Veen SW, Verwoerd-Verhoef HL. In vitro. повторная дифференцировка выращенных в культуре кроличьих и человеческих аурикулярных хондроцитов для реконструкции хряща.
Пласт Реконстр Сург
2001
;107
:433
–40,136Коломбо С., Батлер М., Хикман Л., Селвин М., Диаграмма J, Стейнец Б. Новая модель остеоартрита у кроликов. II. Оценка антиостеоартритных эффектов выбранных противоревматических препаратов, применяемых системно.
Arthritis Rheum
1983
;26
:1132
–9.137Батлер М., Коломбо К., Хикман Л. и др. . Новая модель остеоартроза у кроликов. III. Оценка антиостеоартрозных эффектов отдельных препаратов, вводимых внутрисуставно.
Arthritis Rheum
1983
;26
:1380
–6.138Williams JM, Brandt KD. Гексацетонид триамцинолона защищает от фибрилляции и образования остеофитов после химически индуцированного повреждения суставного хряща.
Arthritis Rheum
1985
;28
:1267
–74.139Пеллетье Дж. П., Мартель-Пеллетье Дж. Защитные эффекты кортикостероидов на повреждения хряща и образование остеофитов в модели остеоартрита у собак Понд-Нуки.
Arthritis Rheum
1989
;32
:181
–93.140Ван Дж., Элеваут Д., Хоффман И., Вейс Е.М., Вербругген Г. Физиологические уровни гидрокортизона поддерживают оптимальный метаболизм внеклеточного матрикса хондроцитов.
Ann Rheum Dis
2004
;63
:61
–6.141Бреннан Ф.М., Чантри Д., Джексон А., Майни Р., Фельдманн М. Ингибирующее действие антител ФНО-альфа на выработку интерлейкина-1 синовиальными клетками при ревматоидном артрите.
Ланцет
1989
;2
:244
–7.142Lipsky PE, van der Heijde DM, St Clair EW et al . Инфликсимаб и метотрексат в лечении ревматоидного артрита.
Исследовательская группа по исследованию противоопухолевого фактора некроза при ревматоидном артрите с сопутствующей терапией.N Engl J Med
2000
;343
:1594
–602.143Смолен Дж. С., Хан С., Бала М. и др. .; Исследовательская группа ATTRACT. Доказательства радиографической пользы лечения инфликсимабом плюс метотрексат у пациентов с ревматоидным артритом, у которых не было клинического улучшения: подробный субанализ данных исследования противоопухолевого фактора некроза при ревматоидном артрите с исследованием сопутствующей терапии.
Arthritis Rheum
2005
;52
:1020
–30.144Круитхоф Э., Ван ден Бош Ф., Баетен Д. и др. . Повторные инфузии инфликсимаба, химерного моноклонального антитела против TNFalpha, пациентам с активной спондилоартропатией: наблюдение в течение одного года.
Ann Rheum Dis
2002
;61
:207
–12.145Verbruggen G, Veys EM. Системы числовой оценки анатомической эволюции остеоартроза суставов пальцев.
Arthritis Rheum
1996
;39
:308
–20.© Автор 2005. Опубликовано Oxford University Press от имени Британского общества ревматологов. Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected]
.Хондропротекторы при дегенеративных заболеваниях суставов | Ревматология
Аннотация
Катаболические пути цитокинов и анаболических факторов роста контролируют разрушение и восстановление при остеоартрите (ОА).Однонаправленный каскад цитокинов, управляемый TNF-α / IL-1, нарушает гомеостаз внеклеточного матрикса суставного хряща при ОА. Хотя хондроциты в хряще OA сверхэкспрессируют анаболический инсулиноподобный фактор роста (IGF) и его специфический рецептор (IGFRI), аутокринный TNF-α, высвобождаемый апоптотическими клетками суставного хряща, запускает ауто / паракринный каскад, управляемый IL-1, который перекрывает активность фактора роста. которые поддерживают восстановление при дегенеративных заболеваниях суставов. Хондропротекция с повторным появлением исчезнувшей суставной щели была безошибочно задокументирована в периферических суставах пациентов, страдающих спондилоартропатией, при лечении агентами, блокирующими TNF-α, которые подавляли однонаправленный цитокиновый каскад, управляемый TNF-α / IL-1.Серия агентов, модифицирующих структуру соединительной ткани (CTSMA), которые напрямую влияют на синтез ИЛ-1 и высвобождают in vitro и снижают нижерасположенные характеристики ИЛ-1, например активности коллагеназы, протеогликаназы и матриксной металлопротеиназы, экспрессия индуцибельной синтазы оксида азота, повышенное высвобождение оксида азота и секреция простагландина E 2 , IL-6 и IL-8, как было показано, обладают модифицирующим заболевание OA активность лекарственного средства (DMOAD) в экспериментальных моделях ОА и у людей с ОА суставов пальцев и коленей.Примерами являются кортикостероиды, некоторые сульфатированные полисахариды, химически модифицированные тетрациклины, диацетилреин / реин, глюкозамин и неомыляемые вещества авокадо / сои.
Утрата функции является следствием анатомических изменений тканей суставов при остеоартрозе (ОА). Вмешательство в анатомическое развитие ОА, по-видимому, является методом сохранения нормальной функции суставов. Вещества, защищающие суставной хрящ во время ОА, получили название хондрозащитных средств.Когда кажется, что они изменяют течение заболевания, эти агенты могут быть названы лекарственными средствами, модифицирующими заболевание, ОА (DMOAD) [1]. Боль в суставах при остеоартрите объясняется различными причинами, вторичными по отношению к анатомическим изменениям, например: воспалительные явления в синовиальной оболочке и субхондральная внутрикостная гипертензия из-за венозного застоя. В этом обзоре будут рассмотрены аспекты хондропротекторной терапии DMOAD, а не облегчение клинических симптомов, которые в конечном итоге могут возникнуть при назначении пациентам терапии DMOAD.
Гомеостаз внеклеточного матрикса здорового суставного хряща
Гомеостаз внеклеточного матрикса (ЕСМ) суставного хряща зависит от реакции клеток суставного хряща на ауто- и паракринные анаболические и катаболические пути. Наиболее важные факторы роста и цитокины, которые, как известно, участвуют в метаболизме хряща, вырабатываются самими хондроцитами [2, 3]. Синтез и накопление ЕСМ регулируется местно продуцируемыми факторами роста, такими как инсулиноподобные факторы роста (IGF) и трансформирующий фактор роста-β (TGF-β).Специфическая регуляторная роль TGF-β была предложена при патологических условиях [4], и большое количество экспериментальных данных подтвердило важность IGF-1 как промотора роста и синтеза матрикса хондроцитами в здоровом суставном хряще. IGF-1 усиливает синтез аггрекана клетками или эксплантами суставного хряща [5-10] и in vivo, в моделях на животных [11]. Оборот и деградация матрикса зависят от реакции клетки суставного хряща на катаболические цитокины, из которых IL-1α и β являются основными агонистами [12, 13].Было показано, что помимо своей способности вызывать деградацию суставного хряща, IL-1 подавляет синтез аггрекана и коллагена хондроцитами [14, 15]. Это снижение продукции соединений ЕСМ частично опосредовано ИЛ-1-индуцированным образованием оксида азота (NO) [16]. Эффекты IL-1 опосредуются высокоаффинным рецептором клеточной поверхности (IL-1RI) [17, 18]. Важными контролирующими факторами активности IL-1 являются белки, относящиеся к семейству рецепторов IL-1, среди которых рецептор-ловушка IL-1 типа 2 (IL-1RII) экспрессируется на плазматической мембране хондроцитов и связывает IL-1α и β, но не не передавать сигналы ИЛ-1 [19, 20].Интересно, что IGF, как было показано, активирует IL-1RII рецептора-ловушки IL-1, тем самым обращая активность IL-1 [21]. Это открытие согласуется с наблюдением, что IGF-1 непосредственно снижает как базальную, так и стимулируемую цитокинами деградацию [22] и депрессию основного вещества суставного хряща [21]. Таким образом, повышая регуляцию IL-1RII, IGF-1 защищает ECM хряща от индуцированного IL-1 разрушения (рис. 1A).
Рис. 1.
Пути IL-1 / IGF, контролирующие оборот внеклеточного матрикса (ECM) в (A) здоровом хряще, (B) хряще OA и (C) хряще OA, когда проводится репрессивная терапия IL-1.(A) Активность IL-1 контролируется IGF-1 в нормальном хряще. Через повышающую регуляцию IL-1RII IGF-1 защищает ECM хряща от индуцированного IL-1 разрушения. (B) Считается, что при ОА TNF-α, высвобождаемый апоптозными клетками суставного хряща, вызывает выделение IL-1RII и запускает ауто / паракринный каскад, управляемый IL-1, что приводит к резорбции ECM. По неизвестным причинам хондроциты в хряще OA сверхэкспрессируют анаболическую активность фактора роста IGF-1 / IGF-RI. (C) Подавление активности IL-1 в хрящевых клетках, которые сверхэкспрессируют IGF-1, приводит к восстановлению ECM.
Рис. 1.
Пути IL-1 / IGF, контролирующие оборот внеклеточного матрикса (ECM) в (A) здоровом хряще, (B) хряще OA и (C) хряще OA, когда проводится репрессивная терапия IL-1. (A) Активность IL-1 контролируется IGF-1 в нормальном хряще. Через повышающую регуляцию IL-1RII IGF-1 защищает ECM хряща от индуцированного IL-1 разрушения. (B) Считается, что при ОА TNF-α, высвобождаемый апоптозными клетками суставного хряща, вызывает выделение IL-1RII и запускает ауто / паракринный каскад, управляемый IL-1, что приводит к резорбции ECM.По неизвестным причинам хондроциты в хряще OA сверхэкспрессируют анаболическую активность фактора роста IGF-1 / IGF-RI. (C) Подавление активности IL-1 в хрящевых клетках, которые сверхэкспрессируют IGF-1, приводит к восстановлению ECM.
Патология метаболических путей цитокинов и факторов роста, принимаемых ОА
Сообщалось о повышении регуляции как катаболических [2, 3, 23, 24], так и анаболических [2, 3, 23–26] путей в хондроцитах и хрящах при ОА. Корреляция с возникновением и степенью патологии ОА была отмечена для IL-1β [2, 3, 27], и эти повышенные уровни катаболических цитокинов воплощены в хорошо задокументированном увеличении активности металлопротеиназ, которые были выше в хряще ОА по сравнению с морфологически нормальными. хрящ из того же сустава [27–30].Кроме того, в хондроцитах ОА было обнаружено увеличение плотности рецепторов IL-1RI по сравнению с нормальными хондроцитами. Уровни мРНК и белка IGF-1 и его рецептора IGFRI были значительно выше в фибриллированном хряще OA, чем в нефибриллированном хряще OA тазобедренного и коленного суставов [23, 26]. Самые сильные сигналы сообщения IGF-1 или уровни белка наблюдались в хондроцитах более продвинутых поражений [23, 26]. Когда сравнивали клетки, полученные из нормальной ткани и ткани ОА из одних и тех же коленных суставов человека, ассоциированный с клетками аггрекан и коллаген типа II были значительно уменьшены вокруг хондроцитов, полученных из патологической ткани.Одновременно хондроциты из фибриллированного хряща OA экспрессировали значительно более высокие внутриклеточные уровни IL-1α и β и повышали уровень IL-1RI, связанный с плазматической мембраной. В то же время наблюдались значительно более высокие уровни внутриклеточного IGF-1 и IGF-R1, связанного с плазматической мембраной. Неожиданно оказалось, что в присутствии этой повышенной активности IGF экспрессия связанного с плазматической мембраной рецептора-ловушки IL-1RII снижалась в хондроцитах ОА [26]. Снижение уровней рецептора-ловушки IL-1RII плазматической мембраны на хондроцитах ОА может быть связано с вмешательством других аутокринных цитокиновых путей.В этом контексте было показано, что TNF-α вызывает быстрое выделение IL-1RII из мембран миеломоноцитарных клеток [31, 32]. Подобный эффект TNF-α на клетки суставного хряща еще предстоит продемонстрировать. Однако присутствие TNF-α в хрящах, подвергшихся механическому повреждению, неоднократно подтверждалось примерами. Травма суставных хондроцитов вызывает апоптоз [33, 34], а апоптоз опосредуется аутокринным путем TNF [35, 36]. Повышенная активность TGF-β в хряще OA [37–39], вызывающая понижающую модуляцию передачи сигналов IL-1RI [40], может частично компенсировать потери IL-1RII, вызванные ауто / паракринной активностью TNF-α.Однако, если необходимо идентифицировать метаболические пути цитокинов и факторов роста, TNF-α и IL-1β и их сигнальные рецепторы являются основными кандидатами (рис. 1B).
Агенты, модифицирующие структуру соединительной ткани (CTSMA), и лекарственные средства от остеоартрита, модифицирующие заболевание (DMOAD)
Первые попытки улучшить структуру и функцию соединительной ткани синовиальных суставов, тем самым облегчить симптомы дегенеративных заболеваний суставов, были основаны на туманных предположениях, что обильное введение предшественников компонентов внеклеточного матрикса поможет клеткам суставного хряща восполнить утраченную среду. .Это предположение побудило врачей использовать такие вещества, как глюкозамин и сульфат или гликозаминогликаны, с целью улучшения восстановления хряща при дегенеративных заболеваниях суставов. Аналогичным образом, первое внутрисуставное введение полисульфата хондроитина было основано на предположении, что этот препарат гепариноидного типа заменит гиалуронан в качестве лубриканта и снизит уровень фибриногена в воспаленных суставах, и что это даст терапевтическое преимущество [41, 42]. Неожиданно некоторые пациенты сообщили об облегчении симптомов после прохождения этой процедуры, и даже сообщалось о некоторых изменениях в химическом составе синовиальной жидкости [43].
Наряду с глубоким поиском механизмов, посредством которых ткани суставов разрушаются в ходе воспалительных или дегенеративных заболеваний суставов, исследователи более методично искали биологические агенты, способные восстанавливать поврежденные соединительные ткани. Поскольку суставной хрящ является одной из основных тканей-мишеней, поражаемых в ходе ревматических заболеваний суставов, многие исследования были сосредоточены на метаболических характеристиках единственной клетки, находящейся в этой ткани: хондроцита. Вещества, защищающие суставной хрящ при деструктивных заболеваниях суставов, получили название хондрозащитных средств.Когда это произошло in vivo в суставах с остеоартритом, эти агенты были названы лекарствами от остеоартрита, модифицирующими заболевание (DMOAD) [1].
Поскольку ауто / паракринный фактор роста и каскады цитокинов, лежащие в основе развития, гомеостаза и разрушения внеклеточного матрикса суставного хряща, ранее не были известны, первые исследования биологических агентов, способных изменять структуру соединительной ткани в положительную сторону, в основном были сосредоточены на от способности этих агентов улучшать синтез или ухудшать разложение соединений ЕСМ, e.грамм. аггрекан и коллаген. Согласно этому определению, ряд веществ можно классифицировать как вещества, модифицирующие структуру соединительной ткани (CTSMA). Среди них неоднократно упоминались сульфатированные гликозаминогликаны и глюкозамин, химически модифицированные тетрациклины, такие как доксициклин и миноциклин, диацетилреин и его активный метаболит реин, а также неомыляемые вещества авокадо / сои.
Сульфатные полисахариды и хондрозащита
Среди первых веществ, способных улучшать накопление соединений ЕСМ, были так называемые хондромукопротеины [44–46], смесь продуктов деградации протеогликанов, в которых присутствовал хондроитинсульфат.Затем была выдвинута гипотеза, что продукты распада ВКМ, содержащие хондроитинсульфат, каким-то образом оказывают положительное влияние на хондроциты суставного хряща. Возможность вмешательства в процессы восстановления клеток соединительной ткани in vitro с помощью сульфатированных полисахаридов была впервые описана в середине 1970-х годов [47, 48]. Позже было показано, что полисульфат хондроитинсульфата улучшает синтез гиалуронана в синовиальных суставах in vivo у людей [49]. Тот же препарат, а также его природный аналог, хондроитинсульфат, улучшали функцию восстановления хондроцитов in vivo в различных экспериментальных моделях остеоартрита [50–53].Недавно рандомизированные двойные слепые плацебо-контролируемые терапевтические испытания привели к выводу, что эти CTSMA обладают свойствами DMOAD, поскольку они, как было показано, замедляют прогрессирование эрозивного ОА в межфаланговых суставах пальцев [54, 55] и ОА коленного сустава. у человека [56–58].
Эксперименты in vitro и in vivo в различных исследовательских центрах, касающиеся влияния на метаболизм молекул межклеточного матрикса (протеогликанов, аггреканов, гиалуронана), показали, что большинство (поли) сульфатированных полисахаридов влияют на клетки соединительной ткани (хрящевые клетки, синовиальные клетки, фибробласты) аналогичным образом [48, 59–61].С улучшением нашего понимания ауто / паракринного фактора роста и цитокиновых путей, которые контролируют гомеостаз здоровых соединительных тканей, стало возможным изучить механизм действия этих CTSMA. Недавние исследования сульфатированных полисахаридов показали, что эти агенты действуют в биологических системах путем подавления важных катаболических ауто / паракринных цитокиновых путей, таких как IL-1, тем самым улучшая накопление соединений ЕСМ в клеточно-ассоциированном матриксе этих клеток.Эксперименты с бычьими хрящевыми клетками, полученными из макроскопически интактных пястно-фаланговых суставов, показали, что физиологические концентрации полисульфата хондроитина значительно снижают последующие эффекты IL-1, такие как активность коллагеназы, протеогликаназы и матриксной металлопротеиназы (MMP) -1 и MMP-3 [62]. Кроме того, полисульфат хондроитина ингибировал индуцированную IL-1 экспрессию мРНК тканевого активатора плазминогена (tPA) [62]. Аналогичным образом, полисульфат ксилозана и полисульфат хондроитина восстанавливали накопление аггрекана, гиалуронана и коллагена типа II в клеточно-ассоциированном матриксе в обработанных IL-1β хондроцитах человека, культивируемых в агарозе.Этот эффект, вероятно, частично является результатом подавления MMPs [63]. Кроме того, в культивируемых хондроцитах лошадей полисульфат хондроитина значительно снижал экспрессию индуцибельной синтазы оксида азота (iNOS), усиленную IL-1β, что сопровождалось повышенным высвобождением NO. Хондроитин полисульфат снижает концентрацию нитрита в супернатантах этих IL-1β-стимулированных культур [64]. Наконец, новый полисульфатированный полисахарид, полисульфат циклодекстрина, продемонстрировал эффекты модификации структуры хряща in vitro , поскольку он улучшал синтез аггрекана и накопление связанных с клетками макромолекул матрикса клетками суставного хряща человека в альгинате.Здесь впервые было показано, что этот эффект частично является результатом прямой репрессии IL-1, поскольку клетки, обработанные полисульфатом циклодекстрина, экспрессируют значительно меньшие количества внутриклеточных IL-1α и β [65]. Те же обработанные β-циклодекстрином хондроциты высвобождали значительно меньше ИЛ-6 в супернатантную культуральную среду, эффект, который, как известно, является результатом ауто / паракринной стимуляции ИЛ-1 [65]. Следует напомнить, что концентрации полисахаридов в культуральном супернатанте большинства описанных экспериментов in vitro и уровни полисахаридов в плазме или хрящевой ткани, полученные у людей после перорального введения, были одного порядка [66–68].
Неомыляемые вещества из авокадо / сои
Сообщалось, что неомыляемые вещества авокадо / сои подавляют катаболическую активность хондроцитов и увеличивают накопление протеогликана хондроцитами ОА в культуре. Неомыляемые вещества из авокадо / сои были мощными ингибиторами основной продукции ММР-3 хондроцитами ОА, а также продукции IL-6, IL-8, NO и простагландина E 2 (PGE 2 ) [69]. Все эти биологические активности зависят от ИЛ-1 и выражены в хондроцитах ОА.Точно так же неомыляемые вещества авокадо / соя обращали вспять эффекты IL-1β в фибробластах десен из воспаленных тканей [70]. Эффекты этих экстрактов, подавляющие IL-1, защищали подкожно имплантированный хрящ от деградации [71]. In vivo Эффекты DMOAD после введения неомыляемых веществ из авокадо / сои были описаны в модели менискэктомии у овец [72] и, возможно, в человеческом OA бедра [73].
Химически модифицированные тетрациклины
Было показано, что химически модифицированные тетрациклины, такие как доксициклин и миноциклин, непосредственно ингибируют активность протеаз и коллагеназ [74].Тетрациклины также могут косвенно подавлять эту катаболическую активность, поскольку, как сообщалось, они снижают уровни мРНК коллагеназ в изолированных хондроцитах ОА. Кроме того, доксициклин ингибировал увеличение мРНК этих ферментов в нормальных хондроцитах, стимулированных TNF-α [75]. Аналогичным образом, хондроциты, выделенные из хряща OA человека и обработанные доксициклином, показали значительное ингибирование белка матриксной металлопротеиназы и соответствующих уровней мРНК, что указывает на транскрипционный / посттранскрипционный уровень контроля.Кроме того, лечение доксициклином привело к значительному снижению уровня мРНК IL-1α, β и IL-6 [76].
Прямое ингибирование таких цитокинов могло быть ответственным за снижение активности синтазы оксида азота в синовиальных клетках ОА [77]. Тетрациклины обращали как спонтанную, так и индуцированную IL-1β активность NOS в условиях ex vivo в тканях OA человека. Было обнаружено, что механизм действия этих препаратов на экспрессию NOS, по крайней мере частично, находится на уровне экспрессии РНК и трансляции фермента [78].
Вероятно, что снижение активности коллагеназы и желатиназы в экстрактах остеоартрозного хряща человека после перорального введения этих тетрациклинов человеку [79], а также открытие того, что доксициклин ингибирует продукцию NO в хряще у собак, у которых развился ОА после спонтанного разрыв передней крестообразной связки [80], возможно, был приписан ингибированию активности ауто / паракринных катаболических цитокинов. Скорее всего, это ингибирование каскадов катаболических цитокинов было ответственно за «хондропротекторные» эффекты при воспалительных артритах на животных моделях.Профилактические доксициклины и химически модифицированные варианты, вводимые перорально, уменьшали изменения ОА в коленных суставах in vivo у морских свинок Хартли, которые имеют высокую частоту ОА коленных суставов [81], и заметно снижали тяжесть ОА в областях, несущих нагрузку. медиального мыщелка бедренной кости при экспериментальном ОА у взрослых беспородных собак [82]. Совсем недавно было показано, что лечение доксициклином в дозе 100 мг два раза в день в течение 30 месяцев снижает скорость сужения суставной щели в коленях с установленным остеоартритом в группе женщин с ожирением [83].
Диацетилреин
В отличие от других CTSMA, которые ингибируют NO [64, 69, 77, 78, 107, 110–113] и продукцию простаноидов [69, 108, 110–112, 114], активный метаболит диацетилреина, реин не снижает, но, по-видимому, стимулирует синтез простагландинов in vitro [84, 85] и in vivo [86]. Этот механизм действия диацетилреина по увеличению экспрессии циклооксигеназы (COX) -2 и продукции PGE 2 , независимо от их ингибирования эндогенного NO [85, 87], аналогичен таковому у тетрациклинов, например.грамм. доксициклин и миноциклин, которые ингибируют индуцибельную NO-синтазу и увеличивают экспрессию ЦОГ-2 [88, 89]. Rhein и тетрациклины являются родственными химическими структурами в том смысле, что эти соединения возникают в результате реакций замещения полиядерных углеводородов: антрацена и нафтацена соответственно. Реин и тетрациклины обладают структурным сходством (рис. 2).
Рис. 2.
Райн, активный метаболит диацетилреина, и тетрациклин обладают структурным сходством.
Рис. 2.
Райн, активный метаболит диацетилреина, и тетрациклин обладают структурным сходством.
Подобно тетрациклинам, диацетилреин / реин подавлял экспрессию ИЛ-1 в активированных липополисахаридами человеческих хондроцитах ОА [90] и синовиальных клетках [91]. Эксперименты на изолированных хондроцитах суставного хряща и на эксплантатах хрящевой ткани показали, что это нарушение высвобождения активного ИЛ-1 частично связано с ингибированием фермента, преобразующего ИЛ-1 (ICE) плазматической мембраны.Судя по отсутствию влияния на уровень экспрессии генов обоих белков, действие диацетилреина / реина на IL-1β и ICE должно было быть посттрансляционным [92]. Понижающая модуляция активной продукции IL-1 сопровождалась ингибированием активации NFκB [93] и, следовательно, экспрессии IL-1 / NFκB-зависимых генов в этих клетках [90, 91, 93]. Блокирующие нижестоящие события IL-1 включали снижение продукции NO, стромелизина-1 [91, 94] и коллагеназы, а также провоспалительных IL-6, -8 и -18 в IL-1α и TNF-α активированных монослойных культивируемых суставных хондроцитах человека из ОА суставов [92, 94].Аналогичным образом, реин подавлял индуцированную IL-1 экспрессию генов proMMP-1, -3, -9 и -13 и их активности, а также повышал продукцию тканевого ингибитора металлопротеиназы 1 (TIMP-1) в монослое культивированных суставные хондроциты кролика. Таким образом, в этих клетках сообщалось об увеличении продукции гликозаминогликанов и коллагена наряду со снижением деградации протеогликана [95–97]. Это улучшенное наращивание матрикса могло быть усилено увеличением экспрессии изоформ TGF-β в хондроцитах, обработанных диацетилреином [98].Все эти результаты in vitro были получены с концентрациями диацетилреина / реина, сравнимыми с терапевтическими уровнями в плазме. Можно разумно предположить, что блокирование ИЛ-1 диацетилреином / реином было ответственно за некоторые эффекты DMOAD, наблюдаемые при экспериментальном ОА у животных, например при разрушении хряща надколенника кролика, вызванном контузией [99], и при спонтанно развивающемся полиартрите у мышей NZB / KN [100]. Хотя это не согласуется с улучшением биохимии суставного хряща [101–103], сравнимая хондрозащита наблюдалась в различных моделях ОА собак, если судить по макроскопическим повреждениям хряща [102, 103].
Эти эффекты DMOAD были подтверждены в двух рандомизированных двойных слепых плацебо-контролируемых исследованиях. Двести шестьдесят девять пациентов с первичным ОА бедра завершили трехлетнее исследование, получая диацетилреин в дозе 50 мг два раза в день или плацебо. Процент пациентов с рентгенологическим прогрессированием, определяемым как потеря суставной щели не менее 0,5 мм, был значительно ниже у пациентов, получавших диацетилреин, чем у пациентов, получавших плацебо. У этих пациентов частота сужения суставной щели была дискретной, но значительно ниже, чем в группе плацебо [104].Эти результаты были подтверждены в другом 1-летнем проспективном рандомизированном двойном слепом плацебо-контролируемом исследовании 301 пациента с радиологическим медиальным ОА коленного сустава [105].
Глюкозамин
Место глюкозамина как CTSMA или DMOAD остается спорным. Тот факт, что этот аминосахар долгое время назывался «сульфатом глюкозамина», вызвал путаницу. Препарат, использованный в ряде экспериментов in vitro и in vivo , не был сложным эфиром сульфата глюкозамина, а оказался препаратом, в котором глюкозамин и сульфат присутствовали в виде двух отдельных молекул в кристаллической форме.Если какие-либо эффекты CTSMA приписываются «сульфату глюкозамина», в настоящее время считается, что активным ингредиентом является моносахарид. В серии экспериментов с изолированными IL-1β-активированными хондроцитами в культуре, где использовались гексозамины, сообщалось о влиянии на последующие события IL-1. Добавление глюкозамина к хондроцитам крысы, обработанным IL-1β, уменьшало активацию фактора транскрипции NFκB, но не белка-активатора-1 [106]. Глюкозамин, но не N, -ацетилглюкозамин или другие моносахариды [107], значительно ингибировал активность NFκB в хондроцитах ОА человека, а также ядерную транслокацию белков p50 и p65 [108].Глюкозамин снижал активность фосфолипазы A2 [109], уровни мРНК и белка ЦОГ-2 [107, 108, 110] и высвобождение PGE 2 [108, 110–114] в клетках суставного хряща различного происхождения. Сходным образом аминосахар снижает продукцию iNOS и NO хондроцитами [107, 110–113] и индуцирует IL-1 металлопротеиназную и коллагеназную активности в супернатантах культур хондроцитов [109–113, 115]. Заметное ингибирование аггреканазозависимого расщепления аггрекана наблюдалось как с клетками крысы, так и с эксплантами крупного рогатого скота при добавлении глюкозамина [116] и маннозамина [117].Ингибирование не было связано с вмешательством в передачу сигналов IL-1, и точный механизм, с помощью которого гексозамины функционируют в этой системе, неясен. Вмешательство в активность ферментов привело к снижению катаболизма ВКМ в этих культурах хондроцитов [113]. Кроме того, сообщалось, что гексозамины улучшают синтез макромолекул ECM в IL-1-репрессированных хрящевых клетках [106, 111, 112, 115]. Большинство цитируемых экспериментов проводилось на нормальных хондроцитах, хондроцитах или хрящевых эксплантатах, примированных IL-1.Редко использовались нативные хондроциты ОА [109, 115]. Основная проблема с исследованиями in vitro , проведенными до сих пор, — это концентрации гексозаминов, используемых в этих экспериментах. Обычно пациентам с ОА ежедневно вводят 1500 мг глюкозамина (20 мг / кг у субъекта массой 75 кг). Эти предписанные количества в лучшем случае обеспечивают концентрацию гексозамина в плазме на уровне 0,15–0,30 мМ у среднестатистического европейца. Два из вышеупомянутых экспериментальных исследований были проведены с концентрациями глюкозамина в этом диапазоне [115, 117].Остальные были сделаны с использованием нефизиологических уровней глюкозамина в питательной среде в диапазоне от 0,56 до 139,66 мМ [106–113, 116], в условиях, при которых ингибирование катаболических эффектов, вызванных IL1β, могло быть связано с токсичностью глюкозамина [118].
Актуальность результатов in vitro , полученных с супрафизиологическими дозами глюкозамина, остается спорным, поскольку ежедневное введение ∼20 мг / кг глюкозамина пероральным путем кроликам, у которых выполнялось перерезание передней крестообразной связки, имело только обнаруживаемый участок. -специфический, частичный модифицирующий болезнь эффект в этой модели ОА.Введение глюкозамина не предотвращало фибрилляцию и / или эрозию суставного хряща у обработанных животных [119]. Кроме того, парентеральное введение 200 мг / кг N-ацетил-глюкозамина на кроличьей модели экспериментального ОА коленного сустава не показало хондропротекторных эффектов [120]. Механизм действия, с помощью которого этот гексозамин, таким образом, мог повлиять на эволюцию одной человеческой популяции с ОА коленного сустава [121, 122], таким образом, еще предстоит выяснить. Принимая во внимание отсутствие хондрозащиты в экспериментальных животных моделях ОА, подтверждение хондропротекторных эффектов глюкозамина в человеческой популяции было бы ценным.
Кортикостероиды и ИЛ-1
Гомеостаз ВКМ клетками суставного хряща зависит от контроля ауто / паракринных катаболических каскадов, индуцированных ИЛ-1 [21]. Множество эндокринных гормонов и факторов роста способны контролировать эту активность IL-1. Традиционно сообщалось, что кортикостероиды напрямую влияют на синтез ИЛ-1 [123, 124]. Как показано на культурах хрящевых эксплантатов, кортикостероидные гормоны в физиологических дозах ингибируют деградацию внеклеточного матрикса [125–127].Это ингибирование пути IL-1 привело к снижению патологической активности нейтральных протеаз в хрящевой ткани [128–132]. Помимо того факта, что кортикостероиды действуют синергетически с различными основными факторами роста и дифференцировки, влияя на синтез основного вещества внеклеточного матрикса [133–135], антикатаболические эффекты кортикостероидов, по крайней мере, частично объясняют защитные эффекты на хрящ ОА однократных или периодических местное или системное введение физиологических доз кортикостероидов в различных моделях экспериментально индуцированного ОА, таких как модель менискэктомированного кролика [136, 137], при химически индуцированном повреждении хряща у морской свинки [138] и в модели собаки Паунда-Нуки. ОА [132, 139].Подобные защитные эффекты этих препаратов наблюдались на хрящах остеоартрита у людей [131]. Это подавление IL-1 физиологическими дозами кортикостероидов вместе с повышающей регуляцией рецептора IGF-1 в конечном итоге привело к накоплению соединений ECM в непосредственном окружении хрящевых клеток in vitro [63, 140] .
Защита и регенерация суставного хряща с помощью блокаторов цитокинов: подтверждение концепции
Совсем недавно были зарегистрированы драматические хондропротекторные эффекты у пациентов с РА и деструктивным артритом, ассоциированным со спондилоартропатией (СПА).У этих пациентов TNF-α, высвобождаемый в синовиальной мембране, запускает катаболический ауто / паракринный путь IL-1 хондроцитов в соседнем суставном хряще [141]. Результирующий каскад ауто / паракринного IL-1 будет вызывать разрушение внеклеточного матрикса суставного хряща. Лечение пациентов с РА рекомбинантными белками, поглощающими TNF-α, подавляет активность IL-1 хондроцитов и останавливает эрозивную прогрессию, продолжающуюся в течение этих воспалительных заболеваний [142]. Нейтрализация TNF-α при RA в конечном итоге приводит к очевидному восстановлению пораженных суставов [143].Повторное появление исчезнувшей суставной щели было зарегистрировано при периферическом артрите, связанном с СПА [144, 145] (рис. 3). Сходным образом при ОА ауто / паракринный TNF-α, возникающий в результате апоптоза хондроцитов [31–34] после чрезмерного механического стресса, вызывает индуцированное IL-1 разрушение внеклеточной среды суставного хряща. Насколько подобное блокирование TNF-α может привести к остановке прогрессирования этого заболевания, еще не изучено.
Рис.3.
Хондрозащита и регенерация суставного хряща блокаторами цитокинов. (A) Тазобедренный сустав пациента с анкилозирующим спондилитом до (слева) и после 1 года лечения инфликсимабом, блокирующим TNF-α моноклональным антителом. Прекращено развитие эрозии, вновь появилась суставная щель. (B) Такое же течение наблюдалось в третьем проксимальном межфаланговом суставе и втором дистальном межфаланговом суставе пациента, страдающего псориатическим артритом. Эти записи были получены после завершения серии проспективных рандомизированных плацебо-контролируемых исследований, одобренных местным комитетом по этике, в которые были включены 107 пациентов для изучения влияния инфликсимаба на клинические признаки спондилоартропатии [144]. , Ван дер Бош, представлен].Рентгеновские снимки пораженных суставов были сделаны при поступлении и через 1 год наблюдения. (C) При эрозивном ОА межфалангового сустава пальца подобный тип ремоделирования происходит спонтанно после прекращения деструктивного эпизода. Четыре рентгеновских снимка были сделаны с интервалом в 1 год [145].
Рис. 3.
Хондрозащита и регенерация суставного хряща цитокиноблокаторами. (A) Тазобедренный сустав пациента с анкилозирующим спондилитом до (слева) и после 1 года лечения инфликсимабом, блокирующим TNF-α моноклональным антителом.Прекращено развитие эрозии, вновь появилась суставная щель. (B) Такое же течение наблюдалось в третьем проксимальном межфаланговом суставе и втором дистальном межфаланговом суставе пациента, страдающего псориатическим артритом. Эти записи были получены после завершения серии проспективных рандомизированных плацебо-контролируемых исследований, одобренных местным комитетом по этике, в которые были включены 107 пациентов для изучения влияния инфликсимаба на клинические признаки спондилоартропатии [144]. , Ван дер Бош, представлен].Рентгеновские снимки пораженных суставов были сделаны при поступлении и через 1 год наблюдения. (C) При эрозивном ОА межфалангового сустава пальца подобный тип ремоделирования происходит спонтанно после прекращения деструктивного эпизода. Четыре рентгеновских снимка были сделаны с интервалом в 1 год [145].
Обсуждение
Идентичные пути цитокинов и факторов роста контролируют разрушение и восстановление при ОА и воспалительных заболеваниях суставов, таких как RA и SPA-ассоциированный артрит. Однонаправленные каскады цитокинов, управляемые TNF-α / IL-1, нарушают гомеостаз ECM суставного хряща при этих нарушениях.TNF-α, происходящий из синовиальной мембраны, запускает каскад во время воспалительных патологий, в то время как при ОА аутокринный TNF-α, высвобождаемый апоптозными клетками суставного хряща, вызывает активность IL-1. Как при воспалительных, так и при дегенеративных состояниях, каскады цитокинов, управляемые TNF-α / IL-1, преобладают над путями факторов роста, способствующих анаболической репарации. Однако, когда биологические препараты, блокирующие TNF-α, вводили при иммунологически опосредованных воспалительных артритах, безошибочно было продемонстрировано восстановление тканей.В СПА зафиксировано повторное появление ранее исчезнувшей суставной щели.
Точно так же репрессия каскадов цитокинов, управляемых TNF-α / IL-1, должна позволить репарации стать еще более очевидной при ОА, поскольку пути анаболического фактора роста также сверхэкспрессируются в этом состоянии. Было показано, что кортикостероиды, отдельные классы (поли) сульфатированных полисахаридов, тетрациклины, диацетилреин / реин, авокадо / соевые бобы и глюкозамин подавляют IL-1 и, по-видимому, подавляют нижестоящие характеристики IL-1, например.грамм. активность коллагеназы, протеогликаназы и ММП, экспрессия iNOS и повышенное высвобождение NO, а также выделение PGE 2 , IL-6 и IL-8. За исключением кортикостероидов и диацетилреина, эти агенты не продемонстрировали стимуляции активности фактора роста. Все эти CTSMA, способные непосредственно влиять на синтез и высвобождение IL-1 in vitro , как было показано, обладают активностью DMOAD в экспериментальных моделях ОА и в популяциях людей с ОА коленных и пальцевых суставов.Эффекты DMOAD глюкозамина in vivo остаются несколько спорными, поскольку концентрации гексозаминов, которые были эффективны в экспериментах in vitro , никогда не были достигнуты при системном введении аминосахаров экспериментальным животным или людям. Фармакологическое усиление факторов, способствующих репарации, например Ожидается, что TGF-β и / или IGF-1 не сильно повлияют на изменение заболевания при ОА. Пути анаболического восстановления уже чрезмерно выражены при этом заболевании.Этим объясняется затяжной характер ОА и очевидные признаки ремоделирования тканей сустава ОА.
Поскольку однонаправленный каскад цитокинов, управляемый TNF-α / IL-1, был идентифицирован как лекарственная мишень при ОА, простые лабораторные процедуры позволят обнаружить новую серию CTSMA с активностями DMOAD.
Авторы заявили об отсутствии конфликта интересов.
Список литературы
1Altman RD, Hochberg MC, Moskowitz RW, Schnitzer TJ.Рекомендации по медикаментозному лечению остеоартроза тазобедренного и коленного суставов. Обновление 2000 года. Подкомитет ACR по рекомендациям по остеоартриту.
ревматоидный артрит
2000
;43
:1905
–15,2Chambers MG, Bayliss MT, Mason RM. Экспрессия цитокинов хондроцитов и факторов роста при остеоартрите мышей.
Тележка для лечения артроза
1997
;5
:301
–8.3Моос В., Фикерт С., Мюллер Б., Вебер Ю., Сипер Дж.Иммуногистологический анализ экспрессии цитокинов при остеоартрите человека и здоровом хряще.
J Rheumatol
1999
;26
:870
–9,4van Beuningen HM, van der Kraan PM, Arntz OJ, van den Berg WB. Защита от интерлейкина 1 индуцировала разрушение суставного хряща путем трансформации фактора роста бета: исследования на анатомически неповрежденном хряще in vitro и in vivo .
Ann Rheum Dis
1993
;52
:185
–91.5Guenther HL, Guenther HE, Froesch ER, Fleisch H. Влияние инсулиноподобного фактора роста на синтез коллагена и гликозаминогликанов суставными хондроцитами кролика в культуре.
Experientia
1982
;38
:979
–81,6McQuillan DL, Handley CJ, Campbell MA, Bolis S, Milway VE, Herington AC. Стимуляция синтеза протеогликана сывороткой и инсулиноподобным фактором роста-1 в культивируемом суставном хряще крупного рогатого скота.
Biochem J
1986
;240
:423
–30.7Luyten FP, Hascall VC, Nissley SP, Morales TI, Reddi AH. Инсулиноподобные факторы роста поддерживают стабильный метаболизм протеогликанов в эксплантатах суставного хряща крупного рогатого скота.
Arch Biochem Biophys
1988
;267
:416
–25,8Tesch GH, Handley CJ, Cornell HJ, Herington AC. Влияние свободных и связанных инсулиноподобных факторов роста на метаболизм протеогликанов в эксплантатах суставного хряща.
J Orthop Res
1992
;10
:14
–22.9Verbruggen G, Malfait AM, Dewulf M, Broddelez C, Veys EM. Стандартизация питательных сред для изолированных суставных хондроцитов человека в гелеобразной суспензионной культуре агарозы.
Тележка для лечения артроза
1995
;3
:249
–59,10Yaeger PC, Masi TL, de Ortiz JL, Binette F, Tubo R, McPherson JM. Синергетическое действие трансформирующего фактора роста-бета и инсулиноподобного фактора роста-I индуцирует экспрессию генов коллагена и аггрекана типа II в суставных хондроцитах взрослого человека.
Exp Cell Res
1997
;237
:318
–25,11Verschure PJ, van Marle J, Joosten LA, van den Berg WB. Экспрессия хондроцитарного рецептора IGF-1 и реакция на стимуляцию IGF-1 в суставном хряще мыши во время различных фаз экспериментально индуцированного артрита.
Ann Rheum Dis
1995
;54
:645
–53,12Саклатвала Дж., Пилсворт ЛМК, Сарсфилд С.Дж., Гравилович Дж., Хит Дж. К.. Катаболин свиньи — это форма интерлейкина 1.
Biochem J
1984
;224
:461
–6,13Дингл Дж. Т., Саклатвала Дж., Хембри Р., Тайлер Дж., Фелл Х. Б., Джубб Р. Катаболический фактор хряща из синовиальной оболочки.
Biochem J
1979
;184
:177
–80,14Dingle JT. Влияние синовиального катаболина на синтетическую активность хряща.
Connect Tiss Res
1984
;12
:277
–86,15Тайлер Дж. А., Саклатвала Дж.Свиной ИЛ-1 (катаболин) вызывает резорбцию протеогликана хряща и предотвращает синтез протеогликана и коллагена.
Br J Rheumatol
1985
;24 (Дополнение 1)
:150
–5,16Таскиран Д., Стефанович-Рачич М., Георгеску Х.И., Эванс Ч. Оксид азота опосредует подавление синтеза протеогликанов хряща интерлейкином-1.
Biochem Biophys Res Commun
1994
;200
:142
–8,17Берд Т.А., Саклатвала Дж.Идентификация общего класса рецепторов с высоким сродством для обоих типов интерлейлина-1 на клетках соединительной ткани.
Nature
1986
;324
:263
–6,18Чандрасекхар С., Харви А.К. Индукция рецепторов интерлейкина-1 на хондроцитах фактором роста фибробластов: возможный механизм модуляции активности интерлейкина-1.
J Cell Physiol
1989
;138
:236
–46,19Colotta F, Re F, Muzio M et al .Рецептор интерлейкина-1 типа II: мишень-приманка для IL-1, которая регулируется IL-4.
Наука
1993
;261
:472
–5.20Аттур М.Г., Дэйв М., Чиполлетта С. и др. . Обращение аутокринных и паракринных эффектов интерлейкина 1 (ИЛ-1) при артрите человека с помощью рецептора-ловушки ИЛ-1 типа II. Возможность фармакологического вмешательства.
J Biol Chem
2000
;275
:40307
–1521Wang J, Elewaut D, Veys EM, Verbruggen G.Индуцированный инсулиноподобным фактором роста 1 рецептор интерлейкина-1 II подавляет активность интерлейкина-1 и контролирует гомеостаз внеклеточного матрикса хряща.
Arthritis Rheum
2003
;48
:1281
–91,22Тайлер Дж. А.. Инсулиноподобный фактор роста 1 может уменьшать деградацию и способствовать синтезу протеогликана в хряще, подвергающемся действию цитокинов.
Biochem J
1989
;260
:543
–8.23Миддлтон Дж. Ф., Тайлер Дж. А. Повышение экспрессии гена инсулиноподобного фактора роста I в поражениях суставного хряща человека при остеоартрите.
Ann Rheum Dis
1992
;51
:440
–7,24Миддлтон Дж., Манти А., Тайлер Дж. Рецептор инсулиноподобного фактора роста (ИФР), ИФР-I, интерлейкин-1 бета (ИЛ-1 бета) и экспрессия мРНК ИЛ-6 при остеоартрите и нормальном хряще человека.
J Histochem Cytochem
1996
;44
:133
–41.25Verschure PJ, Marle JV, Joosten LA, Helsen MM, Lafeber FP, Berg WB. Локализация рецептора инсулиноподобного фактора роста-1 в нормальном и остеоартрозном хрящах человека в отношении синтеза и содержания протеогликана.
Br J Rheumatol
1996
;35
:1044
–55.26Ван Дж., Вердонк П., Элевот Д., Вейс Е.М., Вербрюгген Г. Гомеостаз внеклеточного матрикса нормальных и остеоартрозных хондроцитов суставного хряща человека in vitro.
Тележка для лечения артроза
2003
;11
:801
–9.27Шлопов Б.В., Гумановская М.Л., Поспешный К.А. Аутокринная регуляция коллагеназы 3 (матриксная металлопротеиназа 13) при остеоартрите.
ревматоидный артрит
2000
;43
:195
–205.28Pelletier JP, Martel-Pelletier J, Howell DS, Ghandur-Mnaymneh L, Enis JE, Woessner JF Jr. Коллагеназа и коллагенолитическая активность в остеоартритическом хряще человека.
Arthritis Rheum
1983
;26
:63
–8.29Okada Y, Shinmei M, Tanaka O et al .Локализация матричной металлопротеиназы 3 (стромелизина) в остеоартрозном хряще и синовиальной оболочке.
Lab Invest
1992
;66
:680
–90,30Arner EC, Tortorella MD. Передача сигнала через рецепторы интегрина хондроцитов индуцирует синтез матриксной металлопротеиназы и действует синергично с интерлейкином-1.
Arthritis Rheum
1995
;38
:1304
–14,31Orlando S, Sironi M, Bianchi G et al .Роль металлопротеаз в высвобождении рецептора-ловушки IL-1 типа II.
J Biol Chem
1997
;272
:31764
–9,32Penton-Rol G, Orlando S, Polentarutti N et al . Бактериальный липополисахарид вызывает быстрое отщепление с последующим ингибированием экспрессии мРНК рецептора IL-1 типа II с одновременной активацией рецептора типа I и индукцией не полностью сплайсированных транскриптов.
J Immunol
1999
;162
:2931
–8.33Д’Лима Д.Д., Хашимото С., Чен П.С., Колвелл С.В. мл., Лотц М.К. Апоптоз хондроцитов человека в ответ на механическое повреждение.
Тележка для лечения артроза
2001
;9
:712
–9,34Редман С.Н., Даутуэйт Г.П., Томсон Б.М., Арчер CW. Клеточные реакции суставного хряща на резкую и тупую травму.
Тележка для лечения артроза
2004
;12
:106
–16.35Айзава Т., Кон Т., Эйнхорн Т.А., Герстенфельд LC.Индукция апоптоза хондроцитов фактором некроза опухоли-α.
J Orthop Res
2001
;19
:785
–96,36Islam N, Haqqi TM, Jepsen KJ et al . Гидростатическое давление вызывает апоптоз хондроцитов человека из остеоартрозного хряща за счет усиления фактора некроза опухоли-α, индуцибельной синтазы оксида азота, p53, c-myc и bax-alpha, а также подавления bcl-2.
J Cell Biochem
2002
;87
:266
–78.37Моос В., Фикерт С., Мюллер Б., Вебер Ю., Сипер Дж. Иммуногистологический анализ экспрессии цитокинов в человеческом остеоартрите и здоровом хряще.
J Rheumatol
1999
;26
:870
–9.38Verdier MP, Seite S, Guntzer K, Pujol JP, Boumediene K. Иммуногистохимический анализ бета-изоформ трансформирующего фактора роста и их рецепторов в хряще человека из нормальных и остеоартрозных головок бедренной кости.
Rheumatol Int
2005
;25
:118
–24.39Четина Е.В., Сквайрс Дж., Пул А.Р. Усиленная деградация коллагена II типа и очень ранняя очаговая дегенерация хряща связаны с активацией генов, связанных с дифференцировкой хондроцитов, в ранних поражениях суставного хряща человека.
J Ревматол
2005
;32
:876
–86,40Харви А.К., Хрубей П.С., Чандрасекхар С. Ингибирование активности интерлейкина-1 трансформирующим фактором роста бета включает подавление рецепторов интерлейкина-1 на хондроцитах.
Exp Cell Res
1991
;195
:376
–85,41Эйлау О. Внутрисуставная гепаринотерапия истинного деформирующего артроза коленного сустава.
Мед Клин
1959
;54
:145
.42Эйлау О. О патогенезе и причинном лечении артроза коленного сустава.
Мед Клин
1960
;55
:2367
–70,43Momburg M, Stuhlsatz HW, Vogeli H, Vojtisek O, Eylau O, Greiling H.Клинические химические изменения в синовиальной жидкости после внутрисуставной инъекции полисульфата гликозаминогликана.
Z Rheumatol
1976
;35 (Приложение 4)
:389
–90,44Нево З., Хорвиц А.Л., Дорфман А. Синтез хондромукопротеина хондроцитами в суспензионной культуре.
Дев Биол
1972
;28
:219
–28.45Нево З., Дорфман А. Стимуляция синтеза хондромукопротеинов в хондроцитах внеклеточным хондромукопротеином.
Proc Natl Acad Sci USA
1972
;69
:2069
–72,46Kosher RA, Lash JW, Minor RR. Экологическое усиление хондрогенеза in vitro.
Дев Биол
1973
;35
:210
–20,47Шварц Н.Б., Дорфман А. Стимуляция продукции хондроитинсульфат-протеогликана хондроцитами в монослое.
Conn Tiss Res
1975
;3
:115
–22,48Verbruggen G, Veys EM.Влияние сульфатированных гликозаминогликанов на метаболизм протеогликанов в клетках синовиальной оболочки.
Acta Rheumatol
1977
;1
:75
–92,49Verbruggen G, Veys EM. Влияние гиперсульфатированного гепариноида на метаболизм гиалуроната синовиальной клетки человека in vivo .
J Rheumatol
1979
;6
:554
–61,50Kalbhen DA. Экспериментальное подтверждение противоартритной активности полисульфата гликозаминогликана.
Z Rheumatol
1983
;42
:178
–84,51Carreno MR, Muniz OE, Howell DS. Эффект гликозаминогликана сложного эфира полисерной кислоты на суставной хрящ при экспериментальном остеоартрите: влияние на морфологические переменные тяжести заболевания.
J Rheumatol
1986
;13
:490
–7,52Бреннан Дж. Дж., Ахерн FX, Накано Т. Влияние лечения полисульфатом гликозаминогликана на прочность, содержание гиалуроновой кислоты в синовиальной жидкости и протеогликановый агрегат в суставном хряще хромого хряка.
Can J Vet Res
1987
;51
:394
–8,53Убельхарт Д., Тонар Э. Дж., Чжан Дж., Уильямс Дж. М.. Защитный эффект экзогенного хондроитин-4,6-сульфата при острой деградации суставного хряща у кролика.
Тележка для лечения артроза
1998
;6 (Дополнение A)
:6
–13,54Verbruggen G, Goemaere S, Veys EM. Хондроитинсульфат: S / DMOAD (лекарственное средство против остеоартрита, изменяющее структуру / заболевание) при лечении остеоартрита суставов пальцев.
Тележка для лечения артроза
1998
;6 (Дополнение A)
:37
–8,55Verbruggen G, Goemaere S, Veys EM. Системы для оценки прогрессирования остеоартрита суставов пальцев и эффектов лекарств, влияющих на лечение остеоартрита.
Clin Rheumatol
2002
;21
:231
–43,56Убельхарт Д., Тонар Э. Дж., Дельмас П. Д., Шантрейн А., Виньон Э. Влияние перорального хондроитинсульфата на прогрессирование остеоартрита коленного сустава: пилотное исследование.
Тележка для лечения артроза
1998
;6 (Дополнение A)
:39
–46,57Убельхарт Д., Малез М., Марколонго Р. и др. . Прерывистое лечение остеоартроза коленного сустава пероральным хондроитинсульфатом: однолетнее рандомизированное двойное слепое многоцентровое исследование по сравнению с плацебо.
Тележка для лечения артроза
2004
;12
:269
–76,58Michel BA, Stucki G, Frey D et al . Хондроитины 4 и 6 сульфат при остеоартрозе коленного сустава: рандомизированное контролируемое исследование.
Arthritis Rheum
2005
;52
:779
–86,59Verbruggen G, Veys EM. Внутрисуставная инъекция пентозанполисульфата приводит к увеличению молекулярной массы гиалуронана в суставной жидкости.
Clin Exp Rheumatol
1992
;10
:249
–54,60Francis DJ, Hutadilok N, Kongtawelert P, Ghosh P. Полисульфат пентозана и полисульфат гликозаминогликана стимулируют синтез гиалуронана in vivo .
Rheumatol Int
1993
;13
:61
–4,61Verbruggen G, Cornelissen M, Elewaut D, Broddelez C, De Ridder L., Veys EM. Влияние полисульфатированных полисахаридов на аггреканы, синтезируемые дифференцированными суставными хондроцитами человека.
J Rheumatol
1999
;26
:1663
–71,62Sadowski T., Steinmeyer J. Влияние полисульфатированного гликозаминогликана и триамцинолона ацетонида на продукцию протеиназ и их ингибиторов обработанными IL-1alpha суставными хондроцитами.
Biochem Pharmacol
2002
;64
:217
–27.63Ван Л., Ван Дж., Альмквист К.Ф., Вейс Е.М., Вербругген Г. Влияние полисульфатированных полисахаридов и гидрокортизона на метаболизм внеклеточного матрикса суставных хондроцитов человека in vitro.
Clin Exp Rheumatol
2002
;20
:669
–76,64Tung JT, Venta PJ, Caron JP. Индуцируемая экспрессия оксида азота в суставных хондроцитах лошади: эффекты противовоспалительных соединений.
Тележка для лечения артроза
2002
;10
:5
–12,65Verdonk P, Wang J, Elewaut D, Broddelez C, Veys EM, Verbruggen G. Полисульфаты циклодекстрина усиливают восстановление внеклеточного матрикса хондроцитов человека.
Тележка для лечения артроза
2005
;13
:887
–95.66Muller W., Panse P, Brand S, Staubli A. Исследование in vivo распределения, сродства к хрящам и метаболизма полисульфата гликозаминогликана (GAGPS, Arteparon).
Z Rheumatol
1983
;42
:355
–61.67Volpi N. Пероральное всасывание и биодоступность хондроитинсульфата ихтикового происхождения у здоровых добровольцев мужского пола.
Тележка для лечения артроза
2003
;11
:433
–41.68Volpi N. Биодоступность хондроитинсульфата (Кондросульф) и его компонентов при пероральном введении у здоровых добровольцев мужского пола.
Тележка для лечения артроза
2002
;10
:768
–77.69Хенротин Ю.Е., Санчес С., Деберг М.А. и др. . Неомыляемые вещества авокадо / соевые бобы увеличивают синтез аггрекана и снижают выработку катаболических и провоспалительных медиаторов хондроцитами человека при остеоартрите.
J Ревматол
2003
;30
:1825
–34,70Kut-Lasserre C, Miller CC, Ejeil AL et al . Влияние неомыляемых веществ авокадо и сои на желатиназу A (MMP-2), стромелизин 1 (MMP-3) и тканевые ингибиторы секреции матриксной металлопротеиназы (TIMP-1 и TIMP-2) фибробластами человека в культуре.
J Periodontol
2001
;72
:1685
–94,71Хайял MT, Эль-Газали, Массачусетс. Возможный «хондрозащитный» эффект неомыляемых компонентов авокадо и сои in vivo .
Drugs Exp Clin Res
1998
;24
:41
–50.72Cake MA, Read RA, Guillou B., Ghosh P. Модификация патологии суставного хряща и субхондральной кости в модели остеоартрита менискэктомии у овец неомыляемыми веществами авокадо и сои (ASU).
Тележка для лечения артроза
2000
;8
:404
–11.73Lequesne M, Maheu E, Cadet C, Dreiser RL. Структурное влияние неомыляемых веществ авокадо / сои на потерю суставной щели при остеоартрозе тазобедренного сустава.
Arthritis Rheum
2002
;47
:50
–8,74Yu LP Jr, Smith GN Jr, Hasty KA, Brandt KD. Доксициклин подавляет коллагенолитическую активность экстрактов из хрящей остеоартроза человека и желатиназы типа XI.
J Rheumatol
1991
;18
:1450
–2,75Шлопов Б.В., Смит Г.Н. мл., Коул А.А., Хэсти К.А. Дифференциальные паттерны ответа на доксициклин и трансформирующий фактор роста бета1 при подавлении коллагеназ в остеоартрите и нормальных хондроцитах человека.
Arthritis Rheum
1999
;42
:719
–27,76Шлопов Б.В., Стюарт Ю.М., Гумановская М.Л., Хасты К.А. Регулирование коллагеназы хряща доксициклином.
J Ревматол
2001
;28
:835
–42,77Borderie D, Hernvann A, Hilliquin P, Lemarchal H, Kahan A, Ekindjian OG. Тетрациклины подавляют выработку нитрозотиола цитокин-стимулированными синовиальными клетками остеоартрита.
Inflamm Res
2001
;50
:409
–14,78Amin AR, Attur MG, Thakker GD et al . Новый механизм действия тетрациклинов: эффекты на синтазы оксида азота.
Proc Natl Acad Sci USA
1996
;93
:14014
–9,79Smith GN Jr, Yu LP Jr, Brandt KD, Capello WN. Пероральный прием доксициклина снижает активность коллагеназы и желатиназы в экстрактах остеоартрозного хряща человека.
J Rheumatol
1998
;25
:532
–5,80Jauernig S, Schweighauser A, Reist M, Von Rechenberg B., Schawalder P, Spreng D. Влияние доксициклина на выработку оксида азота и стромелизина у собак с разрывом черепной крестообразной связки.
Вет Сург
2001
;30
:132
–9,81de Bri E, Lei W., Svensson O, Chowdhury M, Moak SA, Greenwald RA. Влияние ингибитора матриксных металлопротеиназ на спонтанный остеоартрит у морских свинок.
Adv Dent Res
1998
;12
:82
–5,82Ю Л.П. младший, Смит Г.Н. мл., Брандт К.Д., Майерс С.Л., О’Коннор Б.Л., Брандт Д.А. Уменьшение тяжести остеоартроза собак путем профилактического лечения пероральным доксициклином.
Arthritis Rheum
1992
;35
:1150
–9,83Brandt KD, Mazzuca SA, Katz BP et al . Влияние доксициклина на прогрессирование остеоартрита: результаты рандомизированного плацебо-контролируемого двойного слепого исследования.
Arthritis Rheum
2005
;52
:2015
–25,84Franchi-Micheli S, Lavacchi L, Friedmann CA, Ziletti L. Влияние реина на простагландиноподобные вещества in vitro .
J Pharm Pharmacol
1983
;35
:262
–4,85Pomarelli P, Berti M, Gatti MT, Mosconi P. Нестероидный противовоспалительный препарат, который стимулирует высвобождение простагландинов.
Farmaco Ed Sci
1980
;35
:836
–42,86Pelletier JP, Mineau F, Fernandes JC, Duval N, Martel-Pelletier J. Диацерхеин и реин снижают уровень и активность индуцибельного синтеза оксида азота, стимулированные интерлейкином 1beta, одновременно стимулируя синтез циклооксигеназы-2 у человека. остеоартрозные хондроциты.
J Rheumatol
1998
;25
:2417
–24,87Тамура Т., Омори К. Диацереин подавляет увеличение оксида азота в плазме при артрите, индуцированном адъювантом у крыс.
евро J Pharmacol
2001
;419
:269
–74,88Attur MG, Patel RN, Patel PD, Abramson SB, Amin AR. Тетрациклин усиливает экспрессию ЦОГ-2 и продукцию простагландина E 2 независимо от его воздействия на оксид азота.
J Immunol
1999
;162
:3160
–7.89Патель Р.Н., Аттур М.Г., Дэйв М.Н. и др. . Новый механизм действия химически модифицированных тетрациклинов: ингибирование производства простагландина E2, опосредованного ЦОГ-2.
Иммунология
1999
;163
:3459
–67,90Ярон М., Ширази И., Ярон И. Анти-интерлейкин-1 эффекты диацереина и реина в синовиальной ткани и культурах хрящей человека при остеоартрите.
Тележка для лечения артроза
1999
;7
:272
–80.91Martel-Pelletier J, Mineau F, Jolicoeur FC, Cloutier JM, Pelletier JP. In vitro эффекты диацереина и реина на системы интерлейкина 1 и фактора некроза опухоли альфа в синовиальной оболочке и хондроцитах человека при остеоартрите.
J Rheumatol
1998
;25
:753
–62.92Moldovan F, Pelletier JP, Jolicoeur FC, Cloutier JM, Martel-Pelletier J. Diacerhein и rhein снижают индуцированную ICE активацию IL-1beta и IL-18 в остеоартритическом хряще человека.
Тележка для лечения артроза
2000
;8
:186
–96.93Мендес А.Ф., Карамона М.М., де Карвалью А.О., Лопес М.С. Диацереин и реин предотвращают индуцированную интерлейкином-1бета активацию ядерного фактора каппаВ, ингибируя деградацию ингибитора каппаВ-альфа.
Pharmacol Toxicol
2002
;91
:22
–8.94Дозин Б., Мальпели М., Камарделла Л., Канседда Р., Пьетранджело А. Реакция суставных хондроцитов человека молодого, пожилого и остеоартритического возраста на воспалительные цитокины: молекулярные и клеточные аспекты.
Матрикс Биол
2002
;21
:449
–59,95Boittin N, Redini F, Loyau G, Pujol JP. Влияние диацереина (ART 50) на синтез матрикса и секрецию коллагеназы культивированными хондроцитами суставов кроликов.
Rev Rhum
1993
;60
:68S
–76S.96Tamura T., Kosaka N, Ishiwa J, Sato T, Nagase H, Ito A. Rhein, активный метаболит диацереина, подавляет продукцию проматричных металлопротеиназ-1 , -3, -9 и -13 и повышают продукцию тканевого ингибитора металлопротеиназы-1 в культивируемых суставных хондроцитах кролика.
Тележка для лечения артроза
2001
;9
:257
–63.97Тамура Т., Омори К. Рейн, активный метаболит диацереина, подавляет индуцированную интерлейкином-1альфа деградацию протеогликана в культивируемых суставных хондроцитах кролика.
Jpn J Pharmacol
2001
;85
:101
–4,98Фелисаз Н., Бумедьен К., Гайор С. и др. . Стимулирующее действие диацереина на экспрессию TGF-beta1 и beta2 в суставных хондроцитах, культивируемых с интерлейкином-1 и без него.
Тележка для лечения артроза
1999
;7
:255
–64,99Mazieres B, Berdah L, Thiechart M, Viguier G. Diacetylrhein на постконтузионной модели экспериментального остеоартрита у кролика.
Rev Rhum
1993
;60
:77S
–81S.100Тамура Т., Омори К., Накамура К. Влияние диацереина на спонтанный полиартрит у самцов новозеландских черных мышей / KN.
Тележка для лечения артроза
1999
;7
:533
–8.101Карни SL. Влияние диацетилреина на развитие экспериментального остеоартроза. Биохимическое исследование.
Тележка для лечения артроза
1996
;4
:251
–61.102Брандт К.Д., Смит Г., Канг С.И., Майерс С., О’Коннор Б., Альбрехт Н. Эффекты диацереина в ускоренной модели остеоартрита у собак.
Тележка для лечения артроза
1997
;5
:438
–49.103Smith GN Jr, Myers SL, Brandt KD, Mickler EA, Albrecht ME.Лечение диацереином снижает тяжесть остеоартрита на модели остеоартрита с дефицитом крестообразных связок у собак.
Arthritis Rheum
1999
;42
:545
–54.104Дугадос М., Нгуен М., Бердах Л., Мазьер Б., Лекесн М.; Исследовательская группа ECHODIAH. Оценка структурно-модифицирующих эффектов диацереина при остеоартрите тазобедренного сустава: ECHODIAH, трехлетнее плацебо-контролируемое исследование. Оценка хондромодулирующего эффекта диацереина при ОА бедра.
Arthritis Rheum
2001
;44
:2539
–47.105Pham T, Le Henanff A, Ravaud P, Dieppe P, Paolozzi L, Dougados M. Оценка симптоматической и структурной эффективности нового соединения гиалуроновой кислоты, NRD101, по сравнению с диацереином и плацебо в 1-летнем рандомизированном контролируемом исследовании симптоматического остеоартрита коленного сустава.
Ann Rheum Dis
2004
;63
:1611
–7.106Gouze JN, Bianchi A, Becuwe P et al .Глюкозамин модулирует индуцированную IL-1 активацию хондроцитов крысы на уровне рецепторов и путем ингибирования пути NF-каппа B.
FEBS Lett
2002
;510
:166
–70.107Shikhman AR, Kuhn K, Alaaeddine N, Lotz M. N-ацетилглюкозамин предотвращает опосредованную IL-1 бета активацию хондроцитов человека.
J Immunol
2001
;166
:5155
–60.108Largo R, Alvarez-Soria MA, Diez-Ortego I et al .Глюкозамин ингибирует индуцированную IL-1beta активацию NFkappaB в хондроцитах человека, страдающих остеоартритом.
Тележка для лечения артроза
2003
;11
:290
–8.109Piperno M, Reboul P, Hellio Le Graverand MP et al . Сульфат глюкозамина модулирует дисрегулируемую активность хондроцитов остеоартрита человека in vitro .
Тележка для лечения артроза
2000
;8
:207
–12.110Накамура Х., Шибакава А., Танака М., Като Т., Нисиока К.Влияние гидрохлорида глюкозамина на продукцию простагландина E2, оксида азота и металлопротеаз хондроцитами и синовиоцитами при остеоартрите.
Clin Exp Rheumatol
2004
;22
:293
–9.111Gouze JN, Bordji K, Gulberti S et al . Интерлейкин-1бета подавляет экспрессию глюкуронозилтрансферазы I, ключевого фермента, запускающего биосинтез гликозаминогликанов: влияние глюкозамина на опосредованные интерлейкином-1бета эффекты в хондроцитах крыс.
Arthritis Rheum
2001
;44
:351
–60.112Fenton JI, Chlebek-Brown KA, Caron JP, Orth MW. Влияние глюкозамина на интерлейкин-1 суставной хрящ.
Equine Vet J Suppl
2002
;34
:219
–23.113Fenton JI, Chlebek-Brown KA, Peters TL, Caron JP, Orth MW. Глюкозамин HCl снижает деградацию суставного хряща лошади в культуре эксплантата.
Тележка для лечения артроза
2000
;8
:258
–65.114Tung JT, Venta PJ, Eberhart SW, Yuzbasiyan-Gurkan V, Alexander L, Caron JP. Влияние препаратов против артрита на экспрессию генов и ферментативную активность циклооксигеназы-2 в культивируемых хондроцитах лошадей.
Am J Vet Res
2002
;63
:1134
–9.115Dodge GR, Jimenez SA. Сульфат глюкозамина регулирует уровни аггрекана и матриксной металлопротеиназы-3, синтезируемые культивированными суставными хондроцитами человека, страдающими остеоартритом.
Тележка для лечения артроза
2003
;11
:424
–32.116Sandy JD, Gamett D, Thompson V, Verscharen C. Опосредованный хондроцитами катаболизм аггрекана: зависимое от агреканазы расщепление, индуцированное интерлейкином-1 или ретиноевой кислотой, может ингибироваться глюкозамином.
Biochem J
1998
;335
:59
–66.117Патвари П., Курц Б., Сэнди Д.Д., Гродзинский А.Дж. Маннозамин подавляет опосредованные агреканазой изменения физических свойств и биохимического состава суставного хряща.
Arch Biochem Biophys
2000
;374
:79
–85.118де Маттей М., Пеллати А., Паселло М. и др. . Высокие дозы глюкозамина-HCl оказывают пагубное воздействие на эксплантаты суставного хряща крупного рогатого скота, культивируемые in vitro .
Тележка для лечения артроза
2002
;10
:816
–25.119Tiraloche G, Girard C, Chouinard L et al . Влияние перорального глюкозамина на деградацию хряща на кроличьей модели остеоартрита.
Arthritis Rheum
2005
;52
:1118
–28.120Шихман А.Р., Амиэль Д., Д’Лима Д. и др. . Хондропротекторная активность N-ацетилглюкозамина у кроликов с экспериментальным остеоартрозом.
Ann Rheum Dis
2005
;64
:89
–94.121Reginster JY, Deroisy R, Rovati LC et al . Долгосрочные эффекты сульфата глюкозамина на прогрессирование остеоартрита: рандомизированное плацебо-контролируемое клиническое исследование.
Ланцет
2001
;357
:251
–6.122Pavelka K, Gatterova J, Olejarova M, Machacek S, Giacovelli G, Rovati LC. Использование сульфата глюкозамина и замедление прогрессирования остеоартрита коленного сустава: трехлетнее рандомизированное плацебо-контролируемое двойное слепое исследование.
Arch Intern Med
2002
;162
:2113
–23.123Knudsen PJ, Dinarello CA, Strom TB. Глюкокортикоиды подавляют транскрипционную и посттранскрипционную экспрессию интерлейкина 1 в клетках U937.
J Immunol
1987
;139
:4129
–34.124Ли С.В., Цоу А.П., Чан Х. и др. . Глюкокортикоиды избирательно подавляют транскрипцию гена интерлейкина 1 бета и снижают стабильность мРНК интерлейкина 1 бета.
Proc Natl Acad Sci USA
1988
;85
:1204
–8.125Pelletier JP, Cloutier JM, Martel-Pelletier J. Эффекты in vitro тиапрофеновой кислоты, салицилата натрия и гидрокортизона на метаболизм протеогликанов остеоартрозного хряща человека.
J Rheumatol
1989
;16
:646
–55,126Hill DJ. Влияние кортизола на пролиферацию клеток, синтез и деградацию протеогликанов в хрящевых зонах реберно-хрящевой пластины роста теленка in vitro с активностью соматомедина плазмы крысы и без нее.
J Endocrinol
1981
;88
:425
–35,127Такигава М., Такано Т., Накагава К., Сакуда М., Судзуки Ф. Стимуляция пролиферации и синтеза гликозаминогликанов в черепно-лицевых хондроцитах кролика in vitro .
Arch Oral Biol
1988
;33
:893
–9.128Макгуайр М.Б., Мерфи М., Рейнольдс Дж. Дж., Рассел РГГ. Производство коллагеназы и ингибитора (ТИМП) нормальной, ревматоидной и остеоартритической синовиальной оболочкой in vitro : эффекты гидрокортизона и индометацина.
Clin Biol
1981
;61
:703
–10.129Пеллетье Дж. П., Мартель-Пеллетье Дж. Разрушение хряща нейтральными протеогликаназами при экспериментальном остеоартрите.
Подавление стероидами. Arthritis Rheum
1985
;28
:1393
–401.130Martel-Pelletier J, Cloutier JM, Pelletier JP. Нейтральные протеазы синовиальной оболочки при остеоартрите человека.
Arthritis Rheum
1986
;29
:1112
–21.131Pelletier JP, Martel-Pelletier J, Cloutier JM, Woessner JF Jr. Активность кислой металлопротеиназы, разрушающей протеогликаны, в хрящах остеоартрита человека и эффекты внутрисуставных инъекций стероидов.
Arthritis Rheum
1987
;30
:541
–8.132Pelletier JP, Mineau F, Raynauld JP, Woessner JF, Gunja-Smith Z, Martel-Pelletier J. Внутрисуставные инъекции метилпреднизолона ацетата уменьшают остеоартритические поражения параллельно с синтезом хондроцитов при экспериментальном строметезинозном синдроме.
Arthritis Rheum
1994
;37
:414
–23.133Itagane Y, Inada H, Fujita K, Isshiki G.Взаимодействие между стероидными гормонами и инсулиноподобным фактором роста-I в хондроцитах кролика.
Эндокринология
1991
;128
:1419
–24.134Ван дер Краан П.М., Виттерс Е.Л., Постма Н.С., Вербунт Дж., Ван ден Берг В.Б. Поддержание синтеза крупных протеогликанов в анатомически неповрежденном суставном хряще мыши с помощью стероидов и инсулиноподобного фактора роста I.
Ann Rheum Dis
1993
;52
:734
–41.135Van Osch GJ, van der Veen SW, Verwoerd-Verhoef HL. In vitro. повторная дифференцировка выращенных в культуре кроличьих и человеческих аурикулярных хондроцитов для реконструкции хряща.
Пласт Реконстр Сург
2001
;107
:433
–40,136Коломбо С., Батлер М., Хикман Л., Селвин М., Диаграмма J, Стейнец Б. Новая модель остеоартрита у кроликов. II. Оценка антиостеоартритных эффектов выбранных противоревматических препаратов, применяемых системно.
Arthritis Rheum
1983
;26
:1132
–9.137Батлер М., Коломбо К., Хикман Л. и др. . Новая модель остеоартроза у кроликов. III. Оценка антиостеоартрозных эффектов отдельных препаратов, вводимых внутрисуставно.
Arthritis Rheum
1983
;26
:1380
–6.138Williams JM, Brandt KD. Гексацетонид триамцинолона защищает от фибрилляции и образования остеофитов после химически индуцированного повреждения суставного хряща.
Arthritis Rheum
1985
;28
:1267
–74.139Пеллетье Дж. П., Мартель-Пеллетье Дж. Защитные эффекты кортикостероидов на повреждения хряща и образование остеофитов в модели остеоартрита у собак Понд-Нуки.
Arthritis Rheum
1989
;32
:181
–93.140Ван Дж., Элеваут Д., Хоффман И., Вейс Е.М., Вербругген Г. Физиологические уровни гидрокортизона поддерживают оптимальный метаболизм внеклеточного матрикса хондроцитов.
Ann Rheum Dis
2004
;63
:61
–6.141Бреннан Ф.М., Чантри Д., Джексон А., Майни Р., Фельдманн М. Ингибирующее действие антител ФНО-альфа на выработку интерлейкина-1 синовиальными клетками при ревматоидном артрите.
Ланцет
1989
;2
:244
–7.142Lipsky PE, van der Heijde DM, St Clair EW et al . Инфликсимаб и метотрексат в лечении ревматоидного артрита.
Исследовательская группа по исследованию противоопухолевого фактора некроза при ревматоидном артрите с сопутствующей терапией.N Engl J Med
2000
;343
:1594
–602.143Смолен Дж. С., Хан С., Бала М. и др. .; Исследовательская группа ATTRACT. Доказательства радиографической пользы лечения инфликсимабом плюс метотрексат у пациентов с ревматоидным артритом, у которых не было клинического улучшения: подробный субанализ данных исследования противоопухолевого фактора некроза при ревматоидном артрите с исследованием сопутствующей терапии.
Arthritis Rheum
2005
;52
:1020
–30.144Круитхоф Э., Ван ден Бош Ф., Баетен Д. и др. . Повторные инфузии инфликсимаба, химерного моноклонального антитела против TNFalpha, пациентам с активной спондилоартропатией: наблюдение в течение одного года.
Ann Rheum Dis
2002
;61
:207
–12.145Verbruggen G, Veys EM. Системы числовой оценки анатомической эволюции остеоартроза суставов пальцев.
Arthritis Rheum
1996
;39
:308
–20.© Автор 2005. Опубликовано Oxford University Press от имени Британского общества ревматологов. Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected]
.News — Эвалар
Когда мы интенсивно тренируемся в фитнес-клубах, наши суставы подвергаются чрезмерной нагрузке и нуждаются в надежной защите. Что бы вы дали, чтобы боль1 и воспаление1 не мешали тренировкам, а суставы получали необходимые ресурсы для естественного обновления и свободы движений? Специально для вас мы создали улучшенную * формулу SportExpert Glucosamine Chondroitin MSM ** — хондропротектор с наиболее мощным * и эффективным * сочетанием трех основных компонентов для здоровья суставов в максимальных * суточных дозах: 1500 мг глюкозамина, 1200 мг хондроитина. сульфат и 1200 мг МСМ.Три лучших * хондропротектора в одном продукте и даже больше * по стоимости — 180 капсул в баночке! О компонентах
Глюкозамин играет важную роль в образовании новых хрящей, связок, сухожилий и суставной жидкости, помогает подавлять выработку воспалительных факторов, защищать хрящевые клетки и синтезировать коллаген.
Сульфат хондроитина синтезируется из глюкозамина и помогает стимулировать клетки, вырабатывающие вещества для обновления хряща, синтеза гиалуроновой кислоты, подавляя активность ферментов, повреждающих хрящи, улучшая микроциркуляцию в суставе.
МСМ (метилсульфонилметан) — источник биодоступной серы, необходимой для синтеза белков, из которых состоят все соединительные ткани. МСМ обладает противовоспалительными и обезболивающими свойствами и помогает ускорить восстановление суставов после тренировки.
SportExpert Глюкозамин Хондроитин МСМ ** способствует: 2
- обезболивающее
- Улучшение подвижности суставов
- естественная регенерация соединительной ткани
- Восстановление суставов и мышц после тренировок
- Профилактика травм суставно-связочного аппарата
Новинку и другие товары нашей профессиональной спортивной линейки SportExpert3 можно приобрести в любой аптеке сети брендов Эвалар, на аптеке.ru, в других аптеках страны. Они также доступны онлайн на торговой площадке Эвалар Фитомаркет.
—
* В линейке SportExpert компании Evalar.
** SportExpert глюкозамин, хондроитин, МСМ.
1 Которые не являются симптомами болезней.
2 Подтверждено СГР (Свидетельство о государственной регистрации) KZ.16.01.98.003.R.000836.11.20 от 11.11.2020.
3 SportExpert.
Сообщение о хондропротекторах и остеоартрите
Остеоартроз — это модное слово в консультациях травматологов.Перед лицом любой боли в суставах всегда найдется кто-нибудь, кто скажет вам «это остеоартрит» . Они идут на консультацию и говорят: « у моей мамы остеоартрит, так что и у меня он будет». И есть даже пациенты, которые обращаются ко мне напрямую », что такое остеоартрит? Акулий хрящ хорош? Я беру в аптеке порошки … Коллаген. Это хорошо?» И, безусловно, они правы.
Что это?Остеоартрит — это прогрессирующее и необратимое дегенеративное заболевание, которое может поражать один или несколько суставов. Он характеризуется прогрессирующим поражением суставного хряща, но также вовлекаются другие структуры сустава, такие как синовиальная оболочка, суставная капсула или субхондральная кость.
Слегка вычеркнув эти термины, чтобы было понятнее: тот факт, что он прогрессивный и необратимый… говорит сам за себя. Учтите, что это не карьера, но, к счастью, за исключением случаев очень быстрого прогрессирования, от первых симптомов до необходимости имплантации протеза проходят многие годы. Это открывает окно, чтобы попытаться замедлить его развитие.Это правда, что болезнь не всегда прогрессирует с одинаковой скоростью, и хотя бывают случаи, когда протез необходимо поставить в течение пяти лет, есть также пациенты, которые испытывают терпимую боль на протяжении всей своей жизни и не нуждаются в хирургическом вмешательстве.
Как это сказывается?Остеоартрит — это БОЛЬ и ФУНКЦИОНАЛЬНЫЕ ОГРАНИЧЕНИЯ, снижающие качество вашей жизни , потому что если у вас болит колено и вы не можете подняться по лестнице, ваша самая большая иллюзия — это прогуляться с партнером или поиграть в игру, а вы не можете ….ты несчастлив.
Вот почему люди обращаются в больницу, потому что они не могут вести нормальную жизнь. Здесь на помощь приходит медицина. Наша цель будет заключаться в том, чтобы облегчить боль, восстановить подвижность и, если мы сможем, попытаться замедлить свою профессию.
Почему у нас остеоартроз?Существует вторичный тип остеоартрита, причина которого четко определяется: перелом, спортивные соревнования с повторяющимся стрессом, дисплазии и другие заболевания. Но в большинстве случаев, как и во многих других, мы не знаем причины.
Мы точно знаем, что происходит при остеоартрите, и это хорошее начало для действий. Мы знаем, что суставной хрящ, покрывающий кости, поражается таким образом, что он изнашивается до тех пор, пока они не обнажатся. Это то, что болит, сам хрящ — нет, так как в нем отсутствуют болевые рецепторы. Кроме того, синовиальная оболочка, покрывающая сустав, воспаляется вследствие изменения хряща, что вызывает усиление боли.
На этом этапе нам остается действовать.
ЛечениеЕсть два типа пероральных лекарств для лечения остеоартрита:
- анальгетики
- SYSADOA ( Симптоматические препараты замедленного действия для лечения остеоартрита, ).
При приступе острого воспаления для облегчения боли мы сначала прибегаем к обезболиванию: парацетамолу, НПВП (ибупрофен, декскетопрофен…) и второстепенным опиатам (трамадол). Эти препараты действуют быстро и очень эффективны. Проблема возникает, когда приходится длительно принимать обезболивающие.Как мы уже говорили, остеоартроз — прогрессирующее и необратимое заболевание. Эти препараты предотвращают боль, устраняя воспаление, но как только мы перестанем их принимать, боль появится снова. И хотя они очень хороши в острой форме, в долгосрочной перспективе они представляют собой серьезные проблемы: токсичность для печени, токсичность для почек и сердечно-сосудистые проблемы.
Когда это происходит, в игру вступают SYSADOA: хондроитин и глюкозамин. ХОНДРОПРОТЕКТОРЫ .
Хондропротекторы при остеоартрозеСуставной хрящ — это узкоспециализированная ткань, состоящая из 2% клеток (хондроцитов) и 98% внеклеточного матрикса (всего, что окружает клетки и составляет хрящ), где мы находим коллагеновые волокна и соединения, называемые аггреканами, образованными, среди прочего, хондроитином и глюкозамином.
Мы думаем, что если произошло то, что суставной хрящ был разрушен, почему бы не добавить в него его основные компоненты перорально? Таким образом, были проведены исследования, в которых было показано, что эти вещества влияют на метаболизм хондроцитов и могут помочь в лечении остеоартрита. В частности, постулируются следующие механизмы: противовоспалительная активность, стимуляция синтеза протеогликанов и гиалуроновой кислоты и снижение катаболической активности хондроцитов. Говоря немедицинским языком: кажется, что они помогают синтезировать компоненты, составляющие внеклеточный матрикс, а также препятствуют его разрушению. То есть это препараты, которые помогли бы устранить симптомы остеоартрита и даже замедлить его.
Но, как следует из названия, они не действуют немедленно. Эффект начинает проявляться через две-три недели, но с тем преимуществом, что, в отличие от обычных анальгетиков, его эффект сохраняется через 2-3 месяца после лечения.
И ко всему этому есть отличное дополнение … КОНДРОТЕКТОРЫ очень безопасны. На сегодняшний день нет известных побочных реакций или повреждений систем организма (почек, печени, сердечно-сосудистой системы…), что делает их идеальными для длительного употребления, поскольку, как мы уже говорили, остеоартрит прогрессирует.
Есть исследования, которые показывают, что прием этих CHONDROPROTECTORS слегка-умеренно, но значительно снижает боль и, следовательно, функциональные ограничения.Есть также исследования, которые утверждают, что он немного, но значительно замедляет прогрессирование остеоартрита. И все это без побочных эффектов, в отличие от долгосрочных НПВП или парацетамола. Вот почему действие перед вспышкой артрита должно начинаться с этих анальгетиков (НПВП или парацетамол индивидуально для каждого пациента) для снятия острой боли и в то же время начинаться с CHONDROPROTECTORS , чтобы они начали действовать и действовать. возможность отменить анальгетики через две недели.
Вкратце…
- Остеоартроз прогрессирует. Мы можем замедлить его прогрессирование, и будут случаи, в которых наблюдается застой в течение длительного времени и не нужно делать ничего другого, но, к сожалению, мы не знаем, как это вылечить. Возможно, наконец-то придется имплантировать протез, но давайте постараемся отложить этот момент с максимально возможным качеством жизни!
- Доза и график лечения всегда определяются врачом для каждого пациента.
- Эффективность CHONDROPROTECTORS во многом зависит от их качества согласно исследованиям, поэтому, насколько это возможно, рекомендуется использовать качественные фармацевтические продукты.
- Короче говоря, КОНДРОПРОТЕКТОРЫ — это еще один инструмент, который нам нужен для улучшения качества нашей жизни в отношении здоровья наших суставов.
BLISScolágeno — наиболее полный и эффективный CHONDROPROTECTOR для ухода за вашими суставами:
БЛИССКОЛАДЖЕНО
Сара Мораис Рубио
Бакалавр медицины и специалист по ортопедической хирургии и травматологии
CV
Bioiberica запускает новое поколение хондропротекторов для собак и c
Bioiberica начала производство и маркетинг инновационной линейки хондропротекторов для собак и кошек с остеоартритом , Condrovet ® Force HA.Это новое поколение продуктов, которые защищают суставы от изнашивания мелких домашних животных, с комбинацией ингредиентов, эксклюзивных для рынка: хондроитинсульфат (чистота 100%), глюкозамин (чистота 99%), гиалуроновая кислота и нативный коллаген типа II.
« После 20 лет работы в секторе домашних животных, уделяя особое внимание здоровью суставов, мы предлагаем развивать наши продукты», — сказал . Альфонсо Веласко , директор Bioiberica Companion Animals.
По оценкам, около 20% собак старше 1 года страдают остеоартритом. Condrovet ® Force HA рекомендуется специально для собак и кошек с остеоартритом и дегенеративными суставными хрящевыми процессами из-за преклонного возраста, высоких физических нагрузок или избыточного веса. Он также подходит после операций на суставах, чтобы обеспечить лучшее выздоровление животных. Эти продукты получили научное одобрение в более чем 150 публикациях и показали, что они уменьшают боль и улучшают подвижность суставов, а также замедляют прогрессирование заболевания.
В частности, хондроитинсульфат (CSBioactive®) стимулирует синтез протеогликанов и других компонентов хрящевого матрикса; глюкозамин гидрохлорид подавляет протеолитические ферменты и другие молекулы, повреждающие хрящ; гиалуроновая кислота (Mobilee®) помогает уменьшить воспаление синовиальной оболочки, улучшая подвижность; а натуральный коллаген II типа (b-2Cool®) позволяет уменьшить разрушение эндогенного коллагена в суставе.





 Обычно оптимальный курс приёма — три-шесть месяцев.
Обычно оптимальный курс приёма — три-шесть месяцев. р-ра для в/м введения 200 мг/мл: 2 мл амп.3, 5, 6, 10 или 12 шт.
р-ра для в/м введения 200 мг/мл: 2 мл амп.3, 5, 6, 10 или 12 шт. 5 г: 4 г пак. 10, 20, 30, 40, 50 или 100 шт., 4 г банки 1 шт.
5 г: 4 г пак. 10, 20, 30, 40, 50 или 100 шт., 4 г банки 1 шт. р-ра д/приема внутрь 1.5 г: пак. 3.95 г 10, 20 или 30 шт.
р-ра д/приема внутрь 1.5 г: пак. 3.95 г 10, 20 или 30 шт. р-ра д/приема внутрь 1500 мг: пак. 20 или 30 шт.
р-ра д/приема внутрь 1500 мг: пак. 20 или 30 шт. 6 шт. в компл. с растворителем
6 шт. в компл. с растворителем д/пригот. р-ра д/в/м введения 200 мг/1 мл: амп. 2 мл 5 шт. в компл. с растворителем амп. 1 мл 5 шт.
д/пригот. р-ра д/в/м введения 200 мг/1 мл: амп. 2 мл 5 шт. в компл. с растворителем амп. 1 мл 5 шт. 2 мл 6 шт. в компл. с растворителем
2 мл 6 шт. в компл. с растворителем
 2 Глюкозамина гидрохлорид, другая форма глюкозамина, считается столь же эффективной, как и сульфатная форма. Он легче усваивается организмом и может приниматься в меньших дозах с такой же эффективностью, как сульфат глюкозамина.
2 Глюкозамина гидрохлорид, другая форма глюкозамина, считается столь же эффективной, как и сульфатная форма. Он легче усваивается организмом и может приниматься в меньших дозах с такой же эффективностью, как сульфат глюкозамина. Ацетаминофен также может быть полезен для облегчения боли в суставах, связанной с остеоартритом. Прием пищевых добавок глюкозамина и хондроитинсульфата может снизить потребность некоторых пациентов в противовоспалительных или обезболивающих, в то время как другие могут продолжать принимать другие лекарства для снятия боли. Однако пациентам, ежедневно принимающим аспирин, следует избегать приема добавок хондроитинсульфата, так как это может способствовать кровотечению.
Ацетаминофен также может быть полезен для облегчения боли в суставах, связанной с остеоартритом. Прием пищевых добавок глюкозамина и хондроитинсульфата может снизить потребность некоторых пациентов в противовоспалительных или обезболивающих, в то время как другие могут продолжать принимать другие лекарства для снятия боли. Однако пациентам, ежедневно принимающим аспирин, следует избегать приема добавок хондроитинсульфата, так как это может способствовать кровотечению. Еще одна щадящая форма упражнений — это использование эллиптического тренажера или велотренажера, которые обеспечивают формы аэробных упражнений с низким воздействием на суставы.
Еще одна щадящая форма упражнений — это использование эллиптического тренажера или велотренажера, которые обеспечивают формы аэробных упражнений с низким воздействием на суставы. Клиники ревматических заболеваний Северной Америки.1999: 379-395.
Клиники ревматических заболеваний Северной Америки.1999: 379-395.