Определение C-реактивного белка при внебольничной пневмонии на фоне хронической сердечной недостаточности как критерий назначения антибактериальной терапии | Бобылев
1. Gau J-T, Acharya U, Khan S, Heh V, Mody L, Kao T-C. Pharmacotherapy and the risk for community-acquired pneumonia. BMC Geriatrics. 2010;10(1). DOI: 10.1186/1471-2318-10-45
2. Bobylev A. A., Rachina S. A., Avdeev S. N., Mladov V. V. Prospects for the use of biomarkers for the diagnosis of community-acquired pneumonia background chronic heart failure. Clinical pharmacology and therapy. 2018;27(3):16–25. [Russian: Бобылев А. А., Рачина С. А., Авдеев С. Н., Младов В. В. Перспективы применения биомаркеров для диагностики внебольничной пневмонии на фоне хронической сердечной недостаточности. Клиническая фармакология и терапия. 2018;27(3):16-25]
3.
4. Bafadhel M, Clark TW, Reid C, Medina M, Batham S, Barer MR et al. Procalcitonin and C-Reactive Protein in Hospitalized Adult Patients with Community-Acquired Pneumonia or Exacerbation of Asthma or COPD. Chest. 2011;139(6):1410–8. DOI: 10.1378/chest.10-1747
5. Brown JS. Biomarkers and community-acquired pneumonia. Thorax. 2009;64(7):556–8. DOI: 10.1136/thx.2008.110254
6. Müller B, Harbarth S, Stolz D, Bingisser R, Mueller C, Leuppi J et al. Diagnostic and prognostic accuracy of clinical and laboratory parameters in community-acquired pneumonia. BMC Infectious Diseases. 2007;7(1):10. DOI: 10.1186/1471-2334-7-10
7. Kang YA, Kwon S-Y, Yoon HI, Lee JH, Lee C-T. Role of C-Reactive Protein and Procalcitonin in Differentiation of Tuberculosis from Bacterial Community Acquired Pneumonia. The Korean Journal of Internal Medicine. 2009;24(4):337–42. DOI: 10.3904/kjim.2009.24.4.337
Kang YA, Kwon S-Y, Yoon HI, Lee JH, Lee C-T. Role of C-Reactive Protein and Procalcitonin in Differentiation of Tuberculosis from Bacterial Community Acquired Pneumonia. The Korean Journal of Internal Medicine. 2009;24(4):337–42. DOI: 10.3904/kjim.2009.24.4.337
8. Lee YJ, Lee J, Park YS, Lee S-M, Yim J-J, Yoo C-G et al. Predictors of Cardiogenic and Non-Cardiogenic Causes in Cases with Bilateral Chest Infiltrates. Tuberculosis and Respiratory Diseases. 2013;74(1):15–22. DOI: 10.4046/trd.2013.74.1.15
9. Stolz D, Christ-Crain M, Gencay MM, Bingisser R, Huber PR, Müller B et al. Diagnostic value of signs, symptoms and laboratory values in lower respiratory tract infection. Swiss Medical Weekly. 2006;136(27–28):434–40. DOI: 2006/27/smw-11271
10. Steurer J, Held U, Spaar A, Bausch B, Zoller M, Hunziker R et al. A decision aid to rule out pneumonia and reduce unnecessary prescriptions of antibiotics in primary care patients with cough and fever. BMC Medicine. 2011;9(1):56. DOI: 10.1186/1741-7015-9-56
A decision aid to rule out pneumonia and reduce unnecessary prescriptions of antibiotics in primary care patients with cough and fever. BMC Medicine. 2011;9(1):56. DOI: 10.1186/1741-7015-9-56
11. Mareev V. Yu., Fomin I. V., Ageev F. T., Begrambekova Yu. L., Vasyuk Yu. A., Garganeeva A. A. et al. Russian Heart Failure Society, Russian Society of Cardiology. Russian Scientific Medical Society of Internal Medicine Guidelines for Heart failure: chronic (CHF) and acute decompensated (ADHF). Diagnosis, prevention and treatment. Kardiologiia. 2018;58(S6):8–164. [Russian: Мареев В. Ю., Фомин И. В., Агеев Ф. Т., Беграмбекова Ю. Л., Васюк Ю. А., Гарганеева А. А. и др. Клинические рекомендации ОССН – РКО – РНМОТ. Сердечная недостаточность: хроническая (ХСН) и острая декомпенсированная (ОДСН). Диагностика, профилактика и лечение. Кардиология. 2018;58(S6):8-164]. DOI: 10.18087/cardio.2475
12.
13. Kanwar M, Brar N, Khatib R, Fakih MG. Misdiagnosis of Community- Acquired Pneumonia and Inappropriate Utilization of Antibiotics. Chest. 2007;131(6):1865–9. DOI: 10.1378/chest.07-0164
14. Basi SK, Marrie TJ, Huang JQ, Majumdar SR. Patients admitted to hospital with suspected pneumonia and normal chest radiographs: Epidemiology, microbiology, and outcomes. The American Journal of Medicine. 2004;117(5):305–11. DOI: 10.1016/j.amjmed.2004.03.029
The American Journal of Medicine. 2004;117(5):305–11. DOI: 10.1016/j.amjmed.2004.03.029
16. Schuetz P, Christ-Crain M, Thomann R, Falconnier C, Wolbers M, Widmer I et al. Effect of Procalcitonin-Based Guidelines vs Standard Guidelines on Antibiotic Use in Lower Respiratory Tract Infections: The ProHOSP Randomized Controlled Trial. JAMA. 2009;302(10):1059–66. DOI: 10.1001/jama.2009.1297
17. Kristoffersen KB, Søgaard OS, Wejse C, Black FT, Greve T, Tarp B et al. Antibiotic treatment interruption of suspected lower respiratory tract infections based on a single procalcitonin measurement at hospital admission—a randomized trial./52/52.jpg)
18. Castro-Guardiola null, Armengou-Arxé null, Viejo-Rodríguez null, Peñarroja-Matutano null, Garcia-Bragado null. Differential diagnosis between community-acquired pneumonia and non-pneumonia diseases of the chest in the emergency ward. European Journal of Internal Medicine. 2000;11(6):334–9. PMID: 11113658
19. Maisel A, Neath S-X, Landsberg J, Mueller C, Nowak RM, Peacock WF et al. Use of procalcitonin for the diagnosis of pneumonia in patients presenting with a chief complaint of dyspnoea: results from the BACH (Biomarkers in Acute Heart Failure) trial. European Journal of Heart Failure. 2012;14(3):278–86. DOI: 10.1093/eurjhf/hfr177
20. Ruiz-González A, Falguera M, Porcel JM, Martínez-Alonso M, Cabezas P, Geijo P et al.
21. Menendez R, Cavalcanti M, Reyes S, Mensa J, Martinez R, Marcos MA et al. Markers of treatment failure in hospitalised community acquired pneumonia. Thorax. 2008;63(5):447–52. DOI: 10.1136/thx.2007.086785
С-реактивный белок — диагностика коронавирусной инфекции — — Статьи
Здравоохранение во всех странах мира сегодня стоит перед огромной проблемой диагностики и прекращения эпидемии коронавирусной инфекции COVID-19, вызванной вирусом SARS-CoV-2.
Определено, что у взрослых пациентов, у которых был обнаружен коронавирус COVID-19 (до 95%), была значимо повышена концентрация С-реактивного белка (СРБ), как при тяжелой, так и легкой формах заболевания. Исследования пациентов с COVID-19 показали, что уровни СРБ напрямую коррелируют с заболеванием: у тяжелобольных пациентов наблюдалось значительное повышение уровня СРБ. Количественное определение СРБ может служить достоверным диагностическим маркером тяжести, прогрессирования и исхода болезни. Так, например, в одном из исследований, которое было сосредоточено на изучении предикторов (маркеров-предсказателей) летального исхода при COVID-19, было показано, что у выживших пациентов средний уровень СРБ составлял ~ 40 мг/л, в то время как у умерших — в среднем 125 мг/л.
Исследования пациентов с COVID-19 показали, что уровни СРБ напрямую коррелируют с заболеванием: у тяжелобольных пациентов наблюдалось значительное повышение уровня СРБ. Количественное определение СРБ может служить достоверным диагностическим маркером тяжести, прогрессирования и исхода болезни. Так, например, в одном из исследований, которое было сосредоточено на изучении предикторов (маркеров-предсказателей) летального исхода при COVID-19, было показано, что у выживших пациентов средний уровень СРБ составлял ~ 40 мг/л, в то время как у умерших — в среднем 125 мг/л.
Важнейшее диагностическое преимущество С-реактивного белка заключается в том, что он является очень ранним маркером воспаления, возникающего при инфекции COVID-19: его концентрация повышается уже через 6-8 часов после заражения. При проникновении вируса SARS-CoV-2 в организм запускается иммунный ответ для борьбы с этим патогеном, что и приводит к повышению уровня СРБ. Другие маркеры воспаления, такие как количество лейкоцитов в крови, имеют недостаточную прогностическую способность различать инфекции бактериальной и вирусной природы.
В соответствии с Методическими рекомендациями Минздрава РФ по профилактике, диагностике и лечению новой коронавирусной инфекции, при подозрении на COVID-19 диагноз устанавливается на основании комплекса диагностических исследований, в котором СРБ является основным лабораторным маркером активности патологического процесса в легких. Повышение СРБ коррелирует с объемом поражения легочной ткани и является основанием для начала противовоспалительной терапии.
Общий биохимический анализ крови (мочевина, креатинин, электролиты, глюкоза, аланинаминотрансфераза, аспартатаминотрансфераза, билирубин, альбумин, лактат, лактатдегидрогеназа тропонин, ферритин) относится к дополнительной лабораторной диагностике COVID-19. Отклонения биохимических маркеров от нормы имеют определенное прогностическое значение, могут указывать на развитие осложнений и помогают в выборе лекарственных средств, а также в режиме их дозирования. Так, например, еще одной особенностью заболевания COVID-19 стало выраженное повышение уровня печеночных трансаминаз (АЛТ и АСТ), что может отражать вирусное повреждение печени.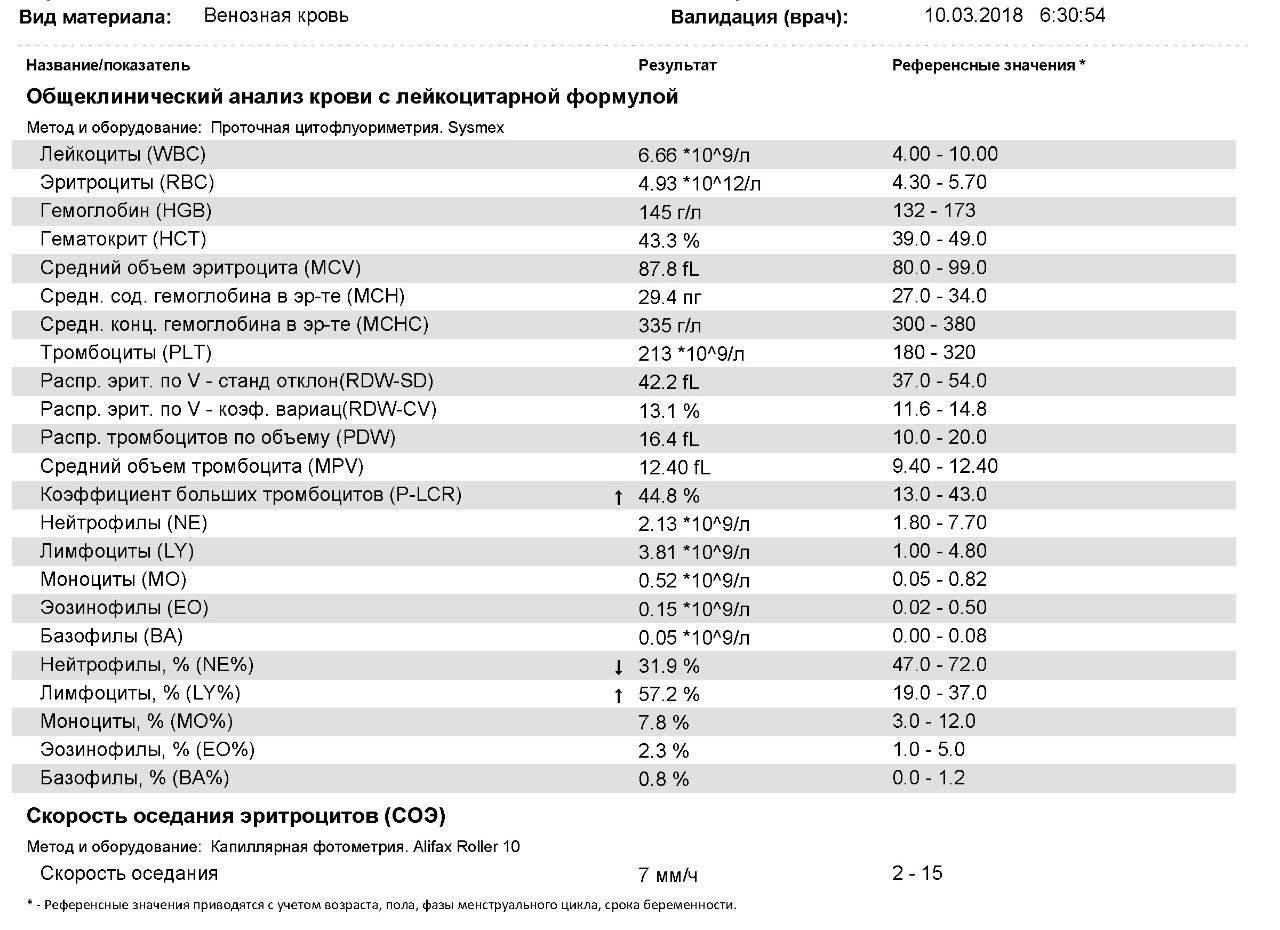 Показано, что повышение АЛТ и АСТ прямо коррелирует с тяжестью течения COVID-19.
Показано, что повышение АЛТ и АСТ прямо коррелирует с тяжестью течения COVID-19.
Предлагаем полный перечень тестов для биохимического анализа маркеров COVID-19 в соответствии с Методическими рекомендациями Минздрава РФ по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19), том числе наборы для количественного определения:
С- реактивный белок высокой чувствительности, иммунотурбидиметрический метод по конечной точке
Набор для количественного определения С- реактивного белка в сыворотке и плазме
| HT-C1122-40 | HT-C1122-100 | |
| Реагент 1 | 20 мл | 50 мл |
| Реагент 2 | 20 мл | 50 мл |
 Подробнее в каталоге биохимических реагентов
Подробнее в каталоге биохимических реагентов АЛТ Ферментативный кинетический метод
Набор для количественного определения аланинаминотрансферазы (АЛТ) в сыворотке крови.
| HT-A306-120 | HT-A306-240 | HT-A306-600 | |
| 100 мл | 2х100 мл | 500 мл |
| 20 мл | 2х20 мл | 100 мл |
АСТ Ферментативный кинетический метод
Набор для количественного определения аспартатаминотрансферазы (АСТ) в сыворотке крови
| HT-A309-120 | HT-A309-240 | HT-A309-600 | |
| 120 мл | 2х120 мл | 500 мл |
| 30 мл | 2х30 мл | 125 мл |
Фотометр лабораторный медицинский модели Вiochem SA — компактный настольный полуавтоматический биохимический анализатор.

Идеальное решение для лаборатории с небольшим потоком проб. Высокая производительность и инновационный дизайн.Автоматические биохимические анализаторы различной производительности серии BioChem для выполнения широкого спектра задач в лабораториях с небольшими и средними объемами биохимических исследований.
Вернуться
Глубокоуважаемые коллеги, друзья! Сегодня нас всех объединяет борьба с новой коронавирусной инфекцией — COVID-19. Уже появилось достаточное число публикаций, как зарубежных, так и российских, посвящённых данной глобальной проблеме, но согласитесь, самым ценным для каждого из нас есть и будет собственный опыт ведения таких пациентов. Поэтому считаем необходимым поделится своим опытом, потому что он очень сильно поменял наше представление об этом заболевании. Во-первых, с самого начала работы наши и без того невысокие ожидания по поводу возможностей «противовирусной терапии» с использованием лопинавира/ритонавира и гидроксихлорохина не оправдались. Поэтому сразу же возник практический вопрос, который можно и нужно рассматривать с самых различных сторон — с научной, лечебной, и, кстати, юридической… Так что же мы лечим в итоге? Давайте посмотрим на это с точки зрения практического врача? И с этой точки зрения термин, без которого не обходится не одна публикация, посвященная COVID-19 — а именно «коронавирусная пневмония» совершенно некорректен и, более того, ведёт порой к ошибочному ведению пациентов. На наш взгляд этот термин — «пневмония» совершенно не отражает клинико-рентгенологические, да и по отдельным сообщениям морфологические признаки патологического процесса, наблюдающегося при вирусном поражении легких COVID-19. Более правильным является термин — вирусное поражение лёгких (пневмонит или интерстициопатия), что и должно быть отражено в диагнозе. Данный факт имеет важное практическое значение, так как термин «пневмония» заставляет врачей ошибочно назначать антимикробную терапию при отсутствии объективных признаков присоединения бактериальной инфекции. Напротив, вышеозначенные термины (вирусное поражение лёгких, пневмонит или интерстициопатия) сподвигнут практического врача к правильной оценке ситуации, в том числе к назначению, при наличии показаний, противовоспалительной терапии (моноклональные антитела, ГКС). Это крайне важный момент, так как в настоящее время подавляющее число пациентов с коронаВИРУСНОЙ инфекцией, в том числе не имеющих признаков поражения лёгких, получают антибактериальную терапию, что не приносит никакого клинического эффекта, а лишь ведёт к росту антибиотикорезистентности! В этом же контексте надо упомянуть о втором важном моменте. В числе лабораторных маркеров, использующихся при ведении больных с COVID-19 фигурирует С-реактивный белок. До настоящего времени в большинстве публикаций он рассматривается, в первую очередь, как маркер присоединения бактериальной инфекции, требующей применения антибиотиков. И мы в своей практике видим, что действительно повышение СРБ коррелирует с объёмом поражения лёгочной ткани, и тем самым у нас есть практический выход — значительный рост СРБ (выше 50 мг/л) и «прогрессия» по результатам компьютерной томографии (КТ), прогрессирование дыхательной недостаточности являются основанием для привлечения противовоспалительной терапии ГКС, тоцилизумаб и др.(а никак не модификации антимикробной терапии!). Напротив, прокальцитонин при коронавирусной инфекции с поражением респираторных отделов лёгких (вирусный пневмонит, интерстициопатия) находится в пределах референсных значений. Но если мы наблюдаем повышение прокальцитонина (выше 0,5 нг/мл), то это действительно свидетельствует о присоединении бактериальной инфекции, и только в этом случае требуется назначение антибиотиков. Поэтому при ведении пациента с COVID-19 целесообразно мониторировать оба показателя — СРБ и ПКТ. Привлечение антимикробной терапии у пациентов с COVID-19 показано только при наличии объективных признаков присоединения бактериальной инфекции — уровень ПКТ более 0,5 нг/мл, как наиболее ранний и надёжный маркер бактериального процесса. Несколько слов о противовирусной терапии. В настоящее время этиотропного лечения с доказанной клинической эффективностью коронавирусной инфекции COVID-19 не существует. На основании анализа литературных данных по лечению пациентов с атипичной пневмонией, связанной с коронавирусами SARS-CoV и MERSCoV, в целом ряде рекомендаций различных стран мира, в том числе в российских, рекомендовано к применению несколько препаратов. К ним относятся хлорохин, гидроксихлорохин, лопинавир + ритонавир, препараты интерферонов. Отмечается, что наиболее перспективными средствами для лечения COVID-19 является группа противомалярийных средств — хлорохин либо его более активное производное — гидроксихлорохин. И если мы будем говорить в данном ключе — пневмонит, интерстициопатия, то, конечно возникает возможность более широкого привлечения в практику ведения пациентов COVID-19 системных глюкокортикостероидов (ГКС). Наш опыт показывает, что их своевременное использование позволяет остановить процесс, «удержать» пациента на самом главном этапе — когда достаточным уровнем респираторной поддержки является оксигенотерапия с потоком 5-10 л/мин. Наш опыт показывает, что на фоне применения ГКС нормализуется температура тела, снижается уровень СРБ, улучшаются показатели газообмена. Именно данный аспект проблемы является наиболее важным! Очевидно, что ранним (по показаниям!) привлечением ГКС мы не вылечим больного, но мы остановим прогрессирование процесса в лёгких на приемлемом уровне оксигенации пациента! Поэтому, на наш взгляд, целесообразно значительно расширить показания к более раннему применению противовоспалительной терапии. А именно, привлечение ГКС целесообразно при сохраняющейся лихорадке выше 38-39°С в течение 5-7 дней, появление признаков дыхательной недостаточности, прогрессирующее поражение легких по результатам КТ, повышение уровня СРБ. Конечно, без результатов дальнейших исследований сделать практические выводы крайне непросто — но, по крайней мере, наш достаточный опыт (который мы постараемся облечь в статистический отчёт), клинические наблюдения итальянских и американских коллег свидетельствуют о необходимости более широкого, НО правильного, своевременного и рационального использования системных ГКС. В одной клинической ситуации — это небольшие дозы преднизолона 120 мг и выше или дексаметазона 12 мг в сутки в течение 3-х дней у пациента с длительной лихорадкой и прогрессирующими изменениями в лёгких без дыхательной недостаточности, в другой — пульс-терапия метилпреднизолоном 250-500 мг в сутки в течение 2-3 дней у больного с массивным поражением лёгочной ткани и дыхательной недостаточностью, требующей высокопоточной оксигенотерапии. Конечно, дальнейшие усилия, в том числе (вернее сказать, в первую очередь) фармацевтических компаний, будут направлены на создание (расширение показаний) препаратов из группы иммунодепрессантов (моно или поликлональные антитела), а мы знаем, что тоцилизумаб или сарилумаб в настоящее время помогают нам в лечении пациентов с коронавирусной инфекцией, но при массовом поступлении пациентов в наши стационары правильное и своевременное привлечение ГКС, на наш взгляд, в настоящее время, является у ряда пациентов жизнеспасающей стратегией. Кстати, в данном контексте стоит упомянуть о другой, не менее важной стороне вопроса. Мы все уже сталкивались с тем, что применение тоцилизумаба или пульс-терапия метилпреднизолоном приводит к стабилизации процесса, но изменения лёгочной ткани по результатам КТ сохраняются длительное время (в том числе появляются участки консолидации, ретикулярные изменения), и у пациента сохраняются элементы дыхательной недостаточности (эпизоды десатурации при физической нагрузке), требующие длительной кислородотерапии. И, безусловно, конечно же, всем пациентам с поражением лёгких рекомендовано назначение низкомолекулярных гепаринов в профилактических дозах. Все наши мысли мы постарались изложить также на бумаге — обновив версию методических рекомендаций, которые можно найти на сайтах www.gvkg.ru и www.cough-conf.ru. Позвольте пожелать нам всем терпения и выздоравливающих пациентов!
ЗАЙЦЕВ Андрей Алексеевич, профессор, заслуженный врач РФ, главный пульмонолог Минобороны РФ, главный пульмонолог ГВКГ имени Н.Н. Бурденко, Президент Межрегиональной Ассоциации Специалистов Респираторной Медицины (МАСРМ). Источник: http://antibiotic. |
(PDF) С-реактивный белок в диагностике внебольничной пневмонии
18 CONSILIUM MEDICUM 2019 | ТОМ 21 | №3 / CONSILIUM MEDICUM 2019 | Vol. 21 | No. 3
Anton V. Ershov / Consilium Medicum. 2019; 21 (3): 15–19.
Обратная клиническая картина, характеризующаяся ма-
лым риском развития осложнений, исходно сопровождает-
ся низким значением концентрации СРБ и/или снижением
в первые 72 ч после начала специфической терапии [36].
Неспецифичность СРБ как острофазного белка, отра-
жающего тяжесть воспалительного процесса, позволяет
эффективно использовать динамику изменений его кон-
центрации в качестве маркера эффективности проводи-
мой терапии (табл. 2) [34]. Доказано, что сохранение кон-
центрации СРБ в крови свыше 100 мг/л на 4-е сутки анти-
биотикотерапии свидетельствует о неэффективности тера-
пии [37]. Более того, увеличение концентрации СРБ на фо-
не антибиотикотерапии является отрицательным прогно-
стическим признаком, свидетельствующим о росте риска
развития осложнений и смертности.
Снижение или нормализация концентрации СРБ в кро-
ви, согласно закономерностям течения воспаления как ти-
пового патологического процесса, должно также коррели-
ровать с падением активности патологических процессов.
Именно эта логика лежит в основе использования отсут-
ствия или замедленного снижения уровня СРБ как про-
гностического маркера неэффективности проводимой ан-
тибактериальной терапии [38]. Кроме того, ежедневное
определение СРБ позволяет существенно уменьшить про-
должительность антибиотикотерапии, снизить частоту
развития и тяжесть нежелательных лекарственных реак-
ций, вероятность развития антибиотикорезистентности, а
также сократить экономические и медицинские затраты
на лечение больных тяжелой ВБП [39].
В настоящее время определение концентрации СРБ в
крови больных ВБП регламентировано в ряде междуна-
родных стандартов. Так, согласно рекомендациям Британ-
ского торакального общества, измерение содержания СРБ
целесообразно проводить в начале антибиотикотерапии, а
также через несколько дней [40]. Европейскими эксперта-
ми пороговое значение СРБ>100 мг/л при наличии клини-
ческих симптомов инфекционного поражения органов
дыхательной системы положено в основу диагностики
пневмонии и безотлагательного начала антибактериаль-
ной терапии. В современных условиях определение актив-
ности СРБ является обязательным при диагностике пнев-
монии у детей [41].
Противоположная картина описана при концентрациях
СРБ<20 мг/л, когда на фоне симптомов поражения брон-
хов и/или легких необходимо проводить дополнительный
диагностический поиск альтернативных причин страда-
ния органов дыхательной системы (обострение хрониче-
ского бронхита, тромбоэмболия легочной артерии, сердеч-
ная недостаточность и пр.) [34].
Таким образом, определение концентрации СРБ в крови
является ценным лабораторным методом дифференциаль-
ной диагностики в терапии и пульмонологии, а также чув-
ствительным критерием своевременного мониторинга эф-
фективности антибактериальной терапии ВБП. Увеличе-
ние его концентрации в крови более 50 мг/л при наличии
респираторной симптоматики с высокой долей вероятно-
сти указывает на наличие ВБП, а исходно высокая кон-
центрация, длительное отсутствие динамики к снижению,
а также увеличение концентрации коррелируют с неблаго-
приятным течением пневмонии и неэффективной анти-
биотикотерапией. Более того, отсутствие существенного
повышения содержания СРБ при наличии симптоматики
поражения органов дыхательной системы должно направ-
лять врача на диагностический поиск иной патологии,
приведшей к данной клинической картине.
Конфликт интересов. Автор заявляет об отсутствии
конфликта интересов.
Conflict of interests. The author declare that there is not
conflict of interests.
Литература/References
1. Титова О.Н., Кузубова Н.А., Лебедева Е.С. Биомаркеры прогноза тяжести течения и исхо-
да внебольничной пневмонии. Мед. альянс. 2018; 2: 55–60.
[Titova O.N., Kuzubova N.A., Lebedeva E.S. Biomarkery prog noza tia zhesti t echeniia i iskhoda
vnebol’nichnoi pnevmonii. Med. al’ians. 2018; 2: 55–60 (in Russian).]
2. Бородулин Б.Е., Черногаева Г.Ю., Бородулина Е.А. и др. Летальность от внебольничной пнев-
монии в условиях многопрофильной больницы за 10 лет. Мед. альманах. 2012; 2 (21): 34–6.
[Borodulin B.E., Chernogaeva G.Iu., Borodulina E.A. et al. Letal’nost’ ot vnebol’nichnoi pnevmonii v
usloviiakh mnogoprofil’noi bol’nitsy za 10 let. Med. al’manakh. 2012; 2 (21): 34–6 (in Russian).]
3. Бородулина Е.А., Бородулин Б.Е., Поваляева Л.В. и др. Предикторы летальности от вне-
больничной пневмонии в современных условия х работ ы пульм онологического центра.
Вестн. современ. клин. медицины. 2015; 8 (4): 19–22.
[Borodulina E.A. , Bor odulin B.E., Po valiae va L.V. et al. Pr edikto ry letal’nosti ot vn ebol’n ichnoi
pnevmonii v sovremennykh u sloviiakh raboty pul’monologicheskogo ts entra. Vestn. sovremen.
klin. meditsiny. 2015; 8 (4): 19–22 (in Russian).]
4. Чучалин А.Г., Синопальников А.И., Козлов Р.С. и др. Внебольничная пневмония у взрослых:
практические рекомендации по диагностике, лечению и профилактике. М.: МАКМАХ, 2010.
[Chucha lin A.G., Sinopal’nikov A.I., Koz lov R.S . et a l. Vneb ol’nichnaia pn evmoniia u vzroslykh:
prakticheskie rekome ndatsii po di agnosti ke, lecheniiu i profilaktike. Mos cow: MAKMAKh, 2010
(in Russian).]
5. Muller B, Harbarth S, Stolz D et al. Diagnostic and prognostic accuracy of clinical and laboratory
parameters in community-acquired pneumonia. BMC Infect Dis 2007; 7: 10.
6. Watkins RR, Lemo novich TL. Diagn osis and manage ment of c ommuni ty-acquired pneu monia
in adult. Am Fam Physician 2011; 83 (11): 1299–306.
7. Woodhead M et al. ERS/ESCMID Joint Task Force. Clin Microbiol Infect 2011; 17 (6): 1.
8. Бобылев А.А., Рачина С.А., Авдеев С.Н., Дехнич Н.Н. Клиническое значение определения
С-реактивного белка в диагностике внебольничной пневмонии. Клин. фармакология и те-
рапия. 2016; 25 (2): 32–42.
[Bobylev A.A., Rachina S.A. , Avdeev S.N., Dekhnich N.N. Klinicheskoe znachenie opredeleniia
S-reaktivnogo belka v diagnostike vnebol’nichnoi pnevmonii. Klin. farmakologiia i terapiia. 2016;
25 (2): 32–42 (in Russian).]
9.Бобылев А.А., Рачина С.А., Авдеев С.Н., Младов В.В. Перспективы применения биомарке-
ров для диагностики внебольничной пневмонии на фоне хронической сердечной недоста-
точности. Клин. фармакология и терапия. 2018; 27 (3): 16–25.
[Bobylev A.A., Rachina S.A., Avdeev S.N., Mladov V.V. Perspektivy primeneniia biomarkerov dlia
diagnostiki vnebol’nichnoi pnevmonii na fone khronicheskoi serdechnoi nedostatochnosti. Klin. far-
makologiia i terapiia. 2018; 27 (3): 16–25 (in Russian).]
10. Tillet W, Francis T. Serological reaction in pneumonia with a non-protein somatic fraction of Pneu-
mococcus. J Exp Med 1930; 52: 561–71.
11. Ghose T. Oswald Avery: the professor, DNA, and the Nobel Prize that eluded him. Can Bull Med
Hist 2004; 21 (1): 135–44.
12. Bottazzi B, Doni A, Garlanda C, Mantovani A. An integrated view of humoral innate immunity: pent-
raxins as a paradigm. Ann Rev Immunol 2010; 28: 157–83.
13. MacLeod CM, Avery OT. The occurrence during acute infections of a protein not normally present
in the blood: II. Isolation and properties of the reactive protein. J Exp Med 1941; 73 (2): 183–90.
14. Singh PP, Voleti B, Agrawal A. A novel RBP-J kappa-dependent switch from C/EBP beta to C/EBP
zeta at the C/EBP binding sit e on the C-reactive prot ein promoter. J Immuno l 2007; 1 78 (11):
7302–9.
15. Thompson D, Pepys MB, Wood SP. The physiological structure of human Creactive protein and its
complex with phosphocholine. Structure 1999; 7 (2): 169–77.
16. Рыдловская А.В., Симбирцев А.С. Функциональный полиморфизм гена TNF-aи патология.
Цитокины и воспаление. 2005; 4 (3): 4–10.
[Rydlovskaia A.V., Simbirtsev A.S. Funktsional’nyi polimorfizm gena TNF-ai patologiia. Tsitokiny i
vospalenie. 2005; 4 (3): 4–10 (in Russian).]
17. S haddock E.J. How and when to use co mmon b iomarkers in commu nity-acquired pneumonia.
Pneumonia (Nathan) 2016; 8: 17.
18. Young B, Greeson M, Gripps AW et al. C-reactive protein: a critical review. Pathology 1991; 23:
118–24.
19. Зайцев А.А., Кондратьева Т.В., Маджанова Е.Р. Диагностические и прогностические воз-
можности количественного определения С-реактивного белка при внебольничной пневмо-
нии. Воен.-мед. журн. 2013; 11: 35–40.
[Zaitsev A.A., Kondrat’eva T.V., Madzhanova E.R. Diagnosticheskie i prognosticheskie vozmozh-
nosti kolichestvennogo opredeleniia S-reaktivnogo belka pri vnebol’nichnoi pnevmonii. Voen.-med.
zhurn. 2013; 11: 35–40 (in Russian).]
20. Pepys MB, Hirschfield GM. C-reactive protein: a critical update. J Clin Invest 2003; 111: 1805–12.
21. Yuste J et al. Serum amyloid P aids complement-mediated immunity to Streptococcus pneumonia.
PLoS Pathog 2007; 3 (9): 1208–19.
22. Brown JS et al. The classical pathway is the dominant complement pathway required for innate im-
munity to Streptococcus pneumoniae infection in mice. Proc Natl Acad Sci U S A 2002; 99 (26):
16969–74.
Практические аспекты использования биомаркеров в диагностике нозокомиальной пневмонии: анализ литературы и собственные исследования. Клиническая фармакология и терапия
Проблема поиска и внедрения в клиническую практику простых и объективных лабораторных биомаркеров является одной из актуальных для современной медицины [1]. Их востребованность определяется недостаточной специфичностью большинства клинических симптомов в ранней диагностике конкретных заболеваний, а также известными ограничениями инструментальных исследований. Роль биомаркеров не ограничивается более точной диагностикой заболеваний. Потенциальными “точками приложения” могут быть определение тяжести состояния пациента, краткосрочного и долгосрочного прогноза, объективная оценка ответа на проводимую терапию, а в случае инфекций – вероятности инфицирования определенными группами патогенов (например, вирусами или бактериальными возбудителями) [1,2]. Основными требованиями, предъявляемыми к биомаркерам, являются: 1) простота выполнения; 2) вы сокая специфичность и чувствитель ность; 3) бы стро та получения результата; 4) невысокая стоимость иссле дования.
К числу непростых для врача диагностических и терапевтических проблем относится нозокомиальная пневмония (НП). Нозокомиальной (госпитальной, внутрибольничной) считают пневмонию, которая развивается у пациента через 48 ч и более после госпитализации при отсутствии симптомов и признаков легочной инфекции на момент поступления в стационар [3,4]. НП, развивающуюся через >48 ч от момента интубации и начала проведения ИВЛ, выделяют в отдельную группу (НПИВЛ) [3]. НПИВЛ отличается высокой атрибутивной летальностью и значительными затратами на лечение [5,6].
Заболеваемость НП |ИВЛ широко варьируется и, по разным данным, составляет от 2 до 16 случаев на 1000 дней вентиляции [7]. Возможная причина столь большого разброса лежит в отсутствии единых критериев постановки диагноза, что приводит как к гипо-, так и гипердиагностике [8,9]. Спектр заболеваний и состояний, с которыми необходимо проводить дифференциальную диагностику при подозрении на НП, включает распространенные повреждения паренхимы легких – острый респираторный дистресс-синдром, тромбоэмболию легочной артерии, послеоперационные ателектазы, нозокомиальный трахеобронхит и др. [3]. Необходимо отметить, что традиционно применяющаяся рентгенография органов грудной клетки характеризуется умеренной чувствительностью и специфичностью в диагностике НПИВЛ, а широкое использование компьютерной томографии высокого разрешения (КТВР) ограничено высокой стоимостью и невозможностью выполнения исследования у постели больного [3].
Наиболее изученными лабораторными биомарке рами при НП помимо количества лейкоцитов периферической крови являются С-реактивный белок, прокальцитонин и растворимая форма триггерного рецептора, экспрессированного на миелоидных клетках I типа [10,11].
С-реактивный белок
С-реактивный белок (СРБ) – это один из самых известных биомаркеров воспаления и тканевого повреждения [12]. Его роль изучалось при различных инфекциях, таких как пневмония, абсцесс легкого, эндокардит, остеомиелит, острая ревматическая лихорадка, сепсис. Внедрение в практику высокочувствительных методов идентификации СРБ существенно расширило диагностические возможности его использования при заболеваниях неинфекционной природы [13]. Перспективы применения СРБ при НП и НПИВЛ оценивались многими исследователями с точки зрения возможности повышения точности диагностики заболевания, оценки исхода, определения эффективности антибактериальной терапии (АБТ).
Q. Lin и соавт. изучали диагностическую ценность концентрации СРБ в сыворотке крови у пациентов, находящихся на ИВЛ >48 ч, в рамках проспективного когортного исследования [14]. Медиана уровня СРБ в группе пациентов с НПИВЛ оказалась достоверно выше, чем у пациентов без НП: 125,8 (85,31-234,8) мг/л и 81,92 (62,94-112,5) мг/л, соответственно (p<0,001). При пороговом значении СРБ >112,7 мг/л специфичность и чувствительность диагностики НП ИВЛ составили 76,0% и 61,6%, соответственно, площадь под ROC-кривой – 0,715±0,044. В другом исследовании у пациентов с НПИВЛ уровень СРБ при пороговом значении ≥196,9 мг/л характеризовался менее высокой чувствительностью (56%), но более высокой специфичностью (91%) [15].
В 2016 году Р. Póvoa и соавт. провели многоцентровое проспективное наблюдательное исследование BioVAP (Biomarkers in the diagnosis and management of ventilator-associated pneumonia) у 138 пациентов отделений реанимации и интенсивной терапии (ОРИТ), которым проводилась ИВЛ >72 ч. У 35 (25,4%) пациентов развилась НПИВЛ, у 33 (23,9%) – другая нозокомиальная инфекция. Оставшиеся 70 (50,7%) пациентов без признаков инфекции и АБТ составили контрольную группу [16]. Концентрация СРБ в сыворотке у пациентов с НПИВЛ была существенно выше контрольной – скорректированное отношение шансов (ОШ) составило 1,202 (95% доверительный интервал [ДИ] 1,061, 1,363, p=0,004). Достоверные отличия выявлены при оценке скорости прироста и степени повышения уровня СРБ по сравнению с исходным значением с первого по шестой день ИВЛ [16]. Чем быстрее увеличивалась концентрация СРБ, тем выше была вероятность развития НПИВЛ. Так, риск развития НПИВЛ при увеличении концентрации СРБ на 1 мг/дл в день был на 62% выше, чем при отсутствии такого подъема. При ежедневном повышении уровня СРБ на каждые 10% по сравнению с исходным риск развития НП ИВЛ возрастал на 20%. Максимальная разница между наибольшим и наименьшим показателем с первого по шестой день также была достоверно ассоциирована с развитием НПИВЛ (ОШ 1,139, 95% ДИ 1,039, 1,248, p=0,006). Увеличение максимальной разницы концентрации СРБ на 1 мг/дл сопровождалось повышением риска развития НП ИВЛ на 14%. Авторы исследования пришли к выводу, что ежедневный мониторинг СРБ позволяет надежно прогнозировать риск развития НП ИВЛ, а его использование в дополнение к клиническим данным и шкале оценки инфекции легких (CPIS):1–112. ) может повысить точность диагностики заболевания.
Этой же группой исследователей было показано, что мониторинг уровня СРБ является хорошим предиктором адекватности ответа на АБТ, а также риска летального исхода у пациентов в ОРИТ c микробиологически подтвержденной НП ИВЛ [17]. Кинетика содержания СРБ достоверно отличалась между выжившими и умершими. На 4-й день лечения концентрация СРБ у выживших составила 47% от исходной против 96% среди умерших, при этом адекватная АБТ ассоциировалась с меньшим риском смерти и более быстрым снижением уровня СРБ.
В более раннем пилотном исследовании Р. P óvoa и соавт. у 47 пациентов с НП ИВЛ были получены сходные результаты. На 4-e сутки АБТ уровень СРБ у выживших и умерших пациентов составил 62% и 98%, соответственно, по сравнению с исходным значением [18]. По характеру изменений концентрации СРБ на фоне лечения пациенты были разделены на 4 группы: быстрый ответ, медленный ответ, отсутствие ответа и двухфазный ответ (снижение и последующее повышение концентрации СРБ выше исходной). Все пациенты первых двух групп выжили, в то время как в третьей и четвертой группе летальность составила 78% и 75%, соответственно. Адекватность стартовой АБТ оказывала значимое влияние на скорость снижения уровня СРБ сыворотки и летальность.
Возможность использования мониторинга сывороточного СРБ для оценки эффективности АБТ пациентов с НП ИВЛ подтверждена также в исследовании В. Kiaei и соавт. [19]. В данной работе уровень СРБ измеряли исходно и каждые 48 ч до окончания АБТ. С 4-го дня лечения отмечено снижение концентрации СРБ, достигшее достоверной разницы к окончанию терапии по сравнению с исходным значением.
Прокальцитонин
Прокальцитонин (ПКТ) – растворимый белок, состоящий из 116 аминокислот и являющийся предшественником кальцитонина. Он обычно поступает в системный кровоток при развитии тяжелого системного воспаления (особенно в случае инфицирования бактериальными возбудителями) [20]. В клинической практике уровень прокальцитонина широко используют для диагностики сепсиса и септического шока [20,21]. Воз мож ность применения ПКТ также активно изучалась у больных НП. В проведенных исследованиях оценивали перспективы его использования для определения вероятности развития НПИВЛ, оценки эффективности АБТ и риска смерти.
Так, в проспективном исследовании M. Abu Elyazed и соавт. было показано, что уровень ПКТ, наряду с СРБ, является точным прогностическим биомаркером развития НП после абдоминального хирургического вмешательства [22]. Причем на второй день после операции уровень ПКТ характеризовался более высокими чувствительностью и специфичностью по сравнению с СРБ (84% и 72% против 70% и 60%, соответственно).
L. S):1–112. u и соавт. показали высокую эффективность ком бинации ПКТ и шкалы CPIS):1–112. в оценке 28-дневной летальности у критически больных пациентов с сепсисом и присоединившейся НПИВЛ [23].
В цитировавшемся ранее исследовании B. Kiaei и соавт. ПКТ, наряду с СРБ, оказался эффективным маркер ответа на АБТ у пациентов с НПИВЛ, причем снижение его уровня отмечалось уже через 48 ч после начала лечения [19]. Однако стоит отметить, что даже на 10-й день лечения уровень ПКТ оставался повышенным, а при сравнении его динамики у умерших и выживших пациентов достоверных различий не выявлено.
В другом проспективном наблюдательном исследовании у пациентов в возрасте ≥65 лет, находившихся в ОИТ в связи с тяжелой НП, уровень ПКТ сыворотки измеряли при включении, на 3, 7-й день и на момент окончания терапии [24]. Динамика уровня ПКТ на 3-и сутки была лучшим предиктором эффективности лечения – при его снижении на 26,2% специфичность и чувствительность составили 72,0% и 75,7%, соответственно, площадь под ROC-кривой – 0,79 (p<0,001). Комбинация изменения уровня ПКТ (>26,2%) с модифицированной шкалой CPIS):1–112. (сумма баллов <6) характеризовалась еще более высокой надежностью в качестве раннего маркера эффективности АБТ [24].
В то же время кинетика уровня ПКТ с первого по шестой день лечения, изучавшаяся в рамках исследо вания BioVAP у 37 пациентов с микробиологически верифицированной НПИВЛ, обладала низкой информативностью в оценке вероятности неблагоприятного прогноза и ответа на АБТ [17]. Авторы отметили, что быстрое снижение уровня ПКТ у пациентов было связано с более низким риском летального исхода по сравнению с таковым при медленном снижении/отсутствии изменений, но достоверных различий между группами выявлено не было.
Среди возможных объяснений “неудачи” ПКТ авторы данной и ряда других работ упоминают его низкий исходный уровень в момент постановки диагноза у значительной части пациентов, особенно с благоприятным прогнозом [17,25-27]. Еще одной причиной противоречивых результатов исследований может быть разная доля пациентов с почечной недостаточностью, в том числе получавших заместительную почечную терапию. Y. Nakamura и соавт. в ретроспективном наблюдательном исследовании показали, что точность ПКТ в диагностике сепсиса может быть ниже у пациентов с острым почечным повреждением (ОПП), так как почки являются основным органом его элиминации [28].
G. Takahashi и соавт. в более позднем исследовании не обнаружили подобных различий, однако также пришли к выводу о том, что уровень ПКТ может отличаться у пациентов с сепсисом и ОПП, что, вероятнее всего, является результатом более сложных взаимодействий кинетики биомаркера у пациентов с сепсисом и ОПП [29]. В частности, более высокий уровень ПКТ может быть следствием не только нарушенного клиренса, но и исходно более тяжелой инфекции при сепсисе с ОПП. Таким образом, в данных подгруппах для диагностики, видимо, стоит рассматривать разные пороговые уровни или точки отсечения ПКТ.
Опубликованный в 2016 г. мета-анализ клинических исследований показал, что уровень ПКТ является хорошим предиктором летального исхода как при внебольничной пневмонии (ВП), так и НПИВЛ [30]. К ограничениям данной работы необходимо отнести превалирование исследований, проводившихся у пациентов с ВП, и в целом небольшое количество больных НП.
Триггерный рецептор I типа, экспрессируемый на миелоидных клетках (TREM-I)
Триггерный рецептор I типа, экспрессируемый на миелоидных клетках (TREM-I), относится к активирующим рецепторам из суперсемейства иммуноглобулинов и присутствует на мембранах нейтрофилов, макрофагов и моноцитов [31]. TREM-1 опосредует активацию данных клеток, наблюдающуюся при воспалительном ответе на бактерии, грибы и некоторые неинфекционные триггеры [32]. Присутствие рецептора в крови в растворимой форме (soluble TREM-1 – sTREM-1) позволяет использовать его как биомаркер. Проведенные исследования показали, что при определенных условиях sTREM-1 может быть предиктором бактериальной инфекции легких у пациентов ОИТ, а в комбинации с другими биомаркерами и/или шкалами может использоваться для диагностики НПИВЛ.
S):1–112. . Palazzo и соавт. в наблюдательном проспективном исследовании оценивали уровень sTREM-1 в бронхоальвеолярной лаважной жидкости (БАЛЖ) и выдыхаемом воздухе у пациентов ОИТ, которым в связи с подозрением на развитие НПИВЛ выполняли бронхоскопию [33]. Уровень sTREM-1 в БАЛЖ у пациентов с подтвержденной НПИВЛ был выше, а концентрация sTREM-1 в выдыхаемом воздухе была ниже у пациентов, получавших АБТ. Однако эти различия оказались статистически недостоверными, а диагностическая ценность определения sTREM-1 в БАЛЖ и выдыхаемом воздухе была недостаточной для выявления пациентов с НПИВЛ.
Ранее приводившееся исследование L.-Х. S):1–112. u и соавт. у тяжелых больных сепсисом подтвердило возможность использования сывороточной концентрации sTREM-1 в комбинации со шкалой CPIS):1–112. для улучшения диагностики НПивл [23].
V. Grover и соавт. изучали перспективы применения 11 маркеров для диагностики НПИВЛ: 6 клеточных (по 3 для моноцитов и нейтрофилов, соответственно: TREM1, CD11b и CD62L) и 5 растворимых (интерлейкин [ИЛ]-1β, ИЛ-6, ИЛ-8, sTREM-1, ПКТ) [34]. В исследование был включен 91 пациент, в том числе 37 – с подтвержденной НПИВЛ, 33 – на ИВЛ без признаков НП, 31 – без инфекции и не на ИВЛ (контрольная группа). Наряду с исследуемыми биомаркерами у пациентов измеряли сывороточную концентрацию СРБ и число лейкоцитов периферической крови. Концентрацию маркеров определяли в крови и БАЛЖ, затем подсчитывали отношение БАЛЖ/кровь. По отдельности маркеры не представляли диагностической ценности вне зависимости от способа подсчета, однако комбинация из 7 биомаркеров (отношение моноцитарных TREM-1 и CD11b в БАЛЖ/крови; уровни sTREM-1, ИЛ-8 и ИЛ-1β в БАЛЖ; уровни СРБ и ИЛ-6 в крови) позволяла достоверно выявлять пациентов с НП [34]. Однако авторы отметили, что для получения более достоверных результатов нужно провести более крупное многоцентровое исследование.
В мета-анализ J. S):1–112. hi и соавт. были включены 9 исследований (суммарно 510 пациентов), в которых изу ча лась возможность использования уровня sTREM-1 в БАЛЖ у пациентов ОИТ для диагностики бактериальной легочной инфекции [35]. Анализ показал возможность применения данного маркера с хорошей диагностической точностью – чувствительность составила 87% (95% ДИ 0,72-0,95), а специфичность – 79% (95% ДИ 0,56-0,92). Однако использование различных уровней sTREM-1 для диагностики бактериальной легочной инфекции не позволило вывести оптимальное пороговое значение показателя. Кроме того, отдельные исследования отличались широкой вариабельностью популяции пациентов и критериев клинической и лабораторной оценки.
В более поздний мета-анализ W. Ye и соавт., выполненный в 2014 г., были включены 13 исследований и суммарно 1138 пациентов c инфекциями нижних дыхательных путей (ИНДП) [36]. Пациенты были разделены на 4 группы: (1) внебольничные ИНДП; (2) нозокомиальные (внутрибольничные) ИНДП; (3) ИНДП с положительным результатом культурального исследования; (4) ИНДП с отрицательным результатом культурального исследования. Мета-анализ показал, что уровень sTREM-1 (1) одинаково эффективен в диагностике как внутри-, так и внебольничных ИНДП и (2) позволяет дифференцировать культуронегативные и культуропозитивные ИНДП, однако последний вывод должен рассматриваться с некоторыми оговорками ввиду меньшего размера выборки пациентов с доступными результатами культурального исследования. Среди наиболее значимых ограничений мета-анализа необходимо отметить неоднородность популяции больных с ИНДП, использование различных методов определения sTREM-1 и различных источников sTREM-1 [36]. При изучении потенциальных перспектив использования sTREM-1 у пациентов с НП следует учитывать, что он может повышаться при многих других неинфекционных заболеваниях/состояниях [37-38].
Другие биомаркеры
К другим биомаркерам, которые могут представлять определенный интерес при НП, относятся пресепсин, проадреномедуллин, растворимый рецептор урокиназного активатора плазминогена (S):1–112. uPAR) [39]. Иссле до вание T. Hellyer и соавт. показало, что низкие уровни ИЛ-1β в сочетании с ИЛ-8 позволяют надежно исключить НПивл [40].
Наибольшее внимание с точки зрения диагностики и оценки прогноза при серьезных инфекциях в последние годы уделяется пресепсину. Пресепсин – это растворимый N-концевой фрагмент рецептора макрофагов CD14, который в норме присутствует в сыворотке крови в следовых количествах [41,42]. Его концентрация значимо возрастает при тяжелых бактериальных инфекциях, прежде всего сепсисе, и может использоваться для его ранней диагностики и, соответственно, оценки показаний к АБТ, а также прогноза. Однако место пресепсина в диагностике НП остается неопределенным.
Несмотря на значительное число исследований биомаркеров у пациентов с НП следует отметить, что их использование в рутинной практике по-прежнему является предметом обсуждения. Так, в опубликованных в 2016 г. российских клинических рекомендациях подчеркивается, что роль биомаркеров, таких как ПКТ и СРБ, в диагностике НП представляется ограниченной, прежде всего, в силу наличия основного заболевания, которое может приводить к повышению их уровня в крови (травма, включая операционную, инсульт, рак легкого, инфекции другой локализации) [3]. Воз мож ности применения уровня пресепсина для диагностики НП не определены. Эксперты Американского торакального общества и Американского общества по инфекционным болезням также не рекомендуют использовать ПКТ, СРБ и sTREM-1 в рутинной клинической практике для принятии решения о начале АБТ [4]. Другие возможности применения биомаркеров при НП (диагностика, прогноз, оценка эффективности терапии) в клинических рекомендациях не упоминаются.
Данное обстоятельство, вероятно, является подтверждением ограниченной доказательной базы, обусловленной в первую очередь недостатком сравнительных многоцентровых рандомизированных клинических исследований. Следует также отметить, что имеющаяся доказательная база в основном касается пациентов с НПИВЛ, исследования же у пациентов с НП, не связанной с ИВЛ, остаются единичными.
Собственные наблюдения
В пилотное исследование, выполнявшееся на базе Го род ской клинической больницы им. В.В. Вино гра дова в 2016-2017 гг., проспективно включали пациентов с клиническим диагнозом нетяжелой НП, не требовавших перевода в ОРИТ и ИВЛ. Диагностика осуществлялась в соответствии с российскими клиническими рекомендациями [3]. С целью верификации пневмонической инфильтрации всем пациентам проводили компьютерную томографию высокого разрешения. Помимо рутинных лабораторных исследований у пациентов в течение 24 ч определяли сывороточные уровни СРБ, ПКТ, пресепсина. Обработка и статистический анализ данных выполнялись с использованием стандартных процедур и методов. Количественные показатели представлены с учетом характера распределения первичных данных: при параметрическом – в виде среднего арифметического значения ± стандартного отклонения, непараметрическом – в виде медианы и интерквартильного размаха (первым и третьим квартилями), качественные – абсолютными и относительными частотами. Стати стические исследования проводились для двусторонней# гипотезы на уровне значимости 0,05 (различия считали достоверными при р<0,05).
Рис. 1 Доля (%) пациентов с нетяжелой НП, у которых отмечалось повышение уровня СРБ, ПКТ и пресепсин (n=30) Прокальцитонин vs СРБ p<0,05, пресепсин vs СРБ p<0,05, прокальцитонин vs пресепсин p>0,05В исследование были включены 30 больных НП, в том числе 16 (54%) мужчин. Средний возраст пациентов составил 67,4±15,0 лет. В выборке преобладали пациенты с поздней НП; у большинства из них имелись хронические сопутствующие заболевания, преимущественно сердечно-сосудистой системы (табл. 1). У всех 30 пациентов на момент включения в исследование выявлено значимое повышение уровня СРБ. Повы ше ние уровня пресепсина и ПКТ регистрировалось достоверно реже (рис. 1). Медианы содержания СРБ, ПКТ и пресепсина составили 129,5 (61;174) мг/л (норма – 0-5 мг/л), 0,28 (0,08;2,67) нг/мл (норма 0-0,5 нг/мл) и 265 (150;372) пг/мл (норма 0-337 пг/мл), соответственно .
| Параметр | Значение |
|---|---|
| Количество пациентов, n | 30 |
| Мужчины, n (%) | 16 (53) |
| Возраст, годы | 67,4±15,0 |
| Поздняя НП, n (%) | 27 (90) |
| Сопутствующие заболевания/синдромы, n | |
| Артериальная гипертония | 20 |
| ИБС | 9 |
| Хроническая сердечная недостаточность | 8 |
| Сахарный диабет | 8 |
| Фибрилляция предсердий | 7 |
| Госпитальная летальность, n (%) | 4 (17) |
Результаты исследования демонстрируют низкую чувствительность ПКТ и пресепсина в ранней диагностике НП по сравнению с СРБ, что, видимо, объяс няется особенностями больных, включенных в исследование, – преимущественно терапевтические пациенты, развитие пневмонии у которых не требовало перевода в ОИТ. Следует отметить, что медиана концентрации СРБ была >100 мг/л, аналогичные показатели ПКТ и пресепсина оказались ниже пороговых значений данных биомаркеров, рекомендуемых производителями диагностических тестов.
С-реактивный белок в диагностике внебольничной пневмонии Текст научной статьи по специальности «Клиническая медицина»
https://doi.org/10.26442/20751753.2019.3.190259
Обзор
С-реактивный белок в диагностике
пневмонии
А.В.Ершови
1ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М.Сеченова» Минздрава России (Сеченовский Университет), Москва, Россия;
2ФГБНУ «Федеральный научно-клинический центр реаниматологии и реабилитологии», Москва, Россия esalavatprof@ mail.ru
Аннотация
В статье приводится анализ актуальной информации о диагностической ценности С-реактивного белка (СРБ) в терапии и пульмонологии в разрезе дифференциального поиска патологии органов дыхательной системы, а также нозологических форм, имеющих общие элементы клинической симптоматики, характерной для внебольничной пневмонии (ВБП). Отражены история открытия, основные эффекты, биологическое значение и особенности лабораторной диагностики содержания СРБ в крови. Критически раскрыты результаты исследований по использованию концентрации СРБ в качестве биологического маркера возникновения ВБП, ее осложнений и тяжести течения, а также адекватности выбранной антибактериальной терапии.
Ключевые слова: внебольничная пневмония, С-реактивный белок, лабораторная диагностика.
Для цитирования: Ершов А.
1I.M.Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia; 2Federal Research and Clinical Center for Resuscitation and Rehabilitation, Moscow, Russia esalavatprof@ mail.ru
Abstract
The article provides an analysis of current information about the diagnostic value of the C-reactive protein in therapy and pulmonology in the context of the differential search for pathology of the respiratory system organs, as well as nosological forms that have common elements of clinical symptoms characteristic of community-acquired pneumonia. The history of discovery, main effects, biological significance and features of laboratory diagnosis of C-reactive protein content in blood are reflected. The results of studies on the use of C-reactive protein concentration as a biological marker of the occurrence of community-acquired pneumonia, its complications and severity, as well as the adequacy of the selected antibacterial therapy are critically disclosed. Key words: community-acquired pneumonia, C-reactive protein, laboratory diagnostics.
For citation: Ershov A.V. С-reactive protein in the diagnostics of communicative pneumonia. Consilium Medicum. 2019; 21 (3): 15-19. DOI: 10.26442/20751753.2019.3.190259
внебольничной
Несмотря на постоянное усовершенствование компонентов и принципов антибактериальной терапии, проблема пневмонии сохраняется во всем мире [1]. Это обусловлено, с одной стороны, повсеместной распространенностью заболевания и неуклонным ростом заболеваемости, с другой стороны, отсутствием существенной тенденции к улучшению ранних и отдаленных исходов лечения. Данные обстоятельства являются причиной того, что летальность от внебольничной пневмонии (ВБП) не снижается, а число больных с затяжными, бессимптомными формами течения, а также с тяжелыми осложнениями основного заболевания неуклонно растет как в мире, так и в России [2, 3].
Пневмония, согласно классическим патофизиологическим понятиям, относится к наиболее частым причинам синдрома системной воспалительной реакции и является одной из ведущих причин смерти среди инфекционных заболеваний [4, 5]. Согласно наблюдениям последних 10-20 лет в палатах интенсивной терапии профильных отделений летальность при тяжелой пневмонии достигает 15-30% [1, 3, 6, 7]. При этом заболеваемость ВБП в развитых странах мира, в зависимости от уровня развития и благосостояния населения, варьируется в среднем от 1 до 11,6% среди лиц молодого и среднего возраста. В возрастной категории старше 65 лет ВБП встречается в 4 раза чаще и составляет 25-44% [8].
Несмотря на широкое распространение, медицинскую и социальную значимость, гипердиагностика пневмонии, по данным разных авторов, составляет от 16 до 52%, в то время как диапазон гиподиагностики варьирует от 0,9 до 18% [1, 2, 9]. Это ведет к тому, что летальность при пневмониях
не снижается, а число больных с затяжным, малосимптом-ным течением, а также с тяжелыми и системными осложнениями в ходе болезни неуклонно растет.
В настоящее время принято считать, что в основе патогенеза большинства заболеваний средней и более тяжести, включая заболевания инфекционной этиологии, лежат общие и местные закономерности формирования синдрома системного воспаления. Продукты повреждения тканей и жизнедеятельности микроорганизмов, токсины и катабо-лические вещества, иммунные комплексы и ряд других факторов одномоментно и в разной степени выраженности активируют механизмы развертывания воспалительной реакции. Медиаторы — факторы, регулирующие воспалительный процесс.
Ранее считалось, что медиаторы и белки острой фазы воспаления оказывают только или преимущественно локальное воздействие. Сейчас же обосновано и доказано существенное системное влияние многих регуляторных молекул на уровне организма. В связи с этим в крови в зависимости от выраженности и тяжести воспалительных процессов могут накапливаться существенные концентрации веществ, оказывающих регуляторное влияние на течение системного воспалительного ответа, а следовательно, отражающих характер самого воспаления. Это позволяет лабораторной службе, определяя концентрацию такого вещества, а также динамику изменений его содержания, диагностировать и прогнозировать возникновение, течение и исход той или иной нозологической единицы. Одним из ярких примеров лабораторных маркеров наличия и тяжести воспалительной реакции в организме является С-реак-тивный белок (СРБ, CRP — от англ. C-reactive protein), ис-
пользование которого в пульмонологии сложилось исторически и в настоящий момент обусловлено его высокой диагностической значимостью.
СРБ — неспецифический белок острой фазы воспаления, являющийся а2-глобулином, относящимся по биохимической структуре к пентраксинам с молекулярной массой 115-135 кДа. Впервые данное вещество было обнаружено в крови больного пневмонией, вызванной Streptococcus pneumoniae, в лаборатории Oswald Avery (Rockefeller University, New York City) в конце 1920-х годов. Исследователи W.Til-let и T.Frances разделили на фракции белки S. pneumoniae, обнаружив при этом, что одна из них (впоследствии названная «фракция С») в присутствии ионизированного кальция осаждает белки, присутствующие в сыворотке крови пациентов с пневмонией. Позднее субстанцию «фракции С» исследователи назвали «С-полисахаридом пневмококка» (PnC), а белок крови, взаимодействующий с ней, — СРБ [10-12].
Впоследствии в 1940-х годах в ходе исследования свойств и диагностической значимости СРБ при инфек-ционно-воспалительных заболеваниях различной этиологии, тяжести и локализации было обнаружено устойчивое повышение его содержания в крови при острой фазе воспаления (в первые 4-6 ч болезни). Тогда же была обнаружена и доказана его этиологическая неспецифичность, так как повышенная концентрация СРБ наблюдалась при тяжелых травмах, ожоговой болезни и в послеоперационном периоде [13].
Позже ученые установили, что рост концентрации СРБ связан с увеличением его синтеза гепатоцитами, в меньшей степени — нейронами, почечными структурами, моноцитами, лимфоцитами и макрофагами альвеол под действием провоспалительных цитокинов — фактора некроза опухоли (ФНО-a), интерлейкина (ИЛ)-6, ИЛ-1 [14-16], т.е. цитокинов, которые вырабатываются в первые минуты развертывания воспалительной реакции.
В настоящее время в лабораторной медицине к современным методам диагностики предъявляются весьма однозначные требования: максимально раннее и достоверное изменение концентрации или активности, свидетельствующее о начале, изменении течения патологического процесса. Согласно общебиологическим закономерностям лабораторные маркеры системного воспаления опережают структурные изменения, а следовательно, могут рассматриваться как ранние предикторы возникновения и течения заболевания [16].
Логично предположить, что упомянутые ранее цитокины (ФНО-a, ИЛ-6, ИЛ-1), вырабатываемые иммунными клетками при контакте с патогеном в первые секунды взаимодействия, являются оптимальным лабораторным маркером диагностики воспалительного процесса. Однако данные вещества характеризуются очень коротким периодом полураспада и существенной неспецифичностью, что делает их использование в практической лабораторной медицине в качестве маркеров оценки тяжести течения и возможного исхода заболевания статистически нецелесообразным [17].
Совершенно иная логика использования в тех же целях вещества — продукта синтеза общего влияния провоспали-тельных цитокинов на гепатоциты — СРБ соответствует полностью современным лабораторным критериям ранней диагностики общей воспалительной реакции организма больного. Его концентрация в крови достоверно повышается более популяционно значимого уровня (5 мг/л) уже в течение первых 4-6 ч от момента альтерации, достигая максимума в течение 48 ч (24-72 ч — в зависимости от тяжести патологического процесса). Более того, известно, что она удваивается каждые первые 8 ч, достигая максимума через 36-50 ч, а на фоне тяжелого генерализованного системного воспаления может возрастать в короткое время в 100 и более раз [1, 18, 19].
Период полувыведения СРБ поразительно стабилен, очень мал в сравнении с другими белками крови и составляет 19 ч, являясь постоянной величиной на фоне полного здоровья и патологии. Благодаря таким характеристикам концентрация СРБ целиком и полностью определяется только скоростью его синтеза, которая прямо пропорционально отражает интенсивность воспалительного процесса [18, 19].
В сравнении с наиболее распространенными в практике маркерами воспалительной реакции — скоростью оседания эритроцитов и уровнем лейкоцитов — содержание СРБ не зависит от приема пищи, суточного диуреза, наличия и выраженности анемии/полицитемии, концентрации сывороточных белков, формы эритроцитов, половой принадлежности (исключением являются поздние сроки беременности, когда наблюдается физиологическое незначительное повышение концентрации СРБ), что позволяет использовать его в экспресс-лабораториях [1, 18, 19]. Отклонение в типовой динамике изменения концентрации СРБ может наблюдаться только в случае выраженной печеночной недостаточности, когда продукция данного белка снижается [1, 18, 20].
Исключительно важным диагностическим аспектом использования СРБ является тот факт, что как белок острой фазы воспаления он появляется в крови в существенных концентрациях намного раньше появления антител. Более того, критически значимым является и изменение содержания в крови СРБ при стихании воспалительного процесса, когда концентрация его значимо уменьшается в течение 4-9 ч [1, 18, 19].
Таким образом, в настоящий момент СРБ рассматривается как наиболее чувствительный «эталонный» лабораторный маркер системного воспаления, тканевого повреждения и инфекционной альтерации [1].
В практической медицине максимальный рост содержания СРБ в крови определяется при бактериальных (100 мг/л и выше), вирусных и системных грибковых инфекциях (10-30 мг/л), а также при некрозах и существенном повреждении тканей (инфаркте миокарда, ожоговой болезни, политравме, опухолевых некрозах).
СРБ, являясь одним из ключевых компонентов гуморального врожденного иммунитета, активирует моноциты, стимулирует экспрессию молекул адгезии VCAM-1, 1САМ-1, Е-селектина на поверхности эндотелиоцитов, способствуя опсонизации микроорганизмов и их фагоцитозу. Ключевым эффектом СРБ является активация белка С3 компонента системы комплемента. В основе данного процесса лежит распознавание и связывание фрагментов фосфоэтаноламина и фосфохолина, присутствующих в С-полисахаридах бактериальной стенки, СРБ (помимо него в этом процессе участвуют иммуноглобулин М и сывороточный амилоид Р), а также взаимодействие с М-фиколи-ном (М-АсоНп), способным к распознаванию патогенных микроорганизмов и участию в активации комплемента [21-23]. Также СРБ играет ключевую роль и в удалении из организма продуктов повреждения собственных тканей. Эту функцию острофазный белок реализует за счет возможности связывания с фосфатидилхолином — основным структурным элементом клеточных мембран, в физиологических условиях находящимся внутри клетки и при выраженной альтерации, апоптозе и некрозе «выворачивающимся» наружу в межклеточное пространство [24]. Имеются убедительные данные о том, что, помимо вышеописанной активации комплемента по классическому пути, СРБ за счет связывания с фактором Н, являющимся растворимым гликопротеином, циркулирующим в плазме, способен активировать компоненты системы комплемента и по альтернативному пути [21-24].
Многочисленные отечественные и зарубежные исследования позволяют говорить о высокой диагностической
Таблица 1. Наиболее критичные уровни концентрации СРБ и их клиническое значение у больных ВБП Table 1. The most critical levels of C-reactive protein concentration and its clinical significance in patients with community-acquired pneumonia
Концентрация СРБ, мг/л Интерпретация и значение
100-110 Госпитализация
>150 Неблагоприятный признак тяжелого течения, показание к интенсификации антибактериальной и дезинтоксикационной терапии
178-200 в первые 32 ч болезни Легионеллезная пневмония
160-170 в первые 32 ч болезни Пневмококковая пневмония
>48-50 ВБП у больных ХОБЛ, а также в случае дифференциальной диагностики с неспецифической патологией дыхательных путей и легких, туберкулезом
>28,5 ВБП у пациентов с сопутствующей хронической сердечной недостаточностью
<11 ВБП исключена
50-60 ВБП легкой степени тяжести
90-100 ВБП средней степени тяжести
130-150 Тяжелое течение ВБП
значимости определения концентрации СРБ у больных с подозрением на ВБП. Достоверно отмечено, что его использование диагностически оправдано, так как позволяет провести дифференциальный поиск, патогенетически обоснованную оценку тяжести, прогнозирование ранних и отдаленных осложнений, а также определить адекватность, чувствительность и достаточность проводимой антибактериальной терапии [25, 26].
Необходимо подчеркнуть, что благодаря наличию множества крупных и значимых исследований пороговые, диагностически достоверные уровни СРБ для диагностики как самой ВБП, так и ее различных осложнений и стадий существенно не варьируют и широко известны. Также определены и ключевые значения концентрации СРБ для различных по возрасту и тяжести заболевания когорт пациентов. По мнению подавляющего большинства авторов, диагностически значимый пороговый уровень СРБ при ВБП должен превышать 50 мг/л [27-29]. Высокоспецифичным для пневмонии является уровень концентрации СРБ более 100 мг/л, позволяя в неоднозначных случаях положительно решить вопрос о необходимости назначения эмпирической антибиотикотерапии [1, 27, 30]. Известна и полностью противоположная ситуация — содержание СРБ, при котором ВБП исключена (менее 11 мг/л) [27, 30].
В каждодневной работе врача общей практики и пульмонолога возникает потребность в дифференциальной диагностике между обострением хронической обструктив-ной болезни легких (ХОБЛ), ее инфекционными осложнениями, бронхиальной астмой, с одной стороны, и ВБП — с другой (табл. 1). Пороговое значение концентрации СРБ, позволяющее отделить больных ВБП от пациентов с обострением ХОБЛ, составляет 33 мг/л (большее значение свидетельствует о пневмонии) [30]. В случае проведения дифференциальной диагностики между бронхиальной астмой (ее осложнениями) и ВБП диагностически значимый уровень концентрации СРБ в крови, однозначно позволяющий достоверно установить наличие ВБП, составляет 48 мг/л и более [31]. В отечественной литературе общепризнанным и наиболее цитируемым пороговым со-
держанием СРБ для верификации ВБП признана величина в 51,5 мг/л [32].
Многочисленные попытки дифференцировать ВБП согласно этиологическому фактору (бактериальной или вирусной природы) по уровню концентрации СРБ в крови нельзя признать удачными, так как у большинства исследователей полученные результаты значимо разнятся. Это абсолютно логичный факт, так как, понимая механизм запуска и поддержания усиленного синтеза белков острой фазы воспаления, можно утверждать, что ключевым элементом, определяющим концентрацию СРБ, является не микроорганизм или вирус, а тяжесть воспалительной реакции (количество провоспалительных цитокинов), ее выраженность и степень деструкции легочной ткани. Только пневмококковая и легионеллезная пневмонии сопровождаются исключительно высоким содержанием СРБ, нехарактерным для пневмоний другой этиологии. Так, при пневмококковой этиологии ВБП концентрация СРБ, как правило, существенно больше 160 мг/л, а для легионеллез-ной пневмонии данный показатель чаще всего в дебюте заболевания не опускается ниже 170 мг/л (по некоторым данным, достигая 250 мг/л) [30, 33].
В отличие от отсутствующей корреляции между уровнем СРБ и этиологическим фактором ВБП, доказана и не подлежит сомнению корреляционная зависимость между концентрацией СРБ в крови, тяжестью и прогнозом ВБП. Так, по мнению большинства исследователей, уровень СРБ в крови в диапазоне 100-110 мг/л является независимым показателем необходимости срочной госпитализации больного [34, 35], а концентрация СРБ>150 мг/л — прогностически неблагоприятный признак тяжелого течения ВБП и должна служить поводом для интенсификации антибактериальной и дезинтоксикационной терапии. Определение концентрации СРБ в крови облегчает диагностический поиск у пациентов с хронической сердечной недостаточностью, когда кардиогенная симптоматика может завуалировать развитие ВБП. В таком случае клиницистам рекомендуется исходить из порогового уровня концентрации СРБ в 28,5 мг/л, свидетельствующего о развитии ВБП [8, 9].
Таблица 2. Динамика изменения концентрации СРБ и ее клиническая интерпретация у больных ВБП Table 2. Dynamics of C-reactive protein concentration and its clinical interpretation in patients with community-acquired pneumonia
Концентрация СРБ, мг/л Интерпретация и значение
Сохранение концентрации СРБ>100 мг/л на 4-е сутки антибиотикотерапии Неэффективность проводимой терапии
Рост концентрации СРБ на фоне антибиотикотерапии Рост риска развития осложнений и смертности
Снижение уровня СРБ менее чем на: • 60% от первоначального уровня на 3-и сутки • 90% от первоначального уровня на 7-е сутки Неэффективная антибиотекотерапия
Снижение уровня СРБ менее чем на 25% от первоначального уровня ко 2-му дню лечения и менее чем на 50% — к 4-му дню Повышение риска 30-дневной летальности
Обратная клиническая картина, характеризующаяся малым риском развития осложнений, исходно сопровождается низким значением концентрации СРБ и/или снижением в первые 72 ч после начала специфической терапии [36].
Неспецифичность СРБ как острофазного белка, отражающего тяжесть воспалительного процесса, позволяет эффективно использовать динамику изменений его концентрации в качестве маркера эффективности проводимой терапии (табл. 2) [34]. Доказано, что сохранение концентрации СРБ в крови свыше 100 мг/л на 4-е сутки анти-биотикотерапии свидетельствует о неэффективности терапии [37]. Более того, увеличение концентрации СРБ на фоне антибиотикотерапии является отрицательным прогностическим признаком, свидетельствующим о росте риска развития осложнений и смертности.
Снижение или нормализация концентрации СРБ в крови, согласно закономерностям течения воспаления как типового патологического процесса, должно также коррелировать с падением активности патологических процессов. Именно эта логика лежит в основе использования отсутствия или замедленного снижения уровня СРБ как прогностического маркера неэффективности проводимой антибактериальной терапии [38]. Кроме того, ежедневное определение СРБ позволяет существенно уменьшить продолжительность антибиотикотерапии, снизить частоту развития и тяжесть нежелательных лекарственных реакций, вероятность развития антибиотикорезистентности, а также сократить экономические и медицинские затраты на лечение больных тяжелой ВБП [39].
В настоящее время определение концентрации СРБ в крови больных ВБП регламентировано в ряде международных стандартов. Так, согласно рекомендациям Британского торакального общества, измерение содержания СРБ целесообразно проводить в начале антибиотикотерапии, а также через несколько дней [40]. Европейскими экспертами пороговое значение СРБ>100 мг/л при наличии клинических симптомов инфекционного поражения органов дыхательной системы положено в основу диагностики пневмонии и безотлагательного начала антибактериальной терапии. В современных условиях определение активности СРБ является обязательным при диагностике пневмонии у детей [41].
Противоположная картина описана при концентрациях СРБ<20 мг/л, когда на фоне симптомов поражения бронхов и/или легких необходимо проводить дополнительный диагностический поиск альтернативных причин страдания органов дыхательной системы (обострение хронического бронхита, тромбоэмболия легочной артерии, сердечная недостаточность и пр.) [34].
Таким образом, определение концентрации СРБ в крови является ценным лабораторным методом дифференциальной диагностики в терапии и пульмонологии, а также чувствительным критерием своевременного мониторинга эффективности антибактериальной терапии ВБП. Увеличение его концентрации в крови более 50 мг/л при наличии респираторной симптоматики с высокой долей вероятности указывает на наличие ВБП, а исходно высокая концентрация, длительное отсутствие динамики к снижению, а также увеличение концентрации коррелируют с неблагоприятным течением пневмонии и неэффективной анти-биотикотерапией. Более того, отсутствие существенного повышения содержания СРБ при наличии симптоматики поражения органов дыхательной системы должно направлять врача на диагностический поиск иной патологии, приведшей к данной клинической картине.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Conflict of interests. The author declare that there is not conflict of interests.
Литература/References
1. Титова О.Н., Кузубова Н.А., Лебедева Е.С. Биомаркеры прогноза тяжести течения и исхода внебольничной пневмонии. Мед. альянс. 2018;2:55-60.
[Titova O.N., Kuzubova N.A., Lebedeva E.S. Biomarkery prognoza tiazhesti techeniia i iskhoda vnebol’nichnoi pnevmonii. Med. al’ians. 2018; 2: 55-60 (in Russian).]
2. Бородулин Б.Е., Черногаева Г.Ю., Бородулина Е.А. и др. Летальность от внебольничной пневмонии в условиях многопрофильной больницы за 10 лет. Мед. альманах. 2012; 2 (21): 34-6. [Borodulin B.E., Chernogaeva G.Iu., Borodulina E.A. et al. Letal’nost’ ot vnebol’nichnoi pnevmonii v usloviiakh mnogoprofil’noi bol’nitsy za 10 let. Med. al’manakh. 2012; 2 (21): 34-6 (in Russian).]
3. Бородулина Е.А., Бородулин Б.Е., Поваляева Л.В. и др. Предикторы летальности от внебольничной пневмонии в современных условиях работы пульмонологического центра. Вестн. современ. клин. медицины. 2015; 8 (4): 19-22.
[Borodulina E.A., Borodulin B.E., Povaliaeva L.V. et al. Prediktory letal’nosti ot vnebol’nichnoi pnevmonii v sovremennykh usloviiakh raboty pul’monologicheskogo tsentra. Vestn. sovremen. klin. meditsiny. 2015; 8 (4): 19-22 (in Russian).]
4. Чучалин А.Г., Синопальников А.И., Козлов Р.С. и др. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике. М.: МАКМАХ, 2010. [Chuchalin A.G., Sinopal’nikov A.I., Kozlov R.S. et al. Vnebol’nichnaia pnevmoniia u vzroslykh: prakticheskie rekomendatsii po diagnostike, lecheniiu i profilaktike. Moscow: MAKMAKh, 2010 (in Russian).]
5. Muller B, Harbarth S, Stolz D et al. Diagnostic and prognostic accuracy of clinical and laboratory parameters in community-acquired pneumonia. BMC Infect Dis 2007; 7: 10.
6. Watkins RR, Lemonovich TL. Diagnosis and management of community-acquired pneumonia in adult. Am Fam Physician 2011; 83 (11): 1299-306.
7. Woodhead M et al. ERS/ESCMID Joint Task Force. Clin Microbiol Infect 2011; 17 (6): 1.
8. Бобылев А.А., Рачина С.А., Авдеев С.Н., Дехнич Н.Н. Клиническое значение определения С-реактивного белка в диагностике внебольничной пневмонии. Клин. фармакология и терапия. 2016; 25 (2): 32-42.
[Bobylev A.A., Rachina S.A., Avdeev S.N., Dekhnich N.N. Klinicheskoe znachenie opredeleniia S-reaktivnogo belka v diagnostike vnebol’nichnoi pnevmonii. Klin. farmakologiia i terapiia. 2016; 25 (2): 32-42 (in Russian).]
9. Бобылев А.А., Рачина С.А., Авдеев С.Н., Младов В.В. Перспективы применения биомаркеров для диагностики внебольничной пневмонии на фоне хронической сердечной недостаточности. Клин. фармакология и терапия. 2018; 27 (3): 16-25.
[Bobylev A.A., Rachina S.A., Avdeev S.N., Mladov V.V. Perspektivy primeneniia biomarkerov dlia diagnostiki vnebol’nichnoi pnevmonii na fone khronicheskoi serdechnoi nedostatochnosti. Klin. farmakologiia i terapiia. 2018; 27 (3): 16-25 (in Russian).]
10. Tillet W, Francis T. Serological reaction in pneumonia with a non-protein somatic fraction of Pneu-mococcus. J Exp Med 1930; 52: 561-71.
11. Ghose T. Oswald Avery: the professor, DNA, and the Nobel Prize that eluded him. Can Bull Med Hist 2004; 21 (1): 135-44.
12. Bottazzi B, Doni A, Garlanda C, Mantovani A. An integrated view of humoral innate immunity: pent-raxins as a paradigm. Ann Rev Immunol 2010; 28: 157-83.
13. MacLeod CM, Avery OT. The occurrence during acute infections of a protein not normally present in the blood: II. Isolation and properties of the reactive protein. J Exp Med 1941; 73 (2): 183-90.
14. Singh PP, Voleti B, Agrawal A. A novel RBP-J kappa-dependent switch from C/EBP beta to C/EBP zeta at the C/EBP binding site on the C-reactive protein promoter. J Immunol 2007; 178 (11): 7302-9.
15. Thompson D, Pepys MB, Wood SP. The physiological structure of human Creactive protein and its complex with phosphocholine. Structure 1999; 7 (2): 169-77.
16. Рыдловская А.В., Симбирцев А.С. Функциональный полиморфизм гена TNF-a и патология. Цитокины и воспаление. 2005; 4 (3): 4-10.
[Rydlovskaia A.V., Simbirtsev A.S. Funktsional’nyi polimorfizm gena TNF-a i patologiia. Tsitokiny i vospalenie. 2005; 4 (3): 4-10 (in Russian).]
17. Shaddock E.J. How and when to use common biomarkers in community-acquired pneumonia. Pneumonia (Nathan) 2016; 8: 17.
18. Young B, Greeson M, Gripps AW et al. C-reactive protein: a critical review. Pathology 1991; 23: 118-24.
19. Зайцев А.А., Кондратьева Т.В., Маджанова Е.Р. Диагностические и прогностические возможности количественного определения С-реактивного белка при внебольничной пневмонии. Воен.-мед. журн. 2013; 11: 35-40.
[Zaitsev A.A., Kondrat’eva T.V., Madzhanova E.R. Diagnosticheskie i prognosticheskie vozmozh-nosti kolichestvennogo opredeleniia S-reaktivnogo belka pri vnebol’nichnoi pnevmonii. Voen.-med. zhurn. 2013; 11: 35-40 (in Russian).]
20. Pepys MB, Hirschfield GM. C-reactive protein: a critical update. J Clin Invest 2003; 111: 1805-12.
21. Yuste J et al. Serum amyloid P aids complement-mediated immunity to Streptococcus pneumonia. PLoS Pathog 2007; 3 (9): 1208-19.
22. Brown JS et al. The classical pathway is the dominant complement pathway required for innate immunity to Streptococcus pneumoniae infection in mice. Proc Natl Acad Sci U S A 2002; 99 (26): 16969-74.
23. Kerr AR et al. Innate immune defense against pneumococcal pneumonia requires pulmonary complement component C3. Infect Immun 2005; 73 (7): 4245-52.
24. Li YP, Mold C, Du Clos TW. Sublytic complement attack exposes C-reactive protein binding sites on cell membranes. J Immunol 1994; 152 (6): 2995-3005.
25. Bauer S, Lamy O. Role of C-reactive protein in the diagnosis, prognosis and follow-up of community-acquired pneumonia. Rev Med Suisse 2010; 6 (269): 2068-70.
26. Van der Meer V, Neven A, Van den Broek P, Assendelft W. Diagnostic value of C reactive protein in infections of the lower respiratory tract: systematic review. BMJ 2005; 331 (7507): 26.
27. Flanders SA, Stein J, Shochat G et al. Performance of a bedside C-reactive protein test in the diagnosis of community-acquired pneumonia in adults with acute cough. Am J Med 2004; 116: 529-35.
28. Kang YA, Kwon SY, Yoon HI et al. Role of C-reactive protein and procalcitonin in differentiation of tuberculosis from bacterial community acquired pneumonia. Korean J Intern Med 2009; 24 (4): 337-42.
29. Steurer J, Held U, Spaar A et al. A decision aid to rule out pneumonia and reduce unnecessary prescriptions of antibiotics inprimary care patients with cough and fever. BMC Med 2011; 9: 56.
30. Almirall J, Bolipar I, Vidal J et al. Contribution of C-reactive protein to the diagnosis and assessment of severity of community-acquired pneumonia. Chest 2004; 125: 1335-42.
31. Bafadhel M, Clark TW, Reid C et al. Procalcitonin and C-reactive protein in hospitalized adult patients with communityacquired pneumonia or exacerbation of asthma or COPD. Chest 2011; 139 (6): 1410-8.
32. Авдеев С.Н., Баймаканова Г.Е., Зубаирова П.А. Возможности С-реактивного белка в диагностике бактериальной инфекции и пневмонии у больных с обострением хронической об-структивной болезни легких. Уральский мед. журн. 2008; 13: 19-24.
ИНФОРМАЦИЯ ОБ АВТОРЕ / INFORMATION ABOUT THE AUTHOR
[Avdeev S.N., Baimakanova G.E., Zubairova P.A. Vozmozhnosti S-reaktivnogo belka v diagnostike bakterial’noi infektsii i pnevmonii u bol’nykh s obostreniem khronicheskoi obstruktivnoi bolezni leg-kikh. Ural’skii med. zhurn. 2008; 13: 19-24 (in Russian).]
33. Garcia Vazquez E, Martines JA, Menza J et al. C-reactive protein levels in community-acquired pneumonia. Eur Respir J 2003; 21: 702-5.
34. Hohenthal U, Hurme S, Helenius H et al. Utility of C-reactive protein in assessing the disease severity and complications of community-acquired pneumonia. Clin Microbiol Infect 2009; 15 (11): 1026-32.
35. Chalmers JD, Singanayagam A, Scally C et al. Risk Factors for complicated parapneumonic effusion and empyema on presentation to hospital with community-acquired pneumonia. Thorax 2009; 64: 592-597.
36. Menendez R, Martinez R, Reyes S et al. Stability in community-acquired pneumonia: one step forward with markers? Thorax 2009; 64: 987-92.
37. Smith RP. C-reactive protein in simple community-acquired pneumonia. Chest 1995; 107: 1028-31.
38. Bruns AH, Oosterheert JJ, Hak E, Hoepelman AI. Usefulness of consecutive C-reactive protein measurements in follow-up of severe community-acquired pneumonia. Eur Respir J 2008; 32: 726-32.
39. Seligman R, Ramos-Lima LF, Oliveira VA et al. Biomarkers in community-acquired pneumonia: A state-of-the-art review. Clinics 2012; 67 (11): 1321-5.
40. Castro-Guardiola A, Armengou-Arxe A, Viedjo-Rodriguez A et al. Differential diagnosis between community-acquired pneumonia and non-pneumonia diseases of the chest in the emergency ward. Eur J Intern Med 2000; 11: 334-9.
41. Вахитов Х.М., Пикуза О.И., Вахитова Л.Ф. и др. Значение определения С-реактивного белка для дифференциальной диагностики бронхита и пневмонии у детей. Практ. медицина. 2012; 7 (63): 23.
[Vakhitov Kh.M., Pikuza O.I., Vakhitova L.F. et al. Znachenie opredeleniia S-reaktivnogo belka dlia dif-ferentsial’noi diagnostiki bronkhita i pnevmonii u detei. Prakt. meditsina. 2012; 7 (63): 23 (in Russian).]
Ершов Антон Валерьевич — д-р мед. наук, проф. каф. патофизиологии ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет), ст. науч. сотр. НИИ общей реаниматологии имени ВАНеговского, ФГБНУ ФНКЦ РР. E-mail: [email protected]; ORCID: https://orcid.org/0000-0001-5758-8552
Anton V. Ershov — D. Sci. (Med.), Prof., I.M. Sechenov First Moscow State Medical University (Sechenov University), Senior Res. Officer, V.A.Negovsky Institute of General Reanimatology, Federal Research and Clinical Center for Resuscitation and Rehabilitation. E-mail: [email protected]; ORCID: https://orcid.org/0000-0001 -5758-8552
Статья поступила в редакцию / The article received: 10.03.2019 Статья принята к печати / The article approved for publication: 24.04.2019
Названы маркеры тяжести течения COVID-19 » Медвестник
Минздрав назвал прогностические и лабораторные маркеры, по которым можно судить о тяжести течения коронавирусной инфекции. Данные приведены в седьмых рекомендациях по лечению больных COVID-19.
У большинства пациентов с COVID‑19 наблюдается нормальное число лейкоцитов. Тромбоцитопения выражена умеренно, более сильные изменения числа тромбоцитов наблюдаются среди пациентов с тяжелым течением заболевания и умерших от COVID‑19.
Клиническое значение имеют возрастание D‑димера в 3—4 раза и более от возрастной нормы, удлинение протромбинового времени и увеличение фибриногена. Необходимо учитывать повышение D-димера после 50 лет и при появлении хронических заболеваний. В этом случае расчет уровня может быть выполнен по формуле: возраст х 0,01 мкг/мл (при измерении в единицах FEU). Необходимо учитывать, что во время беременности D‑димер повышается.
Уровень С-реактивного белка — еще один прогностический маркер тяжести течения и прогноза заболевания. Этот показатель увеличивается у большинства пациентов. Одновременно с С-реактивным белком возрастает уровень интерлейкина-6, -10 и СОЭ.
Пациенты, которые нуждаются в госпитализации, имеют высокие уровни ИЛ‑6, ИЛ‑10 и TNF‑α и низкие уровни Т-лимфоцитов — CD4 и CD8.
При неблагоприятном течении заболевания может повышаться уровень ферритина.
В рекомендациях указаны признаки развития цитокинового шторма и острого респираторного дистресс-синдрома. Это внезапное нарастание клинических проявлений спустя 1—2 недели от начала инфекции, появление фебрильной температуры. Симптомы появляются на фоне изменений показателей крови: наблюдаются выраженное снижение лимфоцитов, увеличение D‑димера выше 1500 или его быстрое нарастание, интерлейкина-6 — выше 40 пг/мл, С‑реактивного белка — более 75 мг/л.
Для прогноза заболевания имеет значение прокальцитонин. При уровне 0,5 мкг/л высок риск присоединения бактериальной инфекции и неблагоприятного исхода.
Отличить вирус от бактериальной пневмонии с помощью С-реактивного белка
Согласно исследованию, опубликованному в BMC Pulmonary Medicine , сочетание повышенного С-реактивного белка (CRP) с клиническими признаками и симптомами может помочь дифференцировать бактериальную внебольничную пневмонию от вирусной у детей.
Австралийские исследователи проспективно набрали детей младше 17 лет с радиологически подтвержденной внебольничной пневмонией. Анкеты были заполнены родителями / опекунами для записи демографической и клинической информации, включая симптомы.Клинические наблюдения, включая частоту дыхания и сатурацию кислорода при поступлении, наивысшую измеренную температуру и потребность во внутривенном введении жидкости, кислородных добавках и респираторной поддержке были записаны на основе обзора диаграммы.
Образцы крови были протестированы на CRP, количество лейкоцитов, абсолютное количество нейтрофилов и посев крови. Плевральную жидкость оценивали с помощью микроскопии, посева и полимеразной цепной реакции (ПЦР) на бактериальные патогены. Мазок из носоглотки (NPS) был собран в течение 36 часов после презентации и протестирован на 14 респираторных вирусов: гриппа (A / h2N1, A / h4N2 и B), респираторно-синцитиального вируса, вируса парагриппа человека 1-3 типа, метапневмовируса человека, аденовируса. , риновирус и коронавирус человека (HCoV OC43, HCoV 229E, HCoV HKU1 и HCoV NL63).В мазке также были обнаружены 6 бактерий: Streptococcus pneumoniae , Staphylococcus aureus , Moraxella catarrhalis , Haemophilus influenzae , Mycoplasma pneumoniae и Chlamydophila.
Тяжесть заболевания оценивалась по шкале респираторного индекса тяжести у детей и стандарту роста детей Всемирной организации здравоохранения с оценками от -2 до 6, причем более высокие баллы указывали на повышенную тяжесть.Случаи были разделены на 3 категории: конкретные бактериальные случаи с клинической эмпиемой или ≥1 бактериального патогена, обнаруженного в крови / плевральной жидкости с помощью посева / ПЦР, предполагаемые вирусные случаи без эмпиемы или бактерий, обнаруженных в крови / плевральной жидкости, и ≥1 вирус, обнаруженный в NPS. и другие случаи пневмонии, не отвечающие ни одному из критериев, с обнаруженными в НПВ бактериями или без них.
В исследование было включено 230 детей: 30 с определенной бактериальной пневмонией, 118 с предполагаемой вирусной пневмонией и 82 с другими случаями пневмонии.Отмечены различия в клинических признаках и симптомах между группами. Больше случаев бактериальной пневмонии требовало внутривенного введения жидкости и кислорода, чем предполагалось вирусной или другой пневмонии. СРБ, количество лейкоцитов и абсолютное количество нейтрофилов были значительно выше в определенных бактериальных случаях. Для порога СРБ 72 мг / л площадь под кривой рабочей характеристики приемника составляла 0,82 для различения определенной бактериальной пневмонии от предполагаемой вирусной пневмонии. Комбинирование CRP либо с лихорадкой (≥38 ° C), либо с отсутствием ринореи улучшало дифференциацию.
Ограничения исследования включали то, что вирусная и другие группы пневмонии также могли иметь бактериальную пневмонию или смешанные инфекции. Половина детей ранее принимали антибиотики при зачислении, что могло повлиять на признаки и симптомы, биомаркеры и чувствительность бактериального посева.
Исследователи пришли к выводу, что сочетание повышенного уровня СРБ с наличием или отсутствием клинических признаков и симптомов отличает определенную бактериальную пневмонию от предполагаемой вирусной пневмонии лучше, чем один СРБ, и что «необходимы дальнейшие исследования для изучения [] комбинации биомаркеров и симптомов для использования в качестве критерия». окончательный диагностический инструмент.”
Раскрытие информации: Питер С. Ричмонд, MBBS, получает гранты от GlaxoSmithKline, Novavax, Medimmune и Janssen помимо представленных работ. Леа-Энн С. Киркхэм, доктор философии, имеет патент, выданный Pfizer.
Артикул
Bhuiyan MU, Blyth CC, West R, et al. Сочетание клинических симптомов и биомаркеров крови может улучшить различение бактериальной и вирусной внебольничной пневмонии у детей. BMC Pulm Med .2019; 19 (1): 71.
Диагностические маркеры внебольничной пневмонии — Ито
Введение
Среди инфекционных заболеваний во всем мире внебольничная пневмония (ВП) является одной из наиболее частых и важных причин госпитализации и смерти (1-3). ВП — это инфекция паренхимы легких, приобретенная в сообществе, а не в больнице или учреждении длительного ухода (4). ВП определяется как наличие тени инфильтрации легких на рентгенограмме грудной клетки и любых симптомов, таких как кашель, мокрота, лихорадка, одышка и боль в груди (1).Диагностика ВП иногда затруднена, потому что вирусы, грибки и микобактерии могут вызывать пневмонию, хотя основными возбудителями болезни являются бактерии. Кроме того, существует множество неинфекционных заболеваний при дифференциальной диагностике ВП, таких как отек легких, рак легких, острый респираторный дистресс-синдром и многие интерстициальные заболевания легких [криптогенная организующая пневмония (COP), эозинофильная пневмония, лекарственная пневмония. , и васкулит] (5).
Обычно мы отличаем пневмонию от других неинфекционных респираторных заболеваний путем всесторонней оценки, включая симптомы, лабораторные исследования и свойства инфильтративных теней в легких.Однако у некоторых пациентов с ВП, особенно у пожилых, нет кашля, мокроты, лихорадки и повышенного количества лейкоцитов (6-8). Поэтому мы обычно проводим анализы крови на биомаркеры, чтобы отличить ВП от других неинфекционных респираторных заболеваний. В настоящее время не существует биомаркеров, которые могли бы самостоятельно диагностировать ВП, но поиск идеального биомаркера пневмонии продолжается, и множество молекул подвергаются тщательному исследованию (9). В этой статье рассматриваются некоторые биомаркеры для диагностики ВП.
Воспалительные биомаркеры в CAP
Биомаркеры были определены как «характеристика, которая объективно измеряется и оценивается как индикатор нормальных биологических процессов, патогенных процессов или фармакологических реакций на терапевтическое вмешательство» (10). Идеальный диагностический биомаркер ВП должен быть повышен только при наличии бактериальной инфекции, а не при других инфекциях, таких как вирусные инфекции и грибковые инфекции, чтобы определить необходимость антибактериальной терапии.Кроме того, ожидается, что идеальный биомаркер будет прост для тестирования, быстро получать результаты и не будет дорогостоящим (11).
Избыточное назначение антибиотиков приведет к увеличению вероятности инфицирования устойчивыми к антибиотикам микроорганизмами (12,13). Следовательно, было бы полезно иметь либо быстрое обнаружение патогенов, вызывающих заболевание, либо наличие биомаркеров, указывающих на бактериальную инфекцию, требующую антибактериальной терапии (14).Многие биомаркеры были разработаны и используются для диагностики ВП (, таблица 1, ). Однако некоторые биомаркеры нельзя исследовать в повседневной клинической практике. Поэтому мы обычно используем некоторые биомаркеры, такие как количество лейкоцитов (WBC), скорость оседания эритроцитов (ESR), C-реактивный белок (CRP), прокальцитонин (PCT) и так далее. Из этих биомаркеров меньше полагаются на количество лейкоцитов и СОЭ, поскольку они имеют более низкую чувствительность и специфичность по сравнению с СРБ и ПКТ (15).Кроме того, ПКТ специфичен для бактериальной инфекции, и существует больше доказательств в поддержку его использования для дополнительной диагностики ВП, чем для других биомаркеров. Ниже рассмотрены характеристики и полезность каждого биомаркера в диагностике ВП.
Таблица 1 Общие воспалительные биомаркеры, используемые в диагностике ВППолная таблица
CRP
CRP представляет собой пентамерный белок массой 118 кДа, синтезируемый в клетках печени путем индукции интерлейкином-6 (IL-6), IL-1β и фактором некроза опухоли-α (TNF-α) всякий раз, когда возникает инфекция или воспаление ткани (16).Впервые СРБ был выявлен у пациентов с пневмококковой пневмонией в 1930 г. (17). У здоровых взрослых нормальная концентрация СРБ обычно составляет менее 5 мг / л (18). Секреция CRP начинается в течение 4–6 часов, а его уровень удваивается каждые 8 часов; затем он достигает максимального уровня в течение 36–50 часов. После снятия стимуляции уровень CRP падает относительно быстро, с периодом полувыведения 19 часов (19).
Фландрия et al. сообщил, что прикроватный тест на СРБ был полезен для прогнозирования ВБП у взрослых с острым кашлем (20).У 173 взрослых пациентов с острым кашлем, если пороговый уровень CRP составлял ≥40 мг / л, чувствительность, специфичность, отношение положительного и отрицательного правдоподобия для диагностики пневмонии составляли 70%, 90%, 6,9 и 0,33 соответственно. Кроме того, добавление CRP к правилу клинического прогноза Хекерлинга (температура> 37,8 ° C, пульс> 100 ударов в минуту, хрипы, снижение шума дыхания и отсутствие астмы) может улучшить площадь под кривой (AUC) (0,93) для диагностики пневмонии по сравнению только с оценкой Хекерлинга (AUC = 0.88) (20).
Штольц и др. оценил полезность CRP для прогнозирования пневмонии у пациентов с пневмонией, подтвержденной рентгенологически (21). Они показали, что специфичность для прогнозирования пневмонии составляла 91,2% при пороговом значении СРБ 100 мг / л (21).
Как описано выше, в некоторых исследованиях сообщалось, что СРБ был полезен для диагностики ВП, но СРБ не является специфическим биомаркером бактериальной инфекции, поскольку он может повышаться при злокачественных заболеваниях и заболеваниях коллагеновых сосудов (22,23).Кроме того, кортикостероидная терапия, по-видимому, снижает уровень СРБ (24). Таким образом, в BMJ в 2005 г. было заявлено, что «тестирование на С-реактивный белок не является ни достаточно чувствительным, чтобы исключить, ни достаточно специфическим, чтобы исключить как инфильтрат на рентгенограмме грудной клетки, так и бактериальную этиологию инфекции нижних дыхательных путей» (25).
PCT
PCT представляет собой пептид-предшественник кальцитонина массой 13 кДа, содержащий 116 аминокислот, о котором впервые было сообщено в медицинской литературе в 1975 году (26).Обычно он продуцируется С-клетками щитовидной железы (27). Уровень ПКТ у здоровых взрослых очень низкий (<0,1 нг / мл) (28). В 1993 году Assicot впервые сообщил о повышении ПКТ у пациентов с сепсисом в исследовании ожоговых педиатрических пациентов (29). Когда происходит бактериальная инфекция, липополисахариды (LPS), IL-1β, IL-6 и TNF-α могут способствовать экспрессии гена CALC-I, и затем высвобождение ПКТ увеличивается из паренхиматозных тканей, таких как печень, почки, легкие, кишечник и мышцы (30,31). ПКТ высвобождается в течение 2–3 часов после бактериальной инфекции с пиком через 6 часов и периодом полувыведения примерно 22–35 часов (32–34).Уровни ПКТ ослабляются интерфероном-γ, высвобождаемым в ответ на вирусную инфекцию; следовательно, теоретически уровни ПКТ не повышаются при вирусных инфекциях. Системные стероиды не влияют на высвобождение ПКТ, в отличие от CRP (35). Характеристики PCT и CRP перечислены в Таблице 2 .
Что касается диагностики ВП, Müller et al. сообщил, что клинические признаки и симптомы, обычно используемые для диагностики ВП, имеют ограниченную ценность (36).Они также показали, что ПКТ является наиболее полезным биомаркером для дифференциации радиологически подтвержденной ВП (n = 373) от других неинфекционных заболеваний легких (n = 44) среди ПКТ, высокочувствительного СРБ, лейкоцитов и температуры. AUC ПКТ (0,88) был значительно выше, чем у высокочувствительного СРБ (0,76, P <0,001), лейкоцитов (0,69, P <0,001) и температуры (0,55, P <0,001) (36).
COP — одно из интерстициальных заболеваний легких, которое гистопатологически определяется внутриальвеолярными зачатками грануляционной ткани, состоящей из перемешанных миофибробластов, фибробластов и соединительной ткани (37,38).КС иногда похожа по симптомам и рентгенологическим данным на ВП; поэтому на ранних стадиях бывает трудно отличить ВП от КС, и мы часто лечим пациентов с КС антимикробными препаратами. Есть несколько исследований, оценивающих полезность ПКТ для дифференциации ВП от КС (39–41). Колдитц и др. показал, что как PCT, так и CRP были значительно выше при CAP, чем при OP (медиана PCT 2,6 против 0,14 нг / мл, P <0,001; медиана CRP 266 против 140 мг / л, P = 0.014). Они также показали, что значение AUC ПКТ (0,90, 95% ДИ: 0,73–0,98) для диагностики ОП было значительно выше, чем у CRP (0,76, 95% ДИ: 0,57–0,90). Другое исследование Takeda et al. также сообщил, что уровни ПКТ и СРБ были значительно выше у пациентов с ВП, чем у пациентов с ХОБ (40). Однако их исследования включали небольшое количество пациентов с OP (исследование Kolditz, n = 15) или пациентов с COP (исследование Takeda, n = 16). Поэтому мы исследовали полезность ПКТ для дифференциации ВП от КС у 56 пациентов с ВП и 914 госпитализированных пациентов с ВП (41).Диагностическая точность была значительно выше для ПКТ (AUC 0,79), чем для WBC (AUC 0,69, P = 0,048) и CRP (AUC 0,60, P <0,001). Когда пороговое значение ПКТ составляло 0,25 нг / мл, чувствительность и специфичность для отличия ВП от КС составляли 83,9% и 61,1% соответственно (41).
Что касается корреляции с возбудителями ВП и ПКТ, то уровни ПКТ у пациентов с классической бактериальной пневмонией (n = 27, медиана 1,41 мкг / л) были выше, чем у пациентов с атипичной пневмонией (n = 9, медиана 0.05) (42). В этом исследовании только у одного атипичного пациента (11,1%) уровень ПКТ был ≥0,5 мкг / л, тогда как у 21 из 27 пациентов с бактериальной пневмонией (77,8%) уровень ПКТ был ≥0,5 мкг / л (42). После этого Krüger et al. сравнил уровни ПКТ среди 5 групп (типичные бактериальные патогены, атипичные патогены, вирус, смешанная инфекция и неизвестная этиология) у 1337 пациентов с ВП (43). Они сообщили, что уровни ПКТ типичных бактериальных патогенов были значительно выше, чем у атипичных патогенов (P <0.01) и вирусов (P <0,01) (43). Мы также сообщили, что уровни ПКТ у пациентов с бактериальной пневмонией (медиана 1,85 нг / мл) были значительно выше, чем у пациентов с атипичной пневмонией, за исключением пневмонии Legionella (медиана 0,41 нг / мл) (44). Кроме того, мы показали, что значения CRP существенно не различались между пациентами с бактериальной и атипичной пневмонией (44). Self et al. показал, что средние значения ПКТ (нг / мл) у пациентов с вирусами, атипичными бактериями, типичными бактериальными, микобактериальными / грибковыми и пациентами с неизвестной этиологией были равны 0.09, 0,20, 2,5, 0,19 и 0,14 соответственно, а значения ПКТ у пациентов с типичной бактериальной этиологией были значительно выше, чем у пациентов с вирусной этиологией (P <0,01) (45). Однако из 169 пациентов с типичной бактериальной пневмонией 39 (23,1%) имели ПКТ <0,25 нг / мл, а 21 (12,4%) имели ПКТ <0,1 нг / мл (45). Естественно, мы не можем обнаружить этиологические патогены на основе уровней ПКТ и должны лечить антибиотиками, если мы клинически подозреваем, что у пациентов есть бактериальная пневмония, потому что есть некоторые пациенты с бактериальной пневмонией, у которых уровень ПКТ ниже 0.25 нг / мл. Однако, основываясь на предыдущих отчетах, мы можем предположить этиологическую группу патогенов, например, бактериальные патогены или атипичные патогены и вирусы.
Как мы указали выше, существует много сообщений о полезности ПКТ для дифференциации ВП от других респираторных заболеваний и бактериальной от атипичной или вирусной пневмонии. Однако есть некоторые ограничения использования ПКТ из-за ложноположительных и ложноотрицательных результатов; ложноположительные и ложноотрицательные ситуации перечислены в Таблице 3 .В частности, значения ПКТ могут быть менее 0,25 нг / мл из-за измерения вскоре после появления симптомов. Следовательно, важно измерять ПКТ серийно в течение 6–24 часов, как указано в алгоритмах, основанных на ПКТ (46).
Таблица 3 Причины ложноположительных и ложноотрицательных результатов ПКТПолная таблица
Растворимый запускающий рецептор, экспрессируемый на миелоидных клетках-1 (sTREM-1)
Триггерный рецептор, экспрессируемый на миелоидной клетке 1 (TREM-1), является гликопротеином из семейства иммуноглобулинов (47), который впервые был идентифицирован как на миелоидных клетках человека, так и на мышиных, особенно нейтрофилах, зрелых моноцитах и макрофагах (48).TREM-1 значительно повышается в коже, биологических жидкостях и тканях при возникновении бактериальных и грибковых инфекций, но не повышается при неинфекционных воспалительных состояниях (49). TREM-1 существует как в мембранной, так и в растворимой форме (sTREM-1), а sTREM-1 высвобождается и может быть измерен в нескольких жидкостях организма (48).
Richeldi et al. сообщил, что экспрессия TREM-1 на поверхности альвеолярных нейтрофилов и макрофагов была увеличена при бактериальной пневмонии по сравнению с неинфекционными интерстициальными заболеваниями легких, хотя экспрессия TREM-1 в нейтрофилах периферической крови у этих пациентов была сходной (50).Кроме того, Gibot et al. показали, что альвеолярные концентрации sTREM-1 позволяют предсказать легочную инфекцию и работают лучше, чем любые другие клинические или биологические результаты, как у пациентов с ВП, которым требовалась искусственная вентиляция легких (n = 38), так и у пациентов с связанной с ИВЛ пневмонией (n = 46) (51). ). Площадь под кривой рабочих характеристик приемника sTREM-1 для дифференциации наличия от отсутствия пневмонии составляла 0,93 (95% ДИ: 0,92–0,95) (51). Когда пороговое значение sTREM-1 составляло 5 пг / мл, чувствительность и специфичность составляли 98% и 90% соответственно (51).Huh et al. также сообщил, что концентрации sTREM-1 в жидкости бронхоальвеолярного лаважа (БАЛ) пациентов с двусторонними инфильтратами легких были значительно выше у пациентов с бактериальной или грибковой пневмонией (n = 29, 521,2 ± 94,7 пг / мл), чем у пациентов с вирусной или атипичной пневмонией ( n = 14, 92,9 ± 20,0 пг / мл, P <0,05) и пациенты с неинфекционными заболеваниями (n = 37, 92,8 ± 10,7 пг / мл, P <0,05) (52). На множественном логистическом регрессионном анализе они показали, что уровень sTREM-1 (пороговое значение ≥184 пг / мл) в жидкости БАЛ является независимым предиктором бактериальной или грибковой пневмонии с отношением шансов 59.742 (52).
Однако все эти исследования показали полезность sTREM-1 в ЖБАЛ для диагностики пневмонии, и было немного сообщений, показывающих полезность сывороточного sTREM-1 для диагностики пациентов с пневмонией. Действительно, Müller et al. показали, что уровни sTREM-1 в плазме и сыворотке пациентов с ВП при поступлении существенно не различались в зависимости от тяжести пневмонии [легкая против тяжелой (медиана, межквартильный размах), 93,3 (44.1–165,2) против 79,1 (45,8–154,1), P = 0,31] (53). Другое исследование Esposito et al. обнаружил, что уровни sTREM-1 в плазме плохо дифференцируют бактериальную и вирусную ВБП у 433 госпитализированных педиатрических пациентов (AUC 0,50, 95% ДИ: 0,45–0,56) (54).
Обычно мы не проводим рутинные исследования БАЛ для пациентов с ВП, особенно в легких и умеренных случаях, потому что это относительно инвазивная процедура. Поэтому мы считаем, что sTREM-1 не является полезным биомаркером для диагностики пневмонии.
Про-адреномедуллин (проАДМ)
ADM вырабатывается физиологическим стрессом и обладает сосудорасширяющей активностью, бактерицидной активностью и противовоспалительными свойствами. Хирата сообщил, что уровни ADM увеличиваются в зависимости от тяжести заболевания у взрослых пациентов с сепсисом (55). Однако ADM быстро выводится из кровотока благодаря быстрому связыванию с рецепторами и его периоду полураспада 22 минуты (56). Поэтому midregional-proADM (MR-proADM), предшественник ADM, используется в повседневной клинической практике из-за его стабильности (57).
Krüger et al. показал, что MR-proADM был лучшим предиктором 28-дневной и 180-дневной смертности среди WBC, CRP, PCT, копептина, CT-proET-1, MR-proANP и MR-proADM у 728 пациентов с ВП (58). Кроме того, Bello et al. показал, что MR-proADM был единственным биомаркером, способным прогнозировать краткосрочную и долгосрочную смертность среди MR-proADM, WBC, CRP и PCT у 228 госпитализированных пациентов с ВП (59). Однако в их исследовании уровни MR-proADM были почти одинаковыми между бактериальными [медиана (межквартильный размах), 0.909 нмоль / л (0,669–1,506 нмоль / л)] и пациенты с вирусной или атипичной пневмонией [медиана (межквартильный размах) 0,875 нмоль / л (0,606–1,155 нмоль / л)] (59). Таким образом, мы считаем, что MR-proADM бесполезен для дифференциации бактериальной пневмонии от вирусной и определения необходимости лечения антибиотиками.
Пресепсин
Пресепсин представляет собой белок массой 13 кДа и фрагмент моноцитарного LPS-рецептора CD14, который высвобождается в кровоток в процессе бактериального фагоцитоза.Yaegashi et al. сообщил, что уровни пресепсина у пациентов с сепсисом были значительно выше, чем у пациентов с SIRS и здоровых людей из контрольной группы (60). Кроме того, Endo et al. сообщил, что пресепсин имел диагностическую точность, аналогичную ПКТ, для дифференциации бактериальных и небактериальных инфекционных заболеваний в многоцентровом проспективном исследовании в Японии (AUC пресепсина составляла 0,908, а ПКТ — 0,825) (61).
У 72 пациентов интенсивной терапии, поступивших по поводу острой дыхательной недостаточности, Klouche et al. сообщил, что пресепсин был полезен для дифференциации тяжелой ВП от неинфекционной дыхательной недостаточности (AUC 0,85) (62). Когда пороговое значение пресепсина составляло 588 пг / мл, чувствительность и специфичность для диагностики пневмонии составляли 81% и 80% соответственно (62). В другом исследовании Qi et al. , уровни пресепсина у пациентов с активным туберкулезом легких были немного увеличены по сравнению со здоровым контролем [медиана (межквартильный размах) пг / мл, 218.0 (146,0–368,0) против 128,0 (101,5–176,5)] (63). Однако они также показали, что пресепсин был полезен для дифференциации бактериальной ВБП от активного туберкулеза легких (AUC 0,841) (63). Недавно Halıcı et al. сообщил, что пресепсин был полезен для диагностики пневмонии у пациентов с хронической обструктивной болезнью легких с обострениями (AUC 0,70) (64). Однако диагностическая точность пресепсина была не выше, чем ПКТ (AUC 0,72) и CRP (AUC 0,75) (64).
Есть лишь несколько исследований, в которых оценивалась полезность пресепсина для диагностики пневмонии.Таким образом, вопрос о том, является ли пресепсин полезным диагностическим биомаркером у пациентов с пневмонией в повседневной клинической практике, является спорным, и необходимы дальнейшие исследования.
Выводы
Биомаркеры полезны для дифференциации ВП от других неинфекционных респираторных заболеваний, но мы не должны полагаться только на биомаркеры; их следует использовать дополнительно. Поиск биомаркеров, которые имеют более высокую чувствительность и специфичность, чем существующие биомаркеры, для диагностики ВП и могут указывать на возбудители ВП, продолжаются, и есть надежда, что они будут идентифицированы.
Благодарности
Финансирование: Нет.
Происхождение и экспертная оценка: Эта статья была заказана приглашенными редакторами (Чжи-Де Ху, Бин Гу) для серии «Достижения в лабораторных тестах на инфекционные заболевания», опубликованной в Annals of Translational Medicine . Статья отправлена на внешнее рецензирование, организованное приглашенными редакторами и редакцией.
Конфликты интересов: Оба автора заполнили единую форму раскрытия информации ICMJE (доступна по адресу http://dx.doi.org/10.21037/atm.2020.02.182). Серия «Достижения в лабораторных исследованиях на инфекционные заболевания» была заказана редакцией без какого-либо финансирования и спонсорства. Компания TI получила гонорары от MSD K. AI не может заявлять о других конфликтах интересов.
Этическое заявление: Авторы несут ответственность за все аспекты работы, обеспечивая надлежащее расследование и решение вопросов, связанных с точностью или целостностью любой части работы.
Заявление об открытом доступе: Это статья в открытом доступе, распространяемая в соответствии с Международной лицензией Creative Commons Attribution-NonCommercial-NoDerivs 4.0 (CC BY-NC-ND 4.0), которая разрешает некоммерческое копирование и распространение статья со строгим условием, что в нее не вносятся изменения или правки, а оригинальная работа должным образом цитируется (включая ссылки как на официальную публикацию через соответствующий DOI, так и на лицензию). См. Https: // creativecommons.org / licenses / by-nc-nd / 4.0 /.
Список литературы
- Манделл Л.А., Вундерринк Р.Г., Анзуэто А. и др. Общество инфекционных болезней Америки; Американское торакальное общество. Общество инфекционных болезней Америки / Американское торакальное общество согласовали руководящие принципы ведения внебольничной пневмонии у взрослых. Clin Infect Dis 2007; 44: S27-72. [Crossref] [PubMed]
- Аневлавис С., Бурос Д. Внебольничная бактериальная пневмония.Экспертное мнение Pharmacother 2010; 11: 361-74. [Crossref] [PubMed]
- Руководство Комитета Японского респираторного общества по лечению пневмонии у взрослых, 2017 г. Руководство JRS по лечению пневмонии у взрослых, 2017 г. Токио: Японское респираторное общество, 2017 г.
- Уоткинс Р.Р., Лимонович Т.Л. Диагностика и лечение внебольничной пневмонии у взрослых. Am Fam Physician 2011; 83: 1299-306. [PubMed]
- Musher DM, Thorner AR.Внебольничная пневмония. N Engl J Med 2014; 371: 1619-28. [Crossref] [PubMed]
- Эспозито AL. Внебольничная бактериемическая пневмококковая пневмония. Влияние возраста на проявления и исход. Arch Intern Med 1984; 144: 945-8. [Crossref] [PubMed]
- Metlay JP, Schulz R, Li YH, et al. Влияние возраста на симптомы у пациентов с внебольничной пневмонией. Arch Intern Med 1997; 157: 1453-9. [Crossref] [PubMed]
- Janssens JP, Krause KH.Пневмония в очень старом возрасте. Lancet Infect Dis 2004; 4: 112-24. [Crossref] [PubMed]
- Morley D, Torres A, Cillóniz C и др. Предикторы неэффективности лечения и клинической стабильности у пациентов с внебольничной пневмонией. Энн Трансл Мед 2017; 5: 443. [Crossref] [PubMed]
- Рабочая группа по определениям биомаркеров. Биомаркеры и суррогатные конечные точки: предпочтительные определения и концептуальная основа. Clin Pharmacol Ther 2001; 69: 89-95. [Crossref] [PubMed]
- Каракиулаки М, Штольц Д.Биомаркеры пневмонии помимо прокальцитонина. Int J Mol Sci 2019; 20: 2004. [Crossref] [PubMed]
- Малхотра-Кумар С., Ламменс С., Коэнен С. и др. Влияние терапии азитромицином и кларитромицином на глоточное носительство макролидорезистентных стрептококков у здоровых добровольцев: рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет 2007; 369: 482-90. [Crossref] [PubMed]
- Хиллер С., Робертс З., Данстан Ф. и др. Предшествующие антибиотики и риск внебольничной инфекции мочевыводящих путей, устойчивой к антибиотикам: исследование случай-контроль.Журнал Antimicrob Chemother 2007; 60: 92-9. [Crossref] [PubMed]
- Сунгурлу С, Балк РА. Роль биомаркеров в диагностике и лечении пневмонии. Clin Chest Med 2018; 39: 691-701. [Crossref] [PubMed]
- Shaddock EJ. Как и когда использовать общие биомаркеры при внебольничной пневмонии. Пневмония 2016; 8:17. [Crossref] [PubMed]
- Мортенсен РФ. С-реактивный белок, воспаление и врожденный иммунитет. Immunol Res 2001; 24: 163-76.[Crossref] [PubMed]
- Tillett WS, Francis T. Серологические реакции при пневмонии с небелковой соматической фракцией пневмококка. J Exp Med 1930; 52: 561-71. [Crossref] [PubMed]
- Du Clos TW. С-реактивный белок как регулятор аутоиммунитета и воспаления. Arthritis Rheum 2003; 48: 1475-7. [Crossref] [PubMed]
- Póvoa P. C-реактивный белок: ценный маркер сепсиса. Intensive Care Med 2002; 28: 235-43.[Crossref] [PubMed]
- Flanders SA, Stein J, Shochat G, et al. Проведение прикроватного теста на С-реактивный белок в диагностике внебольничной пневмонии у взрослых с острым кашлем. Am J Med 2004; 116: 529-35. [Crossref] [PubMed]
- Stolz D, Christ-Crain M, Gencay MM, et al. Диагностическая ценность признаков, симптомов и лабораторных показателей при инфекциях нижних дыхательных путей. Swiss Med Wkly 2006; 136: 434-40. [PubMed]
- Нозо Т., Мацумата Т., Китамура М. и др.Значение предоперационного повышения уровня С-реактивного белка в сыворотке как индикатор прогноза колоректального рака. Am J Surg 1998; 176: 335-8. [Crossref] [PubMed]
- Otterness IG. Значение измерения С-реактивного белка при ревматоидном артрите. Semin Arthritis Rheum 1994; 24: 91-104. [Crossref] [PubMed]
- Юсеф Дж., Новосад С.А., Винтроп КЛ. Риск заражения и безопасность использования кортикостероидов. Rheum Dis Clin North Am. 2016; 42: 157-76.[Crossref] [PubMed]
- van der Meer V, Neven AK, van den Broek PJ, et al. Диагностическая ценность C-реактивного белка при инфекциях нижних дыхательных путей: систематический обзор. BMJ 2005; 331: 26. [Crossref] [PubMed]
- Moya F, Nieto A. R-Candela JL. Биосинтез кальцитонина: данные о предшественнике. Eur J Biochem 1975; 55: 407-13. [Crossref] [PubMed]
- Russwurm S, Oberhoffer M, Zipfel PF и др. Прокальцитонин — новый биохимический маркер медиаторно-направленной терапии сепсиса.Мол Мед Сегодня 1999; 5: 286-7. [Crossref] [PubMed]
- Boussekey N, Leroy O, Georges H, et al. Диагностические и прогностические значения уровней прокальцитонина при поступлении при внебольничной пневмонии в отделении интенсивной терапии. Инфекция 2005; 33: 257-63. [Crossref] [PubMed]
- Assicot M, Gendrel D, Carsin H и др. Высокие концентрации прокальцитонина в сыворотке крови у пациентов с сепсисом и инфекциями. Ланцет 1993; 341: 515-8. [Crossref] [PubMed]
- Müller B, White JC, Nylén ES, et al.Повсеместная экспрессия гена кальцитонина-i во многих тканях в ответ на сепсис. J. Clin Endocrinol Metab 2001; 86: 396-404. [PubMed]
- Linscheid P, Seboek D, Nylen ES, et al. Экспрессия гена кальцитонина I in vitro и in vivo в паренхимных клетках: новый продукт жировой ткани человека. Эндокринология 2003; 144: 5578-84. [Crossref] [PubMed]
- Дандона П., Никс Д., Уилсон М.Ф. и др. Повышение прокальцитонина после инъекции эндотоксина у здоровых людей.J. Clin Endocrinol Metab 1994; 79: 1605-8. [PubMed]
- Brunkhorst FM, Heinz U, Forycki ZF. Кинетика прокальцитонина при ятрогенном сепсисе. Intensive Care Med 1998; 24: 888-9. [Crossref] [PubMed]
- Рейнхарт К., Карзай В., Мейснер М. Прокальцитонин как маркер системного воспалительного ответа на инфекцию. Intensive Care Med 2000; 26: 1193-200. [Crossref] [PubMed]
- de Kruif MD, Lemaire LC, Giebelen IA, et al.Влияние кортикостероидов на высвобождение новых биомаркеров при эндотоксемии человека. Intensive Care Med 2008; 34: 518-22. [Crossref] [PubMed]
- Мюллер Б., Харбарт С., Штольц Д. и др. Диагностическая и прогностическая точность клинико-лабораторных показателей при внебольничной пневмонии. BMC Infect Dis 2007; 7: 10. [Crossref] [PubMed]
- Кордье JF. Криптогенная организующая пневмония. Eur Respir J 2006; 28: 422-46. [Crossref] [PubMed]
- Cottin V, Cordier JF.Криптогенная организующая пневмония. Semin Respir Crit Care Med 2012; 33: 462-75. [Crossref] [PubMed]
- Kolditz M, Halank M, Schulte-Hubbert B, et al. Прокальцитонин улучшает дифференциацию между инфекционной и криптогенной / вторично организующей пневмонией. Дж. Инфекция 2012; 64: 122-4. [Crossref] [PubMed]
- Такеда С., Нагата Н., Миядзаки Н. и др. Клиническая применимость прокальцитонина для дифференциации криптогенной организующей пневмонии и внебольничной пневмонии.Int J Clin Med 2015; 6: 372-6. [Crossref]
- Ито А., Исида Т., Тачибана Х. и др. Использование прокальцитонина для дифференциации криптогенной организующей пневмонии от внебольничной пневмонии. Clin Chem Lab Med 2019; 57: 1632-7. [Crossref] [PubMed]
- Hedlund J, Hansson LO. Уровни прокальцитонина и С-реактивного белка при внебольничной пневмонии: корреляция с этиологией и прогнозом. Инфекция 2000; 28: 68-73. [Crossref] [PubMed]
- Крюгер С., Эвиг С., Папассотириу Дж. И др.CAPNETZ Study Group. Воспалительные параметры позволяют прогнозировать этиологические закономерности, но не позволяют прогнозировать индивидуальную этиологию у пациентов с ВП: результаты немецкой сети компетенций CAPNETZ. Респир Рес 2009; 10: 65. [Crossref] [PubMed]
- Ито А., Исида Т., Тачибана Х. и др. Уровни прокальцитонина для прогнозирования прогноза внебольничной пневмонии. Респирология 2016; 21: 1459-64. [Crossref] [PubMed]
- Self WH, Balk RA, Grijalva CG, et al.Прокальцитонин как маркер этиологии у взрослых, госпитализированных с внебольничной пневмонией. Clin Infect Dis 2017; 65: 183-90. [Crossref] [PubMed]
- Schuetz P, Albrich W, Mueller B. Прокальцитонин для диагностики инфекции и руководство по выбору антибиотиков: прошлое, настоящее и будущее. BMC Med 2011; 9: 107. [Crossref] [PubMed]
- Salluh JIF, Souza-Dantas VC, Póvoa P. Текущее состояние биомаркеров для диагностики внутрибольничных пневмоний.Curr Opin Crit Care 2017; 23: 391-7. [Crossref] [PubMed]
- Lemarié J, Gibot S. Растворимый запускающий рецептор, экспрессируемый на миелоидных клетках-1: диагноз или прогноз? Crit Care Clin 2020; 36: 41-54. [Crossref] [PubMed]
- Bouchon A, Facchetti F, Weigand MA, et al. TREM-1 усиливает воспаление и является важным медиатором септического шока. Природа 2001; 410: 1103-7. [Crossref] [PubMed]
- Richeldi L, Mariani M, Losi M и др.Запускающий рецептор, экспрессируемый на миелоидных клетках: роль в диагностике легочных инфекций. Eur Respir J 2004; 24: 247-50. [Crossref] [PubMed]
- Гибот С., Кравуази А., Леви Б. и др. Растворимый пусковой рецептор, экспрессируемый на миелоидных клетках, и диагностика пневмонии. N Engl J Med 2004; 350: 451-8. [Crossref] [PubMed]
- Huh JW, Lim CM, Koh Y, et al. Диагностическая ценность растворимого пускового рецептора, экспрессируемого на миелоидных клетках-1, в жидкости бронхоальвеолярного лаважа пациентов с двусторонними инфильтратами легких.Crit Care 2008; 12: R6. [Crossref] [PubMed]
- Мюллер Б., Генчай М.М., Гибот С. и др. Уровни циркуляции растворимого пускового рецептора, экспрессируемого на миелоидных клетках (sTREM) -1, при внебольничной пневмонии. Crit Care Med 2007; 35: 990-1. [Crossref] [PubMed]
- Эспозито С., Ди Ганги М., Кардинале Ф. и др. Исследовательская группа Ita-CAP. Чувствительность и специфичность растворимого триггерного рецептора, экспрессируемого на миелоидных клетках-1, промежуточном проатриальном натрийуретическом пептиде и среднемрегиональном проадреномедуллине для определения этиологии и оценки степени тяжести внебольничной пневмонии.PLoS One 2016; 11: e0163262. [Crossref] [PubMed]
- Хирата Ю., Митака С., Сато К. и др. Повышенный уровень циркулирующего адреномедуллина, нового вазодилатирующего пептида, при сепсисе. J. Clin Endocrinol Metab 1996; 81: 1449-53. [PubMed]
- Morgenthaler NG, Struck J, Alonso C, et al. Измерение среднего уровня проадреномедуллина в плазме с помощью иммунолюминометрического анализа. Clin Chem 2005; 51: 1823-9. [Crossref] [PubMed]
- Struck J, Tao C, Morgenthaler NG и др.Идентификация фрагмента предшественника адреномедуллина в плазме больных сепсисом. Пептиды 2004; 25: 1369-72. [Crossref] [PubMed]
- Крюгер С., Эвиг С., Гирсдорф С. и др. Немецкая сеть компетенций по изучению внебольничной пневмонии (CAPNETZ), исследовательская группа. Сердечно-сосудистые и воспалительные биомаркеры для прогнозирования краткосрочной и долгосрочной выживаемости при внебольничной пневмонии: результаты Немецкой сети компетенций, CAPNETZ. Am J Respir Crit Care Med 2010; 182: 1426-34.[Crossref] [PubMed]
- Bello S, Lasierra AB, Mincholé E, et al. Прогностическая сила проадреномедуллина при внебольничной пневмонии не зависит от этиологии. Eur Respir J 2012; 39: 1144-55. [Crossref] [PubMed]
- Yaegashi Y, Shirakawa K, Sato N, et al. Оценка недавно идентифицированного растворимого подтипа CD14 как маркера сепсиса. Оценка недавно идентифицированного растворимого подтипа CD14 как маркера сепсиса. J. Infect Chemother 2005; 11: 234-8.[Crossref] [PubMed]
- Endo S, Suzuki Y, Takahashi G и др. Полезность пресепсина в диагностике сепсиса в многоцентровом проспективном исследовании. Журнал Infect Chemother 2012; 18: 891-7. [Crossref] [PubMed]
- Klouche K, Cristol JP, Devin J, et al. Диагностическая и прогностическая ценность растворимого подтипа CD14 (пресепсин) при сепсисе и внебольничной пневмонии у пациентов в отделении интенсивной терапии. Ann Intensive Care 2016; 6:59. [Crossref] [PubMed]
- Qi ZJ, Yu H, Zhang J, et al.Пресепсин как новый диагностический биомаркер для дифференциации активного туберкулеза легких от бактериальной внебольничной пневмонии. Clin Chim Acta 2018; 478: 152-6. [Crossref] [PubMed]
- Halıcı A, Hür I., Abatay K, et al. Роль пресепсина в диагностике обострения хронической обструктивной болезни легких с пневмонией. Биомарк Мед 2020; 14: 31-41. [Crossref] [PubMed]
Цитируйте эту статью как: Ito A, Ishida T. Диагностические маркеры внебольничной пневмонии.Энн Трансл Мед 2020; 8 (9): 609. doi: 10.21037 / atm.2020.02.182
Тестирование С-реактивного белка в пунктах оказания медицинской помощи при инфекциях дыхательных путей в первичной медико-санитарной помощи
ДЫХАТЕЛЬНЫЕ ИНФЕКЦИИ И АНТИБИОТИКИ В ПЕРВИЧНОЙ ПОМОЩИ
Большинство пероральных антибиотиков назначают в учреждениях первичной медико-санитарной помощи [1]. Большинство из них назначают пациентам, консультирующимся по поводу распространенных инфекций дыхательных путей (ИРО). В целом, чрезмерное назначение антибиотиков при инфекциях нижних дыхательных путей (ИДПТ) в первичной медико-санитарной помощи может быть связано с двумя различными факторами в рамках консультации по ИРТ:
- Диагностическая неопределенность клиницистов в дифференциации серьезного заболевания от самоограничивающегося
- Факторы, связанные с пациентом во время срочной консультации по ИРТ.
В первичной медико-санитарной помощи сложно отличить самоограничение от серьезных респираторных инфекций. Хотя большинство инфекций дыхательных путей проходят самостоятельно, некоторые из них потенциально опасны для жизни, например, пневмония, которая составляет небольшую, но клинически значимую часть всех инфекций нижних дыхательных путей в системе первичной медико-санитарной помощи.
Однако острый бронхит является причиной большинства эпизодов ИДП, которые обычно проходят самостоятельно. Точно дифференцировать пневмонию от острого бронхита на основании клинических данных из истории болезни и физикального обследования практически невозможно, так как клинические данные и рентгенологические данные пневмонии сильно расходятся [2–4].
Предполагаемый золотой стандарт диагностики пневмонии, рентген грудной клетки, обычно не используется в первичной медико-санитарной помощи по экономическим и логистическим причинам [5]. Кроме того, рентгенологические исследования рентгеновских снимков грудной клетки у пациентов с ИДП из первичной медико-санитарной помощи показывают значительные различия, что ставит под сомнение их надежность [6].
Превосходный золотой стандарт — компьютерная томография высокого разрешения — далеко неосуществима для пациентов с ИДП первичного звена [7]. Однако в свете возможной пневмонии и отсутствия доступного диагностического теста, чтобы исключить это состояние, многие семейные врачи (СП) эмпирически назначают антибиотики большинству пациентов с ИНДП как при пневмонии, так и при остром бронхите.
Несколько исследований показали, что для практикующих ПС потребности людей с потенциальными инфекциями и поддержание хороших отношений с пациентами перевешивают предполагаемый риск бактериальной резистентности [8-10]. Тем не менее, несмотря на это, многие ПС признают, что многие рецепты не нужны [11], и признают, что чувствуют себя некомфортно в этой конкретной ситуации [10].
Рекомендации по лечению в руководствах в основном основаны на клинических диагнозах [12]. Однако при очевидной неспособности точно поставить этот диагноз в первичной медико-санитарной помощи трудно следовать рекомендациям.Ежедневные решения о том, когда назначать антибиотики для лечения НИПТ, составляют значительную часть бремени использования антибиотиков, которое способствует устойчивости к антибиотикам [13]. Использование дополнительных диагностических тестов на месте оказания медицинской помощи может облегчить диагностический процесс.
В этой статье основное внимание будет уделено использованию С-реактивного белка в месте оказания медицинской помощи при ИРТ на основе исследований, проведенных в учреждениях первичной медико-санитарной помощи.
ТЕСТ С-РЕАКТИВНОГО БЕЛКА В ТОЧКЕ ПОМОЩИ НА ИРО В ПЕРВИЧНОЙ ЛЕЧЕНИИ
С-реактивный белок, первоначально названный так из-за его способности осаждать С-полисахарид Streptococcus pneumoniae, был первым описанным белком острой фазы [14].
Ответ острой фазы включает неспецифический физиологический и биохимический ответ на большинство форм повреждения тканей, инфекции и воспаления [15]. С-реактивный белок — широко используемый и признанный маркер для диагностики и мониторинга инфекций в учреждениях вторичной медико-санитарной помощи. С появлением устройств для оказания медицинской помощи в 1980-х годах Melbye et al . были первыми, кто оценил диагностическую ценность теста на ИДП в первичной медико-санитарной помощи [16].
К сожалению, широкое внедрение тестирования CRP в скандинавских странах не сопровождалось соответствующей подготовкой врачей.Следовательно, в некоторых условиях это иногда приводило к чрезмерному использованию теста на СРБ в основном при легких инфекциях дыхательных путей, за которым часто следовало ненужное лечение антибиотиками [17, 18].
Устойчивость тестов CRP в местах оказания помощи в настоящее время твердо подтверждена исследованиями, показывающими надежность и точность результатов тестов, полученных с устройств в местах оказания помощи, по сравнению с лабораторными стандартами [19-21].
Постепенно появились диагностические исследования, подтверждающие его роль в качестве дополнительного диагностического маркера при ИДП [3, 22, 23].Систематический обзор диагностической роли CRP при LRTI в первичной медико-санитарной помощи показал, что CRP является сильным предиктором дифференциации пневмонии от острого бронхита [24].
Было упомянуто несколько препятствий для внедрения CRP как части рутинного диагностического обследования при LRTI, включая нерешительность FP в отношении изменения существующих клинических процедур и отсутствие убедительных рандомизированных доказательств того, что использование CRP в местах оказания помощи может снизить количество антибиотиков. прописывание.
Клиницисты вторичного звена могут утверждать, что дополнительный диагностический тест должен различать бактериальные и вирусные инфекции.Тем не менее, на основании больших этиологических когорт ИРО мы знаем, что возбудители ИРО могут быть обнаружены только в небольшом количестве случаев ИРО в первичном звене [2, 3].
Таким образом, хотя эта цель относится к нацеливанию на соответствующее лечение антибиотиками во вторичной медико-санитарной помощи, диагностический тест в первичной медико-санитарной помощи не обязательно должен различать бактериальное и вирусное происхождение ИРТ.
Конечная цель такого теста состояла бы в том, чтобы помочь ПС отличить серьезные инфекции от самоограничивающихся и, как следствие, помочь им отказаться от приема антибиотиков в группе пациентов с последними.
ДОКАЗАТЕЛЬСТВА ПО ТЕСТИРОВАНИЮ НА СРБ НА ИРО В ПЕРВИЧНОЙ ЛЕЧЕНИИ
В Нидерландах недавно были проведены два испытания, изучающих влияние тестирования на места оказания помощи на СРБ в системе первичной медико-санитарной помощи. В первом участвовали 40 ПП и 431 пациент с ИДП [25].
ПС в группе, проходившей тестирование в месте оказания помощи, прописали значительно меньше антибиотиков, чем в группе без тестирования (31% против 53%, P = 0,02). Аналогичным образом, FP в группе FP, специально обученной улучшенным коммуникативным навыкам, прописали значительно меньше антибиотиков, чем в группе без обучения (27% против 54%, P
Оба вмешательства показали статистически значимое влияние на назначение антибиотиков в любой момент в течение 28-дневного периода наблюдения.Клиницисты в группе комбинированного вмешательства прописали антибиотики только 23% пациентов, в то время как обычные медицинские работники сделали это 68%.
Важно отметить, что выздоровление пациентов, удовлетворенность уходом и поддержкой во всех группах исследования были одинаковыми. Вмешательства оказались рентабельными [26].
FP в первом испытании выразили трудности в работе с промежуточно повышенными результатами тестов (20–100 мг / л) и объяснении их своим пациентам [27], а промежуточно повышенные результаты CRP были независимо связаны с повторной консультацией [28].
Таким образом, было исследовано, может ли отсроченное назначение назначений подходящей стратегии назначения для этих пациентов, как у пациентов с НИПТ, так и у пациентов с риносинуситом. Во втором испытании участвовали 31 ПП и 258 пациентов с НИДП или риносинуситом. Был изучен эффект помощи СРБ в стратегиях назначения антибиотиков, включая отсроченное назначение, при консультациях с НИПТ и риносинуситом в первичной медико-санитарной помощи [29].
Пациенты в группе, получавшей CRP, использовали меньше антибиотиков (43.4%), чем пациенты контрольной группы (56,6%) после индексной консультации (p = 0,03). Эта разница оставалась значимой во время наблюдения (52,7% против 65,1%, p = 0,04). Просроченные рецепты в группе, получавшей CRP, выписывались только в меньшинстве случаев (23% против 72% в контрольной группе, p
Выздоровление во всех группах было одинаковым. Удовлетворенность лечением была выше у пациентов, получавших помощь CRP (стр.
ПРАКТИЧЕСКИЕ ВЫВОДЫ
Снижение диагностической неопределенности врача
Похоже, что основной вклад тестирования CRP в местах оказания медицинской помощи заключается в уменьшении неуверенности врача.В частности, результат теста CRP добавляет полезную информацию, которая помогает идентифицировать пациентов, не подверженных риску осложненного течения болезни. Мы наблюдали наибольшее снижение приема антибиотиков у пациентов с СРБ ниже 20 мг / л.
Это клинически значимо, так как у большинства пациентов, обращающихся в первичную медико-санитарную помощь, значения CRP ниже 20 мг / л. Следовательно, больше всего можно получить в этой конкретной группе при отказе от лечения антибиотиками у пациентов с СРБ ниже 20 мг / л, хотя и с учетом полной клинической картины и продолжительности заболевания.
Другие исследования обнаружили аналогичные возможности для ограничительного назначения в этой группе с низкими значениями CRP [30, 31].
Следовательно, наибольшая ценность тестирования CRP в местах оказания помощи заключается в исключении серьезного заболевания, что является ключевой задачей повседневной жизни FP.
Это подводит нас к решающей роли тестирования CRP в первичной медико-санитарной помощи; тест должен отличать серьезную болезнь от болезни, которая проходит самостоятельно. Так ФП удалось сократить количество выписываемых антибиотиков. Тест CRP не может использоваться как самостоятельный диагностический тест для пневмонии [24].
CRP, как и все другие биохимические тесты, всегда следует использовать в клиническом контексте конкретного пациента. Мы знаем, что отдельные признаки и симптомы имеют плохие рабочие характеристики в качестве диагностических тестов, но в сочетании они гораздо более полезны [32].
Температура тела, например, имеет плохие рабочие характеристики в качестве самостоятельного диагностического теста для пневмонии, но клиницисты всегда включают учет температуры в общую оценку пациентов с НИПТ, поскольку она дает дополнительную информацию.
Показания для тестирования CRP будут в качестве помощи для выявления пациентов с тяжелым заболеванием, реагирующим на антибиотики, и последующего отказа от приема антибиотиков у большой оставшейся группы пациентов с самоограничивающимся заболеванием. Таким образом, в некотором смысле CRP при ИРТ является не только диагностическим, но и прогностическим маркером.
СНИЖЕНИЕ НЕОПРЕДЕЛЕННОСТИ ПАЦИЕНТА И ОБЕСПЕЧЕНИЕ УБЕЖДЕНИЯ
Кроме того, тестирование CRP в местах оказания помощи сыграло роль в убеждении пациентов принять стратегию лечения, не связанную с антибиотиками.Это было часто упоминаемым преимуществом CRP со стороны FP, имеющих опыт использования теста, что также влияло на точку зрения пациента на болезнь [5].
Точно так же, как удовлетворенность пациента лечением связана с физическим осмотром [33], то же самое может применяться к CRP в отношении подтверждения. При изучении CRP в качестве дополнительного теста в дополнение к рутинным консультациям пациенты, которым проводился CRP, были более удовлетворены консультацией по сравнению с пациентами, получавшими лечение без теста, хотя все пациенты показали относительно высокую общую удовлетворенность уходом [29].
Кроме того, тестирование CRP в местах оказания помощи сыграло роль в убеждении пациентов принять стратегию лечения, не связанную с антибиотиками. Это было часто упоминаемым преимуществом CRP со стороны FP, имеющих опыт использования теста, что также влияло на точку зрения пациента на болезнь [5].
Точно так же, как удовлетворенность пациента лечением связана с физическим осмотром [33], то же самое может применяться к CRP в отношении подтверждения. При изучении CRP в качестве дополнительного теста в дополнение к рутинным консультациям пациенты, которым проводился CRP, были более удовлетворены консультацией по сравнению с пациентами, получавшими лечение без теста, хотя все пациенты показали относительно высокую общую удовлетворенность уходом [29].
ПРЕДЕЛЬНЫЕ ЗНАЧЕНИЯ И НЕОБХОДИМЫЕ РЕЗУЛЬТАТЫ ИСПЫТАНИЙ
Основываясь на опыте испытаний и повседневной практике, можно рекомендовать использование пороговых значений из таблицы I.
ТАБЛИЦА I: Рекомендации, основанные на уровнях CRP *
| Диапазон CRP | Рекомендация |
≤20 мг / л | Саморегулирующийся РТИ Отказ от приема антибиотиков |
21-50 мг / л | Большинство пациентов имеют самоограничивающийся ИРТ Важна оценка признаков, симптомов и факторов риска, а также СРБ В большинстве случаев не принимают антибиотики |
51-99 мг / л | Оценка признаков, симптомов, продолжительности заболевания, факторов риска и CRP имеет решающее значение Рассмотреть (отложить) прием антибиотиков при высокой степени тяжести заболевания |
≥ 100 мг / л | Тяжелая инфекция Выписать антибиотики |
В системе первичной медико-санитарной помощи примерно 75% пациентов с ИДП будут иметь СРБ 100 мг / л.Остальные 20% будут иметь промежуточно повышенный результат (21-99 мг / л).
Эти промежуточно повышенные результаты тестов оказались трудными для ПС, и их появление было независимо связано с повторной консультацией по инициативе пациента. Эта связь не была обнаружена, когда по результатам этих тестов было рекомендовано отсроченное назначение. Поразительно, что только меньшинство пациентов, которым проводился СРБ, выполнили отсроченный рецепт по сравнению с большинством в контрольной группе.
Помимо того факта, что отсроченные рецепты в группе CRP были лучше нацелены на промежуточно повышенные результаты, это интересное различие также можно объяснить обнадеживающей ролью CRP и объяснением FP, почему отсроченные рецепты выдаются для этого конкретного клинического презентация с соответствующим уровнем CRP.
СРАВНЕНИЕ С ДРУГИМИ БИОМАРКЕРАМИ
Другие потенциальные биомаркеры для дифференциации серьезной инфекции от самоограничивающейся, такие как прокальцитонин и липополисахаридсвязывающий белок, имеют несколько меньшую диагностическую точность при ИДП в первичной медико-санитарной помощи [34, 35].
Что касается первого, то есть доказательства того, что он может сократить количество выписываемых антибиотиков, но в настоящее время он недоступен в качестве теста на месте для первичной медико-санитарной помощи, и его стоимость значительна [36].
Это два существенных препятствия для рентабельного использования этого биомаркера при распространенных инфекциях в первичной медико-санитарной помощи. Таким образом, в настоящее время СРБ является наиболее многообещающим и экономически эффективным биомаркером, позволяющим изменить ситуацию с ИРТ первичного звена.
ЗАКЛЮЧЕНИЕ
Использование теста на СРБ при ИРО в первичной медико-санитарной помощи следует рекомендовать только при ИДП и риносинусите, и его следует использовать только:
- при поиске дополнительной диагностической или прогностической информации
- для уверенности пациентов
Использование показано на рис.1.
РИС. 1. Использование CRP у пациентов с ИРО
Пример из практики CRP
Расследования
Был проведен тест CRP в месте оказания медицинской помощи, который показал уровень CRP 18 мг / л (верхний предел нормы 10 мг / л).
Лечение
Изучив ожидания пациентов, терапевт использовал результат теста CRP, чтобы обсудить низкий риск пневмонии. Пациент согласился не назначать антибиотики, был проинформирован о предполагаемом течении болезни и получил инструкции для повторной консультации.Довольный и успокоенный, пациент вернулся домой.
Фон
У каждого пациента, обращающегося с острым кашлем или другими признаками инфекции нижних дыхательных путей (ИДПТ) в системе первичной медико-санитарной помощи, врачи общей практики (ВОП) должны решить, относится ли это к самоограничивающемуся состоянию или пневмонии, для которой необходимо лечение антибиотиками и последующее: вверх указаны. Несколько исследований показали, что дифференцировать пневмонию и другие причины ИДПТ только на основании клинических данных сложно. 1 Рентгенография грудной клетки считается золотым стандартом для диагностики пневмонии, 2,3 , но не выполнима для всех пациентов с ИНДП. Поэтому в большинстве случаев первоначальный подход включает эмпирическую терапию антибиотиками. Неопределенность диагноза, а также ожидания и удовлетворенность пациентов усиливают необоснованные назначения антибиотиков в первичной медико-санитарной помощи. 4,5 Следовательно, необходимы ранние маркеры для руководства терапевтами при выявлении пациентов, которым показаны антибиотики.Предлагаемый диагностический подход заключается в использовании теста в месте оказания медицинской помощи для определения С-реактивного белка (СРБ). 6-8
CRP — это белок острой фазы, продуцируемый в печени. Повышенное производство этого белка вызывается цитокинами, выделяемыми инфекцией или повреждением тканей. 9 Концентрация в сыворотке обычно ниже 10 мг / л, но может увеличиться до> 500 мг / л в течение нескольких дней в случае тяжелой инфекции. 9 Уровень CRP явно связан с вероятностью пневмонии 6,10 , и было показано, что этот маркер крови превосходит признаки и симптомы для диагностики пневмонии. 7 Однако этот диагностический тест полезен в качестве дополнения к клиническому заключению только тогда, когда его результаты могут значительно повысить диагностическую точность для выявления пневмонии. Помимо клинического заключения терапевта, диагностическая ценность теста на СРБ ограничена у тех пациентов, у которых терапевт уже ожидает низкого или высокого риска пневмонии. 11 Однако у большинства пациентов у терапевта остаются сомнения в диагностике после сбора анамнеза и медицинского осмотра.Доказано, что у всех этих пациентов СРБ помогает, особенно в снижении вероятности пневмонии. 11 Кроме того, количество прописываемых врачами антибиотиков было снижено за счет лечения ИДП под контролем СРБ. 8 ВОП любят CRP как образовательный инструмент, который дает им возможность объяснять пациентам, почему в антибиотиках вообще нет необходимости. 12
Несколько европейских руководств по лечению ИДПТ включили в диагностический процесс использование теста СРБ в месте оказания медицинской помощи.Уровень CRP ниже 20 указывает на низкий риск пневмонии, что делает ненужным лечение антибиотиками. Высокий уровень СРБ (> 100 мг / л) указывает на повышенную вероятность пневмонии, поэтому рекомендуется назначение антибиотиков. 13 В описанном выше случае пациента тест на СРБ помог терапевту воздержаться от назначения антибиотиков, сохранив при этом уверенность пациента.
Обсуждение
Этот отчет демонстрирует новый европейский подход к использованию CRP в качестве руководства для врачей общей практики при выявлении пневмонии и усилении целевого лечения антибиотиками у пациентов первичного звена с острым кашлем.Диагностическая ценность CRP у детей первичной медико-санитарной помощи с LRTI еще не сообщалась, но несколько исследовательских групп в настоящее время изучают это применение.
Следует принять во внимание, что, хотя цены за тест ограничены в ЕС, приобретение устройства CRP может быть дорогостоящим для общей практики. В качестве альтернативы обучение коммуникативным навыкам может позволить себе менее затратный, но столь же эффективный вариант сокращения назначения антибиотиков. 14 Еще одна проблема, связанная с CRP, — это возможность медикализации — пациенты, возвращающиеся с жалобами на LRTI, для повторного измерения уровня CRP.Это может увеличить как расходы на здравоохранение, так и требования к врачам общей практики обучать своих пациентов.
Также следует помнить, что СРБ является неспецифическим маркером воспаления и, следовательно, подвержен влиянию других факторов. Высокие значения могут быть обнаружены при других заболеваниях, таких как тромбоэмболия легочной артерии, инфаркт миокарда, злокачественные новообразования или одновременные инфекции в других местах (например, рожа). 15 Кроме того, нормальное значение может наблюдаться в начале эпизода болезни, до того, как будет установлена острая фаза ответа. 16 Таким образом, CRP всегда следует интерпретировать в сочетании с клинической оценкой.
Полезно ли тестирование СРБ в местах оказания помощи при назначении антибиотиков пациентам с инфекциями дыхательных путей? — BPJ 68
Посмотреть / скачать версию этой статьи в формате pdfЕжедневно по всей Новой Зеландии несколько пациентов обращаются к врачу общей практики с симптомами респираторного тракта. инфекция (ИРО). ИРТ может быть вызван рядом различных патогенов, и врачам, назначающим лекарства, регулярно задают вопрос: «Является ли этот ИРО самоограничивающимся и / или вирусного происхождения, или этому пациенту будут полезны антибиотики?» Желание не упустить диагноз пневмонии часто приводит к чрезмерному назначению антибиотиков пациентам с симптомами нижнего ИРТ, е.грамм. продуктивный кашель и грудные признаки.
Чтобы улучшить способность врачей точно диагностировать пневмонию, растет интерес к использованию C-реактивных устройства для тестирования белка (CRP), которые теперь доступны в Новой Зеландии. Данные свидетельствуют о том, что при соответствующем обучении Тестирование СРБ в стационаре у пациентов с ИРО может сократить ненужное назначение антибиотиков в двух конкретных клинических случаях. сценарии:
- Выявление пациентов с симптомами нижнего ИРТ, у которых маловероятно пневмония, i.е. где антибиотик не подходит
- Предоставление пациентам с верхним ИРТ, которые убеждены, что им «нужен» антибиотик, с подтверждением того, что рецепт антибиотик вряд ли принесет пользу
Повышенный СРБ — маркер бактериальной инфекции и других патологических процессов
СРБ в сыворотке крови является маркером острой фазы ряда патологических процессов, включая инфекцию, воспаление, травму. или инфаркт. 1 Уровень СРБ в сыворотке у «здорового» человека обычно составляет менее 5 мг / л; это начнет повышается через четыре-восемь часов после повреждения ткани, достигает пика в течение 24-72 часов и возвращается к норме через два-три дня после патологический процесс прекратился. 1 Бактериальные инфекции дыхательных путей обычно вызывают большую Повышение СРБ по сравнению с вирусными инфекциями.
Медицинские работники первичной медико-санитарной помощи, прошедшие соответствующую подготовку по использованию устройства на месте оказания медицинской помощи, могут получить Результаты CRP, которые для целей тестирования пациента с ИРО сопоставимы с результатами обычных лабораторных исследований. тестирование (см .: «Тестирование CRP в местах оказания помощи — быстрое, но точное ли оно?»).Тестирование в месте оказания медицинской помощи имеет то преимущество, что может немедленно предоставить клиницисту результат CRP, который может быть учтен в решениях о лечении.
Тестирование СРБ в месте оказания медицинской помощи может быть полезно для «исключения» пневмонии у пациентов с более низкими симптомами ИРТ.
Тестирование CRP в месте оказания помощи может помочь сократить ненужное назначение антибиотиков пациентам с вирусным более низким ИРТ за счет предоставление клиницисту большей уверенности в том, что у пациента нет пневмонии.
В декабре 2014 года Национальный институт здравоохранения и повышения квалификации Соединенного Королевства (NICE) выпустил руководящие принципы, рекомендующие что тестирование CRP в месте оказания медицинской помощи может быть полезно для руководства при назначении антибиотиков пациентам без клинического диагноза пневмонии, но с симптомами более низкого ИРТ, например кашель и хотя бы одно из: лихорадка, выделение мокроты, хрипы или грудная клетка дискомфорт. NICE рекомендует в данной клинической ситуации: 2
- Лечение антибиотиками не следует регулярно предлагать пациентам, если их уровень СРБ <20 мг / л, поскольку они маловероятны заболеть пневмонией
- Лечение антибиотиками следует в плановом порядке предлагать пациентам с симптомами более низкого ИРТ и уровнем СРБ> 100 мг / л, так как у них более высокая вероятность развития пневмонии, при отсутствии основного заболевания, такого как злокачественное новообразование или аутоиммунное заболевание. присутствует
У пациентов с симптомами нижнего ИРТ неясного происхождения и уровнем СРБ от 20 до 100 мг / л потребность в антибиотиках остается полагаться на клиническую оценку.Такие факторы, как сопутствующие заболевания, перенесенная пневмония в анамнезе и личные обстоятельства, например Если вы живете в одиночестве, это может иметь дополнительное значение при рассмотрении вопроса о назначении антибиотика. У пациентов в кому последствия пневмонии могут быть более серьезными, назначение антибиотика при первичной консультации может быть разумной стратегией, в то время как для пациентов с более низким риском можно рассмотреть возможность отсроченного назначения, т.е. если симптомы не исчезнут через несколько дней.
Для получения дополнительной информации см .: « Просроченная выписка рецептов при инфекциях дыхательных путей »
Тестирование СРБ в месте оказания медицинской помощи, когда симптомы указывают на верхний ИРТ
У пациентов с симптомами ИРО верхних отделов дыхательных путей, например сухой кашель, фарингит, ринит, чихание, значение обращения за медицинской помощью Тестирование CRP помогает убедить пациентов в том, что им не нужен антибиотик, если результат CRP подтверждает это. суждение. Уровень CRP <10 мг / л предполагает, что у пациента нет бактериальной инфекции и, следовательно, рецепт поскольку антибиотик, скорее всего, принесет больше вреда, чем пользы, 1 i.е. возможные побочные эффекты антибиотика перевешивают любые клинические преимущества (которые в большинстве случаев были бы незначительными).
Было показано, что тестирование CRP в месте оказания помощи снижает первоначальное назначение антибиотиков
Было показано, что тестирование CRP в месте оказания медицинской помощи снижает вероятность назначения пациентам с симптомами ИРО. антибиотик при первичной консультации, т. е. при первом обращении к врачу с симптомами.Метаанализ из 13 исследований, изучающих частоту назначения лекарств пациентам, у которых был диагностирован верхний или нижний ИРТ, обнаружили, что Использование теста на СРБ в медицинских учреждениях значительно сократило назначение антибиотиков на первичной консультации. 3 Всего, 44% пациентов с ИРТ, прошедших тестирование на СРБ в стационаре, при первой консультации прописали антибиотик, по сравнению с 63% тех, кто не проходил тестирование CRP. 3 Среди пациентов, вернувшихся для наблюдения консультации, те, кто прошел тестирование CRP в месте оказания медицинской помощи, имели несколько меньшую вероятность получения последующего рецепта для антибиотика.В течение 28 дней после первичной консультации 32% пациентов, прошедших тестирование CRP, получили антибиотик, по сравнению с 38% пациентов, у которых не было тестирования на CRP. Однако эта разница не была статистически достоверной. значительный. 3
В настоящее время нет доступных данных для измерения влияния тестирования CRP в местах оказания медицинской помощи на клинические исходы у пациентов. с ИРТ.
Комбинированный подход, включающий эффективное общение, лучше всего для сокращения назначения антибиотиков пациентам с ИРО
Как диагностическая неопределенность, так и неклинические факторы пациента, включая ожидания пациента от рецепта, могут повлиять на решение клинициста назначить антибиотики и на его способность выписывать рецепты на основе фактических данных.Учиться на основе общей практики в Нидерландах рандомизированные пациенты с симптомами более низкого ИРТ для получения медицинской помощи Тестирование CRP, улучшенное информирование о своем заболевании, сочетание CRP и улучшенного общения или обычного ухода. Клиницисты прошли обучение по тестированию на месте оказания медицинской помощи и улучшили коммуникативные навыки при заболевании. Результаты показал, что: 4
- Тестирование СРБ в местах оказания медицинской помощи и обучение коммуникации, ориентированное на заболевание, привели к сокращению назначения антибиотиков. для более низких ИРТ с сохранением выздоровления и удовлетворения пациента
- Наибольшее сокращение количества назначений антибиотиков для лечения низких ИРО произошло среди врачей общей практики, которые могли использовать оба подхода
Это говорит о том, что тестирование CRP в месте оказания медицинской помощи позволяет клиницистам быть более уверенными в своем решении о том, следует ли назначить пациенту с ИРО антибиотик.Однако эффективное общение с пациентами о естественных прогрессирование симптомов ИРТ и роль антибиотиков также являются важным элементом в достижении наилучших результатов.
Тестирование CRP в месте оказания помощи быстрое, но точное ли оно?
Устройства CRP в местах оказания помощи используют ферментативную реакцию для измерения концентрации CRP в образце крови, взятой из пальца. Производители заявляют, что сбор и анализ образцов могут быть выполнены обученными операторами в течение двух-трех минут. в использовании устройства.
Систематический обзор отношения врачей первичной медико-санитарной помощи к тестированию в местах оказания помощи выявил, что точность тестирования была препятствием для внедрения на практике. 5 Исследование, спонсируемое одним производителем, сравнивало эффективность тестирования CRP в месте оказания медицинской помощи с лабораторными исследованиями и обнаружила, что для венозной и капиллярной крови образцов было среднее различие CRP 1 мг / л по сравнению с лабораторным тестированием. 6
Обеспечение качества важно для всех тестов по месту оказания медицинской помощи, чтобы врачи были уверены в том, что они переводят полученные результаты.Рекомендуется обсудить мероприятия по обучению персонала с любым поставщиком перед тестированием CRP на месте. устройство куплено. Периодический внешний контроль качества, организуемый местной диагностической лабораторией, также гарантирует, что тестирование точность сохраняется.
Благодарность
Спасибо доценту Марку Томасу , специалисту по инфекционным заболеваниям Оклендского университета и DHB, Д-р Крис Хьюисон , клинический микробиолог, MedLab Central, Д-р Розмари Икрам , клинический микробиолог, Крайстчерч и Д-ру Кэму Кайлу , клиническому биохимику, Окленд, за экспертную оценку этой статьи.
Список литературы
- Кайл С. (Эд). Справочник патологии: руководство по интерпретации тестов на патологию. Новый Южный Уэльс: Sonic Healthcare, 2014.
- Национальный институт здравоохранения и передового опыта (NICE). Пневмония — диагностика и ведение внебольничных и госпитальная пневмония у взрослых. NICE, 2014. Доступно по адресу: www.nice.org.uk (дата обращения: июнь 2015 г.).
- Хуанг Ю., Чен Р., Ву Т. и др. Связь между тестированием на СРБ в медицинских учреждениях и назначением антибиотиков респираторного происхождения инфекции тракта: систематический обзор и метаанализ исследований первичной медико-санитарной помощи.Br J Gen Pract 2013; 63: e787–94.
- Калс Дж., Батлер С., Хопстакен Р. и др. Влияние тестирования на С-реактивный белок в месте оказания медицинской помощи и обучение общению навыки использования антибиотиков при инфекциях нижних дыхательных путей: кластерное рандомизированное исследование. BMJ 2009; 338: b1374.
- Jones CH, Howick J, Roberts NW, et al. Отношение врачей первичной медико-санитарной помощи к анализу крови в местах оказания медицинской помощи: систематический обзор качественных исследований. BMC Fam Pract 2013; 14: 117.
- Seamark DA, Backhouse SN, Powell R. Полевые испытания и валидация в условиях первичной медико-санитарной помощи теста на месте оказания медицинской помощи для С-реактивного белка. Энн Клин Биохим 2003; 40: 178–80.
врачей общей практики должны провести тесты на C-реактивный белок перед назначением антибиотиков для лечения пневмонии
врачам общей практики следует провести тест на C-реактивный белок (CRP), чтобы определить, следует ли лечить пациента антибиотиками, если неясно, есть ли у него пневмония Институт здравоохранения и передового опыта (NICE) сообщает.
Первое руководство NICE
[1]
по диагностике и лечению внебольничной и внутрибольничной пневмонии у взрослых нацелено на то, чтобы помочь терапевтам и больничным врачам следовать принципам антимикробного контроля, поэтому они назначают антибиотики только при необходимости.
Пациентам, которым необходимы антибиотики, следует назначать их как можно раньше, по словам Марка Бейкера, директора клинической практики NICE. «Точная оценка респираторных инфекций, таких как пневмония, позволяет медицинским работникам ответственно назначать лечение», — говорит он.«Это снижает как затраты, так и любой потенциальный вред от чрезмерного воздействия антибиотиков».
В руководстве рекомендуется, что если диагноз пневмонии не был поставлен после клинической оценки и неясно, следует ли назначать антибиотики, врачам общей практики следует рассмотреть возможность проведения теста на СРБ. Этот простой анализ крови в месте оказания медицинской помощи может дать оценку воспаления в организме в течение нескольких минут, а высокие уровни СРБ предполагают, что инфекция является бактериальной.
NICE рекомендует назначать антибиотики, если концентрация CRP превышает 100 мг / л.Отсроченный рецепт (рецепт для использования позже, если симптомы ухудшатся) следует рассмотреть, если концентрация CRP составляет от 20 мг / л до 100 мг / л, и антибиотики не следует регулярно предлагать, если концентрация CRP ниже 20 мг / литр.
«Если бы не было особенно ясно, есть ли у пациента пневмония или нет, тест CRP мог бы дать немного больше информации для терапевта, чтобы определить, вероятно ли это пневмония или серьезная инфекция, требующая антибиотиков, или более легкая нижняя — инфекция дыхательных путей или вирусная инфекция, при которой антибиотики не показаны », — говорит Тоби Кэпстик, ведущий респираторный фармацевт в Leeds Teaching Hospitals NHS Trust и председатель группы респираторной группы Ассоциации клинической аптеки Соединенного Королевства.«Потенциально это могло бы сократить количество случаев неправильного назначения антибиотиков в первичной медико-санитарной помощи».
Морин Бейкер, председатель Королевского колледжа врачей общей практики, говорит, что тест CRP является ценным инструментом, который врачи общей практики могут найти полезным при принятии решения о назначении антибиотиков, но она подчеркнула, что это «ориентировочный тест и то, что мы действительно делаем». необходимость — это окончательный тест ».
«Нам нужны дополнительные исследования для разработки более надежного, но доступного по цене — теста, а также срочная разработка новых антибиотиков для защиты населения от новых бактериальных инфекций и болезней в будущем», — говорит она.
Руководство NICE также включает рекомендации по типу антибиотиков, которые следует предлагать в зависимости от степени тяжести пневмонии. Пневмонию легкой степени тяжести следует лечить более коротким пятидневным курсом одного антибиотика вместо стандартного семидневного курса. Пациентам с внебольничной пневмонией легкой степени тяжести не следует назначать рутинную терапию фторхинолоном или двумя антибиотиками.
Чтобы уменьшить тревогу и избежать ненужных посещений, пациентам, лечившимся от пневмонии, следует сообщить, что симптомы должны неуклонно улучшаться после начала лечения, но что может потребоваться до шести месяцев, чтобы они вернулись к норме, сообщает NICE.
NICE сообщает, что ежегодно в Великобритании до 480 000 взрослых заболевают пневмонией. Он диагностируется у 5–12% взрослых, которые обращаются к терапевтам с симптомами инфекции нижних дыхательных путей, и 22–42% из них поступают в больницу, где уровень смертности составляет от 5% до 14%. От 1,2% до 10% взрослых, поступающих в больницу с внебольничной пневмонией, лечатся в отделении интенсивной терапии, и для этих пациентов риск смерти составляет более 30%, согласно руководству.
NICE рекомендует врачам общей практики использовать инструмент оценки риска, оценку CRB65 или CURB65, основанную на таких факторах, как возраст и наличие определенных симптомов (спутанность сознания, повышенная частота дыхания, низкое кровяное давление), чтобы определить, находятся ли пациенты на низком, среднем или низком уровне. или высокий риск смерти, и необходимость их госпитализации.В больнице диагностика (включая рентген) и лечение пневмонии должны проводиться в течение четырех часов после госпитализации.
Персонал больницы должен рассмотреть возможность измерения исходной концентрации CRP у пациентов с внебольничной пневмонией при поступлении в больницу и повторить тест, если клинический прогресс неуверен через 48–72 часов. NICE заявляет, что необходимы исследования, чтобы определить, можно ли использовать мониторинг СРБ в дополнение к клиническому наблюдению для определения продолжительности приема антибиотиков у пациентов, госпитализированных с внебольничной пневмонией средней и высокой степени тяжести, чтобы безопасно сократить общую продолжительность терапии.
Клинический потенциал С-реактивного белка и концентраций прокальцитонина в сыворотке для руководства дифференциальной диагностикой и клиническим лечением пневмококковой и легионеллезной пневмонии
РЕЗЮМЕ
Мы ретроспективно проанализировали записи 61 госпитализированного пациента с внебольничной пневмонией (ВП), вызванной S treptococcus pneumoniae или L egionella pneumophila . Мы обнаружили, что концентрации прокальцитонина и натрия в сыворотке были значительно ниже, а уровни ферритина были значительно выше у пациентов, инфицированных L.pneumophila , чем у инфицированных S. pneumoniae . Отношение С-реактивного белка к прокальцитонину значительно различается между группами. Высокий уровень прокальцитонина был связан с неблагоприятным клиническим течением.
Внебольничная пневмония (ВП) может быть вызвана Streptococcus pneumoniae или Legionella pneumophila (5, 19). Начало адекватной эмпирической антимикробной терапии может быть сложной задачей, поскольку S.pneumoniae и L. pneumophila имеют частично противоположные паттерны чувствительности к противомикробным препаратам (11). Таким образом, мы задались вопросом, может ли определение уровней С-реактивного белка (CRP) и прокальцитонина (PCT) в сыворотке быть полезным для дифференциальной диагностики инфекции S. pneumoniae или L. pneumophila . Хотя определение уровней СРБ может быть полезным для дифференциации вирусных и бактериальных легочных инфекций (7), повышенный уровень ПКТ был связан с плохим прогнозом при ВП, особенно при пневмонии Legionella (9, 15).Однако, в то время как ПКТ был связан с серьезностью основной причины, СРБ был более тесно связан с наличием инфекций в проспективном исследовании (8).
Мы ретроспективно проанализировали истории болезни 61 пациента, госпитализированного в Университетскую больницу Инсбрука (Инсбрук, Австрия) в период с 2005 по 2008 год с ВП, вызванным S. pneumoniae ( n = 37) или L. pneumophila . ( п = 24). Пневмония была диагностирована на основании клинических критериев и лабораторных доказательств инфекции и подтверждена рентгенологическими данными.Для диагностики видов использовались тесты на антиген в моче для S. pneumoniae или L. pneumophila , последний из которых выявлял серотип 1 (BinaxNOW; Inverness Medical, ME) (1, 4, 5, 10, 17).
Базовые лабораторные параметры были определены с помощью рутинных автоматизированных тестов, данные были доступны с 1-го дня (поступление) и с 5-го по 7-й день. Уровни ПКТ определялись с помощью анализа технологии эмиссии амплифицированного криптата с временным разрешением (Brahms AG, Henningsdorf, Германия) (2).
Все статистические анализы были выполнены с помощью статистического пакета SPSS (версия 11.5; SPSS, Чикаго, Иллинойс). Для ненормально распределенных данных. Применялись непараметрические критерии (критерий Манна-Уитни). Для анализа ассоциаций использовалась методика ранговой корреляции Спирмена. Все тесты были двусторонними, и значение P <0,05 указывало на статистическую значимость. Бинарный логистический регрессионный анализ использовался для определения параметров, позволяющих прогнозировать исходы пациентов. Было рассчитано отношение концентраций CRP к концентрациям PCT, и логарифмические значения были использованы для определения пороговых значений для различения между л.pneumophila и S. pneumoniae . Диагностическая ценность этих пороговых значений была оценена путем расчета чувствительности, специфичности, а также положительных и отрицательных прогностических значений (PPV и NPV).
Хотя никаких статистически значимых различий в отношении исходных демографических данных не было обнаружено между пациентами с ВП, страдающими инфекциями L. pneumophila по сравнению с инфекциями S. pneumoniae (см. Таблицу S1 в дополнительном материале), пациентами с L.pneumophila при пневмонии имели значительно более низкие уровни ПКТ при поступлении (среднее ± стандартная ошибка среднего [SEM], 6,76 ± 1,74 мкг / л), чем у пациентов с пневмонией S. pneumoniae (20,94 ± 3,99 мкг / л) ( P <0,01) (рис. 1А). Хотя уровни CRP существенно не различались между двумя группами, отношение log CRP / PCT позволило отличить пациентов, инфицированных L. pneumophila , и пациентов, инфицированных S. pneumoniae ( P <0.001) (рис. 1В). Отношение log CRP / PCT ниже 0,5 скорее указывает на инфекцию S. pneumoniae (NPV, 54,1%; PPV, 83,3%; чувствительность, 54,1%; специфичность, 83,3%), тогда как отношение log CRP / PCT превышает 1,25. с большей вероятностью отражает инфекцию L. pneumophila (NPV, 66,7%; PPV, 61,5%; чувствительность, 33,3%; специфичность, 86,5%).
Более того, мы наблюдали достоверные различия в концентрациях натрия (132 ± 1.0 ммоль / литр для L. pneumophila против 135 ± 1.0 ммоль / литр для S. pneumoniae ; P <0,02), мочевина (52,2 ± 7,1 мг / дл против 70,5 ± 5,8 мг / дл; P <0,01) и ферритин (1,372 ± 303 мкг / литр против 929 ± 496 мкг / литр; P <0,01) между двумя группами пациентов на исходном уровне (см. Таблицу S1 в дополнительных материалах). У умерших пациентов стабильно высокий уровень ПКТ (среднее значение ± SEM, 20,1 ± 10,3 мкг / литр для умерших пациентов по сравнению с 1,4 ± 0,5 мкг / литр для выживших; P <0.001) и CRP (13,3 ± 2,3 мг / дл для умерших пациентов по сравнению с 8,2 ± 1,3 мг / дл для выживших; P <0,02) (таблица 1) на 5-й день.
За период наблюдения 30 из 61 пациента были госпитализированы в отделение интенсивной терапии (ОИТ) для инвазивной или неинвазивной вентиляции легких. Факторами риска для поступления в ОИТ были высокие уровни CRP на 5 день (среднее ± SEM, 12,3 ± 1,7 мг / дл), высокие концентрации PCT (25,7 ± 4,6 мкг / литр в 1 день; 10,7 ± 5,2 мкг / литр на 5 день), нарушение функции почек, тромбопения и анемия (см. Таблицу S2 в дополнительном материале).Субъекты с уровнями ПКТ выше 10 мкг / л при поступлении (NPV, 77,8%; PPV, 84%; чувствительность, 72,4%; специфичность, 87,5%) или с логарифмическим соотношением CRP / PCT <0,5 при поступлении (NPV, 73%). ; PPV, 79,2%; чувствительность, 65,5%; специфичность, 84,4%) с большей вероятностью поступили в отделение интенсивной терапии, чем пациенты с уровнем ПКТ <10 мкг / л и / или отношением log CRP / PCT> 0,5.
Мы определили, что повышение уровня ПКТ в дни 1 и 5 также было связано с повышенным риском смерти ( P <0.05 в обоих случаях), а многомерный логистический регрессионный анализ показал, что тромбопения на 5-й день и в пожилом возрасте были факторами риска смерти.
Пациенты с инфекциями L. pneumophila , требующими лечения в отделении интенсивной терапии, находились в больнице дольше ( P <0,001), тогда как пациенты с пневмонией S. pneumoniae , поступившие в отделение интенсивной терапии, имели значительно более низкую выживаемость ( P <0,05), чем пациенты с неосложненным течением заболевания.
Алгоритм дифференциальной диагностики между инфекциями S. pneumophila и L. pneumophila может быть дополнительно полезен включением других параметров, таких как уровни натрия в сыворотке, поскольку гипонатриемия часто наблюдалась у пациентов с пневмонией L. pneumophila (см. Таблицу S1 в дополнительном материале) (6, 12, 13, 20). Наиболее поразительно то, что пациенты с инфекцией L. pneumophila имели значительно повышенный уровень ферритина, который является основным циркулирующим белком-хранилищем железа.Это представляет интерес, поскольку видов Legionella сильно зависят от достаточного количества железа (3). Однако ферритин также индуцируется воспалением, и ограничение железа моноцитами с последующим повышением уровня ферритина является краеугольным камнем развития анемии при хроническом заболевании (18). Таким образом, внутриклеточные и внеклеточные патогены могут вызывать противоположные регуляторные эффекты на гомеостаз железа (14, 16), что приводит к наблюдаемым различиям в экспрессии ферритина.
В заключение, наши данные связывают уровни ПКТ с тяжестью ВП и дополнительно предполагают, что комбинация СРБ и ПКТ имеет значение для дифференциальной диагностики между инфекциями L. pneumophila и S. pneumoniae . Последующие исследования с участием большего числа пациентов могут помочь в поиске пороговых значений для клинически полезных прогностических значений.
РИС. 1.Дифференциация ВП, вызванного Legionella pneumophila или Streptococcus pneumoniae , по воспалительным параметрам.Коробчатые диаграммы уровней ПКТ (мкг / литр) и CRP (мг / дл), определенных для пациентов с S. pneumoniae ( n = 37) или L. pneumophila ( n = 24) пневмонией при поступлении (A) и логарифмических соотношений CRP / PCT (B). Группы сравнивали с помощью непараметрического U-критерия Манна-Уитни. Различия между соответствующими группами считались значимыми, если значения P были ниже 0,05.
ТАБЛИЦА 1.Сравнение лабораторных показателей, сопутствующих заболеваний и демографических данных между выжившими и пациентами, умершими от Legionella или пневмококковой пневмонии
БЛАГОДАРНОСТИ
Это исследование было поддержано грантом Австрийского исследовательского фонда FWF-P19664 и фондом «Verein». zur Förderung von Forschung und Weiterbildung в области молекулярной иммунологии и инфекций в медицинском университете Инсбрука.
СНОСКИ
- Получено 10 июля 2009 г.
- Возвращено для модификации 4 января 2010 г.
- Принято 25 февраля 2010 г.
- Авторское право © Американское общество микробиологии, 2010 г.,
ССЫЛКИ
- 20945. ↵
- 2.↵
Christ-Crain, M., D. Stolz, R. Bingisser, C. Mueller, D. Miedinger, PR Huber, W. Zimmerli, S. Harbarth, M. Tamm, and B. Мюллер. 2006. Прокальцитонин: руководство по антибактериальной терапии внебольничной пневмонии: рандомизированное исследование. Являюсь. J. Respir. Крит. Медицинское обслуживание 174 : 84-93.
- 3.↵
Cianciotto, N. P. 2007. Приобретение железа Legionella pneumophila .Biometals20 : 323-331.
- 4.↵
дель Мар Гарсиа-Суарес, М., М. Д. Чима-Кабал, Р. Вильяверде, Э. Эспиноса, М. Фальгера, Х. Р. де лос Тойос, Ф. Васкес и Ф. Х. Мендес. 2007. Проведение иммуноферментного анализа пневмолизина для диагностики пневмококковых инфекций. J. Clin. Microbiol.45 : 3549-3554.
- 5.↵
Дидерен, Б. М. 2008. Legionella spp. и болезнь легионеров.J. Infect. 56 : 1-12.
- 6.↵
эль-Эбиари, М., Х. Сармиенто, А. Торрес, С. Ногуэ, Э. Месаллес, М. Боди и Дж. Альмиралл. 1997. Факторы прогноза тяжелой пневмонии Legionella , требующей госпитализации. Являюсь. J. Respir. Крит. Медицинское обслуживание 156 : 1467-1472.
- 7.
Flanders, S. A., J. Stein, G. Shochat, K. Selers, M. Holland, J. Maselli, W. L. Drew, A. L. Reingold и R. Gonzales. 2004. Проведение прикроватного теста на С-реактивный белок в диагностике внебольничной пневмонии у взрослых с острым кашлем. Являюсь. J. Med. 116 : 529-535.
- 8.↵
Гайни, С., О. Г. Колдкьяер, К. Педерсен и С. С. Педерсен. 2006. Прокальцитонин, липополисахарид-связывающий белок, интерлейкин-6 и С-реактивный белок при внебольничных инфекциях и сепсисе: перспективное исследование. Крит. Care10 : R53.
- 9.№
Haeuptle, J., R. Zaborsky, R. Fiumefreddo, A. Trampuz, I. Steffen, R. Frei, M. Christ-Crain, B. Mueller и P. Schuetz. 2009. Прогностическое значение прокальцитонина при пневмонии Legionella . Евро. J. Clin. Microbiol. Заразить. Дис. 28 : 55-60.
- 10.↵
Хельбиг, Дж. Х., С. А. Ульдум, С. Бернандер, П. К. Люк, Г. Вевалка, Б. Абрахам, В. Гайя и Т. Г. Харрисон. 2003. Клиническая применимость обнаружения антигенов в моче для диагностики внебольничной, связанной с путешествиями и нозокомиальной болезни легионеров.J. Clin. Microbiol.41 : 838-840.
- 11.
Houck, P. M., D. W. Bratzler, W. Nsa, A. Ma, and J. G. Bartlett. 2004. Время приема антибиотиков и результаты для пациентов Medicare, госпитализированных с внебольничной пневмонией. Arch. Междунар. Мед. 164 : 637-644.
- 12.
Кирби, Б. Д., К. М. Снайдер, Р. Д. Мейер и С. М. Финеголд. 1980. Болезнь легионеров: отчет о шестидесяти пяти внутрибольничных случаях с обзором литературы.Медицина (Балтимор) 59 : 188-205.
- 13.↵
Миллер, А. К. 1982. Гипонатриемия при болезни легионеров. Br. Med. J. (Clin. Res. Ed.) 284 : 558-559.
- 14.↵
Наирз, М., И. Тёрл, С. Людвичек, М. Тёрл, С. М. Майр, Г. Фриче и Г. Вайс. 2007. Скоординированная регуляция гомеостаза железа в мышиных макрофагах ограничивает доступность железа для внутриклеточной Salmonella typhimurium .Клетка. Microbiol.9 : 2126-2140.
- 15.↵
Niederman, M. S. 2008. Биологические маркеры для определения права на участие в исследованиях внебольничной пневмонии: фокус на прокальцитонин. Clin. Заразить. Диск.47 (Дополнение 3) : S127-S132.
- 16.
Paradkar, P. N., I. De Domenico, N. Durchfort, I. Zohn, J. Kaplan, and D. M. Ward. 2008. Истощение запасов железа ограничивает внутриклеточный рост бактерий в макрофагах.Кровь112 : 866-874.
- 17.↵
Смит, М. Д., К. Л. Шеппард, А. Хоган, Т. Г. Харрисон, Д. А. Дэнс, П. Деррингтон, Р. К. Джордж и Юго-западная исследовательская группа по пневмококку. 2009. Диагностика Streptococcus pneumoniae инфекций у взрослых с бактериемией и внебольничной пневмонией: клиническое сравнение пневмококковой ПЦР и определения антигена в моче. J. Clin. Microbiol.47 : 1046-1049.
- 18.↵
Weiss, G. 2005. Изменение регуляции железа при воспалительной реакции. Best Pract. Res. Clin. Haematol.18 : 183-201.
- 19.↵
Welte, T.
Бартлетт, JG 2008. Необходима ли активность против «атипичных» патогенов в протоколах лечения внебольничной пневмонии? Проблемы с комбинированной терапией.Clin. Заразить. Диск 47 (Дополнение 3) : S232-S236.

 Плюс к этому мы нередко получаем больных, которые переводятся из других лечебных учреждений, где они получали неоднократные курсы массивной антибиотикотерапии с неоднократной заменой препаратов, а также вышеперечисленные лекарственные средства — но, без существенного эффекта.
Плюс к этому мы нередко получаем больных, которые переводятся из других лечебных учреждений, где они получали неоднократные курсы массивной антибиотикотерапии с неоднократной заменой препаратов, а также вышеперечисленные лекарственные средства — но, без существенного эффекта.
 На наш взгляд, С-реактивный белок является основным лабораторным маркером активности процесса в лёгких. НО маркером не присоединения бактериального поражения респираторных отделов лёгочной ткани, а маркером активности того самого «непонятного» процесса, инициированного коронавирусом. Вероятно, уже аутоиммунного (пневмонит, интерстициопатия).
На наш взгляд, С-реактивный белок является основным лабораторным маркером активности процесса в лёгких. НО маркером не присоединения бактериального поражения респираторных отделов лёгочной ткани, а маркером активности того самого «непонятного» процесса, инициированного коронавирусом. Вероятно, уже аутоиммунного (пневмонит, интерстициопатия).
 Считается, что их механизм действия на COVID-19 связан с препятствием проникновения вируса в клетку и его репликации. Необходимо отметить, что гидроксихлорохин обладает также противовоспалительным и иммуносупрессивным действием. И на наш взгляд, этот эффект и проявляется клиническим улучшением у ряда нетяжёлых пациентов по окончании курса терапии. В отношении других препаратов (лопинавир + ритонавир) целесообразность назначения на наш взгляд минимальная, в том числе, учитывая нежелательные явления, развивающиеся при его приёме.
Считается, что их механизм действия на COVID-19 связан с препятствием проникновения вируса в клетку и его репликации. Необходимо отметить, что гидроксихлорохин обладает также противовоспалительным и иммуносупрессивным действием. И на наш взгляд, этот эффект и проявляется клиническим улучшением у ряда нетяжёлых пациентов по окончании курса терапии. В отношении других препаратов (лопинавир + ритонавир) целесообразность назначения на наш взгляд минимальная, в том числе, учитывая нежелательные явления, развивающиеся при его приёме.
 Повторюсь — цель назначения: остановить прогрессирование процесса, «цитокиновый шторм», и, как показал наш опыт, меньшие дозы, к сожалению, не работают. Плюс к этому — минимальное количество нежелательных явлений, наблюдающихся при пульс-терапии).
Повторюсь — цель назначения: остановить прогрессирование процесса, «цитокиновый шторм», и, как показал наш опыт, меньшие дозы, к сожалению, не работают. Плюс к этому — минимальное количество нежелательных явлений, наблюдающихся при пульс-терапии). И как не здесь точка приложения для короткого курса системными ГКС (преднизолон, метилпреднизолон per os) в течение 2-3 недель с последующим снижением до полной отмены? По крайней мере, ряд наших клинических наблюдений демонстрирует улучшение показателей газообмена, повышение толерантности к физической нагрузке при использовании данной схемы.
И как не здесь точка приложения для короткого курса системными ГКС (преднизолон, метилпреднизолон per os) в течение 2-3 недель с последующим снижением до полной отмены? По крайней мере, ряд наших клинических наблюдений демонстрирует улучшение показателей газообмена, повышение толерантности к физической нагрузке при использовании данной схемы. ru/index.php?article=2959
ru/index.php?article=2959