Дренирование абсцесса бр. полости под контролем УЗИ
Дренирование абсцесса под контролем УЗИ – чрескожное пункционное вмешательство, производимое с целью опорожнения гнойника в брюшной полости. Манипуляция выполняется под ультразвуковой навигацией. Траекторию пункции выбирают таким образом, чтобы игла не могла повредить органов брюшной полости. Всего в Краснодаре найдено 6 клиник, где выполняют дренирование абсцесса бр. полости под контролем УЗИ.
Цены: от 2303р. до 22585р.
6 адресов, 6 цен, средняя цена 8150р.
|
Дренирование абсцесса бр. Операция при разлитом перитоните Перитонеальный лаваж |
Фильтр:
Круглосуточные
Показать все фильтрыПо умолчанию
сбросить фильтр
Найдено 6 центров
Скрыть фильтр
|
Life на Восточно-Кругликовской
ул. |
ул. Восточно-Кругликовская, д. 30 | ||||
|
|||||
|
ЧУЗ Клиническая больница РЖД-Медицина на Московской
ул. |
ул. Московская, д. 96 | ||||
|
|||||
|
ГБУЗ КБСМП на 40 лет Победы
ул. |
ул. 40 лет Победы, д. 14 | ||||
|
|||||
|
ГКБ №1 на Красной
ул. |
ул. Красная, д. 103 | ||||
|
|||||
|
ГБУЗ КОД №1 на Димитрова
ул. |
ул. Димитрова, д. 146 | ||||
|
|||||
Краевая больница №1 имени С. В. Очаповского В. Очаповского
ул. 1 Мая, д. 167 |
ул. 1 Мая, д. 167 | ||||
|
|||||
Цены в других городах
Treatment of Single Liver Abscesses: Drainage or Resection?
Статья опубликована на с. 10-15
10-15
Актуальность проблемы
В последние десятилетия во всем мире отмечается неуклонный рост количества больных с абсцессами печени (АП), в 20–30 % случаев развиваются угрожающие жизни осложнения, которые могут привести к летальному исходу [1]. По данным разных авторов, несмотря на прогресс в диагностике и лечении, летальность при АП может достигать 40 % [2, 3].
На сегодняшний день применяются пункционные, дренажные и резекционные методы хирургического лечения. Многие вопросы, касающиеся показаний к каждому из перечисленных методов, все еще остаются дискутабельными [4–6].
Материал и методы
В работе обобщен опыт хирургического лечения 194 больных с одиночными бактериальными абсцессами печени за период 1998–2015 гг. Анализируя случаи, в которых имелась возможность проследить эволюцию гнойника от стадии инфильтрации до абсцедирования, мы констатировали, что сначала в каком-то участке печени образуется зона инфильтрации, подвергающаяся размягчению, затем формируется несколько небольших жидкостных образований, которые потом сливаются в один гнойник. В этом аспекте патогенеза логичнее говорить о едином гнойно-воспалительном процессе в определенном участке печени, который при отсутствии адекватного лечения в дальнейшем может превратиться в гигантский гнойник. Поэтому одиночными мы считали абсцессы, расположенные в одной доле или в смежных сегментах в пределах одного воспалительного фокуса. Более правильно в таких случаях говорить о многокамерном абсцессе, а не о нескольких самостоятельных гнойниках. При этом зачастую во время лапаротомной ревизии или при выполнении фистулографии через дренаж два расположенных рядом гнойника оказывались соединенными каналом по типу «запонки». Такая классификация абсцессов печени объединяет пациентов в группу для единого хирургического подхода — ликвидации гнойной полости, что является основной целью оперативного вмешательства. Совершенно другой подход к пациентам с множественными и милиарными (равномерно разбросанными в разных сегментах и долях печени) гнойниками, как правило, холангиогенного генеза.
В этом аспекте патогенеза логичнее говорить о едином гнойно-воспалительном процессе в определенном участке печени, который при отсутствии адекватного лечения в дальнейшем может превратиться в гигантский гнойник. Поэтому одиночными мы считали абсцессы, расположенные в одной доле или в смежных сегментах в пределах одного воспалительного фокуса. Более правильно в таких случаях говорить о многокамерном абсцессе, а не о нескольких самостоятельных гнойниках. При этом зачастую во время лапаротомной ревизии или при выполнении фистулографии через дренаж два расположенных рядом гнойника оказывались соединенными каналом по типу «запонки». Такая классификация абсцессов печени объединяет пациентов в группу для единого хирургического подхода — ликвидации гнойной полости, что является основной целью оперативного вмешательства. Совершенно другой подход к пациентам с множественными и милиарными (равномерно разбросанными в разных сегментах и долях печени) гнойниками, как правило, холангиогенного генеза. Здесь первостепенно корригируется проходимость желчевыводящих протоков и через протоковую систему осуществляется дренаж. Такие пациенты в настоящее исследование не включались.
Здесь первостепенно корригируется проходимость желчевыводящих протоков и через протоковую систему осуществляется дренаж. Такие пациенты в настоящее исследование не включались.
Одиночными абсцессами печени заболевали чаще женщины, их было 108 (55,7 %), мужчин — 86 (44,3 %). Возраст пациентов колебался в пределах от 17 до 84 лет и в среднем составил 56 лет.
Патогенетически абсцессы разделились на посттравматические — 22 (11,3 %), холангиогенные — 25 (12,9 %), метастатические (гематогенные) — 17 (8,8 %), контактные — 16 (8,2 %), нагноение опухолей — 5 (2,6 %), инфицированные паразитарные кисты — 23 (11,9 %), инфицированные непаразитарные кисты — 17 (8,8 %), криптогенные — 69 (35,5 %).
Значительно чаще поражалась правая доля — у 137 (70,7 %), а в ней чаще других страдал седьмой сегмент: I — у 3 (1,5 %), II — у 13 (6,7 %), III — у 22 (11,3 %), IV — у 19 (9,8 %), V — у 35 (18,1 %), VI — у 40 (20,6 %), VII — у 47 (24,3 %) и VIII — у 15 (7,7 %). Слабость VII сегмента печени при инфицировании мы объясняем особенностями его кровоснабжения по системе воротной вены.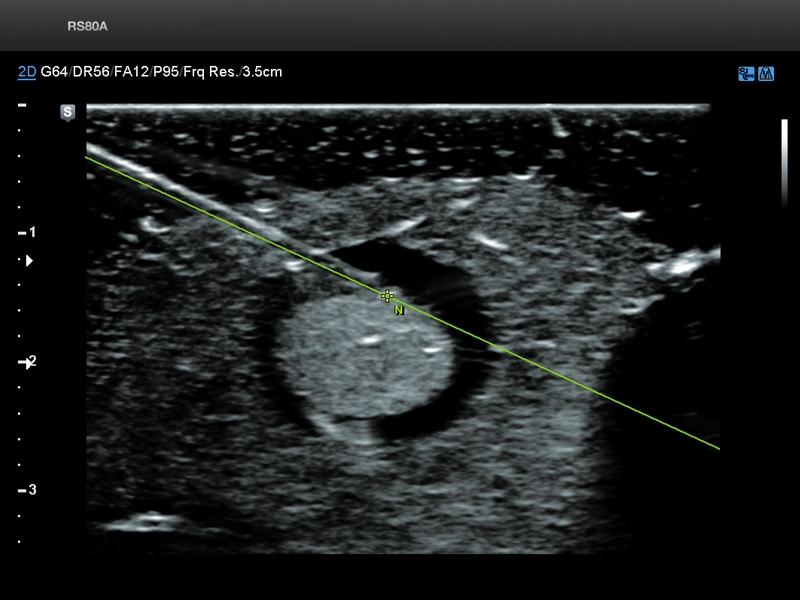 Правая ветвь воротной вены большего диаметра, чем левая, и по направлению является продолжением основного ствола.
Правая ветвь воротной вены большего диаметра, чем левая, и по направлению является продолжением основного ствола.
Объемы абсцессов колебались в широких пределах: менее 60 мл — у 51 (26,4 %) больного, 60–200 мл — у 91 (46,9 %), 201–500 мл — у 22 (11,4 %) и более 500 мл — у 28 (14,4 %).
Длительность заболевания до поступления в клинику также варьировала: до 1 недели — у 29 (14,9 %), до 1 месяца — у 90 (46,5 %), до 3 месяцев — у 35 (18,0 %) и более 3 месяцев (хронические абсцессы) — у 40 (20,6 %) больных.
Основными жалобами при поступлении были общая слабость (у всех больных), в разной степени повышение температуры до 37,5–39 °C — у 124 (72,9 %), нередко с ознобами, и ноющие боли в правом подреберье или эпигастрии — у 160 (94,1 %) пациентов.
Почти половина пациентов страдали сопутствующими заболеваниями, которые либо стали причиной абсцесса, либо оказывали отягощающее влияние на его течение: желчнокаменной болезнью — 23 (11,9 %) пациента, сахарным диабетом — 30 (15,5 %), циррозом печени — 5 (2,6 %), поликистозом печени — 7 (3,6 %), гнойным пиелонефритом — 7 (3,6 %). Желтуха встретилась у 39 (20,1 %) больных, преимущественно при холангиогенных абсцессах, общий билирубин при этом колебался от 25 до 280 мкмоль/л.
Желтуха встретилась у 39 (20,1 %) больных, преимущественно при холангиогенных абсцессах, общий билирубин при этом колебался от 25 до 280 мкмоль/л.
При бактериологическом исследовании содержимого абсцессов печени преобладающими возбудителями были граммотрицательные микроорганизмы — кишечная палочка, клебсиелла, реже встречались стафилококк, стрептококк и протей.
Во всех случаях мы придерживались активной хирургической тактики — все больные оперированы, антибиотикотерапия была фоном для выполнения хирургических процедур. До получения идентифицированных культур из гноя назначалась эмпирическая антибиотикотерапия препаратами широкого спектра действия (для покрытия грамотрицательных и грамположительных аэробов и анаэробов). Кроме этого, всем больным проводилось медикаментозное лечение, включающее инфузионную (коррекция водно-электролитных нарушений) и гепатотропную терапию.
Исследуемым 194 больным выполнена 221 операция (табл. 1), то есть 26 (13,4 %) пациентов оперированы более одного раза: 20 (10,3 %) оперированы дважды, 5 (2,3 %) трижды и одна больная — 4 (0,5 %) раза. Каждая отдельная манипуляция, включая пункционно-аспирационную санацию, считалась отдельной операцией.
Каждая отдельная манипуляция, включая пункционно-аспирационную санацию, считалась отдельной операцией.
Время пребывания в стационаре у выписанных больных колебалось от 8 до 64 суток и в среднем составило 22 дня. Умерло 10 (5,2 %) пациентов. Причинами смерти стали гнойный холангит, интоксикация, печеночная, а затем и полиорганная недостаточность, тромбоэмболия легочной артерии (ТЭЛА).
В процессе лечения возникали осложнения со стороны как грудной клетки — 102 (52,5 %), так и брюшной полости — 48 (24,7 %) (табл. 2).
У 7 умерших был холангиогенный абсцесс с желтухой, холангитом и прогрессирующей печеночной недостаточностью (у двух возникла ТЭЛА), в трех случаях причина смерти связана с декомпенсацией состояния организма по соматическим органам. Развитие перитонита в двух случаях произошло вследствие самопроизвольного вскрытия абсцесса в брюшную полость до поступления в клинику, пациенты выздоровели; еще в двух случаях перитонит был следствием перфорации острой язвы и хрониосепсиса — случаи закончились смертью.
В остальных случаях осложнения не потребовали каких-либо дополнительных оперативных пособий и были ликвидированы медикаментозным лечением.
Довольно частым осложнением лечения абсцессов печени были неполные наружные желчные свищи — 8 (4,7 %) случаев. У 5 пациентов они закрылись самостоятельно, у одного потребовали дополнительного дренирования биломы, еще у одного — выполнения эндоскопической папиллосфинктеротомии.
Результаты и обсуждение
Проведен анализ преимуществ и недостатков аспирационных, дренирующих и резекционных методов лечения одиночных абсцессов печени по следующим параметрам: травматичность, персистенция остаточной гнойной полости, подтекание содержимого гнойника в брюшную полость, повторные операции, длительность пребывания в стационаре.
Пункционно-аспирационная санация выполнялась 44 раза (19,9 % всех операций) под контролем ультразвукового исследования (УЗИ) под местной анестезией. После максимальной аспирации содержимого и бакпосева полость санировалась раствором антисептика (чаще декасаном).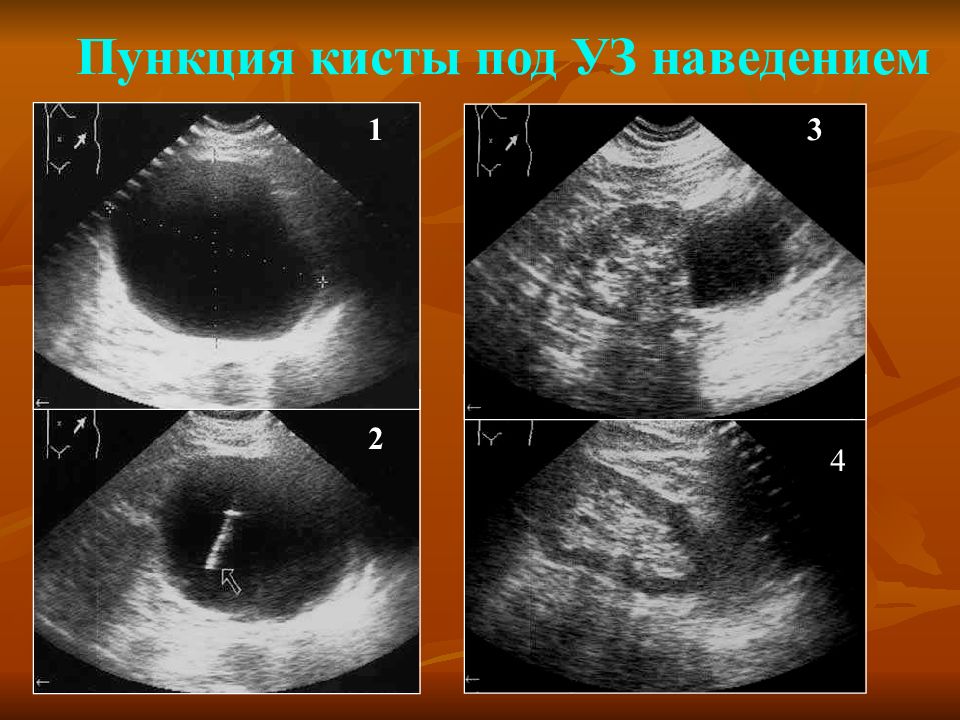 Изначально пункция с аспирацией применена у 39 (20,1 %) больных с размерами гнойника не более 7–8 см в диаметре при их локализации в вентральных сегментах печени. Но желаемый лечебный эффект после первой пункционной санации наступил только у половины — 19 (48,7 %) больных, после двух санаций — еще у 5 (12,8 %). У 6 (15,4 %) пациентов после двух санаций и в связи с отсутствием какого-либо положительного эффекта выполнено дренирование гнойника, которое в дальнейшем привело к выздоровлению. Умер 1 больной вследствие прогрессирующего холангита после двух аспирационных санаций холангиогенного абсцесса V сегмента печени. Лапаротомную коррекцию выполнять было нельзя в связи с тяжестью состояния больного.
Изначально пункция с аспирацией применена у 39 (20,1 %) больных с размерами гнойника не более 7–8 см в диаметре при их локализации в вентральных сегментах печени. Но желаемый лечебный эффект после первой пункционной санации наступил только у половины — 19 (48,7 %) больных, после двух санаций — еще у 5 (12,8 %). У 6 (15,4 %) пациентов после двух санаций и в связи с отсутствием какого-либо положительного эффекта выполнено дренирование гнойника, которое в дальнейшем привело к выздоровлению. Умер 1 больной вследствие прогрессирующего холангита после двух аспирационных санаций холангиогенного абсцесса V сегмента печени. Лапаротомную коррекцию выполнять было нельзя в связи с тяжестью состояния больного.
Случаи неэффективности пункционно-аспирационной санации при ее вынужденном применении встретились у пациентов с многокамерными холангиогенными абсцессами дорсальной локализации и выраженной капсулой, а также при длительности заболевания более месяца.
Высокая эффективность метода пункционно-аспирационной санации даже при его однократном применении отмечена у больных с продолжительностью заболевания до месяца, с гнойником до 5 см, без выраженной капсулы и криптогенным по патогенезу.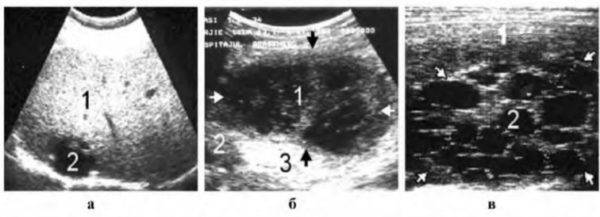
Дренирование абсцесса выполнялось 124 раза 115 больным четырьмя способами: под контролем УЗИ — 56 (48,7 %) пациентам, лапароскопически — 38 (33,0 %), под контролем ангиографа — 2 (1,7 %) и транслапаротомным доступом — 28 (24,3 %).
Положительный эффект наступил только у 105 (91,3 %) больных, остальным потребовалась переустановка дренажа под УЗИ-контролем, лапароскопическим или лапаротомным доступом. Неэффективным дренирование было при многокамерности или наличии в полости гнойника секвестров. Этим больным далее были выполнены резекции печени.
Показанием для лапаротомной санации и дренирования стали: уже развившийся перитонит вследствие самопроизвольного вскрытия абсцесса в брюшную полость (2 пациента), сложная для мини-инвазивных методов дорсальная локализация гнойников, неэффективность мини-инвазивных методов и непереносимость при наличии показаний к резекционным операциям. Преимущество лапаротомного доступа в том, что через него может быть выполнена любая операция.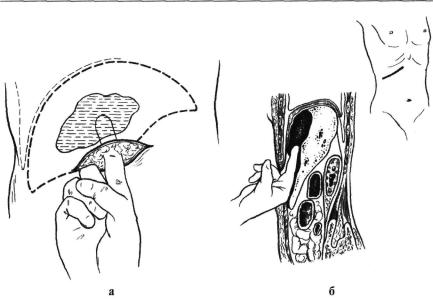 В то же время операция по поводу любого гнойника печени может закончиться лапаротомной санацией и дренированием.
В то же время операция по поводу любого гнойника печени может закончиться лапаротомной санацией и дренированием.
Длительность функционирования дренажа находилась в пределах 5–28 суток и в среднем составила 12,0 ± 5,2 суток. За это время остаточная полость уменьшалась примерно вдвое. После дренирования в 3 случаях наблюдалось формирование наружных желчных свищей.
Резекция печени выполнена 53 (27,3 %) больным, в 9 (17,0 %) случаях — лапароскопически. Все операции были эффективными и привели к выздоровлению. Доступом при резекционных методах была верхнесрединная лапаротомия, иногда J-образный разрез. У 15 пациентов резекция была экономной, типа фенестрации, у 13 выполнялась перицистэктомия в связи с нагноившимися паразитарными кистами, у 25 пациентов произведены сегмент- или гемигепатэктомии. Осложнениями стали: нагноение резекционной раны печени (7) и наружный желчный свищ (4).
Пункционно-аспирационный метод показал свою эффективность у больных с размерами гнойника до 8 см, без секвестров, однокамерных и расположенных в вентральных сегментах печени. Эффективность метода повышается при применении повторных пункций. Основной причиной неудач при вынужденном использовании пункционно-аспирационного метода лечения стало неспадение остаточной полости. Метод оказался неэффективным в случаях сформированной ригидной пиогенной капсулы и при гнойниках больших размеров.
Эффективность метода повышается при применении повторных пункций. Основной причиной неудач при вынужденном использовании пункционно-аспирационного метода лечения стало неспадение остаточной полости. Метод оказался неэффективным в случаях сформированной ригидной пиогенной капсулы и при гнойниках больших размеров.
Пункционно-дренажный способ лечения показал себя более эффективным, однако и ему были свойственны неудачи, и они также были связаны с длительным существованием остаточной гнойной полости. Кроме этого, добавились подтекания содержимого абсцесса в брюшную полость, хотя ни одно из них не потребовало дополнительных хирургических манипуляций. Выигрышным в этих ситуациях показал себя лапароскопический доступ, при котором, помимо дренажа абсцесса, устанавливался страховочный улавливающий дренаж в брюшную полость.
Исходя из анализа неудач, можно сформулировать положение о том, что пункционно-аспирационно-дренажные методики могут быть методом выбора при лечении большинства абсцессов печени и их следует применять в таких случаях:
1. Гнойник любых размеров, но не превышающий размеров одной доли.
Гнойник любых размеров, но не превышающий размеров одной доли.
2. Наличие технических условий для выполнения дренирования под контролем УЗИ или лапароскопически.
3. Тяжелое общее состояние пациента, не позволяющее выполнить более радикальную операцию.
Последний пункт характеризует вынужденное применение мини-инвазивных пункционно-дренажных методик и может быть первым этапом лечения. Его основная задача в случае невозможности полного излечения — подготовить пациента к более травматичной, но эффективной операции.
Резекционные методы являются радикальными операциями в тех случаях, когда гнойный очаг в печени удается удалить в пределах здоровых тканей без вскрытия его полости (классическая резекция или перицистэктомия). В случаях пристеночного расположения абсцесса с паренхиматозной манжетой толщиной 5–7 мм (рис. 1) хорошо себя зарекомендовала экономная резекция типа фенестрации. При этом, хотя одна стенка гнойника и остается неудаленной, исключается дальнейшее существование инфицированной остаточной полости.
Недостатком резекционного метода является большая травматичность, поэтому следует считать его операцией резерва и показания ограничить следующими пунктами:
1. Гнойник больших размеров, занимающий целую долю или больше.
2. Многокамерные абсцессы с множеством перемычек и секвестров (рис. 2).
3. Нагноившиеся паразитарные кисты и хронические абсцессы.
4. Несколько единичных, не сообщающихся между собой и локально расположенных гнойников задних сегментов печени.
Клинический пример. Больная В., 55 лет, поступила в клинику института через месяц после начала заболевания с жалобами на ноющие боли в правом подреберье, гектическую температуру 39–40 °С, слабость. В крови анемия (Hb 115 г/л), лейкоцитоз 30 • 109 со сдвигом до 30 % палочкоядерных форм. По данным компьютерной томографии, в 6–7-м сегментах печени локализуется многокамерный абсцесс (рис. 3) общим объемом 200–250 мл с множественными внутренними тяжами, перемычками и секвестрами. Под контролем УЗИ гнойник дренирован, однако опорожнить и промыть полость не удалось, а общее количество полученного гноя не превысило 20 мл. В связи с отсутствием положительной динамики больная оперирована лапаротомным доступом, произведена резекция 6–7-го сегментов печени с гнойником без вскрытия его просвета. По данным гистологического исследования, гнойник имел характерное строение для туберкулезного абсцесса. Бакпосев роста микрофлоры не дал. Послеоперационный период осложнился пневмонией с правосторонним экссудативным плевритом. В процессе лечения инфекционные процессы в брюшной полости и грудной клетке полностью ликвидированы.
Под контролем УЗИ гнойник дренирован, однако опорожнить и промыть полость не удалось, а общее количество полученного гноя не превысило 20 мл. В связи с отсутствием положительной динамики больная оперирована лапаротомным доступом, произведена резекция 6–7-го сегментов печени с гнойником без вскрытия его просвета. По данным гистологического исследования, гнойник имел характерное строение для туберкулезного абсцесса. Бакпосев роста микрофлоры не дал. Послеоперационный период осложнился пневмонией с правосторонним экссудативным плевритом. В процессе лечения инфекционные процессы в брюшной полости и грудной клетке полностью ликвидированы.
Выводы
Мини-инвазивные методы лечения одиночных абсцессов печени являются малотравматичными и высокоэффективными и поэтому могут быть первой линией хирургической помощи. В то же время хирургическая доктрина лечения гнойников печени должна носить эскалационный характер и при необходимости обязывать хирурга к своевременному переходу на более действенную методику следующей ступени.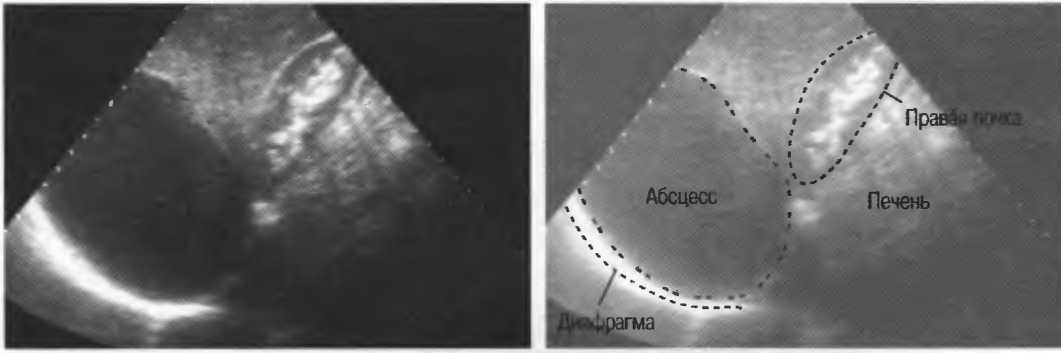
Резекционные методы лечения более травматичны, требуют больших резервов организма, однако они радикальны, сопровождаются меньшим числом послеоперационных осложнений, а нередко и меньшим сроком стационарного лечения. Их следует использовать как методы резерва при неэффективности мини-инвазивных способов, при гигантских, специфических (туберкулез, актиномикоз, сифилис), хронических абсцессах и нагноении паразитарных кист печени.
| Код | Наименование медицинской услуги | Цена | |
| КОНСУЛЬТАЦИИ СПЕЦИАЛИСТОВ | |||
| В01.057.001 | Прием (осмотр, консультация) врача-хирурга первичный | 1100 | |
| В01.057.002 | Прием (осмотр, консультация) врача-хирурга повторный | 550 | |
В01.004.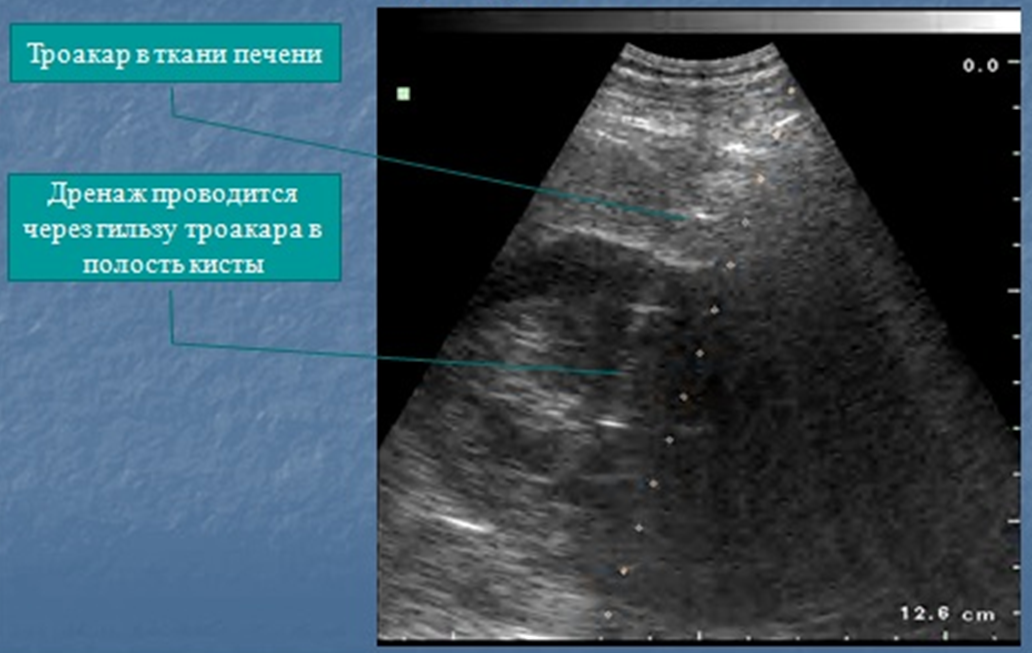 001 001 | Прием (осмотр, консультация) врача-гастроэнтеролога первичный | 1100 | |
| В 01.004.002 | Прием (осмотр, консультация) врача-гастроэнтеролога повторный | 550 | |
| В01.025.001 | Прием (осмотр, консультация) врача-нефролога первичный | 1100 | |
| В01.025.002 | Прием (осмотр, консультация) врача-нефролога повторный | 550 | |
| В01.028.001 | Прием (осмотр, консультация) врача-оториноларинголога первичный | 1100 | |
| В01.028.002 | Прием (осмотр, консультация) врача-оториноларинголога повторный | 550 | |
| В01.029.001 | Прием (осмотр, консультация) врача-офтальмолога первичный | 1100 | |
| В01.029.002 | Прием (осмотр, консультация) врача-офтальмолога повторный | 550 | |
| В01.037.001 | Прием (осмотр, консультация) врача-пульмонолога первичный | 1100 | |
В01. 037.002 037.002 | Прием (осмотр, консультация) врача-пульмонолога повторный | 550 | |
| В01.047.001 | Прием (осмотр, консультация) врача-терапевта первичный | 1100 | |
| В01.047.002 | Прием (осмотр, консультация) врача-терапевта повторный | 550 | |
| В01.040.001 | Прием (осмотр, консультация) врача-ревматолога первичный | 1100 | |
| В01.040.002 | Прием (осмотр, консультация) врача-ревматолога повторный | 550 | |
| В01.053.001 | Прием (осмотр, консультация) врача-уролога первичный | 1100 | |
| В01.053.002 | Прием (осмотр, консультация) врача-уролога повторный | 550 | |
| В01.034.001 | Прием (осмотр, консультация) врача-психотерапевта первичный | 1100 | |
| В01.034.002 | Прием (осмотр, консультация) врача-психотерапевта повторный | 550 | |
В01. 001.001 001.001 | Прием (осмотр, консультация) врача акушера-гинеколога первичный | 1100 | |
| В01.001.002 | Прием (осмотр, консультация) врача акушера-гинеколога повторный | 550 | |
| В01.015.001 | Прием (осмотр, консультация) врача-кардиолога первичный | 1100 | |
| В01.015.002 | Прием (осмотр, консультация) врача-кардиолога повторный | 550 | |
| В01.018.001 | Прием (осмотр, консультация) врача-колопроктолога первичный | 1100 | |
| В01.018.002 | Прием (осмотр, консультация) врача-колопроктолога повторный | 550 | |
| В01.058.001 | Прием (осмотр, консультация) врача-эндокринолога первичный | 1100 | |
| В01.058.002 | Прием (осмотр, консультация) врача-эндокринолога повторный | 550 | |
| В01.056.002 | Прием (осмотр, консультация) врача функциональной диагностики первичный | 600 | |
В01.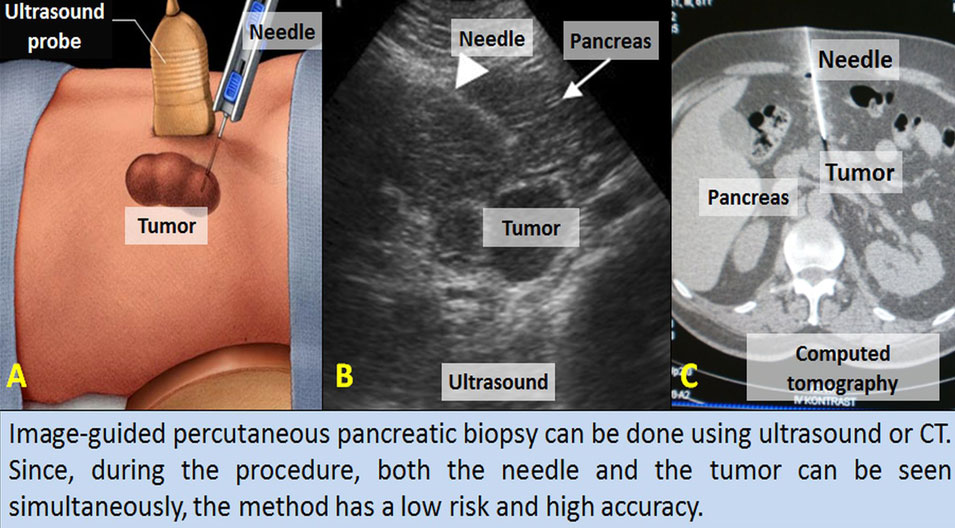 056.003 056.003 | Прием (осмотр, консультация) врача функциональной диагностики повторный | 350 | |
| В01.013.001 | Прием (осмотр, консультация) врача-диетолога первичный | 1100 | |
| В01.013.002 | Прием (осмотр, консультация) врача-диетолога повторный | 550 | |
| B01.059.001 | Прием (осмотр, консультация) врача-эндоскописта первичный | 600 | |
| B05.069.008 | Школа для пациентов с избыточной массой тела и ожирением (групповые занятия) одно занятие | 300 | |
| B01.054.001 | Осмотр (консультация) врача-физиотерапевта | 600 | |
| B01.035.001 | Прием (осмотр, консультация) врача-психиатра первичный | 1100 | |
| B01.035.002 | Прием (осмотр, консультация) врача-психиатра повторный | 550 | |
| B01.041.001 | Прием (осмотр, консультация) врача-рефлексотерапевта первичный | 1100 | |
B01. 041.002 041.002 | Прием (осмотр, консультация) врача-рефлексотерапевта повторный | 550 | |
| B01.048.001 | Прием (осмотр, консультация) врача-токсиколога первичный | 1100 | |
| B01.048.002 | Прием (осмотр, консультация) врача-токсиколога повторный | 550 | |
| B01.057.003 | Прием (осмотр, консультация) врача-пластического хирурга первичный | 1100 | |
| B01.057.004 | Прием (осмотр, консультация) врача-пластического хирурга повторный | 550 | |
| B01.017.001 | Прием (консультация) врача — клинического фармаколога | 600 | |
| В01.023.001 | Прием (осмотр, консультация) врача-невролога первичный | 1100 | |
| В01.023.002 | Прием (осмотр, консультация) врача-невролога повторный | 550 | |
| УЛЬТРАЗВУКОВЫЕ ИССЛЕДОВАНИЯ | |||
| Ультразвуковое исследование головы и шеи | |||
A04. 07.002 07.002 | Ультразвуковое исследование слюнных желез | 1000 | |
| A04.22.001 | Ультразвуковое исследование щитовидной железы и паращитовидных желез | 700 | |
| A04.22.003 | Ультразвуковое исследование паращитовидных желез | 450 | |
| Ультразвуковое исследование органов брюшной полости | |||
| A04.14.001.003 | Ультразвуковое исследование гепатобиллиарной зоны | 1500 | |
| A04.14.001 | Ультразвуковое исследование печени | 800 | |
| A04.14.002 | Ультразвуковое исследование желчного пузыря и протоков | 800 | |
| A04.14.002.001 | Ультразвуковое исследование желчного пузыря с определением его сократимости | 1200 | |
| A04.06.001 | Ультразвуковое исследование селезенки | 700 | |
A04. 16.001 16.001 | Ультразвуковое исследование органов брюшной полости (комплексное) | 1300 | |
| A04.15.001 | Ультразвуковое исследование поджелудочной железы | 700 | |
| Ультразвуковое исследование органов грудной клетки | |||
| A04.06.003 | Ультразвуковое исследование вилочковой железы | 600 | |
| A04.20.002 | Ультразвуковое исследование молочных желез | 1000 | |
| A04.09.001 | Ультразвуковое исследование плевральной полости | 1000 | |
| Ультразвуковое исследование в гинекологии | |||
| A04.20.001 | Ультразвуковое исследование матки и придатков трансабдоминальное | 1300 | |
| A04.20.001.001 | Ультразвуковое исследование матки и придатков трансвагинальное | 1300 | |
A04.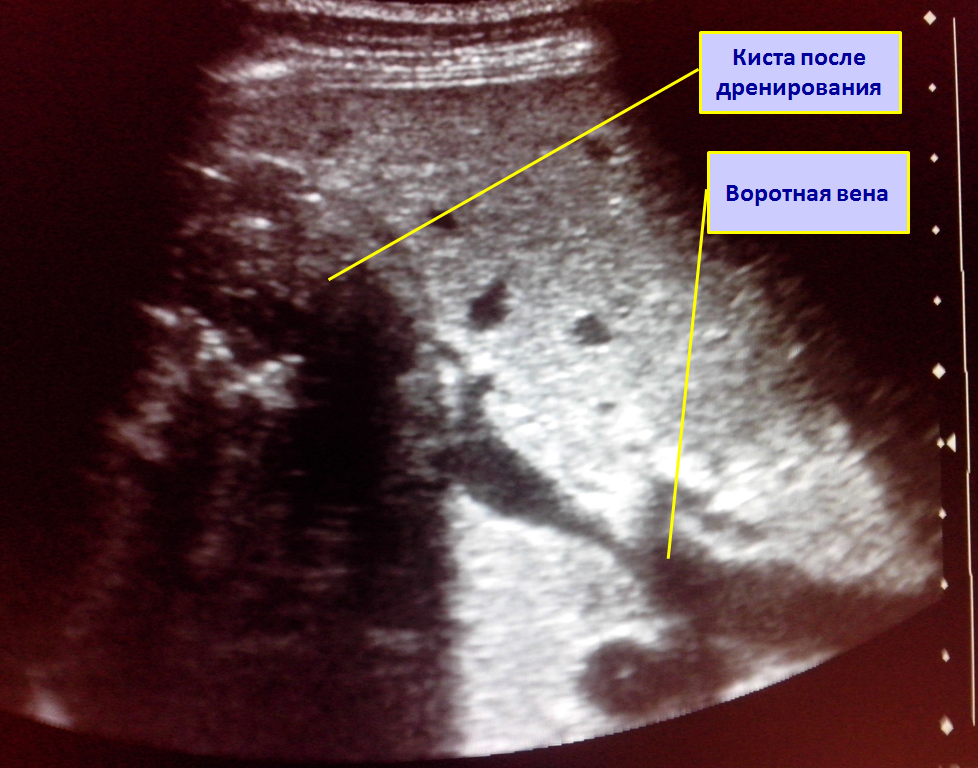 12.024 12.024 | Ультразвуковая допплерография маточно-плацентарного кровотока | 900 | |
| A04.20.003 | Ультразвуковое исследование фолликулогенеза | 900 | |
| A04.30.001 | Ультразвуковое исследование плода * | 1400 | |
| A04.30.001 | Ультразвуковое исследование плода ** | 1600 | |
| A04.30.001 | Ультразвуковое исследование плода*** | 1800 | |
| * | до 13 недель беременности | 0 | |
| ** | скрининг 1 триместр | 0 | |
| *** | скрининг 2-3 триместр | 0 | |
| Общие методы ультразвуковой диагностики | |||
| A04.01.001 | Ультразвуковое исследование мягких тканей (одна анатомическая зона) | 1000 | |
| A04.06.002 | Ультразвуковое исследование лимфатических узлов (одна анатомическая зона) | 500 | |
A04. 28.003 28.003 | Ультразвуковое исследование органов мошонки | 800 | |
| A04.01.001 | Ультразвуковое исследование мягких тканей * | 800 | |
| A04.04.001 | Ультразвуковое исследование сустава | 1300 | |
| A04.04.001.001 | Ультразвуковое исследование тазобедренного сустава | 1200 | |
| Ультразвуковое исследование забрюшинного пространства | |||
| A04.28.002.005 | Ультразвуковое исследование мочевого пузыря с определением остаточного кол-ва мочи | 1400 | |
| A04.28.002.003 | Ультразвуковое исследование мочевого пузыря | 600 | |
| A04.28.001 | Ультразвуковое исследование почек и надпочечников | 1100 | |
| A04.30.010 | Ультразвуковое исследование органов малого таза (комплексное) | 1300 | |
A04. 21.001 21.001 | Ультразвуковое исследование предстательной железы | 1000 | |
| Ультразвуковое исследование вен | |||
| A04.12.005.004 | Дуплексное сканирование вен верхних конечностей | 1500 | |
| A04.12.006.002 | Дуплексное сканирование вен нижних конечностей | 1500 | |
| A04.12.005.002 | Дуплексное сканирование артерий верхних конечностей | 1500 | |
| A04.12.006.001 | Дуплексное сканирование артерий нижних конечностей | 1500 | |
| A04.12.002 | Ультразвуковая допплерография сосудов (артерий и вен) верхних конечностей | 1500 | |
| A04.12.002.001 | Ультразвуковая допплерография сосудов (артерий и вен) нижних конечностей | 1500 | |
| A04.12.005.003 | Дуплексное сканирование брахиоцефальных артерий с цветным допплеровским картированием кровотока | 1500 | |
A04. 12.015 12.015 | Триплексное сканирование вен | 1500 | |
| Ультразвуковое исследование сердечно-сосудистой системы | |||
| A04.10.002 | Эхокардиография | 1500 | |
| РЕНТГЕНОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ | |||
| A06.09.007 | Рентгенография легких | 850 | |
| A06.03.005 | Рентгенография всего черепа, в одной или более проекциях | 800 | |
| А06.18.003 | Ирригография | 1800 | |
| A06.28.002 | Внутривенная урография | 2150 | |
| A06.20.001.001 | Гистерография | 1000 | |
| A06.20.001 | Гистеросальпингография | 1000 | |
| A06.09.012 | Латерография | 650 | |
| А06.30.004.001 | Обзорная рентегонграфия органов брюшной полости | 500 | |
A06. 30.004.001 30.004.001 | Обзорная рентгенография органов брюшной полости | 800 | |
| A06.28.013 | Обзорная урография (рентгенография мочевыделительной системы) | 800 | |
| A06.30.004 | Обзорный снимок брюшной полости и органов малого таза | 500 | |
| A06.14.003 | Операционная и послеоперационная холангиография | 800 | |
| A06.30.002 | Описание и интерпретация рентгенографических изображений | 400 | |
| A06.03.035 | Рентгенография I пальца кисти | 600 | |
| A06.03.055 | Рентгенография I пальца стопы в одной проекции | 600 | |
| A06.04.013 | Рентгенография акромиально-ключичного сочленения | 600 | |
| A06.12.001 | Рентгенография аорты | 600 | |
| A06.03.043 | Рентгенография бедренной кости | 900 | |
A06. 03.046 03.046 | Рентгенография большой берцовой и малой берцовой костей | 800 | |
| A06.03.021 | Рентгенография верхней конечности | 600 | |
| A06.08.003 | Рентгенография придаточных пазух носа | 600 | |
| A06.08.003.003 | Рентгенография гайморовых пазух | 600 | |
| A06.04.012 | Рентгенография голеностопного сустава | 600 | |
| A06.03.042 | Рентгенография головки и шейки бедренной кости | 600 | |
| A06.04.014 | Рентгенография грудино-ключичного сочленения | 600 | |
| A06.03.024 | Рентгенография грудины | 800 | |
| A06.03.014 | Рентгенография грудного и поясничного отдела позвоночника | 800 | |
| A06.03.013 | Рентгенография грудного отдела позвоночника | 800 | |
A06. 03.030 03.030 | Рентгенография запястья | 600 | |
| A06.03.032 | Рентгенография кисти | 600 | |
| A06.03.022 | Рентгенография ключицы | 600 | |
| A06.04.005 | Рентгенография коленного сустава | 1100 | |
| A06.03.017 | Рентгенография крестца и копчика | 800 | |
| A06.08.003.002 | Рентгенография лобной пазухи | 600 | |
| A06.03.048 | Рентгенография лодыжки | 600 | |
| A06.04.003 | Рентгенография локтевого сустава | 800 | |
| A06.03.029 | Рентгенография локтевой кости и лучевой кости | 600 | |
| A06.04.004 | Рентгенография лучезапястного сустава | 800 | |
| A06.04.002 | Рентгенография межпозвоночных сочленений | 900 | |
A06.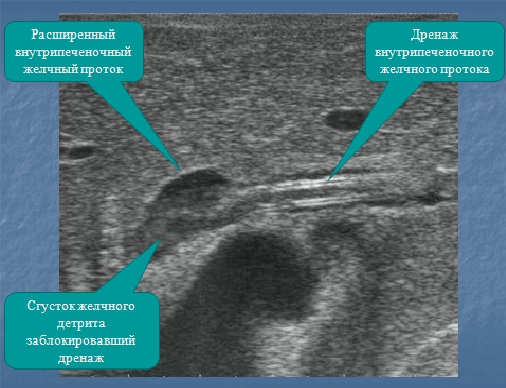 03.045 03.045 | Рентгенография надколенника | 600 | |
| A06.03.036 | Рентгенография нижней конечности | 800 | |
| A06.03.034 | Рентгенография пальцев фаланговых костей кисти | 600 | |
| A06.03.007 | Рентгенография первого и второго шейного позвонка | 600 | |
| A06.04.010 | Рентгенография плечевого сустава | 800 | |
| A06.03.028 | Рентгенография плечевой кости | 800 | |
| A06.03.051 | Рентгенография плюсны и фаланг пальцев стопы | 600 | |
| A06.03.019 | Рентгенография позвоночника с функциональными пробами | 1000 | |
| A06.03.020 | Рентгенография позвоночника, вертикальная | 800 | |
| А06.28.001 | Рентгенография почек и мочевыводящих путей | 780 | |
A06. 03.016 03.016 | Рентгенография поясничного и крестцового отдела позвоночника | 800 | |
| A06.03.015 | Рентгенография поясничного отдела позвоночника | 800 | |
| A06.03.049 | Рентгенография предплюсны | 600 | |
| A06.03.031 | Рентгенография пясти | 600 | |
| A06.03.050 | Рентгенография пяточной кости | 800 | |
| A06.03.023 | Рентгенография ребра(ер) | 800 | |
| A06.03.008 | Рентгенография сочленения затылочной кости и первого шейного позвонка | 600 | |
| A06.11.001 | Рентгенография средостения | 550 | |
| A06.03.053 | Рентгенография стопы в двух проекциях | 950 | |
| A06.03.052 | Рентгенография стопы в одной проекции | 600 | |
| A06.03.053.001 | Рентгенография стопы с функциональной нагрузкой | 800 | |
A06. 03.041 03.041 | Рентгенография таза | 600 | |
| A06.04.011 | Рентгенография тазобедренного сустава | 800 | |
| A06.03.001.001 | Рентгенография турецкого седла | 800 | |
| A06.03.033 | Рентгенография фаланг пальцев кисти | 600 | |
| A06.03.054 | Рентгенография фаланг пальцев ноги | 600 | |
| A06.03.060 | Рентгенография черепа в прямой проекции | 600 | |
| A06.03.010 | Рентгенография шейного отдела позвоночника | 800 | |
| A06.03.011 | Рентгенография шейно-дорсального отдела позвоночника | 600 | |
| A06.17.002 | Рентгеноконтроль прохождения контрастного вещества по желудку, тонкой и ободочной кишке | 1500 | |
| А06.28.008 | Уретероцистография | 1300 | |
А06.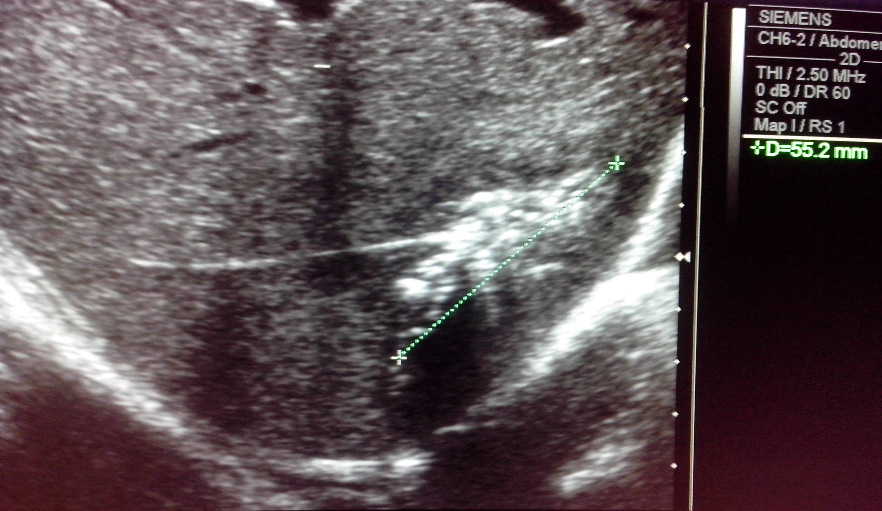 28.007 28.007 | Цистография | 1300 | |
| A06.30.005 | Компьютерная томография органов брюшной полости | 2000 | |
| A06.30.005.001 | Компьютерная томография органов брюшной полости и забрюшинного пространства | 3000 | |
| A06.30.005.003 | Компьютерная томография органов брюшной полости с внутривенным болюсным контрастированием | 6500 | |
| A06.30.007 | Компьютерная томография забрюшинного пространства | 2500 | |
| A06.01.001 | Компьютерная томография мягких тканей | 2500 | |
| A06.03.002 | Компьютерная томография лицевого отдела черепа | 3000 | |
| A06.03.058 | Компьютерная томография позвоночника (один отдел) | 3000 | |
| A06.03.062 | Компьютерная томография кости | 2500 | |
A06.03.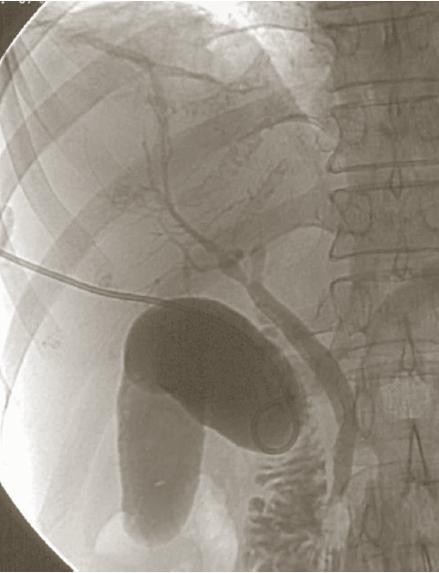 069 069 | Компьютерная томография костей таза | 3000 | |
| A06.04.020 | Компьютерная томография височно-нижнечелюстных суставов | 2500 | |
| A06.04.017 | Компьютерная томография сустава | 2500 | |
| A06.08.007 | Компьютерная томография придаточных пазух носа, гортани | 2500 | |
| A06.08.009 | Компьютерная томография верхних дыхательных путей и шеи | 3000 | |
| A06.09.005 | Компьютерная томография органов грудной полости | 3000 | |
| A06.12.001.001 | Компьютерно-томографическая ангиография грудной аорты | 3000 | |
| A06.12.001.002 | Компьютерно-томографическая ангиография брюшной аорты | 3000 | |
| A06.20.002 | Компьютерная томография органов малого таза у женщин | 3000 | |
A06.20. 002.003 002.003 | Компьютерная томография органов малого таза у женщин с контрастированием | 6000 | |
| A06.21.003 | Компьютерная томография органов таза у мужчин | 3000 | |
| A06.23.004 | Компьютерная томография головного мозга | 3000 | |
| A06.23.004.006 | Компьютерная томография головного мозга с внутривенным контрастированием | 6500 | |
| A06.26.006 | Компьютерная томография глазницы | 2500 | |
| A06.28.009 | Компьютерная томография почек и надпочечников | 3000 | |
| УСЛУГИ ФИЗИОТЕРАПЕВТИЧЕСКОГО ОТДЕЛЕНИЯ | |||
| B01.054.001 | Осмотр (консультация) врача-физиотерапевта | 600 | |
| A17.24.002 | Гальванизация при заболеваниях периферической нервной системы | 150 | |
| A17.23.002 | Дарсонвализация местная при заболеваниях центральной нервной системы и головного мозга | 150 | |
A17.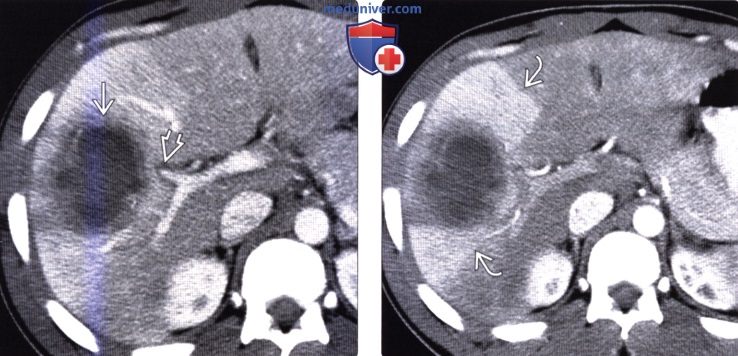 24.004 24.004 | Дарсонвализация местная при заболеваниях периферической нервной системы | 150 | |
| A17.30.031 | Воздействие магнитными полями | 150 | |
| A17.03.007 | Воздействие магнитными полями при костной патологии | 150 | |
| A17.01.002.003 | Лазеропунктура | 200 | |
| A17.03.003 | Воздействие синусоидальными модулированными токами (СМТ-терапия) при костной патологии | 150 | |
| A17.03.006 | Воздействие токами ультравысокой частоты при костной патологии | 150 | |
| A17.04.001 | Электрофорез лекарственных препаратов при заболеваниях суставов | 150 | |
| A17.08.001 | Электрофорез лекарственных препаратов при заболеваниях верхних дыхательных путей | 150 | |
| A17.08.001.001 | Электрофорез лекарственных препаратов эндоназальный | 150 | |
A17. 20.002 20.002 | Электрофорез лекарственных препаратов при заболеваниях женских половых органов | 150 | |
| A17.23.001 | Электрофорез лекарственных препаратов при заболеваниях центральной нервной системы и головного мозга | 150 | |
| A17.24.005 | Электрофорез лекарственных препаратов при заболеваниях периферической нервной системы | 150 | |
| A17.03.001 | Электрофорез лекарственных препаратов при костной патологии | 150 | |
| A17.08.004 | Воздействие токами ультравысокой частоты при заболеваниях верхних дыхательных путей | 150 | |
| A21.01.001 | Общий массаж медицинский | 700 | |
| A21.01.002 | Массаж лица медицинский | 300 | |
| A21.01.003 | Массаж шеи медицинский | 250 | |
| A21.01.003.001 | Массаж воротниковой области | 300 | |
A21.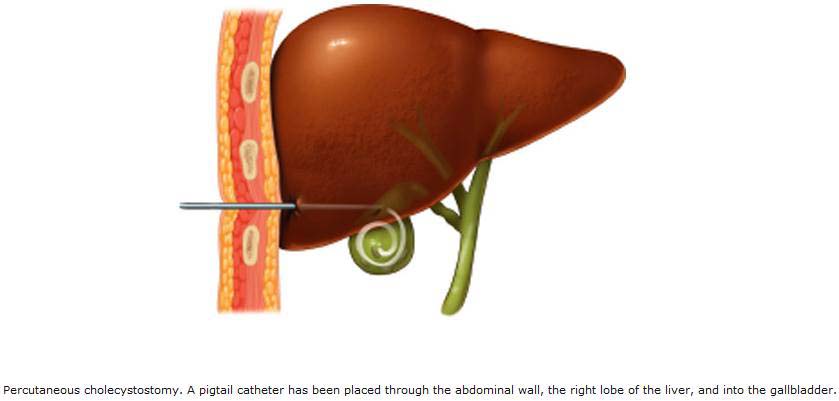 01.004 01.004 | Массаж верхней конечности медицинский | 250 | |
| A21.09.002 | Массаж при хронических неспецифических заболеваниях легких | 300 | |
| A21.23.001 | Массаж при заболеваниях центральной нервной системы | 300 | |
| A21.24.004 | Массаж при заболеваниях периферической нервной системы | 200 | |
| A21.30.002 | Общий массаж и гимнастика у детей раннего возраста | 400 | |
| A21.30.003 | Массаж при заболеваниях нервной системы у детей раннего возраста | 400 | |
| A21.30.004 | Массаж при заболеваниях опорно-двигательного аппарата у детей раннего возраста | 400 | |
| A21.30.005 | Массаж грудной клетки медицинский | 250 | |
| A22.14.002 | Воздействие ультразвуком при заболеваниях печени и желчевыводящих путей | 200 | |
A22. 22.002 22.002 | Воздействие ультразвуковом при заболеваниях желез внутренней секреции | 200 | |
| A22.23.003 | Воздействие ультразвуковое при заболеваниях центральной нервной системы и головного мозга | 200 | |
| A22.24.002 | Воздействие ультразвуковое при заболеваниях периферической нервной системы | 200 | |
| A22.28.003 | Воздействие ультразвуковое при заболеваниях почек и мочевыделительного тракта | 200 | |
| А17.30.009 | Баровоздействие — прессотерапия конечностей, пневмокомпрессия | 200 | |
| A17.01.012 | Воздействие диадинамическими токами (ДДТ-терапия) при заболеваниях кожи и подкожно-жировой клетчатки | 200 | |
| A17.29.002 | Электросон | 200 | |
| A22.01.006 | Ультрафиолетовое облучение кожи | 200 | |
A22.04. 004 004 | Ультрафиолетовое облучение при заболеваниях суставов | 200 | |
| A22.07.005 | Ультрафиолетовое облучение ротоглотки | 200 | |
| A11.09.007.001 | Ингаляторное введение лекарственных препаратов через небулайзер | 200 | |
| B03.020.001 | Услуги по лечебной физкультуре и спортивной медицине | 200 | |
| МАНИПУЛЯЦИИ СЕСТРИНСКОГО УХОДА (1 процедура, сеанс) | |||
| A11.12.009 | Взятие крови из периферической вены | 100 | |
| А11.12.003 | Внутривенное введение лекарственных средств | 100 | |
| А11.12.003 | Внутривенное введение лекарственных средств (капельно) | 300 | |
| A11.02.002 | Внутримышечное введение лекарственных препаратов | 100 | |
| A11.01.002 | Подкожное введение лекарственных препаратов | 70 | |
A11. 01.003 01.003 | Внутрикожное введение лекарственных препаратов | 70 | |
| A11.25.003.001 | Промывание надбарабанного пространства среднего уха | 300 | |
| УСЛУГИ ВРАЧА-РЕВМАТОЛОГА | |||
| A11.04.004 | Внутрисуставное введение лекарственных препаратов | 700 | |
| A16.04.051 | Внутрисуставное введение заменителей (протезов) синовиальной жидкости | 700 | |
| АНЕСТЕЗИОЛОГИЯ И РЕАНИМАЦИЯ | |||
| B01.003.001 | Осмотр (консультация) врачом-анестезиологом-реаниматологом первичный | 800 | |
| B01.003.002 | Осмотр (консультация) врачом-анестезиологом-реаниматологом повторный | 600 | |
| B01.003.003 | Суточное наблюдение врачом-анестезиологом-реаниматологом | 4600 | |
B01. 003.004.001 003.004.001 | Местная анестезия* | 200 | |
| B01.003.004.001 | Местная анестезия** | 600 | |
| B01.003.004.001 | Местная анестезия*** | 1100 | |
| B01.003.004.002 | Проводниковая анестезия | 1200 | |
| B01.003.004.005 | Инфильтрационная анестезия | 700 | |
| B01.003.004.006 | Эпидуральная анестезия | 3000 | |
| B01.003.004.007 | Спинальная анестезия | 2700 | |
| B01.003.004.008 | Спинально-эпидуральная анестезия | 5200 | |
| B01.003.004.009 | Тотальная внутривенная анестезия | 1600 | |
| B01.003.004.010 | Комбинированный эндотрахеальный наркоз **** | 3100 | |
| * продолжительностью до 30 минут | |||
| ** продолжительностью от 30 минутдо 60 минут | |||
| *** при манипуляциях свыше 1 часа | |||
| **** с севораном, длит- ть до 0,5 часа; при увеличении длительности применяются повышающие коэффициенты: | |||
| от 0,5 до 1 часа — 1,32 | 4100 | ||
| от 1 до 2-х часов — 2,06 | 6400 | ||
| от 2 до 2,5 часов — 2,55 | 7900 | ||
| от 2,5 до 3 часов- 3,29 | 10200 | ||
| более 3 часов- 4,06 | 12600 | ||
| ЭНДОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ | |||
A03.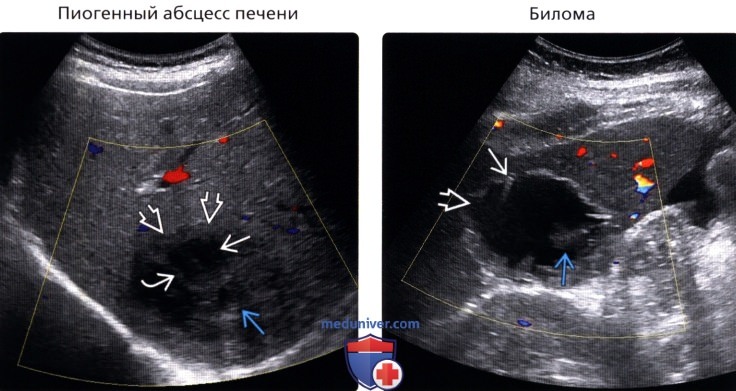 16.001 16.001 | Эзофагогастродуоденоскопия | 1600 | |
| A03.18.001 | Колоноскопия | 3000 | |
| A03.09.001 | Бронхоскопия | 2500 | |
| A16.16.041.001 | Эндоскопическое удаление полипов из пищевода | 3000 | |
| A11.09.008 | Биопсия трахеи, бронхов при бронхоскопии | 3000 | |
| A11.16.001 | Биопсия пищевода с помощью эндоскопии | 3000 | |
| A11.16.002 | Биопсия желудка с помощью эндоскопии | 3000 | |
| A11.16.003 | Биопсия двенадцатиперстной кишки с помощью эндоскопии | 3000 | |
| A11.17.002 | Биопсия тонкой кишки эндоскопическая | 3000 | |
| A11.18.001 | Биопсия ободочной кишки эндоскопическая | 3000 | |
| ФУНКЦИОНАЛЬНАЯ ДИАГНОСТИКА | |||
A05. 10.006 10.006 | Регистрация электрокардиограммы | 220 | |
| A05.10.004 | Расшифровка, описание и интерпретация электрокардиографических данных | 280 | |
| A05.10.008 | Холтеровское мониторирование сердечного ритма | 1200 | |
| A02.12.002.001 | Суточное мониторирование артериального давления | 1200 | |
| A12.09.001 | Исследование неспровоцированных дыхательных объемов и потоков | 800 | |
| A05.02.001 | Электромиография игольчатая (одна мышца) | 800 | |
| A05.02.001.002 | Электромиография накожная (одна анатомическая зона) | 1200 | |
| A05.02.001.011 | Электронейромиография игольчатыми электродами (один нерв) | 800 | |
| A05.02.001.003 | Электронейромиография стимуляционная одного нерва | 1000 | |
А05. 23.001 23.001 | Электроэнцефалография | 1200 | |
| А04.10.002 | Эхокардиография | 1500 | |
| КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ | |||
| B03.016.003 | Общий (клинический) анализ крови развернутый | 400 | |
| A09.05.023 | Исследование уровня глюкозы в крови | 150 | |
| A09.05.083 | Исследование уровня гликированного гемоглобина в крови | 450 | |
| A09.05.007 | Исследование уровня железа сыворотки крови | 250 | |
| A09.05.009 | Исследование уровня C-реактивного белка в сыворотке крови | 270 | |
| A12.06.019 | Определение содержания ревматоидного фактора в крови | 270 | |
| A12.06.015 | Определение антистрептолизина-О в сыворотке крови | 270 | |
| A09.05.010 | Исследование уровня общего белка в крови | 200 | |
A09. 05.017 05.017 | Исследование уровня мочевины в крови | 200 | |
| A09.05.018 | Исследование уровня мочевой кислоты в крови | 200 | |
| A09.05.020 | Исследование уровня креатинина в крови | 250 | |
| A12.28.002 | Исследование функции нефронов по клиренсу креатинина (проба Реберга) | 300 | |
| А09.05.018 | Исследование уровня мочевой кислоты в крови | 570 | |
| А09.05.020 | Исследование уровня креатинина в крови | ||
| А09.05.009 | Исследование уровня C-реактивного белка в сыворотке крови* | ||
| A09.05.026 | Исследование уровня холестерина в крови | 200 | |
| A09.05.004 | Исследование уровня холестерина липопротеинов высокой плотности в крови | 200 | |
| A09.05.028 | Исследование уровня липопротеинов низкой плотности | 200 | |
A09. 05.025 05.025 | Исследование уровня триглицеридов в крови | 200 | |
| A09.05.030 | Исследование уровня натрия в крови | 200 | |
| A09.05.031 | Исследование уровня калия в крови | 200 | |
| A09.05.032 | Исследование уровня общего кальция в крови | 200 | |
| A09.05.041 | Определение активности аспартатаминотрансферазы в крови | 200 | |
| A09.05.042 | Определение активности аланинаминотрансферазы в крови | 200 | |
| A09.05.045 | Определение активности амилазы в крови | 250 | |
| A09.05.046 | Определение активности щелочной фосфатазы в крови | 380 | |
| A09.05.039 | Исследование уровня лактатдегидрогеназы в крови ЛДГ (автоматический анализатор) | 250 | |
| A09.05.044 | Исследование уровня гамма-глютамилтрансферазы в крови | 250 | |
B03. 005.006 005.006 | Коагулограмма (ориентировочное исследование системы гемостаза) | 800 | |
| A12.05.039 | Активированное частичное тромбопластиновое время | 200 | |
| A09.05.051.001 | Определение концентрации Д-димера в крови | 700 | |
| A09.05.021 | Исследование уровня общего билирубина в крови | 230 | |
| A12.05.005 | Определение основных групп по системе AB0 | 200 | |
| A12.05.006 | Определение антигена D системы Резус (резус-фактор) | 200 | |
| A12.05.007.001 | Определение фенотипа по антигенам C, c, E, e, Cw, K, k и определение антиэритроцитарных антител | 400 | |
| A12.06.029 | Определение содержания антител к кардиолипину в крови (Реакция Вассермана) | 200 | |
| B03.016.006 | Общий (клинический) анализ мочи | 240 | |
B03. 016.014 016.014 | Исследование мочи методом Нечипоренко | 200 | |
| B03.016.015 | Исследование мочи методом Зимницкого | 150 | |
| A09.28.003 | Определение белка в моче | 150 | |
| A09.28.003.002 | Определение количества белка в суточной моче | 100 | |
| A09.28.006 | Исследование уровня креатинина в моче | 100 | |
| A09.28.011 | Исследование уровня глюкозы в моче | 100 | |
| A26.19.010 | Микроскопическое исследование кала на яйца и личинки гельминтов | 200 | |
| B03.016.010 | Копрологическое исследование | 320 | |
| A12.20.001 | Микроскопическое исследование влагалищных мазков | 200 | |
| A26.09.001 | Микроскопическое исследование мокроты на микобактерии (Mycobacterium spp.) | 480 | |
B03. 040.001 040.001 | Комплекс исследований для диагностики системной красной волчанки | 620 | |
| A26.06.036 | Определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови | 220 | |
| A26.06.041 | Определение антител к вирусу гепатита C (Hepatitis C virus) в крови | 220 | |
| A26.06.101 | Определение антигена вируса гепатита C (Hepatitis C virus) в крови | 220 | |
| A09.05.060 | Исследование уровня общего трийодтиронина (Т3) в крови | 340 | |
| A09.05.064 | Исследование уровня общего тироксина (Т4) сыворотки крови | 340 | |
| A09.05.063 | Исследование уровня свободного тироксина (СТ4) сыворотки крови | 340 | |
| A09.05.065 | Исследование уровня тиреотропного гормона (ТТГ) в крови | 340 | |
| A09.05.078 | Исследование уровня общего тестостерона в крови | 340 | |
A09. 05.087 05.087 | Исследование уровня пролактина в крови | 340 | |
| A09.05.090 | Исследование уровня хорионического гонадотропина в крови | 340 | |
| A09.05.131 | Исследование уровня лютеинизирующего гормона в сыворотке крови | 340 | |
| A09.05.076 | Исследование уровня ферритина в крови | 340 | |
| A09.05.132 | Исследование уровня фолликулостимулирующего гормона в сыворотке крови | 340 | |
| A09.05.135 | Исследование уровня общего кортизола в крови | 340 | |
| A09.05.153 | Исследование уровня прогестерона в крови | 340 | |
| A09.05.202 | Исследование уровня антигена аденогенных раков CA 125 в крови | 340 | |
| A09.05.201 | Исследование уровня антигена аденогенных раков CA 19-9 в крови | 340 | |
A09. 05.195 05.195 | Исследование уровня ракового эмбрионального антигена в крови | 340 | |
| A09.05.175 | Определение активности простатической кислой фосфатазы крови | 340 | |
| A09.05.154 | Исследование уровня общего эстрадиола в крови | 340 | |
| A09.05.056 | Исследование уровня инсулина плазмы крови | 340 | |
| A09.05.044 | Определение активности гамма-глютамилтрансферазы в крови | 220 | |
| A09.05.039 | Определение активности лактатдегидрогеназы в крови | 220 | |
| A12.22.005 | Проведение глюкозотолерантного теста | 300 | |
| A09.05.205 | Исследование уровня C-пептида в крови | 340 | |
| A12.06.045 | Определение содержания антител к тиреопероксидазе в крови | 350 | |
| A12.06.017 | Определение содержания антител к тироглобулину в сыворотке крови | 350 | |
A09. 05.130 05.130 | Исследование уровня простатспецифического антигена общего в крови | 350 | |
| A09.05.130.001 | Исследование уровня простатспецифического антигена свободного в крови | 350 | |
| A09.05.139 | Исследование уровня 17-гидроксипрогестерона в крови | 350 | |
| A09.05.149 | Исследование уровня дегидроэпиандростерона сульфата в крови | 350 | |
| A09.28.015 | Обнаружение кетоновых тел в моче | 150 | |
| A09.28.003.001 | Определение альбумина в моче | 200 | |
| A09.05.207 | Исследование уровня молочной кислоты в крови | 200 | |
| A09.05.127 | Исследование уровня общего магния в сыворотке крови | 200 | |
| A09.05.033 | Исследование уровня неорганического фосфора в крови | 200 | |
A09.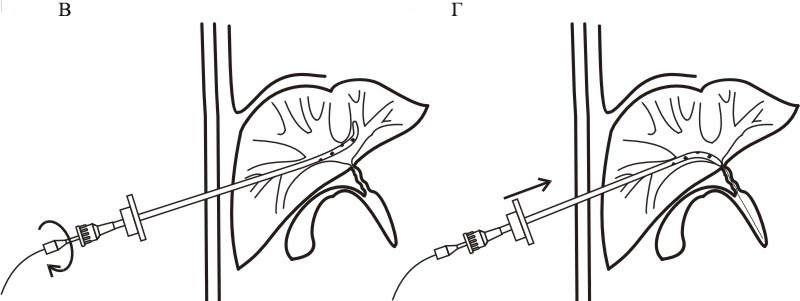 05.253 05.253 | Исследование уровня тропонина T в крови | 400 | |
| A09.28.027 | Определение активности альфа-амилазы в моче | 230 | |
| A09.05.034 | Исследование уровня хлоридов в крови | 200 | |
| A08.09.010 | Цитологическое исследование плевральной жидкости | 800 | |
| A08.22.004 | Цитологическое исследование микропрепарата тканей щитовидной железы | 600 | |
| А08.06.001 | Цитологическе исследование препарата ткани лимфоузла | 800 | |
| А08.28.006 | Цитологическое исследование микропрепарата тканей почек | 800 | |
| А08.15.002 | Цитлогическе исследование микропрепарат тканей поджелудочной железы | 800 | |
| A12.30.012 | Исследование биологического материала методом проточной цитофлуориметрии | 800 | |
A08. 30.027 30.027 | Цитологическое исследование дренажной жидкости (экссудаты, транссудаты) | 800 | |
| * тест на подагру | |||
| ГИПЕРБАРИЧЕСКАЯ ОКСИГЕНАЦИЯ | |||
| A20.01.002 | Оксигенотерапия при заболеваниях кожи | 1000 | |
| A20.09.002 | Оксигенотерапия (гипер-, нормо- или гипобарическая) при заболеваниях легких | 1000 | |
| A20.10.001 | Оксигенотерапия (гипер- и нормобарическая) при заболеваниях сердца | 1000 | |
| А20.24.005 | Гипербарическая оксигенация при заболеваниях периферической нервной системы | 1000 | |
| A20.24.005.001 | Гипербарическая оксигенация при заболеваниях центральной нервной системы | 1000 | |
| A23.30.047 | Лечебная рекомпрессия по кислородным режимам | 1000 | |
A20. 15.001 15.001 | Гипербарическая оксигенация при заболеваниях поджелудочной железы | 1200 | |
| A20.18.002 | Гипербарическая оксигенация при заболеваниях толстой кишки | 1200 | |
| A20.25.001 | Гипербарическая оксигенация при заболеваниях уха | 1200 | |
| A20.26.001 | Гипо-, нормо- и гипербарическая оксигенация при заболеваниях органа зрения | 1200 | |
| A20.30.026 | Оксигенотерапия | 1200 | |
| A20.30.028 | Гипербарическая оксигенация при синдроме длительного сдавления | 1200 | |
| АКУШЕРСТВО- ГИНЕКОЛОГИЯ | |||
| МАНИПУЛЯЦИИ | |||
| A03.20.001 | Кольпоскопия | 1000 | |
| СТАЦИОНАР | |||
| A03.20.003 | Гистероскопия | 2700 | |
А11. 20.008 20.008 | Раздельное диагностическое выскабливание полости матки и цервикального канала | 5900 | |
| А16.20.096 | Удаление новообразования вульвы | 10500 | |
| А16.20.017.001 | Удаление параовариальной кисты с использованием видеоэндоскопических технологий | 12800 | |
| A16.30.079 | Лапароскопия диагностическая | 15800 | |
| А16.20.006 | Резекция шейки матки | 17200 | |
| А03.20.003.001 | Гистерорезектоскопия | 18500 | |
| А16.20.003 | Сальпинго-оофорэктомия лапаротомическая | 20400 | |
| А16.20.002 | Оофорэктомия лапаротомическая | 20700 | |
| А16.20.059.001 | Удаление новообразования влагалища | 21500 | |
| А16.20.098 | Пластика малых половых губ | 21500 | |
А16.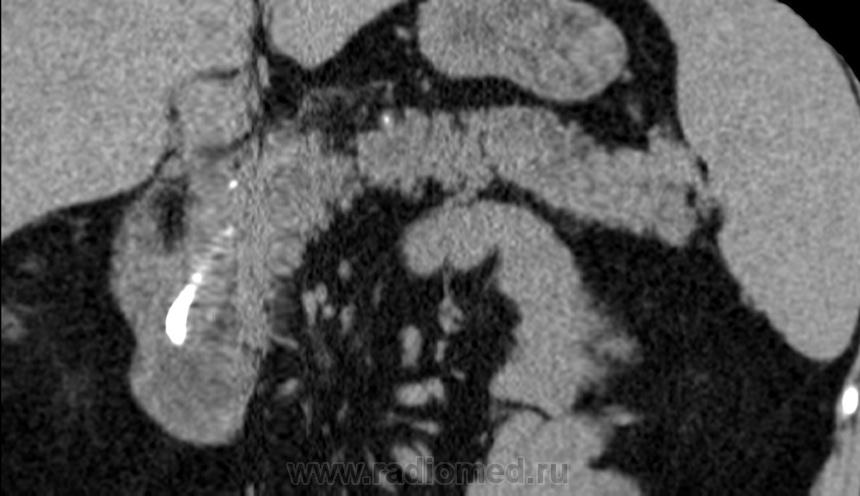 20.010.002 20.010.002 | Субтотальная гистерэктомия (ампутация матки) с придатками лапаротомическая | 21800 | |
| A16.20.061 | Резекция яичника лапаротомическая | 22100 | |
| А16.20.035 | Миомэктомия (энуклеация миоматозных узлов) лапаротомическая | 22800 | |
| А16.20.015 | Восстановление тазового дна | 23600 | |
| А16.20.028.004 | Срединная кольпоррафия | 23600 | |
| A16.20.061.001 | Резекция яичника с использованием видеоэндоскопических технологий | 24000 | |
| A16.20.099 | Гистероскопическая миомэктомия | 24000 | |
| А16.20.011 | Тотальная гистерэктомия (экстирпация матки) лапаротомическая | 24700 | |
| А16.20.007 | Пластика шейки матки | 25100 | |
| A16.20.061.003 | Резекция яичника клиновидная использованием видеоэндоскопических технологий | 25300 | |
A16. 20.001.001 20.001.001 | Удаление кисты яичника с использованием видеоэндоскопических технологий | 26500 | |
| А16.20.011.002 | Тотальная гистерэктомия (экстирпация матки) с придатками лапаротомическая | 26500 | |
| А16.20.095 | Ампутация шейки матки | 26500 | |
| A16.20.004.001 | Сальпингэктомия с использованием видеоэндоскопических технологий | 27900 | |
| A16.20.099.001 | Гистероскопическая миомэктомия электрохирургическая | 24000 | |
| А16.20.002.001 | Оофорэктомия с использованием видеоэндоскопических технологий | 28600 | |
| А16.20.003.001 | Сальпинго-оофорэктомия с использованием видеоэндоскопических технологий | 28500 | |
| А16.20.014 | Влагалищная тотальная гистерэктомия (экстирпация матки) с придатками | 29800 | |
А16. 20.010.001 20.010.001 | Субтотальная гистерэктомия (ампутация матки) с использованием видеоэндоскопических технологий | 33500 | |
| А16.20.010.003 | Субтотальная гистерэктомия (ампутация матки) с придатками с использованием видеоэндоскопических технологий | 33500 | |
| А16.20.035.001 | Миомэктомия (энуклеация миоматозных узлов) с использованием видеоэндоскопических технологий | 33500 | |
| А16.20.083 | Кольпоперинеоррафия и леваторопластика | 34600 | |
| А16.20.011.001 | Тотальная гистерэктомия (экстирпация матки) с использованием видеоэндоскопических технологий | 35500 | |
| А16.20.011.003 | Тотальная гистерэктомия (экстирпация матки) с придатками лапароскопическая с использованием видеоэндоскопических технологий | 35500 | |
| А16.20.014.003 | Влагалищная гистерэктомия с придатками с использованием видеоэндоскопических технологий | 35500 | |
A16. 20.003.005 20.003.005 | Резекция сальника с использованием видеоэндоскопических технологий | 27600 | |
| A16.20.003.003 | Сальпинго-оофорэктомия односторонняя с резекцией контрлатерального яичника и субтотальная резекция большого сальника с использованием видеоэндоскопических технологий | 38600 | |
| A16.20.003.006 | Резекция контрлатерального яичника, большого сальника с использованием видеоэндоскопических технологий | 38600 | |
ВМЕШАТЕЛЬСТВА В БРЮШНОЙ ПОЛОСТИ И ПОЛОСТИ ТАЗА ПОД УЛЬТРАЗВУКОВЫМ КОНТРОЛЕМ. ОБЗОР ОТ А ДО Я
Ультразвуковой (УЗ) контроль для инвазивных процедур является необходимым инструментом и должен рассматриваться, как метод первой линии для большинства процедур в области живота и таза. Существует множество условий в обеспечении безопасности пациентов и оптимальности окружающей среды, где выполняется процедура.
Corinne Deurdulian, MD, Nicole French, MD
ОСНОВНЫЕ ПОЛОЖЕНИЯ
Ультразвуковой (УЗ) контроль для инвазивных процедур является необходимым инструментом и должен рассматриваться, как метод первой линии для большинства процедур в области живота и таза.

Существует множество условий в обеспечении безопасности пациентов и оптимальности окружающей среды, где выполняется процедура, в том числе: расстановка мебели в кабинете и самого оборудования, помощь сонографиста и медсестры и сравнительный обзор истории болезни пациента и полученных изображений.
Совмещение УЗИ еще больше увеличивает пользу УЗИ в проведении инвазивных процедур.
ВВЕДЕНИЕ
Чрескожная биопсия и дренирование жидкости в брюшной полости под видео контролем обычно является радиологическим вмешательством. И УЗ контроль, и компьютерная томография (КТ) используются для изображения инвазивной процедуры. Преимущества УЗИ подхода включают: снижение времени процедуры, отсутствие излучения, низкая стоимость, портативность, режим реального времени визуализации размещения иглы, и режим реального времени допплеровских изображений для профилактики повреждения сосуда или немедленной диагностики таких осложнений, как кровотечение. УЗИ контроль также позволяет быстро, в режиме реального времени, провести аспирацию и дренирование, что исключает необходимость в КТ и излучении для подтверждения расположения иглы или катетера у большинства пациентов.
УЗИ контроль также позволяет быстро, в режиме реального времени, провести аспирацию и дренирование, что исключает необходимость в КТ и излучении для подтверждения расположения иглы или катетера у большинства пациентов.
Для принятия решения об использовании УЗИ или КТ наведения, в первую очередь надо рассматривать УЗИ. Если поражение не видно на УЗИ или безопасный путь проведения исследования не определен, то тогда применяется КТ. Иногда существует необходимость в использовании двух методов. Например, начальный доступ может быть легче выполнен под контролем УЗИ, а подтверждение расположения иглы или катетера – на КТ. Тем не менее, одного УЗИ более чем достаточно для большинства типов абдоминальных вмешательств.
Новые дополнения в процедуре, такие как использование УЗИ контраста, объемная навигация и совмещение расширяют возможности УЗИ. УЗИ контраст помогает визуализировать повреждения, которые могут быть плохо видны при обычном УЗИ, а также определить очаги остаточной или рецидивной опухоли после абляции. Объемная навигации помогает в выборе траектории входа из разных точек на основе расположения цели. Технология совмещения позволяет накладывать изображения КТ, магнитно-резонансной томографии (МРТ) и позитронно-эмиссионной томографии (ПЭТ)/ ПЭТ-КТ на УЗИ картину для проведения прицельной биопсии и абляции.
Объемная навигации помогает в выборе траектории входа из разных точек на основе расположения цели. Технология совмещения позволяет накладывать изображения КТ, магнитно-резонансной томографии (МРТ) и позитронно-эмиссионной томографии (ПЭТ)/ ПЭТ-КТ на УЗИ картину для проведения прицельной биопсии и абляции.
ОБЗОР ДРУГИХ ИЗОБРАЖЕНИЙ
Перед планированием процедуры, очень важно оценить изображение других методов визуализации, таких как КТ, МРТ или ПЭТ, чтобы помочь локализовать или охарактеризовать место поражения или скопление жидкости. Поперечное сканирование может помочь выявить другие очаги, которые более пригодны для биопсии, например надключичные лимфатические узлы или узелки в мягких тканях. Дополнительные повреждения могут отодвинуть на задний план диагноз, что может повлиять на выбор наиболее подходящего поражения для биопсии.
Радиолог затем может пересмотреть историю болезни пациента, лабораторные показатели и информацию об аллергии.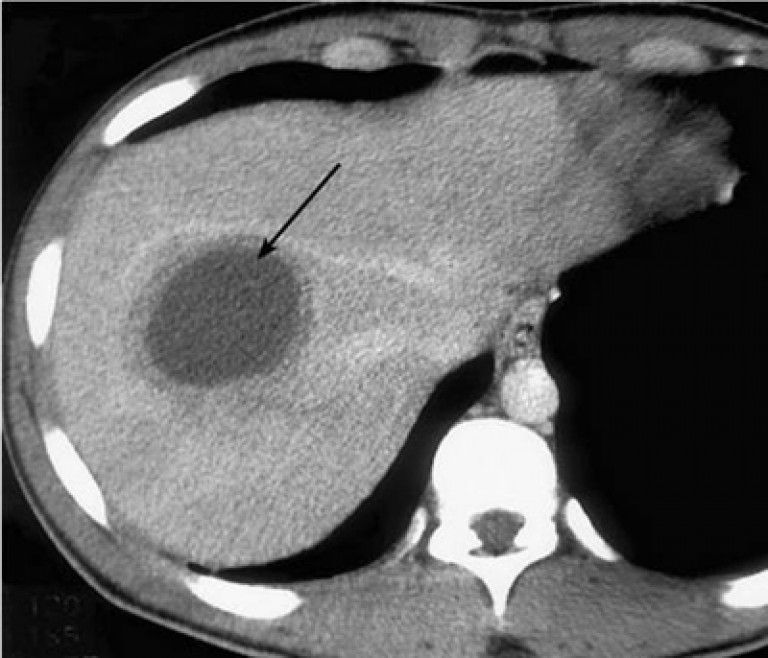 Интервенционный или хирургический метод должен быть взят во внимание для случаев высокого риска. Пациенты с более высоким риском кровотечения, чем в среднем в популяции, должны быть проинформированы о риске и, соответственно, дать согласие.
Интервенционный или хирургический метод должен быть взят во внимание для случаев высокого риска. Пациенты с более высоким риском кровотечения, чем в среднем в популяции, должны быть проинформированы о риске и, соответственно, дать согласие.
СОНОГРАФИСТ
Сонографист играет важную роль как до, так и вовремя процедуры. Он должен иметь все необходимое, чтобы не покидать помещение после того, как процедура началась. Подготовка включает наличие дублирующего оборудования в случае, если что-то упало или непреднамеренно было загрязнено. Проведение УЗ исследования следует также координировать с медсестрой, а также оценить результаты лабораторных исследований до процедуры.
Предварительное сканирование важно для локализации соответствующего поражения или скопления жидкости. Перед тем, как рентгенолог входит в комнату, сонографист может определить интересующее место и помочь оценить возможные траектории входа иглы. В тех случаях, когда необходима смена положения тела пациента, сонографист может также предоставить информацию о положении, которое позволяет оптимально визуализировать цель. После того, как цель определена и положение пациента оптимизировано, оценивается расстояние от кожи, или от верхней части иглы до цели. Сонографист может найти препятствия в возможных траекториях введения иглы, например, кишечник, легкие или крупные сосуды. При этом, необходимо, чтобы была выполнена цветная допплерография, для того чтобы избежать контакта с крупными сосудами. Рентгенолог затем может более точно подтвердить соответствующую траекторию.
Во время процедуры, сонографисту следует записать изображение, демонстрирующее адекватность размещения иглы внутри мишени (Рис. 1). Сонографист может записать видео всей процедуры, когда поднимается вопрос о том, была ли достигнута цель, особенно в труднодоступных для визуализации местах.
УСТРОЙСТВО КАБИНЕТА
Подвижная, регулируемая по высоте кушетка, позволяет выбрать удобный рабочий уровень для рентгенолога, чтобы минимизировать ненужное напряжение. Функционирующий источник кислорода, с соответствующей трубкой или маской должен быть легко доступен. Наличие контейнера для острых предметов – необходимое требование для утилизации игл, скальпелей и др. Кроме того, журнал аварий должен быть доступен в чрезвычайных ситуациях.
Рис. 1. Необходимые шаги во время биопсии. (А) Оценить траекторию к месту поражения (эхогенная опухоль печени, стрелка). (B) Применить цветную допплерографию в поиске судов на пути (стрелка). (C) Записать каждую пункцию, показывая расположение иглы (стрелка). (D) Поиск возможных кровотечений – постскан без – и с цветным допплером (не обнаружено).
УЗИ блок в идеале должен быть расположен напротив рентгенолога и положения пациента (Рис. 2). Эта расстановка позволяет рентгенологу одновременно видеть как игла входит в пациента и УЗИ картину, а также дает врачу пространство на противоположной стороне для записи необходимых изображений. Когда УЗИ аппарат находится на той же стороне, что и врач, последний не может смотреть на монитор и контролировать иглу одновременно, а также не может эффективно скорректировать размещение иглы в зависимости от УЗИ картины. Эта расстановка также способствует напряжения шеи во время процедуры. Новые конфигурации монитора с регулировками его расположения решают часть проблемы. Тем не менее, если необходима документальная регистрация процедуры – пространство, занимаемое УЗИ аппаратом и врачом, очень быстро загромождается.
Рис. 2. Расстановка в кабинете.. (A) Идеальная юкстапозиция врача, обращенного к пациенту, игле и датчику, которые расположены на одной прямой с УЗ монитором. (В) Неидеальное положение, где врач отворачивается от больного и не может видеть иглу и датчик, когда смотрит на монитор. Там нет места для того, чтобы фиксировать изображение.
МЕДСЕСТРА
При умеренном и высоком риске процедуры обычно необходимо присутствие медсестры для оценки и наблюдения за пациентами. Медсестра должна изучить актуальную историю болезни и результаты лабораторных исследований, аллергический профиль, в том числе ранее перенесенные реакции, связанные с лекарствами, которые используются для проведения данной процедуры. Медсестра играет жизненно важную роль в том, чтобы вовремя поднять красный флаг в случае, когда ситуация может стать проблемной во время процедуры или в дальнейшем восстановлении. Медсестра также обеспечивает необходимое лекарственное седативное состояние, чтобы гарантировать уровень контроля боли и тревоги.
СВЯЗЬ С ОТДЕЛЕНИЕМ ПАТОЛОГИЧЕСКОЙ АНАТОМИИ
Связь с отделением патологической анатомии является очень важной в определении типа необходимой биопсии: только лишь тонкоигольная биопсия (fine needle aspiration – FNA), кор-биопсия или оба типа одновременно. Осмотр FNA или отпечатков кор-биопсии во время процедуры уменьшает вероятность неадекватного или недостаточного отбора проб для исследования. Если подозревается лимфома, FNA образцы могут быть направлены на проточную цитометрию. Отделение патологической анатомии также может предоставлять различные растворы для конкретных биопсий, таких как биопсия почки.
ВЫБОР ИГЛЫ
FNA для абдоминальной биопсии, как правило, осуществляется с помощью игл от 18 до 22 размера и может использоваться или самостоятельно, или через коаксиальный датчик. Большинство абдоминальных кор-биопсий выполняются иглами №18. У пациентов с умеренной коагулопатией или с глубокими поражениями, в которых могут быть повреждены кровеносные сосуды, сокращение размера иглы до №20 или выполнение FNA, вместо кор-биопсии, предпочтительнее, так как игла большего размера чаще связана с геморрагическими осложнениями. Тем не менее, многие исследования не сообщают об увеличении риска кровотечения при увеличении размера иглы. Небольшие очаги поражения или расположенные рядом с жизненно важными структурами требуют использования игл с меньшим шагом – например, 1 см вместо 2 см.
Иглы, которые слишком коротки – не доходят до цели, а иглы, которые слишком длинные – могут согнуться, что снижает эффективность достижения цели. Фактическая длина сердечника иглы, как правило, короче указанной на этикетке (Рис. 3).
Рис. 3. Различия в размере иглы. (A) 9-см игла для кор-биопсии – чуть менее 9 см в длину. (В), однако, при введение в тело, фактическая длина иглы составляет менее 7 см. Таким образом, цель должна быть менее 6,5 см от точки входа в кожу.
Многие 10-см иглы для кор-биопсии имеют эффективную длину введения 8 см. Это означает, что 15-см игла нужна для достижения цели на глубине 7-8 см. К тому же, при использовании местной анестезии немного увеличивается расстояние до цели. Схожие проблемы наблюдаются при использовании коаксиальных игл, которые как правило, короче указанной на этикетке длины и короче иглы для биопсии. Например, 10-см коаксиальная игла №18 может иметь длину 6-7 см. Если поражение глубже длины иглы, то необходимо выбрать более длинную коаксиальную систему. Иногда в длину включают муфту, что также необходимо учитывать.
ВЫБОР КАТЕТЕРА
При выборе дренажных катетеров, очень важно выбирать соответствующего диаметра, учитывая характер дренируемой жидкости. Скопление невязкой жидкости обычно дренируется катетерами 8F и 10F. Для более вязких жидкостей, таких как гной и жидкости смешанного характера, могут потребоваться крупные катетеры, такие как 12F и 14F. Катетер 10F 2 разных производителей может иметь разный размер pigtail и боковых отверстий (Рис. 4).
Рис. 4. Два разных 10F катетера. (A) Два разнокалиберных pigtail 10F катетеров. Примечание: у верхнего катетера pigtail менее 2 см в диаметре, а у нижнего – превышает 3 см в диаметре. Чем меньше pigtail, тем это лучше для небольших скоплений жидкости, так как необходимо ввести более короткий катетер. (В) Различия в размерах боковых отверстий различных катетеров. Примечание: верхний катетер имеет большие боковые отверстия, которые дренируют вязкую жидкость лучше, чем более мелкие боковые отверстия.
Катетеры с меньшими pigtail легче разместить в меньшей полости, а большие боковые отверстия способствуют более быстрому дренированию, особенно более вязкой жидкости.
Следует ли использовать модифицированный метод Сельдингера, или технику с одним троакаром зависит от обстоятельств. Техника Сельдингера полезна, когда полость небольшая и глубоко расположена, а оптимальное окно доступа узкое или находится в чувствительной зоне. Если полость большая, с широким окном доступа, в нечувствительном месте, то методика одного троакара обеспечивает достаточно простое и быстрое размещение катетера (12) Многие дренажные катетеры сегодня имеют стандартную конфигурацию троакара, что заменяет технику Сельдингера, когда это возможно.
ВЫБОР ДАТЧИКА
Изогнутый фазированный матричный датчик (например, 4-6 МГц, с диапазоном до 1 или 2 МГц) используется для основных типов абдоминальных вмешательства из-за его глубины проникновения, широкого поля зрения и превосходного пространственного разрешения. Тем не менее, очень часто при исследовании необходимо большее окно и подреберный доступ. Векторный датчик имеет меньшую площадь и, поэтому, проще в использовании в малых пространствах, особенно в межреберье. Хотя, традиционно, меньшее поле зрения является недостатком, новые датчики с высоким разрешением с виртуальной конвексной возможностью компенсируют этот недостаток и обеспечивает возможность наведения на более глубокие повреждения. Если цель расположена поверхностно, или пациент – худой, то высокочастотный линейный датчик (например, 9 МГц) может обеспечить лучшую визуализацию повреждения. Эти датчики имеют каналы для игл, что помогает достичь необходимой цели.
До начала процедуры должно быть выполнено соответствующее сканирование для выбора датчика, который лучше отображает цель и оптимальную траекторию. Если используется направляющая игла с изогнутым датчиком, то воздушный зазор между краем последнего и точкой входа на коже должен быть сведен к минимуму, чтобы улучшить видимость иглы в точке входе. Это может быть достигнуто легким наклоном датчика таким образом, чтобы изогнутый край сохранял контакт с кожей.
КОАГУЛОПАТИЯ И РИСК КРОВОТЕЧЕНИЯ
Протромбиновое время (ПВ)/международное нормализованное отношение (МНО) и количество тромбоцитов являются наиболее важными лабораторными показателями, которые используются для оценки риска кровотечений перед процедурами. Нормальное ПВ колеблется около 11-14 секунд, а нормальное МНО, обычно, находится в диапазоне от 0,9 до 1,1. МНО – 1,5 было использовано в качестве порогового значения для большинства процедур. Многие исследования показали, что риск кровотечений с МНО до 1,7 незначительно увеличивается по сравнению с нормальным МНО.
Активированное частичное тромбопластиновое время (АЧТВ), как правило, не рассматривается в качестве важной величины, как МНО или количество тромбоцитов. Исследования показали, что повышенное АЧТВ является наиболее распространенным коагуляционным отклонением, и не прогнозирует кровотечение в операционной, а аномальные значения АЧТВ часто носит временный характер.
Нормальный уровень тромбоцитов колеблется от 150000 до 450000 со стандартным пороговым значением 50000 для инвазивных процедур. Хотя многие радиологи и не решаются выполнять процедуры у пациентов с уровнем тромбоцитов менее 50 000, многие исследования показывают то, что более низкое количество тромбоцитов не увеличивает риск у пациентов, которые перенесли различные типы процедур. Количество тромбоцитов менее 10 000-20 000 связано со спонтанными кровотечениями.
АНТИКОАГУЛЯНТЫ
Клопидогрель (Плавикс) и подобные средства иногда не могут быть отменены в зависимости от клинической ситуации. Ни Клопидогрель, ни аспирин не могут быть отменены, если пациенту установили сердечный стент с покрытием за последние 12-24 месяца или непокрытый металлический стент за последний месяц.
Если пациенту, получающему Клопидогрель необходимо проведение инвазивной процедуры, сравнительные риски продолжения или прекращения его использования для проведения процедуры должны быть обсуждены с кардиологом пациента или клинической группой. Пациент должен знать о возможном риске кровотечения или кардиоваскулярного осложнения.
Для пациентов, недавно получавших Клопидогрель, процедура может быть изменена таким образом, чтобы можно было выполнить FNA вместо кор-биопсии, или использовать иглу меньшего калибра (например, не №20, а №18). Срок наблюдения после процедуры может быть больше обычного времени восстановления, и жизненно важные показатели должны быть исследованы чаще. Можно запланировать контрольный осмотр вскоре после процедуры, если это необходимо.
КРОВООСТАНАВЛИВАЮЩИЕ ПРЕПАРАТЫ
Тромбоциты
Тромбоциты могут быть введены в количестве 5-6 единиц пакетов с одной дозой, или 1 ферезного пакета. Существует общее увеличение от 5000 до 10000 тромбоцитов на пакет с одной дозой или 25000 до 50000 на все количество или однократную дозу. Оптимальный вариант – если последняя доза тромбоцитов будет дана в начале процедуры. Когда процедурная медсестра не наблюдает за потенциальными реакциями на переливание, процедура должна быть выполнена в течение от 1 до 2 часов после введения тромбоцитов. После введения тромбоцитов, как правило, не рекомендуется перепроверять их число перед процедурой. Это задерживает процедуру, что в свою очередь, уменьшает эффективность тромбоцитов.
Свежезамороженная плазма
Свежезамороженная плазма (СЗП) вводится пациентам для снижения повышенного МНО. Чем выше МНО, тем больше коррекция на единицу СЗП (Таблица 1). Как правило, две единицы СЗП может теоретически уменьшить коагулопатию, когда МНО составляет около 2,5 или больше. Тем не менее, есть данные в пользу поддержки или опровержения преимущества СЗП.
Таблица 1. Оценка коррекции МНО на единицу СЗП
Предтрансфузионное МНО | Коррекция за счет единицы СЗП, среднее и отклонение |
1,3-1,7 | 0,1 (0,1-0,2) |
1,7-2,3 | 0,2 (0,1-0,3) |
2.4-2.9 | 0,4 (0.1-0.7) |
3.0-4.3 | 0,7 (0.2-1.5) |
4.4-20.0 | 3,5 (1.1-8.4) |
Примечание. Чем выше МНО, тем больше отмечается коррекции на единицу СЗП.
Переливание плазмы имеет минимальное воздействие на нормализацию умеренно повышенной МНО, и поэтому СЗП неуместно заказать у 10% до 83% пациентов (15). Легкие и умеренные нарушения свертывания, как правило, не увеличивают риск кровотечения, и переливание СЗП не может, на самом деле, уменьшить кровотечение после процедуры.
Риск посттрансфузионных реакций также должен быть учтен, когда переливаются тромбоциты или СЗП. Переливание реакции включают, но не ограничиваются, аллергию, лихорадку, одышку, перегрузку объемом, и посттрансфузионные поражения легких.
Согласованое руководство Общества интервенционной радиологии выпущено в 2009 г. с поправками и обновлениями в 2013 году. Это полезное пособие для выполнения интервенционных процедур у пациентов с аномальными параметрами коагуляции или заведомо известной коагулопатией. Процедуры были разделены на: процедуры с низким, средним и высоким риском кровотечения с рекомендациями для лабораторного анализа и лечения.
Модификации этих таблиц приведены в таблицах 2-4.
Таблица 2. Низкий риск кровотечения
Процедуры | Предпроцедурные лабораторные тесты | Лечение |
Сосудистые | МНО |
|
Несосудистые | ||
| PLT-нерегулярно рекомендуемо | ASA-не отменять LMWH (терапевтическая доза) |
Примечание. Пожалуйста, обратитесь к официальному обзору.
Сокращения: ASA, аспирин; CVC, центральный венозный катетер; IV, внутривенно; IVC, нижняя полая вена; LMWH, низкомолекулярный гепарин; PICC, центральный катетер вводимый периферически; PLT, количество тромбоцитов.
Таблица 3. Средний риск кровотечения
Процедуры | Предпроцедурные лабораторные тесты | Лечение |
Сосудистые | МНО АЧТВ PLT | МНО коррекция если > 1,5 (СЗП или витамин К) АЧТВ-нет консенсуса , возможна коррекция если > 1,5*норма PLT-переливание, если <50 К Клопидогрель (Плавикс) – отменить на 5 дней |
| ||
Несосудистые | ||
| ASA-не отменять LMWH (терапевтическая доза) |
Примечание. Пожалуйста, обратитесь к официальному обзору.
Сокращения: ASA, аспирин; CVC, центральный венозный катетер; LMWH, низкомолекулярный гепарин; LP, спинномозговая пункция; PLT, количество тромбоцитов; RFA, радиочастотная абляция; UAE, эмболизация маточных артерий.
Таблица 4. Высокий риск кровотечения
Процедуры | Предпроцедурные лабораторные тесты | Лечение |
Сосудистые | МНО АЧТВ PLT | МНО коррекция если > 1,5 АЧТВ-остановить или наоборот гепарин, если > 1,5*норма PLT-переливание, если <50 К Клопидогрель (Плавикс) – отменить на 5 дней |
Несосудистые | ||
ASA- отменить на 5 дней LMWH – отменить на 24 часа или 2 дозы |
Примечание. Пожалуйста, обратитесь к официальному обзору.
Сокращения: ASA, аспирин; LMWH, низкомолекулярный гепарин; PLT, количество тромбоцитов; RFA, радиочастотная абляция; TIPS, трансюгулярное внутрипеченочное портосистемное шунтирование.
Большая часть данных, используемых в настоящее время для процедуры визуального наведения, были экстраполированы из хирургического опыта. Таким образом, в клинической практике методики отличаются, из-за отсутствия рандомизированного контролируемого исследования. Успех, в конечном счете, зависит от сравнительной оценки, выбора типа процедуры и опыта. Новые исследования показывают, что можно быть более либеральными в проведении некоторых процедур, чем традиционно считается, при МНО= 1,5 и пороговым значением тромбоцитов – 50000. В междисциплинарном исследовании O’Connor и его коллеги предлагают более либеральные принципы на основе фактических данных (Таблица 5).
При использовании этих рекомендаций, Kitchin и коллеги показали, что при повышении пороговых критериев коагуляции, при биопсии печени под УЗИ наведением, МНО – от 1,5 до 2, а тромбоцитов – от 50000 до 25000, наблюдается общее уменьшение количества геморрагических осложнений (у 1846 пациентов). Предпроцедурное переливание тромбоцитов и СЗП снизилось пятикратно. Хотя индивидуальный риск кровотечения был выше у пациентов с субоптимальным МНО и значениями тромбоцитов, они отметили, что переливание не уменьшает дополнительный риск кровотечения, при нарушенных значениях лабораторных показателей.
Таблица 5. Рекомендации. Резюме
Вмешательство | МНО | PLT |
FNA ≤20 г | Любые | Любые |
Парацентез | ≤3.0 | ≤25К |
Плевроцентез, биопсия печени, или другая биопсия | ≤2.0 | ≤25К |
Примечание. FNA≤20 г относится к аспирации жидкости в любой части тела. Рекомендации, предложенные O’Connor и его коллегами. Если лабораторные анализы в норме в течение 4-6 месяцев после процедуры и нет значимых клинических изменений, они рекомендуют не повторять лабораторные тесты, если это не оправдано клинической ситуацией.
Пациенты с печеночной недостаточностью могут быть более склонны к кровотечениям, что требует проведения лабораторных тестов чаще, в связи с изменением клинического состояния. Тем не менее, эти пациенты проходят процедур чаще, чем многие другие, у которых частота кровотечений может быть выше. У пациентов из списка на трансплантацию печени, которые получают тромбоциты и СЗП, отмечается улучшение параметров свертывания в динамике, что понижает их место в списке на пересадку и возможное спасение жизни.
Противопоказания
Хотя абсолютных противопоказаний к интервенционным процедурам под УЗИ наведением и нет, относительные противопоказания включают: тяжелую некорректируемую коагулопатию, тяжелую сердечную недостаточность или нестабильность гемодинамики, отсутствие безопасного пути к очагу или мишени (например, крупные кровеносные сосуды, легкие, или кишечник), неспособность пациента терпеть процедуру (например, задерживать дыхание, позиционирование или отказ от сотрудничества) и отказ самого пациента. Противопоказания, касающиеся конкретных органов перечислены в каждой секции отдельно.
ИНТЕРВЕНЦИОННЫЕ МЕТОДЫ
При выполнении вмешательства очень важно, чтобы кончик иглы всегда находился в оптимальном поле зрения и фокусе, особенно когда он проникает в мишень, что достигается настройками и использованием датчика высокой частоты, Игла лучше всего визуализируется в (продольной) плоскости, когда она (игла) параллельна длинной оси датчика и находится под углом по отношению к УЗИ лучу, так чтобы вся длина и ее наконечник визуализировались. После местной анестезии дермы, анестетик должен быть введен под капсулу органа-мишени или очаг поражения, если он находится за пределами органа. Используя УЗИ контроль введения иглы для проведения анестезии, можно использовать спинальную иглу для достижения нужного уровня. Авторы предпочитают использовать для этой цели иглы 20 диаметра, так как более тонкие иглы, как правило, сгибаются в брюшной полости или забрюшинном пространстве. Если необходим умеренный седативный эффект, все равно пациент должен быть достаточно бодрым, чтобы быть в состоянии задержать дыхания, когда это необходимо.
Существует несколько методов преодоления трудностей в достижения цели для биопсии или дренирования. Изменение положения пациента и дыхание – простые приемы, которые могут улучшить доступ. Гидродиссекция является очень полезным методом, при котором используется инъекция физиологического раствора или стерильной воды для оттеснения мешающих структур от мишени (Рис. 5). Этот метод может быть особенно полезным при доступе к забрюшинным структурам, таких как надпочечники (для смещении плевры латерально и расширении заднего паравертебрального пространства, что позволяет осуществить задний экстраплевральный доступ. Кроме того, непрерывное давление датчиком на место доступа может помочь оттеснить петли кишечника с траектории биопсии.
МЕТОДЫ БИОПСИИ
Два метода используется для УЗИ биопсии: мануальная и проводниковая методика. Каждая техника имеет свои преимущества и недостатки. Проводниковая методика обеспечивает предсказуемую траекторию иглы, но ограничена фиксированным углом атаки. Количество фиксированных углов зависит от проводников иглы, как правило, от 1 до 4. Траектория может быть изменена путем изменения угла наклона проводника из того же разреза. Мануальная техника требует большего технического мастерства и может быть сложной для начинающих или неопытных интервенционалистов. Это, зачастую, требует корректировки и исправление пути проведения иглы. Тем не менее, отсутствие фиксированного угла создает большую гибкость в изменении угла атаки без внесения изменений в проводник или необходимости нового разреза. В исследовании с использованием фантомов, проводниковая техника оказалась более быстрой, эффективной и воспроизводимой чем мануальная, особенно для менее опытных интервента. Было отмечено значительное снижение количества попыток ввода иглы, сокращение общего времени, необходимого для выполнения биопсии, уменьшение количества проходов.
Рис. 5. Гидродиссекция. (А) Поражение печени видно на её куполе (слева). По краю печени траектории иглы лежит кишка, что лучше видно на совмещенном КТ (справа). (B) Кишечник по переднему краю печени при УЗИ визуализации. (С) Выполнена гидродиссекция с использованием от 100 до 150 мл физиологического раствора, что отдалило кишечник от поверхности печени, чтобы обеспечить безопасную точку входа. (D) Теперь биопсия может быть безопасно выполнена.
Дополнительный плюс чрескожной биопсии – использование коаксиальной системы. Преимущество коаксиальной методики в том, что коаксиальная игла, как правило, вводится только один раз в орган или очаг. Этот метод может уменьшить риск таких осложнений, как кровотечение, пневмоторакс и распространение опухоли по ходу пути иглы. Кроме того, несколько образцов ткани могут быть получены из очага поражения, слегка изменяя траекторию иглы без полного ее извлечени. Если коаксиальная игла размещена вместе с биопсийным проводником, то, возможно, потребуется отделение этого направляющего устройства от коаксиальной иглы, чтобы избежать перемещения иглы во время процедуры, до тех пор, пока вторая пара рук не будет держать датчик и иглу на месте.
Существует два типа образцов биопсии, которые могут быть получены: FNA и кор-биопсия (core needle biopsy – CNB). FNA образцы из брюшной полости обычно получают, используя иглы №18-22 и анализируются цитологически, тогда как CNB образцы, полученные с использованием большего диаметра игл от №14 до №20 (как правило, №18), исследуются гистологически. Основным преимуществом FNA, учитывая меньший размер иглы, является снижение риска кровотечения. Преимущества CNB включают: сохранение архитектуры ткани, что может требоваться для диагностики высокодифференцированных гепатом и лимфом; возможность использовать специальную окраску и иммуногистохимические методы. При сравнении цитологии FNA и CNB в оценке брюшных новообразований, Stewart и его коллеги показали, что FNA цитология была более чувствительной и точной, чем CNB (FNA цитология была эффективна в 122 из 141 [86,5%] случаях, а CNB – в 113 из 141 [80,1%] случаях). Тем не менее, одним из преимуществ CNB была способность выявлять подтипы опухолей (выявление происхождения или характеристик опухоли). Сочетание двух методов обеспечивают высокую точность.
Мазок-отпечаток является полезным дополнением к CNB, так как он позволяет оценивать качества материала на месте в режиме реального времени и может быть дополнительным диагностическим материалом, если CNB не выдержит обработку. В ретроспективном обзоре сравнения FNA и CNB с или без мазка-отпечатка 154 патологий почек с использованием УЗИ или КТ наведения, CNB с мазком-отпечатком показала большую адекватность образца ткани, чем FNA. В этом исследовании, FNA были получены в несколько проходов иглой №21 или меньшего калибра, а CNB были получены с иглами №20 калибра или больше. Адекватность образца ткани была удовлетворительной в 86% FNA и 94% – CNB, и в 95% CNB с мазком-отпечатком. CNB с или без мазка-отпечатка имела большую адекватность образца и диагностическую ценность, чем FNA. Еще одним преимуществом является то, что CNB предоставляет больше диагностической информации (подтип и ядерный класс) в диагностике почечно-клеточной карциномы.
Для биопсии некротических поражений, игла должна быть направлена в сторону периферии поражения, чтобы получить адекватный клеточный материал. Получение FNA или мазка-отпечатка в этих случаях также минимизирует вероятность неадекватного выбора траектории или место в очаге поражения, которые могут быть изменены, если полученный образец ткани не несет диагностической ценности.
Число проходов при биопсии может быть сокращено, если патологоанатом на месте быстро выполняет мазок-отпечаток и анализирует основные образцы FNA или CNB. Эта экспресс оценка помогает избежать неинформативного результата биопсии. Тем не менее, цитология на месте для каждой процедуры биопсии может быть невозможна из-за ограниченности ресурсов. В исследовании, проведенном Appelbaum и коллегами, показано, что, хотя размер поражения и его расположение не влияют на количество проходов иглой, необходимых для постановки диагноза, при метастатических поражениях необходимо выполнять их меньше. Без наличия цитолога, 3 прохода иглы будет диагностически достоверно в 90% всех биопсий печени под УЗИ наведением с использованием иглы №18 для CNB. В госпитале авторов статьи, для большинства биопсий твердых органов, осуществляется 2-3 прохода иглой №18.
МЕТОДИКИ УСТАНОВКИ ДРЕНАЖА
Для подкожного дренирование скопления жидкости под УЗ наведением используется два метода. К ним относятся метод Сельдингера и троакарный метод. При методике Сельдингера после локализации скопления жидкости под УЗИ контролем, 5F №19 Yueh (Cook Medical, Bloomington, IN) игла катетера продвигается в очаг. При аспирации жидкости, наружная оболочка продвигается дальше, а игла извлекается. 0.035- или 0,038-дюймовый проводник вводится через оболочку и сворачивается колечком в полости с жикостью. Наружная оболочка удаляется по проводнику и затем выполняется серийная дилятация. Как правило, используются дилятаторы с шагом 2F до окончательного размера катетера. Катетер выбора затем продвигается по проводнику, убедившись, что все боковые отверстия расположены в полости, затем проводник удаляется. Формируется Pigtail катетера и подсоединяется дренажный мешок. Преимущества этой техники включают способность манипулировать проводником в точном месте до окончательного введения катетера. Недостатки этого метода включают повышенное время процедуры по сравнению с троакарным методом, проблемы с перегибом проводника и утечка жидкости вокруг проводника во время удаления иглы или дилятаторов.
При троакарном методе, катетер непосредственно монтируется на стилет или троакар и дилятация не выполняется. После локализации полости и проведения местной анестезии, выбранный катетер продвигают в скопление жидкости. После его надлежащего размещения для аспирации жидкости и прямой УЗИ визуализации, разворачивается pigtail и дренажный мешок соединяется с катетером. Преимущества этого метода включают быстрее размещение катетера из-за сокращения числа действий по сравнению со способом Сельдингера, а также уменьшение утечки жидкости вдоль канала.
Наводящая игла используется для лучшего наведения катетера на полость. При троакарном методе 8.5F катетер проводится через наибольший направляющий троакар. В качестве альтернативы, наводящая игла может использоваться для корректирования направления катетера Yueh по технике Сельдингера. После размещения проводника и удаления наводящей иглы, направляющее устройство отсоединяется, а затем вводится катетер на направляющий проводник.
Дренажи устанавливаются через прямой доступ к очагу или через прилежащий орган, например: печень, почки, селезенка. Гематомы и серомы после трансплантации обычно не требуют дренирования. Лимфоцеле, абсцессы и уриномы, как правило, хорошо поддаются дренированию.
РАСПОЛОЖЕНИЕ ПАЦИЕНТА
Как правило, пациентам наиболее комфортно в положении лежа на спине с удобной подушкой и клином или валиком под коленями, для уменьшения давления в нижней части спины. Хотя некоторые пациенты должны быть размещены в косых или наклонных позициях для проведения процедуры, необходимо обеспечить комфорт пациенту с помощью подушки, полотенца или клиньев из пены, что уменьшает движение пациента во время процедуры.
ВМЕШАТЕЛЬСТВА НА ПЕЧЕНИ
Показания
Биопсии печени является одной из наиболее часто выполняемых процедур в области живота, как прицельные, так и неприцельные. Показания к биопсии печени включают: диагноз острого и хронического гепатита, аномалии метаболизма железа и меди, болезни накопления гликогена, инфекции, первичный билиарный цирроз печени, диагностика злокачественных новообразований и дифференцирование доброкачественных и злокачественных новообразований. Биопсия печени после ее пересадки обычно выполняется в случае подозреваемого отторжения. Чрескожная аспирация и дренирование выполняется для лечения как гнойных, так и амебных абсцессов печени, а также симптоматических и эхинококкозных кист печени.
Потенциальные противопоказания
Энцефалопатия, печеночная недостаточность с тяжелой желтухой и серьезная системная патология может помешать вмешательству на печени. Внепеченочная обструкция и бактериальный холангит также являются противопоказаниями, которые могут привести к перитониту и сепсису. Большой объем асцита может осложнить доступ к печени, но это может быть решено путем проведения парацентеза перед процедурой и, поэтому, не рассматривается как противопоказание. Little и коллеги считают, что асцит не влияет на частоту осложнений при биопсии печени.
Процедура
Транспаренхимальный доступ, при котором нормальная ткань печени отделяет место предполагаемой биопсии, могут уменьшить риск внутрибрюшинного кровотечения, и есть особенно важным в предотвращении перитонеальной утечки жидкости при подозреваемом эхинококкозе. Межреберный, подреберный и эпигастральный доступы могут использоваться для процедуры. Эпигастральный или подреберный доступ часто используется для доступа к левой доли печени. Эти варианты помогают избежать повреждение плевральной полости (Рис. 6).
Рис. 6. УЗИ биопсия трансплантата печени с использованием иглы №18 для кор-биопсии. (A) До и (B) после процедуры.
Межреберный и подреберный доступ используется для правой доли печени (Рис.7). При использовании межреберного подхода, игла должна располагаться непосредственно над ребром, чтобы избежать повреждения межреберных сосудов.
Рис. 7. УЗИ биопсия образование диаметром 2,3 см в правой печеночной доле (A) коаксиальная мануальная техника (В) игла для кор-биопсии №18. Данная патология – гепатоцеллюлярная карцинома.
Если используется межреберный доступ, следует иметь в виду, что край плевры простирается примерно до 12-го ребра сзади, 10 ребра сбоку и 8-го ребра спереди. Пневмоторакс встречается редко, даже если повреждена плевра, но удалось избежать повреждения легких. Childs and Tchelepi рекомендуют следить за движением эхогенных легких во время вдоха, чтобы выбрать траекторию без легочной паренхимы. Необходимо приложить все усилия, чтобы избежать сосудистых структур, особенно печеночных артерий и центральных сосудов.
Необходимо прижимать пальцами место биопсии, если это возможно, после каждого прохода иглой рентгенологом или сонографистом. После процедуры, пальцевое давление места биопсии осуществляется не менее 2 минут. Постпроцедурное сканирования может выполняться на предмет кровотечения. Если пациент с коагулопатией – может быть выполнена эмболизация биопсийного канала гелевой пеной через коаксиальную иглу для предотвращения кровотечения. Тем не менее, трансюгулярная биопсия печени рассматривается, как метод выбора у пациентов с тяжелой коагулопатией.
Чрескожная игольная аспирация или катетерное дренирование под визуальным контролем в сочетании с антибактериальной терапией – метод выбора для гнойных и амебных абсцессов печени. Чрескожная игольная аспирация проводится под УЗИ контролем в реальном времени для локализации абсцесса и определения направления введении иглы. Размер иглы варьируются от 18 до 22 калибра в зависимости от размера очага. Изменение размера полости должно контролироваться в режиме реального времени на УЗИ изображении во время аспирации. Чрескожное дренирование выполняется либо троакаром или по технике Сельдингера. Размеры катетеров, как правило, варьируют в диапазоне от 8F до 12F, в зависимости от размера полости. После установки катетера, аспирация должно быть выполнена немедленно. Катетер должен быть фиксирован к коже для непрерывного внешнего дренирования и оставаться на месте, пока вытекание жидкости на прекратится. Околопеченочные абсцессы иногда трудно отличить от печеночных или субкапсулярных (Рис. 8).
Рис. 8. Дренирование под УЗИ наведением околопеченочного абсцесса (А) с размещением 10F катетера, чреспеченочный доступ. (В, C) В общей сложности аспирировано 230 мл гноя, дренаж оставлен на месте (стрелки). КТ изображения до (D) и после (E) дренирования демонстрируют полную эвакуацию абсцесса.
Большие симптоматические кисты также хорошо поддаются дренированию (Рис.9).
В ретроспективном исследовании Giorgio и коллег, 87 чрескожных игольных аспираций были выполнены под контролем УЗИ у пациентов с гнойными абсцессами печени. Это лечение в сочетании с антибактериальной терапией было эффективным у всех пациентов. Рецидивов не было. Для большинства пациентов, один сеанс чрескожного дренирования был достаточным, и только 7,7% пациентам потребовалось повторное. Тем не менее, некоторые исследователи выступают за использование катетерного дренирования для чрескожной аспирации. В рандомизированном проспективном исследовании 60 пациентов с гнойными абсцессами печени, чрескожная игольная аспирация была успешной лишь у 67% пациентов, в то время, как чрескожное дренирование катетером был эффективным у 100% больных (40).
Рис. 9. Аспирация под УЗ наведением 6 см простой кисты левой доли печени (А), которая вызывала боль в эпигастрии. 5F Yueh катетер (B, стрелка) был использован для аспирации. (С) После аспирации – полное разрешение кисты (стрелки). Боль в эпигастрии у пациента исчезла.
Точно так же, в рандомизированном исследовании 50 пациентов с абсцессами печени сравнивалась чрескожная пункция с катетерным дренированием. Чрескожный катетерный дренаж был более эффективным. Чрескожная игольная аспирация была успешна только у 60% пациентов, в то время как катетерный дренаж был эффективным у всех пациентов (41). Хотя большинство печеночных абсцессов менее 4 или 5 см, как правило, реагируют на консервативную антибиотикотерапию, абсцессы в левой доле, близкие к перикарду, обычно дренируют, из-за риска их прорыва в полость перикарда.
Чрескожное лечение эхинококковых кист было впервые введено в 1985 году Mueller и его коллегами (42), (Рис. 10 и 11). До этого, чрескожная игольная пункция или аспирация эхинококкозной кисты всегда были противопоказаны из-за потенциальных осложнений – анафилактического шока или распространение кист по брюшине. При чрескожном лечении эхинококковых кист, профилактическая доза альбендазола, от 15 до 20 мг/кг, дается два раза в день орально, начиная за 1 неделю до процедуры, и продолжается в общей сложности 4 недели.
Рис. 10. Размещение дренажа под УЗИ наведением в эхинококковой кисте левой доли печени на МРТ. Т2-взвешенное МРТ изображение (А, В) демонстрирует большую кисту (C), замещающую левую долю печени. Меньшие кистозные структуры, книзу от кисты похожи на дочерние кисты. 12F pigtail катетер (D, стрелка) был помещен в полость и аспирировано 60 мл темно-зеленой жидкости. Постпроцедурная томография показала уменьшение размера кисты и дренаж в ее полости.
Рис. 11. Эхинококковая киста печени (красная линия – траектория дренирования).
Два разных сколецидных агента могут быть введены в кисту, в том числе 100% спирт или 20-30% гипертонический раствор. Эти агенты работают по принципу того, что алкоголь вызывает денатурации белка и гибель клетки, а затем фиброз стенки кисты. Несколько методов были отмечены для лечения эхинококковых кист. Один из способов лечения кист размером менее 6 см, используя пункцию, аспирацию, инъекцию и реаспирацию, описывается BenAmor и коллегами. Пункция кисты осуществляется иглой №19 под УЗИ контролем, с последующей аспирацией половины объема кисты, инъекцией 20% гипертонического солевого раствора в размере одной трети первоначального приблизительного объема кисты, 20-минутным ожиданием и реаспирацией всей жидкости из кисты. Катетеризация используется для кист размером более 6 см. После инъекции гипертонического солевого раствора, 6F- 9F pigtail катетер помещают в полость на 24 часа для пассивного дренирования. Если цистографическое исследование через катетер не показывает связь между полостью кисты и желчными путями, в полость вводится половина первоначального предполагаемого объема кисты абсолютного спирта на 20 минут для получения протосколецидного и склерозирующего эффекта. Если есть связь, то спирт не должен использовать, так как может развиться вторичный склерозирующий холангит.
Метод двойной прокол-аспирация-инъекция (D-PAI) включает в себя тонкоигольную пункцию кисты печени, удаление жидкости кисты и инъекция 95% спирта в кисту, для замены от 50% до 60% удаленной жидкости (44). Процедура затем повторяется через 3 дня после начальной аспирации. Вторая половина процедуры не включают реаспирацию сколецидного агента (95% спирт) или катетерное дренирование. В обзоре Giorgio и коллег более 225 кист лечили D-PAI, при этом результат методики был равен хирургическому вмешательству. В долгосрочном наблюдении, в среднем – 48 месяцев, в 48,4% случаев кисты исчезли, в 46,2% остался солидный очаг по УЗИ данным. Оставшиеся 5,3% кист, были представлены остаточной полостью с минимальным жидким компонентом, которая повторно аспирирована под УЗ контролем, и при этом не выявлено жизнеспособных сколиксов. Новых внутрипеченочных или внепеченочных кист не было выявлено. Местные рецидивы отмечены в 5% случаев.
Дополнительные преимущества печеночных вмешательств под УЗИ наведением включают: размещение игл и зондов для абляции, склеротерапии симптоматических кист печени, размещение локальны меток в метастатических поражениях до химиотерапии и метастазэктомии.
ПОСТПРОЦЕДУРНОЕ НАБЛЮДЕНИЕ
Постпроцедурные схемы мониторинга варьируются в зависимости от клиники и, как правило, составляют от 2 до 6 часов. В учреждении авторов, за пациентом ведется наблюдение 2-4 часа в зависимости от состояния больного с полным мониторингом жизненно важных функций. Если использовался доступ в правом межреберье, то пациент лежит на правом боку. Постпроцедурные УЗИ исследования, как правило, не выполняются, если у пациента нет строгой симптоматики и не подозреваются осложнения, связанные с процедурой. Если подозревается пневмоторакс, то выполняется рентгенография.
При лечении эхинококковой кисты, УЗИ оценка размера в динамике и УЗИ картина кисты очень важна. Большое снижение объема кисты отмечается сразу же после процедуры, а постепенное изменение УЗИ картины от кистозной до твердой происходит в течении от нескольких месяцев до нескольких лет. Постоянство круглой формы, анэхогенный вид, гладкая и тонкая стенка кисты, отсутствие поврежденных эндоцист при рутинных последующих УЗИ осмотрах вызывают тревогу в пользу рецидива. При излечении, должно быть видно только твердый остаток кисты. Иногда, на месте кисты ничего не обнаруживают.
Осложнения
Осложнения включают: кровотечение (Рис. 12 и 13), пневмоторакс и распространение инфекции из канала иглы.
Рис. 12. Кровотечение после биопсии печени.
Частота осложнений при биопсии поражений печени и дренировании ее абсцессов – невысокая. При анализе осложнений центром, в котором выполнены 2320 биопсии печени, не было серьезных осложнений после FNA или CNB. Малые осложнения включали: самоограниченный гемоперитонеум (0,3%), вазовагальные реакции (0,04%) и транзиторные гипотонии (0,08%). Ни одного случая опухолевого посева вдоль канала иглы не наблюдалось. Также, в том же исследовании после дренирования абсцесса печени крупных осложнений не наблюдалось. Незначительные осложнения включали: транзиторная гипертермия и умеренная боль, которая уходила в течение 24 часов.
Рис. 13. Осложнения. Поражение печени видно на МРТ (A, B, стрелка) и УЗИ (C), возможно с признаками кровотечения после выполнения прямой биопсии, минуя здоровую паренхиму. Биопсия выявила гепатоцеллюлярную карциному (ГЦК). Теперь большинство биопсии предполагаемой ГЦК можно избежать за счет диагностической МРТ.
Контрольное УЗИ исследование не выполняется, если у пациента нет строй симптоматики и не подозреваются осложнения, связанные с процедурой.
Отдаленные результаты лечения одного учреждения, в котором лечилось, в общей сложности, 72 пациента с 106 печеночными эхинококковыми кистами говорят о 11,1% незначительных осложнений, в том числе крапивнице и лихорадке. Основные осложнения включали: инфицирование полости кисты (2,8%), развитие желчных свищей (5,6%) и рецидив (2 больных в сроки 6 месяцев после процедуры).
НАДПОЧЕЧНИК
Показания к биопсии надпочечников включают: диффдиагностика доброкачественной и злокачественной патологии, характеристика поражения надпочечников у пациентов с несколькими злокачественными новообразованиями, определение источника первичной злокачественной опухоли и определение стадии, заведомо известного злокачественного поражения надпочечников.
Противопоказания
Следует избегать биопсию надпочечников, если подозревается феохромоцитома.
Выполнение процедуры
Как правило, имеет смысл использовать и КТ, и УЗИ с или без совмещения изображений при выполнении биопсии поражения надпочечников. КТ обеспечивает лучшее пространственное разрешение, а УЗИ – лучшее временное разрешение. При использовании УЗИ может использоваться как мануальное наведение, так и техника совмещённых изображений. Седация сознания может быть использована; однако, пациенты должны сохранять возможность регулировать задержку дыхания, учитывая близкое расположение надпочечника к диафрагме. Для биопсии надпочечников может использоваться задний доступ; однако, размещение пациента в ипсилатеральном положении на боку может быть оптимальнее во избежание пневмоторакса. Альтернативный доступ: передний, чрезпанкреатический, чреспеченочный и трансселезеночный. Каудально-цевальный доступ используется для предотвращения повреждений почки и диафрагмы. Если опухоль будет иметь сосудистую структуру или выявлено кровотечение в режиме реального времени при УЗИ контроле, тогда следует выполнить эмболизацию биопсийного канала гелевой пеной (Gelfoam) до извлечения иглы.
Постпроцедурное наблюдение
В учреждении авторов за пациентом веедтся набллюдение 2-4 часа с тщательным мониторингом витальных функций. Постпроцедурное УЗИ исследование не выполняется, если у пациента нет патологических симптомов.
Осложнения
Наиболее распространенные осложнения включают кровотечения и пневмоторакс. Реже развивается панкреатит, только если используется передний доступ. Распространение опухолевых клеток вдоль канала иглы встречается крайне редко, чаще всего это зарегистрировано при первичной адренокортикальной карциноме. Использование коаксиальной техники эффективно в снижении распространения опухолевых клеток вдоль канала иглы. В исследовании Mody и коллег, в котором были изучены непосредственные и отдаленные осложнения чрескожной биопсии опухолей надпочечников в 79 случаях, частота осложнений была выше при чреспеченочном доступе (12%), чем при заднем доступе (8%). Осложнения включали: пневмоторакс, боль, околопочечные кровоизлияния, субкапсулярные и внутрипеченочные гематомы и один случай метастаза печени вдоль биопсийного канала иглы.
ВМЕШАТЕЛЬСТВА НА ПОЧКЕ
Показания
В прошлом, биопсия опухолей почки выполнялась для диагностики лимфомы, метастазов, инфекции или опухоли у больных с хирургическим риском. Тем не менее, показания к биопсии почек, в настоящее время, расширены, за счет включения пациентов с: опухолями почек и известного экстраренального первичного злокачественного новообразования, опухолями почек с особыми признаками, которые предполагают неоперабельный рак почки, опухолями почек и хирургическим сопутствующими заболеваниями и опухолями почек, которые могут быть вызваны инфекцией. Общепринятые показания для биопсии включают: пациентов с небольшой (до 3 см), гиперденсивной, однородной опухолью почки; пациентов с опухолью почки, подготовленных для подкожной абляции и пациентов с неопределенными кистозными опухолями почки.
Неприцельные кортикальные биопсии нативных почек выполняются у пациентов с диффузной паренхиматозной патологией, лабораторных показателях, указывающих на протеинурию, гематурию или необъяснимую острую почечную недостаточность. Так как в этом случае окончательный диагноз является важным для назначения лечения (то есть, определения активности и потенциалльной обратимости процесса, или, наборот, обозанчения, есть ли процес хроническим и необратиммым.
Неприцельные кортикальные биопсии трансплантированных почек выполняются при почечной дисфункции. Наиболее частым показанием для биопсии трансплантата почки является диагностика отторжения трансплантата.
Противопоказания
К противопоказаниям неприцельной биопсии относятся: неконтролируемая артериальная гипертензия (систолическое артериальное давление >180 мм рт.ст.), инфекция почек или паранефрия.
Выполнение процедуры
Пересаженная почка нуждается только в местной анестезии, так как она уже не иннервируется. Для биопсии нативных почек, пациент должен лежать на животе или, возможно, в косом положении на боку. Подушка или валик должны быть помещены под нижнюю часть живота пациента, чтобы выпрямить естественный лордоз позвоночника и облегчить определение точки входа иглы над соответствующей почкой. Подреберный доступ часто используется для исключения плеврального прокола. Биопсия нижнего полюса коры, как правило, выполняется как можно ближе к ее периферии, чтобы избежать контакта с почечными воротами или сосудами. Чрескожная биопсия пересаженной почки может быть технически проще, чем биопсия нативных почек, учитывая поверхностное расположение аллотрансплантата почки в тазу (Рис. 14 и 15). В большинстве случаев пациент может лежать на спине.
Для биопсии опухолей почек используется кор-биопсия иглой №18, а также FNA (Рис. 16). Почечные корковые биопсии выполняются биопсийным пистолетом с иглой №18 или больше, так как меньший диаметр предоставляет слишком тонкий стержень ткани, что не обеспечивает адекватным биопсийным материалом. Соответствующий размер иглы, как правило, определяется требованиями патологоанатомического отделения. Некоторые патологоанатомические отделения приглашают присутствовать цитолога при биопсии для обеспечения выбора образца оптимального размера и количества. 2 или 3 образца, каждый 2 см в длину, зачастую достаточно для постановки диагноза. Как правило, по крайней мере, один образец помещают в 10% формалин для световой микроскопии, а другой в 2,5% глутаровый альдегид для электронной микроскопии. Образец для иммунофлюоресцентного анализа, как правило, помещают в раствор Зевса (Zeus (Michel).
Рис. 14. УЗИ биопсия почки после трансплантации (в исполнении нефролога) с ненадлежащим размещением кончика иглы (стрелки) в почечной лоханке.
Рис. 15. УЗИ биопсия почки после трансплантации осуществляется радиологом с соответствующим размещением кончика иглы в верхнем полюсе правого нижнего квадранта трансплантанта почки (А). Была выполнена эмболизация гелевой пеной (В).
Рис. 16. УЗИ биопсия опухоли левой почки (A, B, стрелка) у пациента с раком мочевого пузыря. Было проведено три прохода иглой №18 с использованием коаксиальной техники (C, D). При исследовании выявлена высокодифференцированная инвазивная уротелиальная карцинома.
Если есть опасения в пользу лимфопролиферативного посттрансплантационного расстройства, выполняется дополнительная кор-биопсия или проточный цитометрический анализ. Во время биопсии опухолей почек должен присутствовать цитолог, чтобы обеспечить взятие соответствующих образцов ткани. Как только игла извлечена, может быть использована цветная допплерография для оценки возможного кровотечения из места биопсии. Кровотечение, как правило, останавливается пальцевым прижатием от 5 до 10 минут. Можно также провести эмболизацию канала гелевой пеной.
Постпроцедурное наблюдение
После процедуры, пациенты должны находиться в постели в течение 4-6 часов в зависимости от политики отделения, с тщательным мониторингом жизненно важных функций.
Осложнения
Осложнения включают: кровотечение, гематурию, псевдоаневризмы, артериовенозные фистулы, пневмоторакс и распространение опухолевых клеток вдоль канала иглы. Небольшое кровотечение является наиболее частым осложнением и, как правило, самостоятельно останавливается (Рис. 17).
Рис.17. Кровотечение, связанное с биопсией почки.
Это кровотечение обычно обнаруживается во время биопсии и сводится к минимуму применением компрессии под УЗИ наведением после биопсии. Гематурия, как правило, не выражена, но важно, чтобы пациенты были в курсе этого. В одном исследовании гематурия была в 5-7% пациентов.
Менее распространенные осложнения включают псевдоаневризмы и артериовенозные фистулы, образования, которые часто протекают бессимптомно и разрешаются самостоятельно, но могут вызвать стойкую боль и кровотечение. Если спонтанного разрешения не происходит, выполняется транскатетерная эмболизация. Пневмоторакс является редкостью, но может развиваться, если используется межреберный доступ. Распространение опухолевых клеток вдоль канала иглы – редкое осложнение, менее 0,01% случаев. Таким образом, это не следует рассматривать, как сдерживающий фактор для биопсии.
ВМЕШАТЕЛЬСТВА НА СЕЛЕЗЕНКЕ
Показания
Чрескожные вмешательства на селезенки не так часто выполняются, как и в других органах. Скорее всего, причиной этого есть большой риск развыития кровотечения. Тем не менее, существуют данные, свидетельствующие о том, что чрескожные вмешательства на селезенке безопасны у взрослых и детей, и не являются техникой значительного риска постпроцедурных осложнений. Основные показания для биопсии селезенки включают неопределенное солидное или кистозное поражение у пациента с известными внеселезеночными новообразованиями, а также характеристика поражения селезенки у пациентов с установленой или подозреваемой лимфомой. Другие показания включают: катетерное дренирование и аспирацию инфицированной жидкости или абсцессов, спиртовую абляцию симптоматических кист селезенки и кист эхинококковой природы. В 10-летнем обзоре чрескожных вмешательств на селезенке Lucey и коллег, частота успешных вмешательств составила 91% для биопсии селезенки, 100% для аспирации жидкости и 86% для дренирования жидкости.
Выполнение процедуры
И подреберный, и межреберный доступ может быть использован в зависимости от расположения селезенки. Межреберный доступ чаще связан с риском пневмоторакса и кровотечения, если повреждается плевра или межреберная артерия. Если имеется множественное поражение селезенки, тогда предпочтительным для биопсии является очаг, расположенный ближе к периферии, чтобы избежать контакта с воротами селезенки. Размеры игл для кор-биопсии варьируют от №18 до №20 и для FNA – от №18 до №22 калибра (Рис. 18). Если необходимо, то вводится желатиновая губка в месте канала иглы. Для катетеризации инфицированной жидкости и абсцессов, используются катетеры от 8F до 12F, в зависимости от вязкости жидкости, полученной первоначально.
Рис. 18. Биопсия селезенки. (A) Несколько небольших поражений селезенки. Совмещение с КТ помогает локализовать очаги при УЗ визуализации. (В) При FNA из очага поражения селезенки – лимфома. (C) Настройка изображения небольшого очага поражения селезенки, совмещенное с КТ. (D) Совмещение с КТ помогает прицельно найти крайне малый очаг поражение для биопсии.
Троакарный способ обычно используется чаще, чем техника Сельдингера. Хороший уход за катетером, в том числе его промывание 10-мл физиологическим раствором, имеет важное значение для соответсвующего дренирования. Методики лечения кист селезенки и эхинококковых кист – смотрите процедуры, используемые для лечения кист печени выше.
Осложнения
Наибольший риск при биопсии селезенки – это кровотечение, которое приводит к гипотензивному шоку. Если это случилось, необходимо проведение агрессивной инфузионной терапии и переливание крови, и, если необходимо, эмболизация селезенки или спленэктомия. Также возможен пневмоторакс, если используется межреберный доступ, а также повреждение ободочной кишки. Предположительно, частота осложнений для вмешательств на селезенке – незначительно больше, чем при биопсии других органов брюшной полости. Тем не менее, это может быть связано с тем, что биопсии селезенки выполняется гораздо реже, чем биопсии других органов. В исследовании, в котором выполнено 147 биопсий тяжелые осложнения, требующие спленэктомию были зарегистрированы в 1,9%, а частота малых осложнений составила 14,7%. Тем не менее, в исследование Lucey и коллег было выполнено 24 биопсии, в котором у одного пациента развилось небольшое кровотечение, не требующее дальнейшего вмешательства, в то время как у одного пациента развилось значительное кровотечение, что потребовало спленэктомии. Обе эти биопсии проводились как FNA. Риск осложнений увеличивался в другом исследовании при использовании большего диаметра игл №14 CNB; однако, значительных осложнений не наблюдалось при использовании иглы №18 или меньше при кор-биопсии. В исследовании, проведенном Venkataramu и коллегами, FNA поражений селезенки провели у 35 пациентов спинальной иглой №22. Был отмечен только 1 случай внутрибрюшного кровотечения, который не потребовал вмешательств. Риск существенного кровотечения, требующего спленэктомии, выше при дренировании селезенки. Это осложнение произошло у 1 из 7 пациентов в исследовании Lucey и коллег и у 1 из 9 пациентов в исследовании Tasar и коллег. По данным литературы, кровотечения, связанные с биопсией селезенки встречаются от 0% до 2%, что аналогично частоте осложнений при биопсии других брюшных и тазовых органов.
ВМЕШАТЕЛЬСТВА В ПОЛОСТИ ТАЗА
Показания
Показания включают дренирование скоплений жидкости, таких как: серомы, лимфоцеле и абсцессы, наиболее часто возникающие при дивертикулите, аппендиците и воспалительных заболеваний органов малого таза, а также дренирование лимфоцеле. Биопсия тазовых опухолей также может быть выполнена под контролем УЗИ.
Выполнение процедуры
Несколько доступов используются для дренирования скопления жидкости в тазу, в зависимости от ее расположения. Эти доступы включают: чрескожный (трансабдоминальный (Рис. 19) и транглютеальный) и внутриполостной (трансвагинальный (Рис. 20) и трансректальный) методы.
Рис. 19. Дренирование под УЗИ наведением из трансабдоминального доступа периаппендикулярного абсцесса (А, В) – вторичного, из-за перфорации червеобразного отростка. После размещения 8.5F pigtail катетера (C, стрелка) в абсцессе (А, круг), используя технику Сельдингера. Была выполнена КТ для подтверждения адекватности расположения. КТ (D, Е) показала непреднамеренное попадание pigtail катетера (стрелка) за полость абсцесса в соседнюю сигмовидную кишку. Pigtail катетер был оставлен на месте до образования свища.
Рис. 20. Трансвагинальная аспирация асцита малого таза под УЗИ наведением у больного с аденокарциномой желудка (C). На предварительной ПЭТ-КТ (A, B) диффузное небольшое увеличение активности фтордезоксиглюкозы (максимальное стандартное значение поглощения 1.7) – подозрение на карциноматоз. Игла №20 Chiba (D, стрелка) введена в скопление свободной жидкости в тазу трансвагинально под УЗ контролем в реальном времени. Цитология показала метастатическую аденокарциному.
Транглютеальный доступ позволяет получить доступ к более глубоким частям таза, в том числе позади прямой и сигмовидной кишки. Седация сознания, как правило, выполняется часто в дополнение к местным анестетикам, так как этот доступ считается более болезненным. У пациентов в положении на спине, используются изогнутые датчики от 3 до 5 МГц для локализации скопления жидкости через большое седалищное отверстие, используя его как эхоокно. Для этого доступа, место пункции должно быть каудальным и как можно ближе к крестцу или копчику, чтобы избежать повреждения крупных сосудисто-нервных структур (седалищного нерва и ягодичных сосудов), которые проходят латерально через большое седалищное отверстие, спереди и выше грушевидной мышцы. Используются костные ориентиры, а точка входа должна быть как можно ближе и каудальнее к копчику. Дренажный катетер должен пройти внизу отверстия и на уровне, или ниже уровня крестцово-остистой связки.
Трансректальное и трансвагинальные доступы требуют использования внутриполостного датчика. По сравнению с транглютеальным доступом, они считаются безопасными в том смысле, что позволяют избежать повреждения крупных сосудисто-нервных структур. Трансвагинальный катетер отлично подходит для дренирования жидкости в кармане Дугласа (Рис. 20). Для полостей, расположенных глубоко в малом тазу и пальпируемых через прямую кишку, эффективен трансректальный доступ. Седация и/или местная анестезия может использоваться, но не так важна, как для транглютеального доступа. Как правило, используется внутриполостной 7-МГц датчик, а дренаж фиксируется к его защитной оболочке. Троакарная техника обычно используется для введения катетера в скопление жидкости под непосредственным УЗИ контролем.
Постпроцедурное наблюдение
Засорение катетера можно свести к минимуму строгим уходом за ним после процедуры. Рекомендуется ежедневно промывание катетера 10-мл физиологического раствора. Мониторинг отделяемого позволяет удалить катетер после обеспечения эффективного дренирования. Для сложных абсцессов или гематом, рекомендуется введение через катетер тромболитиков.
Осложнения
Непосредственные осложнения после процедуры в основном включают боль и кровотечение. Боль с иррадиацией в ногу является вторичной из-за размещения катетера слишком латерально и проксимально к седалищному нерву, что случается при транглютеальном доступе. Эта боль развивается чаще всего из-за трансгушевидного доступа и повреждения сакрального сплетения, которое находится спереди грушевидной мышцы. Эту ситуацию лучше избегать, помещая катетер ниже грушевидной мышцы. Вторичные кровотечения происходит вследствие повреждения верхних и нижних ягодичных сосудов, лежащих впереди грушевидной мышцы. Помещая катетер ниже грушевидной мышцы, можно избежать этого осложнения.
В обзоре трансвагинального дренирования жидкости в тазу (45 аспираций и 40 катетерных дренирований), клинический успех достигнут в 75% случаев. Малые осложнения включали: случайное повреждение мочевого пузыря, инфекции, катетер-ассоциированная боль и преждевременное смещение катетера.
ПАРАЦЕНТЕЗ
Показания
Парацентез является одним из наиболее часто выполняемых брюшных вмешательств. Он носит как диагностический характер, в том числе для оценки инфекции или злокачественного процесса, так и терапевтический – снижение внутрибрюшного давления при большом объеме асцита.
Выполнение процедуры
Пациент располагается с возвышенным изголовьем кровати так, чтобы жидкость накапливалась в нижней части живота. Оптимальное место пункции должно быть в наибольшем кармане жидкости, где нет эпигастральных сосудов (Рис. 21), как правило, один из нижних квадрантов.
Рис. 21. Диаграмма нижних эпигастральных судов. (A) Нижние эпигастральные артерии и вены, а также их перфоранты (преувеличены, красный и синий). Следует их избегать во время пункции. Могут быть визуализированы на цветном допплеровском изображении. (B) Цветной допплер над правым нижним квадрантом – нижние эпигастральная артерия и вена. (С) Более боковое позиционирование над правым нижним квадрантом – бессосудистая зона. EIA – наружная подвздошная артерия; EIV – наружная подвздошная вена; IEA – нижние эпигастральная артерия и IEV – вена.
Средняя линия между лобком и пупком также может использоваться в качестве доступа, если возможно избежать травму мочевого пузыря. Многие пациенты, направленные на парацентез, имеют цирроз с портальной гипертензией, поэтому предварительное сканирование с цветным допплером для оценки портосистемных анастомозов и других сосудов до прокола тканей – является обязательным условием. Большинство комплектов для парацентеза включают 5F иглу с пластиковой оболочкой. В учреждении авторов используется 5F Yueh катетер. Ультразвуковой контроль во время движения иглы особенно важен, если объем жидкости мал, а также для обнаружения движущихся петель кишечника. После того, как игла удалена, оболочка остается на месте для проведения пассивного или вакуумного дренирования жидкости. При удалении большого объема асцита (> 5 л), необходимо внутривенное введение сывороточного альбумина (8 г / л) или Терлопрессина для предотвращения гипотонии.
Осложнения
Осложнения включают: кровотечение, инфекцию, перфорацию кишечника и гипотонию.
РАЗНОЕ
Забрюшинные вмешательства, например, биопсия лимфатического узла под УЗ наведением, имеет свои преимущества перед КТ, включая: визуализацию иглы в режиме реального времени, мультипланарную возможности и уменьшения расстояния до цели. Если УЗИ визуализация проблематична, также может быть рассмотрен чреспеченочный доступ. Подкожные скопления жидкости распространены в послеоперационном периоде и легко поддаются УЗИ дренированию с учетом их поверхностного расположения. Эти скопления жидкости обычно включают: послеоперационные серомы, гематомы или инфицированные жидкости. Простая аспирация или катетерное дренирование также может использоваться. Подкожные образования легко доступны сонографически. Если подозревается саркома, то траектория иглы должна быть выбрана в соответствии с хирургическим доступом.
Сальник хорошо виден при УЗИ исследовании, когда он утолщен. Учитывая поверхностное расположение сальника и возможность дифференцировать его от кишечника в реальном времени, сальниковая биопсия под УЗИ контролем – очень эффективна (Рис. 22).
Рис. 22. Биопсия сальника. УЗИ биопсия сальника. Технология совмещения помогает выявить самый утолщенный участок мягких тканей (стрелка, КТ), чтобы определить доступ при биопсии (стрелка, УЗИ) и избежать прокола печени. Продемонстрированная патология – лимфома.
Легкое давление датчиком может помочь уменьшить расстояние до мишени и помочь зафиксировать мобильные участки, если это необходимо.
К серозным очагам может быть применен подобный подход, как и при поражении сальника, но, как правило, они более фиксированны, так как расположены вдоль органа (Рис. 23). Должны быть предприняты меры, чтобы не проколоть нижележащие органы, если это возможно.
Вмешательства на поджелудочной железы, такие как: дренирование псевдокист или абсцессов, биопсия поджелудочной железы могут выполняется с использованием различных методик, в том числе: эндоскопической сонографии, хирургически и чрескожной сонографии или КТ наведением. Эндоскопическая сонография используется чаще, так как это она позволяет избежать необходимости открытого разреза или внешнего дренажного катетера. Чрескожное дренирование интрапанкреатической или перипанкреатической жидкости может быть выполнено под УЗИ контролем. Однако, панкреатический проток может быть связан с процессом, что приводит к увеличению времени дренирования. КТ может лучше отразить интрапанкреатическую или перипанкреатическую жидкость, отношение к другим анатомическим структурам, особенно, когда есть вышележащие желудок и кишечник.
Рис. 23. Серозный очаг по краю печени у пациента с гипоэхогенным образованием поджелудочной железы. (А) КТ изображение демонстрирует образование поджелудочной железы (желтая стрелка) и серозный очаг вдоль печени (красная стрелка). (B) УЗИ изображение показало серозный очаг с возможным кровотоком. (C) Биопсия серозного очага FNA (красная стрелка). Также была проведена CNB; была подтверждена аденокарцинома поджелудочной железы, а не вторичный метастаз.
Чрескожная холецистостомия под УЗИ наведением – обычно выполняемая интервенционная процедура при лечении острого холецистита у больных в критическом состоянии, которые не являются кандидатами на операцию. Для уменьшения осложнений должен быть использован чреспеченочный доступ. Иногда, УЗИ контроль также может залучаться при биопсии поражения желчного пузыря, также используя чреспеченочный доступ. Осложнения включают: кровотечение, желчеистечение и перитонит.
РУКОВОДСТВО ПО СОВМЕЩЕНИЮ КТ, МРТ, ПЭТ
Совмещение УЗ изображений с КТ, МРТ, и ПЭТ является новой технологией, которая используется для процедур под УЗИ наведением. Наибольшее распространение нашло в биопсийной абляции печени, но может быть использовано практически в любой части тела. Эта технология позволяет в режиме реального времени синхронизировать КТ или любое многоплоскостное реконструированное изображения с соответствующей УЗИ картиной. Она проводится на рабочей станции со встроенным программным обеспечением совмещения изображений и УЗИ оборудованием с магнитным устройством слежения за движением. Магнитный датчик прикрепляется к регистрам сонографического датчика и передает положение и ориентацию зонда на рабочую станцию, в которую ранее загружены данные КТ, МРТ или ПЭТ пациента. Затем генерируется совмещенное изображения и отображается или к УЗ картине, или к совмещенному изображению, например КТ.
Если поражение трудно визуализировать с помощью обычного УЗИ, это может привести к повышенной радиационной экспозиции (из-за использования КТ), несоответсвия биопсии и увеличение числа прохода игл (из-за недостаточного количества материала). Совмещение изображений или виртуальная КТ, МРТ или ПЭТ-УЗИ решает эти проблемы путем захвата очага поражения в изображение, полученное другими методами, которое неотчетливо видимо при УЗИ исследовании для биопсии или абляции (Рис. 24 и 25).
Рис. 24. Биопсия с помощью совмещения ультразвука с МРТ. Биопсия небольшого центрального поражения печени около утолщенного желчного протока (стрелки), который лучше виден на МРТ. УЗИ изображения синхронизируются с МРТ и после этого выполняется УЗ биопсия очага поражения. Биопсия показала холангиокарциному.
Рис. 25. Биопсия с помощью совмещения ультразвука с КТ. (А) Малые очаги брыжейки видимы на КТ (М), а затем и на УЗИ, когда изображения совмещены. Цветной допплер показывает кровоток в подвздошных сосудах (стрелки на КТ). Прижатие помогает оттеснить кишечник и, таким образом, может быть выполнена биопсия. (B) FNA, избегая кишечника и кровеносные сосуды, выполнена благополучно (стрелка).
Преимущества использования технологии совмещения УЗ являются: режим реального времени изображения, простота отображения проведения вмешательства и отсутствие радиационной экспозиции.
РЕЗЮМЕ
УЗИ является первоочередным методом визуализация патологии при диагностических и лечебных вмешательствах в брюшной полости. Возможность визуализации в режиме реального времени траектории иглы, ее размещения и выявления кровеносных сосудов и других важных структур на пути иглы, без использования ионизирующего излучения – преимущества УЗИ метода по сравнению с КТ. Быстрота выполнения процедуры, портативность и низкая стоимость – дополнительные преимущества. Технология совмещения позволяет УЗИ изображение наложить на КТ, МРТ, и ПЭТ для того. чтобы лучше локализовать повреждение. Кроме того, использование наводящей иглы и технология объемной навигации помогает точному нацеливанию на сложные поражения. С продолжающимся развитием достижений в УЗИ аппаратах и технологии производства датчиков, УЗИ технологии находят все большее применение.
УЗИ аппарат Samsung Medison Accuvix V10 – лучшее предложение от компании RH.
ДОПОЛНИТЕЛЬНЫЕ ДАННЫЕ
Видео, связанные с этой статьей можно найти в Интернете по адресу
http://www.sciencedirect.com/science/article/pii/S1556858X14000930
Лучевая диагностика болезней органов брюшной полости
В.Е. Синицын
МЕТОДЫ ДИАГНОСТИКИ
Современная лучевая диагностика болезней органов брюшной полости совершенно не похожа на рентгенологию пищеварительного канала 40-70-х годов ХХ века. На протяжении десятилетий для исследований этой анатомической зоны использовались лишь обзорные снимки, контрастирование барием желудка и кишки и холецистография. Возможности оценки печени, поджелудочной железы и желчных протоков, внеорганных опухолей были ограниченными и основывались, в основном, на косвенных признаках. По мере развития эндоскопии частота использования рентгеновских методов для исследований пищевода, желудка и толстой кишки стала уменьшаться. С другой стороны, рентгеноскопия и рентгенография органов пищеварительного канала остаются важнейшими методами комплексного исследования этих органов. Такие методы, как пероральная или внутривенная холецистография, а также диагностический ретроперитонеум, практически вышли из употребления.
Неизбежный технический прогресс техники, изменения в организации медицины и быстрое накопление научных данных неузнаваемо изменили абдоминальную радиологию. В первую очередь, это касается исследования паренхиматозных органов брюшной полости, где ведущую роль на сегодняшний день занимают ультразвуковое исследование (УЗИ), компьютерная томография (КТ) и реже – магнитно-резонансная томография (МРТ).
УЗИ стал основным, стандартным методом исследования всех паренхиматозных органов брюшной полости. Фазированные датчики и ложные микропроцессорные системы предоставили возможность существенно улучшить качество изображений и уменьшить выраженность артефактов. Цветовое доплеровское исследование является стандартным методом изучения сосудов органов брюшной полости и исследования васкуляризации выявленных патологических образований и структур. Появились методики трехмерного УЗИ. Применение эндоскопических датчиков для внутриполостных исследований существенно расширяет возможности этого метода в сложных случаях. Исследуются контрастные средства для УЗИ, предназначенные для изучения перфузии и выявления очаговых поражений печени.
Другой базовый метод исследований органов брюшной полости – КТ – также претерпел огромные изменения. До 1989 г. она была «шаговой» – стол перемещался ступенями, соответственно толщине среза, что ограничивало ее временное и пространственное разрешение и, соответственно, диагностическую информативность.
После появления спиральной КТ (СКТ) в 1989 г. метод стал объемным. При СКТ постоянно включенная рентгеновская трубка вращается вокруг непрерывно движущегося стола. Соответственно этому существенно возросло пространственное и временное разрешение метода, уменьшился риск пропустить мелкие патологические очаги. Метод стал стандартизованным. Следующим шагом (1999 г.) стало появление мультиспиральной КТ (МСКТ). Системы МСКТ первого поколения могли выполнять одновременно 4 среза толщиной от 0,5 мм за один оборот трубки (длительность его удалось сократить до 0,5 с). В настоящее время основной парк МСКТ составляют приборы с 16-64 рядами детекторов, у которых время оборота трубки составляет всего 320-350 мс, а толщина среза – 0,5 с. В 2008 г. появились приборы с 256 и 320 рядами детекторов. В настоящее время все новые системы КТ являются мультиспиральными. Благодаря техническому прогрессу, КТ стала применяться в областях, ранее недоступных для нее. Появилась КТ-ангиография, метод стал использоваться для визуализации полых органов. Были созданы методики КТ-колонографии и гастрографии. Было доказано, что диагностическая эффективность КТ-колоноскопии сопоставимо с таковой традиционной фиброволоконной колоноскопии. Учитывая быстроту выполнения и необременительность КТ-колонографии пациентов, обсуждается целесообразность применения этого метода для скрининга рака толстой кишки.
Однако наиболее распространенным является применение КТ для диагностики и дифференциальной диагностики очаговых поражений печени и поджелудочной железы. Стандартным является выполнение КТ с болюсным введением 100-140 мл контрастного средства. Многофазное исследование в различные фазы контрастирования (из которых важнейшими являются артериальная и портально-венозная) позволяет выявлять и характеризовать очаговые поражения печени и поджелудочной железы, планировать лечение и оценивать его результаты. С помощью МСКТ можно с высокой точностью визуализировать артерии и вены органов брюшной полости, а также желчные протоки.
Благодаря быстроте и надежности МСКТ все чаще используется при обследовании пациентов с диагнозом «острый живот» (выявление перфорации полых органов, кровотечений, кишечной непроходимости, мезентериальной ишемии, острого аппанедицита, панкреатита, холецистита и другой патологии).
МРТ реже используется в исследованиях органов брюшной полости, чем УЗИ и МСКТ, – в первую очередь, по экономическим соображениям. Тем не менее, при правильно выбранных показаниях она дает важную диагностическую информацию. Одной из важнейших областей применения МРТ являются исследования печени. Благодаря мультипараметрическому характеру МР-изображений, возможности получения серий срезов с варьирующими параметрами, подчеркивающих контрастность по параметрам магнитной релаксации (Т1, Т2), подавлению сигнала от жира, хорошей визуализации артерий и вен без контрастирования, МРТ стала важнейшим методом выявления очаговых поражений печени. Методика МР-холангиографии позволяет видеть вне- и внутрипеченочные желчные протоки неинвазивно, не прибегая к искусственному контрастированию. Эта методика основывается на усилении сигнала от неподвижной жидкости (желчь) и подавлению сигнала от плотных тканей и крови. При раздутии очищенных от внутрикишечного содержимого петель толстой кишки воздухом или специальными жидкостями возможно выполнение методики МР-энтерографии или колонографии. Использование контрастных препаратов на основе гадолиния («Магневист», «Гадовист», «Омнискан», «Оптимарк» и пр.) еще более расширяет возможности метода. Относительно недавно появился новый класс контрастных средств для МРТ – гепатотропные (орган-специфические) агенты, такие как «Примовист», «Тесласкан» и ряд других. Эти препараты обладают двойным механизмом действия, позволяя характеризовать как васкуляризацию, так и клеточный состав изучаемых внутрипеченочных структур.
УЗИ, МСКТ и МРТ используются, как уже говорилось, и для изучения структур пищеварительного канала. В качестве примера следует упомянуть эндоскопическое УЗИ (исследования прямой кишки, пищевода, головки поджелудочной железы), КТ- и МРТ-колонографию, гастро- и энтерографию.
Область использования радионуклидных методов в абдоминальной радиологии существенно сократилась. Они утратили свое значение в качестве методик изучения анатомии внутренних органов. Основная роль радионуклидных методов (в первую очередь – позитрон-эмиссионной томографии /ПЭТ/) в абдоминальной радиологии – стадирование опухолей, выявление метастатических поражений (прежде всего – печени). Реже радионуклидные методы применяют для выявления скрытых (оккультных) кровотечений из ЖКТ и изучения функции печени.
Ангиографические методы, в связи с развитием УЗИ, МСКТ и МРТ, в значительной степени утратили свое диагностическое значение. Сейчас они преимущественно используются для планирования и проведения интервенционных вмешательств на полых и паренхиматозных органах (стентирование, остановка кровотечений, хемоэмболизация и пр.).
Основные области использования лучевых методов диагностики болезней органов брюшной полости представлены в таблице 1.
Таблица 1. Методы исследования органов брюшной полости
| Исследуемый орган | Метод | Цель исследования |
|---|---|---|
| Органы брюшной полости |
Обзорный снимок брюшной полости | Обследование пациентов с «острым животом», диагностика кишечной непроходимости, перфорации полых органов, выявление рентгенопозитивных конкрементов |
| Пищевод | Рентгенография/рентгеноскопия пищевода | Выявление грыж пищеводного отверстия диафрагмы, дивертикулов, стриктур, обтураций, варикозного расширения вен, опухолей, инородных тел |
| Желудок и 12-перстная кишка | Рентгенография/рентгеноскопия по обычной методике Рентгенография/рентгеноскопия двойным контрастированием |
Диагностика язв, опухолей, стриктур, обтураций, синдрома нарушенного всасывания, контроль результатов операции |
| 12-перстная кишка | Релаксационная дуоденография | Диагностика опухолей головки поджелудочной железы, Фатерова соска, болезней 12-перстной кишки |
| Тонкая кишка | Пассаж бария (пероральное контрастирование) Энтероклизма (чреззондовое введение контрастного вещества) |
Диагностика проходимости кишки, выявление причин стриктур, обструкции, опухолей, воспалительных заболеваний |
| Толстая кишка | Ирриогоскопия (ретроградное контрастирование) Двойное контрастирование КТ-колоноскопия МР-колоноскопия Эндоскопическое УЗИ |
Диагностика опухолей, воспалительных заболеваний, дивертикулов, выявление причин кишечной непроходимости |
| Желчный пузырь и протоки |
Ретроградная панкреатохолангиография Прямая (пункционная) холангиография УЗИ, КТ, МРТ МР-холангиография |
Оценка состояния внепеченочных и внутрипеченочных желчных протоков (конкременты, стриктуры, опухоли), диагностика опухолей головки поджелудочной железы, Фатерова соска, воспалительных и опухолевых заболеваний |
| Печень | УЗИ КТ МРТ ПЭТ |
Диагностика и дифференциальная диагностика очаговых поражений печени, диффузных болезней, травм |
| Поджелудочная железа | УЗИ Эндоскопическое УЗИ КТ МРТ |
Воспалительные заболевания, конкременты, опухоли, травмы, аномалии развития |
ЧАСТНАЯ ПАТОЛОГИЯ
Пищевод
Для исследования пищевода традиционно используется рентгенологическое исследование с барием (рис.1). Процесс прохождения глотков бариевой взвеси (или специального бариевого препарата) регистрируют с помощью флюороскопии в реальном масштабе времени. Частое показание к рентгенологическому исследованию пищевода – диагностика желудочно-пищеводного рефлюкса. Он проявляется обратным забросом бариевой взвеси из желудка в пищевод при исследовании в горизонтальном положении или в положении Тренделенбурга. В случае обструкции пищевода инородным телом рентгенологическое исследование позволяет немедленно установить его уровень и выраженность. С помощью этого метода хорошо видны участки расширения и сужения пищевода при доброкачественных стриктурах (рубцовых, ахалазии). Для ахалазии характерно расширение проксимальной части пищевода и сужение его дистального отдела в форме «клюва». При опухолях пищевода (доброкачественных и злокачественных) виден дефект наполнения пищевода. Характерным признаком злокачественных образований (рака) является изъязвление слизистой и изменение ее рентгенологического рисунка, ригидность стенок пищевода, неровные контуры опухоли (рис.2). Различные виды патологии пищевода (грыжи пищеводного отверстия диафрагмы, опухоли, расширения) хорошо выявляются с помощью КТ или МРТ. КТ позволяет хорошо выявлять распространение опухолей за пределы пищевода. Для детальной оценки стенок пищевода иногда используют эндоскопическое УЗИ.
У пациентов с циррозом печени рентгенографию пищевода назначают для обнаружения варикозно-расширенных вен. С целью уточнения нарушения моторики пищевода иногда назначается манометрия нижнего пищеводного сфинктера с измерением силы и длительности перистальтических сокращений.
Желудок и 12-перстная кишка
Как уже говорилось, из-за более высокой информативности эндоскопические методы несколько потеснили рентгенологические при диагностике болезней желудка и 12-перстной кишки. В то же время существенно, что рентгеноскопия желудка дает цельную картину об анатомии и функции исследуемых органов (рис.3). Это особенно важно при выявлении диффузно растущих опухолей, оценке степени рубцовых поражений стенок, нарушений эвакуации содержимого. По этой причине рентгеноскопия и рентгенография желудка и 12-перстной кишки входят в большинство стандартных схем обследования пациентов с болезнями этих органов.
При диагностике гастритов данные рентгенографии неспецифичны и лишь в случае гипертрофического или склерозирующего (ригидного) гастрита можно увидеть грубые изменения рисунка слизистой (гипертрофия или сглаживание, ригидность стенок).
Классическим показанием к рентгенологическому исследованию желудка является диагностика язв желудка и 12-перстной кишки. Язвы желудка чаще всего локализуются на малой кривизне, а 12-перстной кишки – в области ее луковицы. Однако возможна любая локализация язв. Наиболее надежными рентгенологическими симптомами язв являются симптомы «ниши» и «кратера», локальные изменения рисунка слизистой, отек и ригидность стенки в месте локализации язвы (рис.4, рис.5). Рентгенография хорошо выявляет последствия язвенной болезни – участки рубцовой деформации желудка и 12-перстной кишки. Иногда язвы могут осложняться пенетрацией в окружающие органы (поджелудочную железу, печеночно-дуоденальную связку, сальник, печень и желчные пути), а также в брюшную полость. В этом случае при обзорной рентгенографии или при выполнении снимка на правом боку (латерография) выявляется свободный воздух в брюшной полости, указывающий на перфорацию полого органа. Следует заметить, что при подозрении на перфорацию одного из органов пищеварительного канала противопоказан прием бария. Для контрастирования органов пищеварительного канала в этом случае используют водорастворимые йодсодержащие контрастные вещества. Диагностика перфораций и сопутствующих им осложнений возможна также с помощью УЗИ и КТ.
Рентгенография и рентгеноскопия остаются важными методами диагностики доброкачественных и злокачественных опухолей желудка. Их дифференциальная диагностика основывается на анализе контуров опухоли, характера изменений складок желудка и локальной ригидности его стенок (рис.6). Во всех случаях при выявлении опухоли при рентгенологическом исследовании желудка и 12-перстной кишки назначается эндоскопия с биопсией. В настоящее время все чаще и чаще опухоли желудка впервые выявляют при проведении КТ органов брюшной полости (рис.7) (чаще всего как случайную находку), после чего пациентов направляют на специализированное исследование. УЗИ и МСКТ широко используются для оценки локальной инвазии злокачественных опухолей (прорастание стенки желудка и окружающих структур) и выявления локальных и удаленных метастазов.
Тонкая кишка
Как уже упоминалось, для исследований тонкой кишки используют оценку пассажа по ней бариевой взвеси или водорастворимого контрастного средства, а также чреззондовую энтерографию. В последнее время большое внимание привлекли такие методики, как КТ- или МР-энтерография, при которых возможно построение трехмерных изображений органа и построение изображений просвета кишки в эндоскопическом режиме. Опухоли тонкой кишки, по сравнению с выше- и нижележащими отделами пищеварительного канала, встречаются редко. При лучевом исследовании этого органа частым показанием к исследованию является диагностика тонкокишечной непроходимости и выяснение ее причины, выявление локальных воспалительных поражений (чаще всего – терминального отдела при болезни Крона), обследование пациентов с синдромом «острого живота». При подозрении на острую тонкокишечную непроходимость выполняют обзорный снимок брюшной полости (рис.9), еще более информативным в выявлении обструкции и диагностике ее причины назначают КТ или УЗИ. Использование МР- или КТ-энтерографии при болезни Крона позволяет получить информацию, зачастую недоступную для эндоскопического исследования. Так, эти методы дают возможность видеть не только утолщенные, изъязвленные участки стенки подвздошной кишки, но и инфильтрацию окружающей клетчатки, локальное расширение сосудов брыжейки, увеличение региональных лимфатических узлов.
Толстая кишка
Ирригоскопия по-прежнему является одним из важнейших методов исследования всех отделов толстой кишки. Она дополняет данные колоноскопии и позволяет получить более полную информацию о состоянии органа (рис.10). Одно из самых частых показаний к ирригоскопии – диагностика рака толстой кишки, полипов и дивертикулов. При ирригоскопии рак толстой кишки виден как дефект наполнения с четкой границей между неизмененной слизистой оболочкой и опухолью; выявляются признаки ригидности кишечной стенки. Нередко участок опухолевого поражения вызывает циркулярное сужение просвета кишки (симптом «яблочного огрызка»). Рентгенологические проявления рака толстой кишки зависят от гистологической формы опухоли, локализации и степени ее распространения. МСКТ и в особенности методика КТ-колонографии могут служить альтернативой ирригоскопии в скрининге и диагностике рака толстой кишки. КТ позволяет лучше видеть изменения кишечной стенки и стадировать заболевание (рис.12). Для диагностики ранних стадий рака прямой и сигмовидной кишки стало применяться и трансректальное УЗИ.
Помимо злокачественных опухолей, рентгенологические исследования толстой кишки позволяют выявить воспалительные заболевания толстой кишки (дивертикулит (рис.13), язвенный или гранулематозный колит), врожденные аномалии развития (болезнь Гиршпрунга, мегаколон), нарушения мезентериального кровообращения.
Обзорный снимок брюшной полости, УЗИ и КТ позволяют выяснить причину острого живота и кишечной непроходимости. Одной из самых частых причин синдрома «острого живота» при локализации боли в правом нижнем квадранте является аппендицит. КТ и УЗИ (рис.14) обеспечивают визуализацию воспаленного и увеличенного червеобразного отростка, своевременную диагностику осложнений (развитие инфильтратов, абсцедирования, перфорации). Эти два метода незаменимы и для диагностики других причин «острого живота» (обструкция мочеточника камнем, острый панкреатит, острый холецистит, панкреатит, перфорация полого органа и другой патологии).
Та же тенденция прослеживается и в диагностике кишечной непроходимости. Чаще всего встречается механическая кишечная непроходимость, вызванная опухолями, спайками, инвагинациями, грыжами, желчными и каловыми камнями. При развитии кишечной непроходимости развивается пневматоз кишечника, по мере ее прогрессирования в петли кишечника жидкостью. Уровни жидкости со скоплениями газа над ними в расширенных петлях кишки («чаши Клойбера») являются классическим симптомом кишечной непроходимости. При тонкокишечной непроходимости вертикальные размеры «чаш Клойбера» преобладают над горизонтальными, видны характерные полулунные складки слизистой петель кишки; при толстокишечной горизонтальные размеры уровней жидкости превалируют над вертикальными, видны гаустры. КТ и УЗИ лучше выявляют кишечную непроходимость на ранних стадиях ее развития нежели обзорный снимок, кроме того, обычно с их помощью удается установить и ее причину (рис.15).
Печень
Как уже упоминалось выше, лучевая диагностика заболеваний печени сегодня в основном основывается на использовании УЗИ, КТ и МРТ, реже – ПЭТ.
Применение методов лучевой диагностики при основных болезнях печени зависит от характеристик самого заболевания и возможностей метода.
При диффузных заболевания печени лучевые методы диагностики играют вспомогательную роль. Они используются для дифференциального диагноза (исключение опухолевых поражений), оценки размеров и структуры органа, динамического наблюдения.
Так, при гепатитах (вирусных, токсических, алкогольных) данные методов лучевой диагностики неспецифичны. Печень может быть увеличена или уменьшена в размерах, могут встречаться признаки неоднородности структуры печени при УЗИ. Может определяться диффузное увеличение органа.
Диагностика жировой инфильтрации печени с помощью лучевых методов вполне надежна. Как правило, области жировой инфильтрации чередуются с участками нормальной паренхимы печени. Жировая инфильтрация не приводит к нарушению архитектоники сосудов печени или масс-эффекту. Картина жировой инфильтрации может претерпевать быструю динамику, что имеет важное дифференциально-диагностическое и прогностическое значение. При УЗИ жировая дистрофия печени хорошо видна. Она выглядит как диффузные изменения печени с пониженной эхогенностью, перемежающиеся с участками неизмененной ткани. При КТ отмечается значительное снижение плотности паренхимы органа (до 20-30 единиц Хаунсфилда) (рис.16). Из-за понижения ее плотности пораженные сегменты становятся отчетливо видимыми на фоне неизмененных участков печеночной ткани и сосудов печени. В норме плотность печени несколько выше, чем плотность селезенки. Поэтому при жировой инфильтрации снижение плотности ткани печени видно даже без помощи денситометрии. МРТ редко применяется для подтверждения диагноза, т.к. УЗИ и КТ вполне достаточно для этой цели. Однако если у этих больных проводится МРТ, то применяют специальные программы исследования (импульсные последовательности с подавлением сигнала от жировой ткани).
При диагностике цирроза печени информативность методов лучевой диагностики существенно выше. Выделяют макроузловую, микроузловую и смешанную формы цирроза печени. При микроузловом циррозе печень уменьшена в размерах и значительно уплотнена, регенеративная активность выражена незначительно. При макроузловом циррозе выявляются множественных узлы регенерации, некоторые из них мультилобулярные, с перегородками. Основными критериями диагностики цирроза являются уменьшение размеров печени (на начальных этапах заболевания печень может быть увеличена в размерах), выявление множественных узлов регенерации, наличие признаков портальной гипертензии, спленомегалии, асцита. Наиболее информативными для диагностики являются КТ, УЗИ и МРТ (рис.17). Оценка характера кровотока в портальной вене и печеночных венах с помощью УЗ-допплерографии может оказывать помощь в оценке степени нарушения венозного кровотока в органе. Иногда возникает необходимость в дифференциальной диагностике очагов печеночно-клеточного рака и узлов регенерации при циррозе. В сложных для диагностики случаях прибегают к пункционной биопсии. Она может выполняться под контролем УЗИ или КТ, что повышает точность забора материала и уменьшает риск осложнений.
При ряде заболеваний печени, связанных с метаболическими нарушениями, лучевые методы диагностики позволяют выявить специфические симптомы, облегчающие их диагностику. В качестве примера можно привести болезнь Коновалова-Вильсона и гемохроматоз.
Гепатоцеребральная дистрофия (болезнь Коновалова-Вильсона) обусловлена нарушениями обмена меди, которая откладывается в печени, почках, головном мозге. При обследованиях печени обнаруживают явления гепатита или цирроза различной степени выраженности. Однако самым важным является характерное увеличение плотности паренхимы печени при КТ (или повышение интенсивности сигнала при МРТ). Это связано с повышенным содержанием в органе ионов меди. При гемохроматозе (первичном или вторичном) происходит повышенное накопление железа в клетках ретикуло-эндотелиальной системы. Соответственно этому меняется характер изображения печени на компьютерных томограммах (повышение плотности) и изменение сигнала при МРТ (низкая интенсивность сигнала от паренхимы печени как на Т1, так и на Т2-взвешенных изображениях – рис.18). Последнее объясняется особенностями магнитных свойств оксидов железа в клетках ретикуло-эндотелиальной системы.
Исключительно важным является диагностика и дифференциальная диагностика объемных образований печени. К ним относятся простые кисты печени, паразитарные болезни, абсцессы, эхинококкоз и альвеококкоз, метастазы органных опухолей и первичные опухоли печени.
Простые кисты печени встречаются достаточно часто. На ультразвуковых и томо- графических изображениях они имеют различные размеры, тонкие стенки, однородное содержимое с характеристиками, характерными для жидкости, по плотности близкой к воде. Внутри кист отсутствуют сосуды. Содержимое простых кист не усиливается при введении контрастного препарата. Кисты печени встречаются у 20-40% пациентов с поликистозом почек.
Все методы лучевой диагностики – УЗИ, КТ, МРТ – позволяют с высокой точностью выявлять кисты печени (рис.19).
Абсцессы печени могут иметь различное происхождение. Чаще всего встречаются микробные (кишечная палочка, стрептококк, анаэробная инфекция) и паразитарные (амебные) абсцессы печени.
Инфекционные абсцессы могут возникать после травм печени, хирургических вмешательств, при холангите, сепсисе, флебите портальной вены. При допплеровском ультразвуковом исследовании видна повышенная васкуляризация капсулы, отсутствие сигнала от кровотока внутри полости абсцесса. При УЗИ абсцесс печени проявляется как округлая структура с плотной, неровной капсулой, имеющая толстые стенки и неровную внутреннюю поверхность. Внутри лоцируется плотное жидкое содержимое, возможно наличие газа. Для амебных абсцессов характерна толстая капсула с множественным внутренними перегородками, отсутствие скоплений газа в абсцессе, нередки множественные поражения. Схожая картина получается при использовании КТ и МРТ. В сомнительных случаях прибегают к внутривенному контрастированию. Повышение контрастности капсулы абсцесса и выявление пузырьков газа в его полости позволяет поставить правильный диагноз (рис.20).
С помощью методов лучевой диагностики (чаще всего КТ и УЗИ) выполняют различные виды манипуляций для лечения абсцессов, такие как пункция и дренирование.
Печень, селезенка и легкие являются основными органами диссеминации личинок эхинококка и альвеококка. Поражения других органов (почки, мог, сердце и пр.) встречаются гораздо реже. Первоначально, после заражения, кисты имеют небольшой размер (2-3 мм), и выявление их бывает крайне затруднительным. По мере их роста диагноз облегчается. Для всех методов наиболее характерными признаками эхинококкоза являются наличие в печени кист различного размера с четкими, тонкими и ровными стенками. Диагноз эхинококкоза облегчается при обнаружении внутри или снаружи образования дочерних кист (рис.21). При эхинококкозе в 30% случаев стенки кисты кальцинированы. В случае гибели паразита часто наблюдается частичное или полное отслоение внутренней оболочки, которая становится хорошо видимой внутри кистозной полости. При альвеококкозе кисты множественные, контуры их нечеткие из-за инфильтративного роста с воспалительными и некротическими реакциями по периферии кист. Плотность внутри кисты выше, чем при эхинококкозе. Поэтому образование может напоминать растущую опухоль.
К очаговым поражениям печени относятся доброкачественные и злокачественные опухоли печени и метастазы органных опухолей в печень.
Среди доброкачественных опухолей наиболее часто встречаются гемангиомы, фокальная узловая гиперплазия и аденома печени.
Гемангиома – наиболее часто встречающаяся доброкачественная опухоль печени. Она встречается у 1-5% взрослого населения. В подавляющем большинстве случаев гемангиомы обнаруживают случайно при УЗИ или томографии печени. Очень редко гигантские (>10 см) гемангиомы могут сопровождаться клинической симптоматикой из-за сдавления окружающих структур, тромбоза, геморрагий. При УЗИ гемангиома выглядит как округлое образование с множественными сигналами внутри опухоли от мелких сосудов. На КТ-изображениях гемангиомы в типичных случаях выглядят как округлые образования с низкой плотностью и четкими контурами. При выявлении образования, похожего на гемангиому, обязательно проводить внутривенное контрастирование. Характерным для гемангиом является центропетальная (от периферии к центру) последовательность заполнения гемангиомы контрастным препаратом (рис.22).
При МРТ, из-за длительного времени релаксации на Т2-взвешенных изображениях, характерно очень яркое изображение опухоли на фоне темной паренхимы печени. При динамическом контрастном МР-исследовании с гадолинием характер заполнения опухоли контрастом тот же, что и при КТ. Большие гемангиомы могут иметь нетипичный вид – протяженные центральные зоны, плохо, или не накапливающие контрастный препарат (рубцы, участки гиалиноза). В редких случаях для диагностик гемангиом используют сцинтиграфию печени с меченными эритроцитами или ангиографию.
Фокальная узловая гиперплазия – редкая доброкачественная опухоль печени, обычно встречающаяся у молодых женщин (до 75% случаев). Она состоит из гепатоцитов, купферовских клеток и желчных протоков. В ее центральной части обычно располагается рубец, от которого расходятся перегородки (септы). Она может быть множественной. На изображениях эта опухоль характеризуется отсутствием капсулы, гомогенностью структуры и гиперваскулярностью. Без контрастного усиления опухоль обычно имеет такие же характеристики сигнала, что и паренхима печени. Большая опухоль может вызывать нарушение хода сосудов печени. Эта опухоль гиперваскулярна, поэтому она хорошо выявляется при динамической КТ или МРТ с контрастным усилением в артериальную фазу (рис.23). Обычно хорошо виден гипоинтенсивный центральный рубец, который в отстроченную фазу накапливает контрастный препарат, в то время как паренхима опухоли становится мало отличимой от нормальной печени.
Аденома – редкая доброкачественная опухоль печени, состоящая из гепатоцитов. Кровоснабжается она одной или несколькими дополнительными веточками почечной артерии. При выполнении УЗИ, КТ или МРТ выглядит как объемное образование, нередко окруженное тонкой псевдокапсулой (зоной фиброза). В ткани опухоли могут выявляться участки кровоизлияний, центральный рубец отсутствует. При проведении КТ и МРТ с контрастным усилением аденома контрастируется преимущественно в артериальную фазу. При этом отмечается негомогенное повышение плотности. Иногда аденому трудно дифференцировать от гепатоцеллюлярного рака.
Злокачественные опухоли печени делятся на первичные и вторичные (метастазы). Из злокачественных опухолей часто встречается гепатома (гепатоцеллюлярный рак), реже – холангиокарцинома (холангиоклеточный рак).
Гепатоцеллюлярный рак (гепатома) – наиболее часто встречающаяся первичная опухоль печени. Риск развития гепатомы повышен у пациентов с циррозом печени, гепатитами В и С, гемохроматозом. Выделяют узловую (солитарную), многоузловую и диффузную формы заболевания. Характерна инвазия опухоли в портальную и печеночные вены (до 30% случаев). Гепатома может метастазировать в другие органы (легкие, кости, лимфатические узлы).
Изображения гепатомы, получаемые при лучевых методах диагностики, достаточно разнообразны. Для опухоли характерна негомогенность внутреннего строения, внутриопухолевые перегородки, может выявляться центральный рубец, некротические или кистозные участки, капсула, наличие дочерних узлов. Опухоль может проникать в сосуды, иметь включения кальция и сопровождаться асцитом. Гепатомы, как правило, характеризуются повышенной васкуляризацией и наличием артерио-венозных шунтов. По этой причине при выполнении УЗ-допплерографии, ангиографии или КТ и МРТ с контрастированием они лучше всего видны в артериальную фазу (рис.24).
При диагностике гепатом лучевые методы позволяют определить размеры и расположение опухоли и выявить наличие локальных внутрипеченочных метастазов, инвазии в вены печени. Эти данные очень важны для выбора метода лечения и определения прогноза.
Холангиоклеточный рак (холангиокарцинома) – злокачественная опухоль, растущая из внутрипеченочных желчных протоков. При УЗИ или КТ может иметь вид гиподенсного (гипоинтенсивного при МРТ) очага или мультифокального образования с инфильтративным ростом по ходу желчных протоков (рис.25). Наиболее яркое проявление заболевания – выраженное расширение внутрипеченочных желчных протоков выше места их обструкции опухолью и контрастирование ткани самого образования. КТ, МРТ и особенно МР-холангиография облегчают диагностику опухолевого поражения желчных протоков. Холангиокарцинома, поражающая область слияния внутрипеченочных желчных протоков и вызывающая их обструкцию, получила название опухоли Клацкина. Заболевание следует дифференцировать со случаями доброкачественного врожденного кистозного расширения желчных протоков (болезнь Кароли).
Среди всех очаговых поражений печени важное значение придается выявлению метастазов злокачественных опухолей в печень. Выявление даже единичного небольшого по размеру метастаза в печень меняет стадию процесса и, соответственно, выбор лечебной тактики и прогноз заболевания. Все методы современной лучевой диагностики позволяют визуализировать метастазы в печень. Их чувствительность и специфичность колеблются в пределах 75-90% и зависят от характеристик самого метода, методики исследования, гистологического строения, васкуляризации и размеров очагов. Чаще всего в качестве начального метода исследования назначают УЗИ. В сложных ситуациях диагностический алгоритм расширяется. Выполняют КТ с многофазным контрастированием и/или МРТ (также с контрастированием).
Метастазы в печень обнаруживают примерно у 30-40% пациентов, умерших от злокачественных заболеваний. Чаще всего источником метастатического поражения печени являются опухоли кишечника и желудка, поджелудочной железы, рак легкого и молочной железы. В печень метастазируют и опухоли других органов.
При УЗИ и томографии метастазы в печень видны как множественные мягкотканые очаги (симптом «монеток») (рис.26). В зависимости от гистологии первичного очага, они могут быть гиперваскулярными или гиповаскулярными (чаще всего). От вакуляризации во многом зависит вид метастатических очагов на томограммах и изменение их плотности (интенсивности при МРТ) во время контрастирования. Иногда встречаются метастазы с кальцинатами или с выраженным кистозным компонентом. В сомнительных случаях помощь в диагностике метастатических поражений может оказать ПЭТ или ПЭТ/КТ с 18-ФДГ.
Лучевые методы важны для диагностики портальной гипертензии. Синдром портальной гипертензии встречается при целом ряде заболеваний: тромбозе и компрессии портальной вены и ее ветвей, циррозе печени, холангите, застойной сердечной недостаточности и других заболеваниях. Поэтому при исследовании органов брюшной полости в обязательном порядке положено изучить и описать состояние сосудов печени и селезенки. Портальную гипертензию диагностируют на основании расширения воротной вены, выявления варикозного расширения коллатеральных вен, спленомегалии, асцита. При диагностике тромбоза воротной вены или синдрома Бадда-Киари (тромбоз печеночных вен) большую роль играют КТ или МРТ, выполненные в ангиографическом режиме. Методом УЗ-допплерографии можно определить скорость и направления кровотока в воротной и селезеночной венах.
Заболевания селезенки встречаются значительно реже, чем болезни печени. Диагностика осуществляется с помощью УЗИ и КТ, реже методом МРТ. В селезенке могут встречаться доброкачественные опухоли: гамартомы и гемангиомы. Из злокачественных опухолей чаще всего диагностируются метастазы и поражение селезенки лимфопролиферативными заболеваниями (лимфогранулематоз, лимфомы). Первичные злокачественные опухоли селезенки очень редки. Принципы диагностики поражений селезенки такие же, как и печени.
Травмы селезенки ведут к образованию гематом и разрыву органа. Точная информация о состоянии селезенки влияет на выбор тактики лечения. Диагностика при этом, как правило, проводится в срочном порядке. Поэтому на первый план выходят УЗ- и КТ-исследования. И при УЗИ, и при КТ можно быстро получить исчерпывающую информацию. Инфаркты селезенки эмбологенного происхождения в острой стадии хорошо выявляются при КТ или МРТ с контрастным усилением. В хронической стадии в местах инфарктов КТ можно выявлять кальцинаты.
Поджелудочная железа
Заболевания поджелудочной железы являются частыми показаниями к направлению пациента на лучевое исследование.
Острый панкреатит в начальной стадии своего развития проявляется увеличением органа, диффузным изменением структуры железы из-за ее отека. По мере прогрессирования заболевания появляются перипанкреатические скопления жидкости, инфильтрация окружающей жировой клетчатки. Важно выявление некротических очагов в железе при тяжелом течении заболевания. Для обнаружения очагов панкреонекроза требуется проведение КТ с контрастным усилением (рис.27). В отдаленном периоде с помощью методов лучевой диагностики могут выявляться псевдокисты, кальцинаты, аневризмы артерий (чаще всего – ветвей селезеночной артерии). Панкреатит головки поджелудочной железы, приводящий к обструкции холедоха, иногда приходится дифференцировать с опухолью. Для этой цели прибегают к выполнению КТ или МРТ с контрастированием.
На хронический панкреатит указывает атрофия железы (иногда в сочетании с участками локальной гипертрофии), жировая дистрофия, фиброз или кальциноз ее паренхимы (рис.28), камни в панкреатическом протоке и его расширение.
Наиболее серьезные требования к методам лучевой диагностики предъявляются при подозрении на опухоль поджелудочной железы. К основным типам опухолей железы относятся рак железы (аденокарцинома и цистаденокарцинома), эндокринные опухоли, лимфома и метастазы.
Рак поджелудочной железы – самая частая злокачественная опухоль органа. Более половины случаев заболевания возникают в головке поджелудочной железы. В этой связи первыми признаками заболевания является желтуха. При диагностике приходится проводить дифференциацию между опухолью, отечной формой панкреатита и некальцинированным конкрементом желчного протока. Опухоли тела и хвоста железы долгое время не проявляются и поэтому часто диагностируются, достигнув большого размера (4-5 см).
Диагноз опухоли поджелудочной железы по данным УЗИ, КТ или МРТ преимущественно основывается на выявлении локального утолщения железы и очагового изменения характеристик сигнала в месте поражения. При уточнении причины желтухи и выявлении изменений в головке железы большую помощь оказывает эндоскопическое УЗИ и ретроградная панкреатохолангиография. Для уточнения диагноза часто выполняется Кт с динамическим контрастированием с тонкими срезами. Опухоль обычно выявляется в виде гиподенсного образования на фоне лучше контрастированной паренхимы железы (рис.29). МРТ с использованием болюсного усиления гадолинием увеличивает чувствительность и специфичность метода в выявлении образований.
Для определения возможности выполнения резекции опухоли необходимо выявить распространенность опухоли. Методика КТ-ангиографии позволяет определить наличие инвазии опухоли в верхнебрыжеечную артерию и вену, чревный ствол или воротную вену или в прилежащие к железе органы (желудок, кишечник, сальник).
Большие трудности в диагностике представляют кистозные опухоли поджелудочной железы (цистаденокарцинома). Это злокачественная кистозного строения опухоль, содержащая муцин. Опухоль обычно локализуется в теле или хвосте поджелудочной железы. При УЗИ, КТ или МРТ опухоль выглядит как гиповаскулярная структура, ее перегородки и узлы накапливают контрастный препарат. Схожим образом может выглядеть доброкачественная опухоль – цистаденома или же многокамерная псевдокиста.
Относительно редко в поджелудочной железе встречаются эндокринные опухоли (инсулиномы, гастриномы, випомы, соматостиномы, глюкагеномы и нефункционирующие опухоли). В большинстве случаев эти опухоли являются гиперваскулярными, поэтому они хорошо видны в артериальную фазу контрастирования при выполнении КТ или МРТ (рис.30). Селективная ангиография также позволяет выявить патологические сосуды опухоли. Большое значение для диагноза имеют признаки гормональной активности опухоли (гипогликемия в случае инсулиномы, синдром Золлингера-Эллисона при гастриномах и пр.). Метастазы в печень опухолей APUD системы также обычно бывают гиперваскулярными.
Желчный пузырь и желчные протоки
Частым показанием к лучевому исследованию является подозрение на желчекаменную болезнь и холециститы (калькулезный и безкалькулезный).
Ведущим методом диагностики заболеваний желчного пузыря и желчевыводящих путей является УЗИ. С помощью этого метода можно видеть конкременты в полости желчного пузыря и симптом «акустической тени» за конкрементом (рис.31). Конкременты в желчном пузыре и протоках хорошо видны при КТ (рис.32), а также при МР-холангиографии (как дефекты наполнения на фоне яркого сигнала от желчи). На современных мультиспиральных компьютерных томографах удается визуализировать даже «рентгенонегативные» (холестериновые) конкременты в пузыре, так как они обычно отличаются по плотности от желчи.
Для диагностики острого и хронического холецистита предпочтение отдают УЗИ. С его помощью можно выявить утолщение и инфильтрацию стенок пузыря (рис.33), расширение его полости, неоднородность желчи. При осложненном холецистите (абсцедирование или гангренозные изменения пузыря) можно выявить скопления газа и гноя. Часто выявляется скопление экссудата в ложе пузыря.
Применение ультразвукового исследования также предпочтительно при подозрении на холангиты. С помощью метода визуализируют расширение внутрипеченочных желчных протоков, перипротоковую инфильтрацию паренхимы печени, изменение плотности желчи внутри протоков. При хронических холангитах характерно выявление чередующихся участков сужения (стриктур) и расширения желчных протоков, фибротических и воспалительных изменений по их периферии, которые можно диагностировать с помощью РХПГ, МР-холангиографии или УЗИ. Могут выявляться камни во внутрипеченочных желчных протоках. При осложненных холангитах УЗИ, КТ и МРТ используют для диагностики таких осложнений заболевания, как внутрипеченочные абсцессы.
Лимфатические узлы и внеорганные опухоли
В забрюшинном пространстве расположены лимфатические протоки и несколько групп лимфатических узлов. Выявление их поражения при злокачественных заболеваниях имеет важное диагностическое значение. Даже при условно нормальных размерах узлов их количественное увеличение должно восприниматься с настороженностью. Чаще всего причиной увеличения забрюшинных лимфатических узлов являются метастазы злокачественных опухолей органов брюшной полости или таза. При лимфомах (лимфогранулематоз, неходжкинские лимфомы) пораженные лимфатические узлы отличаются от пораженных метастатическим процессом. Они сливаются в полициклические массы, которые могут вызывать смещение внутренних органов, обструкцию мочеточников, сосудов. Мезентериальная, забрюшинная или тазовая лимфоаденопатия могут быть проявлением СПИДа.
Выраженное увеличение лимфатических узлов может быть обнаружено при выполнении УЗИ. Однако оптимальным методом оценки всех групп лимфатических узлов брюшной полости является КТ. В сомнительных случаях прибегают к радионуклидным методам диагностики (ПЭТ).
В брюшной полости могут быть расположены внеорганные опухоли. Эти опухоли долгое время могут не проявлять себя клинически и обнаруживаться при диспансеризации либо при обследовании по другому поводу. В зависимости от гистологического типа (липомы, липосаркомы, мезотелиомы, тератомы и т.д.) они могут иметь различную плотность и отношение к контрастному веществу.
ЗАКЛЮЧЕНИЕ
Несмотря на прогресс лучевой диагностики, до сих пор нет единого универсального метода диагностики болезней органов брюшной полости. Их выбор и методика выполнения исследования во многом зависят от характера предполагаемого заболевания, остроты процесса и ведущего клинического синдрома. Тем не менее, очевидно, что продолжает увеличиваться роль УЗИ и КТ. Эти методики все чаще используются в острых, неотложных ситуациях, а также начали применяться и для обследования полых органов (кишка, желудок). МРТ и ПЭТ имеют большое значение в диагностике и дифференциальной диагностике опухолей печени.
MEDISON.RU — Ультразвуковой и рентгенологический мониторинг послеоперационных хирургических осложнений у онкологических больных
УЗИ сканер RS80
Эталон новых стандартов! Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
Лечение онкологических больных в современных условиях связано, как правило, с применением агрессивных хирургических вмешательств, высокотоксичных химиотерапевтических препаратов. Подобная ситуация предполагает высокий риск развития различных осложнений, связанных с расширенным объемом резекций, массивной кровопотерей и обнажением больших пространств и развитием органной недостаточности.
Широкое применение методик и технологий ультразвуковой томографии обусловлено в первую очередь доступностью и высокой мобильностью метода, что в большинстве случаев позволяет проводить раннюю диагностику осложнений в ходе лечения и послеоперационном периоде. Высокий технический уровень современных ультразвуковых томографов позволил значительно расширить спектр задач, решаемых с помощью ультразвуковых методик. Это в свою очередь предполагает необходимость разработки диагностических критериев и алгоритмов использования различных ультразвуковых технологий в экстренных ситуациях.
В условиях отдела лучевой диагностики ГУ РОНЦ им. Н.Н. Блохина РАМН проведен анализ результатов ультразвуковых исследований 96 пациентов после хирургических вмешательств по поводу новообразований брюшной полости и забрюшинного пространства. В структуре послеоперационных осложнений наиболее часто встречались поддиафрагмальные и межпетлевые абсцессы — 11%, несостоятельность швов анастомоза — 6%, гематомы — 5%, внутрибрюшные кровотечения — 5%, панкреонекроз — 2%.
Методика осмотра включала в себя два основных этапа. На первом этапе выполнялось обзорное исследование брюшной полости с целью выявления свободной и осумкованной жидкости, наличия патологических образований и инфильтратов. На втором этапе проводилось прицельное исследование зоны обнаруженных патологических изменений для определения ее топографии, соотношения с окружающими органами и тканями и крупными магистральными сосудами (рис. 1 а, б). Исследование выполнялось полипозиционно, в различных плоскостях сканирования с применением конвексных и линейных датчиков с частотой от 3,5 до 5 МГц. При выявлении жидкостных скоплений в брюшной полости проводилась чрескожная пункция для определения характера жидкости. При подтверждении патологического характера жидкости и наличия клинических проявлений у пациентов применялись малоинвазивные методики лечения послеоперационных осложнений и ряда других ургентных состояний, развивающихся у онкологических больных. В первую очередь это относится к дренированию и санации патологических полостей (абсцессы и послеоперационные гематомы) (рис. 2 а, б).
Рис. 1. Подпеченочный абсцесс.
а) Подпеченочный абсцесс после гастрэктомии с лимфодиссекцией D-2.
б) Чрескожное дренирование подпеченочного абсцесса под рентгенотелевизионным контролем.
Рис. 2. Послеоперационная гематома.
а) Послеоперационная гематома в зоне резекции после левосторонней гемигепатэктомии.
б) Чрескожное дренирование полости гематомы под ультразвуковым контролем.
Интервенционно-радиологические процедуры выполнялись под флюороскопическим, ультразвуковым или РКТ контролем или в комбинации этих методов. Обычно выбиралась та техника, которая лучше визуализировала патологический процесс и доступ к нему.
Ультразвуковой контроль пункции быстрее, дешевле, доступнее при экстренной ситуации и более гибок, чем РКТ. Однако в отличие от ультразвуковой томографии РКТ позволяла визуализировать иглу в легочной ткани и в костных структурах. Высокая чувствительность ультразвуковой томографии в выявлении жидкости делала его методом выбора для контроля пункций и аспираций кист, гематом и абсцессов, а использование методики цветного допплеровского картирования позволяло дифференцировать сосудистые структуры и тем самым избегать возможных серьезных осложнений. Указанные методы навигации можно сочетать в различных вариантах в зависимости от локализации патологического образования. Это позволяло, с одной стороны, увеличить точность пункции под контролем УЗ-томографии или РКТ в реальном времени, а, с другой стороны — давало возможность контролировать инструментальные манипуляции внутри патологической полости. Введение контрастного вещества в патологическую полость позволяет более достоверно оценить ее объем, определить наличие или отсутствие свищевых ходов, провести установку дренажа и укладку его рабочей части в полости абсцесса или гематомы под рентгенотелевизионным контролем. Использование подобной тактики позволило резко сократить число релапаротомий по поводу гнойных послеоперационных осложнений, особенно у ослабленных больных.
Для чрескожного катетерного лечения неосложненных свищами абсцессов обычно требовалось от 3 до 14 дней, в среднем 1 нед. При этом нормализация температуры и улучшение общего состояния пациента происходило уже в 1-е сутки после дренирования. Для лечения осложненных абсцессов иногда необходимо до 8-12 нед. Также достоинством данной методики была возможность в случае необходимости повторного дренирования патологической полости в процессе лечения.
Анализ полученных результатов показал, что большинство абсцессов локализовалось в поддиафрагмальном пространстве в области левого купола диафрагм (рис. 3 а, б). На ультразвуковых томограммах определялось ограниченное жидкостное формирование с тонкими внутренними перегородками. Содержимое образования было, как правило, однородным. При дальнейшем развитии процесса отмечалось появление мелкодисперсных включений, и формировалась плотная гиперэхогенная капсула. Сходная ультразвуковая картина наблюдалась и при ограниченных гематомах. Дифференциальная диагностика абсцессов и гематом проводилась при чрескожной пункции с изучением характера содержимого или в ходе дренирования под ультразвуковым и рентгенотелевизионным контролем. При внутрибрюшных кровотечениях выявлялась свободная жидкость в брюшной полости, количество которой при динамическом наблюдении увеличивалось. Наибольшие сложности представляет диагностика панкреонекроза на фоне пареза кишечника, препятствующего получению оптимального изображения.
Рис. 3. Поддиафрагмальный абсцесс
а) Поддиафрагмальный абсцесс после гастрэктомии со спленэктомией.
б) Чрескожное дренирование полости абсцесса под рентгенотелевизионным контролем.
Таким образом, на современном этапе использование различных ультразвуковых методик является одним из ведущих компонентов в диагностике неотложных состояний, определении топической локализации патологического процесса в брюшной полости и забрюшинном пространстве, а также в установлении его возможной причины. Ультразвуковая томография — наиболее простой и доступный способ наведения и контроля в сочетании с рентгенотелевизионным контролем при проведении манипуляций для дренирования и санации патологических полостей и жидкостных скоплений брюшной полости и забрюшинного пространства у онкологических больных.
Литература
- Власов П.В., Котляров П.М. Лучевая диагностика болезней печени и желчевыводящих путей // Вестн. рентгенол. — 1996. — С. 33-46.
- Гаврилин А.В., Еремина Е.В. Результаты ультразвукового мониторирования внутрибрюшных и внутриплевральных жидкостных скоплений у больных после хирургических вмешательств на печени // Ультразвуковая ифункциональная диагностика. — 2004. — N3. — С 21-29.
- Давыдов М.И., Демидов Л.В., Поляков Б.И. Основы современной онкологии // М., 2002.
- Кривицкий Д.И., Паламарчук В.И. Пункционное дренирование абсцессов печени и брюшной полости под контролем эхотомоскопии и лапароскопии // Клин. хирург. — 1990. — N1. — С. 49-50.
- Нахинсон Р.А. Ранние осложнения после операций по поводу опухолей печени, желчевыводящих протоков и поджелудочной железы // Хирургия. — 1984. — N7. — С. 105-109.
УЗИ сканер RS80
Эталон новых стандартов! Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
Эндоскопическое дренирование труднодоступных абсцессов печени под контролем УЗИ
SAGE Open Med. 2020; 8: 2050312120921273.
Отделение гастроэнтерологии и гепатологии, Академия, Сингапурская больница общего профиля, Сингапур
Поступило 3 октября 2019 г .; Принято 2 апреля 2020 г.
Эта статья цитируется в других статьях в PMC.Реферат
Цели:
Антибактериальная терапия и чрескожный дренаж были первоочередными методами лечения абсцессов печени.Однако чрескожное дренирование абсцессов может быть затруднено в труднодоступных местах, таких как хвостатая доля. Целью этого обзора было определение показаний, технической осуществимости и эффективности эндоскопического дренирования труднодоступных абсцессов печени под контролем УЗИ.
Методы:
Был проведен литературный обзор оригинальных статей, рефератов, серий случаев и отчетов о случаях, описывающих дренирование абсцесса печени под эндоскопическим ультразвуковым контролем. Были рассмотрены показания, методы и осложнения, связанные с эндоскопическим дренированием под ультразвуковым контролем.
Результаты:
Всего было отобрано 15 исследований. Основными показаниями к лечению были неудачная антибактериальная терапия и трудности с чрескожным доступом. Техника включала идентификацию и пункцию абсцесса под эндоскопическим ультразвуковым контролем с последующей установкой протеза с помощью проволочного проводника. Техника была успешной на 97,5% без серьезных осложнений.
Заключение:
Эндоскопическое дренирование под ультразвуковым контролем было осуществимо и безопасно и позволило полностью дренировать абсцессы печени, недоступные при чрескожном дренировании.
Ключевые слова: Эндоскопическое УЗИ, абсцесс печени, дренирование, осложнения
Введение
Абсцессы печени связаны со значительной заболеваемостью и смертностью, если их не лечить. 1 Современное традиционное лечение включает антибактериальную терапию и, в случае абсцессов размером более 5 см, дополнительный чрескожный дренаж (ЧД). Можно лечить абсцессы меньшего размера только с помощью антибиотикотерапии, но часто может потребоваться дополнительная чрескожная аспирация или дренирование.Хирургическое дренирование связано со значительной заболеваемостью и смертностью (32%). 2–4 Хирургический дренаж обычно выполняется как вариант лечения второй линии, когда БП либо невозможно, либо безуспешно. Сообщаемые показатели успеха с PD колеблются от 85% до 100%. 5,6 Несмотря на высокие показатели успеха, БП также может быть связана с осложнениями, связанными с процедурой, такими как кровотечение, перфорация, перитонит, свищ, сепсис и дискомфорт, связанный с трубкой. Более того, БП абсцессов в хвостатой и левой доле печени может быть технически сложной задачей.Дренирование поддиафрагмальных, панкреатических и тазовых абсцессов под контролем эндоскопического ультразвука (ЭУЗИ) было описано как альтернатива хирургическому вмешательству и ПД. 7–9 Непосредственная близость левой доли и центральных сегментов печени к желудку делает дренирование под контролем ЭУЗ привлекательным и осуществимым вариантом. С развитием техники и аксессуаров EUS дренаж недоступных коллекций под контролем EUS может стать стандартом лечения в будущем. В этом обзоре мы обсудили показания, методы, эндопротезы и осложнения, связанные с дренированием абсцессов печени под контролем EUS.
Материалы и методы
Был проведен поиск в PubMed для выявления соответствующих статей о дренировании абсцессов печени под контролем EUS. В качестве поисковых терминов использовались следующие термины: «EUS», «эндосонография» или «под контролем EUS», «абсцесс печени» или «абсцессы печени». Были включены только статьи на английском языке. Также были рассмотрены выдержки из протоколов двух крупных международных встреч (Неделя болезней пищеварения (DDW) и Единая европейская неделя гастроэнтерологии (UEG)). Сроки поиска литературы были с января 2005 г. (первое сообщение о применении этого метода было опубликовано в 2005 г.) по июнь 2019 г.Ссылки на статьи были просмотрены на предмет дополнительных статей. Проанализированы показания, техники, аксессуары, протезирование, успешность и осложнения. Доказательства из этих статей были классифицированы в соответствии с системой классификации рекомендаций, оценки, разработки и оценки (GRADE). 10
Результаты
Мы нашли 15 соответствующих статей, описывающих дренирование абсцессов печени под контролем EUS. В их число вошли 12 отчетов о клинических случаях и 3 ретроспективных исследования (). 11–25 Для анализа использовались только оригинальные отчеты. Полная статья была доступна для всех исследований, за исключением одного отчета о клиническом случае, который был представлен в абстрактной форме. Согласно рекомендациям GRADE, качество доступных доказательств было низким, поскольку доказательства были получены из неконтролируемых исследований и отчетов о случаях (). Однако результаты этих исследований могут иметь важное значение, поскольку пациенты с абсцессами, недоступными для БП, имеют ограниченные возможности лечения. В общей сложности 39 пациентам с 40 абсцессами печени, возникшими по разным причинам, было выполнено дренирование абсцесса под контролем EUS.Информация о демографических характеристиках пациента, показаниях к дренированию, технике, типу используемых принадлежностей, используемому протезу, степени успешности и частоте осложнений суммирована в и.
Таблица 1.
Резюме включенных исследований.
| Автор | Абсцесс (n) | Местоположение (n) | Подход | Технический успех (%) | Клинический успех (%) | Осложнения |
|---|---|---|---|---|---|---|
| Seewald et al. 11 (2005) | 1 | Левая доля | TG | 100 | 100 | Нет |
| Ang et al. 12 (2009) | 1 | Левая доля | TG | 100 | 100 | Нет |
| Но и др. 13 (2010) | 3 | Гастро-печеночное пространство (1) Хвостатая доля (2) | TG (2) TD (1) | 100 | 100 | Нет |
| Итои и др. . 14 (2011) | 2 | Хвостатая доля (1) Левая доля (1) | TD TG | 100 | 100 | Нет |
| Keohane et al. 15 (2011) | 2 | Хвостатая доля (2) | TG | 100 | 100 | Нет |
| Иванина и др. 16 (2012) | 1 | Хвостатая доля | TG | 100 | 100 | Нет |
| Medrado et al. 17 (2013) | 1 | Левая доля | TG | 100 | 100 | Миграция стента |
| Alcaide et al. 18 (2013) | 1 | Левая доля | TG | 100 | 100 | Нет |
| Kawakami et al. 19 (2014) | 1 | Левая доля | TG | 100 | 100 | Нет |
| Koizumi et al. 20 (2014) | 1 | Левая доля | TG | 100 | 100 | Нет |
| Kodama et al. 21 (2015) | 1 | Левая доля | TG | 100 | 100 | Смещение назо-кистозного катетера. Постановление FCSEMS |
| Ogura et al. 22 (2016) | 8 | Левая доля (6) Правая доля (2) | TG (6) TD (2) | 100 | 100 | Нет |
| Tonozuka et al. 23 (2015) | 7 | Левая доля (6) Правая доля (1) | TG (6) TD (1) | 100 | 71,4 | Самопроизвольное смещение стента |
| Yamamoto et al. . 24 (2017) | 1 | Правая доля | TD | 100 | 100 | Нет |
| Carbajo Lopez et al. 25 (2019) | 9 | Левая доля (3) Правая доля (6) | TG (3) TD (6) | 88.9 | 88,9 | GI кровотечение Перфорация |
Таблица 2.
Степень рекомендации.
| Категория доказательств | Исследования |
|---|---|
| I | 0 |
| II-1 | 0 |
| II-2 | 3 |
| II-3 | 12 |
| III | 0 |
| Классификация доказательств | C (низкое качество) |
| Сила рекомендации | Сильная рекомендация |
Таблица 3.
| Характеристики | Пациенты (n = 39) |
|---|---|
| Возраст (средний) | 64,2 ± 16,3 (диапазон 31–94) |
| Расположение абсцесса | |
| Левая доля | 75% (n = 30) |
| Правая доля | 25% (n = 10) |
| Этиология | |
| Пиогенный абсцесс | 95% (n = 37) |
| Туберкулезный абсцесс | 2.5% (n = 1) |
| Амебный абсцесс | 2,5% (n = 1) |
| Размер абсцесса (средний) | 7,7 ± 2,7 см (диапазон 2,5–11) |
| Показания | |
| Неудачное лечение антибиотиками (или) недоступность для дренажа PD | 66,7% (n = 26) |
| Первичный дренаж под контролем EUS | 33,3% (n = 13) |
Таблица 4.
Краткое описание вмешательства и результатов.
| Вмешательство | Абсцесс печени (n = 40) |
|---|---|
| Дренажный доступ | |
| Трансжелудочный | 72,5% (n = 29) |
| Трансдуоденальный | 27,5% (n = 11) |
| Дренажный протез | |
| Назоцистозный катетер | 12,5% (n = 5) |
| Прямой стент | 2,5% (n = 1) |
| Стент с двойным пигтейлом | 12.5% (n = 5) |
| Стент с двойной косичкой + назо-кистозный катетер | 7,5% (n = 3) |
| Только FCSEMS | 2,5% (n = 1) |
| FCSEMS + naso -кистозный катетер | 17,5% (n = 7) |
| FCSEMS + стент с двойным пигтейлом | 37,5% (n = 15) |
| LAMS + стент с двойным пигтейлом | 7,5% (n = 3) |
| Технический успех | 97,5% |
| Клинический успех | 95.0% |
| Осложнение | |
| Миграция стента | 5% (n = 2) |
Показание
Наиболее частым показанием для дренирования абсцессов печени под контролем EUS была неудачная медикаментозная терапия и невозможность дренировать абсцесс чрескожно (93%). Средний размер абсцесса в опубликованных исследованиях составлял 7,7 ± 2,7 см (2,5–11). Наиболее частой этиологией был гнойный абсцесс печени (95%), у двух пациентов были туберкулезный и амебный абсцессы печени, одному из которых потребовалось две процедуры дренирования. 11–25 В большинстве сообщений абсцесс располагался в левой доле печени (75%). Ang сообщил о дренировании разорванного абсцесса печени под контролем EUS у пациента с высоким хирургическим риском. 12 Кеохейн сообщил о дренировании абсцесса печени под контролем EUS у пациента с септическим шоком, требующего интенсивной терапии. 15 Два отдельных туберкулезных абсцесса, расположенные в хвостатой доле и между левой долей печени и поджелудочной железой, были успешно дренированы Итоем. 14 Хотя доступ к правой доле с помощью EUS может быть затруднительным, Огура, Тонозука, Ямамото и Карбаджо сообщили о 10 пациентах, у которых гнойный абсцесс, расположенный в правой доле печени, был успешно дренирован. 22–25
Дренаж под контролем EUS
Место взятия абсцесса было предварительно идентифицировано с помощью поперечного сечения, такого как компьютерная томография. Абсцесс печени локализовали с помощью линейного эхоэндоскопа. Использовались как диагностический эхоэндоскоп с рабочим каналом 2,8 мм, так и терапевтический эхоэндоскоп с большим рабочим каналом 3,7–3,8 мм. Первый позволяет устанавливать только стенты из 7-Fr, тогда как более крупные стенты из 10-Fr могут быть вставлены с помощью терапевтического эхоэндоскопа.Тип доступа определялся близостью абсцесса к стенке просвета и наличием промежуточных сосудистых структур, что определялось цветным допплеровским ультразвуковым исследованием. Трансгелударный доступ был предпочтительнее для абсцессов, расположенных в левой доле печени (72,5%), а трансдуоденальный доступ был предпочтительнее для абсцессов правой доли (27,5%). 11–25 Десять пациентов с абсцессами правой доли были дренированы через дуоденальный доступ. 13,14,22,23
В первом случае, о котором сообщил Зивальд, для прокола использовалась игла 22-го размера (G) с тефлоновой внешней оболочкой из 6-Fr, после чего игла извлекалась и через нее вводился проводник. тефлоновая оболочка. 11 В других случаях полость абсцесса была пунктирована с помощью тонкой иглы для аспирации (FNA) EUS 19G. После получения доступа к полости абсцесса стилет иглы FNA был удален, а проволочный направитель диаметром 0,035 или 0,025 дюйма был продвинут в полость абсцесса и намотан внутрь под рентгеноскопическим контролем (). Было рекомендовано минимум две петли внутри полости абсцесса, чтобы сохранить стабильность проволочного проводника и обеспечить безопасное развертывание эндопротеза. Если требовалась дилатация тракта перед установкой стента, это достигалось с помощью коаксиального билиарного расширителя (6–10 Fr) или баллонного расширителя (6–8 мм) по отдельности или в комбинации.Затем был установлен протез, чтобы дренировать абсцесс в желудок или двенадцатиперстную кишку.
Описывает дренирование абсцесса левой доли печени. (а) Большой абсцесс виден в левой доле печени в непосредственной близости от стенки желудка. (b) Дренирование абсцесса в желудок под контролем EUS, что продемонстрировано установкой цистогастрального стента, привело к рассасыванию абсцесса.
Протез и принадлежности
После создания тракта можно рассмотреть возможность дренирования полости абсцесса стентом или назо-кистозным дренажным катетером.Пластиковый стент с косичками и полностью покрытые саморасширяющиеся металлические стенты (FCSEMS) были дренажными системами, используемыми большинством эндоскопистов. Одновременное использование назо-кистозного дренажного катетера позволило промыть полость абсцесса для улучшения дренажа. Первый случай, о котором сообщают Seewald et al. использовали назо-кистозный катетер 7-Fr. 11 Множественные стенты с двойным пигтейлом использовались для дренирования более крупных абсцессов. Ang использовал стенты с двойными пигтейлами 8 и 10 Fr для дренирования большого разорванного абсцесса печени (10.7 × 5,7 см). 12 Расположение абсцесса и тип доступа могут затруднить развертывание стента. Itoi et al. использовали прямой стент 7-Fr, так как доступ к дренажу абсцесса осуществлялся из луковицы двенадцатиперстной кишки. 14 Стенты с двойным пигтейлом предпочтительнее прямых стентов из-за меньшего риска миграции. В недавних публикациях сообщалось о включении FCSEMS под руководство EUS для дренажа. 17–25 Использование FCSEMS имеет несколько теоретических преимуществ по сравнению с пластиковыми стентами: (1) более широкий диаметр металлического стента обеспечивает быстрый дренаж, (2) вероятность утечки гноя сводится к минимуму, (3) возможность удаление твердых некротических остатков усиливается, и (4) уменьшается необходимость в повторных процедурах.Эти теоретические преимущества перед пластиковыми стентами остаются не подтвержденными.
Medrado провела трансжелудочное дренирование с помощью 10-миллиметрового частично покрытого саморасширяющегося металлического стента (SEMS). 17 Alcaide et al. 18 использовали металлические стенты с просветом 10 мм (LAMS) для дренирования абсцесса левой доли. Kumta и Carbajo сообщили об использовании LAMS с усиленной электрокоагуляцией при дренировании трех абсцессов печени с клиническим успехом. Ogura et al., 22 в своем ретроспективном исследовании с участием 27 пациентов сравнили дренаж PD и EUS с использованием FCSEMS.Они продемонстрировали более высокий процент клинического успеха и значительно более короткое пребывание в больнице в группе дренирования EUS. Аналогичным образом, Tonozuka et al., 23 в своей ретроспективной серии случаев продемонстрировали успешное дренирование семи абсцессов печени с помощью FCSEMS. У одного пациента большой диаметр FCSEMS по сравнению со стентами с косичками позволил хирургам выполнить прямую эндоскопическую некрэктомию для удаления твердых некротических остатков. Другое ретроспективное исследование Carbajo сравнивало дренаж PD и EUS и не показало существенной разницы в техническом или клиническом успехе обеих групп.Они сообщили о своем опыте использования LAMS. 25
Результат и наблюдение
Сообщений о трудностях с дренажной техникой не поступало. Большие абсцессы и наличие твердых компонентов могут потребовать дополнительного эндоскопического дренирования. Тонозука сообщил, что показатель клинического успеха на первом сеансе составил 71,4%. Два пациента с большими абсцессами и твердыми компонентами показали разрешение после второго сеанса. О серьезных осложнениях процедуры не сообщалось. Все исследования показали полное рассасывание абсцесса ().Стенты при необходимости удалялись без каких-либо затруднений после рассасывания абсцесса. В отчете Medrado, где для трансжелудочного дренажа использовался 10-миллиметровый частично закрытый билиарный SEMS, миграция стента внутри абсцесса была отмечена через 2 недели. Стент с двойной косичкой 10-Fr был вставлен внутрь SEMS для поддержания дренажного канала, и к 8 неделям было достигнуто полное клиническое разрешение. 17 Tonozuka et al. 23 сообщили о спонтанном перемещении FCSEMS в пищеварительный тракт без каких-либо побочных эффектов.Ограничением FCSEMS является риск миграции стента. Однако использование новых LAMS с их противомиграционными системами, как продемонстрировано Alcaide et al., 18 Kawakami et al. 19 и Carbajo et al., 25 могут снизить риск смещения стента. Carbajo et al. 25 сообщили о трех случаях желудочно-кишечного кровотечения, которые лечились консервативно, и об одной перфорации, которая была закрыта во время процедуры.
Результат дренажа под контролем EUS и сравнение с PD.
Обсуждение
Нет сомнений в том, что ПД является стандартом лечения с его превосходным профилем безопасности и высокой эффективностью. Однако бывают ситуации, когда PD может быть технически невыполнимым, и именно здесь подход, основанный на EUS, может иметь значение, как описано Yamamoto et al. 24 Ограниченные опубликованные данные кажутся многообещающими.
Техника дренирования абсцесса печени под контролем EUS основана на методах, используемых для дренирования псевдокист под контролем EUS, где имеется множество данных, подтверждающих их эффективность и безопасность. 26 Необходимо признать важное отличие. В контексте псевдокист стенка псевдокисты прилегает к стенке желудка или двенадцатиперстной кишки. Напротив, в случае абсцессов хвостатой или левой / правой доли печени стенка полости абсцесса не прилегает к стенке просвета. Таким образом, там, где это возможно, должен быть край паренхимы печени. Вероятно, безопаснее всего свести к минимуму дилатацию, чтобы избежать внутрибрюшинного разлива, и использовать методы, не основанные на каутеризации.Утечка может быть уменьшена, если стент плотно прилегает или если используются индивидуальные LAMS. Эта концепция в некоторой степени похожа на концепцию транслюминального дренажа желчного протока под контролем EUS, когда желчный проток примыкает к стенке желудочно-кишечного тракта, но не прилегает к ней. 27
Развитие терапевтических EUS сделало хирургическое дренирование абсцессов печени менее привлекательным вариантом в случаях, когда чрескожный доступ невозможен. При эндоскопическом доступе осложнения и заболеваемость ниже, чем при хирургическом доступе.Основные преимущества дренирования под контролем EUS включают (1) четкую визуализацию и локализацию абсцесса, (2) четкое разграничение промежуточных структур и предотвращение непреднамеренных осложнений и (3) прямой ввод иглы в полость и предотвращение кожная инфекция и образование свищей. Хотя это кажется многообещающим, дренаж под контролем EUS имеет определенные ограничения. К ним относятся (1) трудность доступа к правой доле печени, (2) острый изгиб двенадцатиперстной кишки, ограничивающий ее маневренность, и (3) необходимость высокого уровня технических знаний и отсутствие рутинной доступности.Несмотря на указанные выше ограничения, в имеющихся исследованиях сообщается о высоком уровне успеха. 11–25 Еще одна проблема — миграция стента; таким образом, стенты с двойным пигтейлом предпочтительнее других стентов из-за меньшей вероятности миграции. Постоянное развитие EUS и аксессуаров привело к разработке SEMS с системами защиты от миграции. Alcaide et al., 18 Kawakami et al. 19 и Carbajo et al. 25 использовали полностью закрытый саморасширяющийся металлический стент с просветом для дренирования абсцесса левой доли.Однако неясно, могут ли SEMS быть рентабельными, и необходимы исследования, чтобы установить эффективность и превосходство SEMS над пластиковыми стентами. В настоящее время решение относительно типа доступа и выбора протеза должно приниматься индивидуально в зависимости от состояния пациента и опыта эндоскописта. Реакцию на дренаж следует оценивать с точки зрения как клинического, так и радиологического улучшения. Решение об удалении стента должно зависеть от реакции на лечение. Время удаления протеза широко варьировалось в доступных отчетах, но оно должно выполняться после адекватной антибактериальной терапии и документально подтвержденного рентгенологического разрешения абсцесса.
Решение о дренировании множественных или множественных абсцессов должно быть индивидуальным. Факторы, которые следует учитывать, включают количество, размер и доступность абсцессов, а также сопутствующие заболевания, лежащие в основе пациента. Хирургическое дренирование было традиционным подходом в этих обстоятельствах, но было проведено ретроспективное исследование, в котором описывалось успешное ПД при множественных абсцессах (22 из 24 пациентов) и множественных абсцессах (51 из 54 пациентов). 28 В текущем обзоре литературы не было сообщений о дренировании множественных или множественных абсцессов под контролем EUS. Тем не менее, гибридная модель дренажа, сочетающая дренаж под контролем PD и EUS, могла бы быть принята, если бы многолучевые абсцессы затрагивали обе доли печени, чтобы улучшить клинический результат. Подход к дренированию следует подбирать индивидуально с учетом состояния пациента и наличия технических знаний.
Основой лечения амебного абсцесса печени является антибактериальная терапия, которая в большинстве случаев эффективна.Дренирование амебного абсцесса печени показано только при отсутствии клинического улучшения после лечения антибиотиками и высоком риске разрыва абсцесса. 29 Коидзуми и др. Сообщили о своем опыте дренирования амебных абсцессов печени под контролем EUS. Они использовали чреспеченочный подход через желудок, чтобы избежать утечки инфицированного содержимого в брюшную полость, что может привести к катастрофическим последствиям. Автор пришел к выводу, что дренаж под контролем EUS является эффективной альтернативой PD с некоторыми преимуществами, такими как четкая визуализация, низкий риск чрескожной инфекции и возможность достижения прямого доступа через транслюминальный путь без внешней трубки. 20
Заключение
EUS произвела революцию в области диагностической и терапевтической эндоскопии. EUS позволяет полностью визуализировать левую долю и центральные сегменты печени. Имеющиеся предварительные данные позволяют предположить, что дренаж под контролем EUS безопасен и осуществим. Однако использование дренажа под контролем EUS следует ограничивать только разжиженными абсцессами, затрагивающими левую долю или центральные сегменты печени, не поддающиеся лечению БП. Мы твердо убеждены в том, что дренирование под контролем EUS с его превосходным профилем безопасности следует рассматривать при абсцессах, недоступных для PD до хирургического дренирования ( GRADE C, Сильная рекомендация ).В определенных клинических ситуациях дренирование под контролем EUS может служить дополнительной техникой к PD-доступу. Решение относительно типа доступа и выбора протеза должно быть индивидуальным, исходя из состояния пациента и опыта эндоскописта. Пластиковые стенты с двойным пигтейлом предпочтительнее прямых стентов. Теоретически SEMS могут ускорить процесс восстановления, обеспечивая более быстрый дренаж, чем другие стенты, но должны быть LAMS, чтобы снизить риск миграции. Показанием к дренированию абсцесса печени под контролем EUS является отсутствие консервативного лечения антибиотиками или абсцесс, не поддающийся лечению БП.Эта процедура противопоказана пациентам, которые нестабильны для эндоскопии, включая седацию, нескорректированную коагулопатию и отсутствие технических знаний или поддержки со стороны других специалистов, таких как интервенционные радиологи и хирурги. Кроме того, необходимо решить вопрос об относительной рентабельности. Учитывая, что БП является в настоящее время краеугольным камнем лечения, и относительно низкая частота ситуаций, когда БП невозможна, маловероятно, что можно будет провести какие-либо крупные рандомизированные исследования, и поэтому решение должно быть основано на опыте и клинической оценке.
Сноски
Заявление о конфликте интересов: Автор (ы) заявили об отсутствии потенциальных конфликтов интересов в отношении исследования, авторства и / или публикации этой статьи.
Финансирование: Автор (ы) не получил финансовой поддержки для исследования, авторства и / или публикации этой статьи.
Идентификатор ORCID: Юнг Ка Чин https://orcid.org/0000-0002-0816-9375
Ссылки
1. Малик А.А., Бари С.У., Руф К.А. и др.Пиогенный абсцесс печени: изменения в подходах. World J Gastrointest Surg 2010; 272 (12): 395–401. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2. Бертель К.К., Ван Хеерден Дж. А., Шиди П. Ф. и др. Хирургическое лечение гнойных абсцессов печени по сравнению с чрескожным дренированием. Arch Surg 1986; 121: 554–558. [PubMed] [Google Scholar] 3. Bergamini TM, Larson GM, Malangoni MA, et al. Абсцесс печени: обзор 12-летнего опыта. Arch Surg 1986; 121 (5): 596–599. [Google Scholar] 4. Фогль Т.Дж., Эстифан Ф. Пиогенный абсцесс печени: интервенционное против хирургического лечения: техника, результаты и показания.Рофо 2001; 173 (7): 663–667. [PubMed] [Google Scholar] 5. Раджак С.Л., Гупта С., Джайн С. и др. Чрескожное лечение абсцессов печени: пункционная аспирация или катетерный дренаж. AJR Am J Roentgenol 1998; 170 (4): 1035–1039. [PubMed] [Google Scholar] 6. Зерем Э., Хаджич А. Чрескожный катетерный дренаж под сонографическим контролем в сравнении с игольной аспирацией в лечении гнойного абсцесса печени. AJR Am J Roentgenol 2007; 189 (3): W138 – W142. [PubMed] [Google Scholar] 7. Джованнини М., Борис Э., Мутардье В. и др.Дренирование глубоких абсцессов таза с помощью терапевтической эхоэндоскопии. Эндоскопия 2003; 35 (6): 511–514. [PubMed] [Google Scholar] 8. Джованнини М., Песенти С., Роланд А.Л. и др. Эндоскопический дренаж псевдокисты поджелудочной железы или абсцессов поджелудочной железы под контролем УЗИ с использованием терапевтического эхо-эндоскопа. Эндоскопия 2001; 33 (6): 473–477. [PubMed] [Google Scholar] 9. Зеевальд С., Бренд Б, Омар С. и др. Дренирование поддиафрагмального абсцесса под контролем EUS. Гастроинтест Эндоск 2004; 59 (4): 578–580. [PubMed] [Google Scholar] 10.Guyatt GH, Oxman AD, Vist GE и др. ОЦЕНКА: формирующийся консенсус по оценке качества доказательств и силы рекомендаций. BMJ 2008; 336 (7650): 924–926. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Зеевальд С., Имазу Х., Омар С. и др. Дренирование абсцесса печени под контролем EUS. Гастроинтест Эндоск 2005; 61 (3): 495–498. [PubMed] [Google Scholar] 12. Ang T, Seewald S, Teo E, et al. Дренирование разорванного абсцесса печени под контролем EUS. Эндоскопия 2009; 41 (Приложение 2): E21 – E22. [PubMed] [Google Scholar] 13.Но С., Пак до Х, Ким И и др. Дренирование абсцессов печени под контролем EUS, недоступное для чрескожного дренирования (с видео). Гастроинтест Эндоск 2010; 71 (7): 1314–1319. [PubMed] [Google Scholar] 14. Itoi T, Ang T, Seewald S, et al. Дренаж под контролем эндоскопического ультразвукового исследования для дренирования туберкулезного абсцесса печени. Dig Endosc 2011; 23 (Дополнение 1): 158–161. [PubMed] [Google Scholar] 15. Кеохан Дж., Димаио С.Дж., Шаттнер М.А. и др. Дренирование абсцесса хвостатой доли печени под контролем EUS. J Интерв Гастроэнтерол 2011; 1 (3): 139–141.[Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Иванина Э., Майер И., Ли Дж. И др. Дренирование абсцесса печени под контролем EUS. Гастроинтест Эндоск 2012; 75 (4): AB114. [Google Scholar] 17. Medrado BF, Carneiro FOAA, Vilaca TG и др. Дренирование гигантского абсцесса печени под контролем EUS. Эндоскопия 2013; 45 (Приложение 2): E331 – E332. [PubMed] [Google Scholar] 18. Алькаид Н., Варгас-Гарсия А.Л., Санчо-дель-Валь Л. и др. Дренирование абсцесса печени под контролем EUS с помощью металлического стента, выходящего из просвета. Гастроинтест Эндоск 2013; 78 (6): 941–942.[PubMed] [Google Scholar] 19. Каваками Х., Кавакубо К., Куватани М. и др. Дренирование абсцесса печени под контролем эндоскопического ультразвукового исследования с использованием специального широкого, полностью покрытого саморасширяющегося металлического стента с расширяющимися концами. Эндоскопия 2014; 46 (Дополнение 1 UCTN): E982 – E993. [PubMed] [Google Scholar] 20. Коидзуми К., Масуда С., Удзима Х. и др. Эндоскопический дренаж под контролем ультразвука амебного абсцесса печени, распространяющегося в субкапсулярное пространство печени. Clin J Гастроэнтерол 2015; 8 (4): 232–235. [PubMed] [Google Scholar] 21.Кодама Р., Саегуса Х., Ушимару Х. и др. Дренирование инфицированной внутрикистозной папиллярной аденокарциномы печени под контролем эндоскопического ультразвукового исследования. Clin J Гастроэнтерол 2015; 8 (5): 335–339. [PubMed] [Google Scholar] 22. Огура Т., Масуда Д., Саори О. и др. Клинические результаты эндоскопического дренирования абсцесса печени под контролем УЗИ с использованием саморасширяющегося покрытого металлического стента (с видео). Dig Dis Sci 2016; 61 (1): 303–308. [PubMed] [Google Scholar] 23. Тонозука Р., Итои Т., Цучия Т. и др. Дренирование абсцесса печени и инфицированной биломы под контролем EUS с использованием коротких и длинных металлических стентов (с видео).Гастроинтест Эндоск 2015; 81 (6): 1463–1469. [PubMed] [Google Scholar] 24. Ямамото К., Итои Т., Цучия Т. и др. Дренирование абсцесса печени в правой части печени под контролем EUS у пациента с синдромом Чилайдити. VideoGIE 2017; 2: 299–300. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Карбахо А.Ю., Бруни Вегас Ф.Дж., Гарсия-Алонсо Ф.Дж. и др. Ретроспективное когортное исследование, сравнивающее эндоскопическое ультразвуковое исследование и чрескожное дренирование абсцессов верхней части брюшной полости. Dig Endosc 2019; 31 (4): 431–438.[PubMed] [Google Scholar] 26. Като С., Катанума А., Магучи Х. и др. Эффективность, безопасность и отдаленные результаты трансмурального дренирования поджелудочной железы поджелудочной железы под контролем EUS. Диагностика Ther Endosc 2013; 2013: 924291. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Огура Т., Сано Т., Онда С. и др. Эндоскопический дренаж желчевыводящих путей под контролем УЗИ при обструкции правого желчного протока: новые технические советы. Эндоскопия 2015; 47 (1): 72–75. [PubMed] [Google Scholar] 28. Лю Ч., Жерве Д.А., Хан П.Ф. и др.Чрескожное дренирование абсцесса печени: препятствуют ли дренирование множественных абсцессов или многоязычных абсцессов или влияют на результат? J Vasc Interv Radiol 2009; 208: 1059–1065. [PubMed] [Google Scholar] 29. Петри В.А., младший, Сингх У. Диагностика и лечение амебиаза. Clin Infect Dis 1999; 29: 1117–1125. [PubMed] [Google Scholar]Успешное применение тканевого активатора плазминогена у мужчин-подростков с пиогенным абсцессом печени
Большой гнойный абсцесс печени — редкое и трудно поддающееся лечению явление у педиатрических пациентов.Чрескожный дренаж, а не открытый хирургический дренаж стал более распространенным в последние годы, даже при больших абсцессах. Чрескожный дренаж может быть осложнен обструкцией катетера. Мы представляем случай 16-летнего мужчины с болью в животе, лихорадкой и ознобом. Ему поставили диагноз: абсцесс печени размером 9 сантиметров. Был установлен чрескожный дренаж под контролем КТ. Катетер сначала хорошо дренировался, но затем его закупорили. Активатор тканевого плазминогена закапывали в катетер каждые 6 часов, всего пять доз, что приводило к усилению дренажа и улучшению клинического состояния пациента.Насколько нам известно, это первое зарегистрированное использование тканевого активатора плазминогена при гнойном абсцессе печени в педиатрической популяции.
1. Введение
Большие пиогенные абсцессы печени (PLA) редко встречаются у педиатрических пациентов. Большинство диагнозов ставится у взрослых пациентов в возрасте около 50 лет с частотой от 8 до 20 случаев на 100 000 госпитализаций [1]. Симптомы PLA неспецифичны, а результаты физикального обследования могут быть незаметными, что может стать диагностической проблемой [2].Несмотря на низкую заболеваемость детей, составляющую от 0,007% до 0,04% всех госпитализаций, при отсутствии лечения PLA имеют высокий уровень смертности, составляющий 80-100% [3].
2. Описание клинического случая
16-летний ранее здоровый мужчина поступил в отделение неотложной помощи с ознобом, болями в животе, усиливающейся тошнотой и одышкой. Отмечено усиление работы дыхания. Абдоминальное обследование выявило умеренную болезненность в околопупочной области, но отсутствие защиты от отскока. Его оральная температура была 38.6 ° C, частота пульса 123 уд / мин, артериальное давление 121/69, частота дыхания 20 вдохов в минуту. Было отмечено, что у него плохая перфузия с наполнением капилляров в течение 4 секунд, которая улучшилась после жидкостной реанимации. Общий анализ крови показал количество лейкоцитов 18 300 мм3, количество тромбоцитов 78 000 / мм3 и гемоглобин 14,3 г / дл (14-17 г / дл). Химический анализ крови показал высокий уровень азота мочевины крови на уровне 27 мг / дл, высокий уровень креатинина на уровне 2,3 мг / дл, высокий уровень аланинаминотрансферазы на уровне 442 МЕ / л, высокий уровень аспартатаминотрансферазы на уровне 343 МЕ / л и высокий уровень общего билирубина на уровне 2.8 мг / дл. В отделении неотложной помощи больной получил одну дозу цефтриаксона. Ему назначили ванкомицин и пиперациллин / тазобактам.
Пациент был госпитализирован в педиатрическую реанимацию, где ему сделали УЗИ брюшной полости для исследования острого повреждения почек и печени. Ультразвук выявил сложное разнородное на вид смешанные мягкие ткани размером 9,3 x 9,2 см и кистозное поражение в куполе правой доли печени (рис. 1 (а)). После обсуждения с хирургической и инфекционной бригадой, в абсцесс был помещен 10-канальный чрескожный дренажный катетер (PD) с французской косичкой под контролем КТ и дренировалась гнойная коричневая жидкость.
В дренированной жидкости выросло Streptococcus anginosus, , чувствительное к пенициллину, и режим антибиотиков был изменен с пиперациллина / тазобактама и ванкомицина на монотерапию ампициллином. Метронидазол был добавлен позже в его больничный курс. После дренирования абсцесса у него развилось артериальное давление, и ему потребовалось введение норадреналина. У него развилась дыхательная недостаточность, потребовавшая неинвазивной вентиляции с положительным давлением. Минимальное количество жидкости было удалено из ПД в первые 3 дня.Контрольное ультразвуковое исследование через два дня после установки ПД показало увеличение абсцесса (18,4 × 117 см) (рис. 1 (b)). После многопрофильного обсуждения открытый хирургический дренаж был отложен. Вместо этого в PD вводили тканевый активатор плазминогена (tPA). Четыре миллиграмма tPA разводили в 50 мл физиологического раствора, закрывали на один час, а затем осушали под действием силы тяжести. Это выполнялось каждые 6 часов, всего пять доз. После инстилляции tPA дренаж катетера значительно увеличился, а респираторный статус пациента и кривая лихорадки значительно улучшились (рис. 2).Контрольное ультразвуковое исследование после 5 доз терапии tPA показало уменьшение размера абсцесса до 11,3 × 6,2 см (рис. 1 (c)). Пациент был выписан домой на амоксициллин / клавуланате и метронидазоле с установленным дренажем через 14 дней госпитализации. УЗИ, проведенное через одиннадцать дней после выписки из стационара, показало дальнейшее уменьшение размеров абсцесса до 7 × 4,9 см. PD был удален через 34 дня после первоначального размещения.
3. Обсуждение
Пиогенные абсцессы печени (PLA) трудно диагностировать; триада, состоящая из лихорадки, желтухи и дискомфорта в правом верхнем квадранте, присутствует только у 10% пациентов [4], в то время как лихорадка и боль в правом верхнем квадранте без желтухи наблюдаются только у 30% пациентов [2].В развитых странах PLA чаще всего встречаются у хозяев с ослабленным иммунитетом и в сочетании с инфекциями брюшной полости, что может помочь в диагностике [5, 6]. В развивающихся странах PLA более распространены, их зарегистрировано более 79 из 100 000 в Индии [7]. Waghmare et al. изучили 34 пациента с PLA в возрасте до 12 лет в Индии, только четыре из которых имели предрасполагающие факторы для PLA. Трое из пациентов получали только внутривенные антибиотики; девять прошли чрескожную игольную аспирацию под контролем УЗИ; 20 пациентам потребовалась ПД.Ни одному из пациентов не потребовалось открытое хирургическое дренирование [8].
Хотя PLA связаны с предрасполагающими факторами, как у детей, так и у взрослых были зарегистрированы случаи у иммунокомпетентных пациентов [9–11]. Своевременная визуализация важна для ранней диагностики абсцесса печени, если у пациента есть подозрительные симптомы или аномальные лабораторные тесты функции печени, высокий уровень С-реактивного белка или лейкоцитоз [12]. Неспособность лечить PLA всегда приводит к летальному исходу [13].
Абсцессы печени размером более 5 см обычно требуют немедленного дренирования для разрешения симптомов.Ранее это считалось заболеванием с высокой заболеваемостью, требующим открытого хирургического дренирования, со смертностью от 9 до 80% [13]. В последние годы произошел переход от открытого хирургического дренирования к ПД [14, 15]. Было продемонстрировано, что оба этих варианта лечения эффективно выводят PLA [16, 17]. Хирургический дренаж может быть предпочтительным в случаях, когда нет клинического ответа после 4-7 дней дренирования через катетер; множественные, большие или локализованные абсцессы; толстостенный абсцесс с вязким гноем; или сопутствующая внутрибрюшная хирургическая патология.Однако БП является менее инвазивной процедурой с меньшим риском и в настоящее время является основой лечения [13]. Большие абсцессы, особенно если они локализованы или содержат густую вязкую жидкость, могут не справиться с ПД из-за окклюзии катетера [18]. Активатор тканевого плазминогена можно использовать для улучшения результатов ПД и предотвращения открытого хирургического дренирования.
Хотя этот пациент физиологически близок к взрослому, он не соответствовал обычному возрастному диапазону для взрослых с PLA и лечился педиатрами в педиатрической больнице.Высокие показатели заболеваемости и смертности среди детей, не получающих лечения, требуют эффективного лечения. Тканевый активатор плазминогена успешно использовался для разрушения вязкого гноя и облегчения дренажа сложной парапневмонической эмпиемы в педиатрической популяции [19]. Его использовали для облегчения дренирования абсцесса брюшной полости у новорожденных, детей и взрослых [20, 21]. Критерии использования tPA при парапневмоническом выпоте включают вязкое содержимое с небольшим дренажом или его отсутствие при визуализации сразу после дренажа или макроскопически гнойную жидкость при первичном дренировании [22].Было показано, что дополнительный tPA в полостях абсцесса брюшной полости безопасен для взрослых, даже для пациентов, которым вводят системную антикоагуляцию [23]. В настоящее время не существует стандартизированных протоколов лечения tPA [23], и в предыдущих исследованиях не было документально подтверждено использование tPA в педиатрической PLA.
Насколько нам известно, это первый зарегистрированный случай успешного использования tPA для облегчения БП при абсцессе печени у детей. В нашем случае tPA был эффективным в облегчении дренажа PLA, что привело как к клиническим, так и к радиологическим улучшениям.При использовании tPA может потребоваться осторожность, поскольку tPA ассоциируется с кровотечением; однако он безопасно использовался у взрослых пациентов с внутрибрюшным абсцессом, даже в условиях системной антикоагуляции [23].
4. Выводы
Чрескожный дренаж является безопасным, эффективным и менее инвазивным методом лечения больших абсцессов печени у детей. Введение тканевого активатора плазминогена может улучшить дренаж в больших абсцессах, предотвращая необходимость открытого хирургического дренирования. Для оценки этого варианта лечения необходимы дополнительные исследования.
Раскрытие информации
Ранняя версия этого исследования была представлена в виде плаката на Коллоквиуме педиатрической интенсивной терапии, Вашингтон, округ Колумбия, ноябрь 2013 г.
Конфликты интересов
Авторы заявляют об отсутствии научных, финансовых или личных конфликтов интерес. Для этой рукописи не было внутреннего или внешнего финансирования.
Вклад авторов
Все авторы принимали участие в разработке концепции обзора, рецензировали соответствующую литературу, выполняли критические исправления рукописи и окончательно одобряли рукопись.
Медицинская помощь, хирургическая помощь, консультации
Автор
Рубен Перальта, доктор медицины, FACS Профессор хирургии, анестезии и неотложной медицины, старший медицинский советник, совет директоров, руководитель программы травматологии, неотложной и неотложной помощи, консультант, профессор травматологической больницы Хуана Боша, Доминиканская Республика
Рубен Перальта, доктор медицины, FACS является членом следующих медицинских обществ: Американской ассоциации банков крови, Американского колледжа хирургов, Американской медицинской ассоциации, Ассоциации академической хирургии, Массачусетского медицинского общества, Общества интенсивной терапии, Общества лапароэндоскопических хирургов, Восточного Ассоциация хирургии травм, Американский колледж руководителей здравоохранения
Раскрытие информации: раскрывать нечего.
Соавтор (ы)
Мишель В. Лисгарис, доктор медицины Доцент медицины, Медицинский факультет Университета Кейс Вестерн Резерв
Мишель В. Лисгарис, доктор медицины, является членом следующих медицинских обществ: Американского колледжа врачей, Американской медицинской ассоциации, Общества инфекционных болезней Америки , Общество эпидемиологии здравоохранения Америки
Раскрытие информации: нечего раскрывать.
Роберт А. Салата, доктор медицины, FACP, FIDSA STERIS Заведующий кафедрой передового опыта в медицине, профессор и председатель медицинского факультета Медицинского факультета Университета Кейс Вестерн Резерв; Главный врач, главный врач по инфекционным заболеваниям, Университетские больницы Медицинский центр Кливленда
Роберт Салата, доктор медицины, FACP, FIDSA является членом следующих медицинских обществ: Американской ассоциации иммунологов, Американской федерации медицинских исследований, Американской медицинской Ассоциация, Центральное общество клинических и трансляционных исследований, Американское общество инфекционных заболеваний, Медицинская ассоциация штата Огайо, Общество эпидемиологии здравоохранения Америки
Раскрытие: Ничего не разглашать.
Специальная редакционная коллегия
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Получил зарплату от Medscape за работу. для: Medscape.
Джозеф Ф. Джон, младший, доктор медицины, FACP, FIDSA, FSHEA Клинический профессор медицины, молекулярной генетики и микробиологии, Медицинский колледж Медицинского университета Южной Каролины; Заместитель начальника отдела образования, Медицинский центр по делам ветеранов Ральфа Х. Джонсона
Джозеф Ф. Джон-младший, доктор медицины, FACP, FIDSA, FSHEA является членом следующих медицинских обществ: Медицинская ассоциация округа Чарлстон, Американское общество инфекционных болезней, Южная Carolina Infectious Diseases Society
Раскрытие информации: нечего раскрывать.
Главный редактор
Джон Гейбель, доктор медицины, магистр, доктор наук, AGAF Заместитель председателя и профессор отделения хирургии отделения желудочно-кишечной медицины, профессор отделения клеточной и молекулярной физиологии Медицинской школы Йельского университета; Директор хирургических исследований хирургического отделения больницы Йель-Нью-Хейвен; Член Американской гастроэнтерологической ассоциации; Член Королевского медицинского общества
Джон Гейбель, доктор медицины, магистр, доктор наук, AGAF является членом следующих медицинских обществ: Американской гастроэнтерологической ассоциации, Американского физиологического общества, Американского общества нефрологов, Ассоциации академической хирургии, Международного общества нефрологов. , Нью-Йоркская академия наук, Общество хирургии пищеварительного тракта
Раскрытие информации: нечего раскрывать.
Дополнительные участники
Марко Дж. Патти, доктор медицины Хирург, Клиника многопрофильной хирургии больниц UNC
Марко Дж. Патти, доктор медицинских наук, является членом следующих медицинских обществ: Американской ассоциации содействия развитию науки, Американского колледжа хирургов, Американской гастроэнтерологической ассоциации, Американской медицинской Ассоциация, Американская хирургическая ассоциация, Ассоциация академической хирургии, Пан-Тихоокеанская хирургическая ассоциация, Общество хирургии пищеварительного тракта, Общество американских желудочно-кишечных и эндоскопических хирургов, Юго-западный хирургический конгресс, Западная хирургическая ассоциация
Раскрытие: нечего раскрывать.
Результат дренирования абсцессов печени с помощью катетера «косичка» под контролем УЗИ, проспективное исследование 126 случаев | Малик
Хан Р., Хамид С., Абид С. Прогностические факторы для ранней аспирации при абсцессе печени. Мир Дж. Гастроэнтерол. 2008; 14: 2089-209.
Томас П.Г., Гарг Н. Амебиаз и другие паразитарные инфекции. Блюмгарт Л. Х., Белгити Дж., Ярнаджин В. Р. Хирургия печени, желчных путей и поджелудочной железы, 4-е издание. 2009; 2: 935-51.
Strong RW. Пиогенный абсцесс печени.Блюмгарт Л. Х., Белгити Дж., Ярнаджин В. Р.. Хирургия печени, желчевыводящих путей и поджелудочной железы, 4-е издание. 2009; 2: 927-33.
Бертек СК, ван Хеерден Я.А., Шиди П.Ф. Лечение гнойных абсцессов печени. Arch Surg. 1986; 121: 554-8.
Ринтул Р., О’Риордейн М.Г., Лоренсон И.Ф. Изменение тактики гнойного абсцесса печени. Br J Surg. 1996; 83: 1215-8.
Turill FL и Brunham JR. Печеночный амебиаз. Am J Surgery 1996; 11: 424-30.
Ochsner A, DeBackey M, Murray S. et al.Пиогенный абсцесс печени. Разбор 47 случаев с обзором литературы. Am Jurg. 1938; 40: 292-319.
Шарма МП, Верма Н, Ачарая СК. Клинический профиль множественных абсцессов печени. Исследование 56 случаев. J Ассо Врачи Индии. 1990; 38: 837-9.
Data DV, Saha S, Singh SA. Клиническая картина и прогноз пациентов с амебным абсцессом печени и желтухой. Am J Болезнь пищеварения. 1973; 18: 883-98.
Грини Г.С., Рейнольдс ТБ, Донован А.Дж.. Разрыв амебного абсцесса печени.Arch Surg. 1985; 120: 555-61.
Nordestgaard AG, Stapleford L, Worthen N. Современное лечение амебного абсцесса печени. Am Surg. 1992; 58: 315-20.
Анжелика MD, Фонг Ю. Печень. Townstead MC, Beauchamp RD, Evers BM и др. Sabiston Text Book of Surgery, 18-е издание. 2010; 2: 1463-523.
Пирс Н.В., Найт Р., Ирвинг Х. Безоперационное лечение гнойного абсцесса печени. Е.П.Б. (Оксфорд). 2003; 5: 91-5.
Balaguera JC, Estevan JA, Segovia JC et al. Первичный гнойный абсцесс печени: современные варианты лечения.Интернет J Surg. 2009; 18.
Hanna RM, Dahniya MH, Badr SS. Чрескожный катетерный дренаж при лекарственно-устойчивом амебном абсцессе печени. Троп Мед Интер Хелс. 2000; 5 (8): 578-81.
Гиппократ. Подлинные сочинения Гиппократа, т. 1 и 2. Перевод [с греческого с предварительным изложением и аннотациями]. Нью-Йорк: William Wood & Co. 1886: 57,58 266 267.
Повар GC. Неотложные гастроэнтерологические ситуации в тропиках. Baillieres Clin Gastroenterol. 1991; 5: 861-86.
Ридер ММ. Тропические болезни печени и желчевыводящих путей. Семин Рентгенол. 1975; 10: 229-43.
Хьюз М.А., Петри В.А. Младший. Амебный абсцесс печени. Заражение Dis Clin North Am. 2000; 14: 565-82.
Chiu CT, Lin DY, Wu CS, Chang-Chien CS, Sheen IS, Liaw YF. Клиническое исследование гнойного абсцесса печени. Тайвань И Сюэ Хуэй За Чжи. 1987; 86: 405-12.
Barnes PF, De Cock KM, Reynolds TN, Ralls PW. Сравнение амебного и гнойного абсцесса печени. Медицина (Балтимор).1987; 66: 472-83.
Hoffner RJ, Kilaghbian T, Esekogwu VI, Henderson SO. Общие проявления амебного абсцесса печени. Ann Emerg Med. 1999; 34: 351-5.
Бранум Г.Д., Тайсон Г.С., Бранум М.А., Мейерс WC. Печеночный абсцесс. Изменения этиологии, диагностики и лечения. Ann Surg. 1990; 212: 655-62.
Шарма М.П., Кумар А. Абсцесс печени у детей. Индийский J Pediatr. 2006; 73: 813-7.
Хан Р., Хамид С., Абид С. Прогностические факторы для ранней аспирации при абсцессе печени. Мир Дж. Гастроэнтерол.2008; 14: 2089-93.
Альварес Перес Дж. А., Гонсалес Дж. Дж., Балдонедо РФ .. Клинический курс, лечение и многофакторный анализ факторов риска гнойного абсцесса печени. Am J Surg. 2001; 181: 177-86.
Chou FF, Sheen-Chen SM, Chen YS, Chen MC. Единичные и множественные гнойные абсцессы печени: клиника, этиология и результаты лечения. World J Surg. 1997; 21: 384-8.
Wong W-M, Wong BCY, Hui CK. Пиогенный абсцесс печени: ретроспективный анализ 80 случаев за 10-летний период.J Gastroenterol Hepatol. 2002; 17: 1001-7.
Ван Дж. Х., Лю Ю. С., Ли СС. Первичный абсцесс печени, вызванный Klebsiella pneumoniae на Тайване. Clin Infect Dis. 1998; 26: 1434-8.
Сингх С., Кудхари П., Саксина Н. Лечение абсцесса печени: проспективное рандомизированное сравнение катетерного дренажа и пункционной аспирации. Энн Гастроэнтерол. 2013; 26 (4): 332-9.
Мартин Э., Фанкухен Э., Нефф Р. Чрескожное дренирование абсцессов: отчет о 100 пациентах. Clin Radiol. 2009; 35: 9-11.
Нг СС, Ли Дж. Ф. и Лай ПБ.Роль и результаты традиционной хирургии в лечении гнойного абсцесса печени в современную эпоху малоинвазивной терапии. Мир Дж. Гастроэнтерол. 2008; 14: 747-51.
Nordestgaard AG, Stapleford L, Worthen N. Современное лечение амебного абсцесса печени. Am Surg. 1992; 58: 315-20.
Рубин Р.Х., Шварц М.Н., Мальт Р. Абсцессы печени: изменения в клинических, бактериологических и терапевтических аспектах. Am J Medicine. 1974; 57: 601-10.
Nordestgaard AG, Stapleford L, Worthen N.Современное лечение амебного абсцесса печени. Am Surg. 1992; 58: 315-20.
Мартин Э., Фанкухен Э., Нефф Р. Чрескожное дренирование абсцессов: отчет о 100 пациентах. Clin Radiol. 2009; 35: 9-11.
Liu CH, Gervais DA, Hahn PF. Чрескожное дренирование абсцесса печени: препятствуют ли дренирование множественных абсцессов или многоязычных абсцессов или влияют на результат? J Vasc Interv Radiol. 2009; 20: 1059-65.
Чрескожное лечение абсцесса печени — результаты
Исследовательская статьяЧрескожное лечение абсцесса печени — результаты
Томаш Милек * , Петр Поржицкий и Петр Чостек
Кафедра общей и сосудистой хирургии, Варшавский медицинский университет, Польша
* Автор, ответственный за переписку: Томаш Милек, Кафедра общей и сосудистой хирургии, Варшава Медикал Университет, Польша
Опубликован: 14 сентября 2018 г.
Цитируйте эту статью как: Miłek T, Porzycki P, Ciostek P.Чрескожное лечение печени
Абсцесс — исходы. Clin Surg. 2018;
3: 2108.
Аннотация
Введение: Смешанная бактериальная флора ответственна за развитие многочисленных абсцессов,
особенно те, которые являются следствием системной инфекции (сепсиса), происходящей из
патологии органов брюшной полости или желчных протоков. Количество и объем абсцессов могут
различаются, что влияет на метод лечения.
Цель исследования: Целью исследования была оценка эффективности малоинвазивного
чрескожное дренирование абсцессов печени.
Материал и методы: Всего в 2007–2016 годах лечение абсцесса печени прошли 37 пациентов.
Лечение включало чрескожное дренирование абсцесса печени под сонографическим контролем.
Результаты: 35 пациентов с одиночным абсцессом были успешно вылечены минимально инвазивным методом.
чрескожный дренаж.Двое пациентов с объемом абсцессов> 20 см 3 прошли хирургическое лечение после
неэффективный чрескожный дренаж.
Заключение: Чрескожный дренаж эффективен при лечении одиночных объемных абсцессов печени.
3. Абсцессы неправильной формы эффективно дренируются с помощью многоузлового дренажа. Гибридный дренаж
(эндоскопический и чрескожный) — метод выбора при лечении абсцессов, возникших в результате
непроходимость желчных протоков. Статистическая значимость маркеров воспаления была обнаружена только для
CRP, поскольку он коррелирует с эффективностью дренажа, т.е.е. возможность эффективности дренажа
снизился с увеличением значений CRP.
Ключевые слова: абсцесс печени; Чрескожный дренаж; С-реактивный белок
Введение
Бактериальный абсцесс печени — это заболевание, возникшее в результате бактериальной инфекции. Абсцессы могут быть одиночный или множественный. К основным причинам патологии относятся: Enterococcus faecalis, Staphylococcus aureus, Escherichia coli или кишечной флоры. Частота абсцессов печени остается неизменной, но Этиология различна в связи с изменениями в хирургической и микробиологической методике.Следовательно, желчный патологии протоков и дивертикулов пришли на смену аппендициту. Такая тенденция отражается и в этом бумага. У пациентов обычно наблюдается сильная лихорадка, озноб и повышенное потоотделение. Бактериальный заражение происходит разными путями. Маршрут может быть восходящим от желчного протока, портальным или из печеночной артерии, из соседних органов, в результате травмы и без очевидной причины. Согласно статистическим данным, уровень смертности в развитых странах составляет от 2% до 12%.Прогноз во многом зависит от сопутствующих заболеваний или реакции на лечение. Помимо физических осмотр и сбор анамнеза, диагноз в основном основывается на исследованиях изображений с определенным роль УЗИ и компьютерной томографии. Дополнительная информация получена из анализы крови, которые показывают повышенные воспалительные маркеры. Условие традиционно лечится таргетная антибактериальная терапия и дренирование абсцесса под сонографическим контролем или, в случае неудачи, с хирургический дренаж.Многочисленные случаи неэффективного чрескожного дренажа послужили поводом для анализа. ведущие к выявлению причин и определению показаний и принципов, а также тип пациентов, у которых чрескожный дренаж может оказаться эффективным.
Материалы и методы
В 2007-2016 гг. Лечение абсцесса печени прошли 37 пациентов. Демографические данные и основная причина развития абсцесса представлены в (Таблица 1). На основе физических обследование, сбор анамнеза и дополнительные обследования (УЗИ и компьютерная томография брюшной полости) в печени было обнаружено скопление жидкости.Маркеры воспаления, включая С — реактивный белок (СРБ) и лейкоцитоз подтвердили диагноз. Размер, а затем объем абсцесса определяли с помощью компьютерной программы, в которой использовалась компьютерная томография. данные. Метод лечения зависел от объема, количества и формы абсцессов. Небольшой единичные и множественные абсцессы 3 тома лечили чрескожная пункционная аспирация с последующим культивированием содержание. Объем абсцессов 3-5 см 3 лечили чрескожно. дренаж.Объем от 5 до 10 см 3 также был показателем для процедуры чрескожного дренажа. Абсцессы более 10 см 3 лечили чрескожно с множественными дренированием. Множественные сливы также использовались для абсцессов в форме песочных часов, чтобы полость. Каждая дренажная процедура контролировалась сонографией. В эффективность оценивалась исходя из уменьшения суммы дренированного гнойного содержимого и повторное сонографическое исследование выполняется через 3-5 дней после дренажа и до дренажа удаление.Неэффективный дренаж при стойком усилении воспалительного процесса. параметры были показанием к хирургическому дренированию. Все Пациентам вводили внутривенно антибиотики широкого спектра действия начат в первый день лечения и изменен после результатов посева были указаны (таблица 2). При этом мы попытались определить причина абсцесса. В случае механической непроходимости желчевыводящих путей протока мы провели ретроградную холангиопанкреатографию с целью декомпрессия желчных протоков.
Таблица 1
| Демографические данные | |
| Средний возраст (лет) | 68-81, среднее — 74 |
| Количество женщин / мужчин | 25/12 |
| Причина развития абсцесса печени | |
| патологии желчных протоков | 29 |
| дивертикулярные патологии | 6 |
| пневмония | 1 |
| неизвестно | 1 |
Таблица 1: Демографические данные.
Таблица 1
Демографические данные.
Результаты и обсуждение
Результаты подверглись статистическому анализу.Мы проанализировали
повлиял ли объем абсцесса на эффективность
различных методов дренажа. Анализ показал, что
объем абсцесса статистически значим и связан с
эффективность дренажа с чи 2 (df = 3) = 11,711; р = 0,008.
Распределение частот в таблице непредвиденных обстоятельств показало, что
эффективность дренажа существенно снижается при абсцессах
более 5 см 3 . Анализ показал, что тип дренажа
не было статистически значимым и связано с эффективностью
дренажа с chi2 (df = 3) = 5.017; р = 0,171. Кроме того, логистическая
регрессионный анализ проводился с использованием функции LOGIT, преобразованной
с дихотомической зависимой переменной (эффективность дренажа)
по распределению вероятностей. Результаты анализа показали, что только
значение CRP было достоверно связано с вероятностью
эффективный дренаж. На основе оценки максимального правдоподобия
можно констатировать, что вероятность эффективного дренажа уменьшается с увеличением
увеличение значений CRP.
Абсцесс печени впервые был описан Гиппократом в 400 г. до н.э. [1].
В 1938 году Охснер описал хирургическое дренирование абсцесса печени у больного.
ориентир бумага. Такой агрессивный подход привел к высокому уровню смертности.
достигая 60–80% [2]. Прогресс в радиологической и терапевтической
диагностика, связанная с точной микробиологической идентификацией
снизили смертность до уровня [3-5]. Нет смертей
были зарегистрированы у наших пациентов во время лечения. Абсцессы печени бывают
обычно множественные и одиночные чаще всего располагаются в
правая доля печени.Смертность после традиционного хирургического лечения
а системная антибактериальная терапия колеблется от 11,5% до 34% [6-8]. В
роль хирургического дренажа постепенно снижается, и процедура
чаще заменяется чрескожным дренированием [9–12]. Использование
антибиотиков рекомендовалось только в 1980-х годах и в настоящее время
не показан при таком лечении даже в самых тяжелых случаях.
Чаще всего используется сонографический метод.
направленное непрерывное чрескожное дренирование полости абсцесса.Его
эффективность колеблется от 55% до 83% [13-16]. Тонкоигольная аспирация
никогда не был популярным при лечении абсцесса печени. В настоящее время,
он чаще всего используется для сбора образцов, чтобы получить
посевы и проанализировать гнойник. В настоящем исследовании объем
абсцессы оценивали на основании компьютерной томографии.
В профессиональной литературе представлена информация только о самых крупных
размеры абсцессов. Однако мы предположили, что объем, расположение и
форма являются наиболее важными в эффективном дренировании абсцесса.Следовательно,
Мы разделили абсцессы на 4 категории по объему: 3, от 3 до 5 см 3 , от 5 до 10 см 3 и> 10 см 3 . Это подразделение
был использован для определения техники дренирования. Судя по всему,
объем абсцесса был статистически связан с дренажом
методики с p = 0,008. Распределение в таблице непредвиденных обстоятельств
указали, что эффективность дренажа существенно снизилась
при абсцессах более 5 см3.Настоящие авторы продемонстрировали,
вопреки сообщениям профессиональной литературы [17-20], дренаж может
быть эффективным после однократной пункции и аспирации в режиме сонографии.
контроль. Однако эффективность чрескожного дренирования
уменьшается при абсцессах неправильной формы более 5 см 3 и расположен под куполом диафрагмы. В этом исследовании
объем множественных абсцессов печени составлял от 3 до 5 см 3 и они
развился из-за механической непроходимости общего желчного протока.Стандартное лечение в таких случаях включает гибридную процедуру.
включая дренирование абсцесса и вскоре после этого эндоскопическое
ретроградная холангиопанкреатография для устранения утечки
инфицированной желчи. Большие абсцессы являются наиболее сложными в отношении
лечение [21-27]. Казалось бы, большой объем коллекции — это несложно.
проколоть и слить. Однако обширный воспалительный процесс
проявляется в общем состоянии пациента и заметно повышается
лейкоцитоз и CRP — плохие прогностические факторы.На основе
оценка максимального правдоподобия можно констатировать, что вероятность
эффективного дренажа уменьшается с увеличением значений CRP. В нашем
По мнению авторов, основная причина связана с размерами
абсцесс, который напрямую влияет на защитные механизмы
орган и вызывает сепсис. Аномальные результаты функции печени
тесты подтвердили результаты (аспартатаминотрансфераза — ASPAT,
аланинаминотрансфераза — АЛАТ) и иммунная система была
дополнительно ослаблен сопутствующим сахарным диабетом у 8 пациентов
(21.6%).
Техника дренажа выбиралась в зависимости от объема
абсцесс. Небольшие абсцессы (3) были опорожнены ультразвуковым методом.
управляемый прокол, поскольку этот метод облегчает опорожнение всего
абсцесс во время одной процедуры. Повторная биопсия потребовалась через 3 года.
пациенты с рецидивирующим абсцессом, несмотря на таргетную терапию антибиотиками.
Абсцессы размером более 3 см 3 требуют постоянного дренажа, поэтому дренаж
был имплантирован в полость абсцесса под сонографическим контролем.В
дренаж оставался на месте до прекращения гнойного подтекания, которое
длилась от 7 до 34 дней. Форма абсцесса была очень важна
в плане выбора техники дренажа. Мультиокулированный
Абсцессы в форме песочных часов лечили множеством дренажей. Этот
подход, направленный на достижение каждой полости для повышения эффективности
процедура. Хотя терминология и определения были
стандартизировано, большой абсцесс печени до сих пор не определен.Чанг
и другие. [28] предложили называть абсцессы более 5 см «большими».
Это стало результатом их опыта, показывающего, что такой размер требует
более длительное пребывание в больнице и дренаж связаны с высоким риском
отказ. Liao et al. [29] сообщили на основании компьютерной томографии.
сканирование 175 пациентов, у которых абсцессы размером более 7,3 см являются фактором риска
относительно эффективного дренирования абсцесса. В 2011 г. по выборке
63 пациента, эти же авторы сообщили, что размер абсцесса был
незначительно с точки зрения успешности лечения.Средний размер абсцесса
в их исследовании был 6,5 см.
Настоящие результаты показали, что объем абсцесса составляет
статистически значимы и связаны с эффективностью
дренаж с chi2 (df = 3) = 11,711; р = 0,008. Распределение в
таблица непредвиденных обстоятельств показала, что эффективность дренажа
значительно уменьшилась при абсцессах более 5 см. 3 . Системный
антибактериальное лечение остается основным лечением первой линии. В
выбор антибиотика первой линии до получения результатов
посев абсцесса, должен быть наиболее вероятным источником
инфекция и широкий спектр возбудителей.Рекомендуемый
Продолжительность парентеральной антибактериальной терапии составляет 2-4 недели или до клинической,
было получено биохимическое и радиологическое улучшение.
Таблица 2
| Организм | Чувствительность | Кол-во пациентов |
| Escherichia coli | Котримоксазол, амоксициллин, амоксициллин + клавулановая кислота, цефотаксим, цефтриаксон, аминогликозиды Фторхинолоны | 26 |
| Klebsiella pneumoniae | Котримоксазол, цефотаксим, цефтриаксон, аминогликозиды, имипенем, фторхинолоны | 29 |
| Enterobacter sp. | Цефотаксим, цефтриаксон, аминогликозиды, имипенем, котримоксазол, фторхинолоны | 6 |
| Синегнойная палочка | Цефтазидин, цефтриаксон, TMPLSNX, аминогликозиды, имипенем, фторхинолоны | 1 |
| Золотистый стафилококк | метициллин, оксациллин, цефалоспорины, макролиды, клиндамицин, Рифампицин, Котримоксазол, Тейкопланин, Ванкомицин, Нетихницин | 4 |
| Микроаэрофильные стрептококки | Имипенем | 8 |
| Bacteroides fragilis | Сульбактам Ампициллин | 6 |
Таблица 2: Микроорганизмы, выделенные в культурах гноя.
Таблица 2
Микроорганизмы, выделенные в культурах гноя.
Заключение
• Чрескожный дренаж эффективен при лечении
солитарные абсцессы печени объем 3.
• Абсцессы неправильной формы эффективно дренируются с помощью
многопозиционный дренаж.
• Гибридный дренаж (эндоскопический и чрескожный) — это
метод выбора при лечении абсцессов желчевыводящих путей.
закупорка протока.
• Статистическая значимость маркеров воспаления.
был обнаружен только для CRP, поскольку он коррелировал с эффективностью
дренаж, т.е. вероятность снижения эффективности дренажа
увеличение значений CRP.
Список литературы
- Krige JE, Beckingham IJ. Азбука болезней печени, поджелудочной железы и желчевыводящей системы. BMJ. 2001; 322 (7285): 537-40.
- Huang CJ, Pitt HA, Lipsett PA, Osterman FA Jr, Lillemoe KD, Cameron JL, et al. Пиогенный абсцесс печени. Меняются тенденции за 42 года. Ann Surg. 1996; 223 (5): 600-9.
- Ochsner A, DeBakey M, Murray S. Пиогенный абсцесс печени II. Анализ сорока семи случаев с обзором литературы.Am J Surg. 1938; 40 (1): 292-319.
- Бранум Г.Д., Тайсон Г.С., Бранум М.А., Мейерс WC. Печеночный абсцесс. Изменения этиологии, диагностики и лечения. Ann Surg. 1990; 212 (6): 655-62.
- Рахимиан Дж., Уилсон Т., Орам В., Хольцман Р.С. Пиогенный абсцесс печени: последние тенденции в этиологии и смертности. Clin Infect Dis. 2004; 39 (11): 1654-9.
- Farges O, Leese T, Bismuth H. Пиогенный абсцесс печени: улучшение прогноза. Br J Surg. 1988; 75 (9): 862-5.
- Pitt HA, Zuidema GD.Факторы, влияющие на летальность при лечении гнойного абсцесса печени. Surg Gynecol Obstet. 1975; 140 (2): 228-34.
- Chen SC, Huang CC, Tsai SJ, Yen CH, Lin DB, Wang PH и др. Тяжесть заболевания как главный предиктор смертности у пациентов с гнойным абсцессом печени. Am J Surg. 2009; 198 (2): 164-72.
- Chou FF, Sheen-Chen SM, Chen YS, Chen MC. Единичные и множественные гнойные абсцессы печени: клиника, этиология и результаты лечения. World J Surg. 1997; 21 (4): 384-8.
- Малик А.А., Бари С.У., Руф К.А., Вани К.А. Пиогенный абсцесс печени: изменение модели подхода. World J Gastrointest Surg. 2010; 2 (12): 395-401.
- Бари С., Шейх К.А., Ашраф М., Хуссейн З., Хамид А., муфтий Г.Н. Аскаридный абсцесс печени у детей. J Gastroenterol. 2007; 42 (3): 236-40.
- Chung YF, Tan YM, Lui HF, Tay KH, Lo RH, Kurup A и др. Лечение гнойных абсцессов печени — чрескожное или открытое дренирование ?. Сингапур Мед Дж. 2007; 48 (12): 1158-65.
- Хоуп В.В., Врочидес Д.В., Ньюкомб В.Л., Мэйо-Смит В.В., Яннитти Д.А.Оптимальное лечение абсцесса печени. Am Surg. 2008; 74 (2): 178-82.
- Rintoul R, O’Riordain MG, Laurenson IF, Crosbie JL, Allan PL, Garden OJ. Изменение тактики гнойного абсцесса печени. Br J Surg. 1996; 83 (9): 1215-8.
- Назир Н.Т., Пенфилд Д.Д., Хаджар В. Пиогенный абсцесс печени. Cleve Clin J Med. 2010; 77 (7): 426-7.
- Hui JY, Yang MK, Cho DH, Li A, Loke TK, Chan JC и др. Пиогенные абсцессы печени, вызванные Klebsiella pneumoniae: внешний вид и результаты аспирации в США.Радиология. 2007; 242 (3): 769-76.
- Раджак С.Л., Гупта С., Джайн С., Чавла Ю., Гулати М., Сури С. Чрескожное лечение абсцессов печени: аспирация иглой по сравнению с дренированием катетером. AJR Am J Roentgenol. 1998; 170 (4): 1035-9.
- Porras-Ramirez G, Hernandez-Herrera MH, Porras-Hernandez JD. Амебный абсцесс печени у детей. J Pediatr Surg. 1995; 30 (5): 662-4.
- Бергер Л.А., Осборн ДР. Лечение гнойных абсцессов печени чрескожной иглой.Ланцет. 1982; 319 (8264): 132-4.
- Пирс Н., Найт Р., Ирвинг Х., Менон К., Прасад К., Поллард С. и др. Безоперационное лечение гнойного абсцесса печени. Е.П.Б. (Оксфорд) 2003; 5 (2): 91-5.
- О’Фаррелл Н., Коллинз К. Дж., МакЭнти, GP. Пиогенные абсцессы печени: снижение роли оперативного лечения. Хирург. 2010; 8 (4): 192-6.
- Zerem E, Hadzic A. Чрескожный катетерный дренаж под контролем сонографии по сравнению с игольной аспирацией в лечении гнойного абсцесса печени.AJR Am J Roentgenol. 2007; 189 (3): W138-42.
- Джорджио А., Тарантино Л., Мариниелло Н., Франсика Г., Скала Е., Аморосо П. и др. Пиогенные абсцессы печени: 13-летний опыт чрескожной пункционной аспирации под контролем США. Радиология. 1995; 195 (1): 122-4.
- Bertel CK, van Heerden JA, Sheedy PF. Лечение гнойных абсцессов печени. Хирургический или чрескожный дренаж. Arch Surg. 1986; 121 (5): 554-8.
- Liao WI, Tsai SH, Yu CY, Huang GS, Lin YY, Hsu CW и др.Пиогенный абсцесс печени, леченный чрескожным катетерным дренированием: оценка результатов лечения методом MDCT. Eur J Radiol. 2011; 81 (4): 609-15.
- Aydin C, Piskin T., Sumer F, Barut B, Kayaalp C. Лапароскопическое дренирование гнойного абсцесса печени. JSLS. 2010; 14 (3): 418-20.
- Руссо Т., Манделл Дж., Беннетт Дж., Долин Р. Манделл, Принципы и практика инфекционных заболеваний Дугласа и Бенетта. Нью-Йорк: Черчилль Ливингстон. 4. 1995. Возбудители актиномикоза; С. 2280–2287.
- Chung YF, Tan YM, Lui HF, Tay KH, Lo RH, Kurup A и др.Лечение гнойных абсцессов печени — чрескожное или открытое дренирование ?. Сингапур Мед Дж. 2007; 48 (12): 1158-65.
- Liao CY, Yang YS, Yeh YC, Ben RJ, Lee CC, Tsai CC и др. Синдром инвазивного абсцесса печени, предрасположенный к абсцессу простаты, связанному с Klebsiella pneumoniae, у пациента без диабета: отчет о болезни. BMC Res Notes. 2016; 9; 9: 395.
Прикроватная ультразвуковая процедура: дренирование абсцесса печени. # ПЕНА, # ПЕНА
Привет,
Прошу прощения за долгий перерыв.Подумал, что поделюсь случаем прошлой ночи. Несколько недель назад 54-летний мужчина поступил с сепсисом, вызванным кишечной палочкой, осложненным тромбозом воротной вены и множественными поражениями печени. Последующее сканирование госпиталистом показало следующее:
Ага, противно. Так что вызвали нашу информационно-пропагандистскую службу интенсивной терапии (мы выполняем все необходимые процедуры в палатах), и это оказался я.
Итак, в 22:00 я иду со всем необходимым оборудованием (не так много, что нельзя сделать с ультразвуком и кофеином!):
Вот клип:
Итак, это синтез нескольких петель US.Первые просто показывают поражение, которое при УЗИ явно жидкое — движение хорошо видно с дыханием / пульсацией. Затем вы видите связанный с ним асцит и быстро просматриваете субксифоидный вид сердца.
Затем вы видите саму процедуру с введением иглы (намеренно резким для визуализации) и постепенным дренированием абсцесса после трехходового запорного крана.
В данном случае я решил слить воду вручную, чтобы избежать возможного засорения трубки, если ее просто оставить, так как это была маленькая 8.Катетер французской косички 5 (лучше для комфорта). Вы можете видеть, что полость доступа практически стерта. 400 мл или около того слито:
Технически это было очень просто, однако один важный обучающий момент — выбрать нижнебоковой доступ, поскольку более простой, но более опасный — простой боковой — может привести к прохождению через плевральную полость из-за латерального реберно-диафрагмального углубления, которое расширяется. довольно низко. Поэтому при выборе точки входа важно убедиться, что она находится ниже диафрагмы.В противном случае есть вероятность засеять плевральное пространство содержимым абсцесса. Это было бы неоптимально.
Преимущества прикроватного УЗИ? Быстрый и легкий дренаж в выходные дни, когда интервенционная радиология недоступна.
ура!
Филипп
Нравится:
Нравится Загрузка …
СвязанныеИнтернет-научных публикаций
Введение
Entamoeba поражает около 10% населения мира, к счастью, только у 10% инфицированных развивается клинический синдром амебного проявления. 1 Из этого числа только в 3–9% случаев развивается амебный абсцесс печени (АЛК). В развивающихся странах тропических регионов заболеваемость определенно в 3-5 раз больше. Распространенность достигает 50% в эндемичных регионах. Согласно одному исследованию, ежегодно происходит 40000 смертей из-за инвазивного амебиаза. 2 Плохое социально-экономическое положение, плохая санитария, перенаселенность, небезопасная питьевая вода, культурные привычки по-прежнему являются предрасполагающими факторами в развивающихся странах. Заболеваемость возрастает, и иногда, если диагноз задерживается, наступает смертность.Сама по себе лекарственная терапия является основой лечения. Однако существует широкая практика аспирации и дренирования во всех случаях с убеждением, что аспирация ускоряет клиническое выздоровление без каких-либо процедурных осложнений, подтвержденных исследованиями. 3 В то время как другие показали, что аспирация не влияет на клиническое выздоровление. 4 Это исследование было предпринято для оценки легкодоступного ультразвукового исследования как диагностического и терапевтического инструмента, а также для оценки протокола лечения амебного абсцесса печени, как это предлагается в мировой литературе.
Материал и метод
Наше учреждение, специализированный центр на севере Индии, предоставляющий медицинские услуги в 8-10 прилегающих сельских районах, расположенных в эндемичной зоне амебиаза. В период с декабря 2003 г. по ноябрь 2006 г. мы обнаружили 130 случаев подозрения на амебный абсцесс печени. Из них у 86 пациентов была подтверждена АЛК. Диагноз ALA был установлен на основании анамнеза, обследования, ультразвукового исследования и, при необходимости, диагностической аспирации. Серологический тест обычно не проводился из-за эндемичного региона и финансовых ограничений.У всех пациентов были проведены другие стандартные обследования, в том числе рентген грудной клетки. Культура и чувствительность были зарезервированы для подозреваемой вторичной инфекции. Лечение проводилось в соответствии с критериями, сформулированными на основе различных клинических исследований.
Критерии выбора
Предполагаемое клиническое проявление.
USG во всех случаях.
Диагностическая аспирация, если требуется.
Компьютерная томография была отложена в отдельных случаях.
Критерии включения
Все пациенты с амебным абсцессом печени.
Пациенты получили полное лечение.
Пациенты обратились за помощью в соответствии с рекомендациями.
Критерии исключения
Пациенты детской возрастной группы.
Пациенты, у которых позже было диагностировано другое заболевание.
Пациенты, потерянные из-за раннего наблюдения
Пациенты с гнойным абсцессом печени.
Критерии USG для диагностики
Стена — слабое эхогенное, мелкоэхогенное или толстое эхогенное
Контент — гипер- и гипоэхогенный смешанный рисунок, гомогенный гипоэхогенный рисунок, гипоэхогенный и анэхогенный рисунок
Связанный правый плевральный выпот как доказательство разрыва
Аспирация типичного гноя соуса из анчоусов под контролем УЗИ
Методы лечения
Были сформированы четыре группы различных методов лечения.
Только медикаментозная терапия
Аспирация под контролем УЗИ + лекарство.
Чрескожный катетерный дренаж (ПКД) + лекарство.
Лапаротомия и дренирование + препарат
Только критерии консервативного лечения
Абсцессы всех несложных форм.
Нет признаков разрыва / тормозящего разрыва.
Без эффекта сжатия.
Симптомы исчезли после 72-96 часов лечения.
Критерии аспирации под ультразвуковым контролем
Большой абсцесс со знаком надвигающегося разрыва / сжатия.
В зависимости от сайта. Размер варьируется от> 5 см /> 500 мл и выше.
Множественный абсцесс левой и правой доли.
Отсутствие улучшения при неинвазивном лечении через 4-5 дней
Критерии дренирования чрескожного катетера
Толстый сбор не отсасывается иглой
Отказ аспирации под ультразвуковым контролем
При наличии признаков надвигающегося разрыва или сдавления и признаков вторичной инфекции.
- Чрескожный катетер
8-12F был установлен под контролем УЗИ и местной анестезией.
Критерии лапаротомии и дренирования
Абсцесс брюшной полости рваный
Признаки перитонита с вовлечением других внутренних органов.
Осложненный разрыв АЛК в плевральной / перикардиальной полости при необходимости.
Последующее наблюдение
Не было определенных критериев или продолжительности наблюдения. Последующее наблюдение зависело от клинических особенностей и реакции на лечение, размера и локализации абсцесса, типа сопутствующего осложнения.
Статистический анализ
Среднее значение со стандартным отклонением для возраста, клинической картины.
Рассчитывали чувствительность, специфичность, положительную и отрицательную прогностическую ценность ультразвука.
Z-тест на пропорцию применяется для выяснения значимости факторов
Результаты
Средний возраст обращения составил 32 года.4 года. Преобладание мужчин было в соотношении 20,5: 1. Обычными проявлениями были анорексия, боль и дискомфорт с болезненной гепатомегалией (стр.
).Рисунок 1
Рисунок 1: Ультразвуковое обнаружение ALA в правой доле печени
56 из 86 пациентов были подвергнуты консервативному лечению (как показано в таблице-1).
Рисунок 2
Таблица 1
У этих пациентов были симптомы от легкой до умеренной без каких-либо осложнений.Из этих 56 пациентов 46 успешно прошли консервативное лечение. Только у 10 пациентов не исчезли жар и боль. Общий показатель успеха консервативного лечения составил 82%, но у пациентов с размером полости менее 500 мл показатель успеха составил 98,1%.
23 из 86 пациентов с ALA были подвергнуты пункционной пункции под ультразвуковым контролем и лечению (см. Таблицу 2).
Рисунок 3
Таблица 2
Включено 10 пациентов, не поддающихся консервативному лечению.3 с множественным абсцессом размером 500-1000 мл и 10 с одиночным абсцессом размером 500-1000 мл. Из этих 23 пациентов 18 были успешно вылечены. Общая успешность пункционной пункции под контролем УЗИ составила 78,3%.
15 пациентам было выполнено дренирование с помощью гибкого катетера (рис. 2).
Рисунок 4
Рисунок 2: Фотография катетера в полости абсцесса
Включая 5 пациентов с неудачной аспирацией под УЗИ. 4 случая относились к группе 500–1000 правой доли, 6 пациентов — с полостью абсцесса> 1000 мл с компрессионными особенностями (показаны в таблице 3).
Рисунок 5
Таблица 3
Симптомы у всех пациентов улучшились. Катетер удалили через 10-14 дней. Успешность этого метода составила 100%. 7 пациентам выполнена лапаротомия и открытый дренаж (таблица-4). У 3 пациентов был внутрибрюшинный разрыв, у 1 пациента был ассоциированный внутриплевральный разрыв (Рис. 3), кроме перитонеального загрязнения, ему было выполнено дренирование с помощью торакостомии с межреберной трубкой.
Рисунок 6
Рисунок 3: Рентгеновский снимок грудной клетки, показывающий разрыв абсцесса во множественной полости
2 пациента поступили с большим абсцессом (> 1000 мл) с перитонитом перфорации слепой кишки.Им выполнено дренирование абсцесса с ограниченной правой гемиколэктомией. 1 пациенту с множественными абсцессами и объемом одной полости> 1000 мл была проведена процедура открытого дренирования. 2 пациента из 7 умерли (один с внутрибрюшинным разрывом и один с перфорацией слепой кишки с большой АЛК) позже от вторичной инфекции и сепсиса.
Рисунок 7
Таблица 4
Обсуждение
Эпидемиология
ALA охватывает взрослое население в возрасте от 20 до 60 лет.В нем преобладают мужчины в 3-10 раз больше, чем женщины, 5 в нашем исследовании женщин было намного меньше, всего 4 из 86 пациентов. Точная этиология преобладания и наименьшего вовлечения мужчин в экстремальных возрастах не ясна. Большинство пациентов были из сельской местности и с низким социально-экономическим статусом. Антисанитарные условия, небезопасная питьевая вода, плохая санитария, перенаселенность по-прежнему являются распространенными предрасполагающими факторами. Гомосексуализм мужчин, ВИЧ, заключенные, злокачественные новообразования, низкий иммунитет и посещение эндемичных территорий — это другие факторы риска.В нашем исследовании мы не обращались к факторам риска и не проводили анализа.
Клиническая презентация
В ранней подострой фазе преобладают такие симптомы, как анорексия, тошнота, ночная потливость. В установленных случаях общими признаками являются боль в правом подреберье, лихорадка легкой и средней степени тяжести и гепатомегалия. 6 Высокая температура с ознобом указывает на вторичную бактериальную инфекцию, встречается в 20% случаев. 7 Желтуха встречается редко, присутствует только в 5-10% случаев.Особенности перитонита связаны с поражением кишечника или разрывом абсцесса печени. Другие особенности могут быть связаны с поражением плевры или перикарда.
Диагностика
В нашу эпоху визуализации с высоким разрешением ультразвук по-прежнему является опорой при постановке диагноза. Чувствительность достигает 80-95%, 8 в нашем исследовании она составила 96,5%. Дилемма возникает только в некоторых случаях, когда дифференциация с гнойным абсцессом и другими кистозными образованиями становится затруднительной.В сложных случаях полезны пункционная аспирация под контролем УЗИ и компьютерная томография. Ультразвук также помогает обнаружить разрыв абсцесса, сопутствующее заболевание желчевыводящих путей и перитонит. Его повторение легче в последующих действиях. Серологический тест действительно помогает в постановке диагноза, но высокая ложноположительность в эндемичных регионах ограничивает его роль. Демонстрация кист / трофозоитов с помощью эксфолиативной цитологии — еще одно средство подтверждения диагноза. 9 В большинстве случаев диагноз ставится на основании анамнеза, осмотра, ультразвукового исследования и диагностической аспирации типичного соуса из анчоусов.
Лечение
Ранее говорилось, что «гной должен быть удален», поэтому дренирование проводилось независимо от характера абсцесса печени. Теперь, когда появилась более подробная концепция этиопатогенеза и поскольку АЛК не является истинным абсцессом, лечение АЛК радикально изменилось. Большинство ALA лечится консервативным лечением (только медикаментозное лечение). 10 При неосложненной АЛК размером до 10 см (1000 мл) не было обнаружено значительных различий между лечением только метронидазолом и его комбинацией с аспирацией. 11 В нашем исследовании большинство абсцессов в группах объемом <500 мл и 500-1000 мл лечили только медикаментозным лечением. 15-50% пациентов могут не отвечать только на медикаментозное лечение. 12 Тем, кто не ответил только на медикаментозную терапию, был проведен дополнительный дренаж. Показаниями к дренажным процедурам являются абсцесс большого размера со знаком компрессии или желтуха, сохраняющаяся лихорадка с ознобом, болью и высокой вероятностью разрыва. 13 Аспирация под ультразвуковым контролем имеет как диагностические, так и терапевтические преимущества.По нашим наблюдениям, аспирация под ультразвуковым контролем при более крупных абсцессах помогает в раннем облегчении симптомов, но заживление требует своего времени. Многие авторы показали лучший исход абсцесса печени либо после аспирации под контролем УЗИ, либо после чрескожного катетерного дренирования в отдельных случаях, независимо от характера абсцесса. 14 , 15 Чрескожный катетерный дренаж (ПКД) выбирают при симптоматическом более крупном абсцессе, имеющем либо толстое содержимое, либо признаки вторичной бактериальной инфекции, резистентные к медикаментозной терапии. 16 Чрескожное введение катетера в полость абсцесса под контролем ультразвука и местной анестезии легко выполнить в дневном стационаре. PCD экономически эффективен; болезненности открытого и лапароскопического дренирования можно избежать. Лапаротомия требуется при разрыве абсцесса, сопутствующем перитоните и поражении кишечника. Слепая кишка и правая кишка обычно вовлечены в внутренние органы наряду с АЛК в нашем наблюдении и других, 17 , хотя амебный колит часто встречается в сигмовидной кишке.Лапароскопический дренаж не имеет дополнительных преимуществ перед PCD, скорее пневмоперитонеум отменяет защиту Природы. Лапароскопия полезна при разорванном абсцессе, когда возможна уборка брюшины, установка дренажа и исследование кишечника. Заболеваемость ALA увеличивается из-за разрыва абсцесса в брюшной, множественной или перикардиальной полости. Вторичная инфекция и сепсис — основная причина смертности. Следовательно, предостережение «промедление опасно» применимо и при амебном абсцессе печени.Решение ALA занимает от нескольких недель до 18 месяцев. 18 Демонстрация полости / поражения на изображениях после завершения лечения и при последующем наблюдении не означает возобновления лечения, а скорее зависит от симптомов и появления нового поражения.
Заключение
Консервативное лечение метронидазолом / тинидазолом и иногда его сочетание с антибиотиками при вторичной инфекции — это надежный якорь в лечении около 80% АЛК.Дренирование требуется только при больших абсцессах с компрессионными особенностями, вторичной инфекцией и резистентностью к лекарственной терапии. Чрескожный катетерный дренаж — жизнеспособный вариант для адекватного дренирования высокого вязкого содержания АЛК. Облегчение симптомов — это показатель эффективности лечения. Хирургическое вмешательство во всех случаях нежелательно, и его следует избегать.
Благодарность
Мы признательны профессору Азизу Хану за его усилия по статистическому анализу и нашим врачам-резидентам за сбор данных
Переписка на
Доктор Афзал Анис C-25 Медицинская колония A M U, Алигарх 202002 Тел. 0571-2720186 91-9412653744 Идентификатор электронной почты — afzalanees @ gmail.ком [email protected]
Список литературы
1. Шарон Л.Р. Амебиаз и инфекции свободноживущими амебами. В: Fauci AS, Braunwald E, et al., Harrisons, принципы внутренней медицины, 14-е изд. США. Мак Гроу Хилл. 1998; 1126-1180.2. Ли Эллен, Стэнли Л. Простейшие: амебиаз. Гастроэнтерол Cl N Am. 1996; 25: 471-492.
3. Тандон А., Джайн А.К., Диксит В.К. и др. Аспирация иглой при огромном амебном абсцессе печени. Троп. гастрентерол 1997; 18: 19-21.
4. VanAllenRJ, KatzMD, JohnsenMB, LaineLA, Liu Y, Ralls PW. Неосложненный амебный абсцесс печени: проспективная оценка чрескожной терапевтической аспирации. Радиология 1992; 183: 827-830
5. SepulvedaB, ManzoNTG, Клинические проявления и диагностика амебиаза. В: Martinez-PalomaA (eds) Амебиаз: паразитарное заболевание человека. Остердам, Эльзевир. Глава 5 1986; 169–187
6. Хоффмер Р.Дж., Килагбиан Т., Эскогву В.И., Хандевсон С.О. Распространенное проявление амебного абсцесса печени. Ann Emerg med.1999; 34: 351-355.
7. Шерлок С., Дули Дж. Инфекция печени, В: Заболевание печени и желчевыводящей системы. 9 изд. Лондон Блэквелл 1993; 471-477
8. Йео К.Г., Яп И., Вонг С.Т., Ви А. и др. Тропическая болезнь печени. PGMJ 1997; 73: 89-92
9. Бхамбани С., Кашьяп В. Амебиаз: диагностика с помощью аспирационной и эксфолиативной цитологии. Cytopathol 2001; 12: 329-322.
10. Шарма М.П., Ахуджа В., Лечение амебного и гнойного абсцесса печени, Ind J Gastrol 2001; 20suppl: C33-36
11.Blessmann J, Binh HD, Hung DM и др. Лечение абсцесса печени одним метронидазолом или в сочетании с аспирацией под ультразвуковым контролем: сравнительное, проспективное и рандомизированное исследование. Trop Med и Int Health. 2003; 8: 1030-1034
12. Кханна С., Чаудхари Д., Кумар А. и др. Опыт проведения аспирации при амебном абсцессе печени в эндемичной зоне. Eur J Clin Microbiol Infected Dis.

 полости под контролем УЗИ
полости под контролем УЗИ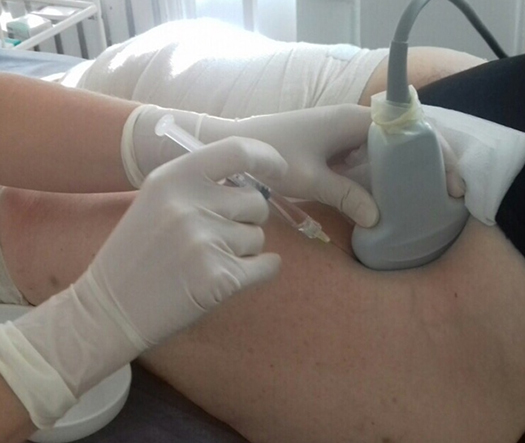
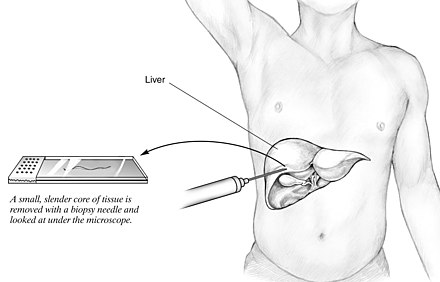 Московская, д. 96
Московская, д. 96 40 лет Победы, д. 14
40 лет Победы, д. 14 Красная, д. 103
Красная, д. 103 Димитрова, д. 146
Димитрова, д. 146