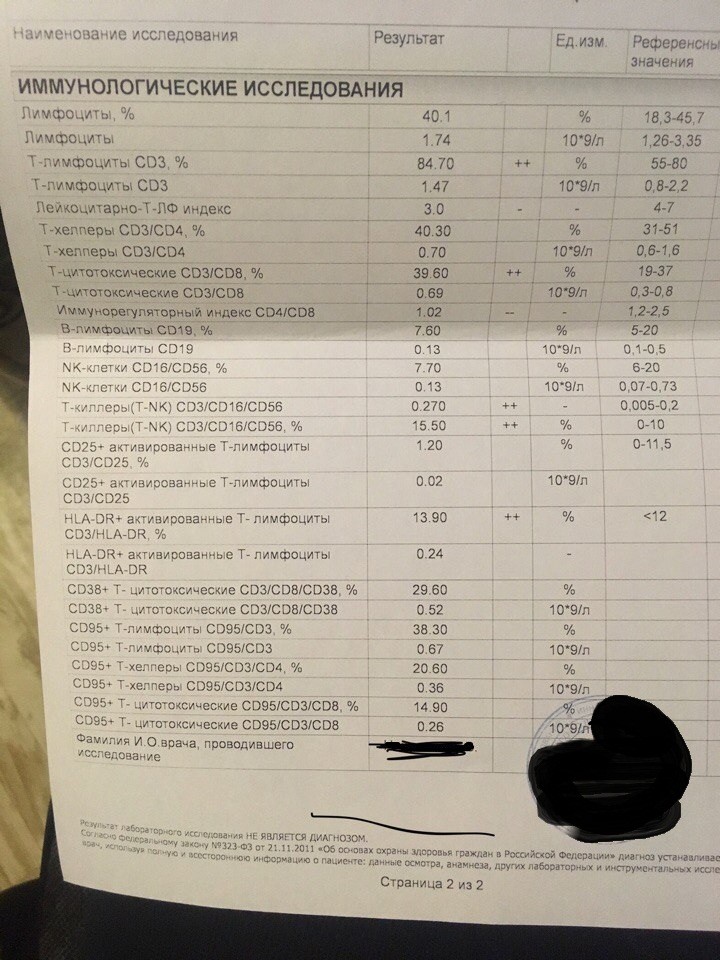
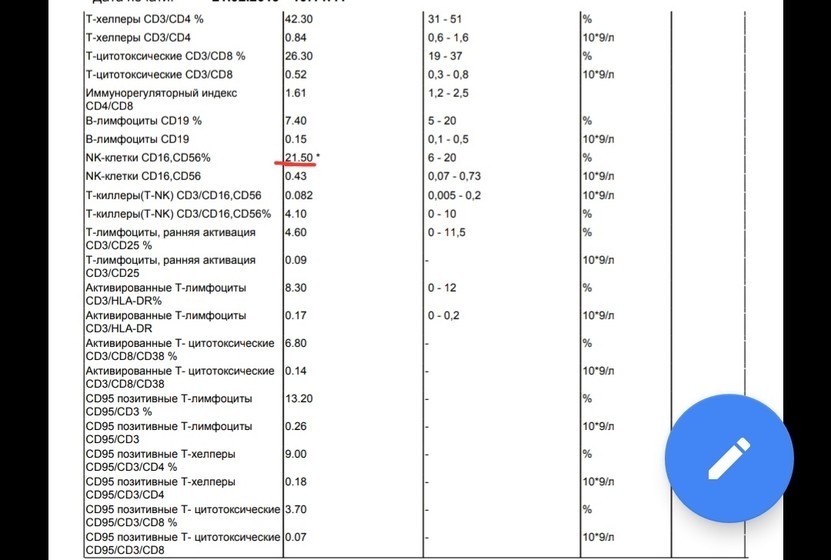
Иммунограмма, сдать анализ на иммунитет
Метод определения Субпопуляции лимфоцитов – иммунофенотипирование (проточная цитофлюориметрия, безотмывочная технология).Фагоцитарная активность — оценка фагоцитоза бактерий с флюоресцентной меткой.
Циркулирующие иммунные комплексы (ЦИК) — спектрофотометрия.
Иммуноглобулины A, M, G: иммунотурбидиметрия.
Иммуноглобулин E: хемилюминесцентный иммуноанализ.
Исследуемый материал Цельная кровь с ЭДТА, цельная кровь с гепарином, сыворотка крови
Синонимы: Скрининговая оценка состояния звеньев иммунитета; Иммунограмма; Иммунофенотипирование; Клеточный иммунитет;
Human Immune System; Immunophenotyping; Human Leukocyte Differentiation Antigens.
Краткое описание комплексного исследования «Иммунологическое обследование расширенное»
Скрининговая оценка состояния различных звеньев иммунитета, используемая в диагностике первичных и вторичных иммунодефицитов, аутоиммунных, лимфопролиферативных, инфекционных, гематологических заболеваний.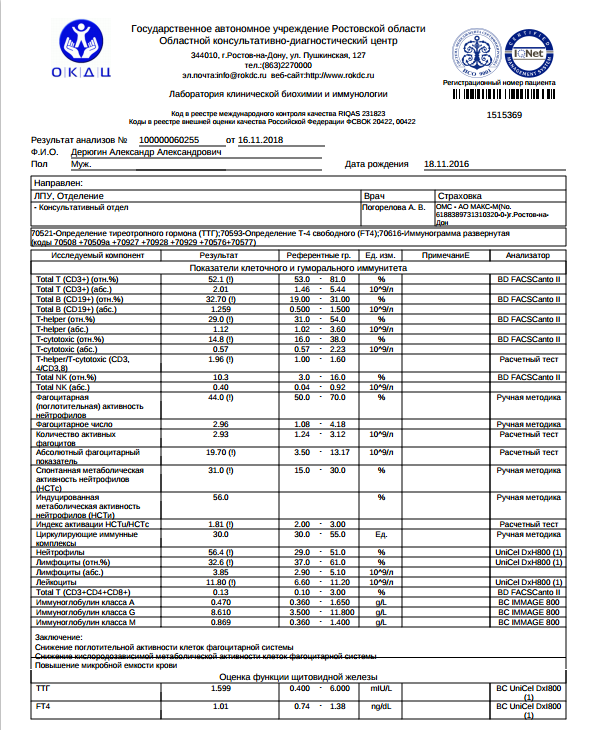
В состав профиля входят следующие показатели:
- Лимфоциты , абсолютное значение
-
Субпопуляции лимфоцитов:
• Т-лимфоциты (CD3+)
• Т-хелперы (CD3+CD4+)
• Т-цитотоксические лимфоциты (CD3+CD8+)
• Иммунорегуляторный индекс (CD3+CD4+/CD3+CD8+)
• В-лимфоциты (СD19+)
• ЕК-клетки (CD3-CD16+CD56+)
• Активированные Т-лимфоциты (CD3+HLA-DR+)
• Активированные клетки, не относящиеся к Т-лимфоцитам (В-лимфоциты и активированные ЕК) (CD3-HLA-DR+)
-
Способность к активации в ответ на ФГА:
• Т-лимфоцитов (CD3+CD69+)
• В- и ЕК-лимфоцитов (СD3-CD69+)
-
Фагоцитарная активность:
• Фагоцитоз (гранулоциты)
• Фагоцитоз (моноциты)
-
Иммуноглобулины:
• IgG
• IgA
• IgM
• IgE
Какие параметры оцениваются в исследовании «Иммунологическое обследование расширенное»
Основные субпопуляции лимфоцитов:
Т-лимфоциты – лимфоциты, созревание которых происходит в тимусе (отсюда их название). Они контролируют работу В-лимфоцитов, ответственных за образование антител, т. е. за гуморальный иммунный ответ. Т-хелперы, Th (от англ. to help – помогать) – разновидность Т-лимфоцитов, несут на своей поверхности структуры, способствующие распознаванию антигенов, презентированных вспомогательными клетками, участвуют в регуляции иммунного ответа, вырабатывая различные цитокины. Цитотоксические Т-клетки — распознают фрагменты антигена, на поверхности клеток-мишеней, ориентируют свои гранулы по направлению к мишени и высвобождают их содержимое в области контакта с ней. При этом некоторые цитокины являются сигналом гибели (по типу апоптоза) для клеток-мишеней. В-лимфоциты (от лат. «bursa» — сумка по названию сумки Фабрициуса, в которой созревают эти лимфоциты у птиц) проходят развитие в лимфоузлах и других периферических органах лимфоидной системы. На поверхности эти клетки несут иммуноглобулины, функционирующие как рецепторы к антигенам. В ответ на взаимодействие с антигеном В-лимфоциты отвечают делением и дифференциацией в плазматические клетки, вырабатывающие антитела, посредством которых обеспечивается гуморальный иммунитет.
Они контролируют работу В-лимфоцитов, ответственных за образование антител, т. е. за гуморальный иммунный ответ. Т-хелперы, Th (от англ. to help – помогать) – разновидность Т-лимфоцитов, несут на своей поверхности структуры, способствующие распознаванию антигенов, презентированных вспомогательными клетками, участвуют в регуляции иммунного ответа, вырабатывая различные цитокины. Цитотоксические Т-клетки — распознают фрагменты антигена, на поверхности клеток-мишеней, ориентируют свои гранулы по направлению к мишени и высвобождают их содержимое в области контакта с ней. При этом некоторые цитокины являются сигналом гибели (по типу апоптоза) для клеток-мишеней. В-лимфоциты (от лат. «bursa» — сумка по названию сумки Фабрициуса, в которой созревают эти лимфоциты у птиц) проходят развитие в лимфоузлах и других периферических органах лимфоидной системы. На поверхности эти клетки несут иммуноглобулины, функционирующие как рецепторы к антигенам. В ответ на взаимодействие с антигеном В-лимфоциты отвечают делением и дифференциацией в плазматические клетки, вырабатывающие антитела, посредством которых обеспечивается гуморальный иммунитет.
Активированные лимфоциты.
HLA-DR – один из антигенов MHC класса II (major histocompatibility complex — главный комплекс гистосовместимости), участвующих в презентации потенциально чужеродных антигенов, что необходимо для формирования адекватного иммунного ответа. При иммунофенотипировании может быть использован в качестве маркёра активированных клеток. CD3+HLA-DR+ — клетки, представляющие собой зрелые активированные Т-лимфоциты человека. CD3-HLA-DR+ — активированные клетки, не относящиеся к Т-лимфоцитам (В-лимфоциты и активированные ЕК).
Способность лимфоцитов к активации.
Способность лимфоцитов к активации в данном тесте оценивают по содержанию лимфоцитов, экспрессирующих CD69 в ответ на инкубацию в присутствии ФГА (митоген растительного происхождения).
Этот белок вовлечен в ранние механизмы активации Т-клеток, ЕК-клеток, В-клеток, моноцитов и тромбоцитов.
Фагоцитарная активность лейкоцитов.
Данные по фагоцитарной активности нейтрофилов и моноцитов (относительное содержание клеток, фагоцитировавших добавленные к пробе при инкубации меченые флюоресцентной меткой бактерии) позволяют оценить резервные возможности этих клеток по поглощению и перевариванию чужеродных агентов.
Циркулирующие иммунные комплексы общие (ЦИК)
Одновременное присутствие высоких концентраций антигенов и их специфических антител может вести к образованию циркулирующих иммунных комплексов. Иммунные комплексы могут выходить из кровотока в мелких сосудах и откладываться в тканях, например, в гломерулах почек, в лёгких, коже, суставах, стенке сосудов. ЦИК обладают способностью связывать и активировать комплемент, что ведёт к повреждению ткани.
ЦИК обладают способностью связывать и активировать комплемент, что ведёт к повреждению ткани.
Повышение уровня ЦИК может наблюдаться при аутоиммунных заболеваниях, хронических инфекционных заболеваниях, при которых постоянная продукция антигена инфекционным агентом сочетается с иммунным ответом на него (хронические гепатиты).
Клинически это часто проявляется гломерулонефритами, артритами, нейропатиями.
Несмотря на непосредственную роль в патогенезе некоторых заболеваний, определение ЦИК не всегда информативно, поскольку количество иммунных комплексов, отложившихся в тканях более важно, чем количество комплексов, циркулирующих в крови. Исследование ЦИК может быть недостаточно чувствительным и специфичным в диагностике болезней, вызываемых иммунными комплексами, и должно дополняться исследованием эффектов ЦИК на функцию органов (например, концентрация креатинина и анализ мочи), а также определением С3 С4 компонентов комплемента (см. тест № 193), количество которых снижается вследствие усиленного потребления.
Иммуноглобулины. См. информацию.к тестам Иммуноглобулины IgG, IgA, IgM, IgE — №№ 45, 46, 47, 67.
Оценка данных, полученных в исследовании «Иммунологическое обследование расширенное»
Данные иммунологического исследования интерпретирует врач-иммунолог в комплексе со всеми клинико-анамнестическими данными конкретного пациента. При оценке иммунного статуса пациента результаты исследования оценивают с точки зрения природы и стадии патологического процесса, сопутствующих заболеваний, приёма лекарственных препаратов и пр. При этом важны не только абсолютные значения отдельных показателей, но и их соотношение и динамика показателей. Изменения иммунологических показателей могут быть проявлением нормальной реакции организма на воздействие физиологических или патологических факторов (с различной картиной сдвигов на разных стадиях заболевания), отражать чрезмерную активацию, истощение иммунной системы, характеризовать врождённый или приобретённый дефект отдельных звеньев иммунной системы.
Иммунограмма (клеточный иммунитет) — Комплексы медицинских анализов и их цен в KDL
Алергология. ImmunoCAP. Индивидуальные аллергены, IgE
Аллергокомпоненты ImmunoCAP
Аллергокомпоненты деревьев
Аллергокомпоненты животных и птиц
Аллергокомпоненты плесени
Аллергокомпоненты трав
Пищевые аллергокомпоненты
Аллергология. ImmunoCAP. Комплексные исследования IgE (результат по каждому аллергену)
Аллергология. ImmunoCAP. Панели аллергенов IgE, скрининг (результат СУММАРНЫЙ)
Аллергология. ImmunoCAP. Фадиатоп
Аллергология. Immulite. Индивидуальные аллергены
Аллергены гельминтов, IgE
Аллергены грибов (кандида и плесневых), IgE
Аллергены деревьев, IgE
Аллергены животных и птиц, IgE
Аллергены клещей домашней пыли, IgE
Аллергены лекарств и химических веществ, IgE
Аллергены насекомых, IgE
Аллергены пыли, IgE
Аллергены ткани, IgE
Аллергены трав, IgE
Бактериальные аллегены (стафилококк), IgE
Пищевые аллергены, IgE
Пищевые аллергены, IgG
Аллергология. Immulite. Комплексы аллергенов, IgE (результат по каждому аллргену)
Immulite. Комплексы аллергенов, IgE (результат по каждому аллргену)
Аллергология. Immulite. Панели аллергенов, скрининг (результат СУММАРНЫЙ)
Аллергены деревьев, IgE (панель)
Аллергены животных и птиц, IgE (панель)
Аллергены трав, IgE (панель)
Ингаляционные аллергены, IgE (панель)
Пищевые аллергены, IgE (панель)
Аллергология. Immulite. Панели пищевых аллергенов IgG (результат СУММАРНЫЙ)
Аллергология. ImmunoCAP. Индивидуальные аллергены, IgE
Аллергены деревьев, IgE
Аллергены животных и птиц, IgE
Аллергены пыли, IgE
Аллергены трав, IgE
Пищевые аллергены, IgE
Аллергология. RIDA. Комплексы аллергенов, IgE
Аллергология. RIDA. Комплексы аллергенов, IgE (результат по каждому аллргену)
Аллергология. Местные анестетики, IgE
Биохимические исследования крови
Диагностика анемий
Липидный обмен
Обмен белков
Обмен пигментов
Обмен углеводов
Специфические белки
Ферменты
Электролиты и микроэлементы
Биохимические исследования мочи
Разовая порция мочи
Суточная порция мочи
Витамины, аминокислоты, жирные кислоты
Гематология
Гемостаз (коагулограмма)
Генетические исследования
HLA-типирование
Исследование генетических полиморфизмов методом пиросеквенирования
Исследование генетических полиморфизмов методом ПЦР
Молекулярно-генетический анализ мужского бесплодия
Гистологические исследования
Гистологические исследования лаборатории UNIM
Гормоны биологических жидкостей
Гормоны гипофиза и гипофизарно-адреналовой системы
Гормоны крови
Гормоны гипофиза и гипофизарно-адреналовой системы
Маркеры остеопороза
Пренатальная диагностика
Ренин-альдостероновая система
Тесты репродукции
Функция органов пищеварения
Функция щитовидной железы
Гормоны мочи
Диагностика методом ПЦР
COVID-19
Андрофлор, иследование биоценоза (муж)
Вирус герпеса VI типа
Вирус Варицелла-Зостер (ветряной оспы)
Вирус герпеса VI типа
Вирус простого герпеса I, II типа
Вирус Эпштейна-Барр
Вирусы группы герпеса
Возбудитель туберкулеза
ВПЧ (вирус папилломы человека)
Грибы рода кандида
Листерии
Парвовирус
Респираторные инфекции
Стрептококки (вкл. S.agalactie)
S.agalactie)
Токсоплазма
Урогенитальные инфекции, ИППП
Урогенитальные инфекции, комплексные исследования
Урогенитальные инфекции, условные патогены
Фемофлор, исследование биоценоза (жен)
Флороценоз, иследование биоценоза (жен)
Цитомегаловирус
Диагностика методом ПЦР, кал
Кишечные инфекции
Диагностика методом ПЦР, клещ
Клещевые инфекции
Диагностика методом ПЦР, кровь.
Вирус Варицелла-Зостер (ветряной оспы)
Вирус герпеса VI типа
Вирус простого герпеса I, II типа
Вирус Эпштейна-Барр
ВИЧ
Возбудитель туберкулеза
Гепатит D
Гепатит G
Гепатит А
Гепатит В
Гепатит С
Листерии
Парвовирус
Токсоплазма
Цитомегаловирус
Жидкостная цитология
Изосерология
Иммуногистохимические исследования
Иммунологические исследования
Иммунограмма (клеточный иммунитет)
Интерфероновый статус, базовое исследование
Интерфероновый статус, чувствительность к препаратам
Оценка гуморального иммунитета
Специальные иммунологические исследования
Исследование абортуса
Исследование мочевого камня
Исследование парапротеинов. Скрининг и иммунофиксация
Скрининг и иммунофиксация
Исследования слюны
Исследования слюны
Комплексные исследования
Лекарственный мониторинг
Маркеры аутоиммунных заболеваний
Антифосфолипидный синдром (АФС)
Аутоиммунные заболевания легких и сердца
Аутоиммунные неврологические заболевания
Аутоиммунные поражения ЖКТ и целиакия
Аутоиммунные поражения печени
Аутоиммунные поражения почек и васкулиты
Аутоиммунные эндокринопатии и бесплодие
Диагностика артритов
Пузырные дерматозы
Системные ревматические заболевания
Эли-тесты
Микробиологические исследования (посевы)
Посев крови на стерильность
Посев на гемофильную палочку
Посев на грибы (Candida)
Посев на грибы (возбудители микозов кожи и ногтей)
Посев на дифтерию
Посев на микоплазмы и уреаплазмы
Посев на пиогенный стрептококк
Посев на стафилококк
Посевы кала
Посевы мочи
Посевы на микрофлору (конъюнктива)
Посевы на микрофлору (отделяемое)
Посевы на микрофлору (урогенитальный тракт женщины)
Посевы на микрофлору (урогенитальный тракт мужчины)
Посевы на микрофлору ЛОР-органы)
Ускоренные посевы с расширенной антибиотикограммой
Неинвазивная диагностика болезней печени
Программы неинвазивной диагностики болезней печени
Неинвазивный пренатальный ДНК-тест (НИПТ)
Неинвазивный пренатальный тест (пол/резус плода)
Общеклинические исследования
Исследование назального секрета
Исследование секрета простаты
Исследования кала
Исследования мочи
Исследования эякулята
Микроскопическое исследование биологических жидкостей
Микроскопия на наличие патогенных грибов и паразитов
Микроскопия отделяемого урогенитального тракта
Онкогематология
Иммунофенотипирование при лимфопролиферативных заболеваниях
Миелограмма
Молекулярная диагностика миелопролиферативных заболеваний
Цитохимические исследования клеток крови и костного мозга
Онкогенетика
Онкомаркеры
Пищевая непереносимость, IgG4
Полногеномные исследования и панели наследственных заболеваний
Пренатальный скрининг
Серологические маркеры инфекций
Аденовирус
Бруцеллез
Вирус HTLV
Вирус Варицелла-Зостер (ветряной оспы)
Вирус герпеса VI типа
Вирус Коксаки
Вирус кори
Вирус краснухи
Вирус эпидемического паротита
Вирус Эпштейна-Барр
Вирусы простого герпеса I и II типа
ВИЧ
Гепатит D
Гепатит А
Гепатит В
Гепатит Е
Гепатит С
Грибковые инфекции
Дифтерия
Кишечные инфекции
Клещевые инфекции
Коклюш и паракоклюш
Коронавирус
Менингококк
Паразитарные инвазии
Парвовирус
Респираторные инфекции
Сифилис
Столбняк
Токсоплазма
Туберкулез
Урогенитальные инфекции
Хеликобактер
Цитомегаловирус
Специализированные лабораторные исследования.
Дыхательный тест
Микробиоценоз по Осипову
Тяжелые металлы и микроэлементы
Тяжелые металлы и микроэлементы в волосах
Тяжелые металлы и микроэлементы в крови
Тяжелые металлы и микроэлементы в моче
Услуги
Выезд на дом
ЭКГ
Установление родства
Химико-токсикологические исследования
Хромосомный микроматричный анализ
Цитогенетические исследования
Цитологические исследования
Чекап
Иммунограмма в Троицке | «Андреевские больницы
Иммунограмма – комплексное обследование, имеющее целью определение состояния иммунной системы человека.Метод исследования
Материалом для исследования обычно служит венозная кровь из пальца. В некоторых случаях берется спинномозговая жидкость, получаемая посредством пункции спинного мозга. Процедура не требует особой подготовки пациента.
Основными показателями, отражающимися в иммунограмме, являются:
-
количество и функциональные свойства лейкоцитов;
-
процентное соотношение разных типов лейкоцитов;
-
клеточный иммунитет, выражаемый количеством Т-лимфоцитов;
-
гуморальный иммунитет, выражаемый уровнем иммуноглобулинов классов А, М, G, Е;
-
определение параметров системы комплемента и интерферона.

Показания
Показаниями к определению иммунного статуса человека являются:
-
врожденные и приобретенные иммунодефициты;
-
выявление аутоиммунных заболеваний;
-
аллергические реакции;
-
рецидивирующие гнойные поражения кожи;
-
микотические поражения кожи;
-
онкологические заболевания;
-
ВИЧ-инфекция;
-
продолжительное лечение антидепрессантами;
-
постоперационный период трансплантации;
-
химиотерапия при онкозаболеваниях.
Показаниями для проведения иммунограммы у беременных являются:
-
аутоиммунные патологии;
-
резус-конфликт при беременности;
-
ВИЧ-инфекция;
-
герпесная инфекция;
-
рецидивирующая цитомегаловирусная инфекция.

Противопоказания
Анализ на иммунограмму не назначается при:
-
обострении инфекционных и воспалительных заболеваний;
-
во время менструации.
Результаты исследования
Расшифровку иммунограммы производит иммунолог. Значения показателей в большинстве случаев зависят от возраста, пола и общего состояния больного. В сомнительных случаях назначается повторное обследование.
ИММУНОГРАММЫ в Уфе — лаборатория МедиаЛаб
Иммунограмма — это комплексное исследование, которое показывает, в каком состоянии находится иммунная система организма человека. Данный анализ помогает увидеть полную картину того, что происходит с иммунитетом, есть ли какие-то расстройства (например, аллергия или иммунодефицит).
Чаще всего иммуногармму делают детям дошкольного и школьного возрастов, так как в этот период жизни дети наиболее подвержены различным заболеваниям.
Сдать анализы на иммунограмму в Уфе можно в сети клинико-диагностических лабораторий “МедиаЛаб”.
Когда необходим анализ?
Для проведения исследования используется венозная кровь пациента. Какой-то особой подготовки к анализу, кроме стандартных процедур при сдаче крови, не требуется.
Основными показаниями к проведению иммунограммы являются:
- Частые и тяжело протекающие инфекционные заболевания. Стоит обратить внимание, если дети болеют ОРВИ чаще, чем 5-6 раз в год, а взрослые более 3 раз в год.
- В обязательно порядке необходимо проводить иммунограмму тем, кто перенес трансплантацию органов, прошел курс химиотерапии или же на протяжении долгого времени вел прием иммунодепрессантов.
- Первичные иммунодефицитные состояние (врожденные или возникшие в следствие генетического фактора).
- Вторичные иммунодефицитные состояния (болезни иммунной системы, прием сильнодействующих препаратов).
- Подозрение на ВИЧ-инфекцию.

- Наличие каких-либо воспалительных заболеваний паталогического характера (бронхит, синусит и т.д.).
- Онкологические заболевания.
- Частые рецидивы герпеса и цитомегаловирусной инфекции.
Помимо всего прочего анализ на иммунограмму может выявить наличие каких-либо аллергических реакций или врожденные иммунные заболевания у детей. Зачастую такие исследования проводят также беременным женщинам, если они ВИЧ-инфицированы, либо, если при вынашивании ребенка возник резус-конфликт.
Сдавая анализы на иммунограмму в Уфе в сети наших лабораторий, вы можете быть уверены в оперативности и точности проводимых исследований. Мы работаем только на самом передовом оборудовании! По всем вопросам можете звонить на нашу горячую линию: 8 800 700 57 22.
Иммунограмма (иммунный статус)
Артикул: 00114
Стоимость анализа
в лаборатории:
Обычный
6 610рубстоимость указана без учета стоимости забора биологического материала
Добавить в корзинуГотовность результатов анализа
Обычные*: 6 р. д.
д.
Дата сдачи анализа:
Дата готовности:
*не считая дня сдачи.
Подготовка к анализу
Общие рекомендации по сдаче анализов
Натощак, не менее 8 часов после последнего приема пищи. Вне менструации, через 2 недели после простуды и др.заболеваний, если иначе не назначено врачом.
Забор биоматериала
Методы выполнения и тесты
Проточная цитометрия. см.описание
Файлы
Скачать образец результата анализаВ этот блок анализов входят:
Условия сдачи анализа
Анализ крови из вены натощак (не менее 8 часов). Анализ не рекомендуется сдавать во время менструации, при простудных, воспалительных заболеваниях, если иначе не назначено врачом.
Смотрите также
youtube.com/embed/bb1kWcFmhls?feature=oembed» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»>Также спрашивают:
С этим анализом сдают:
Как сдать анализы в Лабораториях ЦИР?
Для экономии времени оформите заказ на анализ в Интернет-магазине! Оплачивая заказ онлайн, Вы получаете скидку 10% на весь оформленный заказ!
У Вас есть вопросы? Напишите нам или позвоните +7 (495) 514-00-11. По анализам Вы можете задать вопрос на нашем форуме и обратиться на консультацию к специалисту.
Иммунограмма | Клиника профессора Яковлева
Для клинической оценки иммунитета необходимо исследование четырех главных компонентов иммунной системы — иммунограмма, принимающих участие в защите организма и патогенезе аутоиммунных заболеваний: гуморальный иммунитет (В-клетки), клеточно-опосредованный иммунитет (Т-клетки, моноциты), фагоцитарные клетки ретикулоэндотелиальной системы (полиморфно-ядерные клети, макрофаги) и комплимент.
В таблице – иммунограмма в обобщенной форме приведены первичные скрининговые тесты для контроля иммунной функции.
- Гуморальный иммунитет: Количественное опр6еделение уровней иммуноглобулинов IgG, IgM, IgA, IgE; Тесты специфического антителообразования; Титры изогемагглютининов.
- Клеточно-опосредованный иммунитет: Оценка общего количества лейкоцитов; оценка специфического ответа Т-клеток и макрофагов на антиген.
- Фагоцитоз: Лейкоцитоз с подсчетом дифференциальной формулы: оценка общего количества нейтрофилов; оценка метаболической функции; оценка подвижности клеток; количественное измерение внутриклеточного киллинга бактерий.
- Комплемент: Оценка активности комплемента; определение отдельных компонентов комплемента.
Лабороторное иммунологическое исследование предполагает оценку количественных и качественных показателей функционального состояния иммунной системы. Например, подсчитывается количество имеющихся в микролитре лимфоцитов – анализ крови на лимфоциты и макрофагов. Определяется их качество – то, как они работают, то есть их функциональное состояние. Что толку от того, что количество каких-то клеток, например хелперов или супрессоров, оказывается в норме, если они не работают?
Определяется их качество – то, как они работают, то есть их функциональное состояние. Что толку от того, что количество каких-то клеток, например хелперов или супрессоров, оказывается в норме, если они не работают?
В «Клинико-диагностическом обществе» КДО определяется суммарная концентрация эндотоксина всех грамотрицательных бактерий в сыворотке крови, определяются интегральные показатели гуморального звена антиэндотоксинового иммунитета, то есть количество антиэндотоксиновых антител – это авторская лечебно-диагностическая СОИС-технология.
Применяемые нами методы диагностики и лечение иммунитета основаны на трудах известного русского ученого И.Мечникова и его современных последователей, о которых подробно написано в наших книгах и разделе Наука.
Существуют различные подходы к лечению иммунитета, или коррекции состояния иммунной системы.
Способов регуляции сегодня много, но нужно помнить, что на одно и то же воздействие иммунная система каждого индивидуума реагирует по-своему. Поэтому медикаментозное воздействие должно осуществляться только врачом-иммунологом под постоянным лабораторным контролем – анализами крови (это и клинический анализ крови или общий анализ крови и биохимический анализ крови) с расшифровкой анализа крови в условиях иммуно-мониторинга.
Поэтому медикаментозное воздействие должно осуществляться только врачом-иммунологом под постоянным лабораторным контролем – анализами крови (это и клинический анализ крови или общий анализ крови и биохимический анализ крови) с расшифровкой анализа крови в условиях иммуно-мониторинга.
Бесконтрольное применение иммунных препаратов и иммуномодуляторов может привести к непредсказуемым результатам.
Хотя иммунная система относительно автономна и является саморегулирующейся, она находится под контролем нейроэндокринной системы. Нервная система через гипофиз осуществляет регуляцию эндокринных функций, следовательно, и контроль за балансом гормонов в крови и тканях человек. Клетки иммунной системы отличаются высокой чувствительностью ко многим гормонам и при изменении в крови содержания гормонов отвечают изменением поведения и функциональной активности. В связи с этим важно сдавать анализ крови на гормоны.
Было показано, что существуют нейропептиды (некие регуляторные молекулы), которые обеспечивают функционирование и взаимодействие клеток нервной системы. Оказалось, что и у лимфоидных клеток, то есть у клеток иммунной системы, есть рецепторы к этим нейропептидам, а значит, клетки иммунной системы тоже реагирует на регуляторные молекулы, синтезируемые в клетках нервной сиситемы.
Оказалось, что и у лимфоидных клеток, то есть у клеток иммунной системы, есть рецепторы к этим нейропептидам, а значит, клетки иммунной системы тоже реагирует на регуляторные молекулы, синтезируемые в клетках нервной сиситемы.
С другой стороны, на поверхности нервных клеток есть структуры, на которые воздействуют другие регуляторные молекулы – цитокины, синтезируемые лимфоидными клетками иммунной системы. Поэтому существует взаимодействие нервно-эндокринной и иммунной систем.
В регуляции функций иммунной системы принимает также участие вилочковая железа, или тимус. Клетки тимуса синтезируют пептиды, которые поступают в кровь и действуют дистанционно на клетки иммунной системы, осуществляя обратную связь нервно-эндокринной и иммунной систем.
Обратитесь к нашим специалистам – их богатый опыт и обширные знания помогут вам победить болезнь. Никакие современные компьютерные программы, биополя, газоразрядные анализаторы, биоэнергетические датчики не заменят консультацию профессионала, который ежедневно, в течение многих лет лечит людей и сможет поставить точный диагноз, основанный на ваших жалобах, истории заболевания, осмотре, аналитической расшифровке результатов анализов крови и дополнительных методах обследования.
Статьи и новости медцентра Элиса
Полезные статьи /
24 августа, 2020
Иммунитет — наш главный невидимый защитник в борьбе с болезнями. Однако мало кто представляет, как работают и формируются внутренние силы организма. С самого детствами мы слышим «хороший иммунитет» (если ребёнок мало болеет) и «плохой иммунитет» (если любой сквозняк заканчивается кашлем и соплями). А уж выражение «укрепление иммунитета» стало излюбленным рекламным ходом последних десятилетий. Как понять, нуждается ли именно ваш иммунитет в укреплении? Какой анализ расскажет о внутренних силах организма?
Иммунитет нельзя увидеть, но его можно измерить количественно и качественно. Анализ «на иммунитет» называется иммуннограммой. С его помощью врач узнает иммунный статус человека (оценка функциональной активности органов иммунной системы). Исследование назначают, чтобы понять работу защитной системы организма, диагностировать патологии или проконтролировать течение имеющихся заболеваний.
Что такое иммунитет?
Первые иммунные тельца человек получает от матери с момента рождения. Естественный иммунитет формируется до 15-17 лет и имеет 4 кризисных периода (с рождения и до 6-х месяцев, с 6 месяцев до 2-х лет, с 3 до 6 лет, с 6 до 15 лет). Попытки простимулировать защитные силы ребёнка в большинстве случаев излишни.
— Если ребенок болеет 4-5 раз в год — это нормально! — объясняет Владимир Никоноров, аллерголог-иммунолог МДЦ «ЭЛИСА». — Это поддерживает его естественный иммунитет, вырабатываются антитела к различным вирусам. Вмешиваться в данный процесс не нужно. Особенно это касается родителей, самостоятельно назначающих ребёнку медикаменты для «укрепления иммунитета», что может привести к тому, что в подрастающем организме будет меньше вырабатываться естественных гормонов, защищающих от инфекционных заболеваний. Можно добиться противоположного эффекта — иммунитет станет хуже.
Что является испытанием для иммунитета? Чаще всего это респираторные инфекции. Врачи выделяют три наиболее опасных микроба: стафилококк, стрептококк и гемофильную палочку. Различные герпетические инфекции также могут стать причиной снижения иммунитета.
Иммунограмма: что показывает анализ на иммунный статус?
Иммунограмма — это анализ общего состояния иммунитета, помогающий оценить защитные силы организма, а также диагностировать патологии или прогнозировать течение заболевания. Биоматериал для анализа — кровь.
Обычно исследование проводят для выявления иммунодефицитных, аутоиммунных инфекционных и гематологических заболеваний. Назначает иммунограмму врач-иммунолог.
Показания для исследования на иммунный статус:
- Хронические заболевания.
- Затягивающееся течение вирусных и других инфекционных заболеваний.
- Повышение температуры тела без причины.
- Подозрение на вирус иммунодефицита человека.
- Онкологические заболевания.
- Аутоиммунные патологии.
- Аллергические реакции.
- Перед серьёзными операциями.
Результат даёт представление об иммунном статусе пациента. Иммунный статус —это качественная и количественная характеристика работы органов иммунной системы. Одним из главных показателей является наличие в крови особого типа белков — иммуноглобулинов. Они противодействуют токсинам, микроорганизмам и препятствуют развитию воспалительных процессов. Что касается детей, то для них этот анализ позволяет прогнозировать, что будет со здоровьем ребёнком в ближайшие несколько месяцев (на срок до одного года).
Как подготовиться к анализу крови на иммунный статус?
Чтобы получить точный отчёт о состоянии защитных функций организма, необходимо тщательно подготовиться к анализу:
- Исключите алкоголь за 24 часа до исследования.
- Анализ берётся натощак (обязательное голодание за 8-14 часов до похода в лабораторию).
- Не курить минимум за 3 часа до исследования.
- Исключить физические нагрузки накануне сдачи анализа.
- Если вы принимаете лекарственные препараты, не забудьте сказать об этом лечащему врачу.
Как проходит анализ? Показатели иммунограммы
Забор крови проходит исключительно в клинических условиях. Чаще всего делается обзорная иммунограмма, при обнаружении серьёзных неполадок в работе иммунной системы — расширенная. Расширенная иммунограмма проводится в два этапа. Сначала узнают о «слабых» местах иммунитета и отклонениях от показателей номы, затем подробно разбирают каждый показатель. Исследуется число лейкоцитов, лимфоцитов, тромбоцитов — эти клетки первыми наносят удар попадающим в организм вирусам и инфекциям. Также исследуется активность нейтрофилов и других специфических клеток защитной систем организма, их способность уничтожать и переваривать клетки-возбудители заболеваний.
В среднем на проведение подробного исследования и расшифровку данных уходит от 5 до 14 дней. Что касается нормы показателей иммунограммы, то у детей и у взрослых данные отличаются. Также влияет пол, наличие заболеваний, принимаемые медикаменты и т.д. Важный момент в том, что каждая лаборатория ориентируется на свои нормы, поэтому рекомендуется сдавать анализы и контролировать здоровье в одной лаборатории. Расшифровкой иммунограммы должны заниматься только компетентные и квалифицированные специалисты. Помните, что результат иммунограммы —это не диагноз, а информация о состоянии вашего иммунитета, которая помогает врачу принять решение о тактике лечения.
Иммунограмма — анализы МДЦ ЭЛИСА
Запись к врачу Сочи для определения необходимости в иммунограмме
границ | Иммунограмма для индивидуальной оценки противоопухолевого иммунного ответа у пациентов с гепатоцеллюлярной карциномой
Введение
Обширное клиническое исследование показало, что иммунотерапия рака является ключевым компонентом клинического лечения рака (1–3). Всестороннее понимание взаимодействия рака и иммунной системы имеет решающее значение для разработки новых лекарств и клинических стратегий. Дэниел С. Чен и Ира Меллман предложили цикл «рак-иммунитет», чтобы проиллюстрировать этапы противоопухолевого иммунного ответа, включая высвобождение антигенов раковых клеток, презентацию раковых антигенов, прайминг и активацию, перенос Т-клеток в опухоли, инфильтрацию Т-лимфоцитов. клетки в опухоли, распознавание раковых клеток Т-клетками и уничтожение раковых клеток, а также для лучшего понимания взаимодействия между раком и иммунной системой (4).С точки зрения циклов «рак-иммунитет» иммунотерапия рака в основном включает два класса, как описано ниже. Один класс иммунотерапии разработан для улучшения стимулирующих иммунных факторов, таких как адоптивная Т-клеточная терапия, которая может привести к революции цикла противоракового иммунитета и потенциально усиливает возможное самораспространение цикла (4). Другой класс иммунотерапии предназначен для предотвращения подавления иммунного эффектора, такого как блокада PD-1 / PD-L1, которая оживляет и потенциально расширяет ранее существовавший противоопухолевый иммунный ответ (4, 5).
Как описано выше, различные иммунотерапевтические методы предназначены для регулирования различных измерений цикла «рак-иммунитет». Таким образом, оценка цикла рака-иммунитета у отдельных пациентов является основой для реализации клинических стратегий, адаптированных к каждому пациенту. Основываясь на теории цикла «рак-иммунитет», Джун Накадзима построил иммунограмму, которая наглядно иллюстрирует цикл «рак-иммунитет» у отдельных пациентов с раком легких (6). В иммунограмме цикла «рак-иммунитет» были объединены все данные обследований и секвенирования РНК с последующим облачным преобразованием сложных омических данных на радиолокационном графике для отображения иммунного ответа каждого пациента.Этапы цикла рака-иммунитета оценивались с использованием восьми осей шкалы иммунограммы (IGS), которые включали Т-клеточный иммунитет (IGS1), антигенность опухоли (IGS2), праймирование и активацию (IGS3), трафик и инфильтрацию (IGS4), распознавание опухолевых клеток (IGS5), клеток-ингибиторов (IGS6), экспрессии контрольных точек (IGS7) и ингибирующих молекул (IGS8). Иммунограмма поможет врачам в принятии индивидуальных медицинских решений для каждого пациента.
Печень — иммунологический орган, содержащий множество клеток адаптивного и врожденного иммунитета (7).Печень также является особым анатомическим органом, в котором богатая антигенами кровь сканируется антигенпрезентирующими клетками и лимфоцитами через сеть синусоидов (8). Кроме того, большая гепатоцеллюлярная карцинома (ГЦК) встречается у пациентов с хроническим воспалением печени, связанным с вирусными инфекциями гепатита В или С, злоупотреблением алкоголем и ожирением печени (9). Следовательно, иммунная микросреда играет жизненно важную роль в развитии ГЦК. Предыдущие исследования проиллюстрировали иммунный ландшафт рака печени на основе данных об отдельных клетках, данных секвенирования РНК и данных о последовательности рецепторов Т-клеток (10).
В клинической практике цикл рака-иммунитета у отдельных пациентов с ГЦК должен быть описан для поддержки клинического лечения рака. Однако в этой области опубликовано мало исследований. В настоящем исследовании изучались иммунограммы пациентов с ГЦК, основанные на данных РНК-Seq в печени, чтобы наглядно отобразить личный цикл рака-иммунитета. Кроме того, мы исследовали иммунограмму ГЦК и клинические исходы, а также корреляцию между иммунограммой ГЦК и молекулярными особенностями, чтобы лучше понять индивидуальный противораковый иммунный ответ в печени и поддержать принятие личного клинического решения.
Материалы и методы
Когорта HCC, сбор и предварительная обработка данных
Дизайн исследования и процесс отбора данных показаны на рисунке 1. Мы провели поиск когорт ГЦК с помощью секвенирования всего экзома (WES), секвенирования РНК и клинических данных из Атласа генома рака (TCGA) и Международного консорциума генома рака. (МКГК). Когорты LIHC-TCGA и LIRI-JP HCC были включены в это исследование.
Рисунок 1 . Блок-схема процесса сбора и анализа данных.Показаны дизайн исследования и процесс отбора данных. В это исследование были включены две независимые когорты HCC (TCGA и LIRI-JP HCC) с данными WES, данными секвенирования РНК и клиническими данными из TCGA и ICGC.
LIHC-TCGA был выбран для изучения взаимосвязи иммунограммы HCC и клинических исходов, а LIRI-JP HCC был выбран в качестве независимой когорты для подтверждения прогностической ценности иммунограммы HCC. Данные когорт LIHC-TCGA и LIRI-JP HCC были загружены из браузера UCSC Xena.Значения данных секвенирования РНК (FPKM) были преобразованы в значения транскриптов на миллион килобаз (TPM). Клиническая информация для когорты ГЦК представлена в таблице 1.
Таблица 1 . Кластер иммунограммы ГЦК и клинические особенности.
Иммунограмма ГЦК
Согласно предыдущему исследованию, этапы цикла «рак-иммунитет» описываются восемью осями оценки иммунограммы (IGS) следующим образом: IGS1, Т-клеточный иммунитет; IGS2 — антигенность опухоли; IGS3, прайминг и активация; IGS4, незаконный оборот и проникновение; IGS5, распознавание опухолевых клеток; IGS6, клетки-ингибиторы; GS7, выражение контрольной точки; и IGS8, ингибирующие молекулы (6).Наборы генов IGS1, IGS3, IGS4, IGS5, IGS6, IGS7 и IGS8 использовались в предыдущем исследовании (6). Анализ вариации набора генов (GSVA) был проведен для оценки значения IGS с использованием пакетов GSVA R. Значение неоантигенности опухоли было загружено из опубликованных данных TCGA (https://gdc.cancer.gov/about-data/publications/panimmune) (11). Неконтролируемая кластеризация IGS была выполнена с использованием кластеризации K-средних с пакетом R (версия 3.6.1), как описано в предыдущих исследованиях (12, 13). Кластеризация K-средних — один из наиболее часто используемых алгоритмов неконтролируемого машинного обучения (13).Иммунограммы ГЦК были разделены на два кластера. Два кластера иммунограмм на радиолокационных графиках показаны как медиана IGS.
Сигнатура иммунного гена
Наборы генов цитолитической активности (гранзим-A и перфорин-1), сигнатуры IFN-γ, иммуностимуляторы, иммуноингибиторы, хемокины, сигнатура HLA I и сигнатура HLA II были описаны в предыдущем исследовании (14, 15). Иммунные сигнатуры измеряли как среднее геометрическое значение экспрессии гена в log2 от TPM + 1.
Молекулярные особенности
Бремя неоантигена опухоли, бремя мутаций опухоли, оценка бремени CNV и оценка LOH были получены из опубликованных данных TCGA (9). Соматические изменения в 10 онкогенных сигнальных путях анализировали, как описано ранее (16). Мы сгруппировали гены в известные 10 канонических путей, которые включают клеточный цикл, Hippo, Myc, Notch, Nrf2, киназу PI3 / Akt, RTK-RAS, передачу сигналов TGFβ, p53 и β-катенин / WNT, как описано ранее. Образец, в котором гены определенных путей содержали соматические мутации, был обозначен как измененный конкретный путь.Образец, в котором все гены определенных путей были дикого типа, был обозначен как неизмененный специфический путь. Разница в частоте изменения пути рака между двумя кластерами иммунограммы ГЦК оценивалась с использованием точного теста Фишера (двусторонний).
Статистический анализ
Данные представлены в виде средних значений и стандартных ошибок средних значений (SEM). Групповые значения оценивали с помощью теста нормального распределения. Для нормально распределенных данных средние значения групп сравнивались с использованием теста Стьюдента t , а непараметрические тесты выполнялись, когда данные не были нормально распределены. P <0,05 было определено как статистически значимое. Двусторонний точный тест Фишера использовался для сравнения частот изменений между пациентами с ГЦК, показывающими холодную и горячую иммунограммы ГЦК. Тест лог-ранга был проведен для исследования связи между паттернами иммунограммы HCC и DFS и OS. Статистический анализ проводился с использованием статистического программного обеспечения SPSS версии 22.0 и R версии 3.6.1.
Результаты
Иммунограмма и прогноз рака HCC
Мы использовали иммунограмму рака, которая наглядно иллюстрирует состояние цикла «рак-иммунитет», чтобы оценить противоопухолевый ответ у пациентов с ГЦК.Мы исследовали иммунограмму HCC когорты TCGA. Ссылаясь на предыдущее исследование, этапы цикла «рак-иммунитет» характеризуются следующими восемью осями IGS: IGS1, Т-клеточный иммунитет; IGS2 — неоантигенная нагрузка опухоли; IGS3, прайминг и активация; IGS4, незаконный оборот и проникновение; IGS5, распознавание опухолевых клеток; IGS6, клетки-ингибиторы; IGS7, выражение контрольной точки; и IGS8, молекулы-ингибиторы. Как показано на рисунке 1, мы собрали клинические данные из когорты TCGA HCC, WES и данных секвенирования РНК.Пейзаж иммунограммы рака TCGA HCC и восемь осей IGS показаны на рисунке 2A. Был проведен неконтролируемый кластерный анализ IGS, и иммунограммы HCC были разделены на два кластера. Семь осей IGS одного кластера были значительно выше, чем другого кластера. Неоантигенная нагрузка опухоли (IGS2) существенно не меняется между двумя кластерами (рис. 2А и дополнительный рис. 1). Неоантигенная нагрузка опухоли (IGS2) не была связана с другими осями иммунограммы, включая Т-клеточный иммунитет (IGS1), праймирование и активацию (IGS3), трафик и инфильтрацию (IGS4), распознавание опухолевых клеток (IGS5), клетки-ингибиторы ( IGS6), экспрессия контрольной точки (IGS6) и молекулы ингибитора (IGS8) (дополнительный рисунок 2).
Рисунок 2 . Иммунограмма рака HCC и прогноз. (A) Неконтролируемый кластерный анализ иммунограмм HCC на основе восьми осей IGS для 337 пациентов в когорте TCGA HCC. Более высокий кластер IGS был назван иммунограммой горячего HCC, а более низкий кластер IGS был назван иммунограммой холодного HCC. Клинические особенности, включая возраст, пол, стадию, фиброз, этиологию, гистологический тип и сосудистую инвазию, показаны в аннотациях пациентов. (B) Кривые Каплана-Мейера для DFS пациентов с ГЦК в когорте TCGA, разделенные на два кластера иммунограмм ГЦК.Количество пациентов в кластерах горячей и холодной иммунограмм составляло 129 и 164 соответственно. Лог-ранговый тест показал P = 0,00066. (C) Кривые Каплана-Мейера для OS пациентов с HCC в когорте TCGA, стратифицированной на два кластера иммунограмм HCC. Число пациентов в кластерах горячей и холодной иммунограмм составило 144 и 192 соответственно. Логранговый тест дал P = 0,0057. (D) Кривые Каплана – Мейера для OS пациентов с ГЦК в когортах LIRI-JP HCC, разделенных на два кластера иммунограмм ГЦК.Количество пациентов в кластерах горячей и холодной иммунограмм составило 121 и 108 соответственно. Логранговый тест дал P = 0,017. (E, F) Радиолокационный график показал, что образцы иммунограмм двух кластеров были разными. Оси радиолокационной диаграммы были построены с помощью медианы IGS для кластеров горячей и холодной иммунограмм, соответственно.
Кластер с более высокими показателями иммунограммы был назван «горячей иммунограммой», а кластер с более низкими показателями иммунограммы был назван «холодовой иммунограммой».Более того, два кластера иммунограммы пациентов с ГЦК показали значительные различия в DFS и OS (лог-ранговый тест, P <0,01). Благоприятные OS и DFS наблюдались у пациентов с HCC и горячими иммунограммами (Рисунки 2B, C). Радиолокационный график показал, что образцы иммунограмм двух кластеров были разными (Рисунки 2E, F). Кроме того, была исследована взаимосвязь между клиническими особенностями и паттернами иммунограммы ГЦК (Таблица 1). Паттерны иммунограммы не были связаны с клиническими особенностями, включая возраст, пол, этиологию, сосудистую инвазию, фиброз, стадию, степень классификации по Чайлд-Пью, гистологический тип и гистологическую степень новообразования (таблица 1).
Когорта LIRI-JP HCC была зачислена для проверки паттернов иммунограммы и прогноза HCC, а также для проверки прогностической ценности иммунограмм HCC. Были собраны клинические данные, данные WES и данные секвенирования РНК. Были оценены иммунограммы ГЦК пациентов с ГЦК в когорте LIRI-JP, и был проведен неконтролируемый кластерный анализ IGS с использованием методов, упомянутых выше. Результаты для когорты LIRI-JP были аналогичны когорте TCGA. Иммунограммы ГЦК были разделены на два кластера, названных «горячая иммунограмма» и «холодная иммунограмма» согласно IGS.ОС пациентов с ГЦК, представленных на горячей иммунограмме, была дольше, чем у пациентов с холодовой иммунограммой (лог-ранговый тест, P <0,01, рис. 2D).
Иммунные характеристики горячих и холодных иммунограмм ГЦК
Относительное количество 28 субпопуляций иммунных клеток, которые инфильтрируют опухоль, оценивали с использованием метода анализа обогащения набора генов для одного образца (ssGSEA) с данными опухолевой РНК-Seq. Инфильтрацию иммунных клеток исследовали в двух кластерах иммунограммы ГЦК.Как показано на рисунке 3, у пациентов с горячими иммунограммами в опухоли проникло большее количество из 28 субпопуляций врожденных и адаптивных иммунных клеток, чем у пациентов с холодными иммунограммами. Кроме того, мы наблюдали более высокие уровни иммунных сигнатур, включая цитолитическую активность, сигнатуру IFN-γ, иммуностимулятор, иммуноингибитор, хемокин, молекулу адгезии, MHC I, MHC II и неклассовые MHC, в горячих иммунограммах ГЦК ( P <0,05 , Рисунок 4).
Рисунок 3 . Тепловая карта подмножеств иммунных клеток, которые проникли в опухоли пациентов в группах с горячей и холодной иммунограммой ГЦК.Относительное количество 28 подмножеств иммунных клеток, которые инфильтрировали опухоль, оценивали с помощью метода обогащения набора генов на уровне образца (GSVA) на основе данных RNA-Seq опухоли. Клинические особенности, включая возраст, пол, стадию, фиброз, этиологию, гистологический тип и сосудистую инвазию, показаны в аннотациях пациентов.
Рисунок 4 . Сила иммунной сигнатуры групп горячей и холодной иммунограммы ГЦК. (A – H) Диаграммы разброса показали более высокие уровни иммунных сигнатур, включая цитолитическую активность, цитолитическую активность, сигнатуру IFN-γ, хемокин, иммуноингибитор, молекулу адгезии, MHC I, MHC II и неклассовые MHC, в горячих условиях. Иммунограммы ГЦК, чем иммунограммы холодного ГЦК.Групповые значения оценивали с помощью теста нормального распределения. Для нормально распределенных данных средние значения групп сравнивались с использованием теста Стьюдента t , а непараметрические тесты выполнялись, когда данные не были нормально распределены (* P <0,05, ** P <0,01 и нс: не значимо, P > 0,05).
Молекулярные особенности иммунограмм горячей и холодной ГЦК
Были исследованы мутации гена-драйвера и изменения сигнального пути между двумя кластерами иммунограммы рака HCC.Путь WNT был изменен, и частота мутаций гена CTNNB1 была выше в кластере холодной иммунограммы HCC, чем в кластере горячей иммунограммы HCC (двусторонний точный тест Фишера, P <0,05; Рисунок 5 и Таблица 2). Другие сигнальные пути, включая клеточный цикл, пути PI3K, P53, Notch, Myc, Hippo, Nrf2 и TGFβ, не претерпели значительных изменений между двумя кластерами иммунограммы HCC (двусторонний точный тест Фишера, P > 0,05; Рисунок 5 и Таблица 2). Более того, более высокие баллы бремени CNV и баллы LOH наблюдались в кластере иммунограммы холодного ГЦК, чем в кластере иммунограммы горячего ГЦК ( P <0.05, рисунок 6). Другие генетические варианты, включая несинонимичные мутации, иммуногенные мутации, числа indel и иммуногенные числа indel, существенно не изменились ( P > 0,05, фиг. 6).
Рисунок 5 . Изменения в путях, связанных с раком, выявленные на иммунограммах горячего и холодного ГЦК. Тепловая карта изменений в путях, связанных с раком, на иммунограммах горячего и холодного ГЦК. Различие в частоте изменений в путях, связанных с раком, между двумя кластерами иммунограммы ГЦК оценивали с помощью точного теста Фишера (двусторонний) (* P <0.05, ** P <0,01 и нс: не значимо, P > 0,05).
Таблица 2 . Кластер иммунограммы ГЦК и частота изменений в путях, связанных с раком.
Рисунок 6 . Молекулярные особенности иммунограмм горячего и холодного ГЦК. (A – F) Диаграммы разброса показывают уровни молекулярных признаков, включая баллы бремени CNV, баллы LOH, несинонимичные мутации, иммуногенные мутации, индель-числа и иммуногенные индели-числа в кластерах горячей и холодной иммунограммы ГЦК, соответственно.Групповые значения оценивали с помощью теста нормального распределения. Для нормально распределенных данных средние значения двух кластеров сравнивались с использованием теста Стьюдента t , а непараметрические тесты выполнялись, когда данные не были нормально распределены (* P <0,05, ** P <0,01 и нс: не значимо, P > 0,05).
Иммунограммы молекулярных особенностей
Основные различия в молекулярных характеристиках между горячей и холодной иммунограммами отражались в изменениях WNT-CTNNB1 и показателях CNV и LOH.Мы дополнительно исследовали паттерны иммунограмм опухолей с различными молекулярными особенностями. Как показано на Фигуре 7, образцы иммунограммы отличались для различных молекулярных особенностей опухолей ГЦК. Радарный график выявил более высокий IGS для Т-клеточного иммунитета, клеток-ингибиторов и экспрессии контрольных точек в опухолях без изменений Wnt-CTNNB1, чем в опухолях, в которых был изменен Wnt-CTNNB1 ( P <0,05, фигура 7A). Опухоли с высокой нагрузкой CNV характеризовались более низким IGS для Т-клеточного иммунитета, праймирования и активации, трафика и инфильтрации, распознавания опухолевых клеток, клеток-ингибиторов, экспрессии контрольных точек и молекул-ингибиторов ( P <0.05, рисунок 7B). По сравнению с опухолями с низкой нагрузкой LOH, опухоли с высокой нагрузкой LOH показали более низкий IGS для Т-клеточного иммунитета, прайминга и активации, трафика и инфильтрации, а также распознавания опухолевых клеток и молекул ингибиторов ( P <0,05, рис. 7C).
Рисунок 7 . Паттерны иммунограммы молекулярных особенностей. (A – C) Радиолокационные диаграммы, показывающие модели иммунограмм в опухолях с изменениями Wnt-CTNNB1 и без них (A) , опухолях с высокой и низкой нагрузкой CNV (B) и опухолях с высокими и низкими показателями LOH (С) .Медианные IGS показаны на радиолокационных диаграммах. Данные сравнивали с непараметрическими тестами (* P <0,05).
Обсуждение
В этом исследовании была построена иммунограмма ГЦК цикла «рак-иммунитет» для визуального изучения противоопухолевых иммунных ответов пациентов с ГЦК. Паттерн иммунограммы HCC был разделен на два кластера, которые были названы горячей иммунограммой и холодной иммунограммой HCC. Благоприятные OS и DFS наблюдались у пациентов с HCC и горячими иммунограммами.Более того, основное различие в молекулярных характеристиках между горячей и холодной иммунограммами отражалось в изменениях WNT-CTNNB1 и показателях CNV и LOH. Между тем, паттерны иммунограммы отличались для различных молекулярных особенностей опухолей ГЦК.
Согласно новым данным, противораковый иммунный ответ играет жизненно важную роль в лечении рака (17–19). В предыдущих исследованиях сообщалось об иммуноядре, основанном на оценке количества Т-лимфоцитов CD3 + и Т-лимфоцитов CD8 + , которые проникли в опухоли толстой кишки (20).Недавнее исследование описало три иммунофенотипа на основе Т-клеток CD8 + , которые включали воспаленные (CD8 + Т-клетки инфильтрированы опухоли, но были подавлены), иммунные исключенные (CD8 + Т-клетки накапливались, но не эффективно инфильтрировали опухоли. ) и иммунной пустыни (в опухоли отсутствовали Т-клетки CD8 + ) (21). Иммунофенотипы, основанные на Т-клетках CD8 + , помогают понять микросреду опухоли. Более того, данные омики по опухолям предоставляют дополнительную информацию о взаимодействии онкологии и иммунитета.Однако в клинической практике клиницисты должны объединить данные с множеством измерений в комплексную визуализацию, чтобы оценить противоопухолевый иммунный ответ и принять соответствующие клинические решения для каждого пациента. При использовании иммунограммы были описаны этапы противоопухолевого иммунного ответа отдельных пациентов. В настоящем исследовании разные модели иммунограмм ГЦК были связаны с разными клиническими исходами. Значительное улучшение прогноза наблюдалось у пациентов с ГЦК, у которых были получены горячие иммунограммы.Результаты были подтверждены в двух независимых когортах ГЦК, включая когорты ГЦК TCGA и LIRI-JP. Противоопухолевый ответ, вероятно, был активирован у этих пациентов, что отражало более высокий IGS для Т-клеточного иммунитета, прайминга и активации, трафика и инфильтрации, а также распознавания опухолевых клеток. Кроме того, большее количество инфильтрированных противоопухолевых иммунных эффекторных клеток (активированные CD8 + Т-клетки и NK-клетки) и более сильная противоопухолевая иммунная эффекторная сигнатура (цитолитическая активность и IFN-γ) были связаны с горячими иммунограммами.Интересно, что уровни иммунорегуляторных факторов, включая клетки-ингибиторы, экспрессию контрольных точек и молекулы ингибитора, увеличиваются у пациентов с горячими иммунограммами. Мы предположили, что иммунорегуляторные факторы оказывают отрицательную обратную связь на активацию противоопухолевого иммунного ответа. Более высокая экспрессия контрольных точек, связанная с богатым Т-клетками иммунитетом и сильной иммунной эффекторной сигнатурой (цитолитическая активность и IFN-γ), может быть связана с каскадом активации-истощения в резидентных в опухоли Т-клетках (22).
Первым этапом противоопухолевого иммунного цикла является высвобождение опухолевых антигенов и их захват дендритными клетками. Затем дендритные клетки представляют захваченные антигены Т-клеткам через молекулы MHCI и MHCII, вызывая праймирование и активацию эффекторного ответа Т-клеток против специфичных для рака антигенов. Однако бремя опухолевых неоантигенов и бремя опухолевых мутаций у пациентов с ГЦК не были связаны с Т-клеточным иммунитетом, праймингом и активацией, переносом и инфильтрацией, распознаванием опухолевых клеток и сигнатурами противоопухолевых иммунных эффекторов (цитолитической активностью и IFN-γ).Наши результаты были аналогичны результатам, полученным для пациентов с раком легких (23). Основываясь на этих выводах, прогрессирование от высвобождения неоантигена рака до противоопухолевого ответа Т-клеток включает несколько этапов и сложных механизмов. Как единственный индикатор, неоантигены опухоли не могут предсказать противоопухолевый иммунный ответ.
Понимание взаимодействия между иммунной средой опухоли и молекулярными вариациями жизненно важно для оптимизации стратегии иммунотерапии. В настоящем исследовании мы исследовали изменения в 10 связанных с раком путях и молекулярных особенностях между двумя паттернами иммунограмм ГЦК.Мы наблюдали более высокую частоту изменений в пути WNT-CTNNB1 в кластерах паттернов иммунограммы холодного ГЦК. Паттерны иммунограммы были различны в опухолях с изменениями WNT-CTNNB1 и без них. Радарный график показал более высокий IGS для Т-клеточного иммунитета, клеток-ингибиторов и экспрессии контрольных точек в опухолях без изменений Wnt-CTNNB1, чем в опухолях с изменениями Wnt-CTNNB1. Клиническое исследование показало, что пациенты с HCC, несущие мутации WNT / CTNNB1, были устойчивы к блокаде иммунных контрольных точек (24).Наши результаты могут объяснить этот механизм иммунной резистентности с точки зрения иммунограммы ГЦК. Более того, наш молекулярный анализ выявил более высокие баллы бремени CNV и баллы LOH в кластере холодовой иммунограммы HCC. Паттерны иммунограммы опухолей с высокими показателями CNV и LOH характеризовались более низким IGS для Т-клеточного иммунитета, праймирования и активации, переноса и инфильтрации и распознавания опухолевых клеток. Более высокая нагрузка CNV и LOH в опухолях коррелировала с ускользанием от иммунной системы и более слабым ответом на иммунотерапию в предыдущих исследованиях (25, 26).
Это исследование имеет несколько ограничений. Дальнейшее исследование должно быть разработано для изучения клинической ценности иммунограмм ГЦК при выборе пациентов для индивидуальной иммунотерапии. С теоретической точки зрения индивидуальные стратегии лечения должны разрабатываться на основе модели иммунограммы для оценки иммунного ответа каждого пациента.
Таким образом, всестороннее понимание и оценка противоопухолевого иммунного ответа имеет решающее значение для принятия медицинских решений при лечении рака.В настоящем исследовании использовались иммунограммы для визуальной оценки противоопухолевого иммунного ответа у отдельных пациентов с ГЦК. Кроме того, мы проиллюстрировали корреляцию между иммунограммами ГЦК и молекулярными особенностями опухоли. Это исследование может предоставить ценные ресурсы для персонализированной иммунотерапии ГЦК.
Заявление о доступности данных
В данном исследовании были проанализированы общедоступные наборы данных. Эти данные можно найти здесь: https://portal.gdc.cancer.gov/.
Авторские взносы
YH, HZ и XW разработали исследование.YH и HS выполнили сбор и анализ данных. YH объяснил результаты и написал рукопись. Все авторы рецензировали рукопись.
Финансирование
Это исследование было поддержано Национальным ключевым научно-техническим специальным проектом Китая (№ 2018ZX10302207) и Национальным фондом естественных наук Китая (№ 81774234).
Конфликт интересов
HS был нанят компанией Genecast Biotechnology Co., Ltd.
Остальные авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fonc.2020.01189/full#supplementary-material
Дополнительный рисунок 1. Коробчатая диаграмма показывает IGS кластеров горячей и холодной иммунограммы HCC. Групповые значения оценивали с помощью теста нормального распределения. Для нормально распределенных данных средние значения двух кластеров сравнивались с использованием теста Стьюдента t , а непараметрические тесты выполнялись, когда данные не были нормально распределены ( * P <0.05, ** P <0,01 и нс: не значимо, P > 0,05).
Дополнительный рисунок 2. Корреляция восьми осей IGS в иммунограмме HCC.
Сокращения
HCC, гепатоцеллюлярная карцинома; DFS — безрецидивная выживаемость; ОС — общая выживаемость; CNV, вариант номера копии; LOH, потеря гетерозиготности; TMB — бремя опухолевых мутаций; TCGA, Атлас генома рака.
Список литературы
1. Тан Дж., Ю. Дж. Х, Хаббард-Люси В. М., Нефтелинов С. Т., Ходж Дж. П., Лин Ю.Наблюдение за испытаниями: ландшафт клинических испытаний ингибиторов иммунных контрольных точек PD1 / PDL1. Nat Rev Drug Discov. (2018) 17: 854–5. DOI: 10.1038 / nrd.2018.210
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Ле Д. Т., Дарем Дж. Н., Смит К. Н., Ван Х., Бартлетт Б. Р., Аулах Л. К. и др. Дефицит репарации несоответствия предсказывает ответ солидных опухолей на блокаду PD-1. Наука. (2017) 357: 409–13. DOI: 10.1126 / science.aan6733
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3.Finn RS, Qin S, Ikeda M, Galle PR, Ducreux M, Kim TY и др. Атезолизумаб плюс бевацизумаб при неоперабельной гепатоцеллюлярной карциноме. N Engl J Med. (2020) 382: 1894–905. DOI: 10.1056 / NEJMoa1915745
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Карасаки Т., Нагаяма К., Кувано Х., Нитадори Дж. И., Сато М., Анраку М. и др. Иммунограмма цикла «рак-иммунитет»: к персонализированной иммунотерапии рака легких. J Thorac Oncol. (2017) 12: 791–803.DOI: 10.1016 / j.jtho.2017.01.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Zheng C, Zheng L, Yoo JK, Guo H, Zhang Y, Guo X и др. Пейзаж инфильтрации Т-клеток при раке печени выявлен с помощью секвенирования отдельных клеток. Cell. (2017) 169: 1342–56.e16. DOI: 10.1016 / j.cell.2017.05.035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Цзэн Д., Ли М., Чжоу Р., Чжан Дж., Сунь Х., Ши М. и др. Характеристика микросреды опухоли при раке желудка позволяет идентифицировать прогностические и иммунотерапевтически важные сигнатуры генов. Cancer Immunol Res. (2019) 7: 737–50. DOI: 10.1158 / 2326-6066.CIR-18-0436
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Хартиган Дж, Вонг Массачусетс. Алгоритм AS 136: алгоритм кластеризации K-средних. Appl Statist R Statist Soc. (1979) 28: 100–8. DOI: 10.2307 / 2346830
CrossRef Полный текст | Google Scholar
14. Эйерс М., Лансфорд Дж., Небожин М., Мерфи Э., Лобода А., Кауфман Д. Р. и др. Профиль мРНК, связанный с IFN-гамма, позволяет прогнозировать клинический ответ на блокаду PD-1. J Clin Invest. (2017) 127: 2930–40. DOI: 10.1172 / JCI
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Чароентонг П., Финотелло Ф, Ангелова М., Майер С., Ефремова М., Ридер Д. и др. Иммуногеномный анализ рака выявляет взаимосвязь между генотипом и иммунофенотипом и предикторы реакции на блокаду контрольных точек. Cell Rep. (2017) 18: 248–62. DOI: 10.1016 / j.celrep.2016.12.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16.Санчес-Вега Ф., Мина М, Армения Дж., Шатила В.К., Луна А, Ла Кей Си и др. Онкогенные сигнальные пути в атласе генома рака. Cell. (2018) 173: 321–37.e10. DOI: 10.1016 / j.cell.2018.03.035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Галлуцци Л., Чан Т.А., Кремер Г., Волчок Дж. Д., Лопес-Сото А. Признаки успешной противоопухолевой иммунотерапии. Sci Transl Med. (2018) 10: eaat7807. DOI: 10.1126 / scitranslmed.aat7807
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20.Pages F, Mlecnik B, Marliot F, Bindea G, Ou FS, Bifulco C и др. Международная валидация консенсусного иммунного ядра для классификации рака толстой кишки: прогностическое исследование и исследование точности. Ланцет. (2018) 391: 2128–39. DOI: 10.1016 / S0140-6736 (18) 30789-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Цзя Ц., Ву В., Ван И, Александр П. Б., Сунь Ц., Гонг З. и др. Локальное мутационное разнообразие вызывает внутриопухолевую иммунную гетерогенность при немелкоклеточном раке легкого. Nat Commun. (2018) 9: 5361. DOI: 10.1038 / s41467-018-07767-w
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Harding JJ, Nandakumar S, Armenia J, Khalil DN, Albano M, Ly M, et al. Проспективное генотипирование гепатоцеллюлярной карциномы: клинические последствия секвенирования следующего поколения для сопоставления пациентов с таргетной и иммунной терапией. Clin Cancer Res. (2019) 25: 2116–26. DOI: 10.1158 / 1078-0432.CCR-18-2293
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25.Даволи Т., Уно Х, Вутен Э.С., Элледж С.Дж. Анеуплоидия опухоли коррелирует с маркерами уклонения от иммунитета и снижением ответа на иммунотерапию. Наука. (2017) 355: eaaf8399. DOI: 10.1126 / science.aaf8399
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Макгранахан Н., Розенталь Р., Хили С.Т., Роуэн А.Дж., Уоткинс ТБК, Уилсон Г.А. и др. Аллель-специфическая потеря HLA и ускользание от иммунитета в развитии рака легких. Cell. (2017) 171: 1259–71.e11. DOI: 10.1016 / j.cell.2017.10.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Иммунограмма цикла «рак-иммунитет: на пути к персонализированной иммунотерапии рака легких»
Резюме
Введение
Взаимодействие иммунных и раковых клеток формирует иммуносупрессивное микроокружение опухоли. Для успешной иммунотерапии рака необходимы всесторонние знания противоопухолевого иммунитета как динамического пространственно-временного процесса для каждого отдельного пациента.С этой целью мы разработали иммунограмму цикла «рак-иммунитет» с помощью секвенирования следующего поколения.
Методы
Полное секвенирование экзома и секвенирование РНК были выполнены у 20 пациентов с НМРЛ (12 с аденокарциномой, семь с плоскоклеточной карциномой и один с крупноклеточной нейроэндокринной карциномой). Мутировавшие неоантигены и антигены зародышевой линии рака, экспрессируемые в опухоли, оценивали на предмет предполагаемого связывания с молекулами человеческого лейкоцитарного антигена пациента. Экспрессия генов, связанных с иммунитетом к раку, была оценена и нормализована, чтобы построить радарную диаграмму, состоящую из восьми осей, отражающих семь этапов цикла рака-иммунитета.
Результаты
У пациентов с раком легких наблюдались три модели иммунограммы: с высоким содержанием Т-клеток, с низким содержанием Т-клеток и промежуточным. Паттерн, богатый Т-клетками, характеризовался генными сигнатурами большого количества Т-клеток, регуляторных Т-клеток, миелоидных супрессорных клеток, молекул контрольных точек и иммунно-ингибирующих молекул в опухоли, что позволяет предположить наличие противоопухолевого иммунитета, ослабленного иммуносупрессивным микроокружением. . Фенотип с низким содержанием Т-клеток отражает отсутствие противоопухолевого иммунитета, неадекватную активацию дендритных клеток и недостаточную презентацию антигена в опухоли.Иммунограммы как пациентов с аденокарциномой, так и пациентов с опухолями, не связанными с аденокарциномой, включали фенотипы как с высоким, так и с низким содержанием Т-клеток, что позволяет предположить, что гистологический тип не обязательно отражает статус опухоли с иммунитетом к раку.
Выводы
Специфический для пациента ландшафт микросреды опухоли можно оценить с помощью иммунограмм в качестве интегрированных биомаркеров, которые, таким образом, могут стать ценным ресурсом для оптимальной персонализированной иммунотерапии.
Ключевые слова
Рак легкого
Цикл Рак-иммунитет
Неоантиген
Транскриптом
Иммунограмма
Рекомендуемые статьи Цитирующие статьи (0)
Просмотреть аннотацию© 2017 Международная ассоциация по изучению рака легких. Опубликовано Elsevier Inc.
Рекомендуемые статьи
Цитирующие статьи
Иммунограмма цикла «рак-иммунитет: на пути к персонализированной иммунотерапии рака легких»
Вступление: Взаимодействие иммунных и раковых клеток формирует иммуносупрессивное микроокружение опухоли.Для успешной иммунотерапии рака необходимы всесторонние знания противоопухолевого иммунитета как динамического пространственно-временного процесса для каждого отдельного пациента. С этой целью мы разработали иммунограмму цикла «рак-иммунитет» с помощью секвенирования следующего поколения.
Методы: Полное секвенирование экзома и секвенирование РНК были выполнены у 20 пациентов с НМРЛ (12 с аденокарциномой, семь с плоскоклеточной карциномой и один с крупноклеточной нейроэндокринной карциномой).Мутировавшие неоантигены и антигены зародышевой линии рака, экспрессируемые в опухоли, оценивали на предмет предполагаемого связывания с молекулами человеческого лейкоцитарного антигена пациентов. Экспрессия генов, связанных с иммунитетом к раку, была оценена и нормализована, чтобы построить радарную диаграмму, состоящую из восьми осей, отражающих семь этапов цикла рака-иммунитета.
Полученные результаты: У пациентов с раком легких наблюдались три модели иммунограммы: богатая Т-клетками, бедная Т-клетками и промежуточная.Паттерн, богатый Т-клетками, характеризовался генными сигнатурами обильных Т-клеток, регуляторных Т-клеток, миелоидных супрессорных клеток, молекул контрольных точек и иммунно-ингибирующих молекул в опухоли, что позволяет предположить наличие противоопухолевого иммунитета, ослабленного иммуносупрессивным микроокружением . Фенотип с низким содержанием Т-клеток отражал отсутствие противоопухолевого иммунитета, неадекватную активацию дендритных клеток и недостаточную презентацию антигена в опухоли. Иммунограммы как пациентов с аденокарциномой, так и пациентов с опухолями неаденокарциномы включали фенотипы как с высоким, так и с низким содержанием Т-клеток, что позволяет предположить, что гистологический тип не обязательно отражает статус опухоли с иммунитетом к раку.
Выводы: Специфический для пациента ландшафт микросреды опухоли можно оценить с помощью иммунограмм в качестве интегрированных биомаркеров, которые, таким образом, могут стать ценным ресурсом для оптимальной персонализированной иммунотерапии.
Ключевые слова: Цикл рак-иммунитет; Иммунограмма; Рак легких; Неоантиген; Транскриптом.
Новый метод оценки, основанный на иммунограммах РНК-Seq, описывающих индивидуальные взаимодействия между раком и иммунитетом
Cancer Sci. 2020 ноя; 111 (11): 4031–4040.
, 1 , 2 , 1 , 1 , 3 , 4 и 1 , 2Юкари Кобаяши
1 Отделение иммунотерапии, Больница Токийского университета, Токио Япония,
2 Блок многоуровневой интеграции данных иммунологии рака, Программа Центра инноваций в области медицины, РИКЕН, Токио Япония,
Ёсихиро Кушихара
1 Отделение иммунотерапии, Больница Токийского университета, Токио Япония,
Нориюки Сайто
1 Отделение иммунотерапии, Больница Токийского университета, Токио Япония,
Шигео Ямагути
3 Отделение хирургии, Медицинский факультет Университета Кейо, Токио Япония,
4 cБиоинформатика, Токио Япония,
Казухиро Какими
1 Отделение иммунотерапии, Больница Токийского университета, Токио Япония,
2 Подразделение многоуровневой интеграции данных онкологической иммунологии, Программа Центра инноваций в области медицины, РИКЕН, Токио Япония,
1 Отделение иммунотерапии, Больница Токийского университета, Токио Япония,
2 Подразделение многоуровневой интеграции данных онкологической иммунологии, Программа Центра инноваций в области медицины, РИКЕН, Токио Япония,
3 Отделение хирургии, Медицинский факультет Университета Кейо, Токио Япония,
4 cБиоинформатика, Токио Япония,
Автор, ответственный за переписку. * ПерепискаКазухиро Какими, отделение иммунотерапии, больница Токийского университета, 7-3-1 Хонго, Бункё-Ку, Токио 113-8655, Япония.
E-mail: pj.ca.oykot-u.m@imikak,
Поступила в редакцию 16.07.2020; Пересмотрено 13 августа 2020 г .; Принято 2020 14 августа
Copyright © 2020 Авторы. Наука о раке опубликовано John Wiley & Sons Australia, Ltd от имени Японской онкологической ассоциации. Это статья в открытом доступе на условиях http: // creativecommons.org / licenses / by-nc-nd / 4.0 / License, которая разрешает использование и распространение на любом носителе при условии правильного цитирования оригинальной работы, использования в некоммерческих целях и без каких-либо модификаций или адаптаций. другими статьями в PMC.Abstract
Из-за сложности взаимодействий между раком и иммунной системой, комбинации биомаркеров потребуются для прогнозирования индивидуальных ответов пациента на лечение и для мониторинга комбинированных стратегий для преодоления устойчивости к лечению.С этой целью «иммунограмма» была предложена в качестве комплексной основы для регистрации всех соответствующих иммунологических переменных. Здесь мы разработали метод преобразования транскриптомных данных в оценки иммунограммы (IGS). Эта иммунограмма включает 10 молекулярных профилей, состоящих из врожденного иммунитета, прайминга и активации, ответа Т-клеток, ответа интерферона γ (IFNG), ингибирующих молекул, регуляторных Т-клеток, миелоидных супрессорных клеток (MDSC), распознавания опухолевых клеток, пролиферации и т. Д. и гликолиз.Используя гены, связанные с этими 10 параметрами, мы применили анализ обогащения набора генов с одним образцом (ssGSEA) к 9417 массивным данным RNA-Seq от 9362 больных раком с 29 различными видами солидного рака в Атласе генома рака (TCGA). Показатели обогащения были нормализованы по z-шкале (Z) для каждого типа рака или всей когорты TCGA. IGS был определен формулой IGS = 3 + 1,5 × Z , чтобы пациенты были хорошо распределены по диапазону баллов от 1 до 5. Иммунограммы, построенные таким образом для всех отдельных пациентов во всей когорте TCGA, могут быть Доступно на веб-сайте «The RNA-Seq based Cancer Immunogram Web» (https: // yamashige33.shinyapps.io/immunogram/).
Ключевые слова: GSEA, иммунограмма, РНК-Seq, TCGA, опухолевый иммунитет
Резюме
Мы предлагаем новый метод подсчета баллов и визуализации для «иммунограммы» для оценки статуса иммунитета к раку отдельных пациентов с использованием большого набора данных TCGA и RNA-Seq каждого пациента. Иммунограммы для каждого человека будут полезным инструментом для точной иммуноонкологии, хотя их применение требует подтверждения в клинических испытаниях.
Сокращения
- ACC
- надпочечниковой карцинома
- BLCA
- мочевого пузыря уротелиальная карцинома
- BRCA
- молочной железы инвазивной карциномы
- CESC
- шейки плоскоклеточный рак и эндоцервикса аденокарциномы
- ХОЛ
- холангиокарцинома
- COAD
- аденокарцинома толстой кишки
- CTS
- специфический тип рака
- ESCA
- карцинома пищевода
- fpkm
- фрагментов на килобазу экзона на миллион считываний картированных
- GBM
- мультифоримобластная клетка шеи 90N90
- ICI
- Ингибиторы иммунных контрольных точек
- IGS
- Показатели иммунограммы
- KICP
- почечный хромофоб
- KIRC
- почка почечная светлоклеточная карцинома, клеточная
- KIRP почек арцинома
- LGG
- глиома головного мозга низшей степени злокачественности
- LIHC
- гепатоцеллюлярная карцинома печени
- LUAD
- аденокарцинома легкого
- LUSC
- плоскоклеточная карцинома MDO 9018 карцинома, полученная из клеток мезотеи MdO
- MSigDB
- Molecular Подписи базы данных
- О.В.
- яичников серозный цистаденокарцинома
- PAAD
- поджелудочной железы аденокарциномы
- PAN
- пан-рак
- PCPG
- феохромоцитома и параганглиома
- PRAD
- аденокарциномы простаты
- READ
- аденокарцинома прямой кишки
- SARC
- саркома
- SKCM
- кожная меланома кожи
- ssGSEA
- анализ пополнения набора генов на основе одного образца
- STAD
- аденокарцинома 9018 Атлас ракового генома
- THCA
- карцинома щитовидной железы
- TME
- микросреда опухоли
- UCEC
- карцинома тела матки эндометрия
- UCS
- карцинома матки 905 905 ВВЕДЕНИЕ
Иммунотерапия ингибиторами иммунных контрольных точек (ICI) полностью изменила терапевтический ландшафт для многих типов солидных опухолей. 1 Несколько комбинаций иммунотерапии с химиотерапией, 2 , 3 , 4 препаратов молекулярного таргетинга, 5 или комбинации различных ICI 6 , 7 теперь одобрены для лечения различных видов рака первой линии. Однако не все типы рака одинаково хорошо реагируют на ICI, и даже при ответных формах рака только часть пациентов испытывает устойчивый ответ и благоприятные долгосрочные результаты.Это связано с тем, что первичная и приобретенная резистентность встречается у значительной части пациентов с различными типами рака. 8
Следовательно, очень важно установить надежные прогностические биомаркеры, чтобы отличить респондентов ICI от неответчиков, которые могут нести ненужные затраты и токсичность, а также определить кандидатов для рациональной комбинированной терапии. 9 В настоящее время бремя мутаций опухоли 10 , 11 , 12 и экспрессия PD-L1 13 , 14 — две основные переменные, используемые в качестве биомаркеров, которые были подтверждены в клинических испытаниях фазы III.Кроме того, в качестве биомаркеров были предложены несколько других факторов, связанных с ответом или устойчивостью к ICI для разных типов рака, на основании молекулярного профилирования рака, леченного различными иммунотерапевтическими методами. К ним относятся фенотип с иммунным воспалением, 15 , 16 экспрессия генов сигнального пути Т-клеток, таких как IFNγ, 17 микроспутник неустойчивости, 18 соматических изменений числа копий, 19 разнообразие человеческого лейкоцитарного антигена (HLA) класса I, 20 Изменение клональности репертуара Т-клеток, 21 год передача сигналов WNT-β-катенин, 22 экспрессия TGFβ, 23 и даже комменсальная микробиота. 24
Однако, как единичные биомаркеры, ни один из вышеперечисленных не является достаточным для идентификации отдельных пациентов, которым, вероятно, будет полезна иммунотерапия. В отличие от традиционных методов лечения рака, иммунотерапия, включая ICI, не нацелена непосредственно на опухолевые клетки; вместо этого они воздействуют на опухолевые клетки через иммунную систему пациента или микроокружение опухоли (TME). 25 Следовательно, различные компоненты, которые влияют на взаимодействие опухоли с иммунитетом, необходимо принимать во внимание при разработке прогностических биомаркеров для иммунотерапии.Для этой цели критически важен всесторонний анализ множества различных функциональных путей и молекулярных сетей, которые выявляют интегрированные механизмы опухолевых иммунных взаимодействий. Необходимо учитывать общий и местный иммунитет от рака у каждого пациента. С этой целью Бланк и др. Предложили концепцию иммунограммы рака, которая объединяет многопараметрические биомаркеры для визуализации иммунологического статуса отдельного пациента. 26 год Мы применили эту концепцию к пациентам с раком легких и разработали иммунограмму, отражающую цикл рака-иммунитета. 27 С тех пор van Dijk et al сообщили об иммунограммах, информативных специально для пациентов с уротелиальным раком. 28 год
Хотя иммунограммы могут быть полезны для визуализации ландшафта микросреды опухоли и скомпрометированных этапов противоопухолевого иммунитета у каждого пациента, и Blank et al, и van Dijk et al только теоретизировали, что они могут быть полезны для пациентов, но не тестировали понятие в клинической практике. Напротив, мы проанализировали данные о реальных пациентах с раком легких, чтобы создать иммунограммы с потенциальным применением для персонализированной иммунотерапии.Однако в предыдущей версии нашей иммунограммы параметры были нормализованы и подсчитаны внутри когорты; поэтому этот подход нельзя было применить к другим когортам. Таким образом, в настоящем исследовании мы использовали данные РНК-Seq из когорты ракового генома (TCGA) в качестве стандарта и создали шкалу баллов для количественной оценки параметров, включенных в иммунограмму. Здесь мы предлагаем новый универсальный метод оценки для построения таких индивидуальных иммунограмм.
2. МАТЕРИАЛЫ И МЕТОДЫ
2.1. Данные и анализ.
ДанныеRNA-Seq для 29 солидных опухолей из TCGA были загружены через портал Genomic Data Commons Data Portal (https://portal.gdc.cancer.gov/) (n = 9417). Набор данных «Общее использование исследований в доступе к TCGA» в качестве проекта под названием № 12517: «Иммунограмма для персонализированной иммунотерапии рака» был одобрен NIH (№ 49374-7). Для субъектов с множественными доступными данными RNA-Seq данные среднего числа были преобразованы в количество фрагментов на килобазу экзона на миллион отображенных считываний (fpkm) и использованы для анализа обогащения набора генов (GSEA).Данные по РНК-Seq для 28 опухолей от 27 пациентов с меланомой, получавших лечение анти-PD-1, были получены из Gene Expression Omnibus (номер доступа: {«type»: «entrez-geo», «attrs»: {«text»: » GSE78220 «,» term_id «:» 78220 «}} GSE78220). 29 Оценка обогащения получена с использованием метода анализа обогащения набора генов по одной выборке (ssGSEA) 30 с пакетом R ssGSEA 2.0 (https://github.com/broadinstitute/ssGSEA2.0) и программным обеспечением R версии 3. 6. 0.
2.3. Статистический анализ.
Были рассчитаны коэффициенты корреляции Спирмена между любой парой наборов генов или осями для иммунограммы.Результаты интерпретировались в соответствии со степенью ассоциации как сильная (= 0,7-1), умеренная (= 0,5-0,7) или низкая (<0,5) после принятия во внимание значимых значений корреляции (или). Иерархическая кластеризация (метод Уорда) выполнялась с использованием JMP Pro15.0.0 (SAS Institute Inc).
3. РЕЗУЛЬТАТЫ
3.1. Выбор набора генов для иммунограмм
Иммунограмма — это гибкая система, иллюстрирующая иммунологический статус каждого пациента путем принятия любых и всех соответствующих параметров.Здесь мы изображаем иммунограмму на радиолокационном графике с десятью осями, чтобы обеспечить полезный снимок иммунного ландшафта в микросреде опухоли отдельного пациента (рисунок). Эти десять молекулярных профилей представляют собой врожденный иммунитет: естественные клетки-киллеры (NK) (ось 1), праймирование и активация: дендритные клетки (DC) (ось 2), Т-клетки: CD8 + Т-клеточный ответ (ось 3), интерферон γ. (IFNG) ответ (ось 4), ингибирующие молекулы (ось 5), ингибирующие клетки (регуляторные Т-клетки [Tregs], ось 6), ингибирующие клетки (супрессорные клетки миелоидного происхождения [MDSCs], ось 7), распознавание опухолевых клеток. : процессинг и презентация антигена (ось 8), пролиферация (ось 9) и гликолиз (ось 10).Все эти пути важны для развития противоопухолевых иммунных ответов. Чтобы количественно оценить эти молекулярные профили, была проведена ssGSEA для объемных данных РНК-Seq (таблица, таблица S1).
Иммунограмма радиолокационных участков. Чтобы изобразить молекулярные профили микросреды опухоли у каждого пациента, 10 параметров, связанных с этим процессом, были подсчитаны и нанесены на радиолокационный график. Они состоят из врожденного иммунитета (ось 1), праймирования и активации (ось 2), ответа Т-клеток (ось 3), ответа IFNG (ось 4), ингибирующих молекул (ось 5), регуляторных Т-клеток (Treg, ось 6), супрессорные клетки миелоидного происхождения (MDSC, ось 7), распознавание и представление опухолевых клеток (ось 8), пролиферация (ось 9) и гликолиз (ось 10), все они важны для развития противоопухолевых иммунных ответов
Таблица 1
Набор генов для 10-осевой иммунограммы
Ось Иммунологический параметр Имя набора генов 1 Врожденный иммунитет LM22 907 907 907 NK-клетки активированы (316) 907 907 Примирование и активация Дендритные клетки LM22 активированы (31) 3 Т-клетки LM22 Т-клетки CD8 (31) 4 Ответ IFNG ГАЛЛМАРКОВЫЙ ИНТЕРФЕРОН igDB) 5 Ингибирующие молекулы Набор генов иммунного ускользания (IEGS) иммунный ускользание (32) 6 Ингибирующие клетки (Tregs) LM22 T-клетки 31 регулятор (Tregs) (Tregs) 7 Ингибиторные клетки (MDSC) Angelova_MDSC (33) 8 Распознавание опухолевых клеток РЕАКТОМ КЛАСС I MHC7781 ПРЕЗЕНТАЦИЯ ПРОЦЕССА АНТИГЕНА 907 907 907 РЕАКТОМНАЯ РЕПЛИКАЦИЯ ДНК (MSigDB) 10 Гликолиз ГЛИКОЛИЗ ПО ХОЛМАРКУ (MSigDB) Для количественной оценки наборов NK-клеток, генов DC, CD +
Lreg8 9017 были использованы. 31 год Наборы генов для ответа IFNG, распознавания опухолевых клеток: процессинг и представление антигена, пролиферация и гликолиз были выбраны из базы данных молекулярных сигнатур (MSigDB, https://www.gsea‐msigdb.org/gsea/msigdb/index.jsp ). Набор генов для ингибирующих молекул использовали из набора генов иммунного ускользания (IEGS). 1 , 2 , 32 Для MDSC мы следовали опубликованному набору генов Angelova et al. 33 Мы проверили эти выбранные наборы генов, сравнив их с аналогичными наборами генов, доступными в литературе (Таблица S2).В качестве тестовой выборки мы использовали данные RNA-Seq 103 пациентов с меланомой из TCGA и запустили ssGSEA для получения оценок обогащения. Например, мы сравнили 12 наборов генов, связанных с NK-клетками, с помощью корреляционного анализа Спирмена, чтобы проверить набор генов для оси 1 (рисунок). Большинство наборов генов показали сильную линейную корреляцию друг с другом, за исключением того, о котором сообщил enbabaolu et al. 34 Набор генов NK-клеток LM22 хорошо коррелировал с другими наборами генов. Аналогичным образом наборы генов для других осей были оценены с помощью корреляционного анализа Спирмена, и их достоверность была подтверждена (рис.S1).Матрица точечной диаграммы для корреляционного анализа Спирмена наборов генов для оси 1. Данные RNA-Seq 103 пациентов с меланомой из Атласа генома рака (TCGA) были подвергнуты анализу обогащения набора генов с одним образцом (ssGSEA) с 12 наборами генов. связанные с врожденным иммунитетом: Abbas_NK_cells, 39 Becht_NK_cells, 40 GO: 0045087_innate_immune_response (AmiGo2), Huntington_NK_cells, 41 год Ангелова_Ячейка, 33 ImSig_NK_cells, 42 LM22_NK_cells_activated, 31 год LM22_NK_activated_resting, 31 год LM7_NK_cells, 43 год Charoentong_NK_cells, 44 год Schelker_NK_cells, 45 и Şenbabaoğlu_NK_cells. 34 Корреляции этих наборов генов были проанализированы с помощью корреляционного анализа Спирмена. Анализ парных корреляций 12 наборов генов представлен в матрице точечной диаграммы, которая содержит все попарные данные оценок ssGSEA с указанными наборами генов. Двумерные корреляции для набора данных показаны с цветовым кодированием следующим образом: темно-красный связан с коэффициентом корреляции Спирмена, R , равным 1, а темно-синий связан с R = -1
3.2. Преобразование оценок обогащения ssGSEA в оценки иммунограммы
Для построения иммунограммы метод подсчета баллов зависит от наличия надежных стандартных значений для каждой оси. С этой целью мы использовали данные 9417 RNA-Seq от 9362 больных раком с 29 различными видами солидного рака в наборе данных TCGA. К ним относятся инвазивная карцинома молочной железы (BRCA), карцинома тела матки (UCEC), светлоклеточная карцинома почек (KIRC), аденокарцинома легких (LUAD), глиома головного мозга (LGG), карцинома щитовидной железы (THCA), голова и шея. плоскоклеточный рак (HNSC), плоскоклеточный рак легкого (LUSC), аденокарцинома простаты (PRAD), кожная меланома (SKCM), аденокарцинома толстой кишки (COAD), уротелиальная карцинома мочевого пузыря (BLCA), аденокарцинома желудка (STAD), яичниковая карцинома (OV), гепатоцеллюлярная карцинома печени (LIHC), плоскоклеточная карцинома шейки матки и эндоцервикальная аденокарцинома (CESC), папиллярно-клеточная карцинома почек (KIRP), саркома (SARC), феохромоцитома и параганглиома, аденокарцинома прямой кишки (PCPAD), панкреатокарцинома (PAAD) аденокарцинома (READ), мультиформная глиобластома (GBM), карцинома пищевода (ESCA), мезотелиома (MESO), увеальная меланома (UVM), хромофоб почек (KICP), карциносаркома матки (UCS), холангиокорцинома (CHOL) и холангиокорцинома нома (АСС) (таблица).Данные РНК-Seq были подвергнуты ssGSEA с 10 наборами генов, упомянутыми выше (таблица).
Таблица 2
Пациенты с 29 солидными формами рака из Атласа генома рака (TCGA)
Тип рака Сокращение Количество пациентов Количество образцов карцина груди BRCA 1091 1097 Карцинома тела матки эндометрия UCEC 543 547 Почечный светлоклеточный рак 907 907 907 907 7 LUAD 513 524 Глиома мозга низшей степени злокачественности LGG 511 511 Карцинома щитовидной железы Клеточная карцинома THCA 902 907 5081 907 902 907 907 908 HNSC 500 50 0 Плоскоклеточная карцинома легкого LUSC 501 501 Аденокарцинома простаты PRAD 495 498 909 9081 908 907 907 907 907 907 907 907 907 907 907 907 907 907 907 аденокарциномы толстой кишки COAD 456 469 мочевого пузыря уротелиальная карциномы BLCA 408 412 Желудок аденокарциномы STAD 375 375 яичников серозная цистаденокарцинома OV 374 374 Печеночно-гепатоцеллюлярная карцинома LIHC 371 371 карцинома 9081 907 81 907 907 907 907 901 907 907 907 901 776 Папиллярно-клеточная карцинома почки KIRP 288 288 Саркома SARC 259 259 7 7 панкреатической аденокарциномы PAAD 177 177 колоректальной аденокарциномы ЧТЕНИЕ 166 166 глиобластомы GBM 154 155 карцинома пищевода ESCA 161 161 Мезотелиома MESO 86 86 Uveal меланома UVM 80 907 907 65 Карциносаркома матки UCS 56 56 Холангиокарцинома CHOL 36 45 7 7 9362 9417 Для оценки иммунограммы была применена нормализация z-показателя к показателям обогащения ssGSEA . Из-за значительных различий в профилях экспрессии генов между типами рака, нормализация была выполнена в подгруппах пациентов с каждым типом рака или во всей когорте TCGA. Таким образом, мы построили две иммунограммы для каждого пациента: иммунограмму, специфичную для определенного типа рака (CTS), и иммунограмму пан-рака (PAN). Среднее (M CTS ) и стандартное отклонение (SD CTS ) значения показателей обогащения были рассчитаны для подгрупп пациентов с каждым типом рака или значения M PAN и SD PAN баллов обогащения всех TCGA. пациенты с 29 типами рака для панкологического анализа.Оценка обогащения (ES n ) оси n у каждого пациента была преобразована в z-оценку Z CTS, n или Z PAN, n , а затем преобразована в оценку иммунограммы IGS. CTS, n или IGS PAN, n по следующей формуле.
ZCTS или PAN, n = ESn ‐ MCTS или PAN, n / SDCTS или PAN, nIGSCTS или PAN, n = 3 + 1,5 × ZCTS или PAN, nn = 1∼10CTS = BRCA, UCEC, KIRC, LUAD, LGG, THCA, HNSC, LUSC, PRAD, SKCM, COAD, BLCA, STAD, OV, LIHC, CESC, KIRP, SARC, PCPG, PAAD, READ, GBM, ESCA, MESO, UVM, KICH, UCS, CHOL, ACC
дюйма Для каждого пациента IGS для всех осей были определены с помощью этих формул и нанесены на радарную диаграмму для создания иммунограмм, специфичных для типа рака или пан-рака.Нижний и верхний пределы IGS были установлены на 1 и 5. По определению IGS = 3 представляет ES, эквивалент среднего ES для когорты TCGA, а IGS = 4,5 или IGS = 1,5 представляет ES, эквивалент среднего плюс или минус одна SD. IGS был определен таким образом, чтобы пациенты были хорошо распределены в диапазоне от 1 до 5. Затем мы разработали доступную в Интернете базу данных под названием «Сеть иммунограмм рака на основе RNA-Seq с результатами 9362 больных раком в Когорта TCGA (https: // yamashige33.shinyapps.io/immunogram/). У каждого пациента есть своя собственная дискретная иммунограмма, что свидетельствует о том, что иммунный ответ и микроокружение опухоли уникальны для каждого человека.
3.3. Типоспецифический тип рака и иммунограммы панк-рака
В качестве примера на рисунке показаны иммунограммы (IG PAN и IG CTS ) для одного пациента в TCGA с LUAD, KIC, SKCM, BRCA, PRAD или LGG. . Для каждого пациента формы рака, специфичного к типу (IG CTS ) и рака панкреатита (IG PAN ), различаются.Некоторые опухоли богаты инфильтрацией Т-лимфоцитов и обозначаются как «горячие», тогда как «холодные» опухоли не имеют таких инфильтраций. В панкономическом анализе объединены все данные пациентов с горячими и холодными опухолями. Следовательно, M PAN выше, чем M CTS для типов опухолей, в которых преобладают холодные опухоли. Обратное верно для типов с преобладанием горячей опухоли. Как показано на фигуре, внешние области IG PAN для LUAD и KIRC более протяженные, чем у соответствующих IG CTS , что позволяет предположить, что эти опухоли иммунологически горячие.Напротив, IG PAN для PRAD и LGG кажутся сжатыми по сравнению с соответствующими IG CTS , что позволяет предположить, что эти опухоли иммунологически холодные. IG PAN подходит для сравнения иммунологического статуса при разных типах рака, тогда как с помощью IG CTS мы можем сравнивать тонкие индивидуальные различия во внутриопухолевых иммунных ответах между пациентами с одними и теми же типами рака.
Пан-рак и иммунограммы, специфичные для конкретного типа рака.У каждого пациента могут быть изображены две иммунограммы на основе различных нормализованных баллов, панк-рака и специфичного для типа рака. Показаны иммунограммы случайно выбранного пациента с LUAD (A), KIRC (B), SKCM (C), BRCA (D), PRAD (E) и LGG (F) из Атласа генома рака (TCGA). ID корпуса TCGA отображается на панели. 1. Врожденный иммунитет, 2. Прайминг и активация, 3. Т-клетки, 4. Ответ IFNG, 5. Ингибирующие молекулы, 6. Ингибирующие клетки (Treg), 7. Ингибирующие клетки (MDSC), 8. Распознавание опухолевых клеток, 9 .Распространение, 10. Гликолиз. BRCA, инвазивная карцинома груди; KIRC, почечный светлоклеточный рак; LGG, глиома головного мозга низшей степени злокачественности; LUAD — аденокарцинома легкого; PRAD, аденокарцинома простаты; SKCM, кожная меланома кожи
3.4. Общий обзор иммунных ответов при каждом типе рака
Чтобы получить общий обзор иммунных ответов, специфичных для данного типа рака, мы создали вымышленных пациентов, представляющих 29 типов рака в когорте TCGA, предоставив M CTS, n для их ES n .Когда мы изображаем IG CTS у этих вымышленных пациентов, все иммунограммы показывают правильные декагоны со всеми осями, равными точке 3,0. IG PAN для этих пациентов показаны на рисунке. Иерархическая кластеризация этих «пациентов» по их IGS показала, что MESO, LUAD, KIRC, PAAD, LUSC, CESC и HNSC достаточно иммуногенны, тогда как UCS, GBM, ACC, PRAD, KICH, PCPG, UVM и LGG иммунологически неактивны. . Эти результаты согласуются с клиническим опытом, что отражено в одобрении ингибиторов контрольных точек для этих иммуногенных типов рака (за исключением PAAD).
Иммунограммы панк-рака для вымышленных пациентов с 29 солидными формами рака. А. Пан-рак иммунограммы были созданы для 29 вымышленных пациентов со средними показателями обогащения соответствующего типа рака. B, Иерархическая кластеризация этих пациентов по методу Варда с использованием 10 баллов иммунограммы. Данные показаны с цветовой кодировкой следующим образом: темно-красный соответствует баллу иммунограммы (IGS), равному 5, а темно-синий соответствует IGS = 1
3.5. Иммунограммы для персонализированной иммуно-онкологии
Оси 1-4 представляют серию динамических процессов, участвующих в индукции противоопухолевых иммунных ответов, а ось 8 важна для распознавания Т-клетками опухолевых клеток, тогда как гены, относящиеся к осям 5-7, являются рассматривается как тормозящие контррегуляторы.Поэтому эти оси часто перемещаются вместе. Чтобы изучить корреляцию между всеми 10 осями иммунограммы, все IGS PAN из 9417 пациентов были подвергнуты корреляционному анализу Спирмена. Как показано на рисунке, коэффициенты корреляции между осями 1-6 были> 0,7. Эти результаты можно интерпретировать как означающие, что выбора только одного параметра в пределах осей 1-6 будет достаточно для включения в иммунограмму. Это может быть так, если мы оценим иммунный ответ в целом. Однако это также может вводить в заблуждение, если эти параметры не являются избыточными и необходимы для оценки иммунологического статуса каждого пациента.Примеры пациентов с раком легких, показанные на рисунке, демонстрируют, что каждая ось ведет себя по-разному. В случае TCGA ‐ 86‐8671‐01A оси 1‐7 были одинаково высокими (рисунок), но в TCGA ‐ 86‐8359‐01A оси 1 и 3 были высокими, а оси 2, 4 и 5 были низкими. . Оси 1, 3 и 6 были низкими, а оси 2, 4 и 5 были высокими в TCGA ‐ 97‐8175‐01A. У трех других пациентов наблюдаются дополнительные различные модели иммунограммы. Эти результаты показывают, что все эти параметры необходимы для понимания противоопухолевого иммунитета у каждого отдельного пациента, поскольку комбинированная иммунотерапия может быть выбрана для нацеливания на каждый из различных выявленных нарушенных процессов, идентифицированных с помощью подробной иммунограммы.
Иммунограммы для отдельных пациентов. A. Показатели иммунограммы по каждой оси из данных 9417 пациентов были подвергнуты корреляционному анализу Спирмена. Анализ парных корреляций каждой оси иммунограммы представлен в матрице тепловой карты, которая содержит все попарные данные указанных осей. Двумерные корреляции для набора данных показаны с цветовым кодированием следующим образом: темно-красный связан с коэффициентом корреляции Спирмена, R , равным 1, а темно-синий связан с R = -1.B, Специфические иммунограммы рака легких шести пациентов. Идентификаторы случаев в Атласе генома рака (TCGA) показаны на панели. C, Иммунограммы пациентов с меланомой, получавших терапию анти-PD-1 (когорта Hugo et al., 29 ). Было показано шесть неответчиков. См. Также рис. S2. 1. Врожденный иммунитет, 2. Праймирование и активация, 3. Т-клетки, 4. Ответ IFNG, 5. Ингибирующие молекулы, 6. Ингибирующие клетки (Treg), 7. Ингибирующие клетки (MDSC), 8. Распознавание опухолевых клеток, 9 Пролиферация, 10. Гликолиз
Мы проанализировали данные РНК-Seq для 28 опухолей до лечения от пациентов с меланомой, которые получали анти-PD-1 ICI. 29 Иммунограммы были изображены в этих опухолях до лечения (Рисунок S2). Затем мы сосредоточились на пациентах, не отвечающих на лечение (с прогрессирующим заболеванием) (рисунок), и изучили, можем ли мы рекомендовать потенциальную комбинированную иммунотерапию этим неответчикам с помощью иммунограммы. Иммунограммы Pt10 и Pt12 отображали типичную картину иммунограммы холодных опухолей. Стратегии индукции Т-клеточного ответа в опухоли, например противораковая вакцина или онколитическая виротерапия, можно рекомендовать в сочетании с ICI.Кроме того, гликолиз отличался от других осей в Pt10. Ответу Т-клеток препятствует высокая потребность опухолевых клеток в энергии, что является терапевтической мишенью для комбинированной иммунотерапии. 35 год Ось 6 (Treg) и ось 7 (MDSC) были высоки в Pt25 и Pt16, соответственно, предполагая, что стратегии истощения Treg или MDSC могут быть рекомендованы этим пациентам. В Pt14 и Pt23 ось 9 (пролиферация) была высокой, что позволяет предположить, что молекулярная таргетная терапия или химиотерапия, которые подавляют пролиферацию опухолевых клеток, могут быть объединены с ICI.Хотя эти предложения требуют подтверждения в клинических испытаниях, иммунограмма считается отличной платформой для персонализированной иммуноонкологии.
4. ОБСУЖДЕНИЕ
Концепция иммунограммы рака привлекла большое внимание с тех пор, как Бланк и др. Предложили использовать радиолокационные графики в качестве основы для описания разнообразия взаимодействий между раком и иммунитетом у каждого отдельного пациента. 26 год Хотя их потенциальная ценность широко признана, не было разработано универсального метода оценки для построения иммунограмм в реальных условиях.Здесь мы предлагаем новый метод оценки, основанный на данных RNA-Seq и применении ssGSEA для количественной оценки параметров, связанных с противоопухолевым иммунитетом. Мы создали доступную в Интернете базу данных «Сеть онкологической иммунограммы на основе RNA-Seq» (https://yamashige33.shinyapps.io/immunogram/) с результатами 9362 больных раком (данные 9417 RNA-Seq) из когорты TCGA. .
Хотя иммунные реакции, специфичные для определенного типа рака, можно оценить и сравнить с помощью анализа иммунограммы (рисунок), реальная ценность использования иммунограмм будет заключаться в персонализированной иммуно-онкологии.В самом деле, мы можем легко увидеть, что паттерны иммунограммы сильно различаются между пациентами даже с одним и тем же типом рака, что отражает гетерогенность иммунных ответов и TME у каждого человека (рисунки и, основанная на RNA-Seq Сеть иммунограмм рака). Как показано на рисунке, например, иммунограмма для TCGA-86-8671-01A предполагает ранее существовавшие ответы Т-клеток, но индуцированные опухолью иммуносупрессивные молекулы и клетки в качестве контррегуляторов. Можно ожидать, что для этих пациентов ICI будет эффективным.С другой стороны, низкие баллы по праймированию и активации и высокие баллы для Treg, наблюдаемые у пациента TCGA ‐ 86‐8359‐01A, предполагают, что может быть рекомендована комбинированная терапия с вакцинами DC и терапия истощения Treg. Как только мы сможем идентифицировать нарушенные этапы противоопухолевого иммунного ответа у каждого пациента индивидуально, мы сможем лучше выбрать некоторые из нескольких препаратов, которые уже были разработаны и одобрены для клинического использования при лечении определенных форм рака, чтобы преодолеть эти препятствия. 36 Используя иммунограммы опухолей, не отвечающих на ICI (рисунок), мы могли указать на нарушенный этап, который может быть потенциальной целью для комбинированной терапии у каждого пациента. Иммунограммы для каждого человека будут полезным инструментом для точной иммуноонкологии, хотя их применение требует подтверждения в клинических испытаниях.
Для создания информативных иммунограмм требуется всесторонняя оценка и интеграция множества потенциально иммунных факторов. С этой целью гибкость подходов, основанных на RNA-seq, идеальна.RNA-Seq предоставляет исчерпывающие данные о транскриптоме, 37 Оценка и ssGSEA обеспечивает полезный подход для количественной оценки выбранных молекулярных сигнатур в транскриптоме образца. 30 Существует коллекция аннотированных наборов генов, доступных для GSEA, например, База данных молекулярных сигнатур (MSigDB). Можно дополнить иммунограмму новыми соответствующими биомаркерами и легко протестировать различные комбинации наборов генов, выбрав другие панели генов для создания различных иммунограмм.Например, иммунограммы для признаков рака также могут быть составлены путем принятия наборов генов для восьми признаков: поддержание пролиферативной передачи сигналов, уклонение от супрессоров роста, сопротивление гибели клеток, обеспечение репликативного бессмертия, индукция ангиогенеза, активация инвазии и метастазирования, перепрограммирование энергетического метаболизма, и уклонение от иммунного разрушения. 38
В настоящем исследовании мы описали иммунограмму с 10 осями просто в качестве примера для ознакомления с нашим методом подсчета очков, но, возможно, также потребуется учитывать другие параметры.Эти 10 параметров еще не оптимизированы для разработки прогностических биомаркеров для ICI и для персонализированной комбинированной иммунотерапии. Накапливающиеся данные указывают на то, что на эффективность ICI влияет сочетание местных и системных факторов, включая биомаркеры, присущие опухоли, хозяину и биомаркеры микросреды. В описанной здесь иммунограмме отсутствуют какие-либо данные о мутационной нагрузке опухоли или другие геномные данные. В нем также отсутствует информация о системных факторах, факторах окружающей среды и данные иммуногистохимии и проточной цитометрии.Эти данные могут быть включены в иммунограмму; однако методы нормализации этих модальностей созданы по-разному и требуют значительных трудозатрат. В будущем мы будем добавлять эти параметры по одному к иммунограмме.
В заключение мы предлагаем новый метод оценки и визуализации для оценки статуса иммунитета к раку отдельных пациентов с использованием большого набора данных TCGA и RNA-Seq для каждого пациента. Это исследование — первое, в котором описан способ изображения иммунограмм с использованием реальных данных пациентов.Иммунограммы, полученные таким образом, являются гибкими и могут включать в себя множество наборов генов, доступных сообществу. Дальнейшее уточнение и проверка таких иммунограмм должны способствовать пониманию иммунологического статуса каждого отдельного пациента для прогнозирования эффективности ICI и индивидуального подбора оптимальной комбинированной иммунотерапии.
КОНФЛИКТ ИНТЕРЕСОВ
Доктор Какими сообщает о грантах от TAKARA BIO Inc, грантах от MSD, помимо представленных работ; Отделение иммунотерапии больницы Токийского университета финансируется компанией TAKARA BIO Inc.Доктор Ямагути — основатель cBioinformatics. У других авторов нет конкурирующих интересов, о которых следует сообщать.
ЭТИКА
Эта статья не содержит исследований с участием людей, выполненных кем-либо из авторов. Набор данных «Общее использование исследований в доступе к TCGA» в качестве проекта под названием № 12517: «Иммунограмма для персонализированной иммунотерапии рака» был одобрен NIH (№ 49374-7).
БЛАГОДАРНОСТИ
Авторы выражают благодарность доктору Кодзи Нагаока, доктору Акихиро Хосои, доктору Таро Тешима, госпоже Микико Сибуя и госпоже Джерене Мышеник за техническую помощь.Эта работа проводилась при институциональной поддержке RIKEN. Спонсор не имел никакого отношения к дизайну исследования, сбору и анализу данных, интерпретации, принятию решения о публикации, подготовке рукописи или любому аспекту исследования.
Банкноты
Кобаяси Й., Кушихара Й., Сайто Н., Ямагути С., Какими К. Новый метод оценки, основанный на иммунограммах РНК-Seq, описывающих индивидуальные взаимодействия рака и иммунитета. Cancer Sci. 2020; 111: 4031–4040. 10.1111 / cas.14621 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
ССЫЛКИ
2.Ганди Л., Родригес-Абреу Д., Гаджил С. и др. Пембролизумаб в сочетании с химиотерапией при метастатическом немелкоклеточном раке легкого. N Engl J Med. 2018; 378: 2078-2092. [PubMed] [Google Scholar] 3. Паз-Арес Л., Люфт А, Висенте Д. и др. Пембролизумаб плюс химиотерапия плоскоклеточного немелкоклеточного рака легкого. N Engl J Med. 2018; 379: 2040-2051. [PubMed] [Google Scholar] 4. Socinski MA, Jotte RM, Cappuzzo F, et al. Атезолизумаб для лечения первой линии метастатического неплоскоклеточного НМРЛ. N Engl J Med. 2018; 378: 2288-2301.[PubMed] [Google Scholar] 5. Рини Б.И., Плимак ER, Стус В.и др. Пембролизумаб плюс акситиниб в сравнении с сунитинибом при запущенной почечно-клеточной карциноме. N Engl J Med. 2019; 380: 1116-1127. [PubMed] [Google Scholar] 6. Ходи Ф.С., Кьярион-Силени В., Гонсалес Р. и др. Ниволумаб плюс ипилимумаб или только ниволумаб по сравнению с одним ипилимумабом при запущенной меланоме (CheckMate 067): 4-летние результаты многоцентрового рандомизированного исследования фазы 3. Ланцет Онкол. 2018; 19: 1480-1492. [PubMed] [Google Scholar] 7. Мотцер Р.Дж., Таннир Н.М., Макдермотт Д.Ф. и др.Сравнение ниволумаба и ипилимумаба с сунитинибом при запущенной почечно-клеточной карциноме. N Engl J Med. 2018; 378: 1277-1290. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Шарма П., Ху-Лескован С., Варго Дж. А., Рибас А. Первичная, адаптивная и приобретенная устойчивость к иммунотерапии рака. Клетка. 2017; 168: 707-723. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Гавел Дж. Дж., Човелл Д., Чан Т. А.. Развитие биомаркеров для иммунотерапии ингибиторами контрольных точек. Nat Rev Рак. 2019; 19: 133-150. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10.Снайдер А., Макаров В., Мергуб Т. и др. Генетическая основа клинического ответа на блокаду CTLA-4 при меланоме. N Engl J Med. 2014; 371: 2189-2199. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Ризви Н.А., Хеллманн М.Д., Снайдер А. и др. Иммунология рака. Мутационный ландшафт определяет чувствительность к блокаде PD-1 при немелкоклеточном раке легкого. Наука. 2015; 348: 124-128. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Ван Аллен Э.М., Мяо Д., Шиллинг Б. и др. Геномные корреляты ответа на блокаду CTLA-4 при метастатической меланоме.Наука. 2015; 350: 207-211. [Бесплатная статья PMC] [PubMed] [Google Scholar] 13. Топалян С.Л., Таубе Дж.М., Андерс Р.А., Пардолл Д.М. Биомаркеры, управляемые механизмами, для определения блокады иммунных контрольных точек при лечении рака. Nat Rev Рак. 2016; 16: 275-287. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Гибни Г. Т., Вайнер Л. М., Аткинс МБ. Прогностические биомаркеры для иммунотерапии на основе ингибиторов контрольных точек. Ланцет Онкол. 2016; 17: e542 ‐ e551. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Хербст Р.С., Сориа Дж-К, Кованец М. и др.Прогностические корреляты ответа на анти-PD-L1 антитело MPDL3280A у онкологических больных. Природа. 2014; 515: 563-567. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Tumeh PC, Harview CL, Yearley JH и др. Блокада PD-1 вызывает ответы, подавляя адаптивную иммунную резистентность. Природа. 2014; 515: 568-571. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Гао Дж., Ши Л.З., Чжао Х. и др. Потеря генов пути IFN-гамма в опухолевых клетках как механизм устойчивости к терапии анти-CTLA-4. Клетка. 2016; 167: 397-404.e399. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Ле Д. Т., Дарем Дж. Н., Смит К. Н. и др. Дефицит репарации несоответствия предсказывает ответ солидных опухолей на блокаду PD-1. Наука. 2017; 357: 409-413. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Даволи Т., Уно Х, Вутен Э.С., Элледж С.Дж. Анеуплоидия опухоли коррелирует с маркерами уклонения от иммунитета и снижением ответа на иммунотерапию. Наука. 2017; 355: eaaf8399. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Chowell D, Morris LGT, Grigg CM, et al.Генотип пациента HLA класса I влияет на реакцию рака на иммунотерапию блокадой контрольных точек. Наука. 2018; 359: 582-587. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Риаз Н., Гавел Дж. Дж., Макаров В. и др. Эволюция опухоли и микросреды при иммунотерапии ниволумабом. Клетка. 2017; 171 (4): 934-949. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Шпрангер С., Бао Р., Гаевски Т.Ф. Внутренняя передача сигналов бета-катенина меланомы предотвращает противоопухолевый иммунитет. Природа. 2015; 523: 231-235. [PubMed] [Google Scholar] 23.Мариафазан С., Терли С.Дж., Никлз Д. и др. TGFbeta ослабляет ответ опухоли на блокаду PD-L1, способствуя исключению Т-клеток. Природа. 2018; 554: 544-548. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Чапут Н., Лепаж П., Кутзак С. и др. Исходная микробиота кишечника позволяет прогнозировать клинический ответ и колит у пациентов с метастатической меланомой, получавших ипилимумаб. Энн Онкол. 2017; 28: 1368-1379. [PubMed] [Google Scholar] 25. Бинньюис М., Робертс Э.В., Керстен К. и др. Понимание иммунной микросреды опухоли (ВРЕМЯ) для эффективной терапии.Nat Med. 2018; 24: 541-550. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Blank CU, Haanen JB, Ribas A, Schumacher TN. «Иммунограмма рака». Наука. 2016; 352: 658-660. [PubMed] [Google Scholar] 27. Карасаки Т., Нагаяма К., Кувано Х. и др. Иммунограмма цикла рак-иммунитет: к персонализированной иммунотерапии рака легких. J Thorac Oncol. 2017; 12: 791-803. [PubMed] [Google Scholar] 28. ван Дейк Н., Фунт С.А., Бланк К.Ю., Паулс Т., Розенберг Дж. Э., ван дер Хейден МС. Иммунограмма рака как основа персонализированной иммунотерапии уротелиального рака.Eur Urol. 2019; 75: 435-444. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Хьюго В., Зарецкий Ю.М., Сан Л.Ю. и др. Геномные и транскриптомные особенности ответа на терапию анти-PD-1 при метастатической меланоме. Клетка. 2016; 165: 35-44. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Барби Д.А., Тамайо П., Бем Дж. С. и др. Систематическая интерференция РНК показывает, что онкогенные раковые образования, вызванные KRAS, требуют TBK1. Природа. 2009; 462: 108-112. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Ньюман А.М., Лю К.Л., Грин М.Р. и др.Надежный подсчет клеточных субпопуляций из профилей тканевой экспрессии. Нат методы. 2015; 12: 453-457. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Лоран С., Чармпи К., Гравелл П. и др. Несколько паттернов иммунного ускользания при неходжкинских лимфомах. Онкоиммунология. 2015; 4: e1026530. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Ангелова М., Чароентонг П., Хакл Х. и др. Характеристика иммунофенотипов и антигеномов колоректального рака выявляет различные механизмы ускользания от опухоли и новые мишени для иммунотерапии.Genome Biol. 2015; 16:64. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Enbabaolu Y, Gejman RS, Winer AG, et al. Характеристика иммунного микроокружения опухоли при светлоклеточном почечно-клеточном раке позволяет идентифицировать прогностические и иммунотерапевтически значимые сигнатуры матричной РНК. Genome Biol. 2016; 17: 231. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Киштон Р.Дж., Сукумар М, Рестифо Н.П. Метаболическая регуляция продолжительности жизни и функции Т-клеток при иммунотерапии опухолей. Cell Metab. 2017; 26: 94-109. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36.Патель С.А., Минн А.Дж. Комбинированная терапия рака с блокадой иммунных контрольных точек: механизмы и стратегии. Иммунитет. 2018; 48: 417-433. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Нагалакшми У., Варн К., Снайдер М. RNA-Seq: метод всестороннего анализа транскриптома. Curr Protoc Mol Biol. 2010; Глава 4: Блок 4.11.11-13. [PubMed] [Google Scholar] 39. Аббас А.Р., Болдуин Д., Ма Й. и др. Иммунный ответ in silico (IRIS): иммуноспецифические гены, идентифицированные из сборника данных экспрессии микрочипов.Genes Immun. 2005; 6: 319-331. [PubMed] [Google Scholar] 40. Бехт Э., Хиральдо Н.А., Лакруа Л. и др. Оценка численности популяции проникающих в ткани популяций иммунных и стромальных клеток с использованием экспрессии генов. Genome Biol. 2016; 17: 218. [Бесплатная статья PMC] [PubMed] [Google Scholar] 41. Курсонс Дж., Соуза-Фонсека-Гимарайнш Ф., Фороутан М. и др. Сигнатура гена, предсказывающая инфильтрацию естественных клеток-киллеров и улучшающая выживаемость пациентов с меланомой. Cancer Immunol Res. 2019; 7: 1162-1174. [PubMed] [Google Scholar] 42.Нирмал А.Дж., Реган Т., Ши ББ, Хьюм Д.А., Симс А.Х., Фриман Т. Сигнатуры генов иммунных клеток для профилирования микросреды солидных опухолей. Cancer Immunol Res. 2018; 6: 1388-1400. [PubMed] [Google Scholar] 43. Tosolini M, Pont F, Poupot M и др. Оценка количества лимфоцитов TCRVgamma9Vdelta2 gammadelta, инфильтрирующих опухоль, путем деконволюции микроматриц рака человека. Онкоиммунология. 2017; 6: e1284723. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44. Чароентонг П., Финотелло Ф, Ангелова М. и др.Иммуногеномный анализ рака выявляет взаимосвязь между генотипом и иммунофенотипом и предикторы реакции на блокаду контрольных точек. Cell Rep.2017; 18: 248-262. [PubMed] [Google Scholar] 45. Schelker M, Feau S, Du J, et al. Оценка содержания иммунных клеток в опухолевой ткани с использованием данных одноклеточной РНК-seq. Nat Commun. 2017; 8: 2032. [Бесплатная статья PMC] [PubMed] [Google Scholar]адаптивных сдвигов в иммунограммах здоровых детей, проживающих в районах с повышенным фоновым излучением
- 1.
Алексеев И.А. Проблема биологической адаптации и защиты здоровья населения // Антропология . М .: Медицина, 1989. С.
. 16.
Google Scholar
- 2.
Ильин Б.Н., Борисова В.В., Ветух В.А., Отделение ‘новые биологические эффекты комбинированного воздействия радионуклидов различной тропности. Энергоатомиздат, 1991.
Google Scholar
- 3.
Савченко А.А. , Борисов А.Г. Показатели иммунной системы и активность НАДФ-зависимых дегидрогеназ лимфоцитов у лиц, находящихся в длительном контакте с радиоактивными веществами и химическими веществами, Иммунология, 1996, № 4, стр. 55.
- 4.
Садыков Ш.Б., Бекмухамедова А.С., Садыкова А.Ш. Особенности воздействия различных антропогенных факторов среды на иммунные системы человека и животных // Проблемы медицинской экологии: Сборник. statei (Проблемы медицинской экологии: Сборник статей), Караганда, 1995, т.2, стр. 70.
Google Scholar
- 5.
Байзеркин Б.С. Особенности воздействия радиоактивного радона на здоровье жителей Акчатау // Пробл. Соц. Med. Управл. Здравоохр. , 1996, нет. 3, стр. 41.
- 6.
Козаченко Н.В., Организация массового иммунологического обследования населения с применением комплекса микрометодов: Методические рекомендации.Здравоохр. Каз. ССР, 1987.
Google Scholar
- 7.
Лебедев К.А. , Понякина И.Д. Оценка иммунологического статуса человека в изменившейся среде (экологическая иммунология), Физиол. Chel. , 1992, т. 18, нет. 5, стр. 72.
Google Scholar
- 8.
Петров Р.В. Проблемы иммунологии и перспективы ее развития, БМЕ, 1988, с.282.
Иммунограмма для индивидуальной оценки противоопухолевого иммунного ответа у пациентов с гепатоцеллюлярной карциномой., Frontiers in Oncology
В клинической практике цикл рака-иммунитета отдельного пациента с гепатоцеллюлярной карциномой (ГЦК) должен быть описан для поддержки клинического лечения рака. В настоящем исследовании изучались иммунограммы пациентов с раком печени на основе данных секвенирования РНК печени для визуального отображения индивидуализированных циклов рака-иммунитета.Две независимые когорты ГЦК [Атлас генома рака (TCGA) и когорты ГЦР по раку печени-RIKEN, Япония (LIRI-JP)] с данными полного секвенирования экзома (WES), данными секвенирования РНК и клиническими данными от TCGA и Международного консорциума по раковым геномам (ICGC) были включены в это исследование. В этом исследовании были построены иммунограммы раковых иммунных клеток по ГЦК для визуального изучения противоопухолевых иммунных ответов пациентов с ГЦК. Паттерны иммунограмм ГЦК были разделены на два кластера: горячие и холодные иммунограммы ГЦК.Благоприятная общая выживаемость (OS) и выживаемость без признаков заболевания (DFS) наблюдались в кластере горячей иммунограммы в когорте TCGA. Результаты для когорты LIRI-JP были аналогичны когорте TCGA. ОС пациентов с ГЦК, представленных на горячей иммунограмме, была больше, чем у пациентов с холодовой иммунограммой в когорте LIRI-JP HCC. По сравнению с холодовыми иммунограммами, горячие иммунограммы характеризовались более высоким уровнем инфильтрации иммунных клеток и более сильными иммунными сигнатурами, включая цитолитическую активность, сигнатуру IFN-γ, иммуностимулятор, иммуноингибитор, хемокин, молекулу адгезии, MHC I, MHC II и некласс MHC. уровни.Основное различие в молекулярных характеристиках между горячей и холодной иммунограммами было отражено в изменениях WNT-CTNNB1 и вариантах числа копий (CNV) и потере гетерозиготности (LOH), которые представляют собой молекулярные особенности, связанные с устойчивостью к иммунотерапии и ускользанием опухоли. Паттерны иммунограммы отличались с точки зрения различных молекулярных особенностей опухолей ГЦК. Иммунограмма ГЦК для рака-иммунного цикла позволила визуализировать индивидуальный противоопухолевый иммунный ответ пациентов с ГЦК, а характер иммунограмм ГЦК способствовал клиническим исходам пациентов, что может облегчить индивидуальную оценку противоопухолевого иммунного ответа для оптимальная индивидуальная иммунотерапия.
中文 翻译 :
用于 肝细胞癌 患者 抗 肿瘤 免疫 反应 的 个体 化 评估 的 免疫 图。临床 中 , 描述 单个 肝细胞癌 (HCC) 患者 的 癌症 免疫 周期 , 的 临床 管理。 本 研究 的 肝癌免疫 周期。 两个 独立 的 HCC 队列 [癌症 基因 组 图谱 (TCGA) 和 日本 肝癌 -RIKEN (LIRI-JP) HCC 队列] , 具有 完整 显 子 组 测序 (WES) 数据 , RNA 测序 数据 以及 TCGA 和基因 组 联合会 的 临床 数据 (ICGC) 参加 了 这项 研究。 这项 研究 构建 了 的 的 HCC 免疫 , 以 可视 HCC 的 抗癌 免疫 反应 。HCC 免疫 谱图 模式 模式 分为: 冷热 HCC 图。 TCGA 队列 中 的 热 免疫 图 簇 中 观察 到 总体 生存 ((OS) 和 无 病 生存 (DFS) 良好 LIRI-JP 研究 组 TCGA 研究 组 相似。在 LIRI-JP HCC 中 , 具有 热 免疫 的 HCC 患者 的 OS 比 具有 冷 免疫 的 患者 更长。 与 冷 免疫 图 , 免疫强 , 包括 溶 细胞 活性 , IFN-γ 信号 , 免疫 刺激 剂 , 抑制剂 趋 子 , 粘附 分子 , MHC I , MHC II 和 非 MHC 类 水平 。WNT-CTNNB1 变异 和 ( ) 杂 合度 (LOH) 评分 的 损失 反映 了 冷热 免疫 图 之间 分子 特征 的 主要 差异 , 这些 是 与 免疫 和 肿瘤 特征子 特征。 图谱HCC 的 ,.进行 个体 化 评估 最佳 个性 化 免疫 疗法。
Реферат 4574: Комбинирование мультимодальных биомаркеров в качестве иммунограммы для использования в иммунотерапии: подтверждение концепции
Труды: Ежегодное собрание AACR 2019; 29 марта — 3 апреля 2019 г .; Atlanta, GA
Abstract
Наше недавнее понимание вклада иммунной системы в борьбу с раком глубоко изменило стандарты ухода за онкологическими больными.Например, иммунотерапия с помощью ингибиторов иммунных контрольных точек (ICI) против PD1 / PDL1 в настоящее время одобрена при нескольких показаниях к раку, таких как немелкоклеточный рак легкого или меланома. Однако ICI менее эффективны при других показаниях с высокой заболеваемостью, таких как колоректальный рак (CRC). Здесь неоднородность, а также относительно низкая степень ответа пациента на эти иммунотерапевтические методы подчеркнули, что факторы, присутствующие в микроокружении опухоли (TME), могут ограничивать или повышать эффективность лечения.В этом контексте всесторонняя оценка этих факторов может иметь ключевое значение для стратификации пациентов и позволить выбрать оптимальное лечение.
Чтобы помочь клиническим исследователям и биофармацевтическим компаниям измерить вклад иммунной системы в эффективность лекарств, HalioDx разработала «Иммунограмму рака», решение, основанное на Blank CU et al . Наука (2016). Наш многопараметрический подход, охватывающий уникальный набор тестов иммунной оценки, основан на анализе и понимании иммунного контекста опухолей и предлагает персонализированный и динамический «отпечаток пальца» взаимодействия опухоли с иммунной системой.
Здесь мы предоставляем доказательство концепции иммунограммы рака в контексте CRC путем объединения следующих технологий и биомаркеров: мутационная нагрузка опухоли (чужеродность опухоли), дефицит восстановления несоответствия ДНК (MSI), секвенирование TCR (клональность Т-клеток) ), Immunoscore® Colon (инфильтрация иммунных клеток), Immunosign® (чувствительность опухоли к иммунным эффекторам), Halioseek® PDL1 / CD8, Панель истощения Т-клеток Brightplex (контрольные точки иммунитета) и панель Brightplex MDSC и обнаружение Treg (подавление иммунитета).Мы показываем, что иммунограмма рака позволяет идентифицировать специфические паттерны пациента, которые могут улучшить прогноз ответа на терапию. Мы считаем, что иммунограмма рака поможет исследователям и клиницистам персонализировать лечение, чтобы улучшить результаты лечения пациентов и их реакцию на лечение рака.
Формат цитирования: Томас Сбаррато, Люси Судре, Лоран Ванхилль, Пернел Ауттерс, Михаэла Ангелова, Бернхард Млечник, Анджела Васатуро, Габриэла Биндеа, Тесса Фредриксен, Люси Лафонтен, Даниэла Бруни Галон, Джер.Комбинирование мультимодальных биомаркеров в качестве иммунограммы для руководства использованием иммунотерапии: доказательство концепции [аннотация]. В: Материалы ежегодного собрания Американской ассоциации исследований рака, 2019 г .; 29 марта — 3 апреля 2019 г .; Атланта, Джорджия. Филадельфия (Пенсильвания): AACR; Cancer Res 2019; 79 (13 Suppl): Abstract № 4574.
- © Американская ассоциация исследований рака, 2019 г.
- 1.