Особенности анемического синдрома у пациентов пожилого возраста
Анемия — клинико-гематологический синдром, характеризующийся уменьшением
содержания в единице объема крови гемоглобина, чаще при одновременном
уменьшении количества эритроцитов, что приводит к развитию кислородного голодания
тканей.
За критерий анемии принято считать снижения уровня гемоглобина ниже 130 г/л
и количества эритроцитов ниже 4 × 1012 /л у мужчин и, соответственно, ниже 120 г/л и 3,5
× 10 12/л у женщин.
Анемии наблюдаются у 2-20 % населения Земли, однако следует подчеркнуть разную
частоту развития этого синдрома у пациентов в различные периоды жизни. Необходимо
учитывать значительное увеличение частоты анемического синдрома у пациентов
старших возрастных групп. У лиц старше 65 лет распространенность анемии состовляет
90,3 на 1000 жителей у мужчин и 69,1 на 1000 у женщин. В возрасте старше 85 лет анемия
выявляется у 27-40 % мужчин и у 16-21 % женщин.
Распространенность анемий в значительной степени зависит от региона, социально –
Известны половые различия в частоте встречаемости анемии. У пациентов пожилого и
старческого возраста разница в частоте анемий снижается, и этот синдром встречается
примерно одинаково у пожилых мужчин и женщин.
В большинстве случаев анемии – не самостоятельное заболевание, а симптом,
проявления другого заболевания.
У пациентов старших возрастных групп значительно повышается частота заболеваний,
которые могут приводить к развитию анемий. Впрочем, у пожилых пациентов, как и у
молодых, развитие анемий, наиболее часто связано с кровопотерей. При этом источник
во многом связано с уменьшением плацдарма всасывания веществ, участвующих в
гемопоэзе, например, железа, витамина В 12. Всасывание нарушается при хроническом
гастрите (прежде всего, атрофическом), энтеритах различного происхождения, после
резекции участков тонкого кишечника или резекции желудка по типу Бильрот II с
выключением двенадцатиперстной кишки и других заболеваниях.
 Принципиально
Принципиальноважным является понимание резкого увеличения у больных пожилого и старческого
В гериатрической практике наиболее часто встречаются 3 варианта анемий:
— железодефицитная
— В12 –дефицитная
— анемия хронических заболеваний.
В то же время, у пожилых пациентов могут встречаться все виды анемий, однако,
наследственные формы встречаются чрезвычайно редко.
Зачастую анемии имеют сложный генез, например, часто наблюдается сочетание
железодефицитной и В 12- дефицитной анемии. У пациентов старших возрастных групп
чаще всего имеется одновременно несколько причин для развития анемий, например,
нарушение всасывания железа, кровопотеря, хронический воспалительный процесс,
развившейся почечной недостаточностью, а также хроническая сердечная
недостаточность (ХСН), как следствие, ишемической болезни сердца(ИБС) и др.

Важно отметить влияние анемии на течение целого ряда заболеваний внутренних
органов, встречающихся, преимущественно, у пожилых пациентов. Наиболее изученным
является анемический синдром при заболеваниях сердечно-сосудистой системы.
Выявлено, что у пациентов с ХСН с низким уровнем гемоглобина возрастает риск смерти.
В тоже время, снижение уровня гемоглобина способствует развитию ХСН. Так, гипоксия,
Основными причинами развития анемии у больных ХСН являются увеличенный объем
плазмы крови, дисфункция костного мозга, дефицит железа, снижение выработки
эритропоэтина, активация цитокинов, в частности фактора некроза опухоли.
У больных инфарктом миокарда при сопутствующей анемии выявлен высокий уровень
смертности и выход на ХСН.
По мнению большинства исследователей, снижение уровня гемоглобина у пациентов
старших возрастных групп чаще всего развивается именно вследствие патологических
процессов.

Так же необходимо обратить пристальное внимание на сопутствующую патологию,
которая может обостриться.
Зав. консультационного отделения врач-гематолог Рачкова Татьяна Аркадьевна
Анемия у ребенка. Причины и диагностика
Детскому растущему организму крайне важно насыщать клетки кислородом. Кислород передвигается по организму при помощи гемоглобина — белка, состоящего из железа. При дефиците железа у ребенка снижается уровень гемоглобина, что соответственно приводит к недостатку кислорода в клетках и тканях. Данное состояние принято называть железодефицитной анемией. При хронической анемии у ребенка возникает задержка физического и нервно-психического развития. Тяжелые формы анемии встречаются у детей все реже, но даже при небольшом снижении питания клеток возникают симптомы слабости мышц, головокружения, апатии, снижения иммунитета и нарушений сердечно-легочных функций.
Самое страшное в анемии — ее бессимптомное течение. Поэтому важно регулярно посещать врачей и сдавать общий анализ крови как ребенку, так и любому взрослому человеку.
Поэтому важно регулярно посещать врачей и сдавать общий анализ крови как ребенку, так и любому взрослому человеку.
Причины
Основной причиной железодефицитной анемии, согласно данным Всемирной организации здравоохранения, считается несбалансированное питание. Реже состояние может возникать при кровотечениях, врожденных нарушениях обмена веществ и глистных инвазиях.
Основные причины анемии, которые наиболее часто встречаются во врачебной практике:
1. Врожденный дефицит железа.
2. Неправильное питание.
3. Скачок роста и развития, которые требуют повышенного содержания железа в организме.
4. Повышенная потеря железа из организма.
5. Недостаточное потребление железа с пищей.
6. Снижение всасываемости железа.
7. Увеличенная потеря железа из-за повреждения кишечника вследствие раннего введения в прикорм коровьего молока и кефира (родителям необходимо обратить на этот пункт особое внимание!).
Диагностика
Заподозрить анемию у ребенка можно по следующим признакам:
- снижение уровня эритроцитов (ниже 3,8×1012/л)
- снижение цветового показателя (менее 0,85)
- снижение показателей ретикулоцитов (на начальных стадиях могут оставаться в норме)
- анизоцитоз или пойкилоцитоз
Также могут измениться такие показатели, как средний объем эритроцита, его концентрация и т. д.
Следует отметить, что в каждом организме имеется своеобразное «депо железа». При недостатке этого вещества, железо в первую очередь расходуется из указанного «депо». В связи с этим, общий анализ крови может не выявить анемию на начальных стадиях, поэтому рекомендуется проведение биохимического исследования. Биохимический анализ крови позволяет выявить различные фракции железа, снижение уровня которых и станет сигналом о наличии железодефицитной анемии.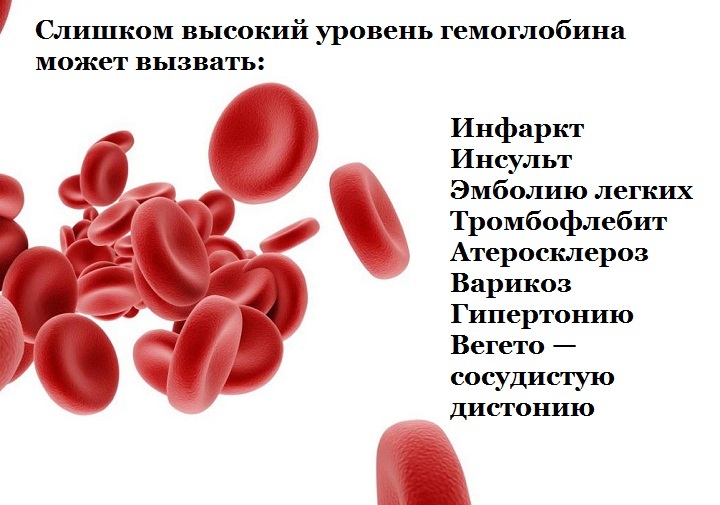
Основная мера профилактики патологии — обеспечение ребенку правильного сбалансированного питания. Для этого родители должны позаботиться о том, чтобы детский рацион содержал достаточное количество продуктов с высоким содержанием железа.
Мясо рекомендуется вводить уже на стадии первого-второго прикорма. Мамам в период грудного вскармливания необходимо контролировать уровень железа не только у ребенка, но и у себя. Особенно это касается матерей, у которых при беременности диагностировалась железодефицитная анемия. В некоторых случаях, когда вероятность железодефицитной анемии высока, первый прикорм может начинаться не с каш или овощей, а именно с мяса. Ведь железо — это одна из основных составляющих нормального развития ребенка.
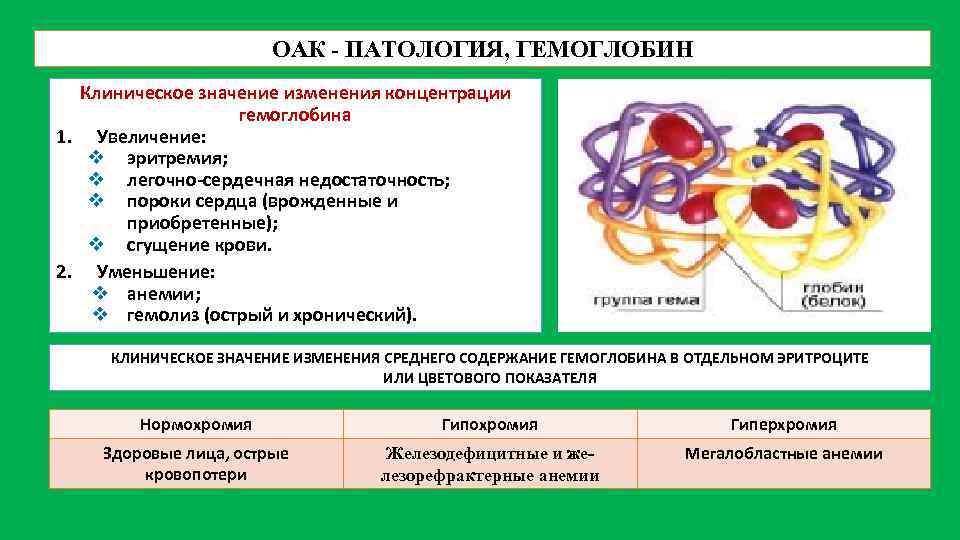
Железодефицитные анемии (ЖДА).Причины, клинические и лабораторные проявления ЖДА.
Железодефицитные анемии – гипохромные анемии, при которых организм оказывается в условиях дефицита железа (Fe). Содержание железа снижается в костном мозге, тканях, сыворотке крови и депо.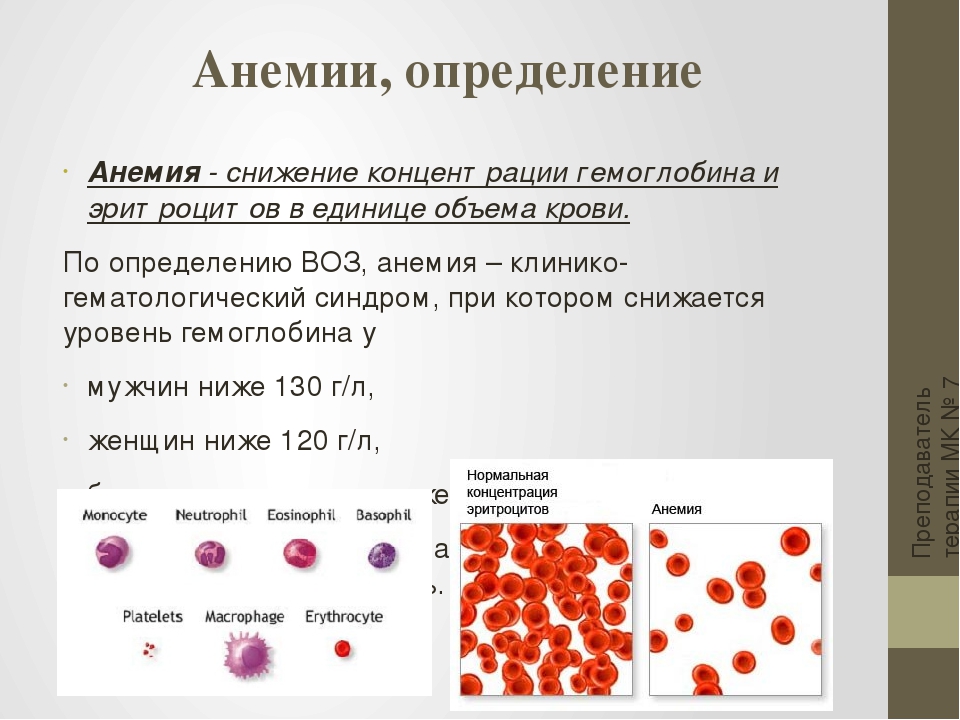
В среднем в организме человека имеется 4,5 г железа. Железо находится в соединении с белками:
1) 60% содержится в составе гемоглобина и называется гемовое или геминовое Fe — это функциональное железо. Функция гемоглобина состоит в переносе кислорода от легких к тканям. Геминовое Fe входит в состав миоглобина, цитохромов, каталазы, лактопероксидазы.
2) Белки, содержащие железо запасов – это ферритин и гемосидерин. Ферритин водорастворимый белок, содержащий 20% 3-х валентного железа.Его много в печени,мышцах, костном мозге, селезенке; немного – в плазме.
Гемосидерин – нерастворимый в воде белок, производное ферритина, еще больше содержит 3-х валентного железа (около 30%).
3) Белок, содержащий транспортное Fe – трансферин, относится к b-глобулинам, синтезируется в печени и переносит Fe в нужное место. Трансферин на 1/3 связан с железом и 2/3 в свободном состоянии. Сколько могут связать эти 2/3 и определяется как общая железосвязывающая способность (ОЖСС).
Трансферин на 1/3 связан с железом и 2/3 в свободном состоянии. Сколько могут связать эти 2/3 и определяется как общая железосвязывающая способность (ОЖСС).
% распределение Fe в организме человека:
— в составе эритроцитов и эритрокариоцитов костного мозга – 65%
— тканевое железо – 15%
— Fe запасов – 20%
— транспортное Fe – 0,1-0,2%
Суточная потребность: мужчины – 1 мг в сутки
женщины – 2-3мг в сутки
В сутки поступает 12-15 мг Fe, а всасывается 5-10% (0,75-1,5 мг). Через желудочно-кишечный тракт естественным путем может всосаться 2,5 мг Fe. Лучше всего усваивается Fe – гема, которым богаты мясные продукты: телятина, печень.
Причины железодефицитных анемий (общие):
— потери железа больше, чем в норме
— недостаточное поступление железа
— повышенный расход железа
1) потери Fe – кровопотери, небольшие по объему, но постоянные и длительные. Чаще всего страдают женщины (менструации, роды, аборты, лактация). Потеря 2 мл крови » 1 мг Fe. Женщина за менструацию не должна терять больше 60 мл крови – считают гематологи. Гинекологи считают, что женщина может терять 100- 200 мг. При больших кровопотерях у женщин потребность железа до 3 мг в сутки. 30-40% женщин репродуктивного возраста имеют ЖДА, а каждая 2-я – латентный период дефицита железа. Во время беременности – суточная потребность железа до 3,5 мг.
Чаще всего страдают женщины (менструации, роды, аборты, лактация). Потеря 2 мл крови » 1 мг Fe. Женщина за менструацию не должна терять больше 60 мл крови – считают гематологи. Гинекологи считают, что женщина может терять 100- 200 мг. При больших кровопотерях у женщин потребность железа до 3 мг в сутки. 30-40% женщин репродуктивного возраста имеют ЖДА, а каждая 2-я – латентный период дефицита железа. Во время беременности – суточная потребность железа до 3,5 мг.
У мужчин кровопотери в основном из ЖКТ (эррозии, дивертикулы, грыжи, язвы, геморрой).
Железодефицитные анемии возникают при хронических носовых, десневых кровотечениях, при гематурии.
Ятрогенные потери железа:
1) донорство ( у мужчин доноров потребность Fe – 3-3,8 мг/сут, у женщин – 3,7-5,3 мг/сут). После каждой сдачи крови рекомендуется 2 недели принимать препараты железа.
2) экстракорпоральные очищения крови (гемодиализ и др.)
Потери в замкнутой полости:
1) эндометриоз, не связанный с полостью матки ( в толще стенки матки и других органов формируются полости; в эти полости при менструации выбрасыватся кровь, кровь всасывается, а Fe превращается в гемосидерин (не растворимый в воде), который не всасывается.
2) в кистах (такой же механизм)
3) изолированный легочный сидероз (формирование полостей; происходит так же, как при эндометриозе).
У детей первого года жизни, младшего возраста,подростков наблюдается дефицит железа (связано с недостаточным исходным уровнем Fe).
Если не удается найти источника потери Fe, железодефицитная анемия называется эссенциальной или идиопатической (но до тех пор, пока не обнаружится источник кровопотери).
Линические проявления ЖДА.
* симптомы гипоксии (бледность без признаков эктерии, слабость, головокружения, сердцебиение, одышка, обмороки)
*симптомы сидеропении:
— секутся и выпадают волосы
— ногти становятся ломкими, изменения формы ногтей (выпуклость может смениться уплощением и даже вогнутостью)
— появляются трещины в углах губ (заеды)
— глоссит, атрофия сосочков языка
— извращения вкуса и запаха (больным нравится мел, зубной порошок, запах бензина, выхлопных газов, ацетона и др.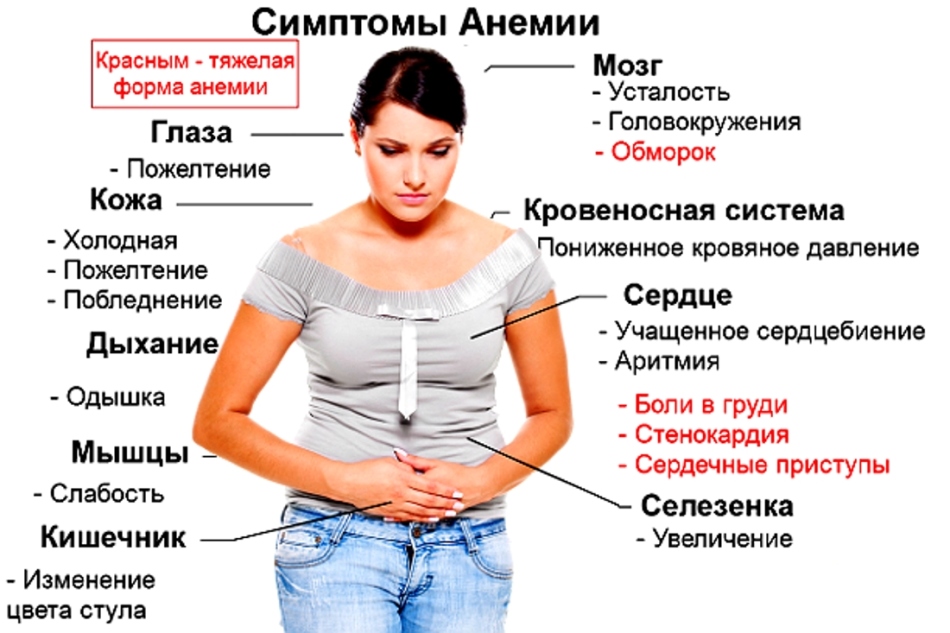 )
)
— мышечная слабость (при кашле, чихе непроизвольное мочеиспускание; у девочек ночное недержание мочи).
Лабораторные проявления ЖДА.
— снижение гемоглобина
— низкий цветовой показатель
— эритроциты в норме или близко к норме
— снижение содержания гемоглобина в одном эритроците МСН
— снижение концентрации гемоглобина в эритроците МСНС
— гипохромия, анизоцитоз ( в сторону микроцитоза), в тяжелых случаях –пойкилоцитоз
— может быть ретикулоцитоз
— снижено сывороточное железо
— ОЖСС повышена
— содержание ферритина понижено.
Ломанова Л.В.
Ответы на самые распространенные вопросы — Into-Sana
Какой уровень гемоглобина у ребенка считается нормой? В чем причины его снижения? Какие продукты помогут нормализовать гемоглобин? Какие причины анемии, и как их определить? На эти и другие вопросы отвечает специалист клиники Into-Sana, врач-педиатр Чехун Наталья Николаевна.
Какой уровень гемоглобина у ребенка считается нормой?
При определении нормы уровня гемоглобина имеет значение возраст ребенка. Например, у новорожденного уровень гемоглобина 130 г/л и выше – это норма. Для 3-месячного ребенка нормой будет 100 г/л и выше. У ребенка 1–3 лет нормой считается 110 г/л и выше, 4–12 лет –115 г/л и выше, 12–16 лет – 120 г/л и выше.
Каковы причины снижения уровня гемоглобина?
Причин анемии (снижения уровня гемоглобина) у детей очень много. Описать все их в рамках подобной статьи невозможно, поэтому просто перечислим основные.
Условно причины анемии можно разделить на такие группы:
1. Нарушения поступления в организм веществ, необходимых для синтеза гемоглобина – железа, например:
- Нерациональное питание, особенно у детей первого года жизни. Лучшей пищей для грудничков является, несомненно, грудное молоко. Вскармливание детей первого года жизни коровьим или козьим молоком может вызвать анемию, поэтому при невозможности грудного вскармливания лучше использовать адаптированные детские смеси, они, кроме прочего, обогащены железом.

- Некоторые специфические заболевания органов ЖКТ: гастриты, энтериты, язвенная болезнь желудка и 12-ти перстной кишки, при которых может нарушаться усвоение железа из пищи.
- Недостаточность витамина В12 в организме может вызывать снижение гемоглобина, так как этот витамин участвует в переносе железа из кишечника в кровь.
2. Также анемия может развиваться при избыточном разрушении эритроцитов.
- При острых или хронических отравлениях некоторыми ядовитыми веществами (змеиные яды, некоторые грибы, угарный газ, кислоты и щелочи, а так же тяжелые металлы, анилин и другие органические вещества, соединения мышьяка, и т.д.).
- При заболеваниях, связанных с разрушением эритроцитов – наследственная серповидно-клеточная анемия, некоторые заболевания селезенки. А также некоторые инвазии.
3. Причинами снижения уровня гемоглобина могут стать кровотечения различного генеза.
- Острые кровотечения – последствия травм или операций.

- Хронические, незначительные по объему, но частые кровотечения. Например, у девочек в пубертатном периоде снижение гемоглобина может быть при обильных или длительных менструациях. Другой пример – заболевания желудка, 12-ти перстной кишки, толстого кишечника, при которых также возможны небольшие, но частые кровотечения.
4. Относительно редкой, но от этого не менее опасной причиной снижения гемоглобина является угнетение кроветворения. Происходит это чаще всего при опухолевых заболеваниях крови (лейкозы и им подобные), когда в кроветворных органах патологический опухолевый клон клеток вытесняет нормальное кроветворение.
Каковы последствия пониженного гемоглобина?Последствия пониженного гемоглобина – это кислородное голодание всех органов и систем организма, и в результате этого развитие дистрофических, иногда даже необратимых изменений в органах и тканях. Страдает больше всего сердце, головной мозг, кожа. Появляются усталость, утомляемость, головокружения и т. д.. Снижается иммунитет.
д.. Снижается иммунитет.
Устранение причины снижения гемоглобина обязательно приведет к нормализации его уровня. Конечно же, если причина была в недостатке поступления железы с пищей, то именно продукты питания и рациональный прием пищи обеспечат ребенку нормальный уровень гемоглобина в крови. Наибольшее содержание железа находится в мясе кролика, говядине, нежирной свинине. Также относительно богаты железом овощи, фрукты, крупы. Поэтому в рационе ребенка должны присутствовать такие продукты: мясо и рыба, злаки и каши, молоко и кисломолочные продукты, овощи и фрукты.
В каких случаях одного питания недостаточно и необходимо потребление лекарственных препаратов? Когда показано применение препаратов железа? И что делать, если есть непереносимость железа?
Лечение анемии зависит от ее причины и механизма развития. Не установив причину, нет смысла начинать лечение, иначе симптомы болезни быстро вернутся. Когда анемия связана с затруднениями усвоения железа из пищи (заболевания желудка или кишечника), или когда недостаток железа в организме слишком велик, прибегают к железосодержащим лекарственным препаратам. Ориентируется врач при этом обычно на уровень гемоглобина. Препараты железа необходимы при развитии анемии средней степени тяжести, т.е. когда уровень гемоглобина составляет 70-90 г/л, если анемия легкой степени тяжести, гемоглобин при этом 90–110 г/л (не забываем учитывать возраст ребенка), можно ограничиться устранением причины анемии и нормальным питанием.
Не установив причину, нет смысла начинать лечение, иначе симптомы болезни быстро вернутся. Когда анемия связана с затруднениями усвоения железа из пищи (заболевания желудка или кишечника), или когда недостаток железа в организме слишком велик, прибегают к железосодержащим лекарственным препаратам. Ориентируется врач при этом обычно на уровень гемоглобина. Препараты железа необходимы при развитии анемии средней степени тяжести, т.е. когда уровень гемоглобина составляет 70-90 г/л, если анемия легкой степени тяжести, гемоглобин при этом 90–110 г/л (не забываем учитывать возраст ребенка), можно ограничиться устранением причины анемии и нормальным питанием.
причины падения и правила подъема
9 месяцевЗдоровье
Во время беременности в организме женщины происходит ряд изменений, которые влияют на содержание гемоглобина в крови, и, как правило, он снижается. Вот только что считается нормой, а что патологией? Важно разобраться в этом вопросе, ведь гемоглобин переносит кислород и при его недостатке у малыша может развиться кислородное голодание.
Гемоглобин – это белок, который содержится в красных кровяных клетках (эритроцитах) и выполняет так называемую дыхательную функцию. Гемоглобин, связывая кислород, переносит его к органам и тканям и забирает из них углекислый газ. Он представляет собой сложный белок, в состав которого входит железо.
Нормальное содержание гемоглобина в крови здоровой женщины до беременности составляет в среднем 120–140 г/л. Во время нормально протекающей беременности в организме женщины происходит ряд изменений, которые влияют на содержание гемоглобина в крови. В первые же недели после зачатия начинается увеличение объема циркулирующей крови в организме будущей мамы, которое достигает своего максимума примерно к 36-й неделе. Увеличение объема крови происходит в основном за счет жидкой части крови (плазмы крови), которой становится больше примерно на 35–47 %. Количество клеточных элементов, в том числе и эритроцитов – клеток крови, содержащих гемоглобин, при этом также возрастает, но всего на 11–30 %. Поскольку увеличение объема плазмы значительно превышает количество эритроцитов, концентрация гемоглобина снижается и возникает так называемая физиологическая анемия беременных.
Поскольку увеличение объема плазмы значительно превышает количество эритроцитов, концентрация гемоглобина снижается и возникает так называемая физиологическая анемия беременных.
Причины снижения гемоглобина
Основной причиной снижения уровня гемоглобина во время беременности является недостаточное поступление с пищей железа.
Потребности в железе в период вынашивания малыша значительно увеличиваются. Оно расходуется на формирование тканей плода, его кроветворной системы, построение плаценты, а также на увеличение мышцы матки в течение беременности. Наиболее активные потери железа начинаются в 16–20 недель беременности, что совпадает с периодом начала процесса кроветворения у плода. Если запасы железа в организме будущей мамы истощены, развивается железодефицитная анемия беременных. Чаще она возникает во втором-третьем триместрах беременности. Однако бывают ситуации, когда снижение количества гемоглобина выявляется уже в первом же анализе крови, взятом при постановке будущей мамы на учет в женской консультации. Это говорит о том, что анемия возникла еще до беременности в связи с недостаточным поступлением железа, плохим его всасыванием или активным разрушением эритроцитов в организме.
Это говорит о том, что анемия возникла еще до беременности в связи с недостаточным поступлением железа, плохим его всасыванием или активным разрушением эритроцитов в организме.
Кроме дефицита железа, в редких случаях причинами снижения гемоглобина могут быть совсем другие состояния: к примеру, дефицит витамина В12, фолиевой кислоты, наследственные заболевания, состояния, при которых организм вырабатывает белки, разрушающие собственные эритроциты, сильное кровотечение.
Особенно часто анемией страдают женщины, вынашивающие второго или третьего малыша.
Как проявляется снижение гемоглобина?
В норме гемоглобин во время беременности снижается постепенно и чаще всего не сопровождается какими-то очевидными проявлениями. Даже при развитии анемии симптомы могут быть столь незначительны, что будущая мама их просто не замечает, списывая недомогание на особенности своей беременности.
Основные проявления дефицита железа – это слабость, повышенная утомляемость, женщину могут беспокоить шум в ушах и головокружения, одышка при физической нагрузке, отмечаются ломкость ногтей и волос, сухость и бледность кожи, извращение вкуса (желание есть мел, песок, зубную пасту и другие несъедобные вещи) или возникает тяга к запахам краски, ацетона, бензина.
прогностическое значение, причины, возможности лечения uMEDp
Эпидемиологические исследования свидетельствуют о важной роли гемоглобина в патогенезе, прогнозе и осложнениях сердечно-сосудистых заболеваний. В последнее десятилетие активно изучаются возможности лечения анемии у больных ХСН [1].
У больных с ХСН анемия встречается чаще, чем в популяции в целом, и ее распространенность, по данным различных авторов, колеблется от 15 до 61% [2–4]. Снижение уровня гемоглобина является независимым фактором, повышающим смертность и частоту госпитализаций у пациентов с острой и хронической сердечной недостаточностью [5–7]. По данным ретроспективного анализа исследования Val-HeFT, у пациентов со снижением уровня гемоглобина в течение 12 месяцев наблюдения отмечалась более высокая частота повторных госпитализаций, осложнений и смерти по сравнению с пациентами без снижения уровня гемоглобина. Также было показано, что увеличение гемоглобина приводило к снижению смертности в обеих группах [8].
По данным исследования PRAISE, снижение уровня гематокрита на 1% приводило к увеличению риска смерти пациентов с ХСН на 11% [9]. По результатам анализа, проведенного в Канаде у обследованных 12 065 пациентов, анемия была выявлена в 17% случаев [10], при этом коэффициент риска смерти у пациентов с анемией в этом исследовании составил 1,34. Частота анемии у 2653 пациентов, рандомизированных в исследование CHARM в Канаде и США, составила 27% у пациентов с сохраненной и 25% у пациентов со сниженной фракцией выброса левого желудочка [11]. По данным метаанализа связи анемии и смертности пациентов с ХСН, проведенного в 2008 г., в который вошло всего 34 исследования, включавших 153 180 пациентов [12], распространенность анемии у пациентов с ХСН составила 37,2%.
В исследовании конечных точек у пациентов с анемией и ХСН, проведенном M. Kosiborod и соавт. [13], риск смерти оказался еще более высоким. У пациентов со снижением уровня гематокрита менее 24% риск смерти увеличивался на 51%, а риск повторных госпитализаций возрастал на 17%. Развитие анемии у больных с ХСН ассоциировано с усугублением тяжести течения заболевания, ухудшением функционального класса сердечной недостаточности, увеличением массы миокарда левого желудочка и частоты осложнений [11]. S.G. Alan и соавт. в 2006 г. была прослежена связь уровня гемоглобина с количеством осложнений у пациентов с ХСН [6]. Было обследовано 59 772 пациента. Пациенты делились на группы по уровню гемоглобина с шагом в 10 г/л. Было выявлено, что уже начиная со 130 г/л количество осложнений и повторных госпитализаций увеличивается, также высоким оказался риск осложнений у пациентов с уровнем гемоглобина более 170 г/л.
Развитие анемии у больных с ХСН ассоциировано с усугублением тяжести течения заболевания, ухудшением функционального класса сердечной недостаточности, увеличением массы миокарда левого желудочка и частоты осложнений [11]. S.G. Alan и соавт. в 2006 г. была прослежена связь уровня гемоглобина с количеством осложнений у пациентов с ХСН [6]. Было обследовано 59 772 пациента. Пациенты делились на группы по уровню гемоглобина с шагом в 10 г/л. Было выявлено, что уже начиная со 130 г/л количество осложнений и повторных госпитализаций увеличивается, также высоким оказался риск осложнений у пациентов с уровнем гемоглобина более 170 г/л.
При изучении смертности у госпитализированных пациентов с сердечной недостаточностью и сохраненной систолической функцией левого желудочка среди 210 больных анемия была выявлена у 46%. Продолжительность госпитализации пациентов с анемией оказалась достоверно выше, а риск смерти выше в 2,7 раза [14]. В исследовании, проведенном среди амбулаторных больных [7], частота анемии при ХСН составила 17,2%. Больные с исходной анемией имели значительно худший 3-летний прогноз, чем лица без анемии: общая смертность составила 47% и 26% соответственно (р
Больные с исходной анемией имели значительно худший 3-летний прогноз, чем лица без анемии: общая смертность составила 47% и 26% соответственно (р
Причины развития анемии у пациентов с ХСН
Этиология анемии у пациентов с ХСН довольно разнообразна. Возможные патогенетические механизмы развития анемии у пациентов с ХСН [15]:
- гемодилюция;
- нарушение функции почек и снижение продукции эритропоэтина;
- активация цитокинов;
- мальнутриция;
- дисфункция костного мозга;
- дефицит железа;
- эффекты лекарственных препаратов;
- анемия хронических заболеваний.
 В то же время задержка жидкости в организме больного нередко протекает бессимптомно. В исследовании, проведенном A.S. Androne и соавт. [16], смертность у пациентов с гемодилюцией более чем в два раза превышала таковую у больных с другими причинами анемии при ХСН. ХСН часто сочетается с различной степени выраженности хронической почечной недостаточностью (ХПН), которая развивается вследствие почечной вазоконстрикции и ишемии и также может приводить к развитию анемии вследствие уменьшения секреции почками эритропоэтина (ЭПО) [18]. Кардиоренальный синдром развивается вследствие активации симпатической нервной системы РААС и воздействия медиаторов воспаления в ответ на структурное поражение сердечной мышцы при ХСН, что приводит к сужению почечных сосудов, ишемии и в конечном итоге снижению скорости клубочковой фильтрации [19]. Снижение почечного кровотока и усиление реабсорбции натрия в проксимальных почечных канальцах у пациентов с ХСН также способствует, как известно, увеличению объема плазмы и гемодилюции, что, в свою очередь, может приводить к снижению гематокрита и анемии.
В то же время задержка жидкости в организме больного нередко протекает бессимптомно. В исследовании, проведенном A.S. Androne и соавт. [16], смертность у пациентов с гемодилюцией более чем в два раза превышала таковую у больных с другими причинами анемии при ХСН. ХСН часто сочетается с различной степени выраженности хронической почечной недостаточностью (ХПН), которая развивается вследствие почечной вазоконстрикции и ишемии и также может приводить к развитию анемии вследствие уменьшения секреции почками эритропоэтина (ЭПО) [18]. Кардиоренальный синдром развивается вследствие активации симпатической нервной системы РААС и воздействия медиаторов воспаления в ответ на структурное поражение сердечной мышцы при ХСН, что приводит к сужению почечных сосудов, ишемии и в конечном итоге снижению скорости клубочковой фильтрации [19]. Снижение почечного кровотока и усиление реабсорбции натрия в проксимальных почечных канальцах у пациентов с ХСН также способствует, как известно, увеличению объема плазмы и гемодилюции, что, в свою очередь, может приводить к снижению гематокрита и анемии.
Одной из причин анемии при ХСН является дефицит железа [20, 21]. Обычно подобная анемия связана со снижением потребления пищи (сердечной кахексией) [22], синдромом мальабсорбции [23], использованием аспирина в профилактических целях [24, 25]. Дефицит железа при ХСН может быть истинным и функциональным. При истинном дефиците имеет место снижение сатурации трансферрина и ферритина. Функциональный дефицит железа, описанный впервые Eschbach и соавт. в 1987 г., расценивается как состояние, при котором железо высвобождается недостаточно быстро для обеспечения возросших потребностей костного мозга в процессе эритропоэза, несмотря на адекватные общие запасы железа в организме [26], при этом сатурация трансферрина снижается, а уровень ферритина остается нормальным или даже повышенным. Для хронического течения анемии характерны плохая утилизация железа, сниженный синтез эритропоэтина и выраженная активация цитокинов, что встречается у 57% пациентов [10, 27]. Так, развитию анемии способствует повышение уровня фактора некроза опухоли у пациентов с ХСН, которое коррелирует с тяжестью анемии [28].
 Ряд исследований доказывает, что у пациентов с ХСН быстро повышается уровень фактора некроза опухоли альфа (ФНО-альфа), который, в свою очередь, частично ингибирует эритропоэз [29–31].
Ряд исследований доказывает, что у пациентов с ХСН быстро повышается уровень фактора некроза опухоли альфа (ФНО-альфа), который, в свою очередь, частично ингибирует эритропоэз [29–31].У пациентов с ХСН уровень провоспалительных цитокинов увеличивается по мере прогрессирования заболевания и является предиктором неблагоприятного исхода заболевания. Фактор некроза опухоли, интерлeйкин-1 и интерлeйкин-6 оказывают прямое влияние на функцию костного мозга и способствуют развитию анемии хронических заболеваний [4]. Активация ФНО также снижает чувствительность рецепторов к эритропоэтину, нарушает высвобождение и утилизацию железа [29, 32, 33]. A. Bolger и соавт., изучая популяцию больных с тяжелой сердечной недостаточностью, продемонстрировали в своей работе тесную взаимосвязь уровня циркулирующего ФНО, рецепторов ФНО-1, ФНО-2 и других цитокинов с уровнем гемоглобина [34]. Аналогичные соотношения выявлены в результате анализа данных исследования VEST [35]. Кроме того, при развитии анемии у пациентов с ХСН наблюдается увеличение уровня мозгового натрийуретического пептида и C-реактивного белка [8, 36], которые являются маркерами дисфункции левого желудочка и воспалительного статуса соответственно.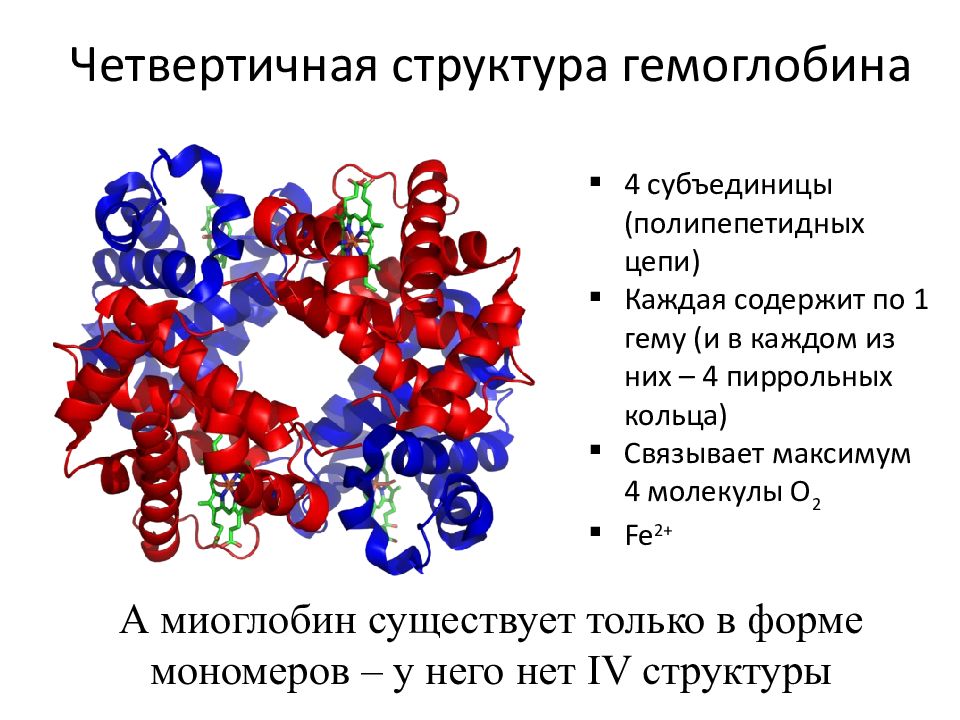
Терапия ингибиторами АПФ может уменьшить концентрацию гемоглобина посредством снижения почечной секреции эритропоэтина [4]. По опыту исследователей программы SOLVD Prevention [37], применение эналаприла повышает риск развития новых случаев анемии у лиц с ХСН в течение 1 года лечения на 56%, причем как у тяжелых больных, так и у пациентов с бессимптомно протекающей дисфункцией левого желудочка. Наиболее часто при ХСН встречается нормоцитарная анемия – до 71% случаев [27], которая у трети больных обусловлена дисфункцией почек с последующим снижением ими секреции эритропоэтина [38], продуцируемого корковым слоем почек, который регулирует синтез эритроцитов и периферическую оксигенацию [39, 40]. Показано, что у больных ХСН снижение уровня данного гормона связано с нарастанием симптомов недостаточности кровообращения [41, 42].
Оптимальное лечение анемии должно основываться на знании механизмов ее развития, однако лишь небольшое количество исследований было посвящено изучению причин анемии у пациентов с сердечной недостаточностью. Одним из них было исследование, проведенное в Греции, в котором изучались причины развития анемии у больных в терминальной стадии ХСН, которым требовалась инотропная поддержка [43]. Было обследовано 37 больных с уровнем гемоглобина ≤ 12 г/л у мужчин и ≤ 11,5 г/л у женщин. Пациенты с почечной недостаточностью не включались в анализ. У 73% пациентов была выявлена железодефицитная анемия, у 5,4% – гемодилюция, у 1 пациента (2,7%) анемия была вызвана приемом эналаприла, и у 18,9% пациентов анемия была классифицирована как анемия хронических заболеваний. Следует отметить, что в данном исследовании гемодилюция признавалась причиной снижения гемоглобина только у пациентов с отсутствием других факторов развития анемии, а в целом в исследовании гемодилюция была выявлена у 33% больных.
Одним из них было исследование, проведенное в Греции, в котором изучались причины развития анемии у больных в терминальной стадии ХСН, которым требовалась инотропная поддержка [43]. Было обследовано 37 больных с уровнем гемоглобина ≤ 12 г/л у мужчин и ≤ 11,5 г/л у женщин. Пациенты с почечной недостаточностью не включались в анализ. У 73% пациентов была выявлена железодефицитная анемия, у 5,4% – гемодилюция, у 1 пациента (2,7%) анемия была вызвана приемом эналаприла, и у 18,9% пациентов анемия была классифицирована как анемия хронических заболеваний. Следует отметить, что в данном исследовании гемодилюция признавалась причиной снижения гемоглобина только у пациентов с отсутствием других факторов развития анемии, а в целом в исследовании гемодилюция была выявлена у 33% больных.
В исследовании, проведенном Opasich и соавт. [27], распределение пациентов с анемией и ХСН по причинам анемии было следующим: 24% – почечная дисфункция, 5% – дефицит железа, 5% – дефицит фолиевой кислоты, 3% – гемодилюция, 5% – талассемия и 57% – анемия хронических заболеваний. По данным Ezekowitz и соавт., среди 2085 пациентов с ХСН и анемией дефицит железа был выявлен в 21% [10], частота анемии хронических заболеваний составила 58%. В одном из ретроспективных анализов [44], проведенном в нашей стране, было выявлено 23,5% пациентов с железодефицитной анемией, 3,9% пациентов с В12-дефицитной анемией, 3,9% с анемией другого генеза, а у 68,6% пациентов генез анемии не был уточнен. В целом эпидемиологические данные об основных причинах анемии у пациентов с ХСН достаточно сильно отличаются в зависимости от выбранных критериев и методов обследования.
По данным Ezekowitz и соавт., среди 2085 пациентов с ХСН и анемией дефицит железа был выявлен в 21% [10], частота анемии хронических заболеваний составила 58%. В одном из ретроспективных анализов [44], проведенном в нашей стране, было выявлено 23,5% пациентов с железодефицитной анемией, 3,9% пациентов с В12-дефицитной анемией, 3,9% с анемией другого генеза, а у 68,6% пациентов генез анемии не был уточнен. В целом эпидемиологические данные об основных причинах анемии у пациентов с ХСН достаточно сильно отличаются в зависимости от выбранных критериев и методов обследования.
Возможности коррекции анемии при ХСН
В настоящее время врачи располагают большим арсеналом лекарственных средств для терапии больных с ХСН. Несмотря на это, уровень смертности и повторных госпитализаций этой категории пациентов остается достаточно высоким. Имеются предположения, что резистентность к лечению во многом обуславливает наличие у пациентов анемии, которая в большинстве случаев остается неоткорригированной [45]. Согласно европейским рекомендациям по лечению сердечной недостаточности [46], применение гемотрансфузий нецелесообразно для лечения анемии при ХСН, терапия препаратами эритропоэтина в сочетании с железом является возможным методом лечения. Проведенные в последние годы исследования показали, что коррекция низкого уровня гемоглобина препаратами эритропоэтина может значительно улучшить сердечную и почечную функции и сокращает количество госпитализаций [1, 47, 48]. В нескольких исследованиях, проведенных европейскими учеными, показано значительное положительное влияние терапии эритропоэтином в сочетании с внутривенным введением железа на течение хронической сердечной недостаточности (снижение частоты госпитализаций, улучшение ФК ХСН, увеличение фракции выброса), что подтверждалось снижением таких лабораторных показателей, как фактор некроза опухоли, мозговой натрийуретический пептид и ИЛ-6 [49–51].
Согласно европейским рекомендациям по лечению сердечной недостаточности [46], применение гемотрансфузий нецелесообразно для лечения анемии при ХСН, терапия препаратами эритропоэтина в сочетании с железом является возможным методом лечения. Проведенные в последние годы исследования показали, что коррекция низкого уровня гемоглобина препаратами эритропоэтина может значительно улучшить сердечную и почечную функции и сокращает количество госпитализаций [1, 47, 48]. В нескольких исследованиях, проведенных европейскими учеными, показано значительное положительное влияние терапии эритропоэтином в сочетании с внутривенным введением железа на течение хронической сердечной недостаточности (снижение частоты госпитализаций, улучшение ФК ХСН, увеличение фракции выброса), что подтверждалось снижением таких лабораторных показателей, как фактор некроза опухоли, мозговой натрийуретический пептид и ИЛ-6 [49–51].
Несмотря на возможные побочные явления, такие как гипертония и вероятность эритропоэтинорезистентности, многие проведенные ранее исследования у пациентов с ХСН и анемией подтверждают эффективность терапии эритропоэтином в снижении гипертрофии левого желудочка и нарастании фракции выброса [52], также у пациентов уменьшалась дисфункция почек и потребность в диуретиках [1, 47, 53]. Эти результаты достигались, несмотря на незначительное увеличение уровня гемоглобина. В большинстве исследований по коррекции анемии участвовали пациенты с выраженными нарушениями функции почек [54]. В наиболее авторитетных исследованиях CHOIR [55] и CREATE [56] приводятся противоречивые результаты. По данным A.K. Singh и соавт. [55], при назначении эпоэтина у пациентов с ХСН с сопутствующей дисфункцией почек при достижении целевого уровня Hb 13,5 г/л повышался риск смерти, ОИМ и инсультов, госпитализаций вследствие ухудшения течения ХСН (CHOIR), чего не было в исследовании CREATE. Не доказана эффективность препаратов эритропоэтина на клинические исходы и в ряде других программ [54, 57]. Так, в крупном рандомизированном плацебоконтролируемом исследовании STAMINA-HeFT не подтвердилась положительная роль дарбопоэтина альфа в улучшении течения ХСН. Было включено 319 пациентов, имеющих симптоматический систолический CHF (ФВ
Эти результаты достигались, несмотря на незначительное увеличение уровня гемоглобина. В большинстве исследований по коррекции анемии участвовали пациенты с выраженными нарушениями функции почек [54]. В наиболее авторитетных исследованиях CHOIR [55] и CREATE [56] приводятся противоречивые результаты. По данным A.K. Singh и соавт. [55], при назначении эпоэтина у пациентов с ХСН с сопутствующей дисфункцией почек при достижении целевого уровня Hb 13,5 г/л повышался риск смерти, ОИМ и инсультов, госпитализаций вследствие ухудшения течения ХСН (CHOIR), чего не было в исследовании CREATE. Не доказана эффективность препаратов эритропоэтина на клинические исходы и в ряде других программ [54, 57]. Так, в крупном рандомизированном плацебоконтролируемом исследовании STAMINA-HeFT не подтвердилась положительная роль дарбопоэтина альфа в улучшении течения ХСН. Было включено 319 пациентов, имеющих симптоматический систолический CHF (ФВ
Для предотвращения развития функционального дефицита железа в процессе лечения эритропоэтином используют препараты железа для парентерального введения. Оказалось, что применение препаратов железа для внутривенного введения вместе с эритропоэтином производит дополнительный эффект, повышая уровень гемоглобина в большей степени, чем при применении одного эритропоэтина, и одновременно позволяет снизить дозу последнего [58]. Применение низких доз эритропоэтина уменьшает вероятность развития гипертензии и позволяет снизить стоимость лечения [59]. Комбинированная терапия эритропоэтином и препаратами железа обеспечивает улучшение сердечной функции, клинической симптоматики и пикового потребления кислорода у пациентов с ХСН и анемией [1, 60]. В то же время лечение только внутривенными препаратами железа способно повышать и поддерживать уровень гемоглобина у пациентов с заболеваниями почек [61]. Есть данные, что пациенты с ХСН во многих случаях имеют повышенный уровень эритропоэтина [41] и поэтому, возможно, нет необходимости в назначении им эритропоэтина. Получены данные о связи увеличения уровня EPO плазмы с неблагоприятным прогнозом у пациентов с ХСН независимо от уровней гемоглобина [62].
Оказалось, что применение препаратов железа для внутривенного введения вместе с эритропоэтином производит дополнительный эффект, повышая уровень гемоглобина в большей степени, чем при применении одного эритропоэтина, и одновременно позволяет снизить дозу последнего [58]. Применение низких доз эритропоэтина уменьшает вероятность развития гипертензии и позволяет снизить стоимость лечения [59]. Комбинированная терапия эритропоэтином и препаратами железа обеспечивает улучшение сердечной функции, клинической симптоматики и пикового потребления кислорода у пациентов с ХСН и анемией [1, 60]. В то же время лечение только внутривенными препаратами железа способно повышать и поддерживать уровень гемоглобина у пациентов с заболеваниями почек [61]. Есть данные, что пациенты с ХСН во многих случаях имеют повышенный уровень эритропоэтина [41] и поэтому, возможно, нет необходимости в назначении им эритропоэтина. Получены данные о связи увеличения уровня EPO плазмы с неблагоприятным прогнозом у пациентов с ХСН независимо от уровней гемоглобина [62]. В связи с этим возникает вопрос: с чем связан успех комбинации эритропоэтина с препаратами железа – с эффектом эритропоэтина или с внутривенным введением железа?
В связи с этим возникает вопрос: с чем связан успех комбинации эритропоэтина с препаратами железа – с эффектом эритропоэтина или с внутривенным введением железа?
К сожалению, крупных рандомизированных исследований по изучению эффективности препаратов железа в качестве монотерапии при анемии у пациентов с хронической кардиальной патологией не проводилось. По результатам менее крупных и нерандомизированных исследований можно сделать вывод о том, что пероральные формы железа для коррекции данного состояния малоэффективны [58]. Поскольку при пероральном приеме железо не может преодолеть ретикулоэндотелиальный блок [63], внутривенное введение железа может быть более эффективным для лечения пациентов с ХСН. В 2006 г. было проведено первое проспективное исследование использования внутривенного железа без эритропоэтина у пациентов [64] с систолической сердечной недостаточностью и уровнем гемоглобина ≤ 12 г/дл и дефицитом железа [65]. Пациентам вводился препарат железа внутривенно болюсно в амбулаторных условиях. Период наблюдения составил 92 ± 6 дней. По результатам исследования наблюдалось увеличение уровня гемоглобина с 11,2 ± 0,7 до 12,6 ± 1,2 г/дл (р = 0,0007), сывороточного железа с 9,2 ± 4,4 до 13,7 ± 4,8 мкмоль/л (р = 0,009), ферритина с 87 ± 113 до 217 ± 185 нг/мл (р = 0,004) и сатурации трансферрина с 16 ± 9,5 до 24,6 ± 8,4% (р = 0,009). По окончании исследования наблюдалось снижение функционального класса сердечной недостаточности, средняя длительность дистанции в 6-минутном тесте увеличилась с 242 ± 78 до 286 ± 72 м (р = 0,01), ФВЛЖ увеличилась с 26 ± 13 до 27 ± 12%.
Период наблюдения составил 92 ± 6 дней. По результатам исследования наблюдалось увеличение уровня гемоглобина с 11,2 ± 0,7 до 12,6 ± 1,2 г/дл (р = 0,0007), сывороточного железа с 9,2 ± 4,4 до 13,7 ± 4,8 мкмоль/л (р = 0,009), ферритина с 87 ± 113 до 217 ± 185 нг/мл (р = 0,004) и сатурации трансферрина с 16 ± 9,5 до 24,6 ± 8,4% (р = 0,009). По окончании исследования наблюдалось снижение функционального класса сердечной недостаточности, средняя длительность дистанции в 6-минутном тесте увеличилась с 242 ± 78 до 286 ± 72 м (р = 0,01), ФВЛЖ увеличилась с 26 ± 13 до 27 ± 12%.
Данное исследование продемонстрировало, что внутривенное введение железа у пациентов с ХСН приводит к значимому увеличению уровня гемоглобина, уменьшению клинической симптоматики и повышению толерантности к физической нагрузке. Эти эффекты были достигнуты без применения препаратов эритропоэтина. Аргентинскими учеными было проведено исследование влияния терапии внутривенным железом на динамику уровней мозгового натрийуретического пептида, С-реактивного белка и качества жизни пациентов с ХСН и железодефицитной анемией [66]. Сорок пациентов с гемоглобином менее 12,5 г/дл, сатурацией трансферрина
Сорок пациентов с гемоглобином менее 12,5 г/дл, сатурацией трансферрина
В основе переносимости физической нагрузки пациентов с ХСН лежат многочисленные механизмы, не связанные с нарушением гемодинамики. Среди них несоответствие доставки кислорода и снижение его использования скелетной мускулатурой при выраженной клинической симптоматике ХСН [67, 68]. Признано, что пациенты с ХСН могут быть склонны к развитию железодефицита вследствие истощения запасов железа, нарушения абсорбции и снижения биодоступности в ретикулоэндотелиальной системе [27, 43]. При железодефицитной анемии снижается доставка кислорода тканям и окислительная способность, в результате уменьшается пиковое потребление кислорода (pVO2) [69–72]. Даже в отсутствие анемии дефицит железа может уменьшать эти показатели [73, 74]. И у пациентов со сниженным гемоглобином, и в отсутствие анемии при железодефиците введение железа корректирует функциональный дефицит. При этом положительное влияние препаратов железа часто превосходит влияние эритропоэтина [69–71, 74, 75].
В исследование FERRIC-HF [76], проведенное в Великобритании и Польше, были включены пациенты II–III ФК ХСН, ФВ ≤ 48%, со сниженным пиковым потреблением кислорода и уровнем ферритина менее 100 нг/л или от 100 до 300 нг/л и сатурацией трансферрина менее 20%. Пациенты изучались в двух группах – с анемией, с уровнем гемоглобина
Небольшое исследование внутривенного введения железа без терапии эритропоэтином было проведено и у пациентов с ХСН и хронической почечной недостаточностью [77]. 32 пациентам с III–IV ФК по NYHA и уровнем гемоглобина
М.В. Мельник, А.М. Шилов, И.Р. Ким и соавт. [79] обследовали 62 больных ХСН с железодефицитной анемией, которым на фоне стандартной терапии ХСН (ингибиторы АПФ, бета-блокаторы, диуретики, сердечные гликозиды) проводилась коррекция дефицита железа путем внутривенного введения Венофера с последующим назначением пероральных препаратов железа. По окончании лечения у пациентов наблюдалось увеличение уровня сывороточного железа на 95,5%, уровня гемоглобина – на 9,8%, получено значительное снижение функционального класса ХСН, увеличение ФВЛЖ и толерантности к физической нагрузке. Можно предположить, что эффекты препаратов железа на сердечную деятельность могут быть связаны не только с увеличением оксигенации при повышении уровня гемоглобина, но также и непосредственно с влиянием на митохондрии и другие клеточные элементы, которым требуется железо, независимо от коррекции анемии.
Можно предположить, что эффекты препаратов железа на сердечную деятельность могут быть связаны не только с увеличением оксигенации при повышении уровня гемоглобина, но также и непосредственно с влиянием на митохондрии и другие клеточные элементы, которым требуется железо, независимо от коррекции анемии.
Хотя истинный дефицит железа присутствует у небольшого количества пациентов с ХСН, функциональный железодефицит, который характеризуется снижением доступности железа из тканевых депо для эритропоэза, нередко встречается в популяции больных ХСН [80]. Так как истинный, или функциональный, железодефицит достаточно часто выявляется у пациентов с ХСН и анемией [27, 43], внутривенное введение железа без сопутствующей терапии эритропоэтином может являться простым и безопасным методом повышения уровня гемоглобина, улучшения клинической симптоматики и увеличения толерантности к физической нагрузке у пациентов с ХСН и анемией. Данный относительно недорогой метод лечения может играть важную роль в коррекции анемии и/или железодефицита у больных с сердечной недостаточностью.
Городская клиническая больница №31 — Пациентам в помощь. Гематологические заболевания. Часть III. Миелодиспластические синдромы (страница 4)
Страница 4 из 7
Рефрактерная анемия с кольцевидными сидеробластами
Слово «анемия» на медицинском языке означает снижение гемоглобина или малокровие, а «рефрактерная» или устойчивая, означает, что никакими витаминами, препаратами железа, диетой исправить ситуацию и поднять гемоглобин нельзя. Бласты — это самые молодые клетки крови, а сидеробласты – это бласты с нарушенным внутренним обменом железа, который наблюдают как особое кольцо вокруг ядра клетки.
Рефрактерная анемия с кольцевидным сидеробластами (РАКС) – это один из видов миелодиспластического синдрома, при котором из-за нарушения созревания красных кровяных телец у пациента снижается гемоглобин и появляются сидеробласты в костном мозге. РАКС заболевают 3-11% всех пациентов с миелодиспластическим синдромом. Обычный возраст больных от 60 до 73 лет.
Диагноз
Диагноз «рефрактерная анемия с кольцевидными сидеробластами» ставят, если у больного не находят других причин для изменения состава крови и в то же время обнаруживают типичные изменения в костном мозге (в первую очередь видят кольцевидные сидеробласты). Пациента всесторонне обследуют: делают цитологическое, цитогенетическое и гистологическое исследование костного мозга, другие специальные анализы, чтобы понять, как быстро произойдет переход анемии в острый лейкоз и каковы в настоящий момент лечебные возможности для данного пациента. РАКС – это диагноз исключения, то есть его ставят тогда, когда все другие причины снижения гемоглобина и изменения костного мозга исключены.
Лечение
Если кровь больного изменена незначительно, и он чувствует себя в целом нормально, то с лечением можно повременить. Затем по необходимости делают переливание крови или ее компонентов. Если со временем у пациента появились предвестники перехода анемии в острый лейкоз, то лечение проводят по схемам рефрактерной анемии с избытком бластов. Если болезнь перешла в острый лейкоз, то лечат уже острый лейкоз. Молодых пациентов можно вылечить с помощью пересадки стволовых (материнских) клеток крови. Мировая статистика показывает, что в среднем больные со времени постановки диагноза живут до девяти лет. Это зависит от различных факторов.
Если болезнь перешла в острый лейкоз, то лечат уже острый лейкоз. Молодых пациентов можно вылечить с помощью пересадки стволовых (материнских) клеток крови. Мировая статистика показывает, что в среднем больные со времени постановки диагноза живут до девяти лет. Это зависит от различных факторов.
Уровни гемоглобина у госпитализированных пациентов
Исследования массы эритроцитов, проведенные у госпитализированных пациентов, были впервые проведены в начале 1970-х годов1. После этого были получены дальнейшие сообщения о снижении концентрации гемоглобина ([Hb]) и его возможных причинах. , особенно у пациентов в критическом состоянии.25 Снижение [Hb] может происходить в результате заборов крови для диагностических исследований; кровопотеря, связанная с инвазивными процедурами и кровотечением; скрытое желудочно-кишечное кровотечение; гемолиз; сокращение выживаемости эритроцитов; дефицит железа, фолиевой кислоты или кобаламина; почечная, печеночная или эндокринная недостаточность; гемодилюция, связанная с жидкостной терапией; и так называемая анемия воспаления (AI). 68 Последнее может быть следствием притупленной реакции костного мозга из-за нескольких факторов, таких как недостаточная секреция эритропоэтина, ингибирование пролиферации и дифференцировки эритроидных предшественников костного мозга и опосредованный гепсидином функциональный дефицит железа (810).
68 Последнее может быть следствием притупленной реакции костного мозга из-за нескольких факторов, таких как недостаточная секреция эритропоэтина, ингибирование пролиферации и дифференцировки эритроидных предшественников костного мозга и опосредованный гепсидином функциональный дефицит железа (810).
Как уже упоминалось, большинство исследований было проведено на пациентах в критическом состоянии, и имеется скудная информация о госпитализированных пациентах (GWAP) с менее тяжелыми заболеваниями. В этом сценарии некоторые из предложенных механизмов могут иметь менее четкую роль.Широко признано, что [Hb] может снижаться без явного кровотечения при GWAP. Однако, учитывая отсутствие информации по этому вопросу, проводятся лабораторные проверки и инвазивные процедуры для определения его потенциальных причин.
Целью настоящего исследования является описание изменения [Hb] во времени в GWAP без кровотечения, оценка доли пациентов со снижением [Hb] на 1,5 г / дл, а также оценка возможных связанных переменных.
Материалы и методы
Проспективное обсервационное исследование продолжительностью 16 недель (сентябрь 2004 г. — январь 2005 г.) было проведено в GWAP в 2 клинических больницах Буэнос-Айреса.
Были обследованы все последовательные пациенты старше 16 лет. Были исключены пациенты, госпитализированные по следующим причинам: кровотечение, травма, хирургическое вмешательство, инвазивные процедуры, связанные с кровопотерей (биопсия, дренаж желчевыводящих путей, эндоваскулярные терапевтические процедуры и дренажные трубки), переливание крови, анемия, химиотерапия и острая почечная недостаточность.
Исключались пациенты с кровотечением в анамнезе, химиотерапия или лучевая терапия в течение двух месяцев до госпитализации, пациенты на диализе и пациенты с текущим онкологическим или гематологическим заболеванием, а также пациенты с продолжительностью пребывания менее 3 дней или менее 2 измерения [Hb] или гематокрита (HCT).
За пациентами наблюдали до выписки, смерти или перевода в отделение интенсивной терапии. Пациенты были исключены из исследования, если у них было кровотечение или гемолиз, им было проведено переливание эритроцитов или терапия, влияющая на уровень гемоглобина (железо, химиотерапия или эритропоэтин), или если была проведена хирургическая или инвазивная процедура, связанная с кровопотерей.
Данные были собраны из медицинских карт пациентов, а дополнительная информация была получена авторами от лечащих врачей и пациентов (AL, NC, SM, AN, MH).Во время госпитализации были заполнены стандартизованные формы отчетов о случаях, включая: возраст, пол, госпитализацию за предыдущие 3 месяца (повторная госпитализация) и то, проживал ли пациент в доме престарелых. Пациенты были разделены на категории в соответствии с диагнозом выписки, как сообщили Nguyen et al.4, с изменениями, относящимися к общей популяции нашего отделения. При поступлении оценивались индекс суточной активности Каца (ADL), 11, 12, оценка острой физиологии (APS) APACHE II, 13, 14 и оценка коморбидности Чарлсона (Charlson) 15, 16.Во всех случаях значения [Hb] и HCT регистрировались при поступлении, на 3, 6, 10 дни и перед выпиской, а также при любом другом определении, требуемом лечащим врачом. Анемия была определена как [Hb] 13 г / дл для мужчин и 12 г / дл для женщин.17 Основываясь на предыдущих отчетах, снижение [Hb] на 1,5 г / дл и на 4,5 балла по HCT по сравнению со значениями госпитализации считалось значительным. осень.1, 4 Острая почечная недостаточность определялась как повышение уровня креатинина на 0,5 мг / дл или на 50% от исходного уровня.18, 19
Также регистрировались все процедуры без значительной кровопотери (PWSBL), такие как установка венозного катетера, плевроцентез, поясничная пункция, парацентез, биопсия кожи, артроцентез и диагностическая ангиограмма. Исследование было одобрено этическим комитетом больницы.
Анализ и обработка данных выполнялись с помощью Excel 2000 и Stata версии 8.0 (Stata Corp; США). Для непрерывных переменных результаты выражались средним значением его стандартного отклонения (SD) и сравнивались с тестом Стьюдента t -test.Для сравнения категориальных переменных использовался критерий хи-квадрат. Кривая выживаемости была построена с помощью метода Каплана-Мейера для анализа времени до значительного падения [Hb]. Наконец, было выполнено моделирование пропорциональных рисков Кокса для оценки связи между значительным падением [Hb] и другими переменными. Мы приняли значение P <0,05.
Результаты
Всего за исследуемый период в стационар внутренних болезней поступило 338 пациентов.Тридцать девять процентов (131) из этих пациентов были включены. Критериями исключения были: диагноз при поступлении (n = 95, 45,9%), история болезни (n = 56, 27%) и продолжительность пребывания менее 3 дней или менее 2 определений [Hb] или HCT (n = 56,27%). Сбор данных был прекращен по следующим причинам: выписка (81,7%), смерть (6,9%), операция или процедуры, связанные с кровопотерей (5,3%), перевод в отделение интенсивной терапии (3%), переливание крови (2,3%), и химиотерапия (0,8%). Исходные характеристики исследуемых пациентов представлены в таблице 1.
| n | % | Среднее (SD) | Медиана | Мин / Макс | |
|---|---|---|---|---|---|
| |||||
| Возраст, лет | 71.9 (17,4) | 77 | 18/97 | ||
| 18-40 | 11 | 8,4 | |||
| 41-60 | 16 | 12,2 | |||
| 61-80 | 52 | 39,7 | |||
| > 80 | 52 | 39,7 | |||
| Пол | |||||
| Женский | 75 | 57.2 | |||
| Продолжительность пребывания (дни) | 7 (4,8) | 6 | 3/28 | ||
| APS | 4,9 (4,2) | 4 | 0/22 | ||
| 0-4 | 71 | 54,2 | |||
| 5-8 | 36 | 27,5 | |||
| > 8 | 24 | 18.3 | |||
| ADL | 4,5 (2,3) | 6 | 0/6 | ||
| 0-2 | 33 | 25,2 | |||
| 3-5 | 11 | 8,4 | |||
| 6 | 87 | 66,4 | |||
| ЧАРЛСОН | 2.2 (2,3) | 2 | 0/11 | ||
| 0 | 32 | 24,4 | |||
| 1 | 32 | 24,4 | |||
| 2 | 22 | 16,8 | |||
| 3 | 18 | 13,7 | |||
| > 3 | 27 | 20.6 | |||
| Реадмиссия | 28 | 21,4 | |||
| PWSBL | 14 | 10,7 | |||
| Анемия при поступлении 63 | 48,1 | ||||
| [Hb] при поступлении | 12,5 (1,7) | 12.5 | 8,6 / 17 | ||
| [Hb] при поступлении мужчины | 12,8 (1,9) | 12,6 | 8,7 / 17 | ||
| [Hb] при поступлении женщины | 12,3 (1,5) | 12,3 | 8,6 / 15,5 | ||
Диагнозы при выписке были разделены на следующие категории: инфекции (25,2%), электролитные нарушения (7,6%), сердечные заболевания (9,9%), неврологические (19 .1%), респираторный (16,8%), желудочно-кишечный (10,7%) и другой диагноз (10,7%).
У включенных пациентов не было обнаружено признаков кровотечения. Кровотечение наблюдалось только у 4 из первоначально обследованных пациентов, которые были исключены, поскольку они не смогли выполнить необходимое количество определений [Hb] перед кровотечением.
Среднее снижение [Hb] на 0,71 г / дл было обнаружено между поступлением и днем выписки ( P <0,001; 95% ДИ, 0,47–0,97). Среднее значение надира [Hb] было на 1,45 г / дл ниже допустимого [Hb] ( P <0.001; 95% ДИ, 1,24-1,67). Средний день надира наблюдался между 3 и 4 днями госпитализации. Среднее значение [Hb] при выписке составляло 11,8 1,8 г / дл. Это значение выше, чем средняя концентрация в надире (0,74 г / дл P <0,001; 95% ДИ, 0,60–0,97) (Рисунок 1).
Рис. 1График изменений концентрации гемоглобина во время пребывания в больнице. Линия в рамке обозначает медиану, а прямоугольник охватывает межквартильный размах. Усы простираются от 10-го до 90-го процентилей.
Таблица 2 показывает частоту пациентов со снижением [Hb] для разных уровней отсечки. Сорок пять процентов исследуемой популяции (59 пациентов) имели значительное снижение [Hb] во время госпитализации. Это наблюдалось на 2-й день у 50% пациентов. Аналогичным образом, значительное снижение значения HCT было обнаружено у 42,7% пациентов. Если анализировать снижение [Hb] во время госпитализации как долю [Hb] при поступлении, у 52,7% пациентов наблюдалось снижение [Hb] на 10% или больше во время пребывания в больнице.
| Падение [Hb] (г / дл) | 0,5 | 1 | 1,5 | 2 | 2,5 | 3 | 3,5 | 4 | 4,5 |
|---|---|---|---|---|---|---|---|---|---|
| % пациентов | 80,9 | 60,3 | 45,0 | 28,2 | 17,6 | 9,9 | 5,3 | 3,8 | 2.3 |
Используя анализ Каплана-Мейера, расчетная доля, показывающая отсутствие значительного падения [Hb], составила 0,63 (95% ДИ, 0,55–0,71) в день 3 и 0,48 (95% ДИ, 0,29-0,67) в день. 10. К 15 дню только 3,8% первоначально включенных пациентов были госпитализированы и не показали снижения [Hb] 1,5 г / дл. У этих пациентов уровень [Hb] оставался стабильным до конца периода наблюдения (рис. 2).
Рисунок 2График Каплана-Мейера, показывающий долю пациентов без падения концентрации гемоглобина ≥1.5 г / дл.
В однофакторном анализе, сравнивая пациентов, у которых наблюдалось снижение [Hb] 1,5 г / дл, с пациентами, у которых этого не произошло, значимые различия были обнаружены только в следующих переменных: длительность пребывания, APS, анемия при поступлении, [Hb] при госпитализации. при поступлении, а также инфекционные, желудочно-кишечные или сердечные заболевания при выписке диагноза (таблица 3).
| Пациенты со значительным падением | Пациенты без значительного падения | P Значение | |
|---|---|---|---|
| |||
| n | 59 (45%) | 72 (55%) | |
| Возраст, лет | 73.15 (18,7) | 70,83 (16,2) | 0,448 |
| Пол, женский | 32 (54,2%) | 43 (59,7%) | 0,527 |
| Продолжительность пребывания (дни) | 8,30 (5,6) | 5,91 (3,7) | <0,007 |
| APS | 6,13 (4,5) | 3,77 (3,7) | <0,004 |
| ADL | 4,33 (2,5) | 4,68 (2,1 ) | 0,410 |
| ЧАРЛСОН | 2.03 (1,8) | 2,37 (2,5) | 0,382 |
| Жильцы дома престарелых | 4 (6,8%) | 3 (4,2%) | 0,700 |
| Реадмиссия | 11 (18,6%) | 17 (23,6%) | 0,490 |
| PWSBL | 6 (10,2%) | 8 (11,1%) | 0,862 |
| Анемия при поступлении | 20 (33,9%) | 43 (59,7 %) | <0,004 |
| [Hb] при поступлении | 13.09 (1,7) | 12,01 (1,5) | <0,001 |
| Диагноз при выписке | |||
| Инфекционный | 20 (33,9%) | 13 (18,1%) | <0,05 |
| Респираторный | 8 (13,6%) | 14 (19,4%) | 0,370 |
| Неврологический | 9 (15,2%) | 16 (22,2%) | 0,312 |
| Желудочно-кишечный тракт | 11 (18.6%) | 3 (4,2%) | <0,01 |
| Сердечный | 2 (3,4%) | 11 (15,3%) | <0,05 |
| Электролитные нарушения | 6 (10,2%) | 4 (5,6%) | 0,512 |
| Прочие | 3 (5,1%) | 11 (15,3%) | 0,087 |
В модели пропорциональных рисков Кокса с поправкой на переменные, указанные в таблице 4, значимая независимая прямая связь была обнаружена между значительным падением [Hb] во время пребывания в больнице и APS, [Hb] при поступлении, а также диагнозом инфекционного или желудочно-кишечного заболевания при выписке.Аналогичные результаты были получены, если значительное снижение было переопределено как снижение [Hb] на 12% или как снижение HCT на 4,5 пункта по сравнению с исходным уровнем.
| Переменная | HRR | Значение P | 95% CI |
|---|---|---|---|
| |||
| APS | 1,07 | 0,007 | 1,02-1,12 |
| ADL | 1,11 | 0,132 | 0,97-1,27 |
| Чарлсон | 0,88 | 0,19 0,75-1,03 | |
| Медсестра | 1,52 | 0,361 | 0,62-3,72 |
| PWSBL | 0,67 | 0,390 | 0.27-1,66 |
| Реадмиссия | 1,14 | 0,710 | 0,57-2,29 |
| Женский пол | 0,98 | 0,944 | 0,57-1,69 |
| Возраст | 1,39 | 0,098 | 0,94 -2,07 |
| [Hb] при поступлении | 1,27 | 0,005 | 1,07-1,51 |
| Диагноз при выписке | |||
| Инфекционный | 2.70 | 0,015 | 1,21-6,05 |
| Неврологический | 1,42 | 0,457 | 0,57-3,55 |
| Желудочно-кишечный | 3,74 | 0,002 | 1,62-8,64 |
| Сердечный | 0,289 | 0,08-2,12 | |
| Электролит расст. | 2,08 | 0,176 | 0,72-6,05 |
| Прочие | 0,95 | 0.946 | 0,24–3,81 |
Обсуждение
Это исследование описывает изменение значений [Hb] и HCT в GWAP без кровотечения или других очевидных заболеваний, связанных с уменьшением массы красных кровяных телец. Как описано ранее, 4, 20, 21, мы обнаружили, что часто наблюдается снижение [Hb] во время пребывания в больнице. Среднее падение [Hb] после госпитализации составило 1,45 г / дл и в основном регистрировалось между 3 и 4 днями госпитализации. Примерно у половины исследуемой популяции a 1.Наблюдалось снижение [Hb] на 5 г / дл. В анализе выживаемости ожидается, что 40% и 55% пациентов будут иметь такое падение на 4-й и 12-й день соответственно. В соответствии с предыдущими сообщениями4, 21 большее снижение [Hb] произошло в первые дни госпитализации, и большая часть пациентов уже страдала анемией на момент госпитализации.
Следующие переменные были связаны со снижением [Hb] во время госпитализации: более высокий показатель APS, более высокий [Hb] при поступлении и диагноз инфекционного или желудочно-кишечного заболевания при выписке.Несмотря на то, что несколько механизмов, по-видимому, способствуют снижению [Hb] во время госпитализации, наши данные предполагают, что 1 из этих факторов, по-видимому, является серьезностью заболевания, как ранее предполагали Нгуен и др. 4 Это наблюдение подтверждается обнаруженной ассоциацией. в нашем исследовании между снижением [Hb] и APS. Не было обнаружено никакой связи с Чарлсоном, ADL, и проживанием в доме престарелых. Эти переменные, которые ранее не анализировались, по-видимому, указывают на то, что у пациентов с хроническими заболеваниями вероятность снижения [Hb] во время госпитализации не выше.
Пациенты с более высоким [Hb] при поступлении имели большее снижение [Hb] во время пребывания в больнице. Это открытие может свидетельствовать о том, что механизм, связанный с этим снижением, оказывает меньшее влияние на пациентов с более низким [Hb]. Это похоже на то, что наблюдается при анемии при хронических заболеваниях, когда [Hb] обычно не падает до крайних значений. Наш анализ показывает большее снижение в первые дни госпитализации. Учитывая высокий уровень анемии у пациентов при поступлении, возможно, что снижение [Hb] началось еще до поступления.
Предыдущие статьи описывают низкую распространенность дефицита цианокобаламина (2%), фолиевой кислоты (2%) и железа (9%) у пациентов, госпитализированных в отделения интенсивной терапии3. механизм снижения [Hb], явление, которое было названо AI или анемией критического заболевания.8, 2228 Воспалительная реакция, связанная с острым заболеванием, вызывает эту гипопролиферативную анемию тремя различными путями: относительный дефицит эритропоэтина, прямое ингибирование эритропоэза в крови. костный мозг через различные медиаторы (например, интерлейкин [IL] -1, IL-6, фактор некроза опухоли [TNF]) и функциональный дефицит железа.Этот относительный дефицит железа вызван в основном индуцированной IL-6 сверхэкспрессией гена гепсидина в гепатоцитах. Гепсидин вызывает нарушение всасывания железа в кишечнике и неадекватную доставку железа от макрофагов, рециркулирующих железо, к предшественникам эритроидов в костном мозге. 8, 9
AI может объяснить некоторые из наших результатов, например, большее снижение, наблюдаемое в первой больнице. дни, когда ожидается повышение уровня медиаторов воспаления. Связь между APS и диагнозом инфекционного заболевания и большим снижением [Hb] также может быть объяснена этим механизмом.Тем не менее, ежедневное производство эритроцитов костным мозгом невелико по сравнению с циркулирующими эритроцитами, и поэтому необходимо получить лучшее объяснение того, как AI может быть связан с этим быстрым снижением [Hb]. Райс и др. 30,31 исследовали некоторые механизмы, приводящие к быстрому уменьшению количества эритроцитов, связанных с резкими изменениями уровня эритропоэтина. Роль этого и других механизмов можно предположить.29
Явное кровотечение не было обнаружено в нашей исследуемой популяции, а процедуры без значительной кровопотери (PWSBL) были редкими, поэтому маловероятно, что они могли повлиять на снижение [Hb].Влияние других переменных, таких как объем крови, взятой для диагностического тестирования, и скрытые кровопотери (особенно из желудочно-кишечного тракта) не исследовалось. Парентеральная гидратация и гемодилюция не оценивались в нашем исследовании и не были подробно описаны в литературе. Мы думаем, что последний упомянутый механизм играет роль в значительном снижении [Hb] в течение первых дней госпитализации. Однако отсутствие связи было упомянуто в единственном исследовании, в котором оценивалась эта проблема у пациентов в критическом состоянии.Внутрисосудистый гемолиз был отмечен как нечастое явление у этих пациентов.2, 4
В исследование были включены только пациенты без четкого объяснения их снижения [Hb], поскольку они представляют собой проблему для госпиталистов и других лечащих врачей. Таким образом, 60% первоначально оцененных пациентов были исключены, так как они были госпитализированы с состояниями, которые могли вызвать снижение [Hb]. Тем не менее, кажется вероятным, что механизмы, задействованные в включенных пациентах, могут играть роль и у тех, у кого есть очевидная причина вариации [Hb].Соответственно, снижение [Hb], ожидаемое у пациентов, поступивших с нарушениями, которые, как известно, вызывают снижение массы эритроцитов, будет больше, чем 1, наблюдаемое в нашей исследуемой популяции.
Это падение [Hb] во время госпитализации может иметь клиническое значение по ряду причин: оно может побуждать лечащих врачей заказывать дорогостоящие и инвазивные исследования, оно может иметь прогностическое значение, как у пациентов, госпитализированных с инфарктом миокарда, и оно может вызвать острый коронарный синдром.20 Мы наблюдали связь между падением [Hb] и более высоким APS у наших пациентов. Эта оценка была подтверждена как прогностический фактор в предыдущих исследованиях. Однако нельзя сделать вывод, что это падение [Hb] связано с худшим прогнозом.
У нашего исследования было несколько ограничений. Неоднородность выборки, присущая общей популяции нашего отделения, могла изменить наши результаты и их обобщение. Чтобы преодолеть эту предвзятость, мы использовали систему категоризации на основе диагноза при выписке.Однако у этой конкретной системы есть несколько ограничений. Небольшой размер выборки и отсутствие данных последующего наблюдения после выписки ограничивали нашу способность обнаруживать какое-либо прогностическое значение снижения [Hb]. В настоящем исследовании общее снижение [Hb] могло быть недооценено, поскольку начало острого заболевания предшествует госпитализации на разное время. Наконец, относительно небольшой размер выборки ограничивал нашу способность обнаруживать другие возможные значимые предикторы снижения [Hb]. Однако это исследование было разработано не для оценки механизмов, связанных со снижением [Hb], а скорее для установления его возникновения, измерения и изучения связанных переменных.
Эти результаты могут быть полезны для дальнейших исследований для оценки вариации [Hb] у госпитализированных пациентов и ее связи с другими переменными, такими как продукция костного мозга, потребление кислорода, выживаемость эритроцитов, дефицит питательных веществ, уровни эритропоэтина и медиаторов воспаления.
В заключение, у наших стационарных пациентов общего профиля во время госпитализации среднее снижение гемоглобина на 1,45 г / дл [Hb], которое было больше в первые дни госпитализации, даже несмотря на отсутствие очевидной причины.Эти данные помогут лечащим врачам общих палат рационально и эффективно решать проблему снижения [Hb] у пациентов.
Благодарности
Авторы благодарят Хорхе Лопеса Камело и Уго Крупицки за советы по статистике и Валерию Мелию за помощь в подготовке этой рукописи.
Факторы, увеличивающие / уменьшающие гемоглобин + гены гемоглобина
Являясь важной частью красных кровяных телец, гемоглобин доставляет кислород ко всем частям тела.В этом посте мы рассмотрим факторы, которые естественным образом изменяют (увеличивают или уменьшают) гемоглобин. Кроме того, мы также рассматриваем гены и SNP, которые влияют на уровень гемоглобина.
Факторы, повышающие гемоглобинНизкий уровень гемоглобина может быть индикатором основного заболевания или расстройства, требующего медицинской помощи. Прежде чем пытаться повысить уровень гемоглобина самостоятельно, поговорите со своим врачом о соответствующих стратегиях, которые могут включать некоторые из вещей, обсуждаемых в этом разделе.Никогда не используйте какие-либо стратегии, описанные в этом разделе, вместо того, что прописал ваш врач.
1) Продукты, богатые железомДефицит железа является наиболее частой причиной низкого гемоглобина (Hb).
Употребление богатой железом пищи (например, красного мяса, яиц, овощей и злаков) обычно является лучшим способом увеличить содержание железа в крови [1].
Около 10% потребляемого вами железа всасывается в кровоток [1].
Исследование 40 молодых людей показало, что трехнедельный прием листовых зеленых овощей с маслом привел к значительному увеличению гемоглобина на 9%.По мнению авторов исследования, употребление масла вместе с овощами может увеличить биодоступность некоторых питательных веществ [2].
2) Добавки железаДобавки железа значительно повышают уровень гемоглобина у людей с дефицитом железа [3].
У девочек с дефицитом железа пять месяцев приема добавок железа были связаны с увеличением гемоглобина на 0,52 г / дл больше, чем у девочек, которые не принимали добавки (279 школьниц) [4].
Прием слишком большого количества железа может вызвать расстройство желудка и в крайних случаях вызвать повреждение тканей.Тем не менее, добавки с железом, по-видимому, не повышают Hb выше нормальных значений. [3].
3) ВитаминыЕсли у вас дефицит витаминов, необходимых для производства красных кровяных телец, устранение этого дефицита должно восстановить нормальные значения гемоглобина.
Во-первых, важно иметь достаточное количество фолиевой кислоты и B12. Недостаток этих витаминов вызывает анемию (низкий уровень гемоглобина) [5].
Витамины A, D и E также могут быть полезны при дефиците [6, 7, 8].
Лечение витамином А увеличивало выработку эритропоэтина (ЭПО), стимулятора выработки красных кровяных телец [9].
Добавки с витамином А увеличивают гемоглобин у детей (2397 и 81 человек) [10, 9].
Эти добавки также повышали гемоглобин у беременных (152 и 190 человек) [11, 12].
Добавки бета-каротина значительно повышали уровень гемоглобина (11%) у молодых здоровых взрослых (40 человек) [2]. В организме он превращается в витамин А.
Дефицит витамина D также был связан с более низким уровнем гемоглобина (метаанализ, 7 исследований, 5183 субъекта) [13].
Кроме того, исследование показало, что добавление высоких доз витамина D повышает уровень гемоглобина у находящихся на ИВЛ взрослых пациентов в критическом состоянии (пилотное исследование, 30 человек) [14].
Наконец, было показано, что добавление витамина Е также улучшает уровень гемоглобина у здоровых взрослых с легкой анемией (86 и 60 человек) [15].
Поговорите со своим врачом, чтобы определить, есть ли у вас дефицит любого из этих витаминов и подходят ли вам добавки.
4) МинералыЦинк, медь и селен являются микроэлементами, которые важны для поддержания адекватного уровня гемоглобина.
Цинк играет важную роль в производстве энергии из железа [16].
Исследование показало, что пациенты с низким уровнем цинка имеют более высокий риск развития анемии (503 пациента) [17].
Добавление цинка к лечению железом дополнительно увеличивает гемоглобин, улучшает показатели железа и оказывает положительное влияние на диарею у детей с анемией [18].
Добавки цинка и витамина С повышают уровень гемоглобина у пациентов с малярией (витамин С увеличивает абсорбцию железа) [19].
Селен и медь также связаны с анемией, и при их дефиците полезны добавки [5].
Поговорите со своим врачом, чтобы определить, есть ли у вас дефицит любого из этих минералов и подходят ли вам добавки.
5) ВысотаНа больших высотах кислорода меньше; чтобы компенсировать это, организм производит больше красных кровяных телец и больше гемоглобина. Условия, имитирующие большую высоту, значительно повышали уровень гемоглобина у пациентов с терминальной стадией болезни почек с анемией [20].
Некоторые спортсмены сознательно тренируются на большой высоте, чтобы повысить уровень гемоглобина и улучшить спортивные результаты.Три недели традиционных высотных тренировок на высоте 2050 метров увеличивают выработку красных кровяных телец даже у спортсменов мирового класса на выносливость [21].
В исследовании 10 спортсменов-ориентировщиков сборной Швейцарии, которые жили на высоте 2500 метров (18 часов в день) и тренировались на высоте 1800 и 1000 метров над уровнем моря в течение 24 дней, улучшили как уровень гемоглобина, так и время бега на 5000 м по сравнению с спортсмены, тренировавшиеся на уровне моря (7 человек) [22].
6) ЭритропоэтинУ 8 здоровых субъектов ЭПО (эритропоэтин), вводимое в течение 15 недель, увеличивало объем эритроцитов, но уменьшало объем плазмы (жидкой части крови).Оба они приводят к увеличению уровня гемоглобина [23].
Эритропоэтин запрещен в спортивных соревнованиях, поскольку он искусственно увеличивает кислородную емкость крови спортсмена. Тест на ЭПО был представлен на летних Олимпийских играх 2000 года в Сиднее (Австралия) [24].
В то время как ЭПО полезен для людей с низким уровнем гемоглобина, его использование для повышения уровня гемоглобина выше нормального имеет неблагоприятные последствия. ЭПО, сгущая кровь, увеличивает риск сердечных заболеваний, инсульта, а также эмболии головного мозга или легочной артерии.Неправильное использование ЭПО может также способствовать развитию аутоиммунного заболевания [24].
7) ПереливаниеПереливание крови обычно проводят при очень низком уровне гемоглобина (менее 6-8 г / дл) [25].
В спорте этот метод также используется для повышения производительности. Особенно это касается так называемого допинга аутологичной крови, который представляет собой переливание собственной крови, которая хранилась (охлаждена или заморожена) до тех пор, пока она не понадобится [24].
Факторы, снижающие гемоглобинВысокий гемоглобин, хотя и бывает редко, может быть индикатором основного заболевания или расстройства, требующего медицинской помощи.Прежде чем пытаться снизить уровень гемоглобина самостоятельно, поговорите со своим врачом о соответствующих стратегиях, которые могут включать некоторые из вещей, обсуждаемых в этом разделе. Никогда не используйте какие-либо стратегии, описанные в этом разделе, вместо того, что прописал ваш врач.
1) ГидратацияУровень гемоглобина повышается при обезвоживании организма. Это происходит из-за уменьшения объема крови (плазма — уменьшается жидкая часть крови) [3].
Острое обезвоживание может повысить концентрацию гемоглобина на 10–15% [3].
Адекватная гидратация важна для поддержания нормального уровня гемоглобина, особенно во время физических упражнений.
2) Бросить куритьУ курильщиков, как правило, выше гемоглобин, чем у некурящих. Это повышение затрудняет выявление анемии и других состояний, связанных с низким уровнем гемоглобина у курящих людей [26, 27].
3) КровопусканиеКровопускание, известное также как кровопускание, является основной терапевтической процедурой, которую мы часто связываем с устаревшими и историческими практиками.Однако терапевтическая флеботомия по-прежнему используется для лечения заболеваний с высоким уровнем гемоглобина, таких как истинная полицитемия [28].
Он также иногда используется при таких состояниях, как хронические заболевания легких и цианотическая болезнь сердца (оба могут вызывать повышение гемоглобина) [28].
Одной из основных целей этого лечения является уменьшение тромбов и риска связанных с ними побочных эффектов [28].
Ни при каких обстоятельствах не пытайтесь самостоятельно сделать лечебное кровопускание.
Лабораторное исследование вариантов гемоглобина Электрофорез гемоглобинаДля определения типов гемоглобина у человека можно использовать метод, называемый электрофорезом гемоглобина.Во многих странах рутинное тестирование всех новорожденных проводится для выявления распространенных вариантов гемоглобина, таких как талассемия и серповидно-клеточная анемия [29].
Гены гемоглобинаНа уровень гемоглобина влияют ваши гены. Существует более 1000 вариантов гена Hb человека (SNP) [29].
Эти варианты распространены, им страдают около 7% населения мира [29].
Наиболее распространенные и важные варианты Hb включают HbS (обнаруживается при серповидно-клеточной анемии) и HbE (обнаруживается при талассемии) [29].
Все они относительно часто поддерживаются у людей, потому что они дают преимущества в выживании, когда дело доходит до малярии [29].
Те, у кого есть одна копия гена серповидноклеточной анемии или альфа-талассемия, защищены от малярии [30].
Однако у лиц, несущих обе копии этих мутаций, защитный эффект полностью утрачен, и они в равной степени подвержены малярии, как и люди с нормальными копиями гемоглобина [30].
Большинство людей, у которых есть только одна копия, остаются без симптомов, а многие не диагностируются [31].
Некоторые варианты Hb клинически доброкачественны, но вызывают очевидные изменения цвета кожи, румяного цвета лица или кожи с синеватым оттенком. Эти варианты не вызывают клинических повреждений, за исключением их косметических эффектов [29].
Обратите внимание, что некоторые варианты Hb могут искусственно повышать уровень HbA1c и мешать диагностике и лечению диабета [29].
HBA1 и HBA2HBA1 (субъединица гемоглобина альфа 1) и HBA2 (субъединица гемоглобина альфа 2) продуцируют альфа-цепь Hb.Обычно у людей есть по две копии (всего четыре копии).
Две альфа-цепи (HBA1 или HBA2) плюс две бета-цепи составляют HbA, который является нормальным взрослым гемоглобином. Обычно он составляет около 97% от общего гемоглобина [32].
Альфа-талассемия может возникнуть в результате потери более двух копий альфа-цепи (HBA1 или HBA2) [33].
Потеря одной или двух копий протекает без клинических проявлений и не вызывает серьезных симптомов [33].
Потеря трех копий вызывает болезнь гемоглобина H с умеренной анемией [33].
Потеря всех четырех копий приводит к гибели плода [33].
Копии чаще всего удаляются, и эти делеции обычно не анализируются геномными компаниями (вам необходимо пройти специальные тесты на типирование гемоглобина).
Однако некоторые случаи альфа-талассемии также вызваны однонуклеотидными вариантами (мутациями).
Мутация T в C в этом положении вызывает альфа-талассемию [34].
Болезнь HbH возникает из-за наличия двух копий этого варианта [35].
HBBHBB (субъединица бета гемоглобина) продуцирует бета-цепь гемоглобина. Обычно у людей есть две копии этого гена.
Две альфа-цепи плюс две бета-цепи составляют HbA, который является нормальным взрослым гемоглобином. HbA составляет около 97% от общего гемоглобина [32].
Мутации в гене HBB вызывают серповидно-клеточную анемию или бета-талассемию.
Однако эти мутации в то же время полезны, обеспечивая устойчивость к малярии.
Термин «промежуточная талассемия» относится к более легким мутациям, при которых уровень гемоглобина поддерживается выше 6,5 г / дл [33].
Термин «большая бета-талассемия» относится к серьезному заболеванию, при котором не удается поддерживать уровень гемоглобина выше 6,5 г / дл [33].
rs334 (T), также известный как i3003137 (A) или HbS, является наиболее распространенной мутацией в бета-субъединице гемоглобина [33].
Наличие двух копий этого варианта ( rs334 T / T) вызывает серьезное заболевание, известное как серповидноклеточная анемия.
С другой стороны, люди, имеющие единственную копию ( rs334 A / T), устойчивы к малярии и заболевают лишь легкой анемией [36].
Этот вариант также известен как HbC.
Мутация особенно распространена в популяциях Западной Африки [37].
HbC обеспечивает почти полную защиту от малярии у людей с двумя копиями (CC) и промежуточную защиту у людей с одной копией (AC) [37].
Наличие двух копий HbC вызывает легкую гемолитическую анемию (анемия, вызванная распадом эритроцитов).Обычно никакого лечения не требуется.
Этот вариант известен как HbE.
Наличие единственной копии HbE не вызывает никаких неблагоприятных симптомов.
Две копии HbE вызывают легкую анемию.
Однако HbE наследуется вместе с бета-талассемией (E / бета-талассемия). Подобные случаи составляют примерно 50% больных тяжелой бета-талассемией [38].
Самые высокие частоты наблюдаются в Индии, Бангладеш и по всей Юго-Восточной Азии, особенно в Таиланде, Лаосе и Камбодже, где люди обычно наследуют копии как гемоглобина E (HbE), так и бета-талассемии [38].
Этим заболеванием страдает миллион человек во всем мире, и его число растет в Северной Америке [39].
HBDHBD (дельта-субъединица гемоглобина) продуцирует дельта-цепь гемоглобина.
Две альфа-цепи плюс две дельта-цепи составляют HbA2, который составляет около 2,5% от общего гемоглобина взрослого человека [32].
Мутации в гене дельта-цепи связаны с дельта-талассемией. Из-за низкой частоты HbA2 в крови у людей с мутациями HBD симптомы отсутствуют.
HBG1 и HBG2HBG1 (субъединица гемоглобина гамма 1) и HBG2 (субъединица гемоглобина гамма 2) — это гены, которые в норме функционируют у плода.
Две гамма-цепи вместе с двумя альфа-цепями составляют гемоглобин плода (HbF), который обычно заменяется гемоглобином взрослого человека (HbA) в год после рождения [29].
Таким образом, гемоглобин плода составляет 80% гемоглобина у новорожденных и лишь около 0,5% у взрослых [32].
В некоторых случаях гемоглобин F сохраняется в эритроцитах взрослых.Это состояние без симптомов, известное как наследственная персистенция гемоглобина плода (HPFH) [40].
В случаях бета-талассемии и родственных состояний продукция гамма-цепи может сохраняться, возможно, как механизм компенсации мутированной бета-цепи.
HBE1 и HBZHBE1 (субъединица гемоглобина эпсилон) и HBZ (дзета-субъединица гемоглобина) — это гены субъединиц гемоглобина, которые обычно обнаруживаются у ранних эмбрионов.
Эмбриональный гемоглобин состоит из любой из следующих комбинаций: две эпсилон-цепи и две дзета-цепи, две эпсилон-цепи и две альфа-цепи, две дзета-цепи и две гамма-цепи или две дзета-цепи и две бета-цепи.
ГаптоглобинГаптоглобин — важный белок, который связывает свободный гемоглобин из крови. Свободный гемоглобин вызывает окислительный стресс и воспаление, что в основном предотвращается гаптоглобином [41].
У человека ген гаптоглобина имеет два варианта: Hp1 и Hp2 [42].
Hp2 образует более крупный и объемный белок. Однако из-за своего размера он может быть менее эффективным.
Hp1 более эффективно ингибирует повреждение, связанное со свободным Hb, по сравнению с вариантом Hp2 [42].
Наличие двух копий варианта Hp2 является фактором риска сердечных заболеваний у пациентов с диабетом как I, так и II типа [42].
Наличие двух копий Hp2 также связано с повышенным риском повреждения мозга у людей с субарахноидальным кровоизлиянием (кровотечение в отдел, окружающий мозг) [42].
Побочные эффекты лечения: анемия
Анемия
Медицинский осмотр, проведенный C.H. Weaver M.D. Medical Editor 4/2021
Анемия — это недостаточное снабжение эритроцитами, приводящее к снижению способности крови переносить кислород.Частая причина, по которой у онкологических больных анемия, — это побочный эффект химиотерапии. Анемия важна, потому что она может вызвать нежелательные симптомы, такие как усталость, утомляемость или одышку, а также может усугубить или вызвать другие медицинские проблемы, такие как сердечное заболевание. К счастью, с анемией можно эффективно справиться.
Что такое анемия
Анемия — это недостаточное снабжение эритроцитами, приводящее к снижению способности крови переносить кислород. Красные кровяные тельца содержат белок гемоглобин, который переносит кислород во все части тела.Низкий уровень красных кровяных телец и, следовательно, гемоглобина приводит к снижению количества кислорода, который может переноситься в организм. Снижение доставки кислорода вызывает следующие симптомы:
- Усталость или усталость
- Проблемы с дыханием
- Учащенное сердцебиение
- Головокружение, головокружение, неспособность сконцентрироваться или головная боль
- Боль в груди
- Проблемы с сохранением тепла
- Потеря сексуального влечения
- Бледная кожа
Анемия обычно возникает у онкологических больных, либо как прямой результат рака, либо как побочный эффект лечения рака.Химиотерапия, лучевая терапия и кровопотеря во время операции — все это частые причины анемии у онкологических больных. Химиотерапевтические препараты убивают быстро делящиеся клетки в организме, включая раковые и нормальные клетки, такие как клетки костного мозга, ответственные за производство красных кровяных телец. Более 60% пациентов, получающих химиотерапию, заболевают анемией. 1
Анемия возникает из-за того, что пациенты не могут производить достаточное количество эритроцитов или потому, что эритроциты теряются в результате кровотечения или разрушаются быстрее, чем они могут быть произведены.Производство красных кровяных телец в костном мозге называется эритропоэзом. Эритропоэз контролируется факторами роста красных кровяных телец. Эритропоэтин является основным фактором роста клеток крови, который увеличивает выработку красных кровяных телец в костном мозге. Эритропоэтин вырабатывается клетками почек. Когда клетки почек обнаруживают снижение содержания кислорода в тканях, в кровоток выделяется эритропоэтин. Конечным результатом является увеличение производства красных кровяных телец в костном мозге. Анемию можно предотвратить или исправить с помощью эритропоэтина или переливания крови.
Существует множество различных причин анемии. Чтобы определить причину анемии, необходимо тщательное обследование, чтобы назначить наиболее подходящее лечение.
Почему анемия важна
Анемия важна по трем основным причинам:
- 1. Пациенты с анемией испытывают нежелательные симптомы, такие как усталость, утомляемость, одышка и снижение толерантности к физической активности. Все эти симптомы способствуют ухудшению общего самочувствия, и лечение анемии может облегчить эти симптомы. 2-4
- Анемия может усугубить или вызвать другие проблемы со здоровьем. Например, анемия требует, чтобы сердце работало больше, и эта дополнительная нагрузка на сердце может вызвать сердечный приступ у пациентов с ранее существовавшим заболеванием сердца.
- Проведение химиотерапии в соответствии с запланированной дозой и графиком лечения важно для достижения наилучших результатов лечения. Анемия как побочный эффект химиотерапии может помешать пациентам получить лечение в соответствующей дозе и в нужное время.
Как диагностируется анемия
Простой лабораторный тест, известный как CBC, или полный анализ крови, измеряет различные типы клеток в крови. Результаты общего анализа крови указывают на количество гемоглобина в эритроцитах. Подсчет гемоглобина — самый полезный индикатор анемии, поскольку он определяет способность крови переносить кислород. Нормальный уровень гемоглобина составляет 12 г / дл — 16 г / дл для женщин и 14 г / дл — 18 г / дл для мужчин. Пациенты с уровнем гемоглобина ниже нормы страдают анемией.Чтобы лучше понять интерпретацию CBC, ниже представлен образец.
Измерение количества крови
Тест, называемый полным анализом крови (CBC), используется для определения низкого уровня эритроцитов. Общий анализ крови измеряет уровни трех основных клеток крови: красных, белых и тромбоцитов.
В США CBC обычно передается в формате, показанном ниже. Если ваши показатели крови выходят за пределы нормального диапазона, который показан в столбце «Референтный интервал», их значения будут указаны в столбце «Флаг» с буквой «L» для низкого и «H» для высокого.Пример CBC ниже показывает, что количество красных кровяных телец низкое.
Результат: В столбце результатов показаны значения, попадающие в нормальный диапазон.
Flag: Счетчики, которые выше или ниже контрольного диапазона, записываются в столбец флагов и помечаются буквой «L» для низкого значения или «H» для максимального значения.
Эталонный интервал (или эталонный диапазон): Эталонный интервал показывает нормальный диапазон для каждого измерения для лаборатории, выполняющей тест. В разных лабораториях могут использоваться разные эталонные интервалы.
Лейкоциты: Лейкоциты помогают защитить людей от инфекций. Приведенный выше отчет общего анализа крови показывает, что общее количество лейкоцитов у пациента составляет 7,2, что находится в пределах нормы 4,0-10,5.
Красные кровяные тельца: Красные кровяные тельца переносят кислород от легких к остальному телу. Приведенный выше отчет общего анализа крови показывает, что у пациента количество эритроцитов 3,5. Это количество ниже, чем нормальный диапазон 4,7-6,1, и поэтому записывается в столбце флагов и помечается буквой «L», что означает низкий уровень.
Гемоглобин (Hb или Hgb): Гемоглобин — это белок красных кровяных телец, переносящий кислород. Приведенный выше отчет общего анализа крови показывает, что уровень гемоглобина у пациента составляет 10,8, что ниже нормального диапазона 14,0-18,0. Гематокрит (HCT) — это еще один способ измерения количества Hb, и он также является низким. Это означает, что у пациента анемия легкой степени, и он может начать замечать симптомы. Нормативные диапазоны для гемоглобина и гематокрита будут варьироваться в зависимости от возраста и пола.Для женщин они будут ниже показанных здесь. Например, референтный интервал гемоглобина для женщины составляет 12,0-16,0.
Тромбоциты: Тромбоциты — это клетки, которые образуют сгустки крови, останавливающие кровотечение. Приведенный выше отчет общего анализа крови показывает, что количество тромбоцитов у этого пациента в норме.
Дифференциальный: Эта часть общего анализа крови показывает количество 5 основных типов белых клеток в процентах (первые 5 единиц) или в абсолютном количестве клеток (вторые 5 единиц).
Абсолютное количество нейтрофилов: Нейтрофилы являются основными лейкоцитами для борьбы или предотвращения бактериальных или грибковых инфекций. В отчете CBC нейтрофилы могут называться полиморфно-ядерными клетками (полисами или PMN) или нейтрофилами. Абсолютное количество нейтрофилов (ANC) — это мера общего количества нейтрофилов, присутствующих в крови. Когда АНК меньше 1000, увеличивается риск заражения. ANC можно рассчитать, умножив общее количество лейкоцитов на процент полиморфноядерных клеток.Например, АНК этого пациента составляет 3,10, что равно количеству лейкоцитов (7,2), умноженному на 43%.
Как лечить анемию
Анемию можно лечить путем повышения уровня гемоглобина с помощью переливания крови или эритропоэтина (эпоэтин альфа или дарбэпоэтин альфа), фактора роста клеток крови, который увеличивает выработку красных кровяных телец. Двумя задачами лечения анемии являются, во-первых, устранение основной причины анемии и, во-вторых, лечение симптомов анемии. Для успешного лечения анемии может потребоваться эритропоэтин, переливание крови или и то, и другое.
Эритропоэтин: Эритропоэтин — это фактор роста клеток крови, который избирательно увеличивает выработку красных кровяных телец. Организм вырабатывает эритропоэтин для увеличения производства красных кровяных телец.
Эритропоэтин одобрен FDA для лечения анемии у пациентов с немиелоидным раком, анемия которых возникла в результате химиотерапии. Лечение эритропоэтином вызывает постепенное увеличение выработки красных кровяных телец.Организм использует железо в производстве красных кровяных телец. Таким образом, добавка железа может потребоваться для адекватной поддержки эритропоэтин-стимулированного эритропоэза. Практически всем пациентам, получающим терапию эритропоэтином, в конечном итоге потребуется дополнительная терапия железом.
Двумя коммерчески доступными формами эритропоэтина являются дарбэпоэтин альфа (Аранесп®) и эпоэтин альфа (Прокрит®, Эпоген®). Аранесп® — это форма эритропоэтина пролонгированного действия, которая позволяет пациентам получать меньше инъекций.
Хотя было показано, что эритропоэтин снижает потребность в переливании крови у пациентов с анемией, вызванной химиотерапией, в некоторых исследованиях сообщалось о серьезных побочных эффектах эритропоэтина у определенных групп пациентов. В ответ на эти отчеты и на основании рекомендаций двух консультативных комитетов FDA выпустило обновленные рекомендации по использованию эритропоэтина в ноябре 2007 года. Пациентам следует обсудить риски и преимущества лечения анемии со своим врачом.
Дополнительную информацию о рекомендациях FDA можно найти на сайте fda.gov / cder / drug / infopage / RHE / default.htm.
Переливание крови: Переливание крови быстро восстанавливает способность крови переносить кислород. Цель переливания крови — увеличить обмен кислорода и углекислого газа между тканями и уменьшить симптомы анемии. Однако переливание крови связано с осложнениями. Пациентам следует тщательно обдумать, стоит ли им делать переливание, и преимущества должны перевешивать риск или осложнения процедуры.
Хотя усовершенствования снизили риск осложнений, передаваемых при переливании крови, единственный способ эффективно устранить риск — избежать контакта с аллогенной или «сохраненной» кровью. Несмотря на риски, переливание эритроцитов является обычным лечением тяжелой анемии, связанной с раком и химиотерапией.
Осложнения при переливании крови
Пациенты, получающие переливание эритроцитов, подвержены риску нескольких неинфекционных реакций, которые варьируются от легких аллергических реакций до опасной для жизни анафилаксии.Клинически наиболее серьезные осложнения связаны с воздействием на иммунную систему. Однако эти условия встречаются редко.
Инфекционные осложнения: Пациенты, получающие аллогенную кровь, подвержены риску бактериальных, паразитарных и вирусных инфекций. По оценкам, бактериальные инфекции возникают в 1 из каждых 2500 переливаний крови, а вирусные инфекции встречаются примерно в 1 из каждых 3000. Страх заражения вирусом иммунодефицита человека (ВИЧ) вызывает наибольшее беспокойство, хотя риск на единицу перелитой крови составляет относительно низкий (1 из 225 000 переливаний).Все компоненты крови проверяются на антитела к ВИЧ; однако после контакта с ВИЧ есть период времени, прежде чем антитела могут быть обнаружены в крови. Для решения этой проблемы проводится тщательный скрининг доноров и разрабатываются более чувствительные тесты.
Пациенты, получающие аллогенное переливание, подвергаются большему риску смертельного заражения вирусами гепатита, чем ВИЧ. По оценкам, гепатит возникает примерно в 1 из 3000 переливаний.
Другие альтернативы переливанию аллогенной крови
Переливание аутологичной крови: Переливание, при котором пациент используется как донор, так и реципиент, называется переливанием аутологичной крови.Для пациента переливание аутологичной крови не связано с риском инфицирования, аллоиммунизации, аллергической реакции или реакции «трансплантат против хозяина». Аутологичная кровь берется от реципиента до того, как она понадобится, а это означает, что сбор необходимо заранее запланировать (например, перед операцией или забором костного мозга). Обычно аутокровь собирают не чаще одного раза в неделю и не позднее, чем за 72 часа до процедуры. Затем аутологичная кровь смешивается с раствором антикоагулянта и либо хранится до 42 дней, либо замораживается.
Направленные доноры: Направленные доноры крови собираются у назначенных доноров, обычно друзей и родственников реципиента. Однако нет никаких доказательств того, что направленная донорская кровь безопаснее аллогенной крови.
Советы по борьбе с анемией
Анемия, распространенное заболевание среди онкологических больных, представляет собой недостаточное снабжение эритроцитами, которое приводит к снижению способности крови переносить кислород. Химиотерапия, лучевая терапия и кровопотеря во время операции — все это частые причины анемии у онкологических больных.Анемия является важным фактором, поскольку она может вызвать нежелательные симптомы, такие как усталость, утомляемость или одышку, и может усугубить или вызвать другие проблемы со здоровьем, например, сердечное заболевание. Кроме того, тяжелая анемия может вызвать задержку лечения рака. Если во время лечения рака у вас действительно возникла анемия, вы можете предпринять несколько шагов, чтобы контролировать симптомы и уменьшить их влияние на ваш график лечения и качество жизни.
Следующие советы помогут вам справиться с последствиями анемии:
- Если вы испытываете какие-либо симптомы анемии (например, утомляемость, утомляемость или одышку), немедленно сообщите об этом своему лечащему врачу.
- Соблюдайте сбалансированную диету и пейте много жидкости.
- Достаточно отдыхайте.
- Расставьте приоритеты в своей деятельности, чтобы вы могли участвовать в тех, которые наиболее важны и требуют больше энергии, когда вы чувствуете себя лучше. Низкоприоритетные занятия можно отложить, пока не почувствуете себя сильнее.
- Позвольте друзьям и родственникам помогать вам с поручениями и повседневными делами, чтобы вы могли сберечь свою энергию.
- Чтобы предотвратить головокружение, медленно вставайте из положения сидя; когда вы ложитесь, медленно сядьте перед тем, как встать.
- Проконсультируйтесь с врачом о рисках и преимуществах лечения анемии эритропоэтином, фактором роста клеток крови, который увеличивает выработку красных кровяных телец.
Aranesp® улучшает анемию, вызванную химиотерапией, не оказывая неблагоприятного воздействия на выживаемость
Комбинированный анализ четырех клинических испытаний Aranesp® (дарбэпоэтин альфа) для лечения анемии, вызванной химиотерапией, предполагает, что Aranesp снижает потребность в переливании крови, увеличивает гемоглобин уровни и не оказывает отрицательного влияния на выживаемость.Эти результаты были представлены на 47-м ежегодном собрании Американского общества гематологов.
Анемия — частое побочное действие некоторых режимов химиотерапии. Он характеризуется низким уровнем циркулирующих эритроцитов, которые отвечают за доставку кислорода к тканям по всему телу.
Распространенными симптомами анемии являются сильная усталость, одышка, снижение уровня активности и снижение общего самочувствия.
Тяжелая анемия часто требует лечения с помощью переливания крови, что сопряжено с риском инфицирования, отторжения и увеличения медицинских расходов.Кроме того, тяжелая анемия может вызвать отсрочку лечения рака, что снижает шансы на излечение или оптимальную долгосрочную выживаемость.
Было показано, что использование лекарств для лечения анемии имеет ряд преимуществ у онкологических больных, включая повышение качества жизни и снижение потребности в переливании крови. Однако влияние на выживаемость остается неопределенным. В исследованиях представлены как положительные, так и отрицательные результаты.
Аранесп лечит анемию, вызванную химиотерапией, стимулируя клетки костного мозга на выработку функционирующих эритроцитов, в конечном итоге обеспечивая устойчивый нормальный уровень эритроцитов в организме.Чтобы оценить влияние Аранеспа на анемию и выживаемость, исследователи из Соединенного Королевства объединили информацию из четырех клинических испытаний Аранеспа. Во всех четырех испытаниях оценивалось использование Аранеспа у пациентов с анемией, вызванной химиотерапией. Комбинированный анализ включал всего 759 человек.
Лечение Аранеспом улучшило анемию и не повлияло на общую выживаемость. Пациенты, получавшие Аранесп, на 31% реже получали переливание крови и имели значительно повышенный уровень эритроцитов.
Исследователи пришли к выводу, что использование Аранеспа для лечения анемии, вызванной химиотерапией, снижает потребность в переливаниях крови, улучшает количество эритроцитов и вряд ли окажет негативное влияние на выживаемость.
Анемия ухудшает психические и физические функции пожилых людей с онкологическими заболеваниями
Согласно недавней статье, опубликованной в Annals of Oncology, анемия, вызванная химиотерапией, ухудшает как умственные, так и физические функции пожилых больных раком.
Анемия — частое побочное действие некоторых режимов химиотерапии.Он характеризуется низким уровнем циркулирующих эритроцитов, которые отвечают за доставку кислорода к тканям по всему телу.
Распространенными симптомами анемии являются сильная усталость, одышка, снижение уровня активности и снижение общего самочувствия.
Тяжелая анемия часто требует лечения с помощью переливания крови, что сопряжено с риском инфицирования, отторжения и увеличения медицинских расходов. Кроме того, тяжелая анемия может вызвать задержку лечения рака; это может поставить под угрозу шансы на излечение или оптимальное долгосрочное выживание.
Было показано, что использование лекарств для лечения анемии имеет ряд преимуществ у онкологических больных, включая повышение качества жизни и снижение потребности в переливании крови. Два распространенных препарата, Прокрит® и Аранесп®, лечат анемию, вызванную химиотерапией, путем стимуляции клеток костного мозга для выработки функционирующих эритроцитов и, в конечном итоге, для поддержания нормального уровня эритроцитов.
Исследователи из Италии недавно провели исследование, в котором участвовали 42 гериатрических пациента с раком легких, проходивших химиотерапию.Некоторые пациенты лечились Прокритом, другие не лечились от анемии. Анемию измеряли до и во время лечения. Также были измерены переменные комплексной гериатрической оценки, что позволило исследователям определить связь между анемией и когнитивным / физическим функционированием пациентов.
- У пациентов, получавших Procrit, улучшилась анемия, а также улучшились когнитивные и физические функции по всем измеряемым параметрам.
- Пациенты, не получавшие Procrit, у которых развилась анемия, имели снижение всех измеренных когнитивных и физических показателей функционирования.
Исследователи пришли к выводу, что профилактика или коррекция анемии у пожилых пациентов, проходящих химиотерапию, помогает поддерживать когнитивные и физические функции. В конечном итоге это может обеспечить большую функциональную независимость пациентов, а также предотвратить снижение умственного развития. Необходимы дальнейшие исследования, чтобы подтвердить эти результаты и предоставить дополнительную информацию о лечении анемии у пожилых пациентов.
Аранесп® эффективен для лечения анемии, связанной с МДС «низкого риска»
Согласно статье, опубликованной в British Journal of Hematology, Аранесп® (дарбэпоэтин альфа) эффективен при лечении анемии у пациентов с миелодиспластическими заболеваниями низкого риска. синдром (МДС).
Миелодиспластические синдромы — это группа заболеваний, поражающих костный мозг. МДС приводит к недостаточному производству эритроцитов, лейкоцитов и тромбоцитов. Поэтому первоначальное лечение часто направлено на восстановление нормального уровня этих клеток. Эта группа заболеваний в конечном итоге приводит к недостаточности костного мозга или острому лейкозу. Однако некоторые пациенты с МДС достигают долгосрочной выживаемости при минимальном вмешательстве.
МДС чаще встречается у пожилых людей, у которых могут быть другие серьезные проблемы со здоровьем, препятствующие агрессивному лечению.Современные методы лечения МДС обычно относятся к категории поддерживающей терапии, особенно с использованием средств, восстанавливающих уровни красных или белых кровяных телец. Пациенты с более запущенным заболеванием также могут лечиться химиотерапевтическими препаратами.
Анемия — частый симптом среди пациентов с МДС. Он характеризуется низким уровнем циркулирующих эритроцитов, которые отвечают за доставку кислорода к тканям по всему телу.
Распространенными симптомами анемии являются сильная усталость, одышка, снижение уровня активности и снижение общего самочувствия.
Тяжелая анемия часто требует лечения с помощью переливания крови, что сопряжено с риском инфицирования, отторжения и увеличения медицинских расходов. Кроме того, тяжелая анемия может вызвать отсрочку лечения рака, что снижает шансы на излечение или оптимальную долгосрочную выживаемость.
Было показано, что использование лекарств для лечения анемии имеет ряд преимуществ у онкологических больных, включая повышение качества жизни и снижение потребности в переливании крови. Однако влияние на выживаемость остается неопределенным.
Аранесп лечит анемию, вызванную химиотерапией, стимулируя клетки костного мозга на выработку функционирующих эритроцитов, в конечном итоге обеспечивая устойчивый нормальный уровень эритроцитов в организме. Он также оценивается для лечения анемии, непосредственно вызванной раком.
Исследователи оценивали график и дозировку Аранеспа, пытаясь установить наименьшее количество доз, поддерживающих эффективность. Меньшие дозы требуют меньше времени для пациента и врача, меньше медицинских ресурсов и уменьшают боль и затраты.
Аранесп был ранее одобрен в дозе один раз в неделю. В настоящее время это единственный препарат, одобренный для приема каждые три недели при лечении анемии, вызванной химиотерапией.
Исследователи из Франции недавно провели клиническое испытание для оценки использования Аранеспа у пациентов с МДС низкого риска (МДС, который считается наименее агрессивным и ассоциируется с наибольшей выживаемостью). В это испытание вошли 62 пациента с анемией, получавших Аранесп.
- 71% пациентов ответили на лечение Аранеспом с улучшением их анемии.
- Из 13 пациентов, которые не ответили на лечение эпоэтином альфа, восемь ответили на последующее лечение Аранеспом.
- В среднем через 40 недель 36 из 46 пациентов, ответивших на Аранесп, продолжали отвечать на Аранесп.
Исследователи пришли к выводу, что лечение Аранеспом значительно улучшает анемию у пациентов с МДС низкого риска.
Обзор лекарств от анемии, проведенный FDA
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) объявило, что оно рассматривает новые данные о средствах, стимулирующих эритропоэз (ESA).ЭСС — препараты, применяемые для лечения анемии. Они включают Прокрит® (эпоэтин альфа), Эпоген® (эпоэтин альфа) и Аранесп® (дарбэпоэтин альфа).
Анемия — частый побочный эффект химиотерапии и рака. Он характеризуется низким уровнем циркулирующих эритроцитов, которые отвечают за доставку кислорода к тканям по всему телу. При тяжелой анемии часто требуется лечение переливаниями крови.
ESAs стимулируют организм производить больше красных кровяных телец. Было показано, что использование ЭСС для лечения анемии, вызванной химиотерапией, снижает потребность в переливании крови.
ESA одобрены для лечения анемии у пациентов с хронической почечной недостаточностью, у пациентов с онкологическими заболеваниями, у которых анемия вызвана химиотерапией, у пациентов с ВИЧ, у которых анемия вызвана AZT (зидовудином), а также для уменьшения количества переливаний во время и после серьезного хирургического вмешательства (кроме операций на сердце).
Сообщалось о серьезных побочных эффектах ЭСС у определенных групп пациентов, особенно у пациентов, которые использовали ЭСС по показаниям, отличным от тех, для которых они одобрены.FDA недавно получило дополнительные данные из двух клинических исследований, которые добавляют к списку проблем, связанных с использованием ESA.
Два исследования, которые сейчас рассматривает FDA, включают данные исследования PREPARE. Первое исследование включало 733 пациента с раком груди, которым до операции проводилось лечение химиотерапией. Часть пациентов получала Аранесп, а другие нет. Через три года умерло 14% пациентов, получавших Аранесп, по сравнению с примерно 10%, которые не принимали Аранесп.
Второе исследование включает данные, проведенные Группой гинекологической онкологии Национального института рака, и включает пациентов, которые лечились химиотерапией и лучевой терапией по поводу распространенного рака шейки матки. Пациенты получали прокрит или переливание крови по поводу анемии. Через три года 66% пациентов, не получавших Прокрит, были живы по сравнению с 58% пациентов, не получавших Прокрит.
Неясно, действительно ли ЭСС были связаны со снижением выживаемости у этих пациентов.
FDA заявляет, что в настоящее время они «изучают эти данные и могут предпринять дополнительные действия. Тем временем FDA рекомендует поставщикам медицинских услуг изучить риски и преимущества ESA, указанные на этикетке продукта, и обсудить эту информацию со своими пациентами ».
Пациенты, проходящие химиотерапию, могут пожелать поговорить со своим лечащим врачом относительно своих индивидуальных рисков и преимуществ лечения с помощью ЭСС.
Раннее лечение анемии улучшает качество жизни пациентов, проходящих химиотерапию
Согласно статье, недавно опубликованной в журнале Cancer , лечение Procrit® (эпоэтин альфа) при легкой анемии улучшает качество жизни и продуктивность пациентов, проходящих лечение. химиотерапия.
Анемия — частое побочное действие некоторых режимов химиотерапии. Он характеризуется низким уровнем циркулирующих эритроцитов, которые отвечают за доставку кислорода к тканям по всему телу.
Распространенными симптомами анемии являются сильная усталость, одышка, снижение уровня активности и снижение общего самочувствия.
Тяжелая анемия часто требует лечения с помощью переливания крови, что сопряжено с риском инфицирования, отторжения и увеличения медицинских расходов.Кроме того, тяжелая анемия может вызвать отсрочку лечения рака, что снижает шансы на излечение или оптимальную долгосрочную выживаемость.
Было показано, что использование лекарств для лечения анемии дает несколько преимуществ для больных раком, включая улучшение качества жизни и снижение потребности в переливании крови. Такие лекарства, как Прокрит и Аранесп® (дарбэпоэтин альфа), стимулируют выработку в организме большего количества красных кровяных телец, что в конечном итоге снижает анемию и ее долгосрочные последствия. В настоящее время исследователи оценивают оптимальные сроки лечения анемии при различных типах рака.
Исследователи из нескольких медицинских учреждений в Соединенных Штатах недавно провели клиническое испытание для оценки использования Прокрита среди пациентов с легкой анемией, проходящих химиотерапию. В это испытание были включены пациенты с неходжкинской лимфомой, лимфомой Ходжкина, хроническим лимфолейкозом или множественной миеломой. Им было назначено четыре или более месяцев химиотерапии от их болезни. До лечения все пациенты имели нормальный уровень гемоглобина. Пациентов либо лечили Прокритом от легкой анемии, либо наблюдали и давали Прокрит, если их анемия стала более тяжелой.
- Пациенты, получавшие Прокрит от легкой анемии, меньше дней проводили в постели и меньше дней ограничивали активность.
- Пациентам, получавшим Procrit от легкой анемии, требовалось меньше ночей в больнице, меньше посещений врача, меньше звонков к врачам и меньше рабочих дней.
Исследователи пришли к выводу, что использование Прокрита при легкой анемии, по сравнению с ожиданием, когда анемия станет более тяжелой, значительно улучшает качество жизни пациентов и продуктивность пациентов с гематологическим раком крови (крови).Пациенты с гематологическим раком, проходящие химиотерапию, могут пожелать поговорить со своим врачом об индивидуальных рисках и преимуществах раннего лечения анемии.
Доказательства того, что Аранесп® снижает риск переливания крови
Согласно объединенному анализу шести клинических испытаний, лечение анемии, вызванной химиотерапией, с помощью Аранесп® (дарбэпоэтин альфа) снижает вероятность переливания крови без отрицательного влияния на выживаемость или риск рака прогрессия.Эти результаты были представлены на Европейской онкологической конференции (ECCO 14).
Анемия — частый побочный эффект химиотерапии и рака. Он характеризуется низким уровнем циркулирующих эритроцитов, которые отвечают за доставку кислорода к тканям по всему телу. Анемию часто измеряют по уровню гемоглобина, который является компонентом красных кровяных телец. Распространенными симптомами анемии являются сильная усталость, одышка, снижение уровня активности и снижение общего самочувствия.
Тяжелая анемия часто требует лечения с помощью переливания крови, что сопряжено с риском инфицирования, отторжения и увеличения медицинских расходов. Кроме того, тяжелая анемия может вызвать отсрочку лечения рака, что снижает шансы на излечение или оптимальную долгосрочную выживаемость.
Было показано, что у онкологических больных с анемией, вызванной химиотерапией, использование бустеров эритроцитов, таких как Аранесп, снижает потребность в переливании крови. Однако из-за неблагоприятных последствий для здоровья, о которых сообщалось в некоторых исследованиях, FDA рекомендует врачам использовать минимально возможную дозу, чтобы избежать переливаний, и использовать усилители эритроцитов только по показаниям.
Чтобы предоставить дополнительную информацию о влиянии Аранеспа на пациентов с анемией, вызванной химиотерапией, исследователи объединили информацию из шести клинических испытаний. В этих испытаниях участвовало в общей сложности 1515 пациентов, получавших несколько циклов химиотерапии по поводу рака, отличного от рака лейкоцитов. Участники исследования имели исходный уровень гемоглобина 11 г / дл или меньше.
- Как и ожидалось, Аранесп снизил потребность в переливании крови.
- Выживаемость и риск прогрессирования рака были одинаковыми у пациентов, которые получали и не получали Аранесп.
Эти результаты являются дополнительным доказательством того, что Аранесп снижает потребность в переливании крови у онкологических больных с анемией, вызванной химиотерапией. Этот анализ не показал, что Аранесп оказывает неблагоприятное влияние на выживаемость или прогрессирование рака.
Аранесп® одобрен для приема каждые три недели
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) недавно одобрило введение аранеспа (дарбепоэтин альфа) каждые три недели для лечения анемии, вызванной химиотерапией у пациентов с немиелоидными кровь) раковые образования.Увеличенное время между дозами обеспечивает пациентам и лицам, осуществляющим уход, дополнительное удобство в эффективном лечении анемии.
Анемия — частое побочное действие некоторых режимов химиотерапии. Он характеризуется низким уровнем циркулирующих эритроцитов, которые отвечают за доставку кислорода к тканям по всему телу.
Распространенными симптомами анемии являются сильная усталость, одышка, снижение уровня активности и снижение общего самочувствия.
Тяжелая анемия часто требует лечения с помощью переливания крови, что сопряжено с риском инфицирования, отторжения и увеличения медицинских расходов.Кроме того, тяжелая анемия может вызвать отсрочку лечения рака, что снижает шансы на излечение или оптимальную долгосрочную выживаемость.
Было показано, что использование лекарств для лечения анемии имеет ряд преимуществ у онкологических больных, включая повышение качества жизни и снижение потребности в переливании крови. Однако влияние на выживаемость остается неопределенным. В исследованиях представлены как положительные, так и отрицательные результаты.
Аранесп лечит анемию, вызванную химиотерапией, стимулируя клетки костного мозга на выработку функционирующих эритроцитов, в конечном итоге обеспечивая устойчивый нормальный уровень эритроцитов в организме.Исследователи оценивали график и дозировку Аранеспа, пытаясь установить наименьшее количество доз, поддерживающих эффективность. Меньшие дозы требуют меньше времени для пациента и врача, меньше медицинских ресурсов и уменьшают боль и затраты.
Аранесп был ранее одобрен в дозе один раз в неделю. В настоящее время это единственный препарат, одобренный для приема каждые три недели при лечении анемии, вызванной химиотерапией.
Пациенты с анемией, вызванной химиотерапией, могут пожелать поговорить со своим врачом об индивидуальных рисках и преимуществах лечения Аранеспом.
Ссылки:
Schwartzberg L, Yee L, Senecal F, et al. Рандомизированное сравнение дарбэпоэтина альфа каждые 2 недели и эпоэтина альфа еженедельно для лечения анемии, вызванной химиотерапией, у пациентов с раком груди, легких или гинекологическим раком. Онколог . 2004: 9: 696-707. Он-лайн по адресу: theoncologist.alphamedpress.org/cgi/content/full/9/6/696.
Amgen. Опубликованные личные данные показывают, что Аранесп, дозируемый каждые две недели, сопоставим с эпоэтином альфа, дозированным раз в неделю.Доступно по адресу: amgen.com/news/viewPR.jsp?id=647344. По состоянию на ноябрь 2004 г.
Razzouk BI, Hord JD, Hockenberry M, et al. Двойное слепое плацебо-контролируемое исследование качества жизни, гематологических конечных точек и безопасности еженедельного приема эпоэтина альфа у онкологических детей, получающих миелосупрессивную химиотерапию. Журнал клинической онкологии. 2006; 24: 3583-3589.
Общественный онкологический альянс. В сенате США. Доступно по адресу: communityoncology.org/Default.aspx?tabid=68&ctl=Details&mid=386&ItemID=851.По состоянию на сентябрь 2007 г.
Риарден Т.П., Чару В., Саидман Б. и др. Результаты рандомизированного исследования каждого трехнедельного приема (Q3W) дарбэпоэтина альфа для лечения анемии, вызванной химиотерапией (CIA). Материалы 40-го ежегодного собрания Американского общества клинической онкологии 2004; 23: 741, Abstract # 8064
Bohlius J, Wilson J, Seidenfeld J et al. Рекомбинантные человеческие эритропоэтины и больные раком: обновленный метаанализ 57 исследований с участием 9353 пациентов. Журнал Национального института рака .2006; 98: 708-14.
Straus DJ, Testa MA, Sarokhan BJ, et al. Качество жизни и польза для здоровья от раннего лечения легкой анемии. Рандомизированное исследование эпоэтина у пациентов, получавших химиотерапию по поводу гематологических злокачественных новообразований. Рак . 2006; 107: 1909-1917.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). FDA получает новые данные о рисках, связанных с лекарствами от анемии. Доступно по адресу: fda.gov/bbs/topics/NEWS/2008/NEW01769.html. По состоянию на январь 2008 г.
Mannone L, Gardin C, Quarre MC, et al.Высокие дозы дарбэпоэтина альфа в лечении анемии миелодикопластического синдрома низкого риска. Результаты исследования фазы II. Британский гематологический журнал. 2006; 133: 513-519.
Берарди Р., Бракони С., Мантелло Дж. И др. Анемия может повлиять на исход пациентов, проходящих неоадъювантное лечение рака прямой кишки. Анналы онкологии . 2006; 17: 1661-1664.
Cannon J-L, Ванстенкисте Дж., Бодоки Дж. И др. Рандомизированное двойное слепое активно-контролируемое исследование дарбэпоэтина альфа каждые 3 недели для лечения анемии, вызванной химиотерапией. Журнал Национального института рака. 2006; 98: 273-284.
Манкузо А., Мильорино М., Де Сантис С. и др. Корреляция между анемией и функциональной / когнитивной способностью у пожилых пациентов с раком легких, получавших химиотерапию. Анналы онкологии. 2006; 17: 146-150.
Фримантл Н., Яо Б., Калверт М. и др. Влияние дарбэпоэтина альфа на переливание крови, ответ гемоглобина и выживаемость онкологических больных с анемией, вызванной химиотерапией: результаты метаанализа рандомизированных плацебо-контролируемых исследований. Кровь . 2005; 106: 871а, аннотация № 3116.
Amgen. FDA одобряет расширенное дозирование аранеспа для лечения анемии, вызванной химиотерапией; Дозирование каждые три недели может обеспечить дополнительное удобство, потенциально уменьшая количество посещений клиники и инъекций для лечения анемии. Доступно по адресу: amgen.com/media/media_pr_detail.jsp?releaseID=835699. По состоянию на март 2006 г.
Glaspy JA, Tchekmedyian NS: Дарбэпоэтин альфа, вводимый каждые 2 недели, облегчает анемию у онкологических больных, получающих химиотерапию.Онкология (Хантингт) 2002; 16: 23-9.
Миршинг Б., Бек Дж., Чару В. и др. Дарбэпоэтин альфа, вводимый каждые две недели (Q2W), снижает вызванную химиотерапией анемию (CIA) в той же степени, что и рекомбинантный эритропоэтин человека (rHuEPO), но с менее частым дозированием. Proc Amer Soc of Clin Oncol 2003. Резюме 2944.
Вадхан-Радж С., Шрайбер Ф., Томас Л. и др. Каждые 2 недели дарбэпоэтин альфа улучшает показатели усталости и энергии у онкологических больных (pts), проходящих химиотерапию.Proc Amer Soc of Clin Oncol 2003. Abstract 2942.
Glaspy JA, Jadeja JS, Justice G, et al. Дарбэпоэтин альфа, вводимый каждые 1-2 недели, облегчает анемию, связанную с химиотерапией рака. Br J Cancer 2002; 87: 268-76.
Glaspy JA, Jadeja JS, Justice G и др. Рандомизированное пилотное испытание с активным контролем режимов дозирования дарбэпоэтина-альфа с предварительной загрузкой для лечения пациентов с анемией во время химиотерапии злокачественных новообразований. Рак 2003; 97: 1312-20.
Glaspy JA, Tchekmedyian N, Erder M, et al.Раннее и устойчивое улучшение качества жизни, связанного со здоровьем (HRQOL), наблюдалось при применении дарбэпоэтина альфа вначале по сравнению с традиционной терапией. Proc Amer Soc of Clin Oncol 2003. Abstract 3063.
Jumbe N, Heatherington A. Рациональная оценка дозы / графика Darbepoitin alfa на основе количественного понимания эритропоэза для раннего и устойчивого облегчения анемии. Proc Amer Soc of Clin Oncol 2003. Реферат 3077.
Генри Д., Патель Р., Чекмедиан С. и др. Рандомизированное исследование фазы 2, оценивающее время введения дарбэпоэтина альфа по сравнению с химиотерапией.Proc Amer Soc of Clin Oncol 2003. Abstract 3162.
Jadersten M, Montgomery S, Astermark J, et al. Лечение анемии при миелодиспластических синдромах с помощью гранулоцитарного колониестимулирующего фактора и эритропоэтина: ответ и влияние на выживаемость при долгосрочном наблюдении за 129 пациентами. Кровь 102: 184a, 2003 (тезисы 643).
Чару В., Белани С., Гилл А. и др. Каждые 2 недели (Q2W) Дозирование дарбэпоэтина альфа пациентам с анемией рака (AOC): промежуточный анализ рандомизированного контролируемого исследования.Кровь 102 :, 499a, 2003 (около 1816).
Анемия при хронических заболеваниях — NORD (Национальная организация по редким заболеваниям)
Точная причина анемии при хронических заболеваниях может варьироваться. Обычно одновременно происходит несколько процессов. Анемия может быть вызвана небольшим сокращением нормального выживания красных кровяных телец. Кроме того, может быть нарушена выработка красных кровяных телец (эритропоэз) или эритропоэтина (гормона, стимулирующего выработку красных кровяных телец). Красные кровяные тельца переносят кислород в организм.Точная причина анемии при хроническом заболевании может зависеть от основного состояния. Например, раковые клетки могут выделять определенные вещества, которые повреждают или разрушают незрелые эритроциты. В некоторых случаях раковые клетки или инфекционное заболевание могут проникать в костный мозг, мягкий губчатый материал, обнаруживаемый в длинных костях, где образуются клетки крови.
Исследователи также узнали, что люди с хронической анемией также имеют дисбаланс в распределении железа в организме и, как следствие, не могут эффективно использовать железо для создания новых клеток крови, несмотря на наличие достаточного или повышенного уровня железа, хранящегося в тканях. .Железо — это важный минерал, который содержится во всех клетках тела и необходим для правильного функционирования и роста организма. Железо содержится во многих продуктах питания, включая красное мясо, птицу, яйца и овощи. Уровни железа в организме должны оставаться в определенном диапазоне, иначе они могут вызвать анемию (из-за низкого функционального уровня железа) или повреждение пораженных органов (из-за аномально высокого уровня железа в определенных тканях).
Железо необходимо для производства гемоглобина, части красных кровяных телец, переносящих кислород.Ключевым признаком анемии при хроническом заболевании является повышенное поглощение и удержание железа в определенных клетках, что приводит к снижению количества функционального железа, доступного для производства гемоглобина. Недостаток функционального железа препятствует развитию гемоглобина, что, в свою очередь, снижает количество кислорода, доставляемого по всему телу (анемия).
Исследователи считают, что иммунная система, которая остается постоянно активной у людей с хроническими заболеваниями, вырабатывает вещества, которые влияют на выработку, хранение и транспортировку железа в организме.Клетки иммунной системы производят цитокины, специализированные белки, которые стимулируют или подавляют функцию других клеток иммунной системы.
Гепсидин, гормон, вырабатываемый в печени, который помогает регулировать метаболизм и транспорт железа в организме, играет важную роль в развитии анемии при хронических заболеваниях. Исследователи полагают, что специфический цитокин, известный как интерлейкин-6 (ИЛ-6), в большинстве случаев стимулирует выработку гепсидина, хотя гепсидин также может вырабатываться в ответ на воспаление путями, не связанными с ИЛ-6.Избыток гепсидина приводит к тому, что в клетках задерживается слишком много железа, что снижает количество железа, доступного для производства гемоглобина, что приводит к анемии. Большинство исследователей считают, что гепсидин является ключевым фактором, влияющим на развитие анемии хронического заболевания.
Анемия — обзор | Темы ScienceDirect
Анемия означает снижение массы эритроцитов (эритроцитов).
Средний корпускулярный объем представляет собой средний размер эритроцитов и используется для классификации типа анемии на микроцитарную, нормоцитарную или макроцитарную.
Микроцитарная анемия возникает в результате процессов, нарушающих синтез гемоглобина в эритроцитах, таких как дефицит железа, отравление свинцом, сидеробластная анемия и талассемия.
Некоторые причины нормоцитарной анемии включают хроническую почечную недостаточность, анемию хронического заболевания, гипогонадизм, апластическую анемию, миелодиспластический синдром и инфильтрацию костного мозга.
Причины макроцитарной анемии включают дефекты синтеза ДНК (дефицит фолиевой кислоты, дефицит витамина B 12 , миелодиспластический синдром, аналоги нуклеотидов), гипотиреоз, заболевания печени и алкоголизм.
Подсчет ретикулоцитов позволяет дифференцировать гипопролиферативную анемию (например, дефицит железа, фолиевой кислоты или дефицит B 12 ) от гиперпролиферативной анемии (такой как гемолиз или острая кровопотеря).
Пациенты с анемией могут протекать бессимптомно (особенно если анемия легкая или развивается медленно) или могут иметь симптомы усталости, головокружения, непереносимости физических упражнений, одышки или обострения стенокардии.
Первоначальное тестирование должно включать в себя полный анализ крови с дифференцировкой, подсчетом ретикулоцитов и гваяковой кислотой в стуле.Другие полезные тесты включают (а) лактатдегидрогеназу, гаптоглобин, общий и прямой билирубин, если есть подозрение на гемолиз, (b) ферритин, сывороточное железо и общую железосвязывающую способность (TIBC), если анемия микроцитарная, и (c) витамин B 12 и фолиевой кислоты, если анемия макроцитарная.
При диагностировании железодефицитной анемии поиск причины дефицита является обязательным.
Анемию хронического заболевания обычно можно отличить от дефицита железа на основе ферритина, концентрации железа в сыворотке и TIBC.
Неврологическое заболевание (которое может возникнуть при отсутствии анемии) является потенциальным осложнением дефицита витамина B 12 , но не дефицита фолиевой кислоты.
Окончательный диагноз дефицита витамина B 12 у пациентов с низким уровнем витамина B 12 уровней, которые превышают нижний предел нормального диапазона, требует измерения метилмалоновой кислоты и гомоцистеина.
Концентрация фолиевой кислоты в сыворотке крови без еды <2 нг / мл является диагностическим признаком дефицита фолиевой кислоты, тогда как уровни> 4 нг / мл по существу исключают дефицит фолиевой кислоты.
Гемолитическая анемия развивается, когда костный мозг не может компенсировать сокращение продолжительности жизни эритроцитов. Результаты, подтверждающие диагноз гемолиза, включают ретикулоцитоз, спленомегалию, фрагментированные эритроциты в периферическом мазке («клетки шлема» или шистоциты), повышенную лактатдегидрогеназу в сыворотке, неконъюгированную гипербилирубинемию (неконъюгированный билирубин составляет 80% от общего билирубина) и .
Анемия и вождение — Fundación MAPFRE
Снижение уровня гемоглобина (Hb) или гематокрита (Ht) всегда должно быть связано с этиологическим диагнозом, чтобы установить пусковую причину анемии и ее исход с течением времени.
Быстрое снижение гематокрита приводит к внезапному появлению клинического состояния, включая астению, тахикардию, головокружение, потоотделение и одышку от усилия, с обмороком в некоторых случаях
Постепенное развитие анемии может быть связано только с нарастанием утомляемости и снижением толерантности к физическим нагрузкам.
Гипохромная микроцитарная анемия
Это в основном вызвано дефицитом железа, который, в свою очередь, в большинстве случаев возникает из-за хронического, особенно пищеварительного, гинекологического или урологического кровотечения.
Это также анемия хронического заболевания, связанного с инфекциями, аутоиммунными заболеваниями, новообразованиями и т. Д.
Обычно он постепенный, что означает, что вызывает усталость, сонливость, головокружение и недостаток внимания только в запущенных случаях.
Это очень часто встречается у женщин среднего возраста, поэтому часто встречается у женщин-водителей.
Обеспечение железом и контроль места кровотечения обычно улучшают анемию.
Рекомендации по гипохромной микроцитарной анемии
- Легкая гипохромная анемия не мешает управлять автомобилем.
- Сонливость, потеря внимания и легкое головокружение в умеренных или тяжелых случаях анемии с Hb <8-10 г / дл могут привести к потере контроля над автомобилем, поэтому в таких случаях не рекомендуется водить автомобиль.
- Врач проинформирует пациента при последующих проверках, если назначенное лечение стабилизировало анемию и устранило ее причину, позволяя управлять автомобилем.
Макроцитарная анемия
Мегалобластный из-за недостатка витамина B12 или фолиевой кислоты и немегалобластный, связанный с системным заболеванием печени, алкоголизмом, гипотиреозом или связанный с заболеванием костного мозга.
Анемия из-за дефицита витамина B12 обычно возникает постепенно и постепенно и может быть связана с желудочно-кишечными расстройствами, такими как анорексия, запор, периодическая диарея и боли в животе.
Периферические нервы часто поражаются с потерей вибрационной чувствительности нижних конечностей, проприоцепции и атаксии. Позже поражаются верхние конечности.
Впоследствии выявляются спастичность и гиперактивность рефлексов, и если лечение не будет начато на ранней стадии, неврологические дефекты необратимы.
Некоторые пациенты проявляют раздражительность, депрессию или паранойю.
Возможна слепота к синему и желтому цветам.
Консультации по макроцитарной анемии
- Мегалобластная анемия проходит при недостаточном питании, поэтому в легких случаях она не мешает вождению.
- Симптомы этой анемии на поздних стадиях приводят к потере трудоспособности из-за неврологических, зрительных и эмоциональных нарушений.
- После лечения врач подтвердит, что симптомы исчезли, разрешив вождение, через отчет, в котором указывается отсутствие последствий.
- Симптоматическая немегалобластная макроцитарная анемия, связанная с другими заболеваниями, показывает переменный исход в зависимости от причинного заболевания.
- В этих случаях врач также оценит клинические признаки и симптомы основного заболевания, заболевания печени, алкоголизма и т. Д. И даст рекомендации, в зависимости от развития пациента, если он может управлять автомобилем.
Нормоцитарная анемия
Гипопролиферативный при недостаточности костного мозга первичного происхождения или вторичных по отношению к хроническим заболеваниям, таким как уремия, заболевание печени, коллагеноз, эндокринное заболевание или диссеминированные новообразования.
Гипопластический , вызванный уменьшением массы костного мозга, поэтому обычно он связан с лейкопенией и тромбоцитопенией.
, который может вызывать серьезные общие симптомы, часто связанные с кровотечением в области глазного дна, слизистых оболочек и кожи, а также инфекциями.
В половине случаев это связано с токсическими веществами или лекарствами, такими как противоопухолевые препараты, противовоспалительные средства, антибиотики и противосудорожные препараты.
Myelophthisic , для замены костного мозга инфильтрирующими новообразованиями, гранулематозными заболеваниями, отложениями или фиброзом.
Симптомы анемии добавляются к симптомам основного заболевания, и иногда возникает массивная спленомегалия, часто связанная с гепатомегалией.
Консультации по нормоцитарной анемии
- При анемии, вызванной недостаточным эритропоэзом, легкие симптомы анемии добавляются к симптомам основного заболевания, что подрывает способность управлять автомобилем.
- Врач не посоветует водить машину при любой анемии, вызывающей головокружение, сонливость и недостаток внимания.
- Клинические проявления причинного заболевания или токсичности, вызванной лекарствами, заставят врача посоветовать не водить машину до тех пор, пока состояние пациента не стабилизируется и не снизится способность управлять автомобилем.
- Большая спленомегалия в случае любого удара связана с дополнительным риском разрыва селезенки и массивного кровотечения в брюшной полости.
Анемия — familydoctor.org
Что вызывает анемию?
Существует три основных причины возникновения анемии.
Ваше тело не может вырабатывать достаточно красных кровяных телец.
Неспособность производить достаточное количество эритроцитов может произойти по нескольким причинам, включая диету , беременность, болезнь и т. Д.
Диета
Ваше тело может не производить достаточно красных кровяных телец, если вам не хватает определенных питательных веществ. Низкое содержание железа — распространенная проблема. Люди, которые не едят мяса или придерживаются модных диет, больше подвержены риску низкого содержания железа. Младенцы и дети ясельного возраста подвержены риску развития анемии из-за диеты с низким содержанием железа.Недостаток витамина B12 и фолиевой кислоты также может вызвать анемию.
Поглощение сложность
Определенные заболевания влияют на способность тонкой кишки усваивать питательные вещества. Например, болезнь Крона и целиакия могут вызывать низкий уровень железа в организме. Некоторые продукты, например молоко, могут препятствовать усвоению железа организмом. В этом может помочь прием витамина С. Лекарства, такие как антациды или рецепты, снижающие кислотность желудка, также могут повлиять на него.
Беременность
Люди, которые беременны или кормят грудью, могут заболеть анемией. Когда вы беременны, вам нужно больше крови (до 30%), чтобы поделиться с ребенком. Если вашему организму не хватает железа или витамина B12, он не может производить достаточно красных кровяных телец.
Следующие факторы могут увеличить риск анемии во время беременности:
- Сильная рвота от утреннего недомогания
- Диета с низким содержанием питательных веществ
- Обильные месячные до беременности
- Наличие двух близких беременностей
- Беременность сразу несколькими детьми
- Забеременеть в подростковом возрасте
- Потеря большого количества крови в результате травмы или операции
Скачки роста
Дети младше 3 лет склонны к анемии.Их тела растут так быстро, что им трудно добывать или удерживать достаточное количество железа.
Нормоцитарная анемия
Нормоцитарная анемия может быть врожденной, (от рождения) или приобретенной (от болезни или инфекции ). Чаще всего причиной приобретенной формы является хроническое заболевание (длительное). Примеры включают болезнь почек, рак, ревматоидный артрит и тиреоидит. Некоторые лекарства могут вызывать нормоцитарную анемию, но это случается редко.
Ваше тело разрушает эритроциты раньше и быстрее, чтобы их можно было заменить.
Лечение, такое как химиотерапия, может повредить ваши эритроциты и / или костный мозг. Инфекция, вызванная ослабленной иммунной системой , может привести к анемии. Вы можете родиться с заболеванием, которое разрушает или удаляет эритроциты. Примеры включают серповидно-клеточную анемию, талассемию и недостаток определенных ферментов. Увеличенная или больная селезенка тоже может вызвать анемию.
У вас кровопотеря, из-за которой не хватает красных кровяных телец.
Обильные месячные могут вызвать снижение уровня железа у женщин. Внутреннее кровотечение, например, в пищеварительном или мочевыводящем тракте, может вызвать потерю крови. Это может быть вызвано такими состояниями, как язва желудка или язвенный колит . Другие причины кровопотери включают:
- Рак
- Хирургия
- Травма
- Длительный прием аспирина или аналогичного лекарства